UNIVERSIDADE ESTADUAL PAULISTA
“JÚLIO DE MESQUITA FILHO”
FACULDADE DE CIÊNCIAS FARMACÊUTICAS
CAMPUS DE ARARAQUARA
MARIANA NOUGALLI ROSELINO
AVALIAÇÃO DO SIMBIÓTICO FERMENTADO
COM Enterococcus faecium CRL 183 e Lactobacillus
helveticus ssp jugurti 416, À BASE DE EXTRATOS
AQUOSOS DE SOJA E DE YACON (Smallanthus
sonchifolius) NO CONTROLE DO
DESENVOLVIMENTO DO DIABETES MELLITUS.
ARARAQUARA
–
SP
UNIVERSIDADE ESTADUAL PAULISTA
“JÚLIO DE MESQUITA FILHO”
FACULDADE DE CIÊNCIAS FARMACÊUTICAS
CAMPUS DE ARARAQUARA
AVALIAÇÃO DO SIMBIÓTICO FERMENTADO
COM Enterococcus faecium CRL 183 e Lactobacillus
helveticus ssp jugurti 416, À BASE DE EXTRATOS
AQUOSOS DE SOJA E DE YACON (Smallanthus
sonchifolius) NO CONTROLE DO
DESENVOLVIMENTO DO DIABETES MELLITUS.
MARIANA NOUGALLI ROSELINO
Dissertação apresentada ao Programa de
Pós-Graduação em Alimentos e Nutrição,
da Faculdade de Ciências Farmacêuticas da
Universidade Estadual Paulista “Júlio
de
Mesquita Filho”, para obtenção do título de
Mestre em Alimentos e Nutrição, área de
Ciência dos Alimentos.
ORIENTADOR: Prof. Dr. Elizeu Antonio Rossi
CO-ORIENTADOR: Prof
a. Dr
a. Daniela Cardoso Umbelino Cavallini
BANCA EXAMINADORA
Prof. Dr. Elizeu Antonio Rossi (Orientador)
Dr
a. Marla Simone Jovenasso Manzoni
Prof
a. Dr
a. Regina Célia Vendramini
Araraquara
–
SP
D ed i co est e t r a b a l h o a o s m eu s a vó s, An t o n i a e Ar y,
qu e h o je n ã o est ã o a qu i , m a s sem pr e m e d er a m fo r ça
e ca r i n h o pa r a en fr en t a r t o d o s o s m eu s d esa fi o s.
“ A vi d a é u m a peça d e t ea t r o qu e n ã o per m i t e en sa i o s.
Po r i sso , ca n t e, ch o r e, d a n ce, r i a e vi va i n t en sa m en t e,
a n t es qu e a co r t i n a se fech e e a peça t er m i n e
sem a pl a u so s.”
AGRADECIMENTOS
À Deus, pela oportunidade de estar aqui em constante aprendizado.
Aos meus queridos avós, Antonia e Ary, que me acompanharam em todas as etapas da minha vida, acreditando e torcendo por mim. Sei que onde eles estiverem estão muito orgulhosos por mais esta conquista minha. Saudades...Amo vocês!
À minha mãe Rose, por todo o amor e dedicação, por acreditar em mim e em tudo o que me proponho a fazer, por querer sempre o melhor pra mim, e por estar em todos os momentos ao meu lado. Se hoje estou aqui devo muito a você.
Ao meu pai Rui, por me permitir levar os estudos à diante, por apoiar minhas decisões, acreditar nos meus sonhos e, pelo amor e carinho.
Aos meus irmãos, Felipe e Rui, por fazerem parte de mim e da minha vida!
Ao Prof. Dr. Elizeu Rossi, por mais uma orientação, por acreditar no meu trabalho, por todos os ensinamentos, carinho, amizade e contribuição ao meu amadurecimento científico e pessoal.
A Profa. Dra. Daniela Cavallini, pela contribuição ao meu trabalho como co-orientadora e pela bela amizade que simplesmente surgiu e só vem crescendo. Nem preciso dizer o quanto você é importante pra mim...
Ao LPP pela ajuda no meu trabalho e pelas risadas de cada dia.
As amigas do Laboratório de Enzimologia, Juliana, Ozeni e Thaís, pela ajuda científica e por todo o carinho que só se multiplica com o passar do tempo.
A querida Raquel Aizemberg, com quem compartilhei muitos momentos em pouco tempo, mas que certamente ficarão pra sempre guardados na minha memória.
A Lari, que chegou de repente e se tornou uma grata surpresa. Espero que nossa amizade continue florescendo, porque você é muito especial pra mim.
A minha “sorella” Nadi, que além de companheira de laboratório, passou a dividir
apartamento comigo e tornou-se mais que uma amiga. Obrigada pelos conselhos, pela ajuda, pelo carinho, por sua amizade, enfim, por fazer parte da minha vida.
A todos os amigos do DAN, que dividiram disciplinas, seminários, piqueniques, passeios, fotos e muito carinho. Obrigada por tornarem meus dias especiais. Sintam cada um, meu agradecimento, pois vocês são especiais pra mim e sabem disso.
À Dri...pela ajuda na parte prática e pelo carinho que sempre me dispensou!
Ao Departamento de Alimentos e Nutrição, pela contribuição direta ou indireta para realização deste trabalho.
À Seção de Pós-Graduação e aos funcionários da Biblioteca da FCFAr, pela atenção e ajuda.
Ao PADC - Programa de Apoio ao Desenvolvimento Científico da Faculdade de Ciências Farmacêuticas da UNESP.
À Fundação de Amparo à Pesquisa do Estado de São Paulo pela concessão da bolsa de mestrado e pelo auxílio à pesquisa.
Sumário
Resumo...I
Abstract...II
Capítulo 1
1.Introdução...10
2. Revisão Bibliográfica...13
2.1. Diabetes mellitus...13
2.1.1. Epidemiologia...13
2.1.2. Fisiopatologia...14
2.1.3. Perfil lipídico no Diabetes mellitus...21
2.1.4. Estresse oxidativo no Diabetes mellitus...24
2.1.4.1 Formação de produtos avançados de glicação não-enzimática (AGE)...25
2.1.4.2. Via do Poliol...26
2.1.5. Diabetes mellitus experimental...26
2.1.6. Tratamento do Diabetes mellitus...29
2.2. Prebióticos...30
2.2.1. Yacon...32
2.3. Probióticos...37
2.3.1. Enterococcus faecium...39
2.3.2. Lactobacillus helveticus...40
2.4. Simbiótico...42
2.5. Probióticos e Diabetes mellitus...43
3. Objetivos...44
3.1 Objetivo geral...44
3.2 Objetivos específicos...44
4. Referência Bibliográficas...45
I
Resumo
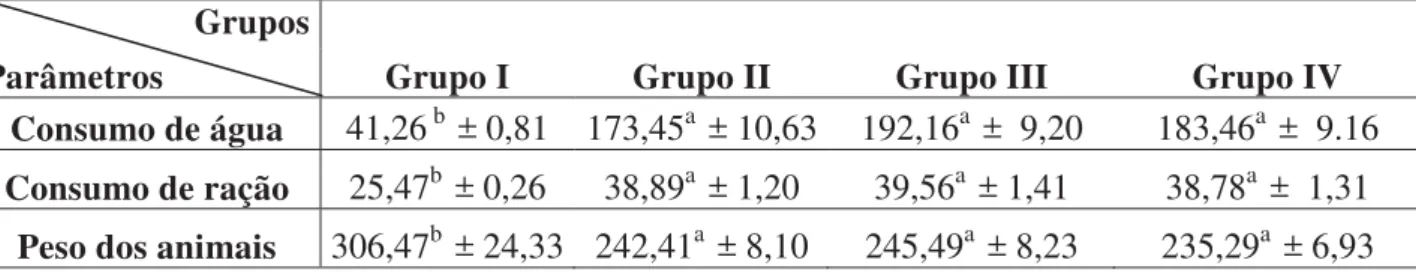
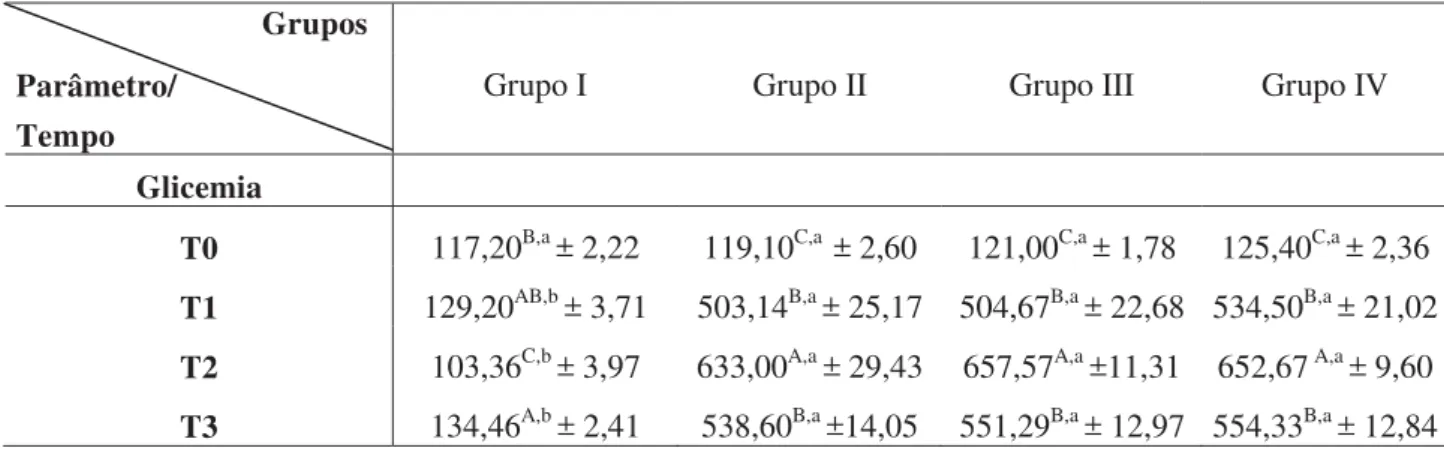
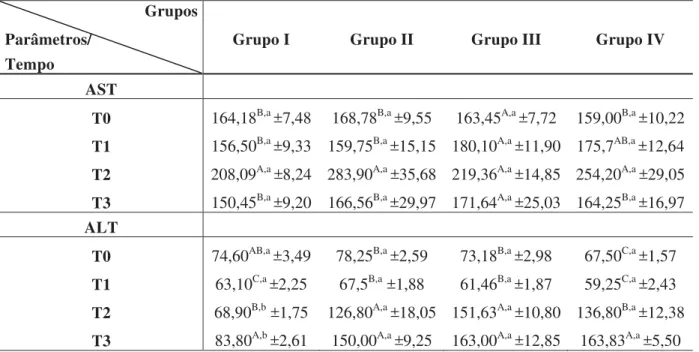
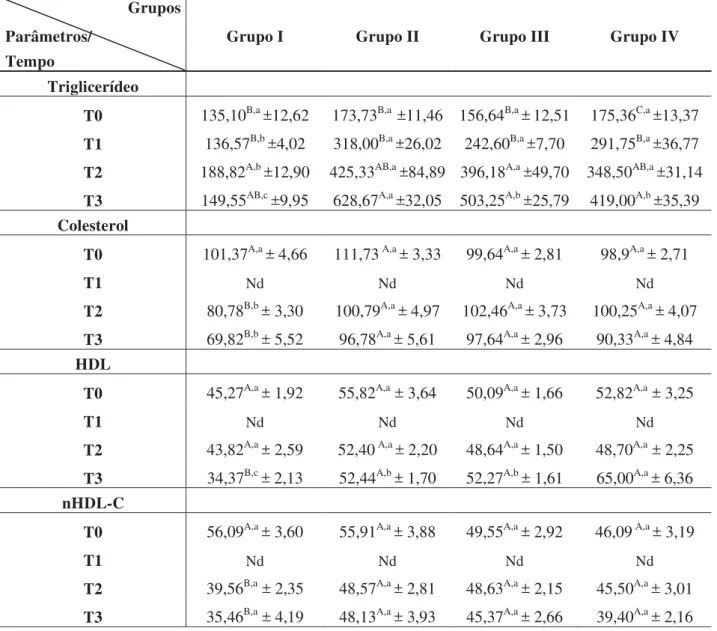
O presente trabalho avaliou os efeitos do simbiótico fermentado com Enterococcus faecium CRL 183 e Lactobacillus helveticus ssp jugurti 416, à base de extratos de soja e de yacon produzidos em ratos com Diabetes mellitus, cuja indução foi feita quimicamente pela administração intraperitoneal de estreptozotocina (50mg/kg de peso corporal). Os animais foram divididos em quatro grupos experimentais (n=10): I - animais não diabéticos que receberam somente ração (controle negativo); II - animais diabéticos que receberam somente ração (controle positivo); III – animais diabéticos que receberam ração + dose de 1 mL/Kg de peso corpóreo/dia do produto não fermentado a base de soja e yacon; IV – animais diabéticos que receberam ração + dose de 1 mL/Kg de peso corpóreo/dia do produto fermentado a base de soja e yacon. No produto em estudo foram quantificadas a viabilidade dos microrganismos probióticos e a concentração dos frutanos (FOS e inulina). O período experimental foi de 59 dias e os parâmetros avaliados foram: peso corpóreo dos animais, ingestão hídrica e alimentar, Coeficiente de Eficácia Alimentar (CEA), glicemia, enzimas aspartato aminotransferase (AST) e alanina aminotransferase (ALT), triglicerídeos, colesterol, HDL, nHDL-C, gorduras epididimal e retoperitonial, músculos sóleo e extensor longo dos dedos, cortes histológicos de fígado, pâncreas e rim e, análise de biomarcadores de estresse oxidativo, TBARS (substâncias reativas ao ácido tiobarbitúrico) e DPPH (2,2 - difenil-1-picril de hidrazila). Não foi observada diferença entre os grupos que receberam os produtos não fermentado e fermentado quando comparado com o grupo de diabéticos que não recebeu tratamento, para consumo de água, ração e peso corporal. O mesmo foi observado para os parâmetros bioquímicos, exceto para as frações HDL e triglicerídeos. Com relação aos biomarcadores, não houve diferença estatística entre todos os grupos, diabéticos ou não. Na histologia do fígado, rins e pâncreas houve diferença entre os grupos não diabético e diabéticos. Os resultados mostraram que a nossa hipótese foi confirmada apenas parcialmente, pois a administração do produto simbiótico não foi capaz de promover a melhoria em parte dos sintomas da doença, nem reduzir a glicemia. No entanto, foi observado um efeito positivo nos níveis de triglicérides e HDL-colesterol nos grupos que receberam o produto não fermentado e produto fermentado, respectivamente.
II
Abstract
This study evaluated the hypoglycemic effects of synbiotic fermented with Enterococcus faecium CRL 183 and Lactobacillus helveticus ssp jugurti 416, based on soymilk and yacon produced in rats with Diabetes mellitus, whose induction was done chemically by intraperitoneal administration of streptozotocin (50 mg/kg body weight). The rats were divided into four groups (n=10): I – non diabetic animals that received only chow diet (negative control), II – diabetic animals that received only chow diet (positive control), III – diabetic animals that received chow diet + 1mL/kg body weight/day of unfermented product of soybean and yacon, IV – diabetic rats that received chow diet + 1mL/kg body weight/day of fermented product of soybean and yacon extracts. In the product under study were quantification viability of microorganisms of the probiotic and the concentration of fructans (inulin and FOS). The experiment was carried out for 59 days and the parameters were evaluated: body weight of animals, feed and water intake, Food Efficiency Ratio (FER), glucose, enzymes aspartate aminotransferase (AST) and alanine aminotransferase (ALT), levels of triglyceride, cholesterol, HDL-C nHDL, epididymal and retoperitonial white adipose tissue, soleus and extensor digitorum longus and tissues liver, kidney and pancreas, and analysis of biomarkers of oxidative stress, TBARS (thiobarbituric acid reactive substances) and DPPH (2,2 - diphenyl-1-picryl of hidrazila). No difference was observed between the groups that received unfermented and fermented products when compared to the diabetic group that not received treatment, for drinking water, feed intake and body weight. The same was observed for the biochemical parameters, except for fractions HDL-cholesterol and triglycerides. With respect to biomarkers there was no statistical difference among all groups, diabetic or not. The histology of the liver, kidneys and pancreas there was statistical difference among no diabetic and diabetic groups. The results showed that our hypothesis was confirmed only partially, as the administration of the synbiotic product was not able to promote improvement in the symptoms of the disease, nor reduce blood glucose. However, we observed a positive effect on levels triglycerides and HDL-cholesterol in the groups receiving the product unfermented and fermented product, respectively.
10
1. INTRODUÇÃO
A soja e seus derivados têm recebido atenção dos pesquisadores, principalmente
devido à quantidade e qualidade de sua proteína, sendo considerada, dentre os vegetais,
o melhor substituto de produtos de origem animal. Além disso, a soja é importante fonte
de outros compostos, como fibras, oligossacarídeos, vitaminas e minerais (DE
ANGELIS, 1999).
Os alimentos probióticos são aqueles que possuem microrganismos com
capacidade para modular a microbiota intestinal e auxiliarem no funcionamento do trato
gastrintestinal, podendo assim reduzir o risco de algumas doenças, tais como, colesterol,
câncer e osteoporose. Enquanto que os alimentos prebióticos são os que apresentam
carboidratos resistentes à ação enzimática e estimulam a proliferação ou a atividade de
determinadas bactérias da microbiota intestinal, atuando como um substrato seletivo no
cólon. Alimentos que apresentem probióticos e prebióticos, simultaneamente, são
denominados de simbióticos. (STEFE; ALVES; RIBEIRO, 2008).
Dentro deste contexto, os alimentos fermentados contendo probióticos e
prebióticos podem ser considerados importantes componentes da dieta, devido as suas
características nutricionais e capacidade de reduzir o risco de doenças
crônico-degenerativas (ROSSI et al., 2000a; 2000b; 2003; 2004; MANZONI; CAVALLINI;
ROSSI, 2008).
Nas últimas décadas, o yacon (Smallanthus sonchifolius), uma planta natural da
região andina, tem despertado o interesse de pesquisadores por apresentar compostos
bioativos de importância para a saúde humana (RIVERA e MARINQUE, 2005). Tem
um sabor levemente adocicado, que se deve, não somente, a presença de glicose, frutose
11 para a ciência dos alimentos e, considerado uma ótima fonte de prebióticos.
(VALENTOVA et al., 2008; DUARTE; WOLF; PAULA, 2008).
Na Bolívia, as raízes de yacon são comumente consumidas por pessoas que
sofrem de diabetes. No Brasil, certas propriedades medicinais são atribuídas às folhas de
yacon, que são usadas secas no preparo de um chá antidiabético (AYBAR et al., 2001).
Vários estudos têm relatado uma correlação positiva entre a ingestão de yacon e a
redução da glicemia (VA LENTOVÁ; ERSEN; ULRICHOVA, 2005).
Há mais de uma década, tem sido relatado, por alguns pesquisadores, que o uso
de bactérias láticas apresenta relativa eficácia na inibição do Diabetes mellitus
(MATSUZAKI et al., 1997a,b; TABUCHI et al., 2003; CANI et al., 2007; YADAV;
JAIN; SINHA, 2007). Esses estudos mostram que a ingestão de bactérias láticas previne
ou retarda o aparecimento da patologia em vários modelos experimentais, induzidos
quimicamente ou pela dieta, ou em animais geneticamente modificados (dB/dB). No
entanto, os trabalhos que relacionam o uso de bactérias láticas e o desenvolvimento do
Diabetes mellitus ainda são relativamente escassos (YUN; PARK; KANG, 2009).
Estudos anteriores realizados pelo nosso grupo de pesquisa mostraram que o
produto à base de soja, fermentado com E. faecium CRL 183 possui atividade
anticarcinogênica, particularmente em relação ao câncer de mama (KINOUCHI, 2006);
imunomoduladora (VENDRAMINI, 2002); capacidade de influenciar positivamente o
metabolismo ósseo de ratas ovariectomizadas, contribuindo para a prevenção da
osteoporose pós-menopáusica (BEDANI et al., 2006; SHIGUEMOTO et al., 2007), e
efeito hipolipemiante com aumento da fração HDL (ROSSI et al., 2008; CAVALLINI,
2009). Entretanto, o efeito de produtos fermentados por E. faecium CRL 183 na
glicemia ainda não foi estudado. Considerando o potencial efeito hipoglicemiante do
12 grande interesse verificar a influência do consumo de um produto simbiótico à base de
soja e yacon no controle dos níveis glicêmicos e demais parâmetros envolvidos no
13
2. REVISÃO BIBLIOGRÁFICA
2.1. Diabetes mellitus
2.1.1. Epidemiologia
O Diabetes mellitus é comum e de incidência crescente. Estima-se que em 1995
atingia 4,0% da população adulta mundial e que, em 2025, alcançará a cifra de 5,4%. A
maior parte desse aumento se dará em países em desenvolvimento, acentuando-se,
nesses países, o padrão atual de concentração de casos na faixa etária de 45-64 anos
(BRASIL, 2006).
No Brasil, no final da década de 1980, estimou-se que o Diabetes mellitus
ocorria em cerca de 8% da população, de 30 a 69 anos de idade, residente em áreas
metropolitanas brasileiras. Essa prevalência variava de 3 a 17% entre as faixas de 30-39
e de 60-69 anos. A prevalência da tolerância à glicose diminuída era igualmente de 8%,
variando de 6 a 11% entre as mesmas faixas etárias (BRASIL, 2006).
Em 2006, 11% da população com 40 anos ou mais, eram portadores do Diabetes
mellitus, representando cerca de 5 milhões e meio de portadores (BRASIL, 2006).
O Diabetes mellitus apresenta alta morbidade, com perda importante na
qualidade de vida. É uma das principais causas de mortalidade, insuficiência renal,
amputação de membros inferiores, cegueira e doença cardiovascular. A Organização
Mundial da Saúde (OMS) estimou em 1997 que, após 15 anos de doença, 2% dos
indivíduos acometidos estariam cegos e 10% teriam deficiência visual grave. Além
disso, estimou, também, que, no mesmo período de doença, 30 a 45% teriam algum
grau de retinopatia, 10 a 20%, de nefropatia, 20 a 35%, de neuropatia e 10 a 25% teriam
14 Mundialmente, os custos diretos para o atendimento ao Diabetes mellitus variam
de 2,5% a 15% dos gastos nacionais em saúde, dependendo da prevalência local do
Diabetes mellitus e da complexidade do tratamento disponível. Além dos custos
financeiros, o Diabetes mellitus acarreta também outros custos associados à dor,
ansiedade, inconveniência e menor qualidade de vida que afetam doentes e familiares. O
Diabetes mellitus representa também carga adicional à sociedade, em decorrência da
perda de produtividade no trabalho, aposentadoria precoce e mortalidade prematura
(BRASIL, 2006).
2.1.2. Fisiopatologia
O Diabetes mellitus, conhecido por afetar seres humanos desde os tempos
antigos, foi descrito como a doença que culminava em consequências calamitosas.
Arateus (81-138 d.C.) escreveu sobre a natureza da doença, que consistia em “desfazer
o corpo em urina”, e era acompanhada por uma terrível sede que não podia ser saciada.
A concentração abundante de glicose carregada pela urina deu a doença seu nome.
Diabetes refere-se ao fluxo de fluido através do sifão, e mellitus vem da palavra mel. Na
Idade Média, o Diabetes mellitus era conhecido como “a doença da má urina”
(SILVERTHORN, 2003).
O Diabetes mellitus é uma síndrome caracterizada pela falta e/ou capacidade da
insulina exercer adequadamente sua função (SOCIEDADE BRASILEIRA DE
DIABETES, 2000), corresponde a um grupo de doenças metabólicas caracterizadas por
hiperglicemia resultantes de defeitos na secreção de insulina ou na sua absorção ou em
ambas (ROSSI, 2005) acompanhado de distúrbios no metabolismo de carboidratos,
15 A hiperglicemia se manifesta por sintomas como poliúria, polidipsia, perda de
peso, polifagia e visão turva ou por complicações agudas que podem levar a risco de
morte: a cetoacidose diabética e a síndrome hiperosmolar hiperglicêmica não cetótica. A
hiperglicemia crônica está associada a dano, disfunção e falência de vários órgãos,
especialmente olhos, rins, nervos, coração e vasos sangüíneos (UKPDS, 1998; GROSS
et al., 2002; ADA, 2010).
O Diabetes mellitus tipo 1 é uma doença poligênica multifatorial que ocorre com
maior frequência em crianças e jovens (ADA, 2007; PATTERSON et al., 2009). Esse
tipo de diabetes é caracterizado pela destruição autoimune ou idiopática das células β
pancreáticas (responsáveis pela secreção de insulina), resultando na deficiência desse
hormônio (ATKINSON; EISENBARTH, 2001; THROWER; BINGLEY, 2011).
Ainda não se sabe ao certo a causa da destruição seletiva das células β no
Diabetes mellitus tipo 1, mas parece haver uma predisposição genética. Porém é
conhecido que fatores ambientais somados a fatores genéticos colaboram para a
progressão da doença (LYRA e CAVALCANTI, 2006).
Nos pacientes com Diabetes mellitus tipo 1, a terapia insulínica é necessária para
suprir a falta da produção orgânica desse hormônio e para evitar a cetoacidose (ADA,
2007). Também é bastante importante o controle de ingestão de carboidratos para
determinar a dose de insulina aplicada (SILVA e MURA, 2007).
O Diabetes mellitus tipo 2 é o mais frequente na população, sendo caracterizado
por defeitos na secreção e/ou ação da insulina. Esse tipo de Diabetes mellitus está
altamente relacionado com um estilo de vida sedentário e com um alto consumo
calórico, motivo pelo qual é mais encontrado em adultos com sobrepeso e obesidade. A
hiperglicemia nesses pacientes não só agrava a resistência, como piora a secreção de
16 No Diabetes mellitus tipo 2, o aumento da gordura corporal causa um impacto
negativo sobre a sensibilidade à insulina. Nesse caso, mudanças no estilo de vida, como
hábitos alimentares mais saudáveis e pratica de atividade física, são determinantes para
melhora da doença (SILVA e MURA, 2007).
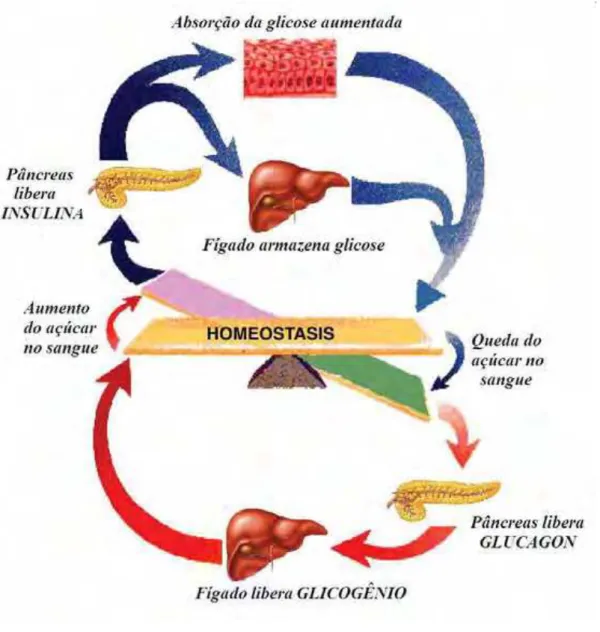
A função mais conhecida da insulina é a regulação da quantidade de glicose no
sangue (Figura 1). A insulina atua como uma chave, abrindo portas nas paredes das
células musculares e do tecido adiposo, permitindo que o açúcar do sangue entre nas
células para produzir energia e faz com que os níveis de açúcar no sangue voltem ao
normal. No tecido adiposo, a insulina facilita a conversão de glicose em ácidos graxos e
inibe a quebra de lipídeos. No fígado, a insulina ativa a glicoquinase, estimulando a
glicogênese, além de diminuir a formação de glicose a partir de outras fontes como os
aminoácidos (neoglicogênese). A ação da insulina é contrabalanceada por outros
17
Figura 1. Homeostase da glicose. Fonte: Portal SÂO FRANCISCO, 2011.
No estado de jejum, todos os nutrientes são armazenados ou utilizados. Há
tendência à queda da glicemia, o mesmo ocorrendo com a secreção de insulina. O
resultado é a redução da síntese de gordura, com aumento da lipólise no tecido adiposo
e da oxidação de ácidos graxos, principalmente nos músculos e no fígado. Os níveis de
glucagon no sangue aumentam, resultando em quebra do glicogênio para liberação de
glicose no sangue e a formação de glicose que ocorre principalmente no fígado
18 A associação do aumento da produção hepática de glicose e a sua baixa
utilização periférica, devido à incapacidade das células musculares e adiposas captarem
a glicose, é a principal causa da hiperglicemia, devido à lipólise, seguida da oxidação
dos ácidos graxos, que disponibilizam substratos, como moléculas de acetil-CoA, para a
cetogênese hepática, que estimula a ocorrência da cetoacidose diabética (CHAMPE e
HARVEY, 2006).
Todos os aspectos da degradação da gordura e sua utilização no suprimento de
energia estão acentuadamente aumentados na ausência de insulina. Os efeitos
resultantes são os seguintes: lipólise da gordura armazenada e liberação de ácidos
graxos livres durante a falta de insulina. Na ausência de insulina, todos os efeitos
hormonais que levam ao armazenamento de gordura são revertidos. O efeito mais
importante consiste na acentuada ativação da enzima lípase hormônio sensível nas
células adiposas. Essa enzima causa hidrólise dos triglicerídeos armazenados, com
consequente liberação de grandes quantidades de ácidos graxos e de glicerol na
circulação sanguínea. Por conseguinte, a concentração plasmática de ácidos graxos
livres começa a aumentar em poucos minutos. A seguir, esses ácidos graxos livres
passam a constituir o principal substrato energético utilizado por praticamente todos os
tecidos do organismo, à exceção do cérebro (GUYTON e HALL, 2006).
Praticamente todo o armazenamento de proteínas cessa por completo quando
não há disponibilidade de insulina. O catabolismo das proteínas aumenta, sua síntese
cessa, e grandes quantidades de aminoácidos são lançadas no plasma. A concentração
plasmática de aminoácidos eleva-se de modo considerável, e a maior parte do excesso
de aminoácidos é utilizada diretamente para energia ou como substratos para o processo
da gliconeogênese. Essa degradação dos aminoácidos também resulta em aumento da
19 graves efeitos do Diabetes mellitus grave. Pode resultar em fraqueza extrema, bem
como em comprometimento de múltiplas funções orgânicas e, explicar a perda de peso
ou falta de crescimento corporal (GUYTON e HALL, 2006; RAW, 2006).
A polidipsia presente nos animais diabéticos deve-se à hiperosmolaridade
sanguínea, em razão de altos níveis de glicose circulante, que faz a água passar do meio
intracelular para o extracelular, a fim de manter o equilíbrio osmótico. A desidratação
intracelular é percebida pelos osmorreceptores cerebrais, desencadeando sede intensa
(LERCO et al., 2003).
Na ausência de insulina o núcleo hipotalâmico ventromedial não capta a glicose,
não inibindo o hipotálamo ventrolateral, responsável pela sinalização da fome. Esta área
não sendo inibida, sinaliza a falta de glicose e fome, estimulando assim a maior ingestão
alimentar que ocorre no Diabetes mellitus. Esse aumento da ingestão alimentar pode ser
atribuído a distúrbios nos processos de regulação da fome no centro da saciedade,
localizado no núcleo hipotalâmico ventromedial, que necessita de insulina para a
captação de glicose e assim o centro da fome é inibido (BERGMAN e FELIG, 1995;
JACOBSON, 1996).
As transaminases são enzimas intracelulares que se encontram praticamente em
todos os tecidos. A mais importante enzima sérica mensurada rotineiramente e que
reflete a integridade funcional dos hepatócitos é a alanina aminotransferase (ALT) que é
encontrada exclusivamente no citoplasma dessas células (ROTHUIZEN, 2001;
WATSON, 2004). Alterações metabólicas com acúmulo de lipídeos nos hepatócitos
podem causar lesão e consequente extravasamento de ALT que também pode aumentar
durante a regeneração ativa de hepatócitos (STOCKHAM e SCOTT, 2002).
A aspartato aminotransferase (AST) está presente no citoplasma dos hepatócitos
20 al., 2004), catalisa a transferência de um grupo amino entre aspartato e α-cetoglutarato
formando oxalacetato e glutamato, a reação é reversível e seu equilíbrio favorece a
formação do aspartato (Figura 2). Sua elevação no soro ocorre em doenças hepáticas
como a hepatite, cirrose, carcinoma hepático, entre outras (DUFOUR et al., 2000).
A ALT catalisa a transferência do grupo amino da alanina para o α-cetoglutarato
com formação de glutamato e piruvato (Figura 2). Em sistemas in vivo o piruvato
origina a acetil-CoA que participa do ciclo Krebs, e o glutamato é desaminado
formando amônia e α-cetoglutarato. Embora não seja uma enzima órgão específica, é
utilizada como marcador no auxílio de diagnóstico de hepatotoxicidade, uma vez que
sua atividade no sangue se torna elevada sempre que há alteração da integridade dos
hepatócitos (BOONE et al., 2005).
Figura 2. Reações catalisadas pelas transaminases AST e ALT durante o metabolismo dos aminoácidos.
Fonte: Adaptado de CHAMPE et al., 2006.
A ALT é uma enzima predominantemente encontrada no citoplasma do
hepatócito, enquanto a AST é bilocular estando 80% presente na mitocôndria, além da
porção citoplasmática. Essa diferença tem auxiliado no diagnóstico e prognóstico de
21 citoplasmática, enquanto em lesões graves há liberação da enzima mitocondrial,
elevando a relação AST/ALT (MOTTA, 2003).
Como o Diabetes mellitus é transmitido geneticamente e demora muito tempo
para determinar alterações fisiopatológicas, os modelos experimentais podem ser
utilizados para aumentar a rapidez no desenvolvimento da doença. Atualmente é aceito
que o Diabetes mellitus insulino dependente se caracteriza pela destruição auto-imune
das células E pancreáticas, que são as responsáveis pela produção de insulina. A
utilização de animais com Diabetes mellitus auto-imune e, mais recentemente, o
aparecimento de modelos experimentais transgênicos, que possuem a expressão imune
para o desenvolvimento da doença, tem ajudado a esclarecer as condições moleculares
que podem ocorrer em humanos (PICKUP e WILLIAMS, 1997).
2.1.3. Perfil lipídico no Diabetes mellitus
Os principais lipídeos do plasma humano são colesterol, ésteres do colesterol,
triglicerídeos, fosfolipídios e ácidos graxos não-esterificados (HENRY, 1998).
As lipoproteínas do plasma classificam-se, de acordo com a sua densidade
crescente, em quilomicrom, lipoproteínas de densidade muito baixa (VLDL),
lipoproteínas de densidade intermediária (IDL), lipoproteínas de baixa densidade (LDL)
e lipoproteínas de densidade elevada (HDL). Estas partículas diferem entre si no que diz
respeito à densidade, diâmetro e composição. (BERG et al., 2006).
As lipoproteínas podem ter uma origem exógena ou endógena. Após ingestão
dos alimentos, os triglicerídeos, colesterol e outros lipídeos provenientes da dieta
alimentar são absorvidos no intestino delgado e agrupados nos quilomicrom, que
22 muscular, através da corrente sanguínea (GEISSLER e POWERS, 2005). Nos tecidos
capilares, a lipoproteína-lipase (LPL) hidrolisa os triglicerídeos e liberta os ácidos
graxos do quilomicron, estes são rapidamente absorvidos pelo tecido adiposo, músculo
e glândulas mamárias. A partícula resultante da hidrólise anterior continua a sofrer a
ação da LPL que hidrolisa os triglicerídeos, colesterol, fosfolipídios e apoproteínas, e
transforma-se numa molécula designada por remanescente de quilomicron, rica em
colesterol, e que é incorporada pelo fígado (GEISSLER e POWERS, 2005).
O fígado desempenha um papel essencial na síntese do colesterol. As moléculas
de triglicerídeos e colesterol em excesso no fígado são liberadas para a corrente
sanguínea sob a forma de lipoproteínas de densidade muito baixa (VLDL) (BERG et al.,
2006). As VLDL são hidrolisadas, tal como os quilomicrom, pela LPL nos capilares do
tecido adiposo, muscular e glândula mamária, originando as lipoproteínas de densidade
intermediária (IDL), partículas ricas em ésteres de colesterol. As IDL podem ser
encaminhadas para dois destinos diferentes: podem ser captadas pelo fígado ligando-se
através das apoproteínas E e B-100, a receptores da membrana do fígado, ou ser
transformadas em lipoproteínas de baixa densidade (LDL) (GEISSLER e POWERS,
2005).
As LDL continuam a circular no sangue, podendo incorporar o colesterol em
vários tecidos ou ser absorvidas pelo fígado ligando-se através da apoproteína B-100 a
receptores específicos, designados receptores LDL. Como a afinidade entre a
apoproteína B-100 e os receptores é baixa, as LDL ficam mais tempo em circulação
(BROODY, 1999). As LDL têm como função o transporte do colesterol para os tecidos
periféricos e são utilizadas na síntese dos esteróides a partir do colesterol (BERG et al.,
23 Como foi anteriormente referido, as LDL são incorporadas na membrana
plasmática do fígado, através de receptores aí localizados, também designados
receptores LDL. Os receptores reconhecem a apoproteína B-100 e incorporam as LDL
em vesículas, por endocitose. Estas vesículas fundem-se com as lisossomas que
possuem enzimas líticas. Os receptores separam-se das LDL e voltam à superfície da
membrana. As LDL são então hidrolisadas libertando aminoácidos, ácidos graxos e
colesterol “livre”. O colesterol “livre” inibe a HMG-CoA redutase e suprime a síntese
da enzima, ao mesmo tempo que ativa a enzima acil transferase (acilCoA - colesterol
acil transferase - ACAT) levando à formação dos ésteres de colesterol. O colesterol que
vai se acumular na célula condiciona a síntese de novos receptores, bloqueando a
incorporação do colesterol proveniente das LDL e aumentando os níveis das LDL no
sangue (DEVLIN, 2007).
As lipoproteínas de densidade elevada (HDL) são sintetizadas principalmente
pelo fígado, mas também pelo intestino, embora em menor quantidade. Estas são
responsáveis pelo transporte reverso do colesterol, isto é, o excesso de colesterol que
exista nas células é transportado para o fígado ou para os tecidos que necessitam de
colesterol (BROODY, 1999). As HDL que sejam encaminhadas para o fígado podem
ser excretadas por este juntamente com a bílis na forma de colesterol ou após conversão
podem ser excretadas em sais biliares (DEVLIN, 2007).
O colesterol nas membranas celulares aparece na sua forma livre. Após a morte
celular, este é removido e transferido para as HDL em circulação através da sua
esterificação pela lecitina: colesterol acil transferase (LCAT), enzima que é sintetizada
pelo fígado (BROODY, 1999). Esta esterificação contínua faz com que as HDL
alterem a sua forma inicial de disco para uma forma esférica. Os ésteres de colesterol
24 funcionar como "esponjas do colesterol" (GEISSLER e POWERS, 2005), representando
um fator de proteção ("bom colesterol").
O risco para aterosclerose é duas a três vezes maior em diabéticos que em
não-diabéticos, independente de outros fatores de risco (ARMAGANIJAN e BATLOUNI,
2000). A anormalidade lipídica mais frequente está relacionada ao metabolismo dos
triglicerídeos e dos ésteres do colesterol (GUTIERREZ e HIGUCHI, 1998; HEINISCH;
NICOLAU, 1998; SERRANO; RACHED; FILHO, 1998; MARTINEZ e VALE, 2000;
ARMAGANIJAN e BATLOUNI, 2000).
O metabolismo das lipoproteínas está prejudicado em indivíduos diabéticos, pois
a insulina exerce um efeito importante sobre as lipases. Quando há deficiência de
insulina, a lipase hormônio sensível estará ativada, ocasionando a hidrólise dos
triglicerídeos armazenados nos adipócitos, contribuindo para a diminuição de peso
corporal e elevação do substrato acetil-CoA, que é um precursor do colesterol. A
ausência de insulina também inibirá a lipase lipoprotéica, não ocorrendo captação pelos
tecidos periféricos dos triglicerídeos transportados pelas lipoproteínas (quilomicron,
VLDL), permanecendo, portanto na circulação (RIFAI e WARNICK, 2006).
A deficiência de insulina promove também a queda dos níveis séricos de HDL,
uma vez que a redução da atividade da lipase lipoprotéica acarreta a diminuição do
catabolismo das quilomicrom e VLDL. E a resistência tecidual a insulina aumenta a
atividade da lipase hepática e com isso há uma metabolização aumentada de HDL
(LUDKE e LÓPEZ, 1999).
2.1.4. Estresse oxidativo e Diabetes mellitus
O estresse oxidativo é um estado de desequilíbrio entre a produção de espécies
25 de ROS no Diabetes melittus pode ser devida à auto-oxidação da glicose, à formação de
produtos finais de glicação avançada (AGEs), à via dos polióis e também às mudanças
no conteúdo e atividade no sistema de defesas antioxidantes no tecido (BAYNES,
1991). ROS causam, in vitro, danos à via de sinalização da insulina (NAJIB e
SANCHEZ-MARGALET, 2001), diminuição da translocação dos transportadores de
glicose (GLUT-4) nos adipócitos (RUDICH et al., 1998) e redução da internalização da
insulina nas células endoteliais (BERTELSEN; ANGGARD; CARRIER, 2001). Em
adição, a oxidação de lipídios e de proteínas está associada com o desenvolvimento das
complicações do diabetes (BAYNES, 1991).
O estresse oxidativo pode ser avaliado por meio de atividade de enzimas
envolvidas no balanço redox da célula, que incluem a superóxido dismutase, catalase,
glutationa peroxidase e glutationa redutase, as quais convertem radicais superóxido em
peróxidos ou peróxidos em água e oxigênio. A conversão de peróxido de hidrogênio
pela glutationa peroxidase ocorre concomitante com a oxidação da glutationa reduzida
(GSH) para a forma oxidada (GSSG). O diabetes pode alterar a atividade dessas
enzimas em vários tecidos (RAUSCHER; SANDERS; WATKINS, 2000).
2.1.4.1. Formação de produtos avançados de glicação não-enzimática (AGE)
A glicação avançada envolve a geração de um grupo heterogêneo de substâncias
químicas conhecidas como produtos finais da glicação avançada (AGEs). A geração
desses produtos resulta de reação não enzimática da glicose com proteínas, lipídeos e
ácidos nucleicos (SOULIS-LIPARORA, COOPER et al., 1991). A maior parte dos
AGEs in vivo são formados a partir de níveis elevados de intermediários reativos dos
grupos carbonilas conhecidos como α-dicarbonilas ou oxaldeídos. Uma das melhores
26 (carboximetil) lisina (CML) (DEGENHARDT, THORPE et al., 1998). Os AGEs
geralmente se acumulam no meio intracelular e ativam vias de sinalização celular ou
modificam a função das proteínas. Seus efeitos - dos AGEs - no Diabetes mellitus
podem ser classificados como independentes ou dependentes de receptores, podendo
atuar de maneira intracelular ou através de ligação com a superfície celular por
intermédio de receptores, como o receptor para produtos finais de glicosilação avançada
(RAGE) (GOH e COOPER, 2008).
2.1.4.2. Via do Poliol
A via dos polióis apresenta a enzima aldose redutase como elemento chave em
suas reações. A enzima possui baixa afinidade com glicose (alto Km), e concentrações
normais de glicose representam baixa atividade desta via. A aldose redutase
normalmente tem a função de reduzir aldeídos tóxicos na célula em alcoóis inativos,
porem, quando a concentração de glicose aumenta (como no Diabetes mellitus), ela
também reduz a molécula a sorbitol, que posteriormente é oxidado à frutose. Neste
processo, a enzima aldose redutase consome o cofator NADPH, que é essencial no
processo de regeneração do antioxidante intracelular, a via dos polióis aumenta a
suscetibilidade ao estresse oxidativo. Além do aumento no fluxo desta via contribuir
para redução das defesas antioxidantes celulares, outras alterações na homeostase
celular são resultantes do acumulo de sorbitol, incluem o estresse osmótico, pelo fato de
sorbitol apresentar baixa difusibilidade e redução na atividade da bomba (Na+ - K+)
ATPase (ENGERMAN, KERN et al, 1994).
2.1.5. Diabetes mellitus experimental
O pâncreas é constituído pelas ilhotas de Langerhans compostas por células α
27 somatostatina e células PP produtoras de polipeptídio pancreático. As ilhotas
pancreáticas podem sofrer alterações funcionais e morfológicas, decorrentes de vários
fatores. Existem fármacos capazes de produzirem radicais livres que destroem as células
E do pâncreas induzindo ao Diabetes mellitus tipo 1 (LEKHOLM, 1993).
Os métodos químicos de supressão endócrina do pâncreas exibem todos os
eventos bioquímicos, hormonais e morfológicos que ocorrem durante e após a indução
do estado diabetogênico (RIBEIRO, 2008).
Deste modo, para possibilitar a análise experimental do Diabetes mellitus em
animais, um dos métodos utilizados para indução consiste na administração do
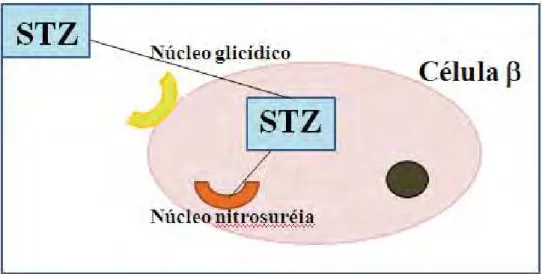
antibiótico estreptozotocina (STZ), que causa a destruição irreversível das células E
(YIN et al., 2010) e, consequentemente, promove o aparecimento do diabetes. A
destruição das células E após a injeção de STZ se deve à inibição de radicais livres,
aumentando assim a produção do radical superóxido (ZHANG et al., 2010). A droga
age da seguinte maneira: o núcleo glicídico, presente na estrutura das células E, permite
a entrada da STZ e o grupo nitrosuréia, também presente na célula, promove o acúmulo
de substâncias tóxicas e consequente morte da célula em questão (MURATA et al.,
1999). Na Figura 3 é apresentado um esquema ilustrativo da ação da estreptozotocina na
28
Figura 3. Esquema ilustrativo da ação da estreptozotocina na célula E do
pâncreas.
Fonte: Adaptado a partir de MURATA et al., 1999.
A morfologia do pâncreas endócrino após a administração de STZ tem mostrado
o aumento do número de células α e G e aumento dos níveis plasmáticos de glucagon e
somatostatina em detrimento a ausência de células E, porém esse quadro pode ser
revertido porque as células E são capazes de diferenciação ou proliferação com o passar
do tempo (LEKHOLM et al., 1993).
A indução do Diabetes mellitus pela STZ pode ser constatada em 24h. As
alterações fisiológicas manifestadas são: hiperglicemia, glicosúria, polidipsia, polifagia
e poliúria. A hiperglicemia plasmática aumenta a absorção de glicose pelos néfrons dos
rins levando a um aumento da excreção de glicose na urina (glicosúria), gerando um
aumento da pressão osmótica e maior retenção de água na urina (poliúria);
consequentemente a ingestão de água é aumentada(polidipsia). O aumento do consumo
de ração (polifagia) pode ser associado com o fato da ausência de insulina comprometer
o transporte de glicose para as células, sendo assim as células ficam sem energia,
portanto o animal aumenta aingestão de ração para suprir a falta de energia celular e
29
2.1.6. Tratamento do Diabetes mellitus
O tratamento do diabetes tipo 1, na maioria dos casos, consiste na aplicação
diária de insulina, dieta e exercícios, uma vez que o organismo não produz mais o
hormônio. A quantidade de insulina necessária dependerá do nível glicêmico.
Naturalmente, a alimentação também é muito importante, pois ela contribui para a
determinação dos níveis glicêmicos. Os exercícios físicos baixam os níveis, diminuindo,
assim, a necessidade de insulina (SOCIEDADE BRASILEIRA DE DIABETES, 2011).
Existem diferentes tipos de preparação de insulina, que se distinguem pela
velocidade com que é absorvida do tecido subcutâneo para o sangue (início da ação) e
pelo tempo necessário para que toda a insulina injetada seja absorvida (duração da ação)
(SOCIEDADE BRASILEIRA DE DIABETES, 2011).
Nos últimos anos, novos fármacos de administração oral surgiram para o
tratamento do Diabetes mellitus, não estando demonstrada a superioridade de uma
determinada droga sobre outra como monoterapia. Essas drogas podem ser divididas em
três grupos de acordo com o seu mecanismo de ação básica: estímulo da produção de
insulina pelo pâncreas (sufoniluréias e meglitinidas), sensibilizadoras da ação da
insulina (metformina e tiazolidinedionas) e redutoras da absorção de carboidratos
(inibidores da α – glucosidase) (MARCONDES, 2003).
A base para o uso de insulina no tratamento do diabetes tipo 2 baseia-se em
evidências de que a glicotoxidade resultante da hiperglicemia contribui tanto para piorar
a resistência à ação da insulina, bem como diminuir a sua secreção, dois dos
mecanismos envolvidos na sua fisiopatologia. De fato, a administração de insulina a
diabéticos tipo 2, mesmo por curto período de tempo, acarreta melhora do controle
glicêmico, principalmente quando administrada nos estágios inicias da doença
30 O custo do medicamento e os efeitos colaterais observados são fatores limitantes
para a adesão ao tratamento. Nesse sentido, algumas plantas e alguns alimentos têm sido
estudados como possíveis coadjuvantes no tratamento do diabetes. Entre esses
alimentos merecem destaque: Aloe vera (OKYAR et al., 2001), alho e cebola
(BALUCHNEJADMOJARAD et al., 2003), curcumina (GUTIERRES, 2011), pata de
vaca (PEPATO et al., 2002; LINO et al., 2004) e o yacon (AYBAR et al., 2001;
RODRÍGUEZ et al., 2008; PORTAL DIABETES, 2009).
2.2. Prebióticos
Prebióticos são componentes alimentares não digeríveis que afetam
beneficamente o hospedeiro, por estimularem seletivamente a proliferação ou atividade
de populações de bactérias desejáveis no cólon. Adicionalmente, o prebiótico pode
inibir a multiplicação de patógenos, garantindo benefícios adicionais à saúde do
hospedeiro. Esses componentes atuam mais frequentemente no intestino grosso, embora
eles possam ter também algum impacto sobre os microrganismos do intestino delgado
(GIBSON e ROBERFROID, 1995; ROBERFROID, 2001; GILLILAND, 2001;
MATTILA-SANDHOLM et al., 2002).
Os prebióticos identificados, atualmente, são a lactulose, a inulina e diversos
oligossacarídeos, que podem ser fermentados pelas bactérias benéficas do cólon. Os
prebióticos avaliados em humanos constituem-se em frutanos e em galactanos
(CUMMINGS e MACFARLANE, 2002). A maioria dos dados da literatura científica
relativos aos efeitos prebióticos relaciona-se aos frutooligossacarídeos (FOS) e à inulina
(PUUPPONEN-PIMIÄ et al., 2002).
A inulina e a oligofrutose pertencem a uma classe de carboidratos denominados
31 sobre processos fisiológicos e bioquímicos no organismo, resultando em melhoria da
saúde e na redução no risco de aparecimento de diversas doenças. As principais fontes
de inulina e oligofrutose empregadas na indústria de alimentos são a chicória
(Cichorium intybus) e a alcachofra de Jerusalém (Helianthus tuberosus) (CARABIN e
FLAMM, 1999; KAUR e GUPTA, 2002).
Da mesma forma, a soja é uma fonte de oligossacarídeos (rafinose e estaquinose)
que estimula a multiplicação de bifidobactérias, sendo, também, considerada uma fonte
de prebióticos (SCHREZENMEIR; DE VRESE, 2001; FUCHS et al.,2005; HAULY et
al., 2005). Existem poucos relatos sobre a ingestão dos prebióticos da soja e o seu papel
na saúde humana. Alguns trabalhos realizados em modelos animais demonstraram
evidências de que os prebióticos, particularmente GOS, podem desempenhar um papel
no aumento da absorção de minerais, e mais especificamente na biodisponibilidade de
cálcio (CHONAN; TAKAHASHI; WATANUKI, 2001; SAKO; MATSUMOTO;
TANAKA, 1999).
Alguns efeitos benéficos atribuídos aos prebióticos são o aumento na absorção
de minerais, como cálcio, magnésio e ferro, redução dos lipídios no sangue, não
cariogenicidade, modulação da composição da microbiota intestinal que exerce um
papel primordial na fisiologia gastrintestinal, redução do risco de câncer de cólon e,
efeito hipoglicemiante (QUINTEROS, 2000; ROBERFROID, 2002).
Diversos estudos experimentais mostraram a aplicação da inulina e da
oligofrutose como fatores bifidogênicos, ou seja, que estimulam a predominância de
bifidobactérias no cólon. Consequentemente, há um estímulo do sistema imunológico
do hospedeiro, uma redução nos níveis de bactérias patogênicas no intestino, um alívio
da constipação, uma diminuição do risco de osteoporose. Adicionalmente, haveria uma
32 ácidos graxos no fígado e consequente diminuição do nível desses compostos no sangue
(KAUR e GUPTA, 2002, SAAD, 2006).
O efeito hipolipidêmico da inulina e da oligofrutose foi observado em alguns
estudos com ratos. Dados experimentais conduziram a hipótese de que os
frutooligossacarídeos poderiam reduzir a capacidade lipogênica hepática, através da
inibição da expressão gênica das enzimas lipogênicas, resultando em secreção reduzida
de lipoproteínas de muito baixa densidade (VLDL) - triacilglicerol. Essa inibição
poderia ser conseguida via produção de ácidos graxos de cadeia curta ou via modulação
da insulinemia, através de mecanismos ainda não identificados, mas que continuam
sendo investigados (ROBERFROID, 2002; KAUR e GUPTA, 2002; DELZENNE et al.,
2002; SAAD, 2006).
O efeito da inulina e da oligofrutose sobre a glicemia e a insulinemia ainda não
foi elucidado e os dados disponíveis a esse respeito são, algumas vezes, contraditórios,
indicando que esses efeitos dependem da condição fisiológica (em jejum ou estado
pós-prandial) ou da doença (diabetes). É possível que, como ocorre no caso de outras fibras,
a inulina e a oligofrutose influenciem na absorção de macronutrientes, especialmente de
carboidratos, retardando o esvaziamento gástrico e/ou diminuindo o tempo de trânsito
no intestino delgado. Adicionalmente, uma gliconeogênese induzida por inulina e
oligofrutose poderia ser mediada por ácidos graxos de cadeia curta, especialmente o
propionato (KAUR e GUPTA, 2002).
2.2.1. Yacon
O nome yacon possui origem da língua indígena Quéchua, que significa; yakku=
insípido e unu = água, e apresenta nomes populares em diferentes países, como na
33 Colômbia (arboloco, jiquima e jiquimilla), Venezuela (jiquima e jiquimilla), Argentina
(llacon), França (poir de terre), Estados Unidos (yacon strawberry) e Itália (polimnia)
(ZARDINI, 1991).
No Brasil o cultivo do yacon foi introduzido por volta de 1989, na região de
Capão Bonito (SP), por imigrantes japoneses, que utilizam suas folhas e raízes
tuberosas na alimentação (MARANGONI, 2007).
Ao contrário de outras raízes de reserva comestíveis, 85 a 90% do peso fresco do
yacon é água. Os carboidratos representam 90% do peso seco de raízes recentemente
colhidas, dos quais 50-70% são frutooligossacarideos (FOS) (KANASHIRO;
FERRARO; POLTRONIERI, 2008) e, o restante é sacarose, frutose e glicose
(OHYAMA el al., 1990, ASAMI et al., 1991, citado por SEMINÁRIO et al., 2003).
Os frutooligossacarideos conhecidos como oligofrutanos ou oligofrutoses,
pertencem a uma determinada classe de açucares, conhecidas como frutanos, que são
cadeias curtas de frutoses, muito solúveis em água, com sabor adocicado (entre 30 e
65% do poder edulcorante da sacarose), e que proporcionam apenas um quarto do valor
calórico de outros carboidratos simples, de modo que, são utilizados como edulcorantes,
fibra alimentar e prebióticos (TORRES, 2004).
A inulina e o FOS não tem uma composição química definida. Eles são mistura
de frutanos de diferentes tamanhos, e a diferença entre eles está no numero de
moléculas de frutose que compõem essas cadeias (NINESS, 1999).
Um dos frutanos mais simples é a inulina, a qual consiste principalmente de
ligações β (2o1) frutosil-frutose. Dentre os frutanos do tipo inulina estão dois grupos
gerais de materiais, inulina e seus subconjuntos oligofrutose e frutoligossacarideos
34 tipo inulina com um grau de polimerização (GP) inferior a 10 (CARABIN; FLAMM,
1999).
O yacon caracteriza-se por apresentar teor considerável de proteínas, fibras e
carboidratos totais (VILHENA; CÂMARA; KAKIHARA, 2000). Além disso, apresenta
elevada quantidade de oligofrutanos do tipo frutooligossacarídeos do tipo inulina:
210,0mg / g de raiz in natura e 13,5mg/g de raiz in natura, respectivamente, sendo,
portanto, considerado como uma importante fonte de prebióticos (SANTANA e
CARDOSO, 2008; LACHMAN; FERNANDEZ; ORSÀK, 2003; VILHENA;
CÂMARA; KAKIHARA, 2000; ZARDINI, 1991).
Estudos recentes têm investigado as propriedades benéficas do yacon em relação
à presença de antioxidantes e compostos fenólicos em suas raízes tuberosas e folhas
(SIMONOVSKA, 2003; FERNANDEZ et al., 2006; LACHMAN et al., 2007).
O uso medicinal da yacon tem aumentado devido à propriedade hipoglicemiante
relatada para esta espécie relacionada ao FOS (CORRÊA et al., 2009).
Nos últimos anos, alguns estudos têm verificado que o extrato de folhas de
yacon promove proteção contra radicais livres, sendo, portanto, um candidato à
prevenção e tratamento de doenças crônicas envolvendo estresse oxidativo,
particularmente o diabetes (VALENTOVÁ; SERSEN; ULRICHOVA, 2005).
O mecanismo pelo qual o yacon promove o controle da glicose sanguínea ainda
não está claro. Uma das possíveis explicações inclui o fato dos frutanos do yacon serem
carboidratos resistentes às enzimas hidrolíticas do sistema digestivo humano, causando
dessa forma, efeito similar aos das fibras e resultando em absorção mais lenta da glicose
(DIABETE NET, 2004; MELODIA WEB, 2009; OLIVEIRA et al., 2009).
Os FOS reduzem a absorção de glicose pelos mesmos mecanismos dos quais as
35 por sua capacidade de aumentar a produção de peptídeo-1 semelhante ao glucagon
(GLP-1), um hormônio que aumenta à medida que a glicose é absorvida e diminui a
produção de glucagon (CABELO, 2005). O GLP-1 promove estimulação da produção
de insulina. Além disso, os frutanos, polímeros da frutose, como não são digeridos,
reduzem a eficiência de hidrolise de enzimas e torna mais lenta a velocidade na qual a
glicose entra na corrente sanguínea, por isso tem a capacidade de prolongar o período de
saciedade. Outra influência no metabolismo em geral está relacionada com os ácidos
graxos de cadeia curta, que são produzidos durante a fermentação, e aumentam a
tolerância à glicose na refeição posterior (GENTA et al., 2005).
No entanto, os dados da literatura confirmam que vários aspectos podem
interferir na quantidade de FOS, tais como: condições de cultivo, armazenamento da
planta e variações na colheita podem influenciar seu mecanismo funcional de redução
glicêmica (PEREIRA et al., 2009).
A terapia nutricional é considerada fundamental no tratamento do Diabetes
mellitus e a inclusão de alimentos que proporcionam uma melhora na tolerância à
glicose, em dietas de indivíduos diabéticos, tem sido enfatizada (BARBOSA-FILHO et
al., 2005; SILVA et al., 2006; CAVALLI et al., 2007; MENEZES et al., 2007;
TORRICO et al., 2007; FERREIRA et al., 2008; RODRÍGUEZ et al., 2008; SANTOS
et al., 2008). Associado a isto, o uso popular do yacon no tratamento do diabetes é
bastante difundido (NIETO, 1991; JORGE, 1998; VILHENA; CÂMARA;
KADIHARA, 2000; AYBAR, 2001; MACHADO et al., 2004).
Aybar et al. (2001) estudaram o efeito hipoglicemiante de extrato aquoso de
folhas de yacon em ratos normais e com diabetes induzido por estreptozotocina. A
administração intraperitonial ou gástrica de decocção de yacon a 10% reduziu
36 substituição do consumo de água pela infusão do yacon a 2% produziu uma
significativa melhora nos parâmetros corporais e renais dos ratos diabéticos quando
comparados com o grupo controle. Esses resultados sugerem que o extrato de yacon
produz um aumento na concentração de insulina no plasma.
O yacon, um alimento com propriedades funcionais bastante promissoras, pode
ser facilmente incorporado à dieta da população em geral e especialmente à alimentação
de diabéticos, principalmente pela raiz que apresenta sabor semelhante ao de frutas
como o melão, e com polpa levemente amarelada, crocante e aquosa (VALENTOVA,
2003). O extrato aquoso de yacon também pode ser introduzido na alimentação humana
como substrato para o crescimento ou veiculação de microrganismos probióticos.
Lactobacillus plantarum, L. acidophilus e Bifidobacterium bifidum, sob
condições anaeróbicas, foram cultivados para simular o ambiente intestinal, em
frutooligossacarídeo comercial (Neosugar®, da Nutraflora) e em extrato de yacon
(PEDRESCHI et al., 2003) e, os resultados sugeriram que os frutooligossacarídeos do
yacon têm potencial prebiótico e podem ser utilizados por bactérias dos gêneros
Bifidobacterium spp. e Lactobacillus spp.
Pauly-Silveira (2009) desenvolveu um produto simbiótico fermentado com
Enterococcus faecium CRL 183 e Lactobacillus helveticus ssp jugurti 416, empregando
simultaneamente os extratos aquosos de soja e de yacon. O produto teve boa aceitação
sensorial e apresentou parâmetros químicos e reológicos adequados.
Manzoni (2010) obteve um produto simbiótico, não fermentado, pela associação
dos extratos aquosos de soja e yacon à cepa probiótica de Bifidobacterium longum. A
ingestão diária desse produto promoveu um aumento na população de bifidobactérias
37
2.3. Probióticos
Os probióticos eram classicamente definidos como suplementos alimentares à
base de microrganismos vivos, que afetam beneficamente o animal hospedeiro,
promovendo o balanço de sua microbiota intestinal (FULLER, 1989). Diversas outras
definições de probióticos foram publicadas nos últimos anos (NICOLI e VIEIRA, 2000;
SCHREZENMEIR e DE VRESE, 2001; WORLD HEALTH ORGANIZATION, 2001;
SANDERS, 2003; JUNQUEIRA e DUARTE, 2005). Entretanto, segundo a definição
internacionalmente aceita, probióticos são microrganismos vivos, que quando
administrados em quantidades adequadas, conferem benefícios à saúde do hospedeiro
(FOOD AND AGRICULTURE ORGANIZATION OF UNITED NATIONS, 2001).
A influência benéfica dos probióticos sobre a microbiota intestinal humana
inclui fatores como efeitos antagônicos, competição por nutrientes e por receptores de
adesão e efeitos imunológicos, resultando em um aumento da resistência contra
patógenos. Assim, a utilização de culturas bacterianas probióticas estimula a
multiplicação de bactérias benéficas, em detrimento à proliferação de bactérias
potencialmente prejudiciais, reforçando os mecanismos naturais de defesa do
hospedeiro (PUUPPONEN - PIMIÄ et al., 2002).
Scutti e Rossi (1996) destacaram, dentre os vários efeitos benéficos à saúde
atribuídos às culturas lácticas, a prevenção e o tratamento contra diarréia, diminuição
dos sintomas da intolerância à lactose, a redução do colesterol sérico, a estimulação da
resposta imune e a redução da incidência de tumores. Contudo, segundo os autores,
esses efeitos não podem ser atribuídos a todas as bactérias ácido lácticas, assim a
seleção e a caracterização da cepa são essenciais para a obtenção do efeito probiótico
esperado. Dentre os critérios desejáveis para a seleção de uma bactéria ácido láctica
38 bile; aderência à superfície epitelial; persistência no trato gastrintestinal;
imunomodulação (sem efeito pró-inflamatório); atividade antagônica contra patógenos;
propriedades antimutagênica e anticarcinogênica e aspectos tecnológicos convenientes
(crescimento em leite, boas propriedades sensoriais, estabilidade, resistência a fago,
viabilidade no processo) (SAARELA et al., 2000).
Os produtos probióticos comercializados geralmente contêm quantidades
maiores ou iguais a 106 UFC por 100g de produto. No entanto, a dose de
microrganismos probióticos para efeitos clínicos específicos ainda não está bem
estabelecida (BOYLE; ROBINS-BROWNE; TANG, 2006). Charteris et al. (1998)
recomendam que a sobrevivência das bactérias probióticas deva alcançar 109 a 1010
UFC/100g ou 100 mL de produto para que a quantidade no intestino do consumidor
atinja 106 a 107 UFC/g. De acordo com as recomendações da Agência Nacional de
Vigilância Sanitária (ANVISA, 2008) o número de células viáveis de probióticos deve
estar na faixa de 108 a 109 UFC na porção diária recomendada do produto pronto para o
consumo, conforme indicação do fabricante. Valores menores podem ser aceitos desde
que a empresa comprove sua eficácia.
No Brasil, a ANVISA (2008) permite o uso da alegação “O (indicar a espécie do
microrganismo probiótico) contribui para o equilíbrio da flora intestinal. Seu consumo
deve estar associado a uma dieta equilibrada e hábitos de vida saudáveis”, para
produtos que contenham os microrganismos Lactobacillus acidophilus, Lactobacillus
casei Shirota, Lactobacillus casei rhammosus, Lactobacillus casei defensis,
Lactobacillus paracasei, Lactococcus lactis, Bifidobacterium bifidum, Bifidobacterium
animallis (incluindo a subespécie lactis), Bifidobacterium longum e Enterococcus
39 Atualmente o maior consumo de produtos probióticos por humanos na Europa
são na forma de produtos lácteos contendo, na maioria das vezes, lactobacilos e/ou
bifidobactérias. Entretanto, são encontrados produtos em que os microrganismos
utilizados são cepas do Enterococcus spp. ou leveduras tais como o Saccharomyces
boulardii (MERCENIER et al., 2002). Cepas probióticas promissoras incluem
microrganismos dos gêneros Lactobacillus spp., Bifidobacterium spp. e Enterococcus
spp. (LUND; ADMSSON; EDLUND, 2002).
2.3.1. Enterococcus faecium
Tradicionalmente Enterococcus spp. são considerados bactérias láticas
(HOLZAPFEL e WOOD, 1995). Assim como outras bactérias láticas, Enterococcus
spp. estão presentes em um grande número de produtos láticos como culturas
iniciadoras, em suplementos alimentares e em alimentos considerados funcionais. São
cocos gram-positivos que freqüentemente ocorrem aos pares (diplococos), sendo
organismos anaeróbicos facultativos (FISCHETTI, 2000). Enterococcus spp. são
utilizados no processo de fermentação ou para melhoria da qualidade sensorial de
alimentos, e como probióticos alimentares. A primeira descrição do gênero
Enterococcus spp. data de 1984 quando Schleifer e Kilpper-Bälz descreveram o E.
faecium e E. faecalis (KLEIN, 2003).
O E. faecium é uma bactéria não patogênica, com um tempo de reprodução de
19 minutos, diferente do Lactobacillus spp. e o Bifidobacterium spp. que é de
aproximadamente 60 minutos. Com reprodução três vezes mais rápida, seu efeito na
remoção de bactérias patogênicas no intestino, é mais efetivo. É mais resistente ao ácido
do estômago, sendo menos inibido quando veiculado por suplemento oral, com
40 CENTER, 2005). Segundo o Ecology Health Center (2005), os efeitos do E. faecium na
microbiota intestinal são frequentemente visíveis nos primeiros dias após sua ingestão,
o que não é observado com outros produtos contendo Lactobacillus spp.
Estudo realizado por Rossi et al. (1994) com um “iogurte” de soja fermentado
por Enterococcus faecium CRL 183 e Lactobacillus helveticus ssp jugurti 416
demonstrou a capacidade de redução do colesterol total e de aumento no HDL -
colesterol em coelhos hipercolesterolêmicos. Rossi et al. (2000) também verificaram
efeitos semelhantes em ratos hipercolesterolêmicos e em humanos
normocolesterolêmicos e concluíram que os efeitos observados são, em grande parte,
decorrentes da presença dos microrganismos viáveis no produto.
2.3.2. Lactobacillus helveticus
As bactérias do gênero Lactobacillus spp. são gram-positivas aeróbias
facultativas, não formadoras de esporos, geralmente catalase negativa, ácido tolerantes,
termofílicas e em forma de bastão (DELLAGLIO e FELIS, 2005). Capazes de fermentar
rapidamente a lactose e produzir ácido lático até concentrações de aproximadamente
2,7% (270°D). A produção de ácido lático faz com que o ambiente fique ácido, o que
inibe o crescimento de bactérias nocivas. Cresce bem a 45°C, mas não se desenvolve
em temperaturas inferiores a 15°C. É uma das espécies bacterianas dominantes no
intestino delgado e interferem em reações metabólicas que ocorrem nessa parte do trato
gastrintestinal (BERGEY´S, 1975; FIGUEIREDO e PASSOS, 2003; RAFTER, 2003).
São encontradas em diferentes ambientes com disponibilidade de carbono e
nitrogênio, tais como produtos de panificação, cárneos e lácteos, além de vegetais e
41 As bactérias ácido-láticas, de acordo com seus co-produtos metabólicos ou pela
sua temperatura ótima de crescimento, podem ser classificadas em homofermentativas,
quando o ácido lático é o principal metabólito (70 a 90%) e heterofermentativas quando
produzem outros compostos, tais como ácido acético, CO2 e etanol, simultaneamente à
síntese de pelo menos 50% de ácido lático (SALOFF-COSTE, 1994).
Lactobacillus helveticus é um microrganismo bacilar regular gram-positivo,
moderadamente termófilo e homofermentativo. São extensivamente utilizados como
cultura lática em queijos duros e semi-duros, tais como Grana Padano,
Parmigiano-Reggiano e Suíço (GIRAFFA; ROSSETTI; NEVIANI, 2000; GATTI et al., 2004;
GATTI et al., 2005). No queijo, os fatores que controlam o desenvolvimento deste
microrganismo incluem a atividade de água (Aw), concentração de sal, potencial de
óxido-redução, pH, temperatura de manutenção e presença de bacteriófagos (FOX et al.,
2000).
Nakamura et al. (1995) mostraram que dois tripeptídeos (Val-Pro-Pro, VPP e
Ile-Pro-Pro, IPP), com um efeito inibitório sobre a ECA (enzima conversora de
angiotensina) foram produzidos no leite fermentado pela bactéria, Lactobacillus
helveticus, produtora de ácido lático. Eles também mostraram que o leite fermentado
com L. helveticus tinha efeito anti-hipertensivo após a administração oral em ratos
espontaneamente hipertensos (REH) (NAKAMURA et al., 1995; NAKAMURA;
MASUDA; TAKANO, 1996). Os tripeptídeos VPP e IPP são associadas com o efeito
anti-hipertensivo de leite fermentado com L. helveticus (MASUDA; NAKAMURA:
TAKANO, 1996). A eficácia do leite fermentado com L. helveticus, contendo VPP e
IPP, foi relatada no estudo de Hata et al. (1996) em que os pacientes ingeriram o
42 fermentado, como parte da dieta, durante os primeiros estágios de um plano terapêutico
para hipertensão, ou para a prevenção da incidência de hipertensão.
Kajimoto et al. (2001) relataram que a PAS (pressão arterial sistólica) e a PAD
(pressão arterial diastólica) diminuíram significativamente, de 12 mm Hg e 10 mm Hg,
respectivamente, após oito semanas de ingestão diária de 2 comprimidos de leite em pó
fermentado com L. helveticus, em indivíduos com hipertensão leve a moderada sem
medicamentos anti-hipertensivos. Em contraste, em normotensos, não foram observadas
mudanças significativas na pressão arterial, após a ingestão diária de 6 comprimidos de
leites em pó fermentado com L. helveticus.
2.4. Simbiótico
Um produto referido como simbiótico é aquele que apresenta em sua
composição um probiótico e um prebiótico, simultaneamente. A interação entre o
probiótico e o prebiótico in vivo pode ser favorecida por uma adaptação do probiótico
ao substrato prebiótico anterior ao consumo. Isto pode, em alguns casos, resultar em
uma vantagem competitiva para o probiótico, se ele for consumido juntamente com o
prebiótico. Alternativamente, esse efeito simbiótico pode ser direcionado às diferentes
regiões “alvo” do trato gastrintestinal. O consumo de probióticos e de prebióticos
selecionados apropriadamente pode aumentar os efeitos benéficos de cada um deles.
(HOLZAPFEL e SCHILLINGER, 2002; PUUPPONEN - PIMIÄ et al., 2002;
MATTILA- SANDHOLM et al., 2002; BIELECKA; BIEDRZYCKA; MAJKOWSKA,
43
2.5. Probióticos e Diabetes mellitus
Alguns estudos foram realizados no sentido de verificar o efeito da ingestão de
microrganismos probióticos na prevenção do desenvolvimento do Diabetes mellitus e os
resultados se mostraram promissores. Matsuzaki et al. (1997) relataram que a ingestão
de L. casei por camundongos Balb/c tratados com aloxana inibiu o desaparecimento das
células - E pancreáticas. Em outro estudo, eles observaram que a destruição auto-imune
de células - E pancreáticas também foi inibida pela administração oral de L. casei nos
camundongos NOD (MATSUZAKI et al., 1997).
Tabuchi et al. (2003) verificaram que a elevação da intolerância a glicose e a
hiperglicemia foram significativamente retardadas pela administração do Lactobacillus
GG à ratos, durante o desenvolvimento do diabetes induzida por estreptozotocina.
Nos estudos de Yadav (2007), a administração oral de dahi (um produto a base
de leite fermentado e de origem indiana) contendo Lactobacillus acidophilus e
Lactobacillus casei, retardou a progressão do diabetes induzida por estreptozotocina em
ratos. Os resultados sugerem que a suplementação de culturas probióticas ao dahi
aumentou sua eficácia em suprimir o diabetes quimicamente induzido, através da
depleção de insulina. Além disso, o produto foi capaz de evitar a dislipidemia diabética,
inibindo a peroxidação lipídica e a formação de nitrito. Isto pode fortalecer o sistema
antioxidante das células E e pode retardar a redução da insulina e elevar os níveis de