UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE PROGRAMA DE PÓS-GRADUAÇÃO EM PSICOBIOLOGIA
CENTRO DE BIOCIÊNCIAS
EFEITO DO TRATAMENTO COM AS DROGAS ANTIPSICÓTICAS HALOPERIDOL E CLOZAPINA SOBRE A INFECÇÃO DE Toxoplasma gondii EM CULTURA DE CÉLULAS RETINIANAS EMBRIONÁRIAS.
VALÉRIA PALHETA DA SILVA
EFEITO DO TRATAMENTO COM AS DROGAS ANTIPSICÓTICAS HALOPERIDOL E CLOZAPINA SOBRE A INFECÇÃO DE Toxoplasma gondii EM CULTURA DE CÉLULAS RETINIANAS EMBRIONÁRIAS.
Dissertação apresentada como requisito à obtenção do título de mestre, pelo Curso de Pós-graduação em Psicobiologia – área Psicologia fisiológica da Universidade Federal do Rio Grande do Norte.
Orientador: Prof°. Dr. Antonio Pereira Júnior
Silva, Valéria Palheta da.
Efeito do tratamento com as drogas antipsicóticas haloperidol e clozapina sobre a infecção de toxoplasma gondii em cultura de células retinianas embrionárias / Valéria Palheta da Silva. - Natal, 2012. 70 f: il.
Orientador: Prof. Dr. Antônio Pereira Júnior.
Dissertação (Mestrado) - Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Psicobiologia.
1. Toxoplasma gondii - Dissertação. 2. Antipsicóticos - Dissertação. 3. Retina - Dissertação. I. Pereira Júnior, Antônio. II. Universidade Federal do Rio Grande do Norte. III. Título.
RN/UF/BSE01 CDU 616.993 Apoio ao Usuário
AGRADECIMENTOS
Ao Prof. Dr. Antônio Pereira Júnior, meu orientador, por ter me proporcionado esta valiosa experiência profissional.
Ao co-orientador informal Dr. Antônio Marcos Mello Moraes pelo incentivo e estímulo que me conduziram até aqui.
Aos professores colaboradores que permitiram a execução deste trabalho, com especial agradecimento ao Prof. Dr. Valter Ferreira de Andrade Neto.
À amiga e colaboradora Ywlliane da Silva Rodrigues Meurer pelo incentivo e auxílio na realização deste trabalho.
Aos amigos José Ronaldo Santos e Claúdio Bruno Silva de Oliveira pelo apoio e incentivo.
A todos os professores e colegas do Programa de Pós-graduação em Psicobiologia e Instituto do Cérebro pela convivência enriquecedora.
A minha família pelo incentivo e carinho.
À Pipa, minha cadelinha, pela companhia e carinho essenciais.
A todas as pessoas que, direta ou indiretamente, colaboraram para a realização deste trabalho.
À empresa Guaraves Guarabira Aves Ltda por ceder os ovos embrionados utilizados neste estudo.
RESUMO
T. gondii é um protozoário intracelular obrigatório e a principal causa de retinocoroidite em humanos. Este estudo foi conduzido para avaliação do efeito do tratamento com as drogas antipsicóticas haloperidol e clozapina sobre a infecção de T. gondii em cultura de células retinianas embrionárias. Retinas de embriões de Gallus gallus domesticus de doze dias (E12) foram usados para preparação de culturas mistas de células retinianas em monocamada. As culturas foram mantidas em placas de 24 e 96 poços à 37°C em meio DMEM suplementado com 5% de soro fetal bovino durante 2 dias. Após este período, as culturas foram simultaneamente infectadas com taquizóitas de T. gondii e tratadas com os antipsicóticos haloperidol e clozapina por 48 horas. Os efeitos dos tratamentos das drogas sobre a infecção deste parasito foram determinados pela avaliação da viabilidade celular pelo método de MTT e avaliação de parâmetros de infecção em lâminas coradas pelo método de giemsa. O tratamento com clozapina e haloperidol de células infectadas com T. gondii resultou em menor prejuízo da viabilidade destas células, o que sugere uma possível prevenção de degeneração neuronal induzida por estes antipsicóticos. Adicionalmente, a replicação intracelular deste protozoário, em células tratadas com clozapina e haloperidol foi significantemente reduzida, possivelmente pela modulação da concentração intracelular de cálcio deste parasito.
ABSTRACT
T. gondii is an obligate intracellular protozoan and the main cause of retinochoroiditis in humans. The aim of this study was to evaluate the effect of the antipsychotic drugs haloperidol and clozapine on the course of infection by T. gondii of cultured embryonic retinal cells. Embryo retinas of Gallus gallus domesticus (E12) were used for the preparation of mixed monolayer cultures of retinal cells. Cultures were maintained on plates of 96 and 24 wells by 37°C in DMEM medium supplemented with 5% fetal bovine serum for 2 days. After this period, cultures were simultaneously infected with tachyzoites of T. gondii and treated with the antipsychotics haloperidol and clozapine for 48 hours. Treatment effects were determined by both assessing cell viability with the MTT method and evaluating infection outcomes in slides stained with Giemsa. The treatment with haloperidol and clozapine cells infected with T. gondii resulted in higher viability of these cells, suggesting a possible prevention of neuronal degeneration induced by T. gondii. Additionally, intracellular replication of this protozoan in cells treated with haloperidol and clozapine were significantly reduced, possibly by modulation of the parasite’s intracellular calcium concentration.
LISTA DE FIGURAS
Figura 1: Taquizoíta de T. gondii. ... 14
Figura 2: Bradizoíta de T. gondii. ... 15
Figura 3: Oocisto de T. gondii ... 16
Figura 4: Ciclo de vida de T. gondii. ... 18
Figura 5: Invasão de T. gondii ... 22
Figura 6: Diagrama da estrutura histológica da retina ... 30
Figura 7: Curva de viabilidade celular de células embrionárias da retina tratadas com sulfadiazina (10µg/mL) e clozapina nas concentrações 0,01µg/mL, 0,1 µg/mL, 1 µg/mL, 5 µg/mL e 10µg/mL ... 40
Figura 8: Curva de viabilidade celular de células embrionárias da retina tratadas com sulfadiazina (10µg/mL) e haloperidol nas concentrações 0,01µg/mL, 0,1 µg/mL, 1 µg/mL, 5 µg/mL e 10µg/mL ... 41
Figura 9: Curva de viabilidade celular de células embrionárias da retina infectadas com T. gondii tratadas com sulfadiazina (10µg/mL) e clozapina nas concentrações 2,5 µg/mL, 5 µg/mL e 10µg/mL ... 42
Figura 10: Curva de viabilidade celular de células embrionárias da retina infectadas com T. gondii tratadas com sulfadiazina (10µg/mL) e haloperidol nas concentrações 2,5 µg/mL, 5 µg/mL e 10µg/mL ... 42
Figura 11: Efeito do tratamento com sulfadiazina (10µg/mL) e clozapina (5 µg/mL) sobre a infecção por T. gondii de células embrionárias da retina ... 43
LISTA DE ABREVIATURAS
AMA1 Antígeno de membrana apical AMPC Adenosina monofosfato cíclico C+ Tratamento com sulfadiazina CCG Camada de células ganglionares CNE Camada nuclear externa
CNI Camada nuclear interna CPE Camada plexiforme externa CPI Camada plexiforme interna D2 Receptor dopaminérgico
DMEM Meio Eagle modificado Dulbecco DMSO Dimetilsulfóxido
E12 Dia embrionário doze
EGTA Quelante de cálcio extracelular GABA Àcido gama-aminobutírico
GBR- 12909 Bloqueador seletivo de autoreceptores dopaminérgicos GRA Protéina do grânulo denso
ID50 Concentração inibitória média IFN-γ Interferon gama
IL- 6 Interleucina 6 IP3 Inositol trifosfato
KT5926 Inibidor de proteína quinase dependente de cálcio MIC Proteína micronemal
MTT Brometo de (3-metil-[4-5-dimetiltiazol-2-il]-2,5 difeniltetrazólio) NO Óxido nítrico
NaOH Hidróxido de sódio
PAS Coloração com ácido periódico - Schiff PKA Proteína quinase A
PVM Membrana do vacúolo parasitofóro RON Proteína roptrial
ROS Espécies reativas ao oxigênio SAG Antígeno de superfície
SFB Soro fetal bovino
SRS Proteína de sequência relacionada a SAG SUSA Proteína de sequência não-relacionada a SAG TNF-α Fator de necrose tumoral
SUMÁRIO
LISTA DE FIGURAS
LISTA DE ABREVIATURAS
1. INTRODUÇÃO ... 13
1.1. O Toxoplasma gondii ... 13
1.1.1. Ciclo de vida ... 17
1.1.2. Interação parasita-hospedeiro ... 19
1.1.3. Infecção por T. gondii ... 23
1.1.4. Toxoplasmose, comportamento e antipsicóticos ... 24
1.2. Estrutura da retina ... 29
1.2.1. A retina em desenvolvimento ... 31
1.2.2. Localização celular de neurotransmissores na retina de galinha ... 32
1.2.3. A retina como modelo de estudo ... 32
2. OBJETIVOS ... 34
2.1. Objetivos Específicos ... 34
3. MATERIAIS E MÉTODOS ... 35
3.1. Parasitos ... 35
3.2. Animais ... 35
3.3. Cultura de células retinianas em monocamada ... 36
3.4. Interação parasito-célula ... 36
3.5. Tratamento com antipsicóticos ... 37
3.6. Determinação da viabilidade celular pelo método de MTT ... 37
3.7. Avaliação da infecção por T. gondii ... 38
3.8. Análise estatística ... 39
4. RESULTADOS ... 40
4.1. Viabilidade celular de células embrionárias da retina tratadas com os antipsicóticos clozapina e haloperidol ... 40
1. INTRODUÇÃO
1.1 O Toxoplasma gondii
O T. gondii foi descrito em 1908 por Nicolle e Manceaux no roedor Ctenodactylus gundi, encontrado na Tunísia, norte da África, e por Alfonso Splendore, no Brasil, em um coelho (Nicolle e Manceaux, 1908; Splendore, 1908). A denominação científica do parasito faz referência ao seu formato de arco (toxon, em grego) e ao roedor em que foi descoberto (Nicolle e Manceaux, 1908) O T. gondii é um protozoário intracelular obrigatório do filo Apicomplexa, classe Sporozoa, subclasse Coccidia, ordem Eucoccidiida, subordem Eimeriina, família Sarcocystidae e subfamília Toxoplasmatinae (Roberts, Schmidt et al., 2009).
Os membros do filo Apicomplexa são caracterizados pela presença do complexo apical, composto de organelas secretórias especializadas na adesão, invasão e multiplicação do parasito na célula hospedeira, como róptrias, micronemas e grânulos densos (Alexander, Mital et al., 2005).
hospedeiro (Dubey, Lindsay et al., 1998). Ocasionalmente, as células hospedeiras se rompem liberando os taquizoítas, que invadem novas células disseminando a infecção para diferentes tecidos, incluindo o sistema nervoso central (SNC), olhos, músculos esquelético e cardíaco e placenta (Denkers e Gazzinelli, 1998). A taxa de invasão e multiplicação dos taquizoítas depende da cepa específica de T. gondii e do tipo de célula hospedeira infectada (Appleford e Smith, 1997).
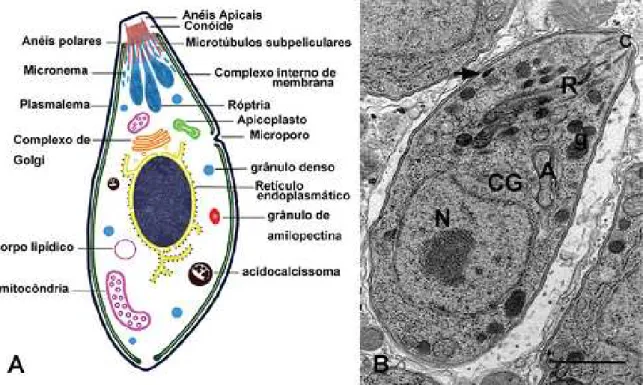
Figura 1: Taquizoíta de T. gondii. (A) Representação esquemática. (B) Corte
longitudinal, com destaque para as seguintes estruturas: núcleo (N), conóide (C), róptrias
(R), apicoplasto (A), complexo de Golgi (CG), grânulo denso (g) e micronema (seta).
Fonte: Souza, et al., 2010.
pólo terminal. A formação do cisto induz o aparecimento de proteínas específicas, demonstrando um controle gênico no processo (Smith, 1995). Os cistos podem ocorrer em diversos órgãos como pulmões, fígado e rins, embora predominem em tecidos neurais e musculares, podendo persistir por toda a vida do hospedeiro (Dubey, Lindsay et al., 1998).
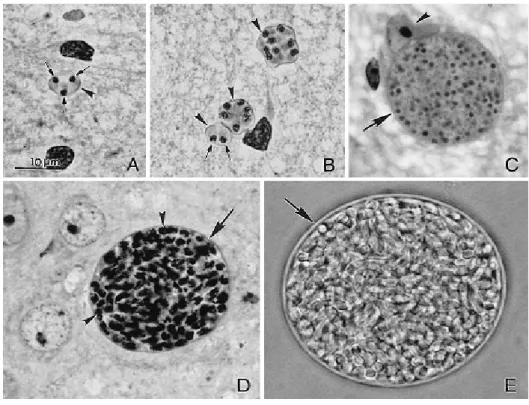
Figura 2: Bradizoíta de T. gondii. (A) Cistos teciduais com três bradizoítas, cada um
com um núcleo terminal (seta) e parede do cisto (ponta de seta). Esfregaço com
impregnação pela prata e Giemsa (B) Três cistos teciduais com parede dos cistos bem
definidas (ponta de seta). Cisto tecidual com dois bradizoítas, cada um com núcleo terminal
(seta). Esfregaço com impregnação pela prata e Giemsa. (C) Secção com cisto tecidual
intracelular. Note a fina parede do cisto tecidual (ponta de seta) e o núcleo da célula
hospedeira (seta) Marcação com hematoxilina e eosina. (D) Cistos teciduais com numerosos
bradizoítas PAS-positivos (ponta de seta) cercados por uma parede de cisto PAS-negativa.
Marcação com PASH. (E) Cisto tecidual livre no cérebro de camundongos. Note a parede do
cisto (seta) envolvendo centenas de bradizoítas. Esfregaço não corado.
O oocisto está presente somente em felídeos e está relacionado ao ciclo sexuado enteroepitelial do hospedeiro. Mede aproximadamente 10 x 12 µm de diâmetro e tem forma ovóide. Cada oocisto contem 2 esporocistos com 4 esporozoítas (figura 3) (Dubey, Lindsay et al., 1998). Os esporozoítas são liberados dos oocistos ingeridos no trato gastrointestinal, onde se multiplicam em células da mucosa e se diferenciam em taquizoítas que se disseminam através da corrente sanguínea ou pelos vasos linfáticos (Dubey, 2004).
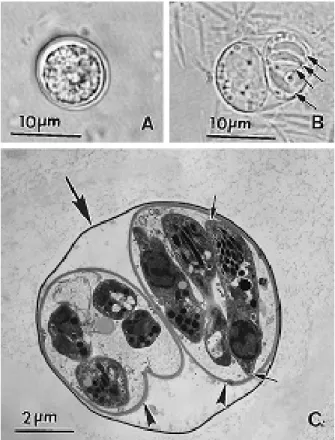
Figura 3: Oocisto de T. gondii. (A) Oocisto não-esporulado. Massa central
(esporonte) ocupando todo o oocisto, (B) Oocisto esporulado com dois esporocistos, quatro
esporozoitos (setas) estão visíveis em um dos esporocistos, (C) Micrografia eletrônica de
oocisto esporulado. Note a parede do oocisto (seta larga), dois esporocistos (ponta de seta),
e esporozoítos, um dos quais aparece em corte longitudinal (setas pequenas).
1.1.2 Ciclo de vida
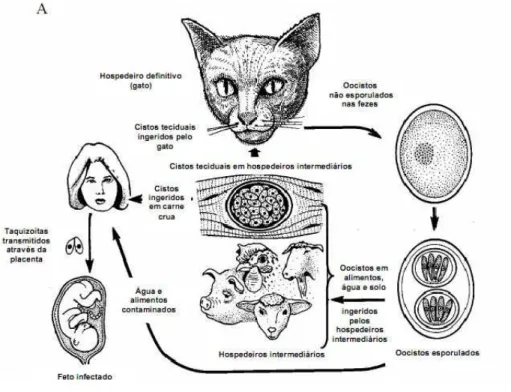
O ciclo biológico do T. gondii é facultativamente heteroxeno, com transmissão do parasito de um hospedeiro intermediário (replicação assexuada) para um definitivo (replicação sexuada). Os hospedeiros intermediários podem ser todos os animais endotérmicos (mamíferos e aves). Os hospedeiros definitivos são membros da família Felidae, com o gato doméstico sendo o hospedeiro mais importante, do ponto de vista epidemiológico, para a toxoplasmose humana (Figura 4) (Dubey, Lindsay et al., 1998).
Todas as três formas de T. gondii (taquizoítas, bradizoítas e oocistos esporulados) são infecciosas tanto para hospedeiros intermediários como definitivos, que podem adquirir a infecção pelas seguintes vias de transmissão: i) Ingestão oral de oocistos do ambiente, através da contaminação de água e alimentos; ii) Ingestão oral de cistos encontrados em carne crua ou mal cozida de hospedeiros intermediários; iii) Transferência transplacentária de taquizoítas (transmissão vertical) (Tenter, Heckeroth et al., 2000).
Em hospedeiros intermediários, onde não há a fase sexuada do ciclo, os bradizoítas presentes nos cistos de T. gondii diferenciam-se diretamente em taquizoítas. Inicialmente, os taquizoítas multiplicam-se rapidamente por endodiogenia repetida em diferentes tipos de células hospedeiras e, em seguida, originam bradizoítas em uma variedade de tecidos (Tenter, Heckeroth et al., 2000).
Após ingerir qualquer uma das três formas infecciosas de T. gondii o gato elimina oocistos. Os oocistos são pouco infecciosos e patogênicos para gatos pela via oral em comparação com outros hospedeiros. Por exemplo, enquanto apenas um oocisto é oralmente infectivo para camundongos, cem ou mais oocistos são necessários para estabelecer a infecção em gatos (Dubey, 1996).
Figura 4: Ciclo de vida de T. gondii.
1.1.3. Interação parasito-hospedeiro
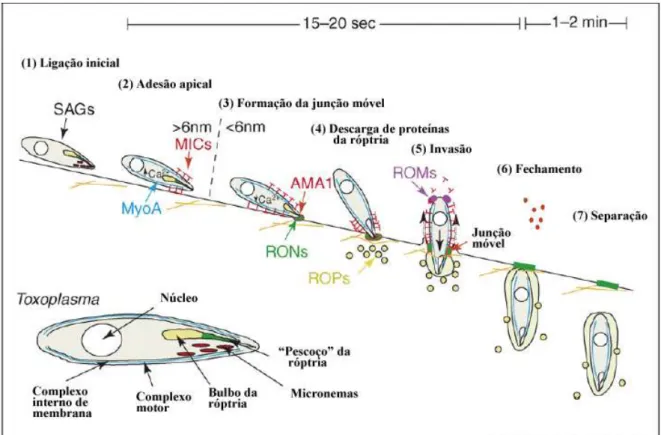
A invasão de células hospedeiras por T. gondii é um processo rápido (15 a 20 segundos), dinâmico e complexo, envolvendo adesão na superfície da célula hospedeira, a ação de organelas secretoras e a invaginação da membrana plasmática da célula hospedeira, induzida pelo parasito (Figura 5) (Soldati e Meissner, 2004).
O parasito se locomove através de um processo de deslizamento (gliding), dependente de energia e baseado na interação actina-miosina, que é utilizado na invasão celular e migração movimentando o protozoário a uma velocidade de 1 à 10 µm por segundo. Tanto a velocidade quanto a direção do deslizamento são determinados pela dinâmica da interação actina-miosina (Sibley, 2004; Wetzel, Chen et al., 2004; Carruthers e Boothroyd, 2007).
Durante o processo de invasão celular, ocorre uma reorientação do parasito, que se posiciona perpendicularmente à superfície da célula hospedeira, onde estabelece uma ligação de baixa afinidade através de seus antígenos de superfície (SAG, do inglês “surface antigens”), proteínas de sequência relacionada à SAG (SRS), e proteínas de sequência não-relacionada à SAG (SUSA) (Boothroyd, Hehl et al., 1998; Pollard, Onatolu et al., 2008). Em virtude de sua capacidade de invadir praticamente qualquer tipo celular, especula-se que o T. gondii interage com vários receptores celulares, como glicosaminoglicanos sulfatados (p.ex. heparina) (Ortega-Barria e Boothroyd, 1999; He, Grigg et al., 2002).
dentre as quais destaca-se AMA1 (do inglês “apical membrane antigen") que estabelece um contato íntimo de menos de 6 nm com a superfície da célula hospedeira (Carruthers e Boothroyd, 2007).
O processo de invasão prossegue com a exocitose de proteínas de outras organelas secretórias de T. gondii chamadas róptrias. Quatro proteínas (RON2, RON4, RON5 e RON 8), localizadas em uma porção alongada da róptria denominada “pescoço”, juntam-se à proteína micronemal AMA1 formando a junção móvel, que é uma junção do tipo ocludente em formato de anel formada entre as membranas do parasito e da célula hospedeira no momento da entrada ativa (Alexander, Mital et al., 2005).
A formação do complexo de junção móvel resulta no desenvolvimento da membrana do vacúolo parasitóforo (PVM, do inglês parasitophorous vacuolar membrane), derivada da invaginação da membrana plasmática da célula hospedeira. A junção móvel controla seletivamente a internalização de componentes da membrana da célula hospedeira na PVM em formação excluindo a maioria das proteínas transmembrana da célula hospedeira (Mordue, Desai et al., 1999). Os lipídios usados para o desenvolvimento do vacúolo parasitóforo (PV) são derivados, em sua maioria, da membrana plasmática do hospedeiro ao invés de serem originados de organelas do hospedeiro como lisossomos, retículo endoplasmático e complexo de Golgi (Suss-Toby, Zimmerberg et al., 1996). Isso poderia explicar parcialmente a razão da PVM não se fundir com lisossomos ou outras vesículas hospedeiras (Mordue, Desai et al., 1999), permitindo a sobrevivência e multiplicação de T. gondii ao garantir a evasão da defesa imune celular, além de permitir o acesso do parasito ao citoplasma rico em nutrientes da célula hospedeira (Mordue, Hakansson et al., 1999).
parasito pode sintetizar suas próprias proteínas e lipídios a partir de aminoácidos e pequenas moléculas importadas do citoplasma hospedeiro, através de canais de transporte na PVM (Saliba e Kirk, 2001).
O processo de maturação do vacúolo ocupado pelo parasito T. gondii envolve a secreção de proteínas de grânulos densos (GRA) no vacúolo recém-formado e a elaboração de uma rede tubulovesicular (TVN, do inglês “tubulovesicular network”) (Carruthers e Sibley, 1997; Mercier, Dubremetz et al., 2002). Proteínas GRA são liberadas durante e após a invasão no vacúolo parasitóforo, podendo permanecer na luz do PV ou associar-se à PVM ou à TVN. A TVN revestida por proteínas GRA é uma rede que se estende da PVM à luz do vacúolo, formando nanotúbulos elongados de 60 a 90 nm de diâmetro. Essa rede pode participar no desenvolvimento intracelular do parasito ao aumentar a área de superfície de trocas entre o parasita e a célula hospedeira (Sibley, Niesman et al., 1995; Mercier, Dubremetz et al., 2002).
Figura 5: Invasão de T. gondii. (1) Ligação inicial envolve reconhecimento de
receptores de superfície da célula hospedeira por SAGs. (2) Adesão apical compreende a
liberação, dependente de cálcio, de proteínas micronemais (MICs) e sua acumulação na
superfície apical do parasito. (3) A junção móvel é formada pela liberação de proteínas do
“pescoço” da roptria, as quais se associam com a proteína micronemal AMA1. (4) Proteínas
do bulbo da roptria são injetadas no citoplasma hospedeiro no local da invasão. (5) A
invasão envolve a formação do vacúolo parasitóforo. (6), (7) Fechamento e separação
envolvem a dissociação entre a membrana do vacúolo parasitóforo e a membrana
plasmática do hospedeiro.
1.1.4. Infecção por T. gondii
T. gondii é um protozoário de alta prevalência em animais e humanos, com estimativas de que 30-50% da população humana mundial esteja infectada cronicamente (Tenter, Heckeroth et al., 2000). A proliferação deste parasito pode causar um processo agudo de doença chamado toxoplasmose, sendo que a maioria dos indivíduos com soropositividade para T. gondii é assintomática.
A evolução clínica da toxoplasmose adquirida em pacientes imunocompetentes é habitualmente benigna. Os sinais e sintomas clínicos mais comuns são linfadenite e febre, acompanhadas por astenia e mialgia (Kean, 1972). Entretanto, em pacientes imunocomprometidos manifestações clínicas como encefalite, pneumonite e retinocoroidite são comuns (Luft e Remington, 1988).
A toxoplasmose congênita resulta de infecção aguda, geralmente assintomática, que é adquirida pela mãe durante a gestação. A parasitemia temporária ocasiona lesões focais na placenta, consequentemente infectando o feto. Os parasitos alcançam o feto pela via transplacentária causando grau variado de danos, dependendo da virulência do parasito, do sistema imune da progenitora e o período de gravidez em que a mãe foi infectada, resultando em morte ou sintomas clínicos severos (Spalding, Amendoeira et al., 2003; Wang, Liu et al., 2010).
A tétrade clássica de Sabin de sinais clínicos da toxoplasmose congênita inclui microcefalia ou anencefalia, calcificações intracranianas, anormalidades mentais e retinocoroidite (Melamed, Dornelles et al., 2001). Aproximadamente 20% dos recém-nascidos com toxoplasmose congênita apresentam doença grave. Ao contrário dos 70% que são assintomáticos ao nascer, mas que podem apresentar patologias associadas no futuro, como retinocoroidite e desenvolvimento mental e neurológico retardado (Tenter, Heckeroth et al., 2000).
fase cicatricial inativa, a toxoplasmose ocular está associada com defeitos permanentes no campo visual em mais de 94% dos casos, com dois terços dos indivíduos apresentando defeitos graves e 48% apresentando diminuição na acuidade visual (Scherrer, Iliev et al., 2007).
O principal alvo da toxoplasmose ocular é a retina, onde o parasito causa inflamação necrosante e, na fase inativa, forma cistos intracelulares (Gazzinelli, Brezin et al., 1994). Também já foi observado a presença de taquizoítos livres e cistos dentro de células do epitélio pigmentar da retina (Nicholson e Wolchok, 1976).
Dentre as lesões oculares, a retinocoroidite é a característica mais marcante da toxoplasmose ocular. É comumente acompanhada por uveíte posterior difusa e reação inflamatória do humor vítreo. A lesão ocular típica causada por T. gondii é oval e redonda, situada na retina. Nos estágios ativos, as lesões apresentam uma aparência cinza-esbranquiçada e podem estar associadas com edema de retina. Quando a inflamação desaparece, ocorre uma atrofia retiniana e coroidal, usualmente com pigmentação das lesões (Vallochi, Muccioli et al., 2005).
1.1.5. Toxoplasmose, comportamento e antipsicóticos
O T. gondii possui um “tropismo” pelo sistema nervoso central. Cistos intracelulares são localizados preferencialmente na retina e cérebro, mas a justificativa para esta localização preferencial é especulativa, na melhor das hipóteses. Alguns estudos sugerem uma relação com o status imunológico diferenciado do cérebro ou a existência de propriedades específicas das células cerebrais, ou ambos (Hunter e Remington, 1994).
infectadas por este parasito (Creuzet, Robert et al., 1998; Fagard, Van Tan et al., 1999). Recentemente, foi demonstrado que os cistos parasitados são encontrados quase exclusivamente no interior de neurônios, não em células de glia, onde podem permanecer por toda a vida do hospedeiro protegidos da ação do sistema imunológico (Melzer, Cranston et al., 2010).
Os parasitos sobrevivem através da exploração de hospedeiros de uma espécie diferente. Este estilo de vida é extremamente bem-sucedido evolutivamente, tendo em vista que para cada organismo existe um parasito que pode infectá-lo. Hospedeiros e parasitos co-evoluem em uma disputa perpétua envolvendo adaptações e contra-adaptações de modo a manter suas adequações aos ambientes no qual compartilham. Este raciocínio é capturado na hipótese evolucionária denominada de princípio da rainha vermelha, proposta por van Valen (Van Valen, 1973) e que pode ser resumido como: “para um sistema evolucionário, o desenvolvimento contínuo é necessário apenas para manter a sua adequação relativa aos sistemas com os quais co-evolui”. No caso de seres humanos, esse princípio pode ser ilustrado pelo fato de que apesar da imensa alocação somática para o sistema imunológico no nosso organismo, as pessoas ainda são bastante vulneráveis às doenças infecciosas.
dendriticum se deslocam para o topo da vegetação e assim aumentam suas chances de predação pelo hospedeiro definitivo do parasito, as ovelhas (Carrey, 1969). Ou o aumento da atratividade de seres humanos infectados pelos parasitos do gênero Plasmodium, causadores da malária, para os mosquitos do gênero Anopheles, hospedeiros definitivos destes parasitos, permitindo que o mesmo possa completar o seu ciclo de vida (Lacroix, Mukabana et al., 2005). As modificações fenotípicas induzidas por parasitos são bem variadas, tanto em magnitude quanto em diversidade. Na maioria dos casos, são vários os traços fenotípicos modificados pelo parasito no hospedeiro, em efeito transformando-os em organismos profundamente modificados (Thomas, Adamo et al., 2005; Thomas, Poulin et al., 2010).
No caso do T. gondii, as alterações fenotípicas induzidas em hospedeiros intermediários como os roedores incluem a modificação do comportamento inato de aversão ao odor da urina de felinos em atração (Berdoy, Webster et al., 2000; Vyas, Kim et al., 2007; Webster, 2007; Kannan, Moldovan et al., 2010; House, Vyas et al., 2011). Esta alteração comportamental é especifica para a aversão inata aos feromônios do gato presentes na urina, já que não ocorrem alterações em outros comportamentos, tal como medo aprendido ou ansiedade (Vyas, Kim et al., 2007).
Os cistos de T.gondii se localizam em regiões estratégicas para a manipulação do comportamento no sistema nervoso central de mamíferos, como no sistema límbico (Holliman, 1997), sistema olfatório, córtex pré-frontal, hipotálamo, amígdala lateral e basolateral (Vyas, Kim et al., 2007). O sistema límbico é uma região envolvida na mediação de vários comportamentos sociais, tal como: agressividade, reprodução e comportamentos parentais (KLEIN, S.L., 2003). Recentemente foi demonstrado que ratos infectados cronicamente com T.gondii ao serem expostos ao odor do gato apresentam aumento da atividade neural localizada numa região da amígdala normalmente ativada quando ratos não infectados são expostos a uma fêmea no estro (House, Vyas et al., 2011). Isto poderia explicar a atração fatal que roedores infectados apresentam pela urina de gato.
Mais recentemente, foi demonstrado que o genoma do T. gondii possui dois genes, TgAaaH1 e TgAaaH2, capazes de codificar a enzima tirosina hidroxilase, a enzima passo-limitante para síntese de dopamina (Gaskell, Smith et al., 2009). Além disso, foi observado que a infecção de células dopaminérgicas com o T. gondii aumentou o metabolismo de dopamina, indicando um possível mecanismo para a manipulação comportamental observada em hospedeiros intermediários do parasito (Prandovszky, Gaskell et al., 2011).
A esquizofrenia é uma doença mental crônica e severa que se manifesta tipicamente no início da vida adulta. É atualmente classificada em três dimensões sintomáticas: sintomas negativos (isolamento social, apatia e falta de iniciativa), sintomas positivos (delírios e alucinações) e comprometimento cognitivo (prejuízo na atenção e memória) (Abi-Dargham e Moore, 2003). Estudos que apontam os processos fisiopatológicos indutores da expressão destes sintomas associados com alterações no sistema de neurotransmissão dopaminérgica tem recebido marcante atenção (Abi-Dargham e Moore, 2003; Guillin, Abi-Dargham et al., 2007).
A hipótese dopaminérgica da esquizofrenia sugere que a mesma resulta de um desequilíbrio nos sistemas dopaminérgicos cortical e subcortical: projeções dopaminérgicas mesolímbicas subcorticais seriam hiperativas, resultando na hiperestimulação de receptores dopaminérgicos D2 e em sintomas positivos, enquanto as projeções dopaminérgicas mesocorticais para o córtex pré-frontal estariam hipoativas, ocasionando a hipoestimulação dos receptores D1, os sintomas negativos e o prejuízo cognitivo associados com a doença (Guillin, Abi-Dargham et al., 2007).
Os antipsicóticos são drogas utilizadas para o tratamento de sintomas psicóticos, incluindo os da esquizofrenia, transtorno esquizoafetivo, transtornos do humor com sintomas psicóticos e psicoses associadas a transtornos cérebro-orgânicos. A primeira geração de antipsicóticos é chamada de típica, representada pelo haloperidol, e caracterizada por efeitos motores colaterais potencialmente incapacitantes, chamados de sintomas extrapiramidais (Conley e Kelly, 2005). Outra classe, chamada de drogas de 2ª geração ou antipsicóticos atípicos, são caracterizados por apresentarem um perfil mais favorável de sintomas extrapiramidais, sem perda da eficácia terapêutica e é representada pela clozapina (Conley e Kelly, 2005).
receptores dopaminérgicos é relativamente pequena, interagindo com outras classes de receptores: muscarínicos, serotoninérgicos, alfa-adrenérgicos e histamínicos (Fitton e Heel, 1990).
A ação de drogas antipsicóticas contra o T. gondii tem sido relatada tanto em estudos in vitro quanto in vivo. A replicação de taquizoítos, a forma de replicação rápida do T. gondii, pode ser inibida por antipsicóticos como a clozapina e o haloperidol em sistemas de cultura celular de fibroblastos humanos (Jones-Brando, Torrey et al., 2003; Goodwin, Strobl et al., 2011). Paralelamente, ratos infectados tratados com haloperidol e submetidos ao protocolo de “atração felina”, na qual estes animais são expostos a ambientes impregnados com o odor de seu predador natural, gato, e outros odores inespecíficos, visitaram e permaneceram menos tempo no “ambiente aversivo” em comparação com animais infectados não tratados com antipsicóticos (Webster, Lamberton et al., 2006).
1.2. Estrutura da retina
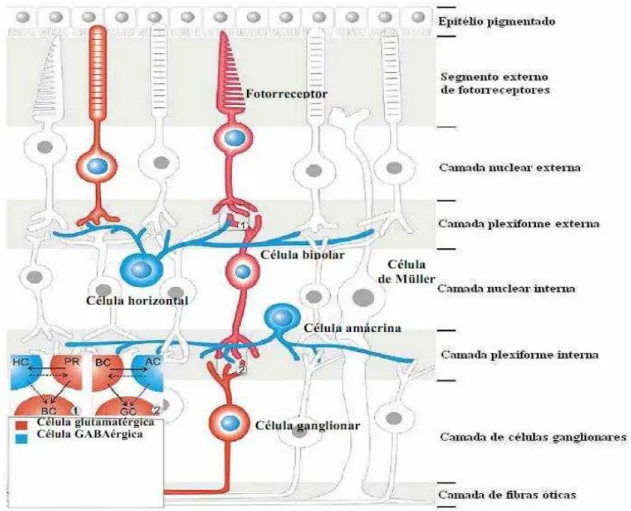
A retina está localizada ao fundo do globo ocular, sendo limitada anteriormente pelo humor vítreo e posteriormente pelo epitélio pigmentado. As células do epitélio pigmentado estão em contato íntimo com o segmento externo dos fotorreceptores, participando da reciclagem de suas membranas e da troca de metabólitos com toda a retina (Kubrusly, Guimaraes et al., 2003).
(CCG) são encontradas as células ganglionares e células amácrinas deslocadas (Figura 5) (Yang, 2004).
Os fotorreceptores, as células bipolares e as células horizontais fazem conexões sinápticas na camada plexiforme externa (CPE). As células bipolares, amácrinas e células ganglionares fazem contato sináptico na camada plexiforme interna (CPI).
Figura 6: Diagrama da estrutura histológica da retina. Mostrando a disposição das
células em camadas. Neurônios glutamatérgicos estão destacados em vermelho e
neurônios GABAérgicos em azul.
1.2.1. A retina em desenvolvimento
A retina é derivada embriologicamente do tubo neural. O desenvolvimento da retina de embrião de galinha dura aproximadamente três semanas e está praticamente completo no momento da eclosão. A região posterior do tubo neural se segmenta sob o comando de um repertório de genes e origina as estruturas precursoras do encéfalo (Mey e Thanos, 2000). O prosencéfalo se invagina bilateralmente formando as vesículas ópticas. A vesícula óptica primária se invagina formando a vesícula óptica secundária, precursora do globo ocular, que consiste em uma estrutura com duas camadas celulares. A camada mais externa formará o epitélio pigmentado, e a camada mais interna dispõe-se em epitélio pseudo-estratificado, formado por células-tronco capazes de dar origem a qualquer um dos tipos neuronais ou à célula de Müller na retina madura (Adler, 2000).
Os processos de divisão celular, migração e diferenciação são orquestrados para permitir a formação da retina madura. A proliferação e a diferenciação ocorrem de maneira sobreposta, pois os tipos celulares se originam em períodos diferentes. A origem de uma determinada célula corresponde ao momento em que esta passa por sua última divisão celular. As primeiras células a sofrerem diferenciação na retina de vertebrados são as células ganglionares. Na retina de galinha, essas células começam a surgir no 2° dia embrionário (E2) e são sucedidas por fotorreceptores, seguido de células de Müller, células amácrinas, células horizontais e células bipolares, que são os últimos neurônios a deixarem o ciclo mitótico. Entre E12 e E13, as células da CNI estão totalmente geradas, com o seu padrão de estratificação sendo essencialmente estabelecido em E16 (Mey e Thanos, 2000).
1.2.2 Localização celular de neurotransmissores na retina de galinha
Aminoácidos neurotransmissores tipicamente excitatórios como o glutamato e o aspartato, ou inibitórios como o ácido gama-aminobutírico (GABA) e a glicina tem sido detectados por imunohistoquímica em células da retina de galinha pós-eclosão (Sun e Crossland, 2000). Foi observado que células da via vertical de sinalização retiniana (fotorreceptores, células bipolares e células ganglionares) geralmente apresentam imunorreatividade para glutamato e aspartato, mas não para GABA e glicina (Kalloniatis e Tomisich, 1999). Ao contrário, células da via lateral (horizontais e amácrinas) apresentam imunorreatividade para GABA e/ou glicina, em adição ao glutamato e aspartato (Hokoc, Ventura et al., 1990). Também existem casos de co-localização extensa destes neurotransmissores em neurônios, inclusive ocorrendo casos de colocalização dos quatro neurotransmissores na mesma célula (Sun e Crossland, 2000).
A imunorreatividade para a dopamina, por sua vez, tem sido observada principalmente em células da CNI e são identificadas com células amácrinas e/ou interplexiformes (Wulle e Schnitzer, 1989). Adicionalmente, foi observado que células de Müller expressam tanto fenótipo dopaminérgico como GABAérgico (Kubrusly, Da Cunha et al., 2005; Kubrusly, Panizzutti et al., 2008). Neste sentido, ambos receptores dopaminérgicos D1 e D2 são expressos em retina de galinha, sendo que receptores D1 diferenciam-se mais precocemente que receptores D2 (De Mello, Ventura et al., 1982; Ventura, Klein et al., 1984).
1.2.3. A retina como modelo de estudo
central (Ferreira e Paes-De-Carvalho, 2001; Magalhaes, Socodato et al., 2006), devido à origem embrionária comum com o cérebro, aliada a um arranjo histológico bem conhecido de camadas alternadas de corpos celulares e axônios, com relativamente poucos tipos celulares. Além disso, as células da retina podem expressar fenótipos de quase todos os neurotransmissores.
A obtenção do tecido retiniano é possível durante quase todos os estágios embrionários, viabilizando o estudo de diversas fases do desenvolvimento do tecido nervoso. A retina é um órgão de fácil dissecção, com probabilidade reduzida de contaminação por outros tecidos neuronais ou não neuronais, além de não provocar danos significativos por hipóxia, pois a retina de galinha tem grande capacidade de metabolismo glicolítico (Lolley, 1969).
As células da retina podem ser mantidas por vários dias em cultura, mesmo em estágios precoces do desenvolvimento embrionário. Diversas formas de cultura podem ser realizadas, como culturas mistas de neurônios e células gliais, culturas purificadas de células gliais (Cossenza e Paes De Carvalho, 2000), ou purificadas de neurônios e fotorreceptores (Adler, Lindsey et al., 1984). Culturas de explantes, que utilizam pequenos pedaços do tecido, também podem ser feitas de forma que o arranjo histológico da retina seja preservado (Zhang, Coleman et al., 2003). A cultura em agregados é outra estratégia para reproduzir uma estrutura laminada, semelhante à do tecido original, em que as células são cultivadas em recipientes apropriados em rotação constante (Layer e Willbold, 1993).
2 OBJETIVOS
2.1 Geral
Avaliar o efeito das drogas antipsicóticas haloperidol e clozapina sobre a infecção pelo T. gondii em cultura de células retinianas embrionárias.
2.2 Específicos
1. Analisar o efeito dos antipsicóticos haloperidol e clozapina sobre a viabilidade celular de células embrionárias da retina.
2. Analisar o efeito dos antipsicóticos haloperidol e clozapina sobre a viabilidade celular de células embrionárias da retina infectadas com o T. gondii.
3 MATERIAL E MÉTODOS
3.1 Parasitos
A cepa RH de Toxoplasma gondii foi obtida de camundongos mantidos no laboratório de Biologia da Malária e Toxoplasmose da Universidade Federal do Rio Grande do Norte (LABMAT - UFRN) e mantida, através de passagens consecutivas, em células da linhagem Hella. As células eram infectadas na proporção 1:1 em meio Hepes contendo 2% de soro fetal bovino, 10mM de L-glutamina e, posteriormente, incubadas dentro de uma estufa a 37ºC e com 5% de CO2. Após 24 horas, o meio foi
substituído por outro sem soro fetal bovino. O T. gondii era coletado três a quatro dias depois por agitação vigorosa e precipitação por centrifugação a 1000xG por 10 minutos (Ashburn, Evans et al., 2000).
3.2 Animais
3.3 Cultura de células retinianas em monocamada
Os olhos de embriões E12 (dia embrionário doze) foram retirados e suas retinas dissecadas, na presença de meio livre de cálcio e magnésio (CMF: NaCl 131mM, KCl 4,09mM, Na2HPO4 0,92mM, KH2PO4 0,45mM, glicose 12,2 mM, NaHCO3 9,4mM, pH 7,4), em ambiente estéril. O tecido era então incubado a 37°C na presença da enzima tripsina a 0,05% em CMF por dez minutos. Após este período, realizava-se uma rápida centrifugação (500xG) para a retirada do excesso da enzima e procedia-se a dissociação mecânica das células com jatos de meio DMEM (Dubelcos modified Eagle Medium - Gibco) com baixa glicose (1%) na presença, de soro fetal bovino (SFB) a 5%.
As células dissociadas eram então semeadas em placas de cultivo celular de 24 poços (concentração de 106 células/poço) e em placas de 96 poços (concentração de 5x105 células/poço) e mantidas em meio DMEM suplementado com antibiótico gentamicina (100µg/ml) e 5% de SFB dentro estufa com 5% de CO2
e 37ºC, por 2 dias. O meio foi trocado diariamente. Quando a realização da cultura previa a coloração por Giemsa, nos poços das placas de 24 poços eram previamente colocadas lamínulas redondas de 13 mm e estas tratadas com poli-L-lisina (Sigma; 10µg/mL de água estéril) por uma noite, no volume de 500µL / poço.
3.4 Interação parasito-célula
foi de aproximadamente 1 parasito para cada 100 células presentes no poço no dia da interação.
3.5 Tratamento com antipsicóticos
Após a interação inicial de T. gondii com células retinianas por duas horas, as células foram lavadas para remover parasitos não aderentes e então tratadas, por 48 horas, com os antipsicóticos clozapina e haloperidol nas concentrações 2,5µg/ml, 5µg/ml e 10µg/ml. Como controle negativo do tratamento, as células infectadas foram incubadas somente com meio de cultura. Em contrapartida, um antibiótico utilizado no controle da toxoplasmose denominado sulfadiazina foi utilizada como controle positivo do tratamento. A concentração de sulfadiazina utilizada foi de 10µg/m, tendo a mesma sido determinada por dados preliminares obtidos em laboratório nos quais esta concentração mostrava-se eficaz e não-citotóxica.
Tanto o haloperidol quanto a clozapina foram diluídos em DMSO (dimetilsulfóxido), em uma concentração final menor que 1%. A sulfadiazina, por sua vez, foi diluída em NaOH em uma concentração final também inferior a 1%.
3.6 Determinação da viabilidade celular pelo método de MTT
O método utilizado nesta dissertação foi adaptado a partir daquele descrito por Mosmann (Mosmann, 1983). Células retinianas em monocamada (E12C2) infectadas e não-infectadas, assim como tratadas ou não com os antipsicóticos descritos acima, foram incubadas por um período de 48 horas com 100µl de uma solução de MTT diluído em água destilada, na concentração de 0,5mg de MTT por mililitro. A placa foi então coberta com papel-alumínio e colocada na estufa de CO2 a
37ºC durante 4 horas. Após esse período, o sobrenadante foi retirado e adicionado 100 µl de DMSO a cada poço para dissolver os cristais. Após esse período, foram realizadas as leituras dos valores de absorbância com excitação com luz com um comprimento de onda de 570nm.
A porcentagem de viabilidade celular foi então determinada dividindo os valores das absorbâncias obtidos para cada amostra pelo valor do controle contendo apenas as células sem tratamento e aquelas tratadas somente com o DMSO.
3.7 Avaliação da infecção por T. gondii
A infecção por T. gondii foi realizada no segundo dia de cultivo celular, na concentração de 1 parasito/100 células, durante 48 horas, na presença ou não de drogas antipsicóticas. Para observação microscópica, as lamínulas com as células foram fixadas em paraformaldeído a 4% por 10 minutos e então coradas pelo método de Giemsa por 10 minutos, seguidos por lavagem em água destilada e montagem em lâmina com Entelam. Após a análise das lâminas em microscópio óptico (Zeiss) com o software axiovision (versão 4.7.2), os resultados foram expressos através dos seguintes parâmetros de infecção:
1. Taxa de replicação intracelular: números de parasitos por célula infectada;
A avaliação dos índices de infecção foi realizada em uma objetiva de 60 x de aumento, sob a qual eram contadas 100 células retinianas por lamínula.
3.8 Análise estatística
4. RESULTADOS
4.1 Viabilidade celular de células embrionárias da retina tratadas com os antipsicóticos clozapina e haloperidol
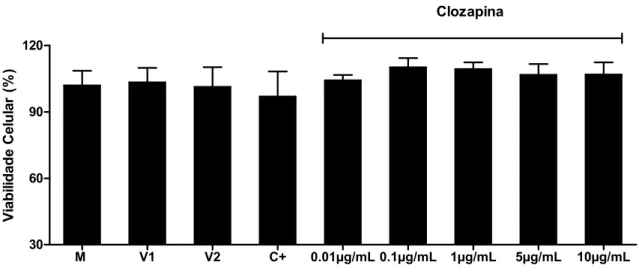
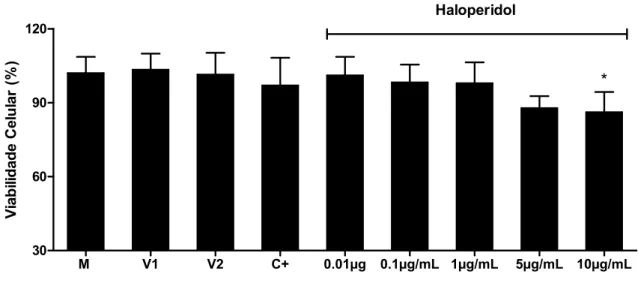
Nas células embrionárias da retina tratadas com clozapina, em diferentes concentrações, e sulfadiazina (10µg/mL) não houve alteração significativa da viabilidade celular em comparação com células não-tratadas (Figura 7). No entanto, o tratamento com o haloperidol resultou em tendência de diminuição da viabilidade celular, em uma maneira dose-dependente, sendo esta diminuição estatisticamente significativa apenas na concentração de 10µg/mL (p<0,05) (Figura 8).
Figura 7: Curva de viabilidade celular de células embrionárias da retina tratadas com
sulfadiazina (10µg/mL) e clozapina nas concentrações 0,01µg/mL, 0,1 µg/mL, 1 µg/mL, 5
µg/mL e 10µg/mL. M= meio; V1= DMSO; V2= NaOH; C+= sulfadiazina.
M V1 V2 C+ 0.01µg/mL 0.1µg/mL 1µg/mL 5µg/mL 10µg/mL
Figura 8: Curva de viabilidade celular de células embrionárias da retina tratadas com
sulfadiazina (10µg/mL) e haloperidol nas concentrações 0,01µg/mL, 0,1 µg/mL, 1 µg/mL, 5
µg/mL e 10µg/mL. M= meio; V1= DMSO; V2= NaOH; C+= sulfadiazina. .(*: p<0,05).
4.2 Viabilidade celular de células embrionárias da retina infectadas
com T. gondii e tratadas com os antipsicóticos clozapina e haloperidol
Em células embrionárias da retina infectadas com T. gondii observou-se que o tratamento com clozapina em todas as concentrações testadas aumentou significantemente a viabilidade destas células, quando comparadas às células infectadas sem tratamento (Figura 9). A concentração de 5µg/mL foi a que resultou em maior proteção (p<0,001). A clozapina na concentração de 10 µg/mL teve uma influência na viabilidade celular semelhante ao da sulfadiazina na concentração 10µg/mL (p<0,01) (Figura 9). O tratamento com haloperidol resultou em aumento significativo da viabilidade celular somente nas concentrações de 2,5µg/mL e 5µg/mL, com um resultado semelhante ao obtido com a sulfadiazina (p<0,05) (Figura 10).
M V1 V2 C+ 0.01µg 0.1µg/mL 1µg/mL 5µg/mL 10µg/mL
Figura 9: Curva de viabilidade celular de células embrionárias da retina infectadas
com T. gondii tratadas com sulfadiazina (10µg/mL) e clozapina nas concentrações 2,5
µg/mL, 5 µg/mL e 10µg/mL. M= meio; C+= sulfadiazina.(*: p<0,05; **: p<0,01; ***: p<0,001).
Figura 10: Curva de viabilidade celular de células embrionárias da retina infectadas
com T. gondii tratadas com sulfadiazina (10µg/mL) e haloperidol nas concentrações 2,5
µg/mL, 5 µg/mL e 10µg/mL. M= meio; C+= sulfadiazina. (*: p<0,05).
M C+ 2.5µg/ml 5µg/ml 10µg/ml
50 100 150 200
*
***
**
Clozapina V iab il id ad e C el u lar ( % ) ** *M C+ 2.5µg/ml 5µg/mL 10µg/ml
4.3 Avaliação da infecção por T. gondii em células embrionárias da retina tratadas com os antipsicóticos clozapina e haloperidol
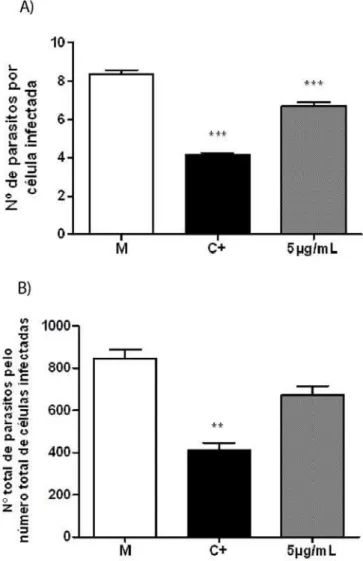
Houve diminuição significativa na taxa de replicação intracelular de parasitos (6,7±2,5 parasitos/célula) nas células embrionárias da retina infectadas com T. gondii e tratadas com clozapina na concentração de 5µg/mL, quando comparado com o grupo não-tratado (8,3±2,3 parasitos/célula). Este efeito não foi observado no índice global de infecção (Figuras 11 e 12), entretanto.
Figura 11: Efeito do tratamento com sulfadiazina (10µg/mL) e clozapina (5 µg/mL)
sobre a infecção por T. gondii de células embrionárias da retina. A, número de parasitos por
célula infectada, B, número total de parasitos pelo total de células infectadas. M= meio; C+=
Figura 12: Efeito do tratamento com sulfadiazina (10µg/mL) e clozapina (5 µg/mL)
sobre a infecção por T. gondii de células embrionárias da retina. A, sem tratamento, B,
tratamento com sulfadiazina, C, tratamento com clozapina. Nota-se a presença de parasitos
Nas células embrionárias da retina infectadas e tratadas com haloperidol, na concentração de 5µg/mL, houve uma redução significativa tanto na taxa de replicação intracelular (6±2,6 parasitos/célula) quanto no índice global de infecção (604,5±4,9 parasitos), em comparação com o grupo não-tratado (8,3±2,3 parasitos/célula e 845±63,6 parasitos, respectivamente) (Figuras 13 e 14).
Figura 13: Efeito do tratamento com sulfadiazina (10µg/mL) e haloperidol (5 µg/mL)
sobre a infecção por T. gondii de células embrionárias da retina. A, número de parasitos por
célula infectada, B, número total de parasitos pelo total de células infectadas. M= meio; C+=
Figura 14: Efeito do tratamento com sulfadiazina (10µg/mL) e haloperidol (5 µg/mL)
sobre a infecção por T. gondii de células embrionárias da retina. A, sem tratamento, B,
tratamento com sulfadiazina, C, tratamento com clozapina. Nota-se a presença de parasitos
5. DISCUSSÃO
Muitos antipsicóticos têm demonstrado atividade inibitória sobre a sobrevivência e proliferação de patógenos humanos. Em 1981, já se demonstrava que um composto tricíclico do grupo fenotiazina, azul de metileno, matava Plasmodium vivax, o agente causador da malária (Guttman e Ehrlich, 1891; Jones-Brando, Torrey et al., 2003). Em outros trabalhos mais recentes, estudos in vitro têm demonstrado atividade inibitória de fenotiazinas sobre o crescimento de Leishmania donovani (Pearson, Manian et al., 1984), Plasmodium falciparum (Kristiansen e Jepsen, 1985), vírus da imunodeficiência humana tipo 1 (Jones-Brando, Buthod et al., 1997), T. gondii (Pezzella, Bouchot et al., 1997), Trypanossoma cruzi (Gutierrez-Correa, Fairlamb et al., 2001) e Mycobacterium tuberculosis (Viveiros e Amaral, 2001).
Embora relevantes, os estudos que demonstraram o efeito antipatogênico dos antipsicóticos ainda não tinham sido testados em linhagens celulares do sistema nervoso, logo a avaliação deste efeito em cultura de células embrionárias da retina, composta por células gliais e neuronais, é oportuno. Entre as vantagens do modelo utilizado neste trabalho estão a expressão de fenótipos de quase todos os neurotransmissores assim como todos os seus receptores celulares característicos. Outra vantagem pertinente ao estudo com T. gondii é a conhecida preferência deste parasito pela retina. Além disso, estudo com células embrionárias podem servir para elucidar mecanismos patogênicos da toxoplasmose congênita, na qual ocorre a passagem de taquizoítas pela placenta seguida de colonização deste tecido, resultando em fetos assintomáticos ao nascer que, entretanto, ao longo da vida podem apresentar sequelas incluindo retinocoroidite (induzindo grave prejuízo da visão), perda auditiva ou retardo mental (Stray-Pedersen, 1993).
com trabalhos anteriores nos quais drogas antipsicóticas típicas demonstram neurotoxicidade de modo dose-dependente (Silver, Yang et al., 1994; Gil-Ad, Shtaif et al., 2001).
O mecanismo de ação comum de drogas antipsicóticas é o antagonismo do receptor dopaminérgico D2 (Nord e Farde, 2011). Receptores D2 são classicamente descritos como inibidores da enzima adenilato ciclase, resultando na diminuição dos níveis de AMPc e consequentemente a diminuição da ativação da proteína quinase A (PKA) e sinalização de cálcio (Neve, Seamans et al., 2004). Entretanto, trabalhos recentes demonstram que a ativação de receptores D2 resulta na ativação da isoforma de fosfolipase C (PLC), PLC 1, causando mobilização dos estoques intracelulares de cálcio induzida por IP3 (inositol trifosfato) e, por sua vez, ativação
de proteínas dependentes de cálcio (Hernandez-Lopez, Tkatch et al., 2000; Hu, Dong et al., 2005). Neste sentido, os antipsicóticos clozapina e haloperidol demonstram inibir a liberação de cálcio dependente de IP3 (Sczekan e Strumwasser,
1996).
O processo de invasão da célula pelo T. gondii inclui eventos que demonstram ser dependentes da sinalização por cálcio (Dobrowolski, Carruthers et al., 1997). As etapas iniciais da invasão, motilidade e ligação à célula hospedeira, podem ser inibidas por KT5926, um inibidor de proteínas quinase dependentes de cálcio (Dobrowolski, Carruthers et al., 1997). A mobilização de cálcio intracelular pelos ionóforos A23187 e ionomicina induzem a secreção de proteínas micronemais MIC2 e MIC4 (Carruthers e Sibley, 1999) e AMA1(Donahue, Carruthers et al., 2000). A replicação intracelular deste protozoário, por sua vez, também se mostrou suprimida por moduladores de cálcio (Song, Ahn et al., 2004).
candidatas para liberação e estoque de cálcio sob estimulação específica (Moreno e Docampo, 2003).
Em células de mamíferos, o retículo sarcoplasmático é a principal fonte de cálcio que pode ser rapidamente mobilizada por uma variedade de estímulos. Dois tipos de canais liberadores de cálcio têm sido identificados nesta organela: receptor de IP3 e receptor de rianodina (Guse, 1999). Estudos sugerem que ambos
receptores estão presentes em T. gondii e estão envolvidos no aumento de cálcio intracelular que promove a secreção de proteínas micronemais (Lovett, Marchesini et al., 2002; Lovett e Sibley, 2003).
A secreção de proteínas micronemais não depende somente da liberação de cálcio pela ativação de receptores, mas também do cálcio extracelular, uma vez que o tratamento de T. gondii com quelante de cálcio extracelular EGTA resultou na inibição de liberação de proteínas micronemais (Lovett, Marchesini et al., 2002). Isto pode ser devido a entrada capacitiva, na qual a liberação de cálcio de organelas intracelulares é reforçada pela subsequente entrada de cálcio de fora da célula (Putney, 1990). Então, este fluxo adicional de cálcio seria importante para a ativação da secreção micronemal (Lovett, Marchesini et al., 2002).
No presente estudo, houve diminuição significativa na taxa de replicação intracelular de T. gondii nas células embrionárias da retina tratadas com clozapina ou haloperidol, na concentração de 5µg/mL, porém somente o tratamento com haloperidol reduziu de modo significativo o índice global de infecção. Estes dados estão em concordância com estudo anterior, no qual a concentração inibitória média (ID50) da proliferação deste protozoário por haloperidol foi 5,6 µg/mL e de clozapina
foi de 5,8 µg/mL (Jones-Brando, Torrey et al., 2003).
sobre possíveis receptores presente neste protozoário e, desta forma, causando a inibição da replicação intracelular.
Adicionalmente, no presente estudo, observou-se que o tratamento com clozapina e haloperidol de células embrionárias da retina infectadas com T. gondii resultou em um efeito protetor da viabilidade celular, quando comparadas às células infectadas sem tratamento. O efeito neuroprotetor de clozapina já foi demonstrado em estudos anteriores, nos quais este efeito demonstrou ser resultante da habilidade deste antipsicótico atípico em inibir a ativação microglial e subseqüente liberação de mediadores inflamatórios incluindo ROS (Espécies Reativas ao Oxigênio), NO (óxido nítrico) e TNF-α (Fator de Necrose Tumoral alfa) (Magliaro e Saldanha, 2009; Hu, Zhou et al., 2012). O tratamento com haloperidol também inibe a ativação microglial e a resultante produção de NO e IL-6 (interleucina 6) (Kato, Monji et al., 2007).
A ativação glial garante a proteção contra injúrias cerebrais, incluindo infecções, através da produção de NO, TNF-α, IFN-γ (interferon gama) e outros metabólitos. Porém esses mediadores pró-inflamatórios podem causar sérios danos celulares e teciduais (Chao, Hu et al., 1992; Chao, Hu et al., 1995),no sistema nervoso central (Giovannoni, Heales et al., 1998).
Estudos in vitro com T. gondii demonstram que a prevenção da degeneração neuronal é dependente da inibição da produção de NO e outros mediadores inflamatórios(Rozenfeld, Martinez et al., 2003; Rozenfeld, Martinez et al., 2005) Isto sugere que o tratamento com os antipsicóticos no presente estudo pode estar contribuindo para prevenção da degeneração neuronal induzida pela infecção parasitária.
6. CONCLUSÃO E CONSIDERAÇÕES FINAIS
Células embrionárias da retina tratadas com clozapina não apresentaram alteração significativa da viabilidade celular, enquanto que o tratamento com haloperidol apresentou neurotoxicidade com tendência dose-dependente.
O tratamento com clozapina e haloperidol de células embrionárias da retina infectadas com T. gondii resultou em menor prejuízo da viabilidade destas células, o que sugere uma possível prevenção de degeneração neuronal induzida por estes antipsicóticos.
7. REFERÊNCIAS BIBLIOGRÁFICAS
Abi-Dargham, A. e H. Moore. Prefrontal DA transmission at D1 receptors and the pathology of schizophrenia. Neuroscientist, v.9, n.5, Oct, p.404-16. 2003.
Adler, R. A model of retinal cell differentiation in the chick embryo. Prog Retin Eye Res, v.19, n.5, Sep, p.529-57. 2000.
Adler, R., J. D. Lindsey, et al. Expression of cone-like properties by chick embryo neural retina cells in glial-free monolayer cultures. J Cell Biol, v.99, n.3, Sep, p.1173-8. 1984.
Alexander, D. L., J. Mital, et al. Identification of the moving junction complex of Toxoplasma gondii: a collaboration between distinct secretory organelles. PLoS Pathog, v.1, n.2, Oct, p.e17. 2005.
Appleford, P. J. e J. E. Smith. Toxoplasma gondii: the growth characteristics of three virulent strains. Acta Trop, v.65, n.2, May 15, p.97-104. 1997.
Ashburn, D., R. Evans, et al. Toxoplasma dye test using cell culture derived tachyzoites. J Clin Pathol, v.53, n.8, Aug, p.630-3. 2000.
Berdoy, M., J. P. Webster, et al. Fatal attraction in rats infected with Toxoplasma gondii. Proc Biol Sci, v.267, n.1452, Aug 7, p.1591-4. 2000.
Boothroyd, J. C., A. Hehl, et al. The surface of Toxoplasma: more and less. Int J Parasitol, v.28, n.1, Jan, p.3-9. 1998.
Caldas, L. A., W. De Souza, et al. Calcium ionophore-induced egress of Toxoplasma gondii shortly after host cell invasion. Vet Parasitol, v.147, n.3-4, Jul 20, p.210-20. 2007.
Carrey, W. P. Behavioral and morphological changes in carpenter ants harboring dicrocoeliid metacercariae. American Midland Naturalist, v.82, p.605-611. 1969.
Carruthers, V. e J. C. Boothroyd. Pulling together: an integrated model of Toxoplasma cell invasion. Curr Opin Microbiol, v.10, n.1, Feb, p.83-9. 2007.
Carruthers, V. B. e L. D. Sibley. Sequential protein secretion from three distinct organelles of Toxoplasma gondii accompanies invasion of human fibroblasts. Eur J Cell Biol, v.73, n.2, Jun, p.114-23. 1997.
______. Mobilization of intracellular calcium stimulates microneme discharge in Toxoplasma gondii. Mol Microbiol, v.31, n.2, Jan, p.421-8. 1999.
Cezilly, F., F. Thomas, et al. Host-manipulation by parasites with complex life cycles: adaptive or not? Trends Parasitol, v.26, n.6, Jun, p.311-7. 2010.
______. Glia, cytokines, and neurotoxicity. Crit Rev Neurobiol, v.9, n.2-3, p.189-205. 1995.
Choisy, M., S. P. Brown, et al. Evolution of trophic transmission in parasites: why add intermediate hosts? Am Nat, v.162, n.2, Aug, p.172-81. 2003.
Conley, R. R. e D. L. Kelly. Second-generation antipsychotics for schizophrenia: a review of clinical pharmacology and medication-associated side effects. Isr J Psychiatry Relat Sci, v.42, n.1, p.51-60. 2005.
Cossenza, M. e R. Paes De Carvalho. L-arginine uptake and release by cultured avian retinal cells: differential cellular localization in relation to nitric oxide synthase. J Neurochem, v.74, n.5, May, p.1885-94. 2000.
Creuzet, C., F. Robert, et al. Neurons in primary culture are less efficiently infected by Toxoplasma gondii than glial cells. Parasitol Res, v.84, n.1, p.25-30. 1998.
De Mello, M. C., A. L. Ventura, et al. Regulation of dopamine- and adenosine-dependent adenylate cyclase systems of chicken embryo retina cells in culture. Proc Natl Acad Sci U S A, v.79, n.18, Sep, p.5708-12. 1982.
Denkers, E. Y. e R. T. Gazzinelli. Regulation and function of T-cell-mediated immunity during Toxoplasma gondii infection. Clin Microbiol Rev, v.11, n.4, Oct, p.569-88. 1998.
Donahue, C. G., V. B. Carruthers, et al. The Toxoplasma homolog of Plasmodium apical membrane antigen-1 (AMA-1) is a microneme protein secreted in response to elevated intracellular calcium levels. Mol Biochem Parasitol, v.111, n.1, Nov, p.15-30. 2000.
Dubey, J. P. Infectivity and pathogenicity of Toxoplasma gondii oocysts for cats. J Parasitol, v.82, n.6, Dec, p.957-61. 1996.
______. Toxoplasmosis - a waterborne zoonosis. Vet Parasitol, v.126, n.1-2, Dec 9, p.57-72. 2004.
Dubey, J. P., D. S. Lindsay, et al. Structures of Toxoplasma gondii tachyzoites, bradyzoites, and sporozoites and biology and development of tissue cysts. Clin Microbiol Rev, v.11, n.2, Apr, p.267-99. 1998.
Endo, T., K. K. Sethi, et al. Toxoplasma gondii: calcium ionophore A23187-mediated exit of trophozoites from infected murine macrophages. Exp Parasitol, v.53, n.2, Apr, p.179-88. 1982.
Fagard, R., H. Van Tan, et al. Differential development of Toxoplasma gondii in neural cells. Parasitol Today, v.15, n.12, Dec, p.504-7. 1999.
Fischer, H. G., B. Nitzgen, et al. Host cells of Toxoplasma gondii encystation in infected primary culture from mouse brain. Parasitol Res, v.83, n.7, p.637-41. 1997.
Fitton, A. e R. C. Heel. Clozapine. A review of its pharmacological properties, and therapeutic use in schizophrenia. Drugs, v.40, n.5, Nov, p.722-47. 1990.
Fuller Torrey, E., R. Rawlings, et al. The antecedents of psychoses: a case-control study of selected risk factors. Schizophr Res, v.46, n.1, Nov 30, p.17-23. 2000.
Gaskell, E. A., J. E. Smith, et al. A unique dual activity amino acid hydroxylase in Toxoplasma gondii. PLoS One, v.4, n.3, p.e4801. 2009.
Gazzinelli, R. T., A. Brezin, et al. Toxoplasma gondii: acquired ocular toxoplasmosis in the murine model, protective role of TNF-alpha and IFN-gamma. Exp Parasitol, v.78, n.2, Mar, p.217-29. 1994.
Gil-Ad, I., B. Shtaif, et al. Evaluation of the neurotoxic activity of typical and atypical neuroleptics: relevance to iatrogenic extrapyramidal symptoms. Cell Mol Neurobiol, v.21, n.6, Dec, p.705-16. 2001.
Giovannoni, G., S. J. Heales, et al. The potential role of nitric oxide in multiple sclerosis. Mult Scler, v.4, n.3, Jun, p.212-6. 1998.
Goodwin, D. G., J. S. Strobl, et al. Evaluation of five antischizophrenic agents against Toxoplasma gondii in human cell cultures. J Parasitol, v.97, n.1, Feb, p.148-51. 2011.
Guillin, O., A. Abi-Dargham, et al. Neurobiology of dopamine in schizophrenia. Int Rev Neurobiol, v.78, p.1-39. 2007.
Guse, A. H. Cyclic ADP-ribose: a novel Ca2+-mobilising second messenger. Cell Signal, v.11, n.5, May, p.309-16. 1999.
Gutierrez-Correa, J., A. H. Fairlamb, et al. Trypanosoma cruzi trypanothione reductase is inactivated by peroxidase-generated phenothiazine cationic radicals. Free Radic Res, v.34, n.4, Apr, p.363-78. 2001.
Guttman, P. e P. Ehrlich. Uber die wirkung des Methylenblau bei Malaria. Berl. Klin. Wochenschr, v.39, p.953-956. 1891.
He, X. L., M. E. Grigg, et al. Structure of the immunodominant surface antigen from the Toxoplasma gondii SRS superfamily. Nat Struct Biol, v.9, n.8, Aug, p.606-11. 2002.
Hering, H. e S. Kroger. Formation of synaptic specializations in the inner plexiform layer of the developing chick retina. J Comp Neurol, v.375, n.3, Nov 18, p.393-405. 1996.
PLC[beta]1-IP3-calcineurin-signaling cascade. J Neurosci, v.20, n.24, Dec 15, p.8987-95. 2000.
Hokoc, J. N., A. L. Ventura, et al. Developmental immunoreactivity for GABA and GAD in the avian retina: possible alternative pathway for GABA synthesis. Brain Res, v.532, n.1-2, Nov 5, p.197-202. 1990.
Holliman, R. E. Toxoplasmosis, behaviour and personality. J Infect, v.35, n.2, Sep, p.105-10. 1997.
House, P. K., A. Vyas, et al. Predator cat odors activate sexual arousal pathways in brains of Toxoplasma gondii infected rats. PLoS One, v.6, n.8, p.e23277. 2011.
Hu, X., H. Zhou, et al. Clozapine protects dopaminergic neurons from inflammation-induced damage by inhibiting microglial overactivation. J Neuroimmune Pharmacol, v.7, n.1, Mar, p.187-201. 2012.
Hu, X. T., Y. Dong, et al. Dopamine D2 receptor-activated Ca2+ signaling modulates voltage-sensitive sodium currents in rat nucleus accumbens neurons. J Neurophysiol, v.93, n.3, Mar, p.1406-17. 2005.
Hunter, C. A. e J. S. Remington. Immunopathogenesis of toxoplasmic encephalitis. J Infect Dis, v.170, n.5, Nov, p.1057-67. 1994.
Jones-Brando, L. V., J. L. Buthod, et al. Metabolites of the antipsychotic agent clozapine inhibit the replication of human immunodeficiency virus type 1. Schizophr Res, v.25, n.1, May 3, p.63-70. 1997.
Kalloniatis, M. e G. Tomisich. Amino acid neurochemistry of the vertebrate retina. Prog Retin Eye Res, v.18, n.6, Nov, p.811-66. 1999.
Kannan, G., K. Moldovan, et al. Toxoplasma gondii strain-dependent effects on mouse behaviour. Folia Parasitol (Praha), v.57, n.2, Jun, p.151-5. 2010.
Kato, T., A. Monji, et al. Risperidone significantly inhibits interferon-gamma-induced microglial activation in vitro. Schizophr Res, v.92, n.1-3, May, p.108-15. 2007.
Kean, B. H. Clinical Toxoplasmosis--50 years. Trans R Soc Trop Med Hyg, v.66, n.4, p.549-71. 1972.
Kristiansen, J. E. e S. Jepsen. The susceptibility of Plasmodium falciparum in vitro to chlorpromazine and the stereo-isomeric compounds cis(Z)- and trans(E)-clopenthixol. Acta Pathol Microbiol Immunol Scand B, v.93, n.3, Jun, p.249-51. 1985.
Kubrusly, R. C., M. C. Da Cunha, et al. Expression of functional receptors and transmitter enzymes in cultured Muller cells. Brain Res, v.1038, n.2, Mar 21, p.141-9. 2005.
Kubrusly, R. C., R. Panizzutti, et al. Expression of functional dopaminergic phenotype in purified cultured Muller cells from vertebrate retina. Neurochem Int, v.53, n.3-4, Sep, p.63-70. 2008.
Lacroix, R., W. R. Mukabana, et al. Malaria infection increases attractiveness of humans to mosquitoes. PLoS Biol, v.3, n.9, Sep, p.e298. 2005.
Layer, P. G. e E. Willbold. Histogenesis of the avian retina in reaggregation culture: from dissociated cells to laminar neuronal networks. Int Rev Cytol, v.146, p.1-47. 1993.
Lefevre, T., S. A. Adamo, et al. Invasion of the body snatchers: the diversity and evolution of manipulative strategies in host-parasite interactions. Adv Parasitol, v.68, p.45-83. 2009.
Lolley, R. N. Light-induced alterations in retinal pyruvate and high-energy phosphates, in vivo. J Neurochem, v.16, n.10, Oct, p.1469-76. 1969.
Lovett, J. L., N. Marchesini, et al. Toxoplasma gondii microneme secretion involves intracellular Ca(2+) release from inositol 1,4,5-triphosphate (IP(3))/ryanodine-sensitive stores. J Biol Chem, v.277, n.29, Jul 19, p.25870-6. 2002.
Lovett, J. L. e L. D. Sibley. Intracellular calcium stores in Toxoplasma gondii govern invasion of host cells. J Cell Sci, v.116, n.Pt 14, Jul 15, p.3009-16. 2003.
Magalhaes, C. R., R. E. Socodato, et al. Nitric oxide regulates the proliferation of chick embryo retina cells by a cyclic GMP-independent mechanism. Int J Dev Neurosci, v.24, n.1, Feb, p.53-60. 2006.
Magliaro, B. C. e C. J. Saldanha. Clozapine protects PC-12 cells from death due to oxidative stress induced by hydrogen peroxide via a cell-type specific mechanism involving inhibition of extracellular signal-regulated kinase phosphorylation. Brain Res, v.1283, Aug 4, p.14-24. 2009.
Magno, R. C., L. C. Straker, et al. Interrelations between the parasitophorous vacuole of Toxoplasma gondii and host cell organelles. Microsc Microanal, v.11, n.2, Apr, p.166-74. 2005.
Melamed, J., F. Dornelles, et al. [Cerebral CT scan alterations in children with ocular lesions caused by congenital toxoplasmosis]. J Pediatr (Rio J), v.77, n.6, Nov-Dec, p.475-80. 2001.
Melzer, T. C., H. J. Cranston, et al. Host Cell Preference of Toxoplasma gondii Cysts in Murine Brain: A Confocal Study. J Neuroparasitology, v.1. 2010.
Mercier, C., J. F. Dubremetz, et al. Biogenesis of nanotubular network in Toxoplasma parasitophorous vacuole induced by parasite proteins. Mol Biol Cell, v.13, n.7, Jul, p.2397-409. 2002.
Mordue, D. G., N. Desai, et al. Invasion by Toxoplasma gondii establishes a moving junction that selectively excludes host cell plasma membrane proteins on the basis of their membrane anchoring. J Exp Med, v.190, n.12, Dec 20, p.1783-92. 1999.
Mordue, D. G., S. Hakansson, et al. Toxoplasma gondii resides in a vacuole that avoids fusion with host cell endocytic and exocytic vesicular trafficking pathways. Exp Parasitol, v.92, n.2, Jun, p.87-99. 1999.
Moreno, S. N. e R. Docampo. Calcium regulation in protozoan parasites. Curr Opin Microbiol, v.6, n.4, Aug, p.359-64. 2003.
Mosmann, T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. J Immunol Methods, v.65, n.1-2, Dec 16, p.55-63. 1983.
Neve, K. A., J. K. Seamans, et al. Dopamine receptor signaling. J Recept Signal Transduct Res, v.24, n.3, Aug, p.165-205. 2004.
Nicholson, D. H. e E. B. Wolchok. Ocular toxoplasmosis in an adult receiving long-term corticosteroid therapy. Arch Ophthalmol, v.94, n.2, Feb, p.248-54. 1976.
Nicolle, C. e L. Manceaux. Sur un protozoaire nouveau du gondi. (Toxoplasma N. Gen.). Archives de L'Institut Pasteur de Tunis, v.1. 1908.