UNIVERSIDADE FEDERAL DE MINAS GERAIS Instituto de Ciências Biológicas
Departamento de Parasitologia
Programa de Pós-Graduação em Parasitologia
Gregório Guilherme Almeida
Complexo anfifílico de antimônio:
atividade leishmanicida
in vitro
e eficácia de uma
formulação tópica em modelo murino de leishmaniose
cutânea.
Belo Horizonte 2012
Dissertação apresentada ao Programa de Pós-Graduação em Parasitologia do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais como pré-requisito parcial para obtenção do grau de mestre em Parasitologia.
Área de concentração: Protozoologia.
Orientadora: Profª. Drª.Maria Norma Melo Universidade Federal de Minas Gerais
Almeida, Gregório Guilherme.
Complexo anfifílico de antimônio: atividade leishmanicida in vitro e eficácia de uma formulação tópica em modelo murino de leishmaniose cutânea. [manuscrito] / Gregório Guilherme Almeida. – 2012.
81 f. : il. ; 29,5 cm.
Orientadora: Maria Norma Melo. Co-orientador: Frédéric Jean Georges Frézard.
Dissertação (mestrado) – Universidade Federal de Minas Gerais, Departamento de Parasitologia.
1. Leishmaniose tegumentar - Teses. 2. Parasitologia – Teses. 3. Protozoologia - Teses. 4. Administração tópica. 5. Octanoil N-metilglucamida. I. Melo, Maria Norma. II. Frézard, Frédéric Jean Georges. III. Universidade Federal de Minas Gerais. Departamento de Parasitologia. IV. Título.
“(...)Dizia o livro: ‘As jibóias engolem, sem mastigar, a presa inteira. Em seguida, não podem mover-se e dormem os seis meses da digestão.’ Refleti muito então sobre as aventuras da selva, e fiz, com lápis de cor, o meu primeiro desenho. Meu desenho número 1 era assim:
Mostrei minha obra-prima às pessoas grandes e perguntei se o meu desenho lhes fazia medo. Responderam-me: ‘Por que é que um chapéu faria medo?’
Meu desenho não representava um chapéu. Representava uma jibóia digerindo um elefante. Desenhei então o interior da jibóia, a fim de que as pessoas grandes pudessem compreender. Elas têm sempre necessidade de explicações. Meu desenho número 2 era assim:
As pessoas grandes aconselharam-me deixar de lado os desenhos de jibóias abertas ou fechadas, e dedicar-me de preferência à geografia, à história, ao cálculo, à gramática.
Foi assim que abandonei, aos seis anos, uma esplêndida carreira de pintor. Eu fora desencorajado pelo insucesso do meu desenho número 1 e do meu desenho número 2. As pessoas grandes não compreendem nada sozinhas, e é cansativo, para as crianças, estar toda hora explicando.(...)”
Agradecimentos
Pela vida, pela paciência, pelo carinho, pelo exemplo, pelo cuidado, pela permissão e a negação, pela humilde sabedoria, por me entender nem sempre me compreendendo, por me amar. Agradeço à minha mãe antes de tudo por me permitir a vida.
Ao meu pai, irmãos e família, por serem, dentre os muitos exemplos ao que serve a família, o meu exemplo de tolerância.
À Renata Gomes, por todos os momentos que vivemos, tranquilos ou ruidosos, mas que nos fizeram chegar onde estamos. Te amo de coração.
A todos os amigos que hoje não estão presentes na minha rotina, mas que contribuíram para quem eu sou hoje. Mantenho-os no anonimato da minha memória, sempre com muito carinho. Nas palavras de Milton Nascimento, “o
que foi feito é preciso conhecer para melhor prosseguir.”. Fato.
A todos os amigos presentes, por serem sempre o que se propuseram a ser. Não exigiria de vocês mais do que isso.
Aos colegas de mestrado, especialmente aqueles que se tornaram grandes amigos. Agradeço ao Daniel Coscarelli pelos longos papos, pelas artes, pelas Fissurelisses, mas acima de tudo pela amizade honesta e profunda. Ao Antonio Mendes, por me fazer acreditar novamente em coisas que eu julgava mortas e por me fazer ter uma postura mais positiva sobre o mundo e a ciência. A ambos, sei que nossa amizade vai resistir à ação corrosiva da rotina, e teremos muitas histórias para contar no futuro, independente da distância.
Aos amigos do Laboratório de Biologia de Leishmania: à Gabriela Vogas pela amizade e pela grande ajuda nesse projeto; Ao Sidney Ferreira (Nino), pela ajuda, por ser exemplo de seriedade e competência; um agradecimento especial à Soraia, pela ajuda, pelo suporte, e pela força.
Ao professor Dr. Frédéric Frézard e a professora Dra .Cynthia Demicheli pela oportunidade de trabalhar com algo totalmente novo e interessante. Obrigado pelo aprendizado e pelo apoio.
À equipe do Laboratório de Imunologia e Genômica de parasitos, em especial à Sara e Natasha pelo suporte nos qPCRs, e especialmente ao Professor Dr. Ricardo Fujiwara pela ajuda na análise estatística e principalmente pela sua prestatividade, marca registrada da sua personalidade. Aos Amigos do Centro de Pesquisas René Rachou: Marcelle Rocha pela paciência e ajuda no projeto. À Paula Monalisa, Izabela Ibraim e Rafael Assis pela convivência excepcional e aprendizado. Especialmente ao Professor Dr. Rodrigo Soares, que além de um exemplo de pesquisador é um grande amigo.
À Bárbara Verçosa pela ajuda essencial na contagem da LDU.
Ao Leonardo Maciel, por ser para mim o grande exemplo que é. Por ser compreensivo, amigo e paciente.
À professora Dra. Maria Norma, “a chefa”. Não haveria páginas
suficientes nessa dissertação para lhe agradecer à altura do seu mérito. Pela acolhida, pela gentileza, pelos (muitos) puxões de orelha, pelo carinho excepcional, por me ensinar, por me permitir... A senhora é, não só um exemplo, mas alguém muito especial que ficará eternizada por essas páginas, que descrevem uma etapa da minha vida. À senhora meu sentimento sempre de muito carinho e respeito. Muitíssimo obrigado!
À força sem nome que sempre me manteve de pé, que sempre encaixou os momentos para que o caminho turbulento terminasse em um plano calmo. Sei da sua existência e não ouso lhe dar nomes ou lhe encaixar nos conceitos da minha limitação humana. Sei da sua essência e me basta. Continue me guiando por onde for necessário para que eu possa fazer algo de útil para o mundo. É por isso que estou aqui.
Sumário
Lista de Abreviaturas e Siglas 9
Lista de Tabelas e Figuras 10
Resumo 12
Abstract 14
1. Introdução
1.1. Leishmanioses 16
1.2. Ciclo biológico 17
1.3. Leishmaniose Tegumentar Americana 19
1.4. Formas Clínicas da LTA 20
1.5. Epidemiologia e Controle 21
1.6. Modelos experimentais utilizados em testes de novos fármacos
24
1.7. Tratamento 25
1.8. Mecanismo de Ação dos Antimoniais 28
1.9. Octanoil N-Metilglucamida 29
2. Justificativa 32
3. Objetivos
3.1. Objetivo Geral 35
3.2. Objetivos Específicos 35
4. Material e Métodos
4.1. Síntese dos complexos de alquilmetilglucamidas com antimônio
36
4.2. Manutenção do parasito 36
4.3. Animais 37
4.4. Estudo da Citotoxicidade in vitro 38
4.4.1. Isolamento de macrófagos peritoneais 38
4.4.2. Ensaio de citotoxicidade em macrófagos murinos (MTT)
38
4.4.3. Concentração citotóxica in vitro 40
4.5.1. Infecção experimental de macrófagos murinos com
Leishmania amazonensis.
40
4.5.2. Exposição dos macrófagos infectados aos compostos
41
4.5.3. Concentração inibitória in vitro 42
4.5.4. Índice de Seletividade in vitro 42
4.6. Estudo da atividade anti-Leishmaniain vivo 42
4.6.1. Isolamento das promastigotas metacíclicas 42
4.6.2. Infecção e tratamento dos camundongos 43
4.6.3. Quantificação da carga parasitária 44
4.7. Estudo da Permeação Percutânea in vitro 44
4.8. Análises Estatísticas 46
5. Resultados
5.1. Curva de Crescimento de Leishmania (Leishmania)
amazonensis
48
5.2. Citotoxicidade em macrófagos murinos 49
5.3. Atividade anti-amastigota in vitro 51
5.4. Absorção percutânea de Sb 53
5.5. Atividade anti-Leishmaniain vivo 56
6. Discussão e Conclusões 60
7. Referências Bibliográficas 67
9
Lista de Abreviaturas e Siglas
AM: Antimoniato de meglumina.
BALB/c: Linhagem isogênica de camundongos susceptíveis à leishmaniose. CC50: Concentração citotóxica em 50%.
CEBIO: Centro de Bioterismo do Instituto de Ciências Biológicas da UFMG. CETEA: Comitê de Ética em Experimentação Animal.
CI50: Concentração inibitória em 50%. DMSO: Dimetilsulfóxido.
GFAAS: Espetroscopia de absorção atômica em forno de grafite. HSR/J: Linhagem de camundongos glabros.
IS: Índice de seletividade.
LA8: Octanoil N-Metilglucamida.
LA8-Sb: Octanoil N-Metilglucamida complexado ao antimônio pentavalente. LC: Leishmaniose cutânea.
LCD: Leishmaniose cutânea anérgica difusa ou leishmaniose cutânea difusa. LCL: Leishmaniose tegumentar localizada.
LCM: Leishmaniose cutâneomucosa. LD: leishmaniose disseminada.
LDU: Unidades de Leishmania donovani (Leishmania donovani units).
LTA: Leishmaniose tegumentar americana. LVA: Leishmaniose visceral americana.
MTT: Brometo de3-(4,5-dimetiltiazol-2-il)- 2,5-difeniltetrazólio. NatAM: Antimoniato de meglumina incorporado em gel de natrosol. OMS: Organização Mundial de Saúde.
PBS: Tampão fosfato-salino.
PSG: Gel Secretório de Promastigotas. RPM: Rotações por minuto.
Sb:Stibium, Antimônio.
SbIII: Antimônio trivalente. SbV: Antimônio pentavalente. SFB: Soro fetal bovino.
10
Lista de Tabelas e Figuras
Tabela 1: Percentagem média de macrófagos peritoneais viáveis de BALB/c, com diferentes concentrações de Glucantime, após 24 horas de exposição.
49
Tabela 2: Percentagem média de macrófagos peritoneais viáveis de BALB/c, com diferentes concentrações de LA8-Sb, após 24 horas de exposição.
49
Tabela 3: Percentagem média de macrófagos peritoneais viáveis de BALB/c, em diferentes concentrações de LA8, após 24 horas de exposição.
50
Tabela 4: Avaliação do peso médio de camundongos BALB/c infectados com Leishmania (Leishmania) amazonensis tratados com Glucantime, LA8 e LA8-Sb.
57
Figura 1: Ciclo de vida de Leishmania spp. 19
Figura 2: Casos de Leishmaniose Tegumentar Americana no Brasil –
1990 a 2010.
22
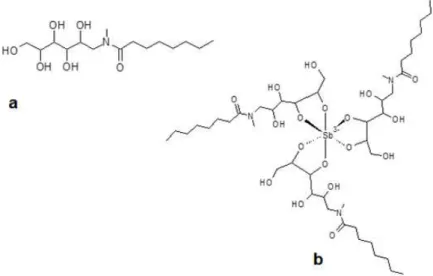
Figura 3: Fórmula estrutural proposta para o Glucantime. 27 Figura 4: Fórmulas estruturais propostas para o octanoil
N-metilglucamida e o complexo LA8-Sb.
30
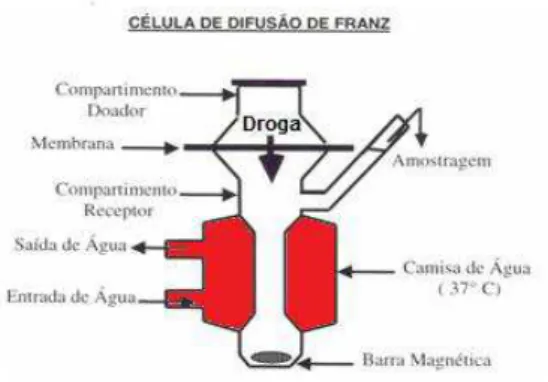
Figura 5: Representação esquemática de uma Célula de Difusão de Franz.
45
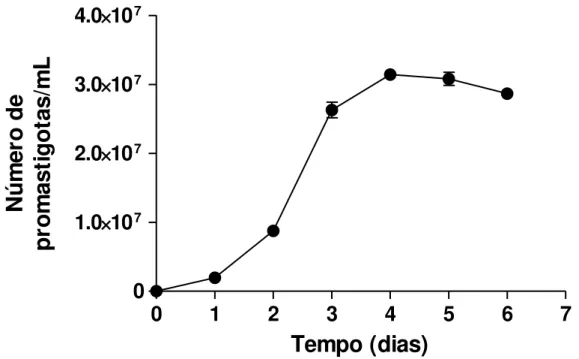
Figura 6: Curva de crescimento para Leishmania amazonensis (cepa PH8) em meio -MEM completo.
48
Figura 7: Curvas de CC50 do Glucantime, do LA8 e do LA8-Sb para
macrófagos peritoneais de camundongos BALB/c.
50
Figura 8: Atividade anti-amastigota in vitro dos compostos LA8, LA8-Sb e Glucantime em diferentes concentrações no modelo de macrófagos peritoneais de BALB/c, infectados com formas promastigotas de fase estacionária de Leishmania amazonensis.
11 Figura 9: Imagens de microscopia ótica das lâminas do teste de
atividade anti-amastigota in vitro com as maiores concentrações utilizadas no teste para cada composto.
52
Figura 10: Curva de CI50 do Glucantime para macrófagos peritoneais de
BALB/c, em diferentes concentrações.
53
Figura 11: Percentual da permeação cutânea de Sb através da pele de camundongos Hairless, após oito horas de exposição às formulações, na presença e na ausência de estrato córneo.
54
Figura 12: Permeação percutânea de antimônio através pele de camundongos Hairless, em função do tempo, na pele íntegra e na ausência do estrato córneo.
55
Figura 13: Diâmetro médio da lesão em função do tempo de tratamento de camundongos BALB/c tratados com Glucantime, LA8 e LA8-Sb.
57
Figura 14: Avaliação da eficácia da formulação tópica de LA8-Sb em camundongos infectados com L. amazonensis.
57
Figura 15: Avaliação do efeito do tratamento em camundongos BALB/c fêmeas infectadas com L. (L.) amazonensis.
12
Resumo
As leishmanioses são consideradas um grande problema de saúde pública em vários países onde incidem. A OMS as classifica como doenças negligenciadas, e incentiva a busca de novos fármacos ou formulações que sejam eficazes e que tenham baixa toxicidade ao homem. O tratamento com as drogas disponíveis demandam longo tempo de tratamento e apresentam diversos efeitos colaterais, comprometendo a adesão dos pacientes. Além do desenvolvimento de novos fármacos, há pesquisas direcionadas a potencializar a atividade leishmanicida de drogas já utilizadas e diminuindo sua toxicidade. O LA8 é uma alquilmetilglucamida capaz de se complexar ao antimônio pentavalente e, devido à sua propriedade anfifílica, o complexo resultante é potencialmente eficaz contra a leishmaniose quando administrado por vias não invasivas como a tópica e a oral. O objetivo do presente estudo foi avaliar sua eficácia in vitro e in vivo em camundongos BALB/c experimentalmente infectados com Leishmania amazonensis. Os ensaios in vitro mostraram que o complexo LA8-Sb foi cerca de 100 vezes mais tóxico (CC50 = 0,26mM de Sb)
para macrófagos peritoneais murinos que o Glucantime (CC50 = 26,31mM de
Sb) e 6 vezes mais tóxico que o seu ligante LA8 isoladamente (CC50 = 4,89mM
de LA8). Não foi possível observar atividade anti-amastigota do complexo LA8-Sb em culturas de macrófagos peritoneais murinos infectados com L. amazonensis, em concentrações abaixo da concentração citotóxica (CC50). No
14
Abstract
Leishmaniasis is considered a major public health problem in 88 countries worldwide. It is considered a neglect disease by The World Health Organization, thus reinforcing the need of new effective and less toxic compounds. The available drugs require long-term treatment and cause several side effects. In addition to the development of new drugs, another strategy is to enhance the leishmanicidal activity of available drugs and decrease its toxicity. LA8 is an amphiphilic alquilmetilglucamida that binds to pentavalent antimony and is a potentially effective molecule against leishmaniasis. The aim of this study was to evaluate its in vitro and in vivo efficacy against Leishmania amazonensis infected BALB/c mice with by a topical formulation. Also, in vitro assays using mice peritoneal macrophages showed that the complex LA8-Sb was about 100 times more toxic (CC50 = 0.26mM Sb) than Glucantime (CC50 = 26.31mM Sb)
and 6 times more toxic than LA8 and its ligand alone (CC50 = 4.89mM LA8).
There is no anti-amastigote activity after 72 hours of exposure, in concentrations below the cytotoxic concentration (CC 50), when incubated in
15
1.
Introduçã
16 1.1. Leishmanioses
As leishmanioses são doenças infecciosas causadas por várias espécies de protozoários do gênero Leishmania (Ross,1903), transmitidas pela picada de diversas espécies de flebotomíneos infectados. A doença apresenta um grande espectro de manifestações clínicas, usualmente divididas em leishmaniose cutânea (LC), leishmaniose cutaneomucosa (LCM) e leishmaniose visceral (Silveira et al., 2004; Lainson & Shaw, 2005)
Anualmente, são reportados 600.000 novos casos de leishmaniose no mundo, podendo esse valor chegar a dois milhões de novos casos por ano, sendo aproximadamente 1,5 milhões, das formas cutânea e cutaneomucosa, e 500 mil da forma visceral, com um total de 12 milhões de pessoas infectadas, e uma população de risco de 350 milhões de indivíduos. A Organização Mundial de Saúde (OMS) relata a ocorrência de leishmanioses em 88 países, com notificação compulsória em apenas 32 (WHO, 2010).
Acredita-se que leishmaniose tegumentar americana (LTA) seja autóctone do continente Americano (Altamirano-Enciso et al., 2003). Figuras humanas em objetos de cerâmica datadas de 400 a 900 a.C., conhecidas como huacos, encontradas no Peru e Equador, evidenciam mutilações em faces humanas sugestivas de LTA. Relatos de lesões faciais em ameríndios foram encontrados em diversos manuscritos da época da colonização espanhola (Lainson & Shaw, 2005).
No entanto, somente em 1909, Carini e Paranhos identificaram o que seriam posteriormente conhecidas como as formas amastigotas, em lesões tegumentares em pacientes no estado de São Paulo. Em 1911, Gaspar de Oliveira Vianna, denominou tais parasitos como Leishmania brasiliensis, sendo essa nomenclatura substituída pelo similar em inglês Leishmania braziliensis, por Matta em 1916 (Lainson & Shaw, 2005).
17 As leishmanioses são consideradas pela OMS como sendo doenças negligenciadas pelos sistemas de saúde dos países onde ocorrem. O Programa Especial para Pesquisa e Treinamento em Doenças Tropicais (TDR), que tem como foco doenças negligenciadas que afetam populações pobres e marginalizadas, coloca as leishmanioses como enfermidades prioritárias entre as endemias abordadas pelo Programa (WHO, 2010).
1.2. Ciclo Biológico
Leishmania é um protozoário pertencente à família Trypanosomatidae, parasito intracelular obrigatório das células do sistema fagocítico mononuclear, com duas formas principais: uma flagelada ou promastigota, encontrada no tubo digestório do inseto vetor, e outra aflagelada ou amastigota, observada nos tecidos dos hospedeiros mamíferos (Bates, 2007).
Há diferentes hipóteses sobre a evolução do gênero Leishmania, mas os dados atualmente disponíveis sugerem que ele evoluiu em mamíferos americanos e migraram com seus hospedeiros para o Velho Mundo, de onde se disseminaram por volta de 24 a 14 milhões de anos atrás (Shaw, 2011; Kuhls et al., 2011).
O parasito possui um ciclo de vida heteroxeno (Figura 1). São transmitidos por fêmeas adultas de flebotomíneos que se infectam ao realizar um repasto sanguíneo em um hospedeiro reservatório, ingerindo as formas amastigotas presentes na pele (Montoya-Lerma 1992). No trato digestório do hospedeiro invertebrado elas sofrem uma transformação, desenvolvendo um flagelo anterior, passando então a se chamar promastigotas, dentro da matriz peritrófica, uma membrana constituída por proteínas, glicoproteínas, e microfilamentos de quitina que encerra o sangue ingerido, formando uma barreira que protege o epitélio intestinal da abrasão por partículas de alimentos e microrganismos (Pimenta et al., 1997; Kamhawi, 2006).
18 adesão propiciada por essas moléculas impede que o parasito seja expelido com as excretas do flebotomíneo, após a digestão do sangue (Sacks & Kamhawi, 2001).
As promastigotas procíclicas passam por mudanças morfológicas e fisiológicas no tubo digestório do vetor, e parte dessa população se diferencia em formas metacíclicas, através de um processo chamado metaciclogênese, onde há uma mudança do perfil de moléculas citoplasmáticas e de membrana do parasito, o que garante sua liberação do tubo digestório do inseto vetor, tornando-as mais infectantes ao hospedeiro mamífero (Pimenta et al., 1992; Sacks & Sher, 2002; Soares et al., 2005).
Esse processo ocorre durante o tempo em que o último repasto sanguíneo-tissular é digerido. Após a metaciclogênese, as promastigotas metacíclicas migram para a parte anterior do tubo digestório do inseto, onde produzem uma glicoproteína de consistência gelatinosa chamada PSG (promastigote secretory gel). Acredita-se que esse gel obstrua a passagem de alimento, quando do repasto sanguíneo-tissular, obrigando o flebotomíneo a regurgitar saliva juntamente com as formas promastigotas metacíclicas, no local da picada (Bates, 2007).
19 Figura 1: Ciclo de vida da Leishmania spp. – adaptado de Harhay et al., 2012.
1.3. Leishmaniose Tegumentar Americana
A leishmaniose tegumentar americana (LTA) é causada por diversas espécies de Leishmania e está amplamente distribuída na América Latina.
A doença tem caráter zoonótico, ocorrendo naturalmente em animais silvestres podendo acometer o homem (Lainson, 1983).
Nas Américas, são atualmente reconhecidas pelo menos 11 espécies dermotrópicas de Leishmania causadoras de doença humana e oito somente em animais. No entanto, no Brasil já foram identificadas oito espécies, sendo seis do subgênero Viannia e duas do subgênero Leishmania. As três principais espécies são: L. (V.) braziliensis, L.(V.) guyanensis e L.(L.) amazonensis, e, mais recentemente, as espécies L. (V.) lainsoni, L. (V.) naiffi, L. (V.) shawi, L. (V.) lindenbergi foram identificadas em estados das regiões Norte e Nordeste (Lainson & Shaw, 2005).
20 Dependendo da espécie de Leishmania envolvida na infecção e da resposta imune mediada por células do individuo infectado, se desenvolve um amplo espectro de formas clínicas da doença, convencionalmente conhecido como leishmaniose cutânea localizada (LCL), leishmaniose cutâneomucosa-(LCM), leishmaniose cutânea anérgica difusa ou simplesmente leishmaniose cutânea difusa (LCD) e leishmaniose disseminada (LD) (Cástes et al., 1983; Carvalho et al., 1985; Lainson & Shaw, 2005).
1.3.1. Formas clínicas da LTA
Dentre os aspectos clínicos da LTA, destacam-se lesões de pele com úlceras localizadas (LCL) ou múltiplas, o que representa a forma mais frequente da doença, tendo como agente etiológico qualquer uma das espécies dos subgêneros neotropicais. A L.(V.) braziliensis é considerada o mais prevalente parasito associado a esta forma de doença. Representa o acometimento primário da pele, sendo a lesão única ou múltipla, geralmente do tipo ulcerado, com tendência à cura espontânea ou apresentando boa resposta ao tratamento (Silveira et al., 2004).
Inicialmente a lesão tem aspecto papular e indolor, podendo ou não ser pruriginosa. Posteriormente a pápula evolui, produzindo uma lesão inflamada, ulcerada, circular e de bordas elevadas (Gontijo & De Carvalho, 2003). A lesão pode permanecer única, mas em muitos casos macrófagos infectados podem transportar amastigotas para outras regiões do organismo, produzindo lesões secundárias (Lainson & Shaw, 2005).
Um parasito em especial, Leishmania (V.) braziliensis, tende a
produzir lesões metastáticas nas mucosas oral, nasal e laringo-faringiana. A leishmaniose cutaneomucosa manifesta-se por lesões destrutivas localizadas nas mucosas das vias aéreas superiores (Berman, 1997; Bittencourt & Barral-Neto, 1995).
Embora muitos pacientes possam apresentar as lesões na pele e nas mucosas, é observado que a maioria dos casos de LCM registrados na Amazônia, ocorre em pacientes infectados com L. (L.) braziliensis que
21
(Silveira et al., 1999). É caracterizada por apresentar metástases nas mucosas que conduzem a quadros clínicos desfigurantes (Marsden, 1986).
A LCD é uma manifestação relativamente rara caracterizada por lesões nodulares disseminadas por todo o corpo, ricas em amastigotas. Em alguns casos ocorrem múltiplas e até centenas de lesões papulares e de aparência acneiforme, que acometem vários segmentos corporais, envolvendo com frequência a face e o tronco. É uma forma clínica grave que ocorre em pacientes com anergia e deficiência específica na resposta imune celular a antígenos de Leishmania, sendo esses pacientes negativos
no teste de Montenegro (Silveira et al., 2004; Lainson & Shaw, 2005; ).
A forma cutânea difusa é causada por algumas espécies do subgênero Leishmania, sendo Leishmania (Leishmania) amazonensis a
única espécie considerada responsável pela forma clínica no Brasil (Lainson, 1983; Lainson & Shaw, 2005). Demonstrou-se que pacientes acometidos com a LCD, apresentam uma resposta do tipo Th2 exuberante
(Moraes et al., 1999). A gravidade desse quadro se complica quando observado que os pacientes não apresentam uma resposta satisfatória ao tratamento com antimoniais (Silveira & Lainson et al., 2004).
1.3.2. Epidemiologia e Controle
Até a década de 1950 a LTA disseminou-se praticamente por todo o território nacional, coincidindo com o desflorestamento provocado pela construção de estradas e instalação de aglomerados populacionais, com maior incidência nos estados de São Paulo, Paraná, Minas Gerais, Ceará e Pernambuco. A partir daí até a década de 1960, a doença parece ter entrado em declínio, com o desmatamento já completado nas regiões mais urbanizadas do país, além da relativa estabilidade das populações rurais (Furtado, 1994). Desde então, a transmissão da doença vem sendo descrita em vários municípios de todas as unidades federadas (UF) (Ministério da Saúde, 2007).
22 acometia ocasionalmente pessoas em contato com as florestas. Posteriormente, a doença começou a ocorrer em zonas rurais, já praticamente desmatadas, e em regiões periurbanas (Passos et al., 1993).
Acredita-se que essa mudança no perfil de transmissão possa estar relacionada a uma adaptação de algumas espécies de flebotomíneos aos ambientes modificados pelo homem e os animais domésticos envolvidos no ciclo de transmissão (Tolezano et al., 1980; Lainson, 1989; Marzochi, 1992). Em 2010 foram registrados 21981 casos no Brasil, sendo 72,8% dos casos registrados nas regiões Norte e Nordeste, 14,4% na região Centro-oeste, 11% na região Sudeste e 1,1% na região Sul do país (Figura 2) (Sinan/SVS/MS, 2012).
Observa-se a existência de três perfis epidemiológicos:
Segundo o Manual de Vigilância Epidemiológica da LTA, produzido pelo Ministério da Saúde (MS), podem ser observados três padrões epidemiológicos da doença no Brasil:
a) Silvestre – em que ocorre a transmissão em áreas de vegetação primária (zoonose de animais silvestres);
b) Ocupacional ou Lazer – em que a transmissão esta associada à exploração desordenada da floresta e derrubada de matas para construção de estradas e usinas hidroelétricas, extrativismo vegetal, desenvolvimento de atividades agropecuárias e ecoturismo; (antropozoonose);
10000 15000 20000 25000 30000 35000 40000 19 90 19 91 19 92 19 93 19 94 19 95 19 96 19 97 19 98 19 99 20 00 20 01 20 02 20 03 20 04 20 05 20 06 20 07 20 08 20 09 20 10
Casos de LTA no Brasil de 1990 a 2010
Casos de LTA
23 c) Rural ou periurbana – em áreas de colonização (zoonose de matas residuais) ou periurbana, em que houve adaptação do vetor ao peridomicílio (zoonose de matas residuais e/ou antropozoonose).
Em virtude das características epidemiológicas da LTA, as estratégias de controle devem ser flexíveis, distintas e adequadas a cada região ou foco em particular. A diversidade de agentes etiológicos, de reservatórios, de vetores e a situação epidemiológica da LTA, aliada ao conhecimento ainda insuficiente sobre vários aspectos da sua epidemiologia, evidenciam a complexidade do controle desta endemia. Para definir as estratégias e a necessidade das ações de controle para cada área de LTA a ser trabalhada, deverão ser considerados os aspectos epidemiológicos, bem como seus determinantes (Ministério da Saúde, 2007).
No Brasil, a vigilância epidemiológica e a metodologia para controle da LTA é determinada pelo Ministério da Saúde. Todo caso suspeito de LTA deve ser submetido à investigação clínica e epidemiológica, e a método auxiliar de diagnóstico. Caso seja confirmado, inicia-se o tratamento segundo as normas técnicas preconizadas pelo Ministério da Saúde e acompanha-se mensalmente o paciente, pelos três primeiros meses e, uma vez curado, bimensalmente, até completar doze meses após o término do tratamento (Ministério da Saúde, 2007).
Os casos de LTA devem ser obrigatoriamente notificados ao MS em uma ficha de notificação padronizada pelo Sistema de Informação de Agravos de Notificação (SINAN). As informações contidas nesses formulários são essenciais para caracterização da doença em uma região e apartir deles, serão observadas a necessidade de adoção de medidas de controle, destacando que o diagnóstico precoce, e o tratamento adequado dos pacientes, bem como as atividades educativas, devem ser prioridades em todas as situações (Ministério da Saúde, 2007).
24 mucoso é frequente, sendo de 2% nos casos tratados e em torno de 10% nos casos não tratados (Marsden, 1986).
1.4. Modelos experimentais utilizados em testes de novos fármacos
O estudo da LTA recorre aos modelos experimentais para induzir infecções experimentais utilizadas na análise de diversos aspectos do parasitismo por Leishmania e mesmo na avaliação da eficácia de novos candidatos a vacinas e fármacos (Passero, 2011).
Existem diversos sistemas de teste in vitro e in vivo, com características específicas para conduzir à uma otimização do teste. Os ensaios in vitro constituem uma primeira etapa para avaliação da eficácia de novas drogas e são utilizadas tanto as formas promastigotas quanto as amastigotas (Gupta & Nishi, 2011).
Dentre os requisitos para esses ensaios podemos citar a utilização do parasito na sua forma encontrada no hospedeiro mamífero, uma população de células em divisão, medidas reprodutíveis e quantificáveis da atividade da nova droga, e a mensuração da atividade de drogas padrão, como o glucantime, em concentrações compatíveis com o modelo in vivo (Croft, 1986). Além desses requisitos, é interessante que o sistema utilize pequenas quantidades do composto, rápida execução e baixo custo (Croft et al., 2006).
Os modelos in vitro que simulam o ambiente da fase amastigota intracelular tem sido descritos como mais confiáveis para avaliação das novas drogas (Croft, 1986). Esses têm utilizados macrófagos primários e linhagens de células imortalizadas como hospedeiras, incluindo macrófagos peritoneais de camundongos e sangue humano derivados de monócitos, macrófagos humanos, células THP-1, promonócitos humanos U937 e células J774.1(Seifert et al., 2010). Nesses modelos, a atividade da droga é mensurada através da contagem em microscopia ótica do percentual de macrófagos infectados e/ou o número de amastigotas por macrófago (Neal & Croft, 1984).
25 susceptibilidade a drogas padrão em comparação com as formas amastigotas, e as diferenças bioquímicas que existem entre as duas formas, tornam esse modelo mais útil para determinação da toxicidade de novas moléculas (Croft et al., 2006). Outros modelos foram descritos utilizando amastigotas axênicas (Callahan et al., 1997). No entanto, foram observadas diferenças na sensibilidade a drogas dessas formas em comparação com as amastigotas intracelulares (Ephros et al., 1999).
Os ensaios in vivo são essenciais para determinar os parâmetros de absorção, distribuição, metabolismo, excreção e toxicidade de uma nova droga. O modelo murino é o mais utilizado, pois requer um pequeno volume do composto e reproduz bem os resultados utilizando apenas 5 animais por grupo (Gupta & Nishi, 2011). Os modelos utilizando camundongos BALB/c são extensivamente utilizados devido à susceptibilidade desse camundongo a diversas espécies de Leishmania causadora de LT, e por ser uma linhagem cuja cura é excepcionalmente difícil, mesmo utilizando as drogas padrão (Croft et al., 2006).
Nesses modelos a determinação da atividade da formulação é feita através da mensuração do tamanho da lesão pela quantificação da carga parasitária in situ. São descritos diversos métodos de quantificação da carga parasitária da lesão, utilizando o cultivo dos parasitos através de biópsias das lesões em diluição limitante (Titus et al., 1985), a LDU (Leishmania donovani Units) que consiste na relação entre número de amastigotas por células nucleadas do hospedeiro e o peso do órgão parasitado (Stauber, 1956) e pelo método de PCR em tempo real (Bretagne et al., 2001).
1.5. Tratamento
26 pentavalente (SbV), menos tóxicos, foram introduzidos na quimioterapia das
leishmanioses (Berman, 1997; WHO, 2010).
Devido à sua comprovada eficácia terapêutica, os antimoniais pentavalentes ainda são os fármacos de primeira escolha, utilizados no tratamento convencional de ambas as formas de leishmaniose, em muitos países da América do sul e norte da África, além da Turquia, Bangladesh Nepal e Índia, excetuando-se o caso especial de Bíhar, norte da Índia (Marsden et al., 1985; Murray et al., 2005).
Os antimoniais pentavalentes atualmente em uso são o Antimoniato de N-metil glucamina (Glucantime®, Aventis) e Estibogluconato de sódio (Pentostan®), administrados por via endovenosa ou intramuscular (Rath et al., 2003; Herwaldt, 1999). Esses compostos são aplicados em injeções intramusculares ou intralesionais e frequentemente causam dor no local da aplicação e às vezes efeitos colaterais sistêmicos, sendo requerida supervisão médica (Al khawajah et al., 1997). Outra modalidade de tratamento inclui o uso de vacinas associadas ao tratamento com antimonias, obtendo resultados promissores no que diz respeito ao volume de droga administrada e tempo de tratamento, reduzindo, portanto, sua toxicidade (Mayrink et al., 2006).
Dentre os efeitos colaterais podemos citar náusea, fraqueza, vômito, mialgia, dor abdominal, nefrotoxicidade, alterações hepáticas e distúrbios cardiológicos, o que representa um problema na utilização destes medicamentos (Balaña-Fouce et al., 1998; Marsden, 1985; Masmoudi et al., 2005; Rodrigues et al., 1999). Ao lado disso, foi relatada resposta terapêutica variável e falhas no tratamento com antimoniais (Lawn et al., 2003; Sundar, 2001; Marsden et al.,1985).
27 Figura 3: Fórmula estrutural proposta para o Glucantime, adaptadas de Frézard et al., 2008.
Como medicamento de segunda escolha é usado o Desoxicolato sódico de anfotericina B e suas formulações lipossomais. Esse é um antibiótico antifúngico, usado para o tratamento de pacientes em estado grave, gestantes, recidivantes e nos casos de falha terapêutica (Ministério da saúde, 2007).
Apesar das altas taxas de cura na quimioterapia antimonial, sua utilização é limitada devido a vários fatores. O tratamento com os antimoniais é longo, requerendo doses repetidas. O aparecimento de reações adversas é frequente, sendo a mais grave a cardiotoxicidade. Este efeito é diretamente relacionado com a dose e com o tempo de utilização do fármaco. Outras reações adversas frequentes são artralgias, mialgias, inapetência, náuseas, vômitos, dor abdominal, plenitude gástrica, epigastralgia, pirose, dor no local da aplicação, febre e elevação de enzimas hepáticas e pancreáticas. Ocasionalmente observam-se anemia, leucopenia ou trombocitopenia (Ganier & Croft, 2002; Berman, 2005).
28
Na América do Sul, a ocorrência de resistência ao Sb é desconhecida (Lima et al., 2007).
Tendo em foco essas limitações, a organização mundial de saúde recomenda e apoia pesquisas no desenvolvimento de novas drogas. No entanto, a falta de apelo comercial para a indústria farmacêutica e a política pública de muitos países, em se tratando de doenças negligenciadas, resultam em um suporte insuficiente a tal desenvolvimento. Portanto, estratégias baseadas na melhoria dos fármacos existentes são mais bem sucedidas do que o desenvolvimento de novas moléculas, com o objetivo de reduzir sua toxicidade, melhorando sua eficácia além, de utilizar vias de administração menos invasivas, como a via oral e a tópica (Frézard & Demicheli, 2010).
Somente o miltefosine (1-0-hexadecilfosfocolina), originalmente desenvolvido para o tratamento de metástases cutâneas em carcinomas mamários, foi lançado no mercado como uma opção racional de fármaco a ser usado contra as leishmanioses (Hilgard et al., 1993).
Diversos outros fármacos encontram-se em fase clínica de teste, como as formulações lipossomais de anfotericina B, a sitamaquina, a buparvaquona e o imiquimod, que apresentaram bons resultados nas fases pré-clínicas (Croft et al, 2006).
Apenas a paromomicina, um antibiótico aminoglicosídeo identificado como tendo ação leishmanicida na década de 60, obteve bons resultados quando administrada por via tópica (El-On et al., 1992). Outras formulações de paromomicina envolvendo outros veículos foram testadas obtendo resultados variáveis (Soto et al., 2002; Iraji & Sadeghinia, 2005; Aguiar et al., 2009).
1.6. Mecanismos de ação dos antimoniais
29 organismo a antimônio trivalente (Shaked-Mishan et al., 2001, Goodwin & Page, 1943)
Estudos recentes indicam que pelo menos quatro diferentes tióis podem agir como agentes redutores nessa conversão: Glutationa, o tiol predominante no citosol de células de mamíferos; cisteína e cisteinil-glicina, os principais tióis presentes em lisossomos, e a tripanotiona, predominante no citosol de Leishmania (Ferreira et al., 2003). Aparentemente a redução do antimônio ocorre preferencialmente em amastigotas devido ao pH e temperatura do ambiente intracelular (Shaked-Mishan et al., 2001). Estudos recentes sugerem ainda a participação de enzimas específicas do parasito na redução do antimônio pentavalente para trivalente (Denton et al., 2004; Zhou et al., 2004).
Um segundo modelo propõe uma atividade intrínseca do antimônio contra a Leishmania. Foi demonstrado que o antimônio pentavalente pode formar complexos estáveis com ribonucleosídeos, interferindo no processo
de -oxidação de ácidos graxos e glicólise do parasito e na depleção dos níveis de ATP intracelular (Demicheli et al., 2002; Rath et al., 2003).
Recentemente, Ferreira (2010) propôs um grupo de moléculas anfifílicas complexadas ao antimônio para o tratamento das leishmanioses. São elas o Octanoil N-metilglucamida (LA8), o Decanoil N-metilglucamida (LA10) e o Dodecanoil N-metilglucamida (LA12), respectivamente contendo 8, 10 e 12 carbonos na porção apolar da molécula.
Dado que a localização intracelular de Leishmania dificulta a ação dos fármacos, pela barreira natural representada pela membrana das células, o uso de compostos anfifílicos apresentaria uma vantagem ao facilitar a passagem através dessa barreira.
1.7. Octanoil N-metilglucamida
30 possa atravessar barreiras biológicas específicas como a membrana plasmática, o epitélio do trato gastrintestinal e a pele (Ferreira, 2010).
Dados obtidos por microscopia eletrônica de transmissão indicam que as alquilmetilglucamidas formam nano agregados de diâmetro médio entre 20 e 200nm. Suas propriedades anfifílicas sugerem que sua formulação tópica possa ser uma proposta relevante para o tratamento da LTA (Ferreira, 2010).
31
2.
32 Nos últimos anos houve um significativo aumento do número de casos de leishmaniose, além da expansão geográfica da doença em todo o mundo, sendo, portanto considerada um grande problema de saúde pública em vários países onde incide. A OMS classifica a doença como negligenciada, ocupando lugar de destaque dentre as doenças tropicais e parasitárias. Isso torna importante o desenvolvimento de pesquisas e de novas estratégias que possam contribuir com o controle da doença.
O tratamento, sobretudo nas formas tegumentares da doença, cuja epidemiologia é bastante complexa, é essencial para o controle. Inúmeros novos compostos têm sido estudados para o tratamento das leishmanioses. No entanto, existe hoje uma carência de opções terapêuticas ou tratamentos mais adequados para esta doença. Tal carência é o reflexo de políticas públicas ineficientes, do escasso investimento da indústria farmacêutica no desenvolvimento de novas drogas. Além disso, há um desinteresse do mercado internacional no investimento para o desenvolvimento de novas drogas eficazes contra doenças negligenciadas de países em desenvolvimento e subdesenvolvidos.
A OMS sugere a busca de novos compostos que sejam eficazes e que tenham baixa toxicidade para o homem. É necessário buscar estratégias para solucionar esta questão, pois apesar dos avanços no conhecimento das bases moleculares e celulares das patologias, o desenvolvimento de novas drogas para o tratamento destas doenças avança a passos lentos (Nwaka, 2003).
Desde o ano 2000, existe uma interação entre grupos de pesquisa do Instituto de Ciências Exatas / ICEX (Departamento de Química) e do Instituto de Ciências Biológicas / ICB (Departamentos de Parasitologia e Fisiologia e Biofísica), no estudo, desenvolvimento e testes pré-clínicos de drogas leishmanicidas. Além do desenvolvimento racional de novas moléculas, o grupo desenvolve pesquisas com os fármacos já existentes, no sentido de potencializar seu efeito leishmanicida e diminuir sua toxicidade.
34
2. D 3. d
3.
35 3.1. Objetivo Geral
Avaliar a eficácia do composto LA8-SbV in vitro e in vivo por via tópica em camundongos BALB/c experimentalmente infectados com
Leishmania (Leishmania) amazonensis.
3.2. Objetivos Específicos
Avaliar a citotoxicidade in vitro dos compostos LA8 e LA8-SbV em macrófagos peritoneais murinos.
Avaliar a atividade anti-amastigota in vitro dos compostos LA8 e LA8-SbV em macrófagos peritoneais murinos experimentalmente infectados com
Leishmania amazonensis.
Avaliar a permeação percutânea de antimônio in vitro a partir do complexo LA8-SbV, utilizando pele de camundongos Hairless, com e sem o estrato
córneo.
36 4. d
4.
Material e
37 4.1. Síntese dos complexos de alquilmetilglucamidas com antimônio
(Ferreira, 2010)
A síntese do complexo foi realizada no Departamento de Química da UFMG e no Laboratório de biofísica de sistemas Nanoestruturados do ICB, segundo protocolo descrito por Ferreira (2010).
4.2. Manutenção do parasito
Para a realização dos experimentos foi utilizada a cepa de referência da Organização Mundial de Saúde: Leishmania (L.) amazonensis (IFLA/BR/1967/PH8). Os parasitos foram isolados em meio de cultura a partir de lesão de hamsters (Mesocricetus auratus), nos quais são mantidas as cepas para uso do Laboratório de Biologia de Leishmania. As promastigotas foram cultivadas em meio MEM suplementado com 10%
de soro fetal bovino, 50μg/mL de estreptomicina e 1000U/mL de penicilina
(MEM completo) e incubadas em estufa a 24±1°C em garrafas plásticas de cultura celular de 50mL (Sarsted, USA).
4.3. Animais
Foram utilizados camundongos BALB/c fêmeas de 6 a 8 semanas de idade, provenientes do Centro de Bioterismo do Instituto de Ciências Biológicas da Universidade Federal de Minas Gerais (CEBIO-ICB/UFMG) e do Biotério do Centro de Pesquisas René Rachou da Fiocruz (CPqRR).
Os animais foram mantidos no Biotério do Departamento de Parasitologia do ICB-UFMG, sobre condições adequadas de manejo técnico, de acordo com o Colégio Brasileiro de Medicina Veterinária.
Este projeto foi aprovado pelo Comitê de Ética em Experimentação Animal (CETEA) – protocolo 206/2010 (Anexo 1).
38 4.4. Estudo da citotoxicidade in vitro.
4.4.1. Isolamento de macrófagos peritoneais
O ensaio de citotoxicidade foi realizado com macrófagos peritoneais de camundongos BALB/c. Os macrófagos foram elicitados com injeção intraperitoneal de 2mL de tioglicolato 3% (Gibco®- Grand Island, NY,USA) para indução de uma resposta inflamatória. Após três dias, os camundongos foram eutanasiados por deslocamento cervical e foi obtido o lavado da cavidade peritoneal com injeção de 10mL de meio RPMI 1640 (Cultilab, Brasil) e posterior recuperação do fluido (Zhang et al., 2008).
O lavado foi centrifugado a 2000g por 10 minutos (Centrifuga
HERMLE, modelo 2323 K), o sobrenadante descartado e o “pellet” ressuspendido em meio RPMI 1640 suplementado 10% SFB, 50μg/mL de
estreptomicina e 1000U/mL de penicilina (RPMI 1640 completo). As células foram quantificadas em câmara hemocitométrica de Neubauer com o auxílio do corante vital azul de Trypan (Cascade BiologicalTM-USA) a 0,4%.
Apenas as células viáveis foram consideradas para cálculo do inóculo. O número de células/mL da amostra foi estimado como a média aritmética de duas contagens dos quatro quadrantes da câmara, multiplicado pelo inverso da diluição da amostra e por 104 (fator de correção
da câmara).
4.4.2. Ensaio de citotoxicidade em macrófagos murinos (MTT assay)
Para o ensaio de citotoxicidade foi utilizado o protocolo descrito por Denizot & Lang, (1986), com modificações. Os macrófagos isolados segundo descrito no ítem 3.4.1., foram então, incubados em placa de 96 poços (TPP®, Switzerland), com o volume de células ajustado para 3x105
macrófagos por poço em um volume final de 100μL de meio RPMI 1640
39 Inc. modelo 3154 S/N 31433) com atmosfera de 5% de CO
2 por 1 hora, para
aderência dos macrófagos aos poços.
Após o período de incubação, as culturas foram visualizadas em microscópio invertido (Olympus Optical CO – contraste de fase) para observação dos macrófagos aderidos e, os poços foram então lavados com meio RPMI 1640 previamente aquecido a 37ºC, para remover possíveis células não aderentes.
Após as lavagens para retirada das células não aderidas e o esgotamento dos poços, os macrófagos aderidos à placa foram incubados na presença dos compostos LA8 (nas concentrações de 10.0, 7.5, 5.0, 2.5 e 1.0mM), LA8-Sb (nas concentrações de 1.0, 0.5, 0.25, 0.1 e 0.05mM de Sb) e Glucantime® (nas concentrações de 332.6, 110.8, 22.1, 11.0, e 2.2mM de
Sb) diluídos em um volume final de 100μL de meio RPMI 1640 completo.
Como controle positivo do experimento, macrófagos aderidos foram incubados apenas com RPMI 1640 completo, e como controle negativo, macrófagos foram expostos à solução fixadora ISOTON (ácido cítrico 0,05 M, NaCl 0,12 M, formaldeído 0,5%, pH 7,2).
As culturas permaneceram expostas aos compostos durante 20 horas, incubadas a 37ºC com atmosfera de 5% de CO2. Após os períodos
de incubação, foram adicionados aos poços 10μL da solução MTT (brometo de [3-(4,5-dimetiltiazol-2-il)]- 2,5-difeniltetrazólio) (Sigma®Co-USA) a 5mg/mL (50μg/poço). As placas foram novamente incubadas por 4 horas a
37ºC com atmosfera de 5% de CO2. Após incubação, o sobrenadante foi
removido e adicionou-se 100μL de dimetilsulfóxido (DMSO – Sigma® Co - USA.), para solubilizar os cristais de formazan formados. Posteriormente, as placas foram submetidas à leitura em espectrofotômetro, onde a densidade ótica foi lida em comprimento de onda de 570nm.
40 4.4.3. Concentração citotóxica in vitro
A concentração citotóxica (CC50) foi definida como àquela que gerou
redução de 50% na absorbância, nos ensaios de MTT. Foi calculada por
análise de regressão “Sigmoidal fit”, utilizando o programa Origin® 6.0, a partir dos dados obtidos em cada experimento.
4.5. Estudo da atividade leishmanicida in vitro.
4.5.1. Infecção experimental de macrófagos murinos com
Leishmania amazonensis.
Foram realizados ensaios da toxicidade in vitro dos compostos anfifílicos LA8 e LA8-Sb sobre as formas amastigotas de L. amazonensis, internalizadas em macrófagos peritoneais de camundongos.
Para a realização deste ensaio, os macrófagos murinos obtidos conforme descrito no item 4.4.1., foram incubados em placas de 24 poços (TPP®, Switzerland), contendo previamente em cada poço, uma lamínula estéril, em formato circular, com 13 mm de diâmetro. A população de células foi ajustada para 2x105macrófagos por poço, em um volume final de 0,5mL.
As células foram incubadas em estufa a 37ºC, com atmosfera de 5% de CO2durante 1 hora, para que ocorresse a aderência dos macrófagos às
lamínulas. Após o período de incubação, com os macrófagos já aderidos, foi feita a infecção destes com L. amazonensis.
41 incubação dos macrófagos foi então substituído pelo meio de cultura contendo as formas promastigotas.
A placa foi incubada durante 5 horas, em estufa a 34ºC e atmosfera de 5% de CO2, para que houvesse a infecção dos macrófagos. Após este
período foram feitas três lavagens dos poços com meio RPMI 1640 completo, aquecido a 34ºC, para remover promastigotas não fagocitadas e células não aderidas (Berman & Lee, 1984; Neal & Croft, 1984).
4.5.2. Exposição dos macrófagos infectados aos compostos
Os compostos foram previamente diluídos em meio de cultura RPMI 1640 completo, nas concentrações 1.0, 0.5 e 0.1mM para o LA8; 0.2, 0.1 e 0.05mM de Sb, para o LA8-Sb e nas concentrações de 10.0, 5.0, e 1.0mM de Sb para o Glucantime®,respeitando os valores de citotoxicidade de cada droga, obtidos no ensaio de MTT em macrófagos. Cada concentração dos compostos foi testada em triplicata em pelo menos três experimentos independentes.
Após a terceira lavagem e o esgotamento completo dos poços que continham as lamínulas, os compostos nas diferentes concentrações, foram adicionados sobre as lamínulas com macrófagos infectados, em um volume final de 500L por poço. Macrófagos não infectados também foram expostos às mesmas concentrações das drogas.
As placas foram incubadas em estufa a 34ºC com atmosfera de 5% de CO2por 24 horas na presença dos compostos e na presença apenas de
RPMI 1640 completo como parâmetro de controle. Após o período de incubação, as lamínulas foram retiradas dos poços, coradas por Panótico rápido (Laborclin®) e montadas em lâminas permanentes com Bálsamo do Canadá (Vetec®- USA). As lâminas foram analisadas em microscópio ótico com objetiva de imersão (1000X).
42 As médias dos percentuais de infecção de macrófagos, estabelecidas na presença de cada um dos compostos, foram comparadas com a taxa de infecção média dos controles sem droga.
4.5.3. Concentração inibitória in vitro
A concentração inibitória (CI50) foi definida como aquela que gerou
redução de 50% na taxa de infecção dos macrófagos in vitro. Foi calculado
por análise de regressão “Sigmoidal fit” utilizando o programa Origin 6.0®, a partir dos dados obtidos em cada experimento.
4.5.4. Índice de Seletividade in vitro
O índice de seletividade (IS) foi calculado pela razão CC50/ CI50.
4.6. Estudo da atividade leishmanicida in vivo
4.6.1. Isolamento das promastigotas metacíclicas
O protocolo descrito a seguir foi adaptado a partir daquele descrito por Späth & Beverley (2001).
As promastigotas foram cultivadas como descrito anteriormente. No sexto dia de incubação, a cultura foi transferida da garrafa para um tubo cônico de 50mL, lavando a garrafa duas vezes com PBS estéril para remover os parasitos aderidos. O material transferido foi centrifugado a 2000g por 15 minutos a 4ºC.
Durante a centrifugação foi preparada uma solução de Ficoll 400 (Sigma Aldrich) a 10% (2mL de Ficoll 20% estéril, 1,6mL de água Milli-Q estéril e 400L de PBS 10X estéril.).
43 Após a centrifugação da cultura, o sobrenadante foi descartado e o
pellet ressuspendido e homogeneizado em 2mL de PBS estéril. Esta solução foi então cuidadosamente aplicada sobre o gradiente de Ficoll e centrifugada a 1150g por 10 minutos a 4ºC.
Após a centrifugação foi observada a formação de um anel branco sobre a solução de Ficoll a 10%. Foi coletado o sobrenadante sobre o anel, rico em promastigotas metacíclicas e ressuspenso para 10mL de PBS. Após essa etapa o isolado foi lavado três vezes, centrifugando a 2000 g por 15 minutos a 4ºC, descartando o sobrenadante e adicionando-se 10mL de PBS estéril.
Após a última lavagem, o sobrenadante foi descartado e o pellet ressuspendido em 1mL de PBS. As formas metacíclicas foram contadas em câmara de Neubauer e o volume do inóculo ajustado para 108 parasitos por mL, equivalente a 106 parasitos em 10L, sendo esse o volume final do inóculo por camundongo.
4.6.2. Infecção e tratamento dos camundongos
Foram inoculadas 1x106 promastigotas metacíclicas de L. (L.) amazonensis (cepa IFLA/BR/1967/PH8) cultivadas como descrito no item 4.2 em 20 camundongos BALB/c (fêmeas, 6 a 8 semanas de vida). A inoculação foi realizada por injeção subcutânea, ajustada a um volume final de 10L de inócuo em PBS, na base da cauda, previamente tricotomizada.
44 O tratamento se iniciou aproximadamente no 45º dia após infecção, quando as úlceras mediam em média 3mm de diâmetro, sendo esse valor estimado pela média das maiores medidas da lesão, respectivamente perpendicular e paralela à coluna vertebral do camundongo.
Os camundongos foram marcados e pesados individualmente semanalmente, durante a execução do protocolo de tratamento, para avaliar indícios de toxicidade sistêmica, causada pelas formulações. As lesões foram medidas semanalmente a partir de uma semana antes do tratamento. Foi considerado como diâmetro médio da lesão a média das medidas da maior distância entre as bordas crânio-caudal e a maior medida do seu eixo perpendicular. Os animais foram eutanasiados 24 horas após o término do tratamento para quantificação da carga parasitária da lesão.
4.6.3. Quantificação da carga parasitária
A carga parasitária da lesão foi estimada utilizando-se o método descrito por Stauber (1956).
Após eutanásia dos camundongos, as lesões foram removidas e foram confeccionadas imprints da lesão. As lâminas foram coradas com corante Panótico rápido (Laborclin®) e fotografadas em aumento de 40X em um microscópio ótico. As imagens obtidas foram analisadas por um software de análises de imagens assistido (Media Cybernetics Image Proplan 4.5).
Foi contado o número de amastigotas em relação a 1000 células do hospedeiro e o resultado foi multiplicado por um fator de correção (2x104) e
pelo peso da lesão. Os resultados foram expressos como número de amastigotas na lesão.
4.7. Estudo da permeação percutânea in vitro
45 pele íntegra e na ausência do estrato córneo, representando uma lesão ulcerada.
Para obtenção das peles, os camundongos sem pêlo (machos de 8 semanas, pesando de 25 a 30g), foram eutanasiados por deslocamento cervical. O dorso foi limpo com água destilada e a pele retirada. Após remoção do tecido adiposo subcutâneo com o auxílio de bisturi e inspeção visual, a pele foi colocada nas células de Franz.
O compartimento receptor foi preenchido com o tampão HEPES 5mM /NaCl 0,15M pH 7,4, ficando em contato com a pele pelo período de 1 hora para promover equilíbrio do sistema. Após este período, o tampão foi retirado e o compartimento receptor novamente preenchido com tampão. Foram aplicados 100L sobre a superfície da pele de camundongo hairless os compostos LA8-Sb 0,2M diluído em água destilada estéril e uma formulação de antimoniato de meglumina (AM) na concentração de 0,35M previamente incorporado em gel natrosol a 2% (adicionou-se um volume de gel de natrosol a 4% a um volume igual de AM a 0,7M, à temperatura ambiente e homogeneizou-se em vórtex por cerca de 20 minutos). As formulações foram espalhadas com bastão de vidro, garantindo desta forma homogeneidade da distribuição das formulações sobre a pele.
Durante o procedimento, o fluido receptor foi mantido a 37oC e
agitado continuamente com uma barra magnética. O compartimento doador foi mantido aberto, permitindo a evaporação da fase aquosa volátil das formulações mimetizando o processo como ocorreria in vivo (condição não
46 oclusiva). Em diferentes intervalos de tempo (2, 4, 6 e 8 horas) após a aplicação das formulações, o fluido receptor foi coletado e o compartimento receptor novamente preenchido com um novo tampão.
A concentração de antimônio nos fluidos coletados em diferentes tempos foi determinada por espectroscopia de absorção atômica, em um espectrômetro Perkin Elmer® AAnalyst 600 (GFAAS), equipado com
plataforma de aquecimento do tipo forno de grafite e corretor Zeeman de background, do Laboratório de Biofísica de Nano Sistemas/Departamento de Fisiologia e Biofísica, ICB/UFMG.
Foram realizados dois estudos de permeação percutânea in vitro, a partir de formulações do LA8-Sb diluído em água deionizada e de antimoniato de meglumina incorporado ao gel de natrosol (NatAM). O primeiro estudo utilizou pele íntegra, e o segundo a pele com o estrato córneo removido.
4.8. Análises estatísticas
A análise estatística foi realizada com o auxílio do programa GraphPad Prism versão 5.0 e Origin versão 6.0.
Para calcular os valores de IC50 e CC50, foram feitas regressões não
lineares das médias dos valores encontrados para cada concentração em, pelo menos, três experimentos independentes.
Para a análise da evolução da lesão dos camundongos, foi utilizado o teste Two-way repeated measure ANOVA, seguido pelo teste de Bonferroni. A média dos pesos dos animais foi avaliada para cada grupo por análise de variância (ANOVA) com delineamento em parcelas subdivididas.
Para comparar os valores da absorção percutânea in vitro foi usado o teste One-way ANOVA seguido do teste de Tukey’s.
47
5. d
5.
48 5.1. Curva de crescimento
As formas promastigotas de Leishmania amazonensis foram cultivadas como descrito no item 4.2. Para a realização da curva de crescimento foi utilizada uma cultura na segunda passagem, de um isolado de L. amazonensis de hamsters (Mesocricetus auratus) experimentalmente infectados.
Foi observado um grande aumento do número de parasitos na fase logarítmica, até o terceiro dia de incubação, estabilizando-se a partir do quarto dia. No quinto dia foi observado um grande número de formas metacíclicas (Figura 6).
0
1
2
3
4
5
6
7
0
1.0
10
72.0
10
73.0
10
74.0
10
7Tempo (dias)
Nú
m
er
o
d
e
p
ro
m
as
ti
g
o
ta
s/
m
L
Figura 6 - Curva de crescimento para Leishmania amazonensis (cepa PH8) em meio
MEM completo. Os desvios padrões estão representados por barras verticais.
Para a infecção dos camundongos do estudo in vivo foi utilizada cultura no sexto dia de crescimento, rica em formas metacíclicas isoladas conforme descrito anteriormente.
49 5.2. Citotoxicidade em macrófagos murinos
As Tabelas 3, 4 e 5 mostram as médias dos resultados obtidos nos testes de viabilidade de macrófagos peritoneais de camundongos BALB/c na presença do ligante LA8, o complexo LA8-Sb e o Glucantime. Os dados foram expressos em porcentagem de viabilidade celular relativa, tendo como referência, a média dos resultados obtidos na leitura dos poços controles, onde não foram aplicadas formulações, considerando as mesmas como 100% de viabilidade relativa (Tabelas 1 a 3).
O valor da concentração citotóxica para 50% dos macrófagos (CC50) foi
determinado para o ligante LA8, o complexo LA8-Sb e o Glucantime, através do método citado no item 4.4.2.
O Glucantime apresentou um valor de CC50 de 26,31mM de Sb (tabela 2,
figura 8). O ligante LA8 e o complexo LA8-Sb, por outro lado, mostraram um valor de CC50 de 4,89mM e 0,26mM de Sb (equivalente a 0,78mM de LA8)
respectivamente (Figura 7).
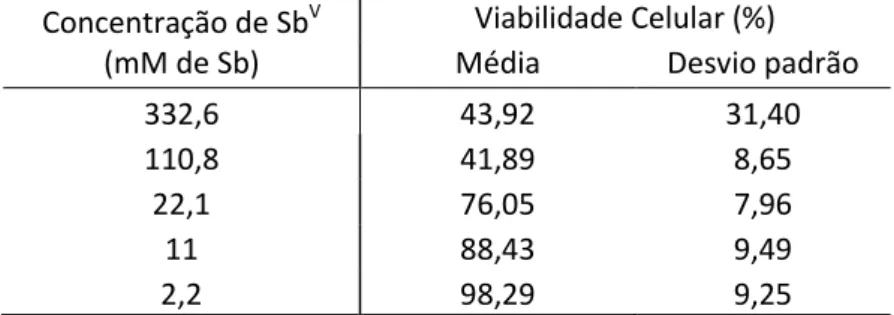
Tabela 1: Percentagem média de macrófagos peritoneais de BALB/c viáveis, em diferentes concentrações de Glucantime, após 24 horas de exposição.
Concentração de SbV (mM de Sb)
Viabilidade Celular (%) Média Desvio padrão 332,6 43,92 31,40 110,8 41,89 8,65
22,1 76,05 7,96 11 88,43 9,49 2,2 98,29 9,25
Tabela 2: Percentagem média de macrófagos peritoneais de BALB/c viáveis, em diferentes concentrações de LA8-Sb, após 24 horas de exposição.
Concentração de SbV (mM de Sb)
Viabilidade Celular (%) Média Desvio padrão
1 2,53 1,10
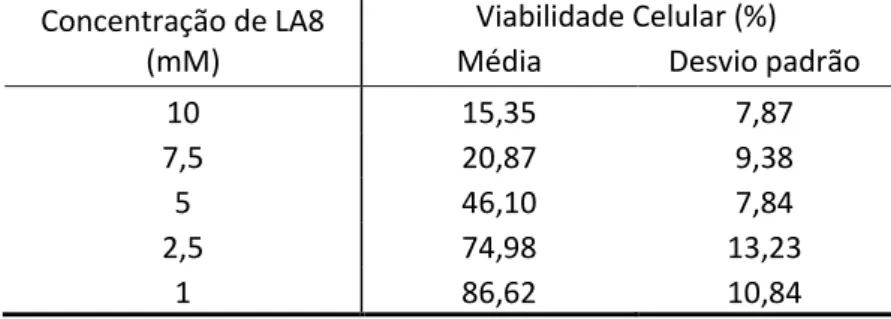
50 Tabela 3: Percentagem média de macrófagos peritoneais de BALB/c viáveis, em diferentes concentrações de LA8, após 24 horas de exposição.
Concentração de LA8 (mM)
Viabilidade Celular (%) Média Desvio padrão 10 15,35 7,87 7,5 20,87 9,38
5 46,10 7,84
2,5 74,98 13,23 1 86,62 10,84
Figura 7 - Curvas de viabilidade de macrófagos peritoneais de camundongos BALB/c em função da concentração de Glucantime, LA8 (octanoil-N-metilglucamida) e LA8-Sb (octanoil-N-metilglucamida+Sb). Os dados mostrados representam a média de 3 experimentos independentes.
51 concentrações do ligante em ambos os compostos. A atividade citotóxica do complexo é cerca de 100 vezes maior que atividade obtida para o Glucantime neste ensaio, quando comparamos as concentrações de antimônio presentes em ambas as formulações.
5.3. Atividade anti-amastigota in vitro
Procuramos determinar o valor da concentração capaz de reduzir em 50% o número de macrófagos parasitados (CI50) no modelo de macrófagos
infectados com Leishmania amazonensis, para o ligante LA8, o complexo LA8-Sb e Glucantime, através do método citado no item 4.5.2.
As concentrações utilizadas foram determinadas selecionando-se valores abaixo daqueles que permitiam uma viabilidade celular acima de 80%, nos testes de citotoxicidade em macrófagos.
Para um estudo preliminar da atividade leishmanicida do LA8 e do LA8-Sb foram selecionados apenas três concentrações a serem testadas como citado no material e métodos. No entanto, como não foi observada atividade anti-amastigota dos compostos testados, em concentrações muito próximas daquelas tóxicas para macrófagos, optamos por não realizar um novo teste com outras concentrações.
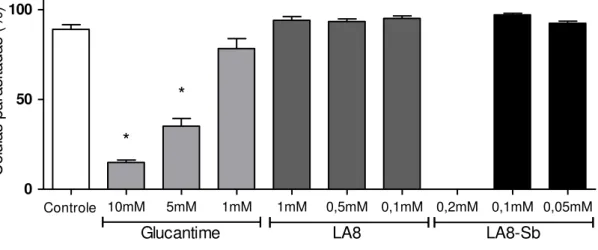
O Glucantime apresentou atividade leishmanicida nas concentrações de 10 e 5 mM de Sb, quando comparado ao grupo controle. Os compostos LA8 e LA8-Sb não apresentaram atividade nas concentrações testadas (Figura 8).
Não foram observados macrófagos viáveis na concentração de 0,2 mM do complexo LA8-Sb, sendo observadas raras amastigotas ou grumos de amastigotas, muitas delas não apresentando a morfologia clássica do parasito (Figura 9).
52
10mM 5mM 1mM 1mM 0,5mM 0,1mM 0,2mM 0,1mM 0,05mM
0 50 100
Glucantime LA8 LA8-Sb
Controle
*
*
C
él
ul
as
p
ar
as
ita
da
s
(%
)
Figura 8 - Atividade leishmanicida in vitro dos compostos LA8, LA8-Sb e Glucantime em diferentes concentrações no modelo de macrófagos peritoneais de BALB/c, infectados com formas promastigotas de fase estacionária de Leishmania amazonensis. Os dados são mostrados como a percentagem média de células parasitadas com relação ao controle não tratado. Os asteriscos evidenciam diferenças estatisticamente significativas em comparação ao controle (p<0,001)
Figura 9 - Imagens de microscopia ótica das lâminas do teste de atividade anti-amastigota in vitro com as maiores concentrações utilizadas no teste para cada composto. Grupo controle (A), Glucantime 10,0mM (B), LA8-Sb 0,2mM (C) e LA8 1,0mM (D). Aumento de 40x.
A CI50 calculada para o Glucantime foi de 4,21mM de Sb, (Figura 10), e
53 Figura 10 - Curva de inibição do número de macrófagos peritoneais infectados em função da concentração de Glucantime. Os valores são mostrados como a média de 3 experimentos independentes.
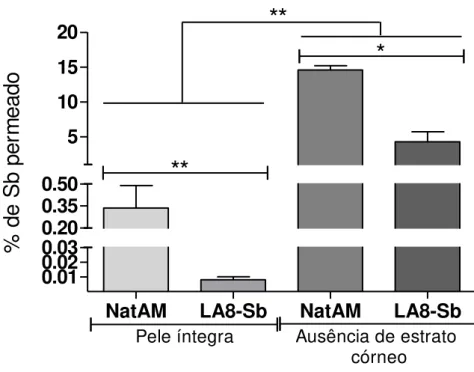
5.4. Permeação percutânea de Sb
A permeação média de antimônio a partir da formulação NatAM nestas condições descritas no item 4,8, após oito horas de exposição foi de 0,33 ± 0,26% e 14,57 ± 1,08%, respectivamente. Para o composto LA8-Sb, estes valores foram 0,008 ± 0,003% e 4,27 ± 2,49%, respectivamente (Figura 11).