Estudo fitoquímico do extrato hexânico e
da atividade biológica de constituintes das
folhas de Maytenus robusta (Celastraceae)
UFMG-ICEx/DQ 888a D 502a
GRASIELY FARIA DE SOUSA
ESTUDO FITOQUÍMICO DO EXTRATO HEXÂNICO E DA
ATIVIDADE BIOLÓGICA DE CONSTITUINTES DAS
FOLHAS DE
MAYTENUS ROBUSTA
(CELASTRACEAE)
UNIVERSIDADE FEDERAL DE MINAS GERAIS Belo Horizonte
2012
Sousa, Grasiely Faria de
Estudo fitoquímico do extrato hexânico e da atividade biológica de constituintes das folhas de Maytenus robusta (Celastraceae)./ Grasiely Faria de Sousa. 2012.
xiii, 141 f. : il.
Orientadora: Grácia Divina de Fátima Silva. Co-orientadora: Sidney Augusto Vieira Filho. Dissertação (mestrado) – Universidade Federal de Minas Gerais. Departamento de Química.
Bibliografia p.133-141
1. Química orgânica - Teses 2. Fitoquímica – Teses 3.Celastaceae – Teses 4.Maytenus robusta – Teses 5. Triterpenos pentacíclicos- Teses I. Silva, Grácia Divina de Fátima, Orientadora II.Duarte, Lucienir Pains, Co-orientadora III. Título.
“O amor é a força mais abstrata e, também, a mais potente que há no mundo.”
AGRADECIMENTOS
A Deus por essa oportunidade e por se fazer presente em todos os momentos.
À Professora Dra. Lucienir Pains Duarte, pela orientação, confiança, paciência e convivência agradável. Obrigada por ter me recebido em seu laboratório quando eu era ainda aluna da graduação, pelos conhecimentos transmitidos e por ser sempre tão ágil e prestativa.
À Professora Dra. Grácia Divina de Fátima Silva, pela contribuição com seus conhecimentos e pela oportunidade de fazer parte do grupo NEPLAM.
Ao Professor Dr. Sidney Augusto Vieira Filho (Bibo), pela colaboração nos trabalhos desenvolvidos e amizade.
Aos amigos de laboratório Fernando e Cássia, pelas contribuições neste trabalho.
Aos professores do Departamento de Química da UFMG, pelos conhecimentos transmitidos.
Aos funcionários do DQ, pela assistência e apoio técnico.
À Dra. Ivana Silva Lula, pela eficiência na obtenção e processamento dos espectros de RMN.
Às professoras Dra. Jacqueline Aparecida Takahashi e Dra. Lúcia Pinheiro dos Santos Pimenta, pela realização dos testes biológicos.
Aos professores Dr. Antônio Flávio de Carvalho Alcântara, Dra. Adriana Akemi Okuma e Dra. Roqueline Rodrigues Silva de Miranda, pela participação na banca de mestrado e pelas valiosas considerações.
Aos amigos e companheiros do NEPLAM, Fernando, Fernanda, Cássia, Jéfferson, Vanessa, Nathany, Aline, Débora, Gabriele, Mariana, Leandro, Daphine, Izaac, Cíntia, Jailton, Graziele e Prof. Fernando Carazza, pela convivência agradável, assistência e conhecimentos compartilhados.
À secretaria do Programa de Pós-Graduação em Química do Departamento de Química da UFMG.
À minha família, meus pais Reni e Eva, meus irmãos, Flávio e Paulo Henrique pelo amor, apoio e compreensão.
Ao meu amor João Paulo, pelo carinho, companheirismo, paciência e admiração.
Ao meu querido sobrinho, Marco Túlio, pela alegria e momentos de descontração.
Ás minhas cunhadas Camila e Luana pelo carinho e incentivo.
Às amigas Natália Dantas, Izabela, Larissa, Raquel e Luiza, pelo apoio e incentivo.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pela concessão da bolsa de mestrado.
SUMÁRIO
ÍNDICE DE FIGURAS... i
ÍNDICE DE TABELAS... vii
LISTA DE ABREVIATURAS, SIGLAS E SÍMBOLOS... ix
RESUMO... xii
ABSTRACT... xiii
INTRODUÇÃO
A importância dos produtos naturais na descoberta de novos medicamentos 01 A família Celastraceae... 08O gênero Maytenus... 09
A espécie Maytenus robusta Reiss... 10
OBJETIVOS
Objetivos do trabalho... 12
CAPÍTULO 1: ESTUDO FITOQUÍMICO
1.1 – Parte Experimental... 131.1.1 – Métodos gerais... 13
1.1.2 – Coleta e identificação do material vegetal... 14
1.1.3 – Preparação dos extratos das folhas de Maytenus robusta... 15
1.1.4 – Elaboração de SEHF... 17
1.1.5 – Elaboração de EHF... 19
1.2 – Determinação estrutural ... 27
1.2.1 – MR01: 3-oxofriedelano... 27
1.2.2 – MR02: 3β-hidroxifriedelano... 32
1.2.3 – MR03: 3-oxo-11β-hidroxifriedelano e MR04: 3-oxo-29- hidroxifriedelano... 37
1.2.4 – MR05: 3β,11β-di-hidroxifriedelano... 43
1.2.5 – MR06: Mistura de hidrocarbonetos... 58
1.2.6 – MR07: 2,6,11-trimetildodeca-2,6,10-trieno (tanaceteno)... 62
1.2.7 – MR01: 3-oxofriedelano e MR08: 3-oxo-21β-H-hop-22(29)- eno... 65
1.2.8 – MR09:3,4-secofriedelan-3,11β-olídeo... 70
1.2.9 – MR10: 3β-hidroxi-21β-H-hop-22(29)-eno………... 84
1.2.11 – MR12: ácido 3,4-seco-21β-H-hop-22(29)-eno-3-óico e MR13: ácido
3,4-secofriedelan-3-óico... 100
1.2.12 – MR13: ácido 3,4-secofriedelan-3-óico e MR14: sistosterol... 106
CAPÍTULO 2: ESTUDO DA ATIVIDADE BIOLÓGICA
2.1 – Introdução Geral... 1112.2 – Atividade Antimicrobiana... 112
2.2.1– Introdução... 112
2.2.2 – Teste antimicrobiano... 113
2.2.2.1– Avaliação da atividade antimicrobiana em ensaio de microplaca... 114
2.2.2.2 – Metodologia... 114
2.2.2.3 – Análise dos resultados e discussão... 115
2.3 – Atividade de Inibição da Enzima Acetilcolinesterase... 118
2.3.1– Introdução... 118
2.3.2 – Método de bioautografia empregando reagente de Ellman... 121
2.3.2.1 – Metodologia... 122
2.3.2.2 – Análise dos resultados e discussão... 122
2.3.3 – Teste de inibição da AChE em microplaca empregando reagente de Ellman... 123
2.3.3.1 – Metodologia... 125
2.3.3.2 – Análise dos resultados e discussão... 125
2.4 – Avaliação do Potencial Tóxico Através da Atividade Larvicida Sobre Artemia salina... 127
2.4.1– Introdução... 127
2.4.2 – Método experimental, segundo Santos Pimenta e colaboradores (2003)... 128
2.4.3 – Resultados e discussão... 129
CONCLUSÃO... 131
ÍNDICE DE FIGURAS
Figura 1: Alguns alcalóides isolados de Papaver somniferum... 02
Figura 2: Estrutura química de alguns salicilatos... 02
Figura 3: Estrutura do paclitexel (taxol), da vincristina e da vimblastina... 04
Figura 4: Catharanthus roseus(Foto: autora)... 05
Figura 5: Taxus baccata(Foto: Kevin Nixon)... 05
Figura 6: Estrutura dabenzilpenicilina, da ciclosporina e da daunorrubicina 06 Figura 7: Estrutura do elliptinium e da galantamina... 07
Figura 8: Estrutura do ácido betulínico e do bevirimat... 07
Figura 9: Alguns triterpenos pentacíclicos biologicamente ativos... 09
Figura 10: Maytenus robusta, exemplar do Parque Estadual do Itacolomi, Ouro Preto – MG (Fotos: autora)... 11
Figura 11: Maytenus robusta (Fotos: Anita Stival e Marcio Verdi, FloraRS)... 11
Figura 12: Esquema da obtenção dos extratos de folhas de M. robusta... 16
Figura 13: Esquema dofracionamento de SEHF... 19
Figura 14: Esquema do fracionamento de EHF... 26
Figura 15: Espectro na região do IV de MR01(ATR)... 28
Figura 16: Espectro de RMN de 1H (400 MHz) de MR01 em CDCl 3... 29
Figura 17: Espectro e expansão de RMN de 13C (100 MHz) de MR01 em CDCl3... 30
Figura 19: Espectro na região do IV de MR02 (ATR)... 33
Figura 20: Espectro de RMN de 1H (200 MHz) deMR02em CDCl
3... 33
Figura 21: Espectro de RMN de 13C (50 MHz) de MR02 em CDCl
3... 34
Figura 22: Subespectro DEPT135 (50 MHz) de MR02 em CDCl3... 35
Figura 23: Espectro de absorção na região do IV da mistura de MR03e
MR04(ATR)... 38
Figura 24: Espectro de RMN de 1H (400 MHz) da mistura de MR03 e MR04 em CDCl3... 39
Figura 25: Espectro de RMN de 13C (100 MHz) da mistura de MR03 e MR04 em CDCl3... 40
Figura 26: Expansão do espectro de RMN de 13C (100 MHz) da mistura de
MR03 e MR04em CDCl3... 41
Figura 27: Subespectro DEPT135 (100 MHz) da mistura de MR03 e MR04
em CDCl3... 41
Figura 28: Curvas de TG, DTG e DTA de MR05, obtidas em atmosfera dinâmica de N2, fluxo de 100 mL min-1; razão de aquecimento 10 oC min-1; cadinho de α-Al
2O3... 45 Figura 29: Curva de DSC de MR05, obtida em atmosfera dinâmica
dinâmica de He; fluxo de 50 mL min-1; razão de aquecimento
10 oC min-1; cadinho de Al... 45
Figura 30: Espectro na região do IV de MR05(ATR)... 46
Figura 31: Espectro de RMN de 1H (400 MHz) de MR05 em CDCl + Piridina- d5... 46
Figura 32: Espansão do espectro de RMN de 1H (400 MHz) de MR05 em CDCl3 + Piridina-d5...
47
Figura 33: Estrutura tridimensional de MR05, destacando a posição dos
átomos de hidrogênio carbinólicos... 47
Figura 34: Espectro de RMN de 13C (100 MHz) de MR05 em CDCl3 +
Figura 35: Expansão do subespectro DEPT135 (100 MHz) de MR05 em
CDCl3+ Piridina-d5... 49
Figura 36: Expansão do mapa de contornos HSQC (400 MHz) de MR05 em CDCl3 + Piridina-d5... 50
Figura 37: Expansão do mapa de contornos HSQC (400 MHz) de MR05 em CDCl3 + Piridina-d5... 50
Figura 38: Expansão do mapa de contornos HMBC (400 MHz) de MR05 em CDCl3 + Piridina-d5... 51
Figura 39: Expansão do mapa de contornos HMBC (400 MHz) de MR05 em CDCl3 + Piridina-d5... 52
Figura 40: Expansão do mapa de contornos COSY (400 MHz) de MR05
em CDCl3 + piridina-d5... 54
Figura 41: Expansão do mapa de contornos COSY (400 MHz) de MR05em
CDCl3 + piridina-d5... 55
Figura 42: Expansão do mapa de contornos NOESY (400 MHz) de MR05
em CDCl3 + piridina-d5... 55
Figura 43: Expansão do mapa de contornos NOESY (400 MHz) de MR05
em CDCl3 + piridina-d5... 56
Figura 44: Algumas correlações observadas no mapa de contornos NOESY
de MR05... 56
Figura 45: Espectro de absorção na região do IV de MR06 (ATR)... 58
Figura 46: Espectro de RMN de 1H (200 MHz) deMR06 em CDCl
3... 59
Figura 47: Espectro de RMN de 13C (50 MHz) de MR06 em CDCl
3... 60
Figura 48: Subespectro DEPT135 (50 MHz) de MR06 em CDCl3... 60
Figura 49: Cromatograma de padrões de hidrocarbonetos C-27 a C31. Condições de análise: 200 °C (0 min) com taxa de aquecimento
de 10°C /min até 300 °C... 61
Figura 50: Cromatograma de MR06. Condições de análise: 200 °C (0 min)
Figura 51: Espectro de RMN de 1H (200 MHz) de MR07 em CDCl
3... 62
Figura 52: Espectro de RMN de 13C (50 MHz) de MR07 em CDCl 3... 63
Figura 53: Subespectro DEPT135 (50 MHz) de MR07em CDCl3... 64
Figura 54: Espectro na região do IV da mistura de MR01 e MR08 (ATR)... 66
Figura 55: Espectro de RMN de 1H (200 MHz) da mistura de MR01 e MR08 em CDCl3... 67
Figura 56: Expansão do espectro de RMN de 13C (50 MHz) da mistura de MR01 e MR08 em CDCl3... 68
Figura 57: Expansão do subespectro DEPT135 (50 MHz) da mistura de MR01 e MR08 em CDCl3... 68
Figura 58: Espectro na região do IV de MR09 (KBr)... 71
Figura 59: Espectro de RMN de 1H (400 MHz) de MR09 em CDCl3... 72
Figura 60: Espectro de RMN de 13C (100 MHz) de MR09 em CDCl3... 73
Figura 61: Expansão do espectro de RMN de 13C (100 MHz) de MR09 em CDCl3... 73
Figura 62: Subespectro DEPT135 (50 MHz) de MR09 em CDCl3... 74
Figura 63: Expansão do mapa de contornos HSQC (400 MHz) de MR09 em CDCl3... 75
Figura 64: Expansão do mapa de contornos HMBC (400 MHz) de MR09... 76
Figura 65: Expansão do mapa de contornos HSQC (400 MHz) de MR09 em CDCl3, correlações de H-11 e H-2... 77
Figura 66: Expansão do mapa de contornos HMBC (400 MHz) de MR09 em CDCl3, correlações de H-11 e H-2... 79
Figura 67: Expansão do mapa de contornos COSY (400 MHz) de MR09 em CDCl3... 79
Figura 69: Expansão do mapa de contornos NOESY (400 MHz) de MR09
em CDCl3... 82
Figura 70: Algumas correlações observadas no mapa de contornos NOESY de MR09... 82
Figura 71: Espectro na região do IV de MR10(ATR)... 85
Figura 72: Espectro de RMN de 1H (400 MHz) de MR10 em CDCl + Piridina- d5...
86
Figura 73: Expansão do espectro de RMN de 1H (400 MHz) de MR10 em
CDCl3 + Piridina-d5... 87
Figura 74: Espectro de RMN de 13C (100 MHz) de MR10 em CDCl +
Piridina-d5... 87
Figura 75: Expansão do espectro de RMN de 13C (100 MHz) de MR10 em
CDCl3 + Piridina-d5... 88
Figura 76: Expansão do subespectro DEPT135 (100 MHz) de MR10 em
CDCl3 + Piridina-d5... 88
Figura 77: Expansão do mapa de contornos HSQC (400 MHz) de MR10 em
CDCl3 + Piridina-d5... 89
Figura 78: Expansão do mapa de contornos HSQC (400 MHz) de MR10 em CDCl3 + Piridina-d5... 90
Figura 79: Expansão do mapa de contornos HMBC (400 MHz) de MR10 em CDCl3 + Piridina-d5... 91
Figura 80: Expansão do mapa de contornos HMBC (400 MHz) de MR10 em CDCl3 + Piridina-d5... 92
Figura 81: Mapa de contornos COSY (400 MHz) de MR10 em CDCl3 +
Piridina-d5... 94
Figura 82: Espectro de absorção na região do IV de MR11 (KBr)... 97
Figura 83: Espectro de RMN de 1H (400 MHz) de MR11 em CDCl3 +
Piridina-d5... 98
Figura 84: Espectro de RMN de 13C (100 MHz) de MR11 em CDCl3 +
Figura 85: Subespectro DEPT135 (100 MHz) de MR11 em CDCl3 + Piridina- d5... 99 Figura 86: Espectro de absorção na região do IV da mistura de MR12 e
MR13 (ATR)... 101 Figura 87: Espectro de RMN de 1H (400 MHz) da mistura de MR12 e MR13 em CDCl3... 102 Figura 88: Espectro de RMN de 13C (100 MHz) da mistura de MR12 e MR13 em CDCl3... 103 Figura 89: Expansão do espectro de RMN de 13C (100 MHz) da mistura de
MR12 e MR13 em CDCl3... 103
Figura 90: Subespectro DEPT135 (100 MHz) da mistura de MR12 e MR13
em CDCl3... 104
Figura 91: Espectro de absorção na região do IV da mistura de MR13 e
MR14 (ATR)... 107
Figura 92: Espectro de RMN de 1H (200 MHz) da mistura de MR13 e MR14 em CDCl3... 108
Figura 93: Espectro de RMN de 13C (50 MHz) da mistura de MR13 e MR14
em CDCl3... 108 Figura 94: Expansão do espectro de RMN de 13C (50 MHz) da mistura de
MR13 e MR14 em CDCl3... 109
Figura 95: Subespectro DEPT135 (50 MHz) da mistura de MR13 e MR14
em CDCl3... 109
Figura 96:Fármacos colinomiméticos empregados no tratamento da doença de Alzheimer... 120
Figura 97: Estrutura da memantina... 120
Figura 98: Sequência de reações propostas no método de Ellman (Figura
adaptada de Marston, 2011)... 121
Figura 99: Bioautograma das amostras testadas e do padrão utilizado (cafeína) e estruturas químicas de algumas das amostras
(Fotos: Karine Ferreira de Campos)... 124
Figura 100: Teste de inibição da AChE em microplaca empregando
ÍNDICE DE TABELAS
Tabela 1: Princípios ativos isolados a partir de plantas... 3
Tabela 2: Frações obtidas da coluna A e eluentes utilizados... 17
Tabela 3: Frações obtidas da coluna C e eluentes utilizados... 20
Tabela 4: Frações obtidas da coluna D e eluentes utilizados... 21
Tabela 5: Frações obtidas da coluna E e eluentes utilizados... 23
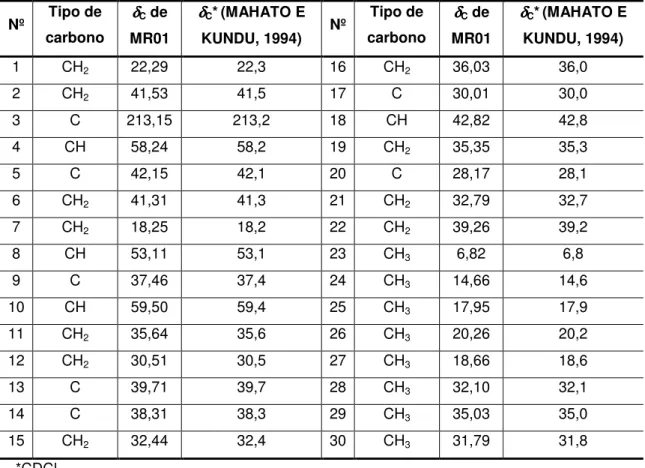
Tabela 6: Comparação dos dados de RMN de 13C de MR01 com os dados da literatura para 3-oxofriedelano (MAHATO E KUNDU, 1994)... 31
Tabela 7: Comparação dos dados de RMN de 13C de MR02 com dados da literatura para 3β-hidroxifriedelano (SALAZAR et al., 2000)... 36
Tabela 8: Comparação dos dados de RMN de 13C (CDCl3) de MR03 e MR04 com dados da literatura para 3-oxo-11β-hidroxifriedelano e 3-oxo-29-hidroxifriedelano (CHEN et al., 2010; MAHATO E KUNDU, 1994)... 42
Tabela 9: Dados de RMN 1D e 2D (400 MHz, CDCl3 + piridina-d5) de MR05.. 57
Tabela 10: Comparação dos dados de RMN de 13C de MR07 (CDCl3) com valores da literatura para 2,6,11-trimetildodeca-2,6,10-trieno (MAHMOOD et al., 2002)... 64
Tabela 11: Comparação dos dados de RMN de 13C (CDCl3) de MR01 e MR08 com dados da literatura para 3-oxofriedelano (MAHATO E KUNDU, 2004), 3α-hidroxi-21β-H-hop-22(29)-eno (KIEM et al., 2004) e 3-oxo-21α-H-hop-22(29)-eno (DAVID et al., 2004)... 69
Tabela 12: Dados de RMN 1D e 2D (400 MHz, CDCl3) de MR09... 83
Tabela 13: Dados de RMN 1D e 2D (400 MHz) de MR10 e comparação com dados de RMN 13C do lupeol e 3α-hidroxi-21β-H-hop-22(29)-eno. 95
Tabela 15: Comparação dos dados de RMN de 13C (CDCl3) de MR13 e
MR14 com dados da literatura utilizados como referência... 110
Tabela 16:Amostras utilizadas no teste antimicrobiano... 115
Tabela 17: Percentagens de inibição para cada micro-organismo na
primeira leitura, seguidas pelo desvio padrão e coeficiente de
variação... 116
Tabela 18: Percentagens de inibição para cada micro-organismo na
segunda leitura, seguidas pelo desvio padrão e coeficiente de variação... 117
Tabela 19: Amostras utilizadas no teste de inibição da enzima AChE... 123
Tabela 20: Resultados do teste de inibição da enzima AChE em microplaca. 127
Tabela 21:Amostras submetidas ao ensaio de toxicidade frente à Artemia salina... 129
Tabela 22: Concentração das amostras utilizadas no teste de toxicidade
ABREVIATURAS, SIGLAS E SÍMBOLOS
δ - Deslocamento químico
[α] – rotação óptica
1D – Uma dimensão
2D – Duas dimensões
AAS – Ácido acetilsalicílico
ACh – Acetilcolina
AChE – Acetilcolinesterase
ANVISA – Agência Nacional de Vigilância Sanitária
AIDS – Acquired Immune Deficiency Syndrome
ATCC – American Type Culture Collection
ATR – Attenuated Total Reflection (Reflectância Total Atenuada)
BHI – Broth Heart Infusion
CAT – Colina acetiltransferase
CC – Cromatografia em Coluna
CCD – Cromatografia em Camada Delgada
CerQBio - Laboratório de Quimio e Bioprospecção de Plantas do Cerrado
CG – Cromatografia Gasosa
CGAR – Gromatografia Gasosa de Alta Resolução
DA – Doença de Alzheimer
DEPT135 – Distortionless Enhancement by Polarization Transfer 135
DL50 – Dose Letal mediana
DQ – Departamento de Química
DSC – Differential Scanning Calorimetry
DTNB – 5,5’-ditiobis-(ácido 2-nitrobenzóico)
FDA – Food and Drug Administration
HIV – Human immunodeficiency virus
HMBC – Heteronuclear Multiple Bond Correlation Spectroscopy
HSQC – Heteronuclear Single Quantum Coherence Spectroscopy
HTS – High Throughput Screening
ICEB – Instituto de Ciências Exatas e Biológicas
IV – Infravermelho
J – Constante de acoplamento
LAREMAR – Laboratório de Ressonância Magnética de Alta Resolução
LB – Liebermann Burchard
NCI – National Cancer Institute
NEPLAM – Núcleo de Estudo de Plantas Medicinais
NOESY – Two Dimensional Nuclear Overhauser Effect Spectroscopy
OMS – Organização Mundial da Saúde
RDC – Resolução da Diretoria Colegiada
Rf – Fator de retenção
RMN – Ressonância Magnética Nuclear
RMN de 13C – Ressonância Magnética Nuclear de Carbono-13
RMN de 1H – Ressonância Magnética Nuclear de Hidrogênio
SNC – Sistema Nervoso Central
TG – Thermogravimetry
TMS – Tetrametilsilano
TNB – 5-tio-2-nitrobenzoato
UFMG – Universidade Federal de Minas Gerais
UFOP – Universidade Federal de Ouro Preto
RESUMO
O estudo fitoquímico do extrato hexânico das folhas de M. robusta e do
sólido obtido durante a preparação desse extrato resultou no isolamento de sete
triterpenos pentacíclicos: 3-oxofriedelano, 3β-hidroxifriedelano, 3-oxo-11β
-hidroxifriedelano, 3-oxo-29--hidroxifriedelano, 3β,11β-di-hidroxifriedelano,
3-oxo-21β-H-hop-22(29)-eno e 3β-hidróxi-21β-H-hop-22(29)-eno. Foram isolados ainda,
dois triterpenos de esqueleleto seco-friedelano, 3,4-seco-friedelan-3,11β-olídeo e
ácido 3,4-seco-friedelan-3-óico, o triterpeno de esqueleto seco hopânico ácido
3,4-seco-21β-H-hop-22(29)-en-3-óico, o esteroide sitosterol, misturas de
hidrocarbonetos de cadeia longa, um sesquiterpeno,
2,6,11-trimetildodeca-2,6,10-trieno, e um ácido graxo de cadeia longa, ácido hentriacontanóico. As estruturas
químicas foram determinadas por métodos espectroscópicos (IV, RMN de 1H,
RMN de 13C, HSQC, HMBC e NOESY). Das substâncias isoladas, o 3β,11β
-di-hidroxifriedelano e o 3,4-seco-friedelan-3,11β-olídeo são inéditos.
O estudo da atividade biológica consistiu da avaliação de atividade
antimicrobiana, atividade da inibição da enzima acetilcolinesterase e avaliação do
potencial tóxico por meio da atividade larvicida sobre Artemia salina. Os
triterpenos 3β,11β-di-hidroxifriedelano e 3β-hidroxi-21β-H-hop-22(29)-eno
apresentaram atividade de inibição da enzima acetilcolinesterase. Essa atividade
foi observada também para os extratos clorofórmico, acetato etílico e metanólico.
O sólido obtido durante o preparo do extrato clorofórmico mostrou-se ativo contra
S. aureus, C. albicans e B. cereus. O extrato acetato etílico apresentou atividade
contra B. cereus, S. typhimurium, S. aureus e C. albicans. O sólido do extrato
ABSTRACT
Phytochemical study of the hexane extract from the leaves of M. robusta
and of the solid obtained during the preparation of this extract resulted in the isolation of seven pentacyclic triterpenes: 3-oxofriedelane, 3β-hydroxyfriedelane,
3-oxo-11β-hydroxyfriedelane, 3-oxo-29-hydroxyfriedelane, 3β,11β
-di-hydroxyfriedelane, 3-oxo-21β-H-hop-22(29)-ene and 3β-hydroxy-21β-H
-hop-22(29)-ene. The triterpenes with seco-friedelan skeleton, 3,4-seco-friedelan-3,11β -olide and 3,4-seco-friedelan-3-oic acid, the triterpene with seco-hopene skeleton,
3,4-seco-21β-H-hop-22(29)-en-3-oic acid, the steroid sitosterol, mixtures of long chain hydrocarbons, the sesqueterpene 2,6,11-trimethyldodeca-2,6,10-triene and the long chain fatty acid hentriacontanoic acid were also isolated. The chemical structures were determined by spectroscopic methods (IR, 1H and 13C NMR, HSQC, HMBC and NOESY). The triterpenes 3β,11β-dihydroxyfriedelane and
3,4-seco-friedelan-3,11β-olide are new compounds.
The study of the biological activity consisted of antimicrobial activity, activity of the capacity to inhibit acetylcholinesterase and evaluation of toxic potential through larvicidal activity on Artemia salina. The triterpenes 3β,11β
-di-hydroxyfriedelane and 3β-hydroxy-21β-H-hop-22(29)-ene showed cholinesterase inhibiting activities. This activity was also observed for the chloroform, ethyl acetate and methanol extracts. The solid obtained during the preparation of chloroform extract was active against S. aureus, C. albicans and B. cereus. The ethyl acetate extract showed activity against B. cereus, S. typhimurium, S. aureus
and C. albicans. The solid obtained during the preparation of hexane extract
showed activity against C. albicans.
INTRODUÇÃO
A importância dos produtos naturais na descoberta de novos
medicamentos
Os produtos naturais têm se mostrado uma fonte abundante de moléculas bioativas. Uma vez que a diversidade estrutural é fundamental na pesquisa para atingir diferentes alvos biológicos observa-se a importância do estudo de produtos naturais, considerando que, durante os milhões de anos da evolução biológica a seleção natural realizou um processo de química combinatória inigualável (YUNES E CECHINEL FILHO, 2001). Diversas fontes de produtos naturais têm sido utilizadas na obtenção de medicamentos, incluindo as plantas terrestres, os micro-organismos, organismos marinhos, vertebrados e invertebrados terrestres (NEWMANet al., 2000).
O uso de princípios ativos de produtos naturais na forma de preparações brutas predominou na terapêutica até o século XIX. A partir daí, com o desenvolvimento das técnicas de isolamento de substâncias puras dos produtos naturais, principalmente das técnicas de separação cromatográfica e, também, dos métodos de elucidação estrutural, foi possível isolar e identificar os princípios ativos dos produtos naturais usados na medicina popular (SILVA et al., 2003). Os estudos de produtos naturais impulsionaram o desenvolvimento das técnicas de separação, dos métodos espectroscópicos de elucidação e das técnicas de síntese que constituem o fundamento da química orgânica contemporânea. Além do uso terapêutico, havia o interesse na obtenção de corantes, polímeros, fibras, colas, óleos, aromatizantes e perfumes a partir de fontes naturais (CROTEAU et al., 2000). Produtos naturais continuam estimulando o desenvolvimento da química orgânica, ocasionando avanços em metodologias de síntese na busca de análogos com melhores características farmacológicas e farmacocinéticas do que o produto natural original (HARVEY, 2008).
somniferum (SILVA et al., 2003; LI E VEREDAS, 2009). A morfina é empregada na terapêutica atual como analgésico opioide e utilizada no tratamento de dores intensas e constantes como as provocadas por alguns tipos de câncer. Além da morfina, outros alcaloides foram isolados de Papaver somniferum, dentre eles a papaverina e a codeína (Figura 1). A codeína é obtida comercialmente por semi-síntese a partir da morfina e utilizada como antitussígeno e analgésico opioide
(SHUMACHER et al., 2005). Em 1828, Buchner isolou a salicina das cascas de
Salix alba. Em 1860 Kolbe e Lauteman sintetizaram o ácido salicílico e, em 1898, Felix Holman sintetizou o ácido acetilsalicílico (AAS) (Figura 2) (YUNES E
CECHINEL FILHO, 2001). Assim, foi obtido o primeiro fármaco sintético a partir da
otimização de um produto natural. O AAS apresentava um custo 10 vezes menor do que a salicina e podia ser sintetizado sem grandes dificuldades (YUNES E
CECHINEL FILHO, 2001). O AAS continua sendo amplamente empregado como
analgésico e antipirético e, em baixas doses, é utilizado como antiagregante plaquetário. Diversos outros fármacos foram obtidos a partir de plantas nos séculos XIX e XX (YUNES E CECHINEL FILHO, 2001; SILVA et al., 2003) e alguns exemplos são apresentados na Tabela 1, pág 3.
Figura 1: Alguns alcaloides isolados de Papaver somniferum.
Figura 2: Estrutura química de alguns salicilatos.
Morfina
O H
N
OH
HO
Codeína
O H
N
OH
O
N
O O O
O
Papaverina
Ácido salicílico
OH OH O
Salicina
Oglicose
OH
Ácido acetilsalicílico
O
Tabela 1: Princípios ativos isolados a partir de plantas
Princípio
ativo Ano Fonte Atividade
morfina 1804 Papaver somniferum analgésica
quinina 1820 Cinchona sp antimalárica
atropina 1831 Atropa belladonna anticolinérgica
cocaína 1859 Erythroxylum coca analgésica local
fisostigmina 1864 Physostigma venenosum colinomimética
pilocarpina 1875 Pilocarpus jaborandi colinomimética
tubocurarina 1895 Chondodendron tomentosum neuromuscular bloqueadora
reserpina 1952 Rauwolfia serpentina anti-hipertensiva
vincristina e
vimblastina 1954 Catharanthus roseus antitumoral
artemisina 1987 Artemisia annua antimalárica
paclitaxel 1993 Taxus brevifolia antitumoral
excelentes fontes de estruturas químicas complexas que podem apresentar atividade biológica, o Instituto Nacional do Câncer dos Estados Unidos (NCI) realizou um programa de screening para agentes anticancerígenos e, entre 1960 e 1982, 35000 plantas foram avaliadas quanto à atividade anticancerígena. Descobriu-se a atividade do paclitaxel encontrado nas cascas do teixo (Taxus
baccata e Taxus brevifolia), estudos clínicos revelaram que essa substância foi capaz de regredir o câncer de mama e de ovário resistentes à terapia tradicional (CRAGG E NEWMAN, 2009; BRANDÃO et al.; 2010). Havia um problema de suprimento, para a obtenção do paclitaxel em quantidades satisfatórias uma devastação de teixos seria necessária. A solução encontrada foi a produção por semi-síntese a partir do 10-desacetilbacatina-III, o qual é isolado das folhas da árvore Taxus baccata (Figura 5, pág. 5) em grande quantidade e apresenta o esqueleto básico do paclitaxel (SOUZA, 2004; LI E VEREDAS, 2009).
Figura 3: Estrutura do paclitaxel (taxol), da vincristina e da vimblastina.
Paclitaxel
O
N
φ O
O OH
O O
OH
O H
O
φ
O
O O HO H
O
H
Vincristina; R=CH3
Vimblastina; R=CHO
N H
N
OH
O O
O N
N
R H
O O
OH O
Figura 4: Catharanthus roseus (Foto: autora).
Figura 5: Taxus baccata (Foto: Kevin Nixon).
Além das plantas, outras fontes de produtos naturais têm se mostrado úteis na descoberta de substâncias biologicamente ativas. Como, por exemplo, os fungos. A benzilpenicilina (Figura 6), metabólito secundário do fungo Penicillium chrysogenum e descoberta por Alexander Fleming, foi o primeiro antibiótico a ser utilizado com sucesso e teve tamanha importância que foi chamada pelos cientistas da época de “droga milagrosa” (WHO, 2000). A ciclosporina A (Figura 6) foi descoberta como um metabólito de um fungo e é um agente imonossupressor de grande importância no tratamento de pacientes submetidos a transplante de órgão (YUNES E CECHINEL FILHO, 2001; LAKE at al., 2005). Os antibióticos antraciclinas isolados a partir da bactéria Streptomyces peucetius var. caesius estão entre os fármacos antineoplásicos citotóxicos mais utilizados. A daunorrubicina (Figura 6) foi o primeiro fármaco dessa classe a ser isolado e continua sendo utilizada no tratamento da leucemia mieloide aguda (CHU E SARTORELLI, 2005). Os produtos naturais marinhos também têm sido estudados e vêm apresentado bons resultados, principalmente para o tratamento do câncer (COSTA-LOTUFO et al., 2009).
Figura 6: Estrutura da benzilpenicilina, da ciclosporina e da daunorrubicina.
N
N H
H N
N
H N
O
O
O
O
O N R
N H
N N
N
O O
O O
O
HO
O
R = CH2CH(CH3)2
Ciclosporina Benzilpenicilina
O H N
N S
O
OH O
Daunorrubicina
O
O O
OH
OH H O
OH
O
NH2
Dentre os fármacos baseados em produtos naturais aprovados recentemente estão o antineoplásico elliptinium e o inibidor da acetilcolinesterase galantamina (Figura 7) (HARVEY, 2008). Vários derivados de produtos naturais encontram-se em estudos clínicos ou pré-clínicos. O antiviral bevirimat (Figura 8), um análogo do triterpeno pentacíclico ácido betulínico (Figura 8), apresentou bons resultados nos estudos clínicos de fase IIa e IIb (LEE, 2010). Kashiwada e colaboradores (1996) isolaram o ácido betulínico de Syzigium claviflorum e observaram a atividade anti-HIV do composto. A partir daí foram obtidos vários análogos e realizados estudos da relação estrutura atividade (QIAN et al, 2010), o bevirimat apresentou potente atividade contra o vírus HIV-1 e foi o primeiro composto da classe de inibidores da maturação do vírus HIV. Uma nova classe de anti-HIV significa esperança para pacientes em que a terapia com os fármacos atualmente disponíveis para o tratamento da AIDS não for satisfatória.
Figura 7: Estrutura do elliptinium e da galantamina.
Figura 8: Estrutura do ácido betulínico e do bevirimat.
Elliptinium
N
N HO
Galantamina
O
O
N OH
Ácido betulínico
HO
OH
O H
Bevirimat
O
OH
O H
HO
O
Apesar do histórico de sucesso, nos últimos anos a pesquisa das grandes indústrias farmacêuticas em produtos naturais vem diminuindo, em parte devido a ênfase na triagem em bibliotecas de compostos sintéticos (LI E VEREDAS, 2009; HARVEY, 2008). Produtos naturais geralmente apresentam estruturas complexas com vários átomos de oxigênio e vários centros estereoquímicos. Isso implica em um tempo longo para identificação desses compostos e podem haver problemas em relação ao abastecimento e a produção (LI E VEREDAS, 2009). No entanto, o potencial para a descoberta de novos fármacos a partir de produtos naturais é enorme. Uma vez que, metabólitos secundários são elaborados dentro de sistemas vivos, podem mostrar maior afinidade por receptores biológicos do que compostos sintetizados aleatoriamente, tornando-os bons candidatos para o desenvolvimento de futuros medicamentos (CHIN et al., 2006).
A descoberta de novas classes de fármacos é extremamente importante. Ainda existem doenças para as quais os tratamentos não são adequados, a AIDS, o Mal de Alzeheimer e diversos tipos de câncer são alguns exemplos. Há preocupação quanto a possibilidade de cura de pacientes com doenças infecciosas no futuro (WHO, 2011), visto que os micro-organismos tendem naturalmente a se tornar resistentes aos medicamentos disponíveis. Assim, a exploração da diversidade química dos produtos naturais na busca de novos medicamentos pode trazer bons resultados. Nesse processo de descoberta, a Química e a Biologia são áreas da ciência complementares e codependentes. Para se encontrar novos compostos bioativos são necessários os testes biológicos e o composto químico, por sua vez, pode ocasionar a descoberta de novos alvos biológicos (LEE, 2010).
A família Celastraceae
As principais classes de compostos isolados são triterpenos (RAVELO et al., 2008; DE SOUSA et al., 2008), sesquiterpenos (RAVELO et al., 2008; BAZZOCCHI et al., 2008), alcaloides (DE SOUSA et al., 2008), flavonoides (DE SOUSA et al., 2008) e esteroides glicosilados (DUARTE, 2000). Dessas classes, os triterpenos pentacíclicos são os mais abundantes, dentre os quais destacam-se: friedelanos, oleananos, ursanos e lupanos. Vários triterpenos pentacíclicos e seus derivados foram reportados na literatura por apresentarem atividade biológica (Figura 9). Atividade anti-inflamatória, analgésica e antipirética foram atribuídas ao 3-oxo-friedelano (friedelina) (ANTONISAMY et al., 2011). O ursano
α-amirina apresentou atividade contra Staphylococcus aureus (ABREU et al., 2011) e atividades antiurolítica, antioxidante, anti-inflamatória, hepatoprotetora e antilipidêmica foram observadas para o lupeol (SUDHAHAR et al., 2008).
Figura 9: Alguns triterpenos pentacíclicos biologicamente ativos.
O gênero
Maytenus
O gênero Maytenus é um dos maiores da família Celastraceae (SANTOS et al., 2007) e, no Brasil, são reconhecidas 76 espécies de Maytenus (NIERO at al., 2011). As espécies Maytenus ilicifolia Martius ex Reiss e M. aquifolium Mart. constituem exemplos de plantas da família Celastraceae que são amplamente utilizadas na medicina popular brasileira. São ingeridas na forma de infusão aquosa para o tratamento de úlcera gástrica e outras afecções intestinais (OLIVEIRA, 2004). As cascas de Maytenus rigida são utilizadas para o tratamento de inflamação, úlcera e diarréia (SANTOS et al., 2007). Muitos metabólitos
O
Friedelina
HO
α-amirina
HO
H
bioativos foram isolados de espécies de Maytenus, tais como maitenosídeos com atividade inseticida (MADRIGAL et al., 1985), alcaloides piridínicos sesquiterpênicos com ação fagorrepulssiva e imunodepressora, poliésteres sequiterpênicos com atividade antitumoral (SHIROTA et al., 1994, GONZÁLEZ et al., 2000), triterpenos quinonoides e triterpenos diméricos que apresentam ação antimicrobiana (GONZÁLEZ et al., 1996; AVILLA et al., 2001) e sesquiterpenos que inibem a resistência do parasita Leishmania a alguns fármacos (RAVELO et al., 2008).
Várias espécies de Maytenus são utilizadas na medicina popular contra úlceras estomacais (OLIVEIRA, 2004). O exemplo mais clássico é a utilização do extrato seco de folhas de M. ilicifolia (espinheira santa) empregado na produção de um fitoterápico utilizado como protetor gástrico. Existem estudos que sugerem o uso de M. robusta em substituição à M. ilicifolia que encontra- se em estágio de extinção devido ao uso indiscriminado no Brasil (DE ANDRADE et al., 2007).
A espécie
Maytenus robusta
Reiss
M. robusta (Figuras 10 e 11, pág. 11) é uma espécie utilizada na medicina popular para o tratamento de úlceras estomacais e é bem adaptada ao sul do Brasil. A espécie é conhecida popularmente como espinheira santa ou cancerosa e, morfologicamente, similar à M. ilicifolia (NIERO at al., 2011). M. robusta pode ser encontrada tanto na vegetação de restinga dos Estados de Santa Catarina, Paraná e São Paulo, como no interior da floresta (CARVALHO-OKANO, 1992). Em Minas Gerais, existem exemplares no Parque Estadual do Itacolomi, situado na cidade de Ouro Preto. A espécie apresenta de 6 a 12 m de altura e devido ao seu porte, tem tido utilização ornamental e, pelo interesse pela fauna, é também recomendada para a composição de reflorestamentos heterogêneos destinados ao repovoamento de áreas degradadas (BERKENBROCK E PAULILO, 2009).
al., 2008) e antinociceptiva (NIERO et al., 2006) foram atribuídas ao 3,15-dioxo-21α-hidroxifriedelano. Niero e colaboradores (2001) relataram que M. robusta apresenta o triterpeno friedelina em quantidade três vezes maior do que a encontrada em M. ilicifolia.
Figura 10: Maytenus robusta, exemplar do Parque Estadual
do Itacolomi, Ouro Preto – MG (Fotos: autora).
Figura 11: Maytenus robusta (Fotos: Anita Stival e Marcio Verdi,
OBJETIVOS
Objetivos do trabalho
Pretendeu-se dar continuidade às pesquisas com éspecies da família
Celastraceae, buscando identificar novos metabólitos bioativos e/ou que
contribuam para o estudo quimiotaxonômico de Maytenus robusta. Neste
contexto, o grande interesse do presente trabalho envolveu: a realização do
estudo fitoquímico de folhas de Maytenus robusta, buscando a obtenção de
metabólitos ainda não relatados; a realização de um estudo detalhado de
confirmação estrutural dos metabólitos secundários isolados, utilizando métodos
espectroscópicos; o estabelecimento de relações fitoquímicas entre espécies da
família Celastraceae e contribuição para o estudo quimiotaxonômico; e a
realização de estudos de atividade biológica de extratos e das substâncias
1 – ESTUDO FITOQUÍMICO
1.1 – Parte Experimental
1.1.1 – Métodos gerais
Nesse trabalho foi adotado como critério preliminar de pureza a visualização de uma única mancha em cromatoplaca obtida por cromatografia em camada delgada (CCD), utilizando eluentes com diferentes polaridades.
Na preparação das cromatoplacas utilizou-se suspensão de sílica gel 60 G em água (7 g para cada 15 mL), formando camada de 0,25 mm de espessura sob suporte de vidro. Após secagem parcial à temperatura ambiente, as placas foram
ativadas em estufa a 100 ºC durante prazo mínimo de 30 minutos. Como reveladores utilizaram-se luz ultravioleta e pulverização com solução de vanilina
em álcool etílico (1:99) e solução de ácido perclórico em água (3:97), recém misturadas na proporção de 1:1 v/v, seguida por aquecimento em estufa a 100 ºC. As placas de cromatografia em camada preparativa de sílica gel foram preparadas com 0,75 mm de espessura.
Para o preparo de colunas cromatográficas clássicas (CC) utilizou-se sílica
gel 60 (70-230 Mesh). Os solventes empregados nas análises cromatográficas
foram hexano, clorofórmio, acetato de etila e metanol. A reutilização desses solventes, quando em mistura e para a mesma coluna, foi realizada após correção das proporções das misturas usando refratômetro modelo Biobrix.
Para teste de Liebermann Burchard (MATOS, 1988) as amostras foram solubilizadas em pequena quantidade de clorofórmio e adicionaram-se 1 mL de anidrido acético e algumas gotas de ácido sulfúrico, ambos concentrados.
As faixas de fusão foram determinadas em aparelho Microquímica MQAPF-302. Também foram utilizados os métodos de análises térmicas: termogravimetria (TG), análise térmica diferencial (DTA) e calorimetria diferencial de varredura ou exploratória (DSC). Os equipamentos empregados foram DTG-60 Shimadzu e
DSC-60 Shimadzu.
As rotações ópticas específicas foram medidas em polarímetro Perkin Elmer 341 do Laboratório de Quimio e Bioprospecção de Plantas do Cerrado (CerQBio) do DQ da UFMG, utilizando um tubo de 1 dm.
Espectros de absorção na região do infravermelho foram obtidos utilizando, quando necessário, pastilhas de KBr [1% (m/m)]. Os equipamentos usados foram espectrômetro Shimadzu IR-408 do Departamento de Química, UFMG e o espectrômetro modelo Spectrum One Perkin Elmer do Laboratório de Química Farmacêutica da Faculdade de Farmácia da UFMG. O último possui dispositivo ATR permitindo que o espectro seja obtido diretamente da amostra sólida sem a necessidade do uso de pastilha.
Os espectros de RMN de 1D e 2D foram obtidos em espectrômetros Bruker
Avance DPX-200 e DRX-400 do Laboratório de Ressonância Magnética de Alta
Resolução (LAREMAR) do Departamento de Química, UFMG. Solventes deuterados utilizados encontram-se indicados em cada caso. Os deslocamentos
químicos (δ) foram registrados em ppm usando tetrametilsilano (TMS) como
padrão de referência interna e as constantes de acoplamento (J) dadas em Hz.
Cromatografia gasosa foi realizada utilizando cromatógrafo HP5890 do Laboratório de Cromatografia do Departamento de Química, UFMG.
1.1.2 – Coleta e identificação do material vegetal
Folhas de Maytenus robusta (Celastraceae) foram coletadas no Parque
Estadual do Itacolomi, situado na cidade de Ouro Preto – MG, em junho de 2010 pelo Prof. Dr. Sidney Augusto Vieira Filho da Escola de Farmácia da Universidade Federal de Ouro Preto (UFOP).
O material vegetal foi identificado pela Profa. Maria Cristina Teixeira Braga Messias do Departamento de Biodiversidade, Evolução e Meio Ambiente do
Instituto de Ciências Exatas e Biológicas (ICEB) da UFOP. Uma exsicata do
especimen (Nº. OUPR 25559) encontra-se depositada no Herbário Professor José
1.1.3 – Preparação dos extratos das folhas de Maytenus robusta
Após secagem a temperatura ambiente, as folhas foram pulverizadas em moinho de martelos e obtiveram-se 864,4 g. Os extratos das folhas pulverizadas foram preparados empregando extração exaustiva por maceração à temperatura ambiente. Foram utilizados hexano, clorofórmio, acetato de etila e metanol puros. Após filtração, a remoção dos solventes por destilação sob pressão reduzida, conduziram aos respectivos extratos. Durante a remoção parcial do solvente dos extratos em hexano e clorofórmio houve precipitação de sólidos que foram separados por processo de filtração sob pressão reduzida. A preparação dos extratos está esquematizada na Figura 12, página 16.
A nomenclatura dos extratos foi feita da seguinte forma: letra E, para extrato; H para hexânico; C para clorofórmico; A para acetato etílico; M para metanólico e F para folhas. Para os sólidos, foi incluída a letra S no início da nomenclatura. Assim, o sólido obtido do extrato hexânico das folhas foi identificado como SEHF e o proveniente do extrato clorofórmico como SECF.
A notação empregada para codificar as substâncias ou misturas isoladas
durante o estudo fitoquímico do extrato hexânico das folhas de Maytenus robusta
Figura 12: Esquema da obtenção dos extratos de folhas de M.robusta.
Folhas moídas m = 864,4 g
Torta 1
Torta 3
1- Extração com clorofórmio 2- Filtração
1- Extração com acetato de etila
2- Filtração
1- Extração com metanol Extrato em hexano
1- Remoção parcial do solvente em rotavapor 2- Filtração
Filtrado
Remoção total do solvente
Extrato (EHF) m = 31,43 g Sólido do extrato
(SEHF) m = 4,51 g
1- Remoção parcial do solvente em rotavapor 2- Filtração
Filtrado
Extrato (ECF) m = 18,49 g Sólido do extrato
(SECF) m = 1,78 g
2- Filtração 1- Extração com hexano
Extrato em clorofórmio
Remoção total do solvente
Torta 2
Extrato em acetato de etila
Remoção total do solvente
Extrato (EAF) m = 5,74 g
2- Filtração
Extrato em metanol Torta 4
1.1.4 – Elaboração de SEHF
SEHF (4,51 g) foi obtido como um sólido de coloração ligeiramente verde durante a preparação do extrato hexânico. Apresentou resultado positivo para triterpenos pentacíclicos no teste de Liebermann-Burchard. Realizou-se análise por CCD de SEHF utilizando padrões dos triterpenos pentacíclicos friedelina e
β-friedelinol, os quais são comumente encontrados em membros da família
Celastraceae, as duas substâncias foram identificadas como possíveis
constituintes do sólido. SEHF foi submetido à CC (Coluna A), utilizaram-se 4,51 g
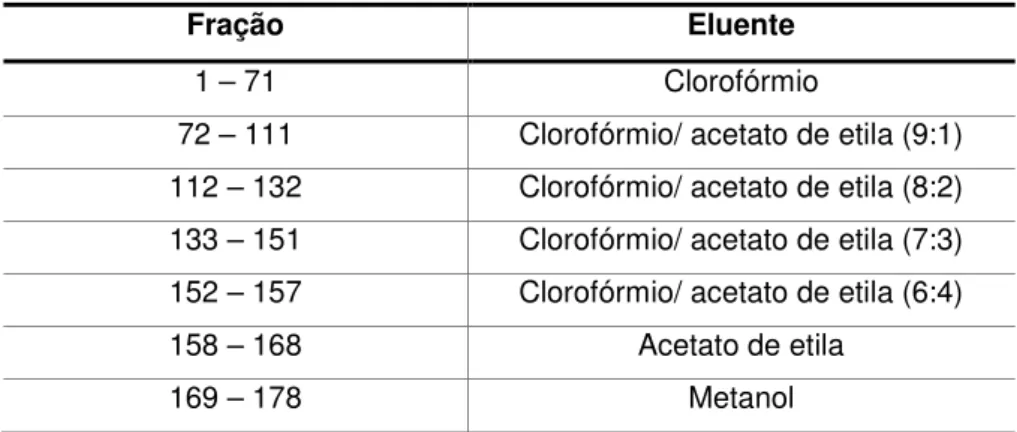
da amostra e 242,7 g de sílica gel 60 (70-230 Mesh). Os eluentes empregados foram clorofórmio, acetato de etila e metanol, puros ou em misturas, em ordem crescente de polaridade. Foram coletadas 178 frações de aproximadamente 50 mL cada (Tabela 2).
Tabela 2. Frações obtidas da coluna A e eluentes utilizados
Fração Eluente
1 – 71 Clorofórmio
72 – 111 Clorofórmio/ acetato de etila (9:1)
112 – 132 Clorofórmio/ acetato de etila (8:2)
133 – 151 Clorofórmio/ acetato de etila (7:3)
152 – 157 Clorofórmio/ acetato de etila (6:4)
158 – 168 Acetato de etila
169 – 178 Metanol
Algumas frações foram consideradas mais promissoras de acordo com a massa e análise por CCD e foram reunidas em 6 grupos (Figura 13, pág. 19). Frações com massas muito pequenas e que apresentaram várias manchas em CCD não foram trabalhadas.
Grupo A1 (frações 12 a 16). Foi obtido como um sólido branco (102,0 mg)
com faixa de fusão de 251-254 ºC. A análise por CCD, comparação com amostras
autênticas de 3-oxofriedelano e 3 -hidroxifriedelano e os espectros de RMN de 1H
Grupo A2 (frações 17 a 50). Esse grupo foi obtido como um sólido branco
(3,32 g). A análise por CCD empregando amostras autênticas de 3-oxofriedelano
e 3β-hidroxifriedelano e os experimentos de RMN de 1H e 13C indicaram tratar-se
da mistura desses dois compostos codificados como MR01 e MR02.
Grupo A3 (frações 51 a 71). Foi obtido como um sólido branco (163,0 mg)
com faixa de fusão de 271-276 ºC. O sólido foi submetido à cromatografia em
camada delgada e comparado com uma amostra autêntica de 3β
-hidroxifriedelano, indicando tratar-se dessa mesma substância. Espectros no IV e
RMN de 1H e 13C foram obtidos e confirmou-se que o composto tratava-se de 3β
-hidroxifriedelano (MR02).
Grupo A4 (frações 86 a 89). O grupo foi obtido como um sólido amarelo
amorfo (90,0 mg). Foram observadas na cromatoplaca duas manchas quase sobrepostas. Após adição de éter etílico na amostra, houve precipitação de um sólido branco que foi filtrado sob pressão reduzida, obtendo-se 10,8 mg. A análise
dos espectros no IV, RMN de 1H e 13C indicou tratar-se de mistura de 3-oxo-11β
-hidroxifriedelano (MR03) e 3-oxo-29-hidroxifriedelano (MR04).
Grupo A5 (frações 120 e 121). Foi obtido como um sólido branco (6,0 mg)
e apresentou uma única mancha em CCD. Foram obtidas curvas de TG, DTA e
DSC e observou-se que o composto começa a decompor próximo de 163 ºC.
A análise dos espectros no IV, RMN de 1H e 13C (1D/2D) permitiu elucidar a
estrutura química do composto inédito, identificado como 3β,11β
-di-hidroxifriedelano (MR05).
Grupo A6 (122 a 131). Foi obtido como um sólido branco amorfo (54,0
mg). Apresentou várias manchas em CCD, sendo que a de maior intensidade
apresentou o mesmo Rf do 3β,11β-dihidroxifriedelano. Esse grupo foi submetido a
outra CC (Coluna B) utilizando-se 47,94 g de sílica gel 60 (70-230 Mesh). Os
eluentes foram clorofórmio, acetato de etila e metanol, puros ou em misturas em gradiente de polaridade. Obtiveram-se 38 frações de aproximadamente 30 mL
Esse subgrupo (15,5 mg) foi comparado com amostra autêntica de 3β,11β
-dihidroxifriedelano (MR05) em CCD e ambos apresentaram o mesmo Rf. As
demais frações apresentaram massa muito pequena e não foram trabalhadas.
Do sólido obtido durante a preparação do extrato hexânico, foi possível
isolar 5 substâncias (algumas como misturas), conforme está representado na Figura 13.
Figura 13: Esquema dofracionamento de SEHF.
1.1.5 – Elaboração de EHF
O extrato hexânico das folhas de Maytenus robusta (EHF) foi submetido à
CC (coluna C), utilizaram-se 31,43 g da amostra e 509,3 g de sílica gel 60 (70-230
Mesh). Os eluentes utilizados foram hexano, clorofórmio, acetato de etila e metanol, puros ou em misturas, em ordem crescente de polaridade. Foram obtidas 304 frações de aproximadamente 250 mL cada (Tabela 3). Após análise por CCD, algumas frações foram reunidas em 9 grupos (Figura 14, pág. 26).
SEHF 4,51 g
A2
17-50
A1
12-16
A3
51-71
A6
122-131
B1
19-27
MR01 (2,3%)
MR02
MR01 MR03
MR05 (0,5%; A5 + B1)
MR04 MR05
MR02 (3,6%)
MR01: 3-oxofriedelano
MR02: 3β-hidroxifriedelano
MR03: 3-oxo-11β-hidroxifriedelano
MR04: 3-oxo-29-hidroxifriedelano
MR05: 3β,11β-di-hidroxifriedelano
Coluna A
Coluna B A4
86-89
A5
120-121
Frações com massas muito pequenas e que apresentaram várias manchas em CCD não foram trabalhadas.
Tabela 3. Frações obtidas da coluna C e eluentes utilizados
Fração Eluente
1 – 71 Hexano
72 – 97 Hexano/clorofórmio (9:1)
98 – 134 Hexano/clorofórmio (8:2)
135 – 174 Hexano/clorofórmio (7:3)
175 – 206 Hexano/clorofórmio (5:5)
207 – 242 Clorofórmio
243 – 265 Clorofórmio/acetato de etila (5:5)
266 – 296 Acetato de etila
297 – 304 Metanol
Grupo C1 (fração 3). Foi obtido como um sólido branco amorfo (400,7 mg)
com faixa de fusão de 61-65 ºC. A fração foi identificada como mistura de
hidrocarbonetos (MR06), após análise do espectro no IV, de RMN e
cromatograma de CG. De acordo com o cromatograma obtido, os principais constituintes da amostra foram C27 (12,8%), C29 (36,4%), C30 (2,7%), C31
(27,6%) e C32 (6,7%).
Grupo C2 (fração 4). Foi obtido como um sólido branco amorfo (861,9 mg)
com faixa de fusão de 58-62 ºC. Essa fração também foi identificada como mistura de hidrocarbonetos após análise do espectro no IV e cromatograma de CG. A partir do cromatograma, concluiu-se que os principais constituintes da mostra são C27 (13,8%), C28 (1,6%), C29 (42,0%), C30 (2,9%) e C31
(26,3%). Essa amostra também foi codificada como MR06.
Grupo C3 (frações 6 e 7). Esse grupo foi obtido como um óleo viscoso de
hidrocarboneto sesquiterpênico 2,6,11-trimetildodeca-2,6,10-trieno
(tanaceteno) (MR07).
Grupo C4 (frações 104 a 106). Foram observadas várias manchas para
esse grupo em CCD. O grupo (1,27 g) foi submetido à CC (coluna D).
Utilizaram-se 124,06 g de sílica gel 60 (70-230 Mesh). Os eluentes foram hexano, clorofórmio, acetato de etila e metanol, puros ou em misturas, em ordem crescente de polaridade. Obtiveram-se 305 frações de aproximadamente 10 mL cada (Tabela 4). Após análise por CCD, as frações 59 a 79 foram consideradas mais promissoras e reagrupadas no subgrupo D1. As demais frações não foram trabalhadas por apresentarem massas muito pequenas e várias manchas em CCD.
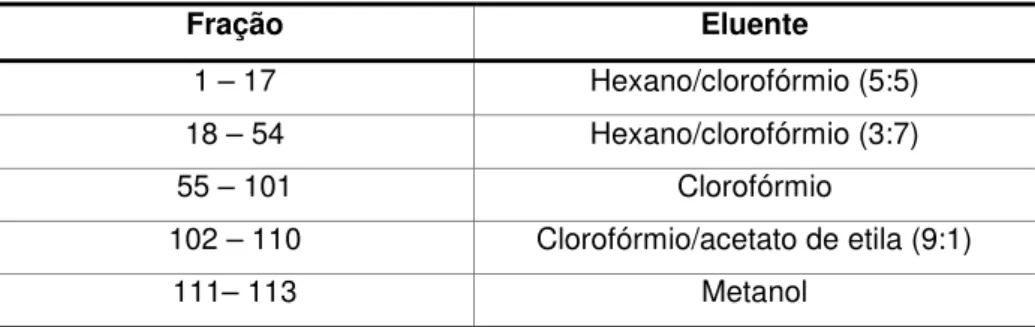
Tabela 4. Frações obtidas da coluna D e eluentes utilizados
Subgrupo D1 (frações 59-79). Esse subgrupo (88,2 mg) apresentou
aspecto de cera. Após adição de hexano houve precipitação de um sólido branco
(13,5 mg), o qual foi filtrado sob pressão reduzida. Espectros de RMN foram obtidos para o sólido e comparados com dados da literatura, concluiu-se que se
tratava da mistura de 3-oxofriedelano (MR01) e 3-oxo-21β-H-hop-22(29)-eno
(MR08).
Fração Eluente
1 – 76 Hexano/clorofórmio (5:5)
77 – 104 Hexano/clorofórmio (4:6)
105 – 150 Hexano/clorofórmio (3:7)
151 – 182 Hexano/clorofórmio (1:9)
183 – 226 Clorofórmio
227 – 258 Clorofórmio/acetato de etila (2:8)
259 – 276 Clorofórmio/acetato de etila (5:5)
277 – 293 Acetato de etila
Grupo C5 (frações 107 a 130). A esse grupo (1,79 g) foi adicionado
hexano e ocorreu precipitação de um sólido branco que foi filtrado sob pressão reduzida levando à obtenção de 624 mg deste sólido. Fez-se CCD comparando o sólido com amostra autêntica de 3-oxofriedelano, ambos apresentaram o mesmo Rf. Espectros de RMN e IV foram obtidos e permitiram concluir que o sólido obtido
tratava-se de 3-oxofriedelano (MR01).
Grupo C6 (frações 131 a 137). A partir da análise por CCD utilizando
amostras autênticas de 3-oxofriedelano e de 3β-hidroxifriedelano observou-se a
presença das duas substâncias. Após a adição de hexano houve precipitação de sólido o qual foi filtrado sob pressão reduzida. A partir de espectros de RMN e IV,
o sólido obtido (98,7 mg) foi identificado como mistura de 3-oxofriedelano (MR01)
e 3β-hidroxifriedelano (MR02).
Grupo C7 (frações 138 a 150). Nesse grupo houve formação de um
precipitado branco após adição de hexano e o sólido (566,1 mg) foi separado através de filtração sob pressão reduzida. Empregando CCD, o sólido foi
comparado com amostra autêntica de 3β-hidroxifriedelano e ambos apresentaram
o mesmo Rf. Espectros de RMN e no IV foram obtidos e concluiu-se que o sólido
tratava-se de 3β-hidroxifriedelano (MR02).
Grupo C8 (frações 151 a 172). Foram observadas várias manchas para
esse grupo em CCD. Fez-se uma nova CC (coluna E) a fim de se isolar
Tabela 5. Frações obtidas da coluna E e eluentes utilizados
Subgrupo E1 (frações 52 a 71). O subgrupo foi obtido como um sólido
amorfo, apresentou várias manchas em CCD e foi submetido a nova CC (Coluna
F), utilizaram-se 777,3 mg de amostra e 55,21 g de sílica gel 60 (70-230 Mesh).
Os eluentes foram hexano, acetato de etila e metanol, puros ou em misturas, em ordem crescente de polaridade. Obtiveram-se 60 frações de aproximadamente 5 mL cada. As frações 31 a 39 foram agrupadas em um subgrupo. Não se trabalharam as demais frações por apresentarem massa muito pequena e várias manchas em CCD.
Subgrupo F1 (frações 31 a 39). As frações foram obtidas como um sólido
amorfo de coloração amarela. Após adição de hexano houve precipitação de um sólido branco (14,1 mg) que foi filtrado sob pressão reduzida. Esse sólido apresentou uma única mancha em CCD e faixa de fusão de 184-187 ºC. Foram
obtidos espectros de RMN de 1H e 13C (1D/2D) e o sólido foi identificado como
3,4-seco-friedelan-3,11β-olideo (MR09), substância inédita.
Subgrupo E2 (frações 72 a 99). O subgrupo (1,80 g) foi obtido como um
sólido com aspecto de cera e apresentou várias manchas em CCD. Após adição de etanol ocorreu precipitação de um sólido branco que foi filtrado e, posteriormente, recristalizado em etanol. O sólido recristalizado foi filtrado sob pressão reduzida e obtiveram-se 289,0 mg. Fez-se CCD empregando amostra
autêntica de 3β-hidroxi-20(29)-lupeno (lupeol) e observou-se uma mancha de
coloração lilás e Rf semelhante ao observado para o lupeol. O sólido foi analisado
por espectroscopia no IV e de RMN de 1H e 13C (1D/2D), o que indicou que o
Fração Eluente
1 – 17 Hexano/clorofórmio (5:5)
18 – 54 Hexano/clorofórmio (3:7)
55 – 101 Clorofórmio
102 – 110 Clorofórmio/acetato de etila (9:1)
sólido não estava puro. O principal componente foi identificado como 3β
-hidroxi-21β-H-hop-22(29)-eno (MR10). O sólido recristalizado foi submetido a uma nova
CC (coluna G) a fim de purificá-lo. Utilizaram-se 272,6 mg de amostra e 22,9 g de
sílica gel 60 (70-230 Mesh). Os eluentes foram clorofórmio, acetato de etila e metanol, puros ou em misturas, em ordem crescente de polaridade. Obtiveram-se 62 frações de aproximadamente 5 mL. Após análise por CCD, as frações 20 a 35 e 42 a 53 foram agrupadas em dois subgrupos. Não se trabalharam as demais frações por apresentarem massas muito pequenas.
Subgrupo G1 (frações 20 a 35). Foi obtido como um sólido branco (103,0
mg), apresentou uma única mancha em CCD e faixa de fusão de 217-221 ºC. A
análise por espectroscopia no IV, de RMN de 1H e 13C indicou tratar-se de 3β
-hidroxi-21β-H-hop-22(29)-eno (MR10).
Subgrupo G2 (frações 42 a 53). Foi obtido como um sólido branco amorfo
(14,90 mg) com faixa de fusão de 80-84 ºC. A análise por espectroscopia no IV,
de RMN de 1H e 13C indicou tratar-se do ácido hentriacontanóico (ácido melíssico)
(MR11).
O sobrenadante obtido a partir da recristalização do subgrupo E2 foi
submetido à CC (Coluna H). Utilizou-se 1,4919 g da amostra e 81,5 g de sílica gel
60 (70-230 Mesh). Os eluentes foram clorofórmio, acetato de etila e metanol, puros ou em misturas, em ordem crescente de polaridade. Obtiveram-se 100 frações de aproximadamente 5 mL. As frações 28 a 53 foram reunidas em um subgrupo. Não se trabalharam as demais frações por apresentarem massas muito pequenas e várias manchas em CCD.
Subgrupo H1 (frações 28 a 53). Para esse grupo (493,9 mg) foram
observadas várias manchas em CCD e uma delas apresentou o mesmo Rf que
MR10. Realizou-se CC (coluna I) a fim de se obter maior quantidade de MR10.
As frações 53 a 57 e 58 a 93 foram agrupadas em dois subgrupos. Não se trabalharam as demais frações por apresentarem massas muito pequenas e várias manchas em CCD.
Subgrupo I1 (frações 53 a 57). O subgrupo (27,9 mg) apresentou aspecto
de cera e observaram-se duas manchas em CCD, sendo que uma delas
apresentou o mesmo Rf que MR10.
Subgrupo I2 (frações 58 a 93). Foi obtido como um sólido branco (409,7
mg) e, quando submetido a CCD, exibiu apenas uma mancha com mesmo Rf de
MR10. A partir da análise de espectros de RMN de 1H e 13C concluiu-se que o
sólido tratava-se de MR10.
Grupo C9 (frações 173-209). Esse grupo (1,90 g) apresentou algumas
manchas em CCD, foi considerado promissor e submetido a uma nova coluna cromatográfica (coluna J). Utilizaram-se 255,3 g de sílica gel 60 (70-230 Mesh).
Os eluentes foram hexano, clorofórmio, acetato de etila e metanol, puros ou em misturas, em ordem crescente de polaridade. Foram obtidas 200 frações de aproximadamente 30 mL cada. As frações 88 a 89 e 90 a 92 foram reunidas de acordo com o perfil cromatográfico em CCD e reunidas em dois subgrupos. Não se trabalharam as demais frações por apresentarem massas muito pequenas e várias manchas em CCD.
Subgrupo J1 (frações 88 a 89). Esse grupo (148,7 mg) apresentou uma
única mancha em CCD mesmo com a utilização de diferentes misturas de solventes como eluentes. Após adição de hexano na amostra ocorreu precipitação de um sólido branco (59,5 mg) que foi filtrado sob pressão reduzida. O sólido foi identificado a partir da análise de espectros no IV e RMN como
mistura de ácido 3,4-seco-21β-H-hop-22(29)-en-3-óico e de ácido 3,4-seco
-friedelan-3-óico (MR12) e (MR13).
Subgrupo J2 (frações 90-92). Nesse subgrupo (244,7 mg), após a adição de
tentativas utilizando diferentes misturas de solventes como eluentes. O sólido foi identificado a partir de espectros no IV e de RMN como mistura de ácido
3,4-seco-friedelan-3-óico (MR13) e sitosterol (MR14). Fez-se CCD preparativa na
tentativa de separar as substâncias, mas não foi possível obtê-las puras.
Do extrato hexânico foi possível isolar 11 substâncias (algumas como
misturas), conforme está representado na Figura 14.
EHF
(31,433 g)
C2
4
C1
3
C3
6-7
C4
104-106
C5
107-130
C7
138-150
MR07 (3,2%)
MR08 MR01
MR02 (1,8%)
MR01 (2,0%)
MR06
C6
131-137
C8
151-172
MR12
MR10 MR14
MR13
MR10 (1,63 %; I2 + G1)
MR01: 3-oxofriedelano
MR02: 3β-hidroxifriedelano
MR06: mistura de hidrocarbonetos
MR07: 2,6,11-trimetildodeca-2,6,10-trieno
MR08: 3-oxo-21β-H-hop-22(29)-eno
MR09: 3,4-seco-friedelan-3,11β-olídeo
MR10: 3β-hidroxi-21β-H-hop-22(29)-eno
MR11: ácido hentriacontanóico
MR12: ácido3,4-seco-21β-H-hop-22(29)-en-3-óico
MR13: ácido 3,4-seco-friedelan-3-óico
MR14: sitosterol
C9
173-209
D1
59-79
MR01 MR02
Coluna C
Coluna D
Coluna E
Coluna G Coluna H
Coluna I
E1
52-71
E2
72-99
F1
31-39
Recristalização (EtOH)
Sólido Sobrenadante
G1
20-35
G2
42-53
MR11(0,05%)
H1
28-53
I1
53-57
I2
58-93
J1
88-89
J2
90-92
Coluna F
MR09
(0,04%)
MR13
MR06 (0,4%; C1 + C2)
(0,04%)
(0,3%)
(0,02%) (0,03%)
Coluna J
1.2 – Determinação Estrutural
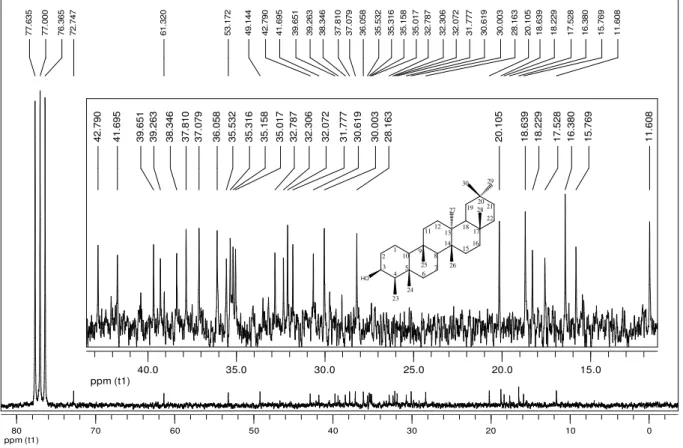
1.2.1 – MR01: 3-oxofriedelano (friedelina)
MR01 apresentou-se como um sólido branco cristalino com faixa de fusão
de 251-254 ºC e foi isolado a partir do sólido obtido durante a remoção do
solvente para a obtenção do extrato hexânico das folhas de M. robusta (SEHF)
(Figura 13, pág. 19). MR01 também foi obtido a partir do fracionamento do extrato
hexânico das folhas de M. robusta (EHF) (Figura 14, pág. 26). O teste LB foi
positivo para triterpenos pentacíclicos. A análise por CCD desse sólido utilizando
diferentes eluentes evidenciou a existência de uma única mancha após revelação
com solução de ácido perclórico e vanilina.
O espectro na região do IV (Figura 15, pág. 28) de MR01 apresenta
bandas em 2926 cm-1 característica de estiramento assimétrico da ligação CH de
grupos CH2 de grupos alifáticos, em 2868 cm-1 característica de estiramento
simétrico da ligação CH de grupos CH2 e CH3 de grupos alifáticos, em 1461 e
1389 cm-1 características de deformação angular no plano de ligação simples CH
de grupos alquilas e em 1711 cm-1 característica de estiramento de ligação CO de
carbonila de cetona.
1 2 3
4 5
6 7 8 9 10
11 12 13
14
15 16
17 18
19 20
21
22
23 24
25 26
27 28
30 29