Wendy Marina Toscano Queiroz de Medeiros
Síntese e caracterização de complexo tetranuclear de cobre
com o ligante resorcinareno
_______________________________________
Dissertação de Mestrado
1
WENDY MARINA TOSCANO QUEIROZ DE MEDEIROS
SÍNTESE E CARACTERIZAÇÃO DE COMPLEXO TETRANUCLEAR DE COBRE COM
O LIGANTE RESORCINARENO
Dissertação apresentada ao Programa de Pós-Graduação em Química, como um dos requisitos para obtenção do grau de Mestre em Química, pela Universidade Federal do Rio Grande do Norte.
Orientador (a): Prof.ª Dra. Ana Cristina Facundo de Brito Pontes
Co-orientador: Prof. Dr. Daniel de Lima Pontes
NATAL, RN
Divisão de Serviços Técnicos
Catalogação da Publicação na Fonte. UFRN Biblioteca Setorial do Instituto de Química
Medeiros, Wendy Toscano Queiroz de
Síntese e caracterização de complexo tetranuclear de cobre com o ligante resorcinareno / Wendy Marina Toscano Queiroz de Medeiros. - Natal, RN, 2014.
204 f. : il.
Orientadora: Ana Cristina Facundo de Brito Pontes. Co-orientador: Daniel de Lima Pontes.
Dissertação (Mestrado em Química) - Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química. Afetividade. Química. Aulas experimentais.
1.Fenantrolina. - Dissertação. 2. Compostos de Coordenação - Dissertação. 3. Cobre - Dissertação. 4. Resorcinareno – Dissertação. I. Pontes, Ana Cristina Facundo de Brito. II. Pontes, Daniel de Lima. III. Universidade Federal do Rio Grande do Norte. III. Título.
AGRADECIMENTOS
Primeiramente agradeço a DEUS, por me abençoar e iluminar os meus passos a cada
dia, sempre me dando forças para superar os obstáculos que encontro ao longo de minha
caminhada. Obrigada meu Deus por mais uma vitória alcançada em minha vida.
Aos meus pais, Joana Queiroz e Francisco Toscano, meu infinito agradecimento. Vocês
são a minha referência, minha fonte de inspiração, meu porto seguro. Obrigada por toda
confiança, por me ensinarem a lutar pelos meus ideais e pelo amor incondicional.
Às minhas irmãs Tuyanne Medeiros e Sayama Toscano, que me dão força e me ajudam
quando preciso.
Ao meu namorado Michell Nascimento, por seu amor, carinho, apoio e compreensão
nos momentos em que estive ausente para me dedicar a este trabalho. Obrigada pela confiança
que você sempre depositou em mim.
Ao Prof. Dr. Daniel Pontes, por todos os ensinamentos, orientações, contribuições, e
pela paciência que teve ao longo destes dois anos de trabalho, um exemplo como orientador e
pesquisador.
Aos professores Dra. Ana Cristina, Dr. Ótom Anselmo de Oliveira e Dr. Francisco
Ordelei pelos conselhos, sugestões e colaborações no desenvolvimento deste trabalho.
A todos que fazem parte do Laboratório de Química de Coordenação e Polímeros:
Verônica, Anallicy, Ana Carolina, Nayara, Francimar, Aimée, Mayara, Dayana, Thuanny,
Luciana e Alexsandro, obrigada por toda ajuda e muito incentivo que recebi de vocês ao longo
destes anos, pelas trocas de experiências e momentos de descontrações.
Ao Professor Kássio Michell, pela estima e consideração.
A todos os meus amigos que contribuíram para a realização deste trabalho, dando apoio
e torcendo junto comigo. Em especial, a Fernanda Saadna: Obrigada pela sua confiança, por
sua amizade, paciência em ouvir meus “choros” e por toda força que você me deu ao longo
desta jornada.
Ao Laboratório de Bioinorgânica e Catálise da Universidade Federal do Paraná, na
pessoa da professora Dra. Shirley Nakagaki, pela contribuição com as análises de EPR.
Ao Professor Dr. Valter Ferreira do Centro de Biociências da UFRN, pela parceria com
4
À central analítica, na pessoa do técnico Joadir e a todos do Instituto de Química da
Universidade Federal do Rio Grande do Norte que contribuíram direta ou indiretamente para a
realização deste trabalho.
Ao programa de Pós-Graduação em Química da UFRN e a CAPES pela ajuda
financeira, com a concessão de bolsa de estudo.
A todos aqueles que de alguma forma contribuíram no processo de desenvolvimento
RESUMO
Com o presente trabalho tem-se como objetivo contribuir para o desenvolvimento da
química de coordenação de macromoléculas como o resorcinareno, com a síntese e
caracterização de novos complexos de cobre com os ligantes cloretos, vanilina e resorcinareno,
todos eles coordenados à fenantrolina, uma molécula que é biologicamente ativa e possui
importantes propriedades em sistemas biológicos. O complexo [(Cu(phen))4(resvan)],
sintetizado a partir da reação direta do resorcinareno com metais, gera várias possibilidades de
coordenação, o que dificulta sua caracterização. Por isso, com o objetivo de limitar os sítios de
coordenação do ligante, o complexo [(Cu(phen))4(resvan)]Cl4 foi formado a partir de uma nova
metodologia de síntese. Os complexos cis-[Cu(phen)Cl2], cis-[Cu(phen)(van)]Cl,
[(Cu(phen))4(resvan)] e [(Cu(phen))4(resvan)]Cl4 foram caracterizados pelas técnicas
espectroscópicas de IV, Uv-Vis e EPR. Através do infravermelho foi possível comprovar a
presença do ligante fenantrolina em todos os complexos sintetizados, bem como a presença do
ligante vanilina no complexo cis-[Cu(phen)(van)]Cl e do ligante resvan no complexo
[(Cu(phen))4(resvan)], além de indicar a formação do resorcinareno no complexo
[(Cu(phen))4(resvan)]Cl4. Os espectros eletrônicos dos compostos de coordenação obtidos
indicaram a presença do ligante fenantrolina, através de suas bandas intensas na região do
ultravioleta. Para o complexo cis-[Cu(phen)(van)]Cl esta técnica indicou ainda a presença do
ligante vanilina, a partir das bandas intraligante da vanilina e de transferência de carga, LMCT.
Além disso, os espectros apresentaram bandas d-d, confirmando a presença de metais nos
compostos formados. A quantidade de átomos de cobre presentes no complexo
[(Cu(phen))4(resvan)]Cl4 foi estimada, a partir da análise comparativa das absorbâncias de
soluções de mesma concentração de [(Cu(phen))4(resvan)]Cl4 e cis-[Cu(phen)(van)]Cl, a qual
indica que estes compostos possuem em suas estruturas átomos de cobre na proporção 4:1. Os
espectros de EPR dos compostos cis-[Cu(phen)Cl2], cis-[Cu(phen)(van)]Cl e
[(Cu(phen))4(resvan)]Cl4 apresentaram perfis axiais, enquanto que o complexo
[(Cu(phen))4(resvan)] apresentou perfis axial e rômbico, indicando uma mudança no ambiente
de simetria do Cu(II) para este complexo. Os ligantes vanilina e resvan foram submetidos a
ensaios biológicos com resultados satisfatórios, ambos apresentando atividade antioxidante e
baixa toxicidade, além da vanilina apresentar certo caráter antitoxoplásmico.
6
ABSTRACT
The main objective of the present work is to contribute to the development of the
coordination chemistry of macromolecules such as resorcinarene with the synthesis and
characterization of new copper complexes with chloride, vanillin and resorcinarene binders, all
coordinated to phenanthroline, a biologically active molecule with important properties in
biological systems. The complex [(Cu(phen))4(resvan)], was synthesized from the direct
reaction of the metals with resorcinarene and generates several possibilities for coordination,
which hinders its characterization. Therefore, in order to limit the coordination sites of the
ligand, the complex [(Cu(phen))4(resvan)]Cl4 was formed from a new synthetic methodology.
The complex cis-[Cu(phen)Cl2], cis-[Cu(phen)(van)]Cl, [(Cu(phen))4(resvan)] and
[(Cu(phen))4(resvan)]Cl4 were characterized by spectroscopic techniques such as IR, UV-vis
and EPR. By using infrared it has been possible to demonstrate the presence of the
phenanthroline ligand in the synthesized complexes, and vanillin in the complex
cis-[Cu(phen)(van)]Cl and resvan ligand in the complex [(Cu(phen))4(resvan)], besides this
indicating the formation of resorcinarene in the complex [(Cu(phen))4(resvan)]Cl4. The
electronic spectra of these coordination compounds indicated the presence of the
phenanthroline ligand, by its intense bands in the ultraviolet region. For the complex
cis-[Cu(phen)(van)]Cl it still indicated the presence of the ligand vanillin based on intraligand
bands of vanillin and charge transfer, LMCT. Furthermore, the spectra showed d-d bands,
confirming the formation of metal compounds. The amount of copper atoms present in the
complex [(Cu(phen))4(resvan)]Cl4 was estimated from a comparative analysis of the
absorbances of solutions of the same concentration of [(Cu(phen))4(resvan)]Cl4 and
cis-[Cu(phen)(van)]Cl, which indicates that these compounds have copper atoms in the ratio 4:1.
The EPR spectra of the complex cis-[Cu(phen)Cl2], cis-[Cu(phen)(van)]Cl and
[(Cu(phen))4(resvan)]Cl4 showed axial profiles, while the complex [(Cu(phen))4(resvan)]
showed of axial and rhombic profiles, indicating a change in the symmetry of the Cu (II) to this
complex environment. The binders vanillin and resvan underwent biological assays with
satisfactory results, both exhibited antioxidant activity and low toxicity, as well vanillin present
antitoxoplásmico character.
LISTA DE FIGURAS
Figura 1 - Estrutura química do Resorcinol... 25
Figura 2 - Estrutura do composto 4-hidroxi-3-metoxibenzaldeído... 26
Figura 3 - Reação de condensação para formação da base de Schiff... 26
Figura 4 - Estrutura dos compostos vanilina, capsaicina, eugenol e ácido ferúlico, com destaque ao grupo vanilóide... 27
Figura 5 - Estrutura química da base de Schiff Valen... 29
Figura 6 - Esquema de formação dos calixarenos... 30
Figura 7 - Derivados de calixarenos... 30
Figura 8 - Complexos com o ligante calixareno... 31
Figura 9 - Mecanismo da condensação ácido catalizada entre resorcinol e aldeído. 32 Figura 10 - Estrutura geral do Resorcinareno... 33
Figura 11 - Diferentes conformações possíveis para resorcinarenos e indicação dos respectivos grupos pontuais... 34
Figura 12 - Esquema de síntese da cavidade do resorcinareno modificado com tetraquinoxalina... 35
Figura 13 - Possibilidades de modificações estruturais do resvan... 36
Figura 14 - Geometrias propostas para complexos de cobre I e II... 37
Figura 15 - Principais processos biológicos envolvendo o cobre no organismo... 38
Figura 16 - Sistema da proteína hemocianina nas formas (a) desoxihemocianina, sem oxigênio e (b) oxihemocianina, após a coordenação do oxigênio aos átomos de Cu... 39
Figura 17 - Estrutura do complexo [Cu(phen)2]+... 41
Figura 18 - Estrutura do complexo cis-[Cu(phen)Cl2]... 41
Figura 19 - Ciclo do Toxoplasma gondii... 42
Figura 20 - Estrutura dos fármacos pirimetamina, sulfadiazina e leucovorina... 43
Figura 21 - Comportamento dos spins na ausência de campo magnético (esquerda) e na presença de campo magnético (direita)... 45
Figura 22 - Rotação de uma partícula eletrizada em torno do seu próprio eixo e o dipolo magnético gerado devido a esta rotação... 45
Figura 23 - Direção dos dipolos magnéticos: direções aleatórias (esquerda) direções alinhadas devido à ação do campo magnético (direita)... 46
Figura 24 - Tipos de interações magnéticas que podem ocorrer no EPR... 47
Figura 25 - Perfis de espectros de EPR idealizados para diferentes simetrias... 48
Figura 26 - Espectros de EPR dos compostos 1-4 em DMSO, a 43K (a) simulação do espectro de EPR... 49
Figura 27 - Espectro de EPR experimental (- - - ) e simulado (-.-.-.-)... 50
Figura 28 - Espectro de EPR do complexo [Cu(pabh)2] em pó à 298K... 50
Figura 29 - Espectro de EPR do complexo [Ni(NH3)6]2+ em solução de amônia a 77K... 51
Figura 30 - Fluxograma da síntese do complexo de partida cis-[Cu(phen)Cl2]... 53
Figura 31 - Estrutura proposta para o complexo de partida cis-[Cu(phen)Cl2]... 54
Figura 32 - Fluxograma da síntese do complexo cis-[Cu(phen)(van)]Cl... 55
Figura 33 - Estrutura proposta para o íon complexo cis-[Cu(phen)(van)]+... 55
Figura 34 - Fluxograma de síntese do resvan... 56
Figura 35 - Estrutura proposta para o resvan... 56
Figura 36 - Fluxograma de síntese do C-Tetrafenil-calix[4]resorcinareno... 57
8
Figura 38 - Fluxograma da síntese do complexo [(Cu(phen))4(resvan)]... 59 Figura 39 - Estrutura proposta para o complexo [(Cu(phen))4(resvan)] obtido
através do procedimento de síntese usual... 59 Figura 40 - Fluxograma de síntese do complexo [(Cu(phen))4(resvan)]Cl4... 60 Figura 41 - Estrutura proposta para o complexo [(Cu(phen))4(resvan)]Cl4 obtido
através do novo procedimento de síntese desenvolvido neste trabalho... 61 Figura 42 - Fluxograma do esquema experimental para os testes biológicos... 65 Figura 43 - Espectro de absorção na região do infravermelho da Vanilina na região
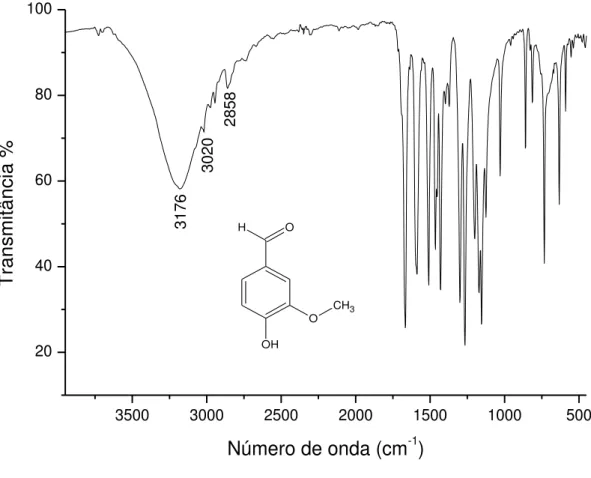
de 4000 a 400 cm-1... 70 Figura 44 - Espectro de absorção na região do infravermelho da Vanilina na região
de 1800 a 400 cm-1... 71 Figura 45 - Espectro de absorção na região do infravermelho do Resorcinol na
região de 4000 a 400 cm-1... 74 Figura 46 - Espectro de absorção na região do infravermelho do Resorcinol na
região de 1750 a 400 cm-1... 75 Figura 47 - Espectro de absorção na região do infravermelho do resvan na região de
4000 a 650 cm-1 (obtido através de ATR)... 76 Figura 48 - Espectro de absorção no infravermelho do resvan na região de 1750 a
650 cm-1 ... 77 Figura 49 - Sobreposição dos espectros de absorção na região do infravermelho dos
compostos vanilina (preto), resorcinol (vermelho) e resvan (verde) na região de 1750 a 400 cm-1... 80 Figura 50 - Sobreposição dos espectros de infravermelho da vanilina (preto) e do
resvan (vermelho) enfatizando a presença das bandas referentes aos modos vibracionais do grupo metóxido nos dois compostos... 81 Figura 51 - Sobreposição dos espectros de infravermelho da vanilina (preto) e do
resvan (vermelho) enfatizando a ausência das bandas referentes aos modos vibracionais do grupo aldeído no espectro do resvan... 82 Figura 52 - Espectro de absorção na região do infravermelho do complexo cis-
[Cu(phen)Cl2] na região de 4000 a 400 cm-1, obtido em pastilhas de KBr... 84 Figura 53 - Espectro de absorção na região do infravermelho do complexo
cis-[Cu(phen)Cl2] na região de 1750 a 400 cm-1... 85 Figura 54 - Espectro de absorção na região do infravermelho do complexo
cis-[Cu(phen)(van)]Cl na região de 4000 a 400 cm-1... 87 Figura 55 - Espectro de absorção na região do infravermelho do complexo
cis-[Cu(phen)(van)]Cl na região de 1750 a 400 cm-1... 88 Figura 56 - Sobreposição dos espectros de infravermelho dos complexos
cis-[Cu(phen)(van)]Cl (preto) e cis-[Cu(phen)Cl2] (vermelho) na região de 1750 a 520 cm-1... 89 Figura 57 - Sobreposição dos espectros de infravermelho dos compostos
cis-[Cu(phen)(van)]Cl (preto) e vanilina (vermelho) na região de 1750 a 1000 cm-1... 91 Figura 58 - Sobreposição dos espectros de infravermelho dos compostos
cis-[Cu(phen)(van)]Cl (preto) e vanilina (vermelho) na região de 1050 a 500 cm-1... 93 Figura 59 - Espectro de absorção na região do infravermelho do complexo
[(Cu(phen))4(resvan)] na região de 4000 a 400 cm-1... 95 Figura 60 - Espectro de absorção na região do infravermelho do complexo
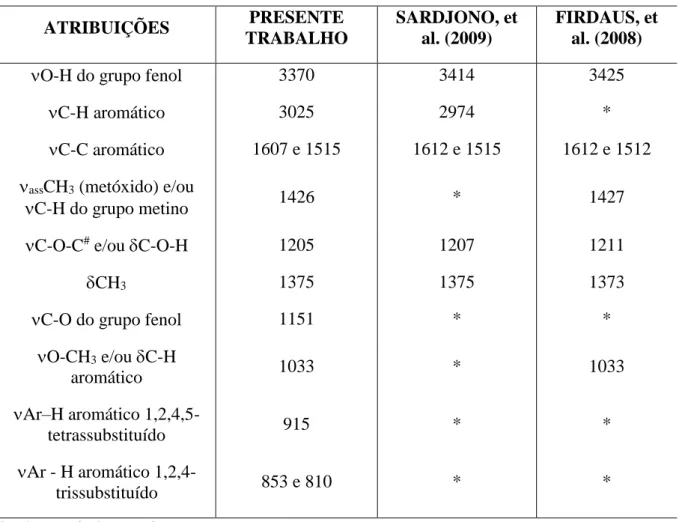
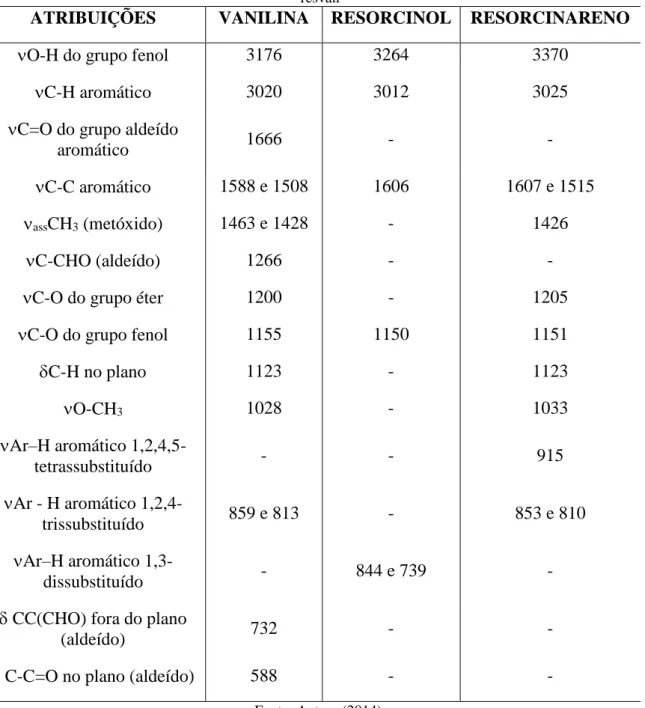
Figura 61 - Sobreposição dos espectros de absorção na região do IV dos compostos resvan (preto), cis-[Cu(phen)Cl2] (vermelho) e [(Cu(phen))4(resvan)] (verde) na região de 4000 a 400 cm-1... 98 Figura 62 - Sobreposição dos espectros de absorção na região do infravermelho do
resorcinareno, complexo cis-[Cu(phen)Cl2] e complexo [(Cu(phen))4(resvan)]Cl4 na região de 1800 a 400 cm-1... 99 Figura 63 - Espectro de absorção na região do infravermelho do complexo
[(Cu(phen))4(resvan)]Cl4 na região de 4000 a 650 cm-1... 101 Figura 64 - Espectro de absorção na região do infravermelho do complexo
[(Cu(phen))4(resvan)]Cl4 na região de 1750 a 650 cm-1... 102 Figura 65 - Sobreposição dos espectros de IV dos compostos cis-[Cu(phen)(van)]Cl
(preto) e [(Cu(phen))4(resvan)]Cl4 (vermelho) enfatizando a ausência das bandas referentes aos modos vibracionais do grupo aldeído no espectro do complexo [(Cu(phen))4(resvan)]Cl4.... 104 Figura 66 - Sobreposição dos espectros de infravermelho dos complexos
[(Cu(phen))4(resvan)] (preto) e [(Cu(phen))4(resvan)]Cl4 (vermelho).... 105 Figura 67 - Espectro Eletrônico da vanilina obtido em meio aquoso, concentração
5,85. 10-5 mol L-1... 108 Figura 68 - Sobreposição dos espectros da vanilina obtidos em meio aquoso, em
DMF e em metanol, na região de 270 a 800 nm, representados em preto, vermelho e verde, respectivamente... 110 Figura 69 - Equação de equilíbrio da vanilina... 111 Figura 70 - Alteração espectral da vanilina (concentração 1,06. 10-4 mol L-1) em
decorrência da variação do pH (3,0 a 9,5)... 112 Figura 71 - Sobreposição dos espectros da vanilina (preto) e do íon vanilínico
(vermelho), obtidos em meio ácido e alcalino, respectivamente... 113 Figura 72 - Sobreposições dos espectros de vanilina obtidos a partir da redução com
amálgama de zinco... 114 Figura 73 - Sobreposição do íon vanílico gerados pela variação do pH (preto) e
redução (vermelho)... 115 Figura 74 - Espectro eletrônico do resorcinol obtido em meio aquoso, concentração
2,26. 10-5 mol L-1... 116 Figura 75 - Sobreposição dos espectros do resorcinol em água, DMF e metanol,
representados em preto, vermelho e verde, respectivamente... 118 Figura 76 - Espectro eletrônico obtido em água do resvan, concentração 5,45. 10-5
mol L-1 (a) na região de 190 a 800 nm (b) na região de 215 a 315 nm e (c) na região de 305 a 780 nm... 119 Figura 77 - (a) Sobreposição dos espectros do resorcinareno em água, DMF e
metanol, representados em preto, vermelho e verde, respectivamente. Espectro em (b) água (c) DMF e (d) metanol... 121 Figura 78 - Espectro eletrônico do C-Tetrafenil-calix[4]resorcinareno, obtido em
DMF... 124 Figura 79 - Sobreposição dos espectros dos compostos
C-Tetrafenil-calix[4]resorcinareno (preto) e C-Tetrafenil-C-Tetrafenil-calix[4]resorcinareno (vermelho), obtidos em DMF... 125 Figura 80 - Sobreposição dos espectros de resvan em meio aquoso, concentração
3,98.10-5 mol L-1, com variação de pH na faixa de 11,45 a 2,61... 127 Figura 81 - Sobreposição dos espectros de resvan com variação de pH na faixa de
10
Figura 82 - Sobreposição dos espectros de resvan com variação de pH na faixa de 8,87 a 2,30 com pontos isosbésticos em destaque... 129 Figura 83 - Gráfico de Absorbância versus pH para a banda em 326nm com
representação da curva através de dados experimentais (pontos) e dados com correções dos erros experimentais (linha)... 130 Figura 84 - Gráfico de Absorbância versus pH para a banda em 326nm com
representação da curva através de dados experimentais (pontos) e dados com correções dos erros experimentais (linha)... 131 Figura 85 - Gráfico de Absorbância versus pH para a banda em 500 nm com
representação da curva através de dados experimentais (pontos) e dados com correções dos erros experimentais (linha)... 132 Figura 86 - Gráfico de Absorbância versus pH para a banda em 247 nm com
representação da curva através de dados experimentais (pontos) e dados com correções dos erros experimentais (linha)... 133 Figura 87 - Estrutura de derivados da vanilina, destacando os hidrogênios fenólicos
que poderão sofrer desprotonações... 134 Figura 88 - Sobreposição dos espectros eletrônicos da vanilina, resorcinol e
resorcinareno obtidos em água, concentração 5,85. 10-5 mol L-1, 2,26. 10-5 mol L-1 e 5,45. 10-5 mol L-1, representados em verde, vermelho e preto, respectivamente... 135 Figura 89 - Espectros Eletrônicos do complexo cis-[Cu(phen)Cl2] em meio aquoso,
concentração 5. 10-5 mol L-1, obtidos (a) na região de 190 a 800 nm (b) com ampliação da região de 316 a 450 nm (c) com ampliação da região de 525 a 892 nm... 138 Figura 90 - Sobreposição dos espectros do complexo cis-[Cu(phen)Cl2] em água,
DMF, DMSO, acetonitrila e metanol, representados em preto, vermelho, verde, azul e rosa, respectivamente (a) na região de 190 a 800 nm (b) na região de 358 a 892 nm e (c) espectro em solução concentrada de DMSO na região de 345 a 550 nm... 140 Figura 91 - (a) Sobreposição dos espectros do complexo precursor sob redução do
centro metálico (b) com ênfase à banda LMCT e (c) ênfase à banda MLCT... 143 Figura 92 - Sobreposição dos espectros do complexo cis-[Cu(phen)Cl2] em
acetonitrila obtidos antes da redução do metal (preto) e após a redução do metal (vermelho)... 144 Figura 93 - Espectro Eletrônico do complexo cis-[Cu(phen)(van)]Cl obtido em
meio aquoso, concentração 1,5. 10-5 mol L-1... 145 Figura 94 - Acompanhamento da redução do complexo cis-[Cu(phen)(van)]Cl com
amálgama de zinco em acetonitrila nas regiões de (a) 190 a 900 nm (b) 190 a 400 nm e (c) 400 a 600 nm... 147 Figura 95 - Sobreposição dos espectros do complexo cis-[Cu(phen)(van)]Cl, em
acetonitrila, sob redução do amálgama de zinco... 149 Figura 96 - Sobreposição dos espectros eletrônicos da vanilina (preto) e do
complexo cis-[Cu(phen)(van)]Cl (vermelho) após redução com amálgama de zinco... 150 Figura 97 - Sobreposição dos espectros do complexo cis- [Cu(phen)(van)]Cl em
água (preto), metanol (vermelho), DMF (verde) e acetonitrila (azul)... 151 Figura 98 - Espectros do complexo cis-[Cu(phen)(van)]Cl em água (preto), metanol
Figura 99 - Desdobramento do campo cristalino para um complexo de Cu2+ com geometria quadrado planar... ... 154 Figura 100 - Espectro Eletrônico do complexo [(Cu(phen))4(resvan)] obtido em meio
aquoso, concentração 5. 10-5 mol L-1... 155 Figura 101 - Sobreposição dos espectros eletrônicos do resorcinareno,
cis-[Cu(phen)Cl2] e [(Cu(phen))4(resvan)], obtidos em meio aquoso, representados em preto, vermelho e verde, respectivamente... 156 Figura 102 - Sobreposição dos espectros do complexo [(Cu(phen))4(resvan)]em meio
aquoso (preto) e DMF (vermelho)... 158 Figura 103 - Ampliação do espectro do complexo [(Cu(phen))4(resvan)] em
DMF... 159 Figura 104 - Espectro Eletrônico do complexo [(Cu(phen))4(resvan)]Cl4 obtido em
meio aquoso, 4,68. 10-6 mol L-1... 161 Figura 105 - Sobreposição dos espectros do complexo [(Cu(phen))4(resvan)]Cl4 em
meio aquoso (preto) e metanol (vermelho)... 162 Figura 106 - Sobreposição dos espectros do complexo [(Cu(phen))4(resvan)]Cl4
(preto), [(Cu(phen))4(resvan)] (vermelho) e cis-[Cu(phen)(van)]Cl (verde) obtidos em água... 164 Figura 107 - Sobreposição dos espectros do complexo [(Cu(phen))4(resvan)]Cl4 com
variação de pH na região de 318 a 415 nm... 165 Figura 108 - Sobreposição dos espectros do complexo [(Cu(phen))4(resvan)]Cl4 com
variação de pH na região de 420 a 900 nm... 166 Figura 109 - Gráfico de concentração versus absorbância para o composto
cis-[Cu(phen)(van)]Cl... 168 Figura 110 - Gráfico Concentração versus Absorbância do composto
[(Cu(phen))4(resvan)]Cl4... 169 Figura 111 - Sobreposição dos espectros dos complexos cis-[Cu(phen)(van)]Cl
(preto) e [(Cu(phen))4(resvan)]Cl4 obtidos em meio aquoso, 5. 10-4 mol L-1... 170 Figura 112 - Espectro de EPR do complexo cis-[Cu(phen)Cl2] obtido em solução
DMF a 77K... 172 Figura 113 - Espectro de EPR do complexo [Cu(qbsa)(phen)] obtido em sólido à
temperatura ambiente... 172 Figura 114 - Sobreposição dos espectros de EPR do complexo cis-[Cu(phen)Cl2]
obtidos em DMF (77K) (preto) e no estado sólido (vermelho)... 174 Figura 115 - Espectro de EPR do complexo cis-Cu(phen)(van)]Cl obtido em DMF... 175 Figura 116 - Espectro de EPR do complexo cis-[Cu(phen)(van)]Cl obtido em solução
de DMF à 77K (preto) e em sólido à temperatura ambiente (vermelho)... 176 Figura 117 - Espectro de EPR do complexo [(Cu(phen))4(resvan)] obtido em DMF.. 177 Figura 118 - Espectro de EPR do complexo [(Cu(phen))4(resvan)] obtido em solução
de DMF à 77K (preto) e em sólido à T.A. (vermelho)... 178 Figura 119 - Espectro de EPR do complexo [(Cu(phen))4(resvan)]Cl4 obtido em
DMF... 179 Figura 120 - Espectro de EPR do complexo [(Cu(phen))4(resvan)]Cl4 obtido em
solução de DMF à 77K (preto) e em sólido à T.A. (vermelho)... 180 Figura 121 - Espectros de EPR dos complexos cis-[Cu(phen)Cl2],
12
Figura 122 - Representação gráfica da viabilidade das células após o tratamento com vanilina e resvan durante 24 horas... 185 Figura 123 - Atividade antioxidante do Ácido ascórbico, Vanilina e Resvan avaliada
pelo método de sequestro do radical DPPH... 186 Figura 124 - Curvas de sobrevivência de camundongos suíços após infecção e
tratados com Sulfadiazina (200mg/Kg), Resvan (500mg/Kg) ou Vanilina (500mg/Kg)... 187 Figura 125 - Mudança no peso corporal em camundongos infectados com 25 cistos
de T. gondii e tratados com Sulfadiazina (200mg/Kg), Resvan (500mg/Kg) ou vanilina (500mg/Kg)... 188 Figura 126 - Número de cistos cerebrais em camundongos suíços infectados e
LISTA DE TABELAS
Tabela 1 - Atribuições das principais bandas presentes no espectro de infravermelho da vanilina ... 73 Tabela 2 - Atribuições das principais bandas presentes do espectro de
infravermelho do resorcinol... 75 Tabela 3 - Atribuições das principais bandas presentes no espectro de
infravermelho do resvan... 79 Tabela 4 - Atribuições das principais bandas presentes nos espectros de
infravermelho da vanilina, resorcinol e resvan... 83 Tabela 5 - Atribuições das bandas do complexo cis-[Cu(phen)Cl2] no espectro de
infravermelho... 86 Tabela 6 - Atribuições das bandas principais do complexo cis-[Cu(phen)(van)]Cl
no espectro de infravermelho, comparadas aos compostos vanilina e cis-[Cu(phen)Cl2]... 94 Tabela 7 - Atribuições das bandas do complexo [(Cu(phen))4(resvan)] no espectro
de infravermelho... 97 Tabela 8 - Atribuições das principais bandas do resvan, complexo
cis-[Cu(phen)Cl2] e complexo [(Cu(phen))4(resvan)] presentes nos espectros de infravermelho... 100 Tabela 9 - Atribuições das principais bandas dos complexos
cis-[Cu(phen)(van)]Cl, [(Cu(phen))4(resvan)] e [(Cu(phen))4(resvan)]Cl4 presentes nos espectros de infravermelho... 106 Tabela 10 - Atribuições das bandas encontradas no Espectro Eletrônico da vanilina
em meio aquoso... 108 Tabela 11 - Dados comparativos entre as bandas de absorção da vanilina utilizando
água e DMF como solventes... 110 Tabela 12 - Dados comparativos entre as bandas da vanilina e do íon vanílico gerado
pela variação do pH e redução... 115 Tabela 13 - Atribuições das bandas encontradas no Espectro eletrônico do resorcinol
em meio aquoso... 117 Tabela 14 - Dados comparativos entre as bandas de absorção do resorcinol quando
utilizado água e DMF como solventes... 118 Tabela 15 - Atribuições das bandas encontradas no Espectro Eletrônico do resvan
em meio aquoso... 120 Tabela 16 - Dados comparativos entre as bandas de absorção do resorcinareno em
água, DMF e metanol... 122 Tabela 17 - Valores de pKa determinados pelo monitoramento das bandas em 326 e
500 nm... 132 Tabela 18 - Valores de pKa para vanilina e seus derivados... 135 Tabela 19 - Atribuições das bandas encontradas no Espectro Eletrônico da vanilina,
resorcinol e resvan em meio aquoso... 137 Tabela 20 - Atribuição das bandas encontradas no espectro eletrônico do complexo
cis-[Cu(phen)Cl2] em meio aquoso... 139 Tabela 21 - Dados comparativos entre as bandas de absorção do complexo
14
Tabela 22 - Atribuição das bandas encontradas no espectro eletrônico do complexo cis-[Cu(phen)(van)]Cl em meio aquoso... 145 Tabela 23 - Dados comparativos entre os comprimentos de onda referentes à
transição LLCT... 148 Tabela 24 - Dados comparativos entre as bandas de absorção do complexo
cis-[Cu(phen)(van)]Cl quando utilizado água, DMF, metanol e acetonitrila como solventes ... 152 Tabela 25 - Dados comparativos das transições eletrônicas presentes nos complexos
de cobre-phen obtidos na literatura... 153 Tabela 26 - Atribuição das bandas encontradas no espectro eletrônico do complexo
[(Cu(phen))4(resvan)] em meio aquoso... 156 Tabela 27 - Dados comparativos entre as bandas de absorção do complexo
[(Cu(phen))4(resvan)] utilizando água e DMF como solventes... 159 Tabela 28 - Atribuição das bandas encontradas no espectro eletrônico do complexo
[(Cu(phen))4(resvan)]Cl4 em meio aquoso... 162 Tabela 29 - Dados comparativos entre as bandas de absorção do complexo
[(Cu(phen))4(resvan)]Cl4 quando utilizado água e metanol como solventes... 163 Tabela 30 - Valores de absorbâncias das bandas em 665 e 691 nm para os compostos
cis-[Cu(phen)(van)]Cl e [(Cu(phen))4(resvan)]Cl4, respectivamente, em diferentes concentrações... 168 Tabela 31 - Parâmetros magnéticos de complexos de cobre com o ligante
fenantrolina e derivados... 173 Tabela 32 - Parâmetros magnéticos dos complexos cis-[Cu(phen)Cl2],
cis-[Cu(phen)(van)]Cl, [(Cu(phen))4(resvan)] e [(Cu(phen))4(resvan)]Cl4... 183 Tabela 33 - Erro padrão dos experimentos de quantificação de cistos cerebrais em
LISTA DE ABREVIAÇÕES E SIGLAS
Abs Absorbância
Bipy/Bpy 2,2-bipiridina
Cat Catecol
CWEPR Ressonância Paramagnética de Elétrons de Ondas Contínuas Dipica Di(2-picolil)amina
DMF Dimetilformamida
DMSO Dimetilsulfóxido
DNA Ácido desoxirribonucleico Dpp 2,9-difenil-1,10-fenantrolina DPPH 2,2-difenil-1-picrilidrazil
EPR Ressonância Paramagnética de Elétrons Et-Bzac 2-Etil-1-fenil-1,3-butanodiona
Glu Ácido glutâmico
GSH Glutationa
His-trp-ome Histidina-triptófano metil ester His-tyr-ome Histidina-tirosina metil ester
IC50 Concentração Inibitória para 50% das células
IV Infravermelho
LABMAT Laboratório de Biologia da Malária e Toxoplasmose LLCT Transferência de Carga do Ligante para o Ligante LMCT Transferência de Carga do Ligante para o Metal Me-Bzac 2-Metil-1-fenil-1,3-butanodiona
MLCT Transferência de Carga do Metal para o Ligante MTT Brometo de 3-[4,5-dimetiltiazol-2il]-2,5-difenil
OECD Organização para a Cooperação e Desenvolvimento Econômico Phen 1,10-fenantrolina
Qbsa N-quinolin-8-il-benzenosulfonamida Qui 2-fenil-3-hidroxi-4-quinolinona Resvan C-4-metoxifenilcalix-[4]resorcinareno Threo Threoninato
Uv-Vis Ultravioleta e Visível Valp 2-propilpentanoato
Van Vanilina
16
LISTA DE SÍMBOLOS
Deformação Angular
Frequência de estiramento gװ Fator-g paralelo
g﬩ Fator-g perpendicular
SUMÁRIO
1 INTRODUÇÃO... 20
2 OBJETIVOS... 23
2.1 OBJETIVOS GERAIS... 23
2.2 OBJETIVOS ESPECÍFICOS... 23
3 REVISÃO BIBLIOGRÁFICA... 25
3.1 RESORCINOL... 25
3.2 VANILINA... 26
3.3 CALIXARENOS... 29
3.3.1 Resorcinarenos... 32
3.4 COMPOSTO DE COORDENAÇÃO DE COBRE... 36
3.4.1 Química do Cobre... 36
3.4.2 Aplicações do cobre... 37
3.5 ATIVIDADES BIOLÓGICAS... 41
3.5.1 Toxoplasmose... 42
3.5.2 Atividade antioxidante... 43
3.6 ESPECTROSCOPIA DE RESSONÂNCIA PARAMAGNÉTICA DE ELÉTRONS (EPR)... 44
4 PARTE EXPERIMENTAL... 53
4.1 PROCEDIMENTOS DE SÍNTESES... 53
4.1.1 Síntese do complexo de partida cis-[Cu(phen)Cl2]... 53
4.1.2 Síntese do complexo cis-[Cu(phen)(van)]Cl... 54
4.1.3 Síntese do ligante C-4-metoxifenilcalix-[4]resorcinareno (Resvan)... 55
4.1.4 Síntese do ligante C-Tetrafenil-calix[4]resorcinareno... 57
4.1.5 Síntese do complexo [(Cu(phen))4(resvan)]... 58
4.2 REAGENTES E SOLUÇÕES... 61
4.2.1 Água... 61
4.2.2 Amálgama de zinco... 61
4.2.3 Ácidos... 61
4.2.4 Brometo de potássio... 62
4.2.5 Cloreto de cobre (II)... 62
4.2.6 Hidróxido de sódio... 62
4.2.7 Solventes orgânicos... 62
4.2.8 Ligantes... 63
4.3 EQUIPAMENTOS E TÉCNICAS EXPERIMENTAIS... 63
4.3.1 Espectroscopia Eletrônica na Região do Ultravioleta e Visível (UV-vis)... 63
4.3.2 Espectroscopia Vibracional na Região do Infravermelho... 64
4.3.3 Ressonância Paramagnética de Elétrons (EPR)... 64
4.3.4 Testes Biológicos... 65
5 RESULTADOS E DISCUSSÃO... 69
5.1 ESPECTROSCOPIA VIBRACIONAL NA REGIÃO DO INFRAVERMELHO... 69
5.1.1 Espectro de Infravermelho da Vanilina... 69
5.1.2 Espectro de Infravermelho do Resorcinol... 73
18
5.1.4 Comparativo entre os Espectros de Infravermelho dos compostos
vanilina, resorcinol e resvan... 79
5.1.5 Espectro de Infravermelho do complexo precursor cis-[Cu(phen)Cl2]... 83
5.1.6 Espectro de Infravermelho do complexo cis-[Cu(phen)(van)]Cl... 86
5.1.7 Espectro de Infravermelho do complexo [(Cu(phen))4(resvan)]... 94
5.1.8 Comparativo dos espectros de IV dos compostos resvan, cis-[Cu(phen)Cl2] e [(Cu(phen))4(resvan)]... 97
5.1.9 Espectro de infravermelho do complexo [(Cu(phen))4(resvan)]Cl4... 101
5.2 ESPECTROSCOPIA ELETRÔNICA NA REGIÃO DO ULTRAVIOLETA E VISÍVEL (UV-VIS)... 107
5.2.1 Espectro Eletrônico da Vanilina... 107
5.2.2 Espectro Eletrônico do Resorcinol... 116
5.2.3 Espectro Eletrônico do C-4-metoxifenilcalix-[4]resorcinareno (Resvan)... 118
5.2.3.1 Estudo da influência do pH sobre o espectro eletrônico do resvan e determinação dos valores de pKa... 125
5.2.4 Comparativo entre os Espectros Eletrônicos dos compostos Vanilina, Resorcinol e Resvan... 135
5.2.5 Espectro Eletrônico do complexo precursor cis-[Cu(phen)Cl2]... 137
5.2.6 Espectro Eletrônico do complexo cis-[Cu(phen)(van)]Cl... 144
5.2.7 Espectro Eletrônico do complexo [(Cu(phen))4(resvan)]... 155
5.2.8 Espectro Eletrônico do complexo [(Cu(phen))4(resvan)]Cl4... 160
5.2.8.1 Comparativo entre os espectros eletrônicos dos complexos cis-[Cu(phen)(van)]Cl, [(Cu(phen))4(resvan)] e [(Cu(phen))4(resvan)]Cl4... 163
5.2.8.2 Estudo da acidez do complexo [(Cu(phen))4(resvan)]Cl4... 165
5.2.9 Determinação da proporção do metal dos complexos cis-[Cu(phen)(van)]Cl e [(Cu(phen))4(resvan)]Cl4... 167
5.3 RESSONÂNCIA PARAMAGNÉTICA DE ELÉTRONS (EPR)... 171
5.3.1 Ressonância Paramagnética de Elétrons do complexo cis-[Cu(phen)Cl2].. 171
5.3.2 Ressonância Paramagnética de Elétrons do complexo cis-[Cu(phen)(van)]Cl... 174
5.3.3 Ressonância Paramagnética de Elétrons do complexo [(Cu(phen))4(resvan)]... 176
5.3.4 Ressonância Paramagnética de Elétrons do complexo [(Cu(phen))4(resvan)]Cl4... 178
5.3.5 Comparativo entre os espectros de EPR dos complexos cis-[Cu(phen)Cl2], cis-[Cu(phen)(van)]Cl, [(Cu(phen))4(resvan)] e [(Cu(phen))4(resvan)]Cl4... 180
5.4 AVALIAÇÃO TOXICOLÓGICA, ANTIOXIDANTE E ANTITOXOPLÁSMICA DOS COMPOSTOS VANILINA E RESVAN... 184
5.4.1 Toxicidade Aguda... 184
5.4.2 Citotoxicidade... 184
5.4.3 Atividade antioxidante... 185
5.4.4 Atividade antitoxoplásmica... 186
6 CONCLUSÃO... 191
Introdução
20
1 INTRODUÇÃO
O estudo de novos compostos de coordenação vem se intensificando nas últimas
décadas, visando à obtenção de novos complexos com aplicações em diferentes áreas, tais como
medicamentos (HAAS; FRANZ, 2009) e catálise (WARD, et al., 2004).
Complexos com os mais variados tipos de ligantes apresentam relevantes aplicações em
sistemas biológicos, devido à interação de íons de metais de transição com moléculas de
sistemas biológicos. Dentre os diversos complexos metálicos que tornam esta área da química
de coordenação tão fascinante, pode-se destacar a hemoglobina, uma metaloproteína presente
no organismo de mamíferos responsável pelo transporte de oxigênio através do sistema
respiratório, além de diferentes fármacos e agentes quimioterapêuticos, como a cisplatina,
utilizada atualmente no tratamento de certos tipos de câncer, em especial o câncer de ovário e
testículo. (GUERRA, et al., 2007).
Complexos de cobre, especificamente, possuem uma série de aplicações na química
medicinal, devido principalmente à facilidade de interconversão entre os estados de oxidação
(I/II) apresentados por este metal. Compostos de coordenação de cobre com o ligante
fenantrolina apresentam atividades biológicas importantes, como por exemplo, atividades
antitumorais, antifúngicas, antibacteriana e antimicrobiana (OLIVER, et al., 2009). Tais
aplicações estão relacionadas à forte interação dos complexos de cobre-fenantrolina com o
DNA, ocasionando a clivagem do ácido desoxirribonucleico (LINDER, 2001).
Entre os ligantes que vem ganhando destaque na química de coordenação, estão às
macromoléculas denominadas resorcinarenos, que possibilitam a coordenação de vários íons
metálicos, com formação de complexos estáveis, além de permitirem uma série de modificações
estruturais ao se ligar com outras moléculas em suas extremidades, gerando novas aplicações
na área da catálise e da medicina (HOMDEN; REDSHAW, 2008).
Neste presente trabalho foi realizada a síntese, bem como ensaios biológicos do ligante
resorcinareno, um macrocíclo formado através da reação entre resorcinol – um composto com
relevante atividade antioxidante atribuída aos grupos fenólicos de sua estrutura (SPATAFORA;
TRINGALI, 2012) – e um aldeído, que neste trabalho é a vanilina – uma molécula que vêm
despertando bastante interesse em aplicações na área de bioinorgânica por apresentar fortes
ações como agente antioxidante e antimicrobiano (CHENG, et al., 2007). – Além disso, também
foram sintetizados novos complexos de cobre (II) com os ligantes vanilina e resvan, sendo este
obtidos foram caracterizados através das técnicas espectroscópicas de infravermelho,
Uv-Visível e Ressonância Paramagnética de Elétrons. Além disto, foram realizados testes
22
2 OBJETIVOS
2.1OBJETIVOS GERAIS
O objetivo principal é contribuir para o desenvolvimento da química de coordenação de
compostos que possuam em suas estruturas ligantes macrocíclicos, como o resorcinareno, a
partir da síntese de um novo complexo tetranuclear, tendo átomos de cobre como centros
metálicos, coordenados ao ligante resvan, o qual possa ter aplicações relevantes em sistemas
biológicos.
2.2OBJETIVOS ESPECÍFICOS
Apresentar uma nova proposta de síntese para o complexo de cobre com o ligante
resvan;
Sintetizar o novo complexo de cobre com o ligante vanilina, cis-[Cu(phen)(van)]Cl,
bem como o complexo tetranuclear [(Cu(phen))4(resvan)]Cl4;
Caracterizar os complexos obtidos através das técnicas de Espectroscopia Vibracional
na Região do Infravermelho, Espectroscopia Eletrônica na Região do Ultravioleta e
Visível e Espectroscopia de Ressonância Paramagnética de Elétrons;
24
3 REVISÃO BIBLIOGRÁFICA
3.1RESORCINOL
Sob o ponto de vista funcional orgânico e estrutural, o resorcinol é um fenol cristalino,
constituído por dois grupos hidroxilas localizados nas posições meta de um anel benzênico,
conforme apresentado na Figura 1. Este composto é também conhecido como resorcina,
1,3-dihidroxibenzeno, meta-1,3-dihidroxibenzeno, 1,3-benzenodiol ou 3-hidroxifenol (DURAIRAJ,
2005).
Figura 1 – Estrutura química do Resorcinol
O
H OH
H
H H
H
Fonte: Autora (2014).
Os grupos hidroxilas presentes no anel aromático conferem ao resorcinol uma elevada
reatividade, uma vez que os átomos de carbono localizados nas posições orto e para em relação
aos grupos hidroxilas são bastante reativos, ficando apenas o carbono na posição meta com
baixa reatividade. Isto torna a molécula bastante versátil e possibilita uma série de modificações
e reações químicas, proporcionando diversas aplicações nas áreas de físico-química e biologia.
Essa molécula é utilizada como material de partida na síntese de compostos orgânicos,
tais como borrachas, tinturas capilares e plásticos (BLANCO, et al., 2005), assim como no
desenvolvimento de produtos farmacêuticos, dentre eles, o 2,6-dihidroxiacetofenona, “Sódio
Cromolin”, 2,4-di-hidroxi-3-n-propilacetofenona e o leucotrieno B4 (DURAIRAJ, 2005). O resorcinol, bem como muitos dos seus derivados, possuem caracterísiticas estruturais
que possibilitam suas utilizações no desenvolvimento de compostos com ações farmacológicas
26
anemia, asma, câncer, diabetes, osteoporose, úlceras gástricas, além de atuar como antisséptico
(DURAIRAJ, 2005).
3.2VANILINA
A 4-hidroxi-3-metoxibenzaldeído, também conhecida como vanilina, possui em sua
estrutura um anel aromático 1,3,4-trisubstituído, tendo como substituintes osgrupos funcionais
aldeído, éter e fenol, respectivamente, conforme observado na Figura 2.
Figura 2 – Estrutura do composto 4-hidroxi-3-metoxibenzaldeído O
H
OH
O
CH3
Fonte: Autora (2014).
O grupo aldeído presente na estrutura da vanilina possui elevada reatividade e, como
consequência, muitos derivados da vanilina são originados por reações que têm este grupo como
centro reativo. As bases de Schiff, por exemplo, são moléculas formadas pela condensação de
uma amina primária com um composto que apresente um grupo carbonila, como é o caso da
vanilina. Na Figura 3 é apresentada a reação de condensação de uma amina com a vanilina para
formação da base de Schiff.
Figura 3 – Reação de condensação para formação da base de Schiff
A vanilina possibilita uma série de reações como esta, formando bases de Schiff com
diversas aplicações na área da química e da biologia (SABAA, et al., 2009), com elevado
potencial em atividades antibacterianas e antitumorais (ZHANG, et al., 2010).
Além das bases de Schiff, outros derivados podem ser formados a partir de reações que
ocorrem através do grupo aldeído da vanilina, como por exemplo, os resorcinarenos, que são
macromoléculas formadas pela reação de condensação entre um resorcinol e um composto
aldeídico, como é o caso davanilina. Este derivado possui aplicações na área da química e
biologia, com atividades em sistemas biológicos e catálise.
A vanilina também possui em sua estrutura o grupo vanilóide – constituído pelo anel
aromático e os grupos substituintes metóxi e fenol – o qual apresenta importantes atividades
em sistemas biológicos. Compostos que, semelhantemente à vanilina, possuem o grupo
vanilóide em suas estruturas normalmente favorecem a apoptose, além de apresentarem
importantes características antioxidantes e antimicrobianas. Alguns exemplos de derivados
vanilóides que possuem importantes aplicações biológicas como a capsaicina, o eugenol e o
ácido ferúlico são apresentados na Figura 4.
Figura 4 – Estrutura dos compostos vanilina, capsaicina, eugenol e ácido ferúlico, com destaque ao grupo vanilóide em vermelho
28
A capsaicina é um alcalóide incolor e inodoro, absorvido rapidamente pela pele, por ser
facilmente solúvel em gordura. Tal molécula é encontrada na pimenta e em sementes de
pimentões. A capsaicina tem se mostrado bastante eficaz em estudos relacionados ao tratamento
da obesidade e de patologias que envolvem dores agudas, tais como dor neuropática, neuropatia
diabética, psoríase e problemas musculares (DEVARI, et al., 2014). Estudos mostram que este
composto químico pode apresentar aplicações no tratamento do câncer, uma vez que ele ataca
o centro dos tumores, inibindo sua proliferação.
O 4-Alil-2-Metoxifenol, conhecido também como Eugenol é um composto presente no
cravo, na canela e na mirra. Esta substância possui efeitos medicinais que auxiliam no
tratamento de náuseas, flatulências, indigestão e diarreia. O eugenol, além de apresentar
atividades bactericidas e antivirais, é um forte antisséptico e anestésico, utilizado
principalmente em tratamentos odontológicos.
O ácido ferúlico possui propriedades bioquímicas importantes, tais como atividade
antibactericida e antioxidante, que são características do grupo vanilóide presente em sua
estrutura. O ácido ferúlico também possui atividade antitumoral, podendo atuar no tratamento
do câncer de mama e câncer de fígado (IBTISSEM, et al., 2012). Este composto pode ser
facilmente encontrado em componentes da parede celular das plantas, como arroz, aveia e trigo,
assim como em alimentos, como café, maçã e laranja.
Desta forma, tendo como base os exemplos acima de compostos vanilóides
apresentados, pode-se destacar a importância que este grupo possui para diversas atividades
biológicas no organismo.
A vanilina possibilita uma gama de aplicações em diversas áreas: é amplamente
utilizada nas indústrias de alimentos, bebidas, perfumaria e cosméticos (SHANG, et al., 2014),
além de possuir um vasto campo de aplicação na fabricação de produtos agroquímicos e
produtos farmacêuticos, atuando como um importante reagente de síntese.
Estudos realizados em ratos comprovaram que a vanilina possui efeito
quimiopreventivo em carcinogênese e mutagênese, atuando também como inibidora no
processo de migração de células cancerígenas (CHENG, et al., 2007).
A vanilina, o agente responsável pelo aroma da baunilha, tem sabor agradável e ação
bacteriana bastante significativa. Porém, sua principal característica consiste no elevado
potencial em atividade antioxidante no organismo, que ocorre por sequestro de radicais livres,
proteínas (CHENG, et al., 2007). O alto teor antioxidante que este composto possui é
fundamental para sua utilização como conservante de alimentos naturais (SUN, et al., 2013).
As múltiplas possibilidades de aplicações da vanilina têm estimulado muitos
pesquisadores a realizar estudos sobre esta substância. Entre esses estudos pode-se destacar os
que envolvem compostos de coordenação, uma vez que cada um dos seus grupos funcionais -
aldeido, éter e fenol - dispõe de um par de elétrons livres, disponíveis para interagir com centros
metálicos.
Complexos metálicos com vanilina e seus derivados apresentam aplicações
farmacológicas, atuando como agentes antimicrobianos e antitumorais. Tais propriedades
também estão presentes na vanilina livre, porém, em muitas circunstâncias, a coordenação de
íons metálicos aumenta a ação destas atividades biológicas (REASH, et al., 2010), o que sugere
que o centro metálico modula a atividade biológica dessa molécula. Dentre os complexos
metálicos de vanilina e derivados, destacam-se os compostos de coordenação com a base de
Schiff Valen, que possuem propriedades luminescentes e atuam como agentes antioxidantes e
catalisadores. Na Figura 5 é apresentada a estrutura da base de Schiff Valen, molécula derivada
da o-vanilina, a qual possui atividade antibacteriana (LI, et al., 2014).
Figura 5 – Estrutura química da base de Schiff Valen
Fonte: Autora (2014).
3.3 CALIXARENOS
Calixarenos são macromoléculas obtidas a partir da reação de condensação de fenóis e
aldeídos, geralmente em meio ácido. Em 1872, Adolf Von Baeyer sintetizou o primeiro
calixareno, a partir da reação entre resorcinol e benzaldeído. (TIMMERMAN, et al., 1996). O
30
sua estrutura que possui a forma de um cálice, e arene significa “arila”, que são radicais
derivados do grupo aromático presente em sua estrutura. (GUTSCHE, 2008).
Calixareno corresponde a uma classe de compostos, que pode ser modificada
quimicamente dependendo da natureza dos grupos R, dos grupos aromáticos derivados do fenol,
e do número de grupos arila a partir do qual podem ser originados, conforme pode ser observado
no esquema de síntese proposto na Figura 6.
Figura 6 – Esquema de formação dos calixarenos
Fonte: Adaptado de Gutsche (1993).
Dentre tais compostos, têm-se como exemplos o p-tert-Butilcalixarenos,
calix[n]resorcinarenos, com “n” significando o números de grupos arila,
dihomooxacalix[4]arenos, p-tert-butylphenol, entre outros (GUTSCHE, 2008). Na Figura 7
estão apresentados alguns exemplos de derivados de calixarenos.
Figura 7 – Derivados de calixarenos
Os calixarenos possuem pontos de fusão elevados, são normalmente insolúveis em água
e pouco solúveis em solventes orgânicos (GUTSCHE, 2008). A forma de cone do calixareno
origina uma cavidade hidrofóbica, com paredes aromáticas ricas em elétrons, e extremidades
hidrofílicas, que possibilitam a formação de várias ligações de hidrogênio. Eles possuem uma
habilidade única para reconhecer e se ligar a complexos catiônicos, aniônicos e moléculas
neutras, selecionando-os de acordo com seu tamanho e cargas adequadas à sua estrutura. Tais
características ampliam o campo de aplicação dos calixarenos em diferentes ramos da química,
física e principalmente da biologia, atuando também como bactericida, anticancerígeno,
antiviral, antitrombótico, bloqueador seletivo de enzimas e complexação de proteínas (RODIK,
et al., 2009).
A flexibilidade conformacional, a capacidade de coordenar simultaneamente numerosos
centros metálicos em várias posições e as possibilidades que esta classe de moléculas oferece
em termos de modificações estruturais e funcionais, proporcionaram desenvolvimentos
relevantes para a química de coordenação dos calix[n]arenos na última década (HOMDEN;
REDSHAW, 2008).
Os calixarenos podem formar complexos com vários metais do bloco d da tabela
periódica, tais como Cu2+, Zn2+ e Ag+, conforme observado em alguns exemplos apresentados
na Figura 8. O posicionamento dos metais no macrocíclico possibilita o desenvolvimento de
novos catalisadores (SORRELL, et al., 1994), bem como atua na busca de enzimas artificiais,
e na concepção de sensores para determinação de traços de íons metálicos, principalmente na
área ambiental. (SLIWA; DESKA, 2008).
Figura 8 – Complexos com o ligante calixareno
32
3.3.1 Resorcinarenos
Resorcinarenos são moléculas macrocíclicas que pertencem à classe dos calixarenos,
obtidos a partir da condensação de resorcinol com aldeído, em meio ácido. (IWANEK;
WZOREK, 2009). São formados a partir da combinação de um número igual de moléculas de
aldeído e resorcinol, com perda de um número igual de moléculas de água. (TIMMERMAN, et
al., 1996).
Na Figura 9 é apresentado o mecanismo geral envolvido na reação de formação do
resorcinareno. A macromolécula formada não possui o grupo aldeído em sua estrutura e, em
seu lugar, permanece o grupo metino, unindo as moléculas entre si.
Figura 9 – Mecanismo da condensação ácido catalizada entre resorcinol e aldeído
Fonte: Gutsche (2008, p. 59).
Em 1872, Adolf Von Baeyer, sintetizou o primeiro composto pertencente à classe dos
resorcinarenos, utilizando benzaldeído e resorcinol como reagentes. Entretanto, a estrutura
deste composto foi proposta apenas em 1940 por Niederl e Vogel. A partir da determinação do
seu peso molecular e, ao realizar estudos entre os vários produtos obtidos através das reações
comprovação ocorreu no ano de 1968 por Erdtman, através de análises de raios-X.
(TIMMERMAN, et al., 1996).
Na Figura 10 observa-se uma representação geral da estrutura macrocíclica dos
resorcinarenos, onde os grupos R podem variar, dependendo do aldeído utilizado no processo
de síntese. Na literatura já são relatados resorcinarenos com estruturas tendo como grupo R
desde grupos alquila, contendo apenas um átomo de carbono, até cadeias lineares com 12
carbonos, por exemplo. Espécies aromáticas como benzaldeído e vanilina são também
utilizadas para a formação de resorcinarenos (TIMMERMAN, et al., 1996).
Figura 10 - Estrutura geral do Resorcinareno
Fonte: McIldowie (2010, p.17).
Sabe-se que os resorcinarenos não apresentam uma estrutura planar, sendo possível a
obtenção de compostos com diferentes conformações, como pode ser observado na Figura 11,
sendo a simetria mais provável a C4v, pois, com esta conformação, as hidroxilas fenólicas
34
Figura 11 – Diferentes conformações possíveis para resorcinarenos e indicação dos respectivos grupos pontuais
Fonte: Iwanek; Wzorek (2009, p. 399).
Pelo fato de suas estruturas apresentarem cavidades que podem acomodar íons ou
moléculas, os resorcinarenos têm sido objeto de estudos que vêm se intensificando ao longo
dos anos (PETERSON, et al., 2003). Nesses estudos tem-se produzido compostos modificados
estruturalmente, cujas aplicações são bastante diversificadas, e as reações geradoras desses
produtos apresentam altos rendimentos.
Os resorcinarenos contribuem para a química supramolecular devido, principalmente,
às suas características de reconhecimento molecular, que são de grande importância para vários
processos biológicos em células vivas, tais como, formação de membranas e ribossomos,
reconhecimento do substrato pelas enzimas e processos estruturais complementares no DNA
(JASAT; SHERMAN, 1999). Muitos resorcinarenos são utilizados nas sínteses de receptores
que interagem com marcadores tumorais, além de possuírem várias aplicações na busca de
novos compostos farmacêuticos, pesticidas, gêneros alimentícios (IWANEK; WZOREK,
2009), bem como catálise e cromatografias (MCILDOWIE, et al., 2010), sensores
eletroquímicos, fotoresistência (HABA, et al ., 1999) e na adsorção de metais pesados
(FIRDAUS, et al., 2008).
A classe de compostos dos resorcinarenos, assim como outras macromoléculas que
possuam propriedades semelhantes, pode reagir entre si, formando cápsulas macromoleculares
capazes de envolver completamente moléculas ou íons hóspedes no seu interior, como é o caso
Coroa – C4v Barco – C2v Cadeira – C2h
do resorcinareno tetraquinoxalina (resoqx), uma cavidade macromolecular que tem sido
amplamente utilizada para o estudo das interações existentes entre o hospedeiro e suas
moléculas hóspedes (CASTRO, et al., 2004). A quinoxalina é uma molécula fundamental na
construção de cavidades derivadas do resorcinareno, possui atividades biológicas e
farmacêuticas importantes, além de possibilitar interações com o DNA (BALLISTRERI, et al.,
2010). A cavidade resoqx é formada a partir de ligações entre os grupos hidroxilas dos
resorcinóis vicinais do resorcinareno com a quinoxalina (VINCENTI; IRICO, 2002). Na Figura
12 é apresentado o esquema de síntese para formação da cavidade do resorcinareno com a
quinoxalina.
Figura 12 – Esquema de síntese da cavidade do resorcinareno modificado com tetraquinoxalina
Fonte: Adaptado de Panahi (2012).
Os resorcinarenos podem também atuar como ligantes polidentados, podendo se
coordenar a alguns metais de transição, tais como paládio, níquel, zinco e cobre (JAIN;
KANAIYA, 2011). Os complexos formados com estas macromoléculas têm capacidade de agir
como moléculas seletivas quanto ao tamanho e a carga das moléculas vizinhas presentes no
meio, sendo estas polares ou apolares (SORRELL, et al., 1994), além de serem utilizados no
desenvolvimento de catalisadores.
O resorcinareno sintetizado a partir da reação de condensação entre resorcinol e
vanilina, neste trabalho identificado como resvan, possui uma estrutura com vários sítios ativos,
totalizando dezesseis átomos de oxigênio com elétrons disponíveis. Conforme apresentado na
Figura 13, o resvan apresenta algumas possibilidades de modificações estruturais importantes,
sendo estas através das reações que ocorrem entre as hidroxilas dos resorcinóis com outros
ligantes favoráveis, como a quinoxalina, assim como coordenações de centros metálicos através
dos átomos doadores de elétrons presentes em sua estrutura. Para este último caso, no entanto,
as coordenações podem ocorrer através das hidroxilas dos grupos fenólicos dos resorcinóis e/ou
36
utilizado. Devido à presença de vários sítios ativos nesta macromolécula, torna-se possível a
formação de complexos polinucleares, podendo ocorrer a coordenação de até oito íons
metálicos de forma bidentada na molécula.
Figura 13 – Possibilidades de modificações estruturais do resvan
Fonte: Autora (2014).
3.4COMPOSTO DE COORDENAÇÃO DE COBRE
3.4.1 Química do Cobre
O cobre é um dos poucos metais que pode ser encontrado na sua forma pura na natureza.
Possui massa atômica igual a 63,6 e está localizado no grupo 11 da tabela periódica, sendo,
portanto, um metal de transição. A configuração eletrônica da camada de valência deste metal
é 3d10, 4s1, apresentando como principais estados de oxidação os valores +1 e +2.
Complexos de cobre (I) geralmente possuem números de coordenação (NC) pequenos,
com valências secundárias que variam entre 2 e 4. Estes complexos possuem geometrias linear
para número de coordenação 2, trigonal para número de coordenação 3 e tetraédrico para
número de coordenação 4.
Já o cobre (II) normalmente forma complexos com números de coordenação que variam
entre 4-8, geralmente com geometrias quadrado planar, para número de coordenação 4,
bipirâmide trigonal ou pirâmide de base quadrada, para número de coordenação 5 e octaédrica
geometrias que são preferencialmente utilizadas para os compostos de coordenação com os íons
de cobre (I) e (II).
Figura 14 – Geometrias propostas para complexos de cobre I e II
Fonte: Adaptado de Tisato (2010, p.711).
3.4.2 Aplicações do cobre
O cobre foi o primeiro metal utilizado pelas mais antigas civilizações da história da
humanidade, há mais de 10.000 anos, conforme alguns relatos bíblicos. Por volta de 6.000 anos
atrás, o cobre teve grande importância para produção de espadas, lanças e ferramentas, e, por
isso, este período ficou conhecido como idade do cobre. Atualmente, o cobre é um dos metais
de maior importância para a indústria moderna, na formação de ligas metálicas, assim como
para sistemas biológicos por se tratar de um elemento biologicamente ativo em organismos
vivos.
O cobre é um oligoelemento, ou seja, essencial para muitas formas de vida, sendo o
elemento principal em mais de 300 proteínas em humanos (CRISPONI, et al., 2010). Seu caráter
bioessencial foi descoberto em 1925 (LINDER, 1991), porém, sua importância biológica foi
reconhecida apenas nas últimas décadas, com o desenvolvimento da química bioinorgânica
deste metal (LIPPARD; BERG, 1994).
Por ser um elemento biologicamente ativo, possui aplicações biológicas relevantes,
38
seus estados de oxidação (I) e (II). O cobre, na forma de íon ou complexo, pode causar danos a
moléculas constituintes de células, modificando suas estruturas em processos como
fragmentação de DNA, induzindo mutações ou apoptose. Isso ocorre porque o cobre livre pode
reagir com moléculas de oxigênio, gerando radicais livres ou íons superóxiodos, tais como o
OH• e o O2-, que prejudicam as células dos organismos vivos. No caso de alguns complexos de
cobre este processo se intensifica, pois além do cobre formar radicais livres, determinados
ligantes conseguem aumentar a interação com as estruturas celulares, produzindo encaixes
perfeitos entre eles durante as modificações celulares.
Ao mesmo tempo, o cobre é um elemento de fundamental importância em mecanismos
de reações de várias enzimas, como, por exemplo, no transporte de elétrons (citocromo c
oxidase), na produção de melanina (tirosinase) e na quebra de radicais realmente perigosos
como superóxido (superóxido dismutase). Na Figura 15 estão representados os principais
processos que têm o cobre como elemento central nos organismos vivos (LINDER, 2001).
Figura 15 – Principais processos biológicos envolvendo o cobre no organismo
Fonte: Kaim (1996, p. 47).
Dentre as proteínas e enzimas de cobre apresentadas na figura acima, pode-se destacar
presente nos artrópodes e moluscos. Sua função principal é transportar oxigênio nestes animais,
atuando de forma equivalente a hemoglobina nos mamíferos.
Na Figura 16 são apresentadas as estruturas do sistema hemocianina nas formas
desoxihemocianina (a) e na forma oxihemocianina (b). Na Figura 16.a, observa-se que o cobre
está em seu estado de oxidação +1, o qual não possibilita transições d-d e, por isso, a
desoxihemocianina é incolor. À medida que o oxigênio se coordena à metaloproteína,
ligando-se em ponte aos dois centros metálicos, os átomos de cobre sofrem oxidação passando de Cu1+
Cu2+ provocando assim a mudança de coloração da metaloproteína. A coloração azul do
sangue dos artrópodes é, portanto, característica da presença do cobre no seu estado de oxidação
II em tais proteínas sanguíneas.
Um fato a ser destacado neste sistema é a capacidade do cobre poder formar compostos
estáveis com diferentes números de coordenação. Na forma desoxihemocianina, por exemplo,
o cobre (I) faz três ligações, enquanto que na forma oxihemocianina, ao fazer pontes de
oxigênios, o cobre (II) faz cinco ligações. Estes processos geram mudanças na geometria dos
compostos, relacionadas com o estado de oxidação do metal, cujas estruturas sofrem distorções,
estabilizando o centro metálico.
Figura 16 – Sistema da proteína hemocianina nas formas (a) desoxihemocianina, sem oxigênio e (b) oxihemocianina, após a coordenação do oxigênio aos átomos de Cu
Fonte: Disponível em (http://moray.ml.duke.edu/projects/magnus/images/).
O cobre é bastante utilizado na formação de vários complexos que possuem aplicações
importantes na química de coordenação, principalmente quando aplicados em sistemas
biológicos. Alguns complexos de cobre atuam como catalisadores na formação de radicais,
principalmente complexos de cobre (I), outros neutralizam os radicais, e há ainda complexos
metálicos de cobre que permanecem neutros (LINDER, 2001). Atualmente, vários estudos vêm
40
cataliticamente ativos, como é o caso dos compostos de coordenação de cobre(II)-guanidinas,
que possuem um vasto potencial de aplicações em catálises oxidativas.
Complexos de cobre (II) com o ligante o-fenantrolina e seus derivados têm sido bastante
utilizados para provocar dano oxidativo ao DNA (LINDER, 2001), apresentando alta eficiência
nucleolítica (KUMAR, et al., 2008) e atividades biológicas importantes, tais como atividades
de nuclease química, antitumoral, antibacteriana, antifúngica e antimicrobiana (OLIVER, et al.,
2009). Palaniandavar e colaboradores relataram que os complexos de cobre (II) coordenados a
ligantes mistos diiminas possuem propriedade de clivagem do DNA e apresentam atividades
anticancerígenas, sendo estas mais eficientes do que a cisplatina (KANNAN; ARUMUGHAM,
2012).
O complexo [Cu(phen)2]+, por exemplo, apresenta excelente atividade de clivagem do
DNA, e por isso, é considerado um importante modelo biológico no estudo de fármacos
anticancerígenos, uma vez que a clivagem pode causar danos ao DNA de células cancerosas,
bloqueando sua replicação (SANTHAKUMAR; ARUMUGHAM, 2012).
Para que ocorra a clivagem do DNA, o complexo [Cu(phen)2]2+ é inicialmente reduzido
a [Cu(phen)2]+ que em seguida se liga ao DNA, com intercalante eficiente através da estrutura planar rica em interações π do ligante fenantrolina. O cobre I reduz as espécies de oxigênio
presentes no meio, gerando radicais livres como superóxido e o radical hidroxila, e o complexo
[Cu(phen)2]+ é oxidado para [Cu(phen)2]2+. Estes radicais vão gerar um ataque oxidativo
clivando o DNA principalmente nas unidades C-1’, C-4’ ou C-5’ do 2-desoxirribose (TISATO,
et al., 2010).
O complexo [Cu(phen)2]+, cuja estrutura é representada na Figura 17, gera um certo
aumento na produção de espécies reativas de oxigênios (ROS) no organismo. No entanto,
estudos mostram que o complexo cobre-phen favorece a indução da apoptose de células
cancerígenas no fígado. Este mesmo complexo possui alta citotoxicidade com relação às células
leucêmicas humanas, podendo inibir até 90% do crescimento destas células (TISATO, et al.,

![Figura 29 – Espectro de EPR do complexo [Ni(NH 3 ) 6 ] 2+ em solução de amônia a 77K](https://thumb-eu.123doks.com/thumbv2/123dok_br/15668584.114936/53.892.312.694.190.572/figura-espectro-epr-complexo-ni-nh-solução-amônia.webp)
![Figura 41 – Estrutura proposta para o complexo [(Cu(phen)) 4 (resvan)]Cl 4 obtido através do novo procedimento](https://thumb-eu.123doks.com/thumbv2/123dok_br/15668584.114936/63.892.133.729.194.431/figura-estrutura-proposta-complexo-resvan-obtido-através-procedimento.webp)


![Figura 60 - Espectro de absorção na região do infravermelho do complexo [(Cu(phen)) 4 (resvan)] na região de](https://thumb-eu.123doks.com/thumbv2/123dok_br/15668584.114936/98.892.169.776.199.699/figura-espectro-absorção-região-infravermelho-complexo-resvan-região.webp)
![Tabela 7 – Atribuições das bandas do complexo [(Cu(phen)) 4 (resvan)] no espectro de infravermelho ATRIBUIÇÕES AWAD, D](https://thumb-eu.123doks.com/thumbv2/123dok_br/15668584.114936/99.892.132.784.307.743/tabela-atribuições-bandas-complexo-resvan-espectro-infravermelho-atribuições.webp)