ABRAHAM DAMIAN GIRALDO ZUÑIGA
ESTRATÉGIA DE PURIFICAÇÃO DAS PROTEÍNAS α-LACTOALBUMINA E β -LACTOGLOBULINA DO SORO DE QUEIJO
Tese apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos, para obtenção do título de Doutor Scientiae.
VIÇOSA
ABRAHAM DAMIAN GIRALDO ZUÑIGA
ESTRATÉGIA DE PURIFICAÇÃO DAS PROTEÍNAS α-LACTOALBUMINA E β-LACTOGLOBULINA DO SORO DE QUEIJO
Tese apresentada à Universidade Federal de Viçosa, como parte das exigências do Programa de Pós-Graduação em Ciência e Tecnologia de Alimentos, para obtenção do título de
Doutor Scientiae.
APROVADA: 11 de Junho de 2003.
____________________________ ____________________________ Prof. Luis Antonio Minim Prof. José Antonio M. Pereira
(Conselheiro) (Conselheiro)
______________________________ ____________________________ Prof. Luis Henrique Mendes da Silva Profa. Vânia Regina Nicoletti Telis
_____________________________ Profa Jane Sélia dos Reis Coimbra
A Deus.
À minha inigualável mãe Maura Zuñiga Quiñones, que, com sua humildade e simplicidade, soube me proporcionar os momentos mais felizes da vida. A todos os meus irmãos e sobrinhos, especialmente a Fely, minha segunda Mãe,
AGRADECIMENTO
À Universidade Federal de Viçosa e ao Departamento de Tecnologia de Alimentos, pela oportunidade oferecida.
À Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES/PEC-PG), FAPEMIG e ao CNPq, pelo auxílio financeiro.
À professora Jane Sélia dos Reis Coimbra, pela oportunidade que me deu para a realização da tese, pela orientação, pelo apoio, pelos ensinamentos, pela amizade e paciência.
Aos professores Luís Antônio Minim e José Antônio Pereira, pelas valiosas contribuições como conselheiros, pelos ensinamentos, pelo apoio e pela amizade.
À minha família, pelo carinho, pela confiança e pelo incentivo.
À minha esposa Lúcia e sua família, pelo incentivo, carinho e pelas freqüentes acolhidas.
Aos amigos, irmãos e companheiros de curso Wilmer Luera, Milton Cano e Edwin Garcia, pelos momentos compartilhados e pelos anos de convívio fora do nosso país.
CONTEÚDO
RESUMO... v ABSTRACT... vii 1. INTRODUÇÃO GERAL... ix 2. ARTIGOS CIENTÍFICOS... 2.1. Obtención de Fracciones Enriquecidas de α-Lactoalbumina Y
β-Lactoglobulina Usando Cromatografía de Intercambio Iónico en Escala Semipreparativa... 01 2.2. Otimização da Dessorção de α-Lactoalbumina β-Lactoglobulina em
Cromatografia de Troca Iônica... 15 2.3. Separação e Purificação da α-Lactoalbumina e β-Lactoglobulina
por Integração da Cromatografia de Troca Iônica, Sistemas Aquosos Bifásicos e Cromatografia de Exclusão Molecular... 34 2.4. Estudo Preliminar de Implantação de Uma Unidade de Purificação
de Proteínas do Soro de Queijo... 55 2.5. Extração Líquido – Líquido Usando Sistemas Aquosos Bifásicos:
Uma Revisão... 75 2.6. Propriedades Funcionais e Nutricionais das Proteínas do Soro de
Leite... 107 2.7. Revisão: Técnicas Usadas no Processo de Purificação de
RESUMO
ZUÑIGA, Abraham Damian Giraldo, D.S., Universidade Federal de Viçosa, junho de 2003. Estratégia de Purificação das Proteínas α-lactoalbumina e β-lactoglobulina do Soro De Queijo. Orientadora: Jane Sélia dos Reis Coimbra. Conselheiros: Luis Antonio Minim e José Antonio Marques Pereira.
ABSTRACT
ZUÑIGA, Abraham Damian Giraldo, D.S., Universidade Federal de Viçosa, June, 2003. Purification Strategy of proteins α-lactalbumin and β -lactoglobulin of whey. Adviser: Jane Sélia dos Reis Coimbra. Committee Members: Luis Antonio Minim and José Antonio Marques Pereira.
1. Introdução Geral
As proteínas do soro de queijo possuem elevado valor funcional e nutricional. Podem ser usadas como espumantes, emulsificantes e são consideradas ingredientes alimentícios potenciais, com capacidade para substituir outros ingredientes de características semelhantes, como a clara de ovo, ovo integral ou leite em pó desnatado em uma ampla variedade de produtos alimentícios, como por exemplo em produtos de panificação, produtos cárneos, na fortificação de cereais, bebidas nutricionais, queijos, produtos farmacêuticos (USDEC, 1997), na microencapsulação de lipídeos do leite (KEOGH et al., 1999), em produtos extrusados (ONWULATA et al., 2001), no preparo de alimentos funcionais, filmes comestíveis e alimentos nutracêuticos (MANN, 2000). A α-lactoalbumina (α-la) e a β-lactoglobulina (β-lg) são as proteínas presentes em maior quantidade no soro de queijo e constituem cerca de 70% do conteúdo protéico total do soro (MORR e HA, 1993). Estas proteínas em forma purificada são benéficas à saúde (ETZEL, 2000). Dentre as funções atribuídas à α-la e à β-lg encontram-se as anticarcinogênicas, digestiva, reguladoras do sono e da vigília, sendo também usadas como suplemento alimentício (MCINTOSHI et al., 1998) e no desenvolvimento de fórmulas especiais, como por exemplo alimentos para pessoas com fenilcetonúria, uma enfermidade que provoca a não-metabolização de fenilalanina e causa, entre outros problemas, a deficiência mental (GRASSELLI et al., 1997).
O crescimento da produção de soro no Brasil, aproximadamente 3,2 milhões de toneladas (ANUALPEC, 2002), resultante da demanda de queijo, criou um problema para a indústria de laticínios, isto é, a poluição produzida pelo soro nos mananciais de água devido à sua alta demanda bioquímica de oxigênio (40.000 a 60.000 mg.L-1) (FERRAT, 1980), pois somente 55% do total de soro produzido é utilizado em produtos alimentícios de forma geral. Com o passar dos anos, esse problema torna-se cada vez mais saliente, em razão do surgimento, dentro da opinião pública e da economia em geral, de uma preocupação predominante que é a luta contra a poluição.
técnicas tem sido utilizadas para sua separação e isolamento. Dentre elas pode-se mencionar a cromatografia de troca iônica em leito fluidizado (CARRÈRE et al., 1996), filtração em gel (YOSHIDA, 1990), precipitação com polifosfatos (AL-MASHIKI e NAKAI, 1987), cromatografia de troca iônica (GERBERDING e BYERS, 1998; HAHN et al., 1998, MANJI et al; 1985), ultrafiltração (MEHRA e DONNELLY, 1993), combinação dos processos de precipitação e diafiltração (PETRA et al., 1997) e adsorção bioseletiva (GURGEL et al., 2001), dentre outros. Existem também algumas patentes para o fracionamento das proteínas α-la e β-lg, como as de OUTINEN et al. (1996) e de ETZEL (1999).
Os resultados alcançados nos trabalhos citados levaram a valores máximos de pureza de 91,9% para β-lg e de 90,6% para α-la, quando foi utilizada uma resina composta por um hexapeptídeo covalente (GURGEL et al., 2001). Considerando que estes valores possam ser aumentados busca-se desenvolver processos de separação e purificação alternativos, que possam ser aplicados em escala contínua, que sejam técnica e economicamente viáveis, assim como de fácil aumento de escala e que produzam frações com elevados níveis de pureza.
Portanto, este trabalho visou estabelecer uma estratégia alternativa de purificação das proteínas do soro de queijo α-la e β-lg mediante a integração das técnicas de adsorção, extração líquido-líquido com sistemas aquosos bifásicos e de cromatografia por exclusão molecular (CEM). A CEM foi empregada como etapa de polimento para separar as proteínas das fases do sistema aquoso bifásico a fim de obté-las puras. A etapa final de liofilização foi utilizada para concentrar o produto purificado. O trabalho está organizado em forma de artigos científicos, sendo os três últimos apresentados, como anexos, na forma de artigos de revisão. Sendo assim distribuídos:
1. Obtención de Fracciones Enriquecidas de α-lactoalbumina y β-lactoglobulina Usando Cromatografía de Intercambio Iónico en Escala Semipreprativa.
2. Otimização da Dessorção da α-lactoalbumina e β-lactoglobulina em Cromatografia de troca Iônica.
3. Separação e Purificação da α-lactoalbumina e β-lactoglobulina por Combinação da Cromatografia de Troca Iônica, Sistemas Aquosos Bifásicos e Cromatografia de Exclusão Molecular.
5. Extração Líquido – Líquido Usando Sistemas Aquosos Bifásicos: Uma Revisão.
6. Propriedades Funcionais das Proteínas do Soro de Leite. 7. Técnicas Usadas no Processo de Purificação de Biomoléculas.
2. Referências bibliográficas
ALBERTSSON, P. A . Partition of cell and macromolecules. New York: John Wiley, 1986. 346 p.
AL-MASHIKI, S. A., NAKAI, S. Reduction of β-lactoglobulin content of cheese whey by polyphosphate precipitation. Journal Food Science, v.52, n.5, p.1237-1240, 1987.
ANUALPEC. Anuário da Pecuária Brasileira. São Paulo-Brasil: FNP Consultoria & Comercio, 2002. 400p.
CARRÈRE, H., BASCOUL, A., FLOQUET, P., WILHELM, A. M., DELMAS, H. Whey proteins extraction by fluidized ion exchange chromatography: simplified modeling and economical optimization. The Chemical Engineering Journal, v. 64, p. 307-317, 1996.
COIMBRA, J. R., TÖMMES, J., KULA, M. R., Continuous separation of whey proteins with aqueous two-phase systems in a graesser contactor. Journal of Cromatography A, v.668, n.1, p. 85-94, 1994.
ETZEL, M. R. Isolation Beta-lactoglobulin and alpha-lactalbumin by eluting from a cation exchanger without sodium chloride. United States Patent, N° 126904, 1999.
ETZEL, M. R. A new way to separate whey proteins?. Food Engineering , v. 3, p. 12, 2000.
FERRAT, A. Como valorizar o subproduto das fábricas de queijos, o "Lacto Soro”. Boletim do leite, v.618, p.32-38, 1980.
FERREIRA, R. C. Separação de α-lactoalbumina e β-lactoglobulina de proteínas do soro de queijo por adsorção em colunas de leito fixo, Viçosa, MG: DTA, UFV, 2001. Dissertação (Mestrado), Departamento de Tecnologia de Alimentos, Universidade Federal de Viçosa , 2001, 81p.
GERBERDING, S. J., BYERS, C. H. Preparative ion-exchange chromatography of proteins from dairy whey. Journal of Chromatography, v. 808, p.141-151, 1998.
GRASSELLI, M., NAVARRO, A., FERNANDEZ, H. L., MIRANDA, M. V., CAMPERI, I., OSVALDO CASCONE. Que hacer com el suero de queso. Ciencia Hoy, v.43, n.1, p.27-35, 1997.
GURGEL, P., CARBONELL, R. G., SWAISGOOD, H. E. Fractionation of whey proteins with a hexapeptide ligand affinity resin. Bioseparation, v.9, p.385-392, 2001.
HAHN, R., SHULZ, P. M., SCHAUPP, C., JUNGBAUER, A. Bovine whey fractionation based on cation-exchange chromatography. Journal of Chromatography, v. 795, p.277-287, 1998.
USDEC, Manual de referência para produtos de soro dos EUA. Airlington , VA 22201-3001 U.S.A, 1997.
KEOHJ, M. K., O’KENNEDY, B. T. Milk fat microencapsulation using whey proteins. International Dairy Journal, v. 9, p.657-663, 1999.
MCINTOSHI H. GRAEME, PETER J. ROYLE, RICHARD K.LE LEU, GEOFFREY REGESTER, MELISSA JOHNSON, ROSS L. GRINSTED, RACHEL S.
KENWARD AND GEOFFEREY W. SMITHERS., Whey Proteins as Functional Food Ingredients?., International Dairy Journal ,8 p. 425-434,1998
MANJI, B., HILL, A., KAKUDA, Y., IRVINE, D. M. Rapid separation of milk proteins by anion exchange chromatography. Journal of Dairy Science. v. 68,
p.3176-3179, 1985.
MEHRA, R. K., DONNELLY, W. Fractionation of whey protein components trough a large pore size hydrophilic, cellulosic membrane. Journal Dairy Research. v.60, n.1, p. 89-97, 1993.
ONWULATA, C. I., SMITH, P. W., KONSTANCE, R. P., HOLSINGER, V. H. Incorporation of whey products in extruded corn, potato or rice snacks. Food Research International. v.34, p.679-687, 2001.
OUTINEN, M., HARJU, M., TOSSAVAINEN, O and ANTILA, P. (Valio Oy, FIN-00100 Helsinki, Finland) PCT International Patent application WO 95/19714. Trends in Food Science & Technology. v. 7, p.340, 1996.
MANN, E. Whey products and their uses. Dairy Industries International. v. 6, p.13, 2000.
MORR, C., HA, E. W. Whey protein concentrates and isolates processing and functional properties critical reviews. Food Science and Nutrition, v.33, n.6, p.431-476, 1993.
PETRA, W. J. R., CAESSENS., VISSER, S., GRUPPEN, H. Method for the isolation of bovine β-lactoglobulin from a cheese whey protein fraction and physicochemical characterization of the purified product. International Dairy Journal, v. 7, p. 229-235, 1997.
YOSHIDA, S. Isolation of β-lactoglobulin and α-lactoglobulin by gel filtration using sephacryl s-200 and purification by diethylaminoethyl ion - exchange
OBTENCIÓN DE FRACCIONES ENRIQUECIDAS DE α-LACTOALBUMINA Y β-LACTOGLOBULINA USANDO CROMATOGRAFÍA DE INTERCAMBIO
IÓNICO EN ESCALA SEMIPREPARATIVA
Laboratório de Processos de Separação (LPS) / Departamento de Tecnologia de Alimentos (DTA), Universidade Federal de Viçosa, MG – Brasil, CEP 36571-000
RESUMEN
En el presente trabajo fue desarrollado un proceso cromatográfico en escala semipreprativa para la purificación de las proteínas del lactosuero α-lactoalbumina (α-la) y β-lactoglobulina (β-lg). Los resultados mostraron que hubo una adsorción selectiva de α-la y β-lg (35,05% de α-la y 61,08% de β-lg) en la resina de intercambio iónico Accell Plus QMA ® (Waters). Para la elución de las proteínas fueron testadas diferentes soluciones tampón como fases móviles y varios tipos de gradientes de fuerza iónica. En esta etapa fueron obtenidas varias fracciones conteniendo α-la y β-lg en diferentes proporciones. Con el uso de los gradientes y diferentes tipos de sales fue posible obtener fracciones enriquecidas de α-la y β-lg.
Palabras clave: α-lactoalbumina, β-lactoglobulina, lactosuero, cromatografía de intercambio aniónico.
1. INTRODUCCIÓN
constituida de 123 residuos de aminoácidos, tiene una masa molar de 14,2 kDa y su concentración en el lactosuero varia de 0,6 a 1,7 g/L (YE et al, 2000). Es una fuente proteica preferida para la formulación de alimentos infantiles debido a su elevado valor nutricional, alta digestibilidad y bajo potencial para causar alergia (GURGEL et al., 2001, PUERTA et al., 2002). La β-lg esta presente en mayor cantidad en el lactosuero, aproximadamente 50%, tiene una masa molar de 18,4 kDa y contiene 162 residuos de aminoácidos, su concentración en el lactosuero se encuentra en el rango de 2 - 4 g/L (YE et al 2000). La β-lg también es de grande valor nutritivo y puede ser utilizada para el fortalecimiento de bebidas energéticas a base de frutas, debido a su grande solubilidad y estabilidad (DE WITH, 1998). Preparados enzimáticos hidrolizados con β-lg son usados como complemento para convalecientes, ya que muchos péptidos de la β-lg pueden ser adsorbidos directamente por el intestino (GRASSELLI et al,
1997).
es limitado (HAHN et al., 1998), normalmente se utilizan pequeñas cantidades de muestras para ser separadas.
En las últimas décadas, aumentó el interés en las separaciones por medio de técnicas cromatográficas. Este crecimiento es debido, al desarrollo de la industria biotecnológica y a las necesidades de las industrias farmacéutica y química por productos con elevado grado de pureza (GERBERDING e BYERS, 1998). Entre estas técnicas, la cromatografía de intercambio iónico esta siendo usada con mucho éxito, por conservar las características naturales de las biomoléculas separadas (NIVEN, 1995).
En este estudio fue desarrollada una técnica, en escala semi-preparativa, para la separación de las proteínas α-la y β-lg de las otras proteínas presentes en el lactosuero. Para este fin, fue usada la resina de intercambio aniónico Accell Plus QMA® como adsorvente de las proteínas de interés, pues esta resina presentó buenos resultados para la adsorción de esta proteínas (FERREIRA, 2001). La desorción de estas proteínas de la columna, nos llevó a la obtención de fracciones con diferentes composiciones de α-la y β-lg.
2. MATERIAL Y MÉTODOS
2.1. Equipo
mediante el software UNICORN®. Un diagrama esquemático del sistema “ÄKTA® purifier” es mostrado en la Figura 1.
Figura 1. Diagrama esquemático del sistema ÄKTA® purifier (Pharmacia, 1998)
La columna utilizada fue del tipo HR 10/10 (1 cm de diámetro x 10 cm de longitud) (Pharmacia), la cual fue empaquetada con la resina ACCELL PLUS QMA® (Waters) mediante la ayuda de un equipo para empaquetamiento HR 10 (Pharmacia), siendo que el volumen del lecho de la columna fue de 6,2 mL. La resina escogida para este estudio es compuesta por una matriz de sílica con alto grado de entrecruzamiento y con grupos de intercambio iónico ligados químicamente a la matriz. El grupo de intercambio iónico es el amino cuaternario cargado positivamente. Esta resina tiene un tamaño nominal de partícula en el rango de 37μm a 55 μm y un tamaño de los poros de 500 Å. Debido a su estructura rígida e incomprimible, esta resina es adecuada para el aislamiento y purificación de proteínas, enzimas e inmunoglobulinas, particularmente en los casos de ampliación de escala y en cromatografía preparativa (WATERS, 2002).
2.2. Preparación del Lactosuero y Adsorción de las Proteínas
Para la adsorción de las proteínas fue utilizada una solución de 1% (fracción en masa) de aislado proteico de lactosuero en polvo WPI (Davisco
Bomba A Bomba B
Mixer
Válvula de Injección
Columna
Detector
Descarte
Foods, USA) preparada en tampón Tris (hidroximetil) -aminometano-HCL 0,05 M y pH 7,6 y filtrada con filtro de acetato de celulosa (0,4 μm). Esta condición fue determinada como óptima para la adsorción de las proteínas por FERREIRA (2001). La adsorción fue realizada, mediante la inyección continua de la solución de 1% de WPI através de la columna de intercambio aniónico, hasta su saturación, utilizando un “Superloop” (Pharmacia) de 200 mL, para la inyección de la muestra. Después de saturarse la columna, esta fue lavada con agua deionizada, filtrada y desgasificada, para retirar el material que no fue adsorbido. El tiempo de saturación y lavado de la columna fueron determinados experimentalmente. Para determinar el tempo de saturación fueron analizadas las fracciones al final de la columna mediante HPLC hasta verificar que las concentraciones de entrada y salida eran iguales.
2.3. Condiciones de la Desorción de las Proteínas
Después del lavado de la columna, fue realizada la desorción de las proteínas adsorbidas a la matriz. Dicha desorción se realizó usando diferentes tipos de sales y de gradientes de fuerza iónica. Las Tablas 1 e 2 muestran las fases móviles A y B y las programaciones de los gradientes utilizados, respectivamente.
Tabla 1. Sales empleadas en la desorción de las proteínas mediante gradiente
Sistema Fase Móvil A Fase Móvil B
1 Tampón Tris-HCL 0,05M pH 7,6 NaCl 1M + Fase móvil A
Tabla 2. Programación de los gradientes usados en la desorción de las proteínas
Número Tempo (minutos) Fase móvel B (%)
0 –37 10
1 37 – 85 35
85 - 122 100
122- 150 0
0 - 57 10
57 - 109 28
2 109 - 153 39
153 - 190 60
190 - 219 100
219 - 237 0
0 - 15 5
15 - 29 10
29 - 44 20
44 - 59 25
59 - 87 30
3 87 - 95 35
95 - 203 40
203 - 210 45
210 - 217 50
217 - 223 60
223 - 230 100
230 - 250 0
0 – 47 10 (pH 5)
4 47 - 172 35 (pH 4)
172 - 215 100 (pH 4)
215 - 240 0
2.4. Análisis de las Fracciones Obtenidas en la Desorción de la Columna
de exclusión molecular (CEM) en el sistema ÄKTA purifier®, con una columna Superdex® HR 75/30 (Pharmacia), flujo isocrático, fase móvil compuesta por tampón fosfato pH 7 + NaCl 0,05 M, flujo de la fase móvil de 1 mL.min-1, temperatura ambiente (28°C), volumen de inyección de 100 μL y longitud de onda de 210 nm. Los reactivos utilizados fueron de grado analítico y el agua deionizada, filtrada y desgasificada.
3. RESULTADOS Y DISCUSIÓN
Inicialmente fue verificado, que las proteínas α-la, β-lg y trazos de albúmina de suero bovino (BSA) quedaron adsorbidas en la resina. Para esto fue realizado un experimento preliminar de adsorción y desorción de las proteínas en conjunto, empleándose para la desorción una solución de NaCl 1 M, con el objetivo de obtener solamente una fracción proteica. Después de colectar estas fracciones, sus constituyentes fueron cuantificados mediante CEM.
3.1. Saturación, Desorción y Fraccionamiento de las Proteínas
La saturación de la columna de intercambio iónico, fue alcanzada mediante la inyección continua de la solución de aislado proteico descrita en el ítem 2.2. El tiempo de saturación fue calculado mediante las curvas de perfil de concentración obtenidas para ambas proteínas. Esta curva fue construida analizando las concentraciones de las proteínas en la salida de la columna de intercambio iónico. El tiempo de saturación fue definido como el tiempo en el qual las concentraciones de entrada y salida fueron iguales.
(HAHN et al., 1998). En La Figura 2 es presentado, uno de los cromatogramas obtenidos con la aplicación de los diferentes tipos de sales y gradientes testados para la desorción de las proteínas.
Figura 2 - Cromatograma obtenido con el sistema 1 y el gradiente número 1.
3.2. Análisis de las Fracciones Obtenidas en la Desorción
El análisis de las fracciones eluidas fue realizada mediante CEM, según la metodología descrita en el ítem 2.4. El cromatograma del análisis de la segunda fracción obtenida, cuando fueron utilizados el sistema 1 y el gradiente número 1 (Figura 2,) esta mostrado en la Figura 3. La fracción analizada está compuesta por α-la y β-lg, lo que muestra una cierta capacidad de esta condición de trabajo, para la separación de estas dos proteínas.
La Tabla 3 muestra las diferentes proporciones de α-la y β-lg obtenidas en las fracciones desorbidas en las diferentes condiciones testadas. En la mayoría de los casos, la desorción de las fracciones conteniendo las proteínas de interés, fue hecha en bajas concentraciones de sal (0,1 a 0,25 M), lo cual es
0 1000 2000 3000 mAU
0 20 40 60 80 %B
0 50 100 150 200 250 min
ventajoso, pues podría ser eliminada una etapa a más, normalmente usada para separar la proteína de la sal.
Figura 3 - Cromatograma de la fracción 2 de la Figura 2 obtenido por CEM.
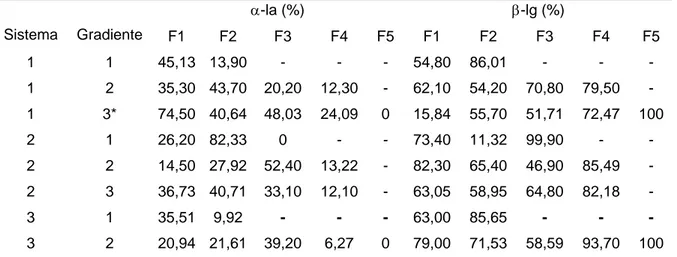
Tabla 3. Contenido de α-la y β-lg en las diferentes fracciones obtenidas
α-la (%) β-lg (%)
Sistema Gradiente F1 F2 F3 F4 F5 F1 F2 F3 F4 F5
1 1 45,13 13,90 - - - 54,80 86,01 - - -
1 2 35,30 43,70 20,20 12,30 - 62,10 54,20 70,80 79,50 -
1 3* 74,50 40,64 48,03 24,09 0 15,84 55,70 51,71 72,47 100
2 1 26,20 82,33 0 - - 73,40 11,32 99,90 - -
2 2 14,50 27,92 52,40 13,22 - 82,30 65,40 46,90 85,49 -
2 3 36,73 40,71 33,10 12,10 - 63,05 58,95 64,80 82,18 -
3 1 35,51 9,92 - - - 63,00 85,65 - - -
3 2 20,94 21,61 39,20 6,27 0 79,00 71,53 58,59 93,70 100
F: fracción. *en el sistema 1 y gradiente 3, fueron obtenidas 8 frações, siendo que las fracciones F5, F6, F7 y F8 fueron constituidas por 100% de β-lg.
fuerza iónica fue aumentada y el pH disminuido para 4, para eluir las proteínas con pI encima de 4. Estas condiciones fueron testadas debido a que al disminuir el pH las proteínas de hacen menos positivas y pueden ser eluidas mas fácilmente (GU et al., 1991). Los resultados en estas condiciones fueron similares a los obtenidos sin utilizar el gradiente de pH. Dos fracciones fueron obtenidas, siendo la primera compuesta por 19,48 % de α-la y 71,35% de β-lg y la segunda fracción por 12,59 % de α-la y 78,4 % de β-lg. En la bibliografía existen estudios referentes al aislamiento de estas proteínas, como el trabajo de YOSHIDA (1990) que utilizó cromatografía de filtración en gel, seguida de cromatografía de intercambio iónico y obtuvo fracciones con 73 % de α-la. En las investigaciones de MANJI et al. (1985) y GURGEL et al. (2001) fueron obtenidas fracciones con poco mas de 90% de pureza de α-la, trabajando con volúmenes de muestras de máximo 500 μL que son muy inferiores a las empleados en este estudio. La utilización de volúmenes mayores como los empleados por GERBERDING et al. (1998) y HANH et al. (1998) condujo a resultados comparables con los de este trabajo, o sea fracciones conteniendo diferentes porcentajes de α-la e β-lg. Todas las fracciones obtenidas contenían soluciones de sal empleado para la desorción.
En cada ciclo de extracción ( inyección y elución) y fraccionamiento de las proteínas fueron recuperadas cantidades relativamente grandes de estas proteínas, por ejemplo la cuando fue inyectado en la columna 435 mg de β-lactoglobulina, la cantidad adsorbida en la columna, fue de aproximadamente 300 mg, lo que verifica el fraccionamiento en escala semipreparativa.
La recuperación total de las proteínas, empleando los diferentes sales y gradientes, fue de aproximadamente 66% para α-lactoalbumina e de 75% para β-lactoglobulina, con una diferencia media entre os tipos de sales de 4%.
Para las fracciones ricas en β-lg, los mejores resultados fueron obtenidos mediante el empleo de del sistema 1 con gradientes 1 e 3, sistema 2 con gradiente 1, y el sistema 3 con gradiente 1, donde fueron obtenidas fracciones con 100%, 99,90%, e 85,65%, respectivamente. Para el caso de la α-la, el sistema 2 con gradiente 1 y el sistema 1 con gradiente 3 fueron los más favorables a la obtención de fracciones con 82,33 % y 14,50% de esta proteína.
Las fracciones conteniendo α-la y β-lg, con bajos contenido de sal, pueden ser utilizadas en la industria de alimentos para aumentar la gelificación, rigidez y visco-elasticidad de los geles, pudiendo ser empleadas como sustituto de las proteínas individuales (GURGEL et al., 2001). Las fracciones conteniendo β-lg pura o en concentraciones elevadas, pueden ser utilizadas en productos
4. CONCLUSIONES
La técnica de cromatografía de intercambio iónico usando diferentes tipos de gradientes, demostró ser efectiva en la separación de α-la y β-lg de las otras proteínas del lactosuero. Fueron obtenidas algunas fracciones conteniendo α-la y β-lg en proporciones factibles de uso industrial. Las mejores condiciones para la separación de las proteínas α-lactolabumina y β-lactoglobulina fue cuando de utilizó el sistema 2 con gradiente 1, donde solo fueron obtenidas tres fracciones con elevados contenidos de ambas proteínas (82,33 de α-la e 99,90 de β-lg). Cuando fue testado el cambio simultaneo de pH y fuerza iónica los porcentajes de proteínas obtenidos en cada fracción no fueron superiores.
Agradecimientos: Los autores agradecen al CNPq/PADCT III y a la Fapemig
por el apoyo financiero y también a la CAPES por la bolsa de estudios concedido a Abraham Damian Giraldo Zuñiga.
5. REFERENCIAS BIBLIOGRÁFICAS
ANUALPEC. Anuário da Pecuária Brasileira. São Paulo-Brasil: FNP Consultoria & Comercio, 2002. 400p.
DE WITH, J. N. Nutritional and Functional characteristics of whey proteins in food products. Journal Dairy Science, v.81, n.6, p.597-609, 1998.
FERREIRA, R. C. Separação de α-lactoalbumina e β-lactoglobulina de proteínas do soro de queijo por adsorção em colunas de leito fixo, Viçosa, MG: DTA, UFV, 2001. Dissertação (Mestrado), Departamento de Tecnologia de Alimentos, Universidade Federal de Viçosa , Brasil, 2001, 81p, 2001.
GIRALDO ZUÑIGA, A. D., COIMBRA, J. S. R., MINIM, L. A. Coeficientes de partição da α-lactoalbumina e β-lactoglobulina em sistemas aquosos bifásicos :influência da massa molar do polímero. Ciencia y Tecnologia de Alimentos, v. 3, n. 3, p. 149-155, 2001.
GRASSELLI, M., NAVARRO, A., FERNANDEZ, H. L., MIRANDA, M. V., CAMPERI, I., OSVALDO CASCONE. Que hacer con el suero de queso. Ciencia Hoy, v.43, n.1, p.27-35, 1997.
GU, T., TSAI, G., TSAO, G. T. Some considerations for optimization of desorption chromatography. Biotechnology and Bioengineering, v.37, p. 65-70, 1991.
GURGEL, P. V., CARBONELL, R.G., SWAISGOOD, H. Fractionation of whey proteins with a hexapeptide ligand affinity resin. Bioseparation, v. 9, p.385-392, 2001.
HAHN, R., SHULZ, P. M., SCHAUPP, C., JUNGBAUER, A. Bovine whey fractionation based on cation-exchange chromatography. Journal of Chromatography, v. 795, p.277-287, 1998.
MANJI, B., HILL, A., KAKUDA, Y., IRVINE, D. M. Rapid separation of milk proteins by anion exchange chromatography. Journal of Dairy Science, v. 68, p.3176-3179, 1985.
MORR, C., HA, E. W. Whey protein concentrates and isolates processing and functional properties critical reviews. Food Science and Nutrition, v.33, n.6, p.431-476, 1993.
NIVEN, G. W. Separation processes for biotechnology in the food industry. In: Food processing: recent developments. Elsevier Science. N.Y, 1995, p. 143-195.
PASECHNIK, V. A., PHLS, J. M. Large-scale extraction and purification of enzymes and other proteins, in: Handbook of enzyme biotechnology, third edition, editor, Wiseman, A., N.Y, 1995.
PUERTA, A., JAULMES, A., FRUTOS, M., DIEZ-MASA, J. C., VIDAL-MADJAR, C. Adsorption kinetics of b-lactoglobulin on a polyclonal immunochromatographic support. Journal of Chromatography.v.935, p.17-30, 2002.
WATERS CORPORATION, WWW.waters.com/SPE.chem.htm#qma (ingreso en 04/03/2002).
OTIMIZAÇÃO DA DESSORÇÃO DE α-LACTOALBUMINA E β-LACTOGLOBULINA EM CROMATOGRAFIA DE TROCA IÔNICA
Laboratório de Processos de Separação (LPS) / Departamento de Tecnologia de Alimentos (DTA), Universidade Federal de Viçosa, MG – Brasil, CEP 36571-000
Resumo
Na etapa de dessorção são recuperadas biomoléculas de soluções diluídas, que foram previamente adsorvidas em resinas cromatográficas. Esta etapa tem um papel importante no desenvolvimento de novos processos de separação de proteínas biologicamente ativas, particularmente em escala piloto, onde a quantidade do composto dessorvido é determinante no rendimento do processo. Para realizar a dessorção na cromatografia de troca iônica faz-se uso de soluções salinas de elevadas forças iônicas, sendo o NaCl o sal mais comumente empregado. No presente trabalho foram analisados o efeito da força iônica de uma solução salina de fosfato de potássio e a influência da vazão da fase móvel sobre o processo de dessorção das proteínas α-lactoalbumina e β-lactoglobulina previamente adsorvidas na resina Accell Plus QMA®. As condições operacionais ótimas para estes fatores foram determinadas por meio da metodologia de superfície de resposta, utilizando um planejamento fatorial 22. O valor ótimo da quantidade de proteínas recuperadas da matriz cromatográfica foi estabelecido com 1,37 gmol.L-1 de fosfato de potássio e 0,54 mL.min-1 de vazão da fase móvel.
1. Introdução
viabilizar a sua comercialização. Na literatura encontram-se vários estudos sobre o isolamento destas proteínas, porém são, na maioria, inviáveis e aplicam-se somente para propósitos de análise de laboratório (KONRAD et al., 2000).
Dentre as diversas técnicas passíveis de uso na purificação de biomoléculas, os métodos cromatográficos se destacam por apresentarem elevada eficiência na separação, alto poder de resolução e pela ampliação do seu emprego em larga escala (PASECHNIK e PHLS, 1995). A utilização de um linha de processo com uma seqüência de métodos cromatográficos possibilita purificar, por exemplo, uma única enzima, entre os milhares de componentes presentes em um extrato celular (NIVEN, 1995).
A variabilidade das técnicas cromatográficas, cada uma delas com diferentes propriedades, fornece uma combinação poderosa para a purificação de qualquer biomolécula (PHARMACIA, 1999). A quantidade e tipo de técnicas usadas nos processos de purificação, dependerão da natureza e características das amostras assim como do grau de pureza desejado no produto final (PASECHNIK e PHLS, 1995).
A escolha da técnica cromatográfica a usar leva em consideração os critérios de recuperação, resolução, velocidade e capacidade, posto que cada técnica se comporta de maneira diferenciada frente a estes parâmetros.
Dentre os diferentes métodos cromatográficos, a cromatografia de troca iônica é a técnica de purificação de proteínas de maior emprego. Adicionalmente, deve-se notar que é utilizada com efetividade pelas indústrias farmacêutica e de química fina para purificar diversas biomoléculas, mesmo quando é feita a ampliação de escala (GERBERDING e BYERS, 1998). A cromatografia de troca iônica separa biomoléculas de acordo com suas próprias cargas e as cargas do adsorvente nos quais são ligadas por meio de forças eletrostáticas (LEVISON, 2002).
de fermentação para a remoção de contaminantes simultânea à fermentação. Os produtos foram obtidos após dessorver os contaminantes das colunas cromatográficas. Embora a dessorção seja uma etapa importante na recuperação de biomoléculas, poucos são os estudos a seu respeito, principalmente no tocante às quantidades dessorvidas do adsorvente.
Na literatura não foram encontrados relatos acerca da eficiência da dessorção, ou seja quanto do produto ligado no adsorvente é recuperado na dessorção, apesar desta etapa afetar diretamente os custos de produção de biocompostos. Assim, para avaliar a dessorção no caso específico da α-la e β−lg, no presente trabalho foi estudada a dessorção desras proteínas com o emprego do sal fosfato de potássio. Este sal foi escolhido devido ao seu posterior uso no preparo de sistemas aquosos bifásicos como técnica de purificação intermediária.
A metodologia de superfície de resposta foi utilizada para otimizar o processo. Esta é uma técnica de otimização baseada em planejamentos fatoriais, introduzida nos anos cinqüenta, e desde então tem sido empregada com sucesso na modelagem de diversos processos industrias (NETO et al., 2001). É composta por duas etapas distintas, modelagem e deslocamento, que são repetidas tantas vezes quantas forem necessárias, com o objetivo de atingir uma região ótima de superfície investigada (BOX e DRAPER, 1987).
2. Materiais e métodos
2.1. Proteínas do soro
As biomoléculas utilizadas como adsorvato, foram as proteínas α-lactoalbumina e β-lactoglobulina presentes no isolado protéico de soro de queijo em pó (BioPro, Davisco Foods, USA®). A partir deste isolado foi preparada uma solução aquosa a 1% (fração mássica), a qual foi injetada na coluna cromatográfica com o auxílio de um “superloop” de 200 mL.
2.2. Matriz cromatográfica
quaternário (-C(O)NH(CH2)3N(CH3)3+Cl-). Esta resina têm um tamanho nominal de partícula na faixa de 37 μm a 55 μm e tamanho dos poros de 500 Å. É incompressível, devido a sua estrutura rígida e é adequada ao isolamento e purificação de proteínas, enzimas e imunoglobulinas, particularmente nos casos de aumento de escala e em cromatografia preparativa (WATERS, 2002). Foi empregada com sucesso para estudos de adsorção de albumina de soro bovino (ARAÚJO, 1996), beta-galactosidase (PEREIRA, 1999) e proteínas do soro de queijo (FERREIRA, 2001).
2.2. Sistema cromatográfico
O equipamento utilizado no presente trabalho foi o sistema cromatográfico “ÄKTA® purifier” desenvolvido pela Pharmacia (Suécia). O sistema consiste de duas bombas dosadoras (P-900), um misturador (m-925), uma válvula de injeção (INV-907), um detector (UV-900), um controlador de pH (pHC-900), um sistema de controle (EIC-900) e um coletor de frações (FRAC-900). É monitorado via o software UNICORN®. Um diagrama esquemático do sistema “ÄKTA® purifier” é mostrado na Figura 1.
Figura 1. Diagrama esquemático do sistema ÄKTA® purifier (Pharmacia, 1998)
2.2. Adsorção das proteínas
Para a adsorção das proteínas foi empregada a condição determinada como ótima por FERREIRA (2001): uma solução de 1% (fração mássica) de isolado protéico de soro em pó, IPS (BioPro, Davisco Foods, USA), preparada em tampão Tris-HCL 0,05 M e pH 7,6 e filtrada em filtro de acetato de celulose (0,4 μm). A adsorção foi realizada com a injeção contínua desta solução através da coluna, até atingir a saturação da mesma, usando um “Superloop” (Pharmacia) de 200 mL para injeção da amostra. Após a saturação da coluna, verificada mediante quantificação do eluente na saída da coluna, esta foi lavada com água deionizada, filtrada e degaseificada, para a retirada do material não adsorvido presente na coluna. O tempo de saturação e lavagem da coluna foi determinado experimentalmente.
Para garantir a total dessorção das proteínas e a repetitividade dos experimentos, foi implementado um procedimento de lavagem CIP (“clean-in-place”), que envolve lavagens seqüenciais com NaOH 0,1 gmol.L-1 (3 volumes de coluna), H2O (3 volumes de coluna), HCl 0,25 gmol.L-1 (3 volumes de coluna) e NaCl 2 gmol.L-1 , pH 7,5 (3 volumes de coluna).
2.3. Dessorção das proteínas
Tabela 1. Valores analisados no planejamento estatístico
O planejamento inicial, foi realizado para as condições de vazão de 0,5 mL.min-1; 1,0 mL.min-1 e 1,5 mL.min-1 e para três níveis de força iônica 0,5 gmol.L-1; 1 gmol.L-1 e 1,5 gmol.L-1.
2.4. Quantificação das proteínas eluídas na dessorção.
Para cada condição testada, a fração recolhida no coletor de frações, foi filtrada (membranas de acetato de celulose de 0,4 μm) e quantificada, em duplicata, por cromatografia liquida de alta eficiência em fase reversa (CLAE-FR, cromatógrafo SHIMADZU) segundo a metodologia descrita por GIRALDO-ZUÑIGA et al. (2000). Para quantificação simultânea das proteínas α-la e β-lg nas amostras construiu-se uma curva de calibração utilizando soluções das proteínas α-la e β-lg puras (Sigma®), com concentrações na faixa de 0,02 mg.mL-1
a 3,2 mg.mL-1.
2.5. Determinação da quantidade de proteínas adsorvidas na coluna
Para determinação da quantidade de proteína adsorvida na resina, é preciso conhecer a área sob a curva de ruptura, para posteriormente calcular o valor de “q”, mediante a equação 1. As curvas de ruptura das duas proteínas foram construídas, para cada uma das condições apresentadas na Tabela 1, com os dados obtidos mediante a coleta de frações do eluente durante a adsorção, em
Condição Q (mL.min-1) μ (gmol.L-1)
1 0,3 1
2 0,7 1
3 0,3 2
4 0,7 2
intervalos de tempo preestabelecidos. Em seguida estas frações foram analisadas por CLAE-FR, conforme o item 2.4.
ads t f m y y ydt Q t Q C q f ⎥ ⎥ ⎦ ⎤ ⎢ ⎢ ⎣ ⎡ + + ⎟ ⎟ ⎠ ⎞ ⎜ ⎜ ⎝ ⎛ − =
∫
1 20
0* * *
(1) em que b t t a y ⎟⎟ ⎠ ⎞ ⎜⎜ ⎝ ⎛ + = 0 1 b T 0
1 =C *A *L*ε
y
p
y2 =C0*AT *L*(1-εb)*ε
sendo a, b e t0 parâmetros da equação calculados por meio do ajuste e da análise
de regressão; C0 (mg.mL-1) a concentração inicial da solução; AT (m2) a área da seção transversal da coluna; L (m) o comprimento da coluna; εb e εp as porosidades do leito e da partícula, respectivamente; Q a vazão volumétrica (mL.min-1); tf o tempo final de operação e mads a massa do adsorvente (g).
Os termos y1 e y2 representam as quantidades de soluto não-adsorvido (mg) mas presentes na coluna nos espaços externo e interno à partícula, respectivamente, no instante em que o processo foi interrompido.
Um modelo empírico (sigmoidal) foi ajustado às curvas de ruptura. Por meio de integração numérica, utilizando um programa computacional em linguagem Fortran, calculou-se a área sob a curva de ruptura, segundo o procedimento estabelecido por FERREIRA (2001). Por exemplo, na Figura 2 é apresentada a área sob a curva de ruptura da β-lactoglobulina para uma vazão de 0,78 mL.min-1. Posteriormente, calculou-se o valor de q.
calculada no item 2.4. Assim foi possível avaliar a recuperação de proteínas na dessorção.
0 0.2 0.4 0.6 0.8 1
0 15 30 45 61 76 91 106
tempo (minutos)
Co
Figura 2. − Curva de ruptura para β-lactoglobulina (vazão igual a 0,78 mL.min-1) utilizada na determinação do equilíbrio, por análise frontal. Co é a concentração adimensional, e t, tempo de adsorção.
3. Resultados e discussão
3.1. Dessorção das proteínas α-la e β-lg
Inicialmente foi realizado um experimento para verificar quais proteínas presentes no IPS ficaram retidas na matriz cromatográfica. Foi observado que a resina Accell Plus QMA® adsorveu seletivamente as proteínas α-lactoalbumina e β-lactoglobulina, com alguns traços de albumina de soro bovino.
3.1.1. Otimização da dessorção
quantidade de proteínas dessorvida (D, % em massa) foi a variável dependente ou variável resposta.
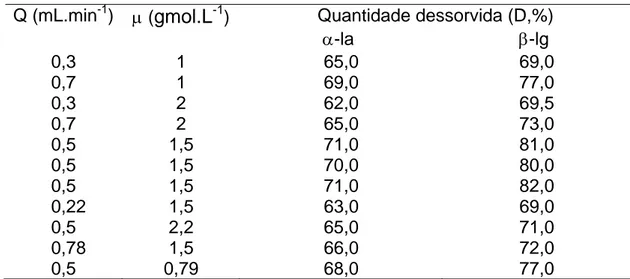
Tabela 2 - Quantidades dessorvidas para as diferentes condições testadas
O sal empregado na dessorção foi o fosfato de potássio (FFP) pois a fração dessorvida contendo as proteínas será usada no preparo de um sistema aquoso bifásico composto por polietilenoglicol (PEG) + FFP + H20, para separar a α-lactoalbumina da β-lactoglobulina.
O modelo empregado para o planejamento fatorial 22 com três repetições do ponto central foi:
2 1 12 2 2 22 2 1 11 2 2 1 1
(%) b bx b x b x b x b xx
D = o+ + + + +
∧
(1)
Este é o modelo quadrático completo, em que D (%) é a resposta predita,
0
b é o termo de intercepto, b1 e b2 são os coeficientes dos termos lineares e b11 e 22
b os coeficientes dos termos não lineares.
A partir dos resultados experimentais apresentados na Tabela 2, foram obtidas duas correlações para predizer a quantidade de proteínas dessorvidas. Os dados dos coeficientes destas correlações estão listados na Tabela 3. Para este propósito foi utilizado o pacote estatístico SAS (SAS Institute Inc., 1989), procedimentos RSREG e REG. Foram feitos os testes de falta de ajuste,
Quantidade dessorvida (D,%) Q (mL.min-1) μ (gmol.L-1)
α-la β-lg
0,3 1 65,0 69,0
0,7 1 69,0 77,0
0,3 2 62,0 69,5
0,7 2 65,0 73,0
0,5 1,5 71,0 81,0
0,5 1,5 70,0 80,0
0,5 1,5 71,0 82,0
0,22 1,5 63,0 69,0
0,5 2,2 65,0 71,0
0,78 1,5 66,0 72,0
significância dos parâmetros e análise de resíduos e do coeficiente de determinação (R2) para a escolha do melhor modelo.
Os parâmetros estimados e a análise de variância da regressão com o teste de falta de ajuste para os modelos determinados, são apresentados nas Tabelas 3, 4 e 5, respectivamente. Nestes modelos observou-se que o coeficiente do produto entre força iônica e vazão da fase móvel (x1x2), foi não-significativo a
5% de probabilidade, pelo teste t. O modelo foi reavaliado, retirando-se o parâmetro citado, e obteve-se um modelo simplificado, no qual todos os parâmetros foram significativos a 5% de probabilidade, pelo teste t.
Na Tabela 3, pode ser observado um elevado valor de R2, o que indica a eficiência do modelo para ajustar os dados experimentais. Os valores experimentais da quantidade de proteínas dessorvida em função daqueles preditos pelo modelo podem ser observados na Figura 2.
Tabela 3 – Parâmetros estimados
Proteína Intercepto (b0) b1 b2 b11 b22 R2
α-la 70,66 1,4053 -1,4053 -3,1459 -2,1458 0,9730 β-lg 81,02 1,9678 -1,4982 -5,2813 -3,5313 0,9526
Tabela 4 - Análise de variância para o ajuste do modelo
2 1 12 2 2 22 2 1 11 2 2 1 1
(%) b bx b x b x b x b xx
D = o + + + + +
∧
aos dados da Tabela 1, para a α-lactoalbumina
Fonte de variação N° de graus de liberdade
Quadrado médio Fcalculado
Regressão 4 24,1867 50,22**
Resíduo da regressão 6 0,4816
Falta de ajuste 4 0,5557 1,67ns
Resíduo puro 2 0,3333
Total
CV = 1,09%
10
** significativo a 5% de probabilidade, pelo teste F.
Tabela 5 - Análise de variância para o ajuste do modelo 2 1 12 2 2 22 2 1 11 2 2 1 1
(%) b bx b x b x b x b xx
D = o + + + + +
∧
aos dados da Tabela 1, para a β-lactoglobulina
Fonte de variação N° de graus de liberdade
Quadrado médio Fcalculado
Regressão 4 57,6665 20,67**
Resíduo da regressão 6 2,7905
Falta de ajuste 4 3,68575 3,69ns
Resíduo puro 2 1
Total
CV = 2,05%
10
** significativo a 5% de probabilidade, pelo teste F.
ns – não significativo a 5% de probabilidade, pelo teste F.
Valores experimentais (D%)
60 65 70 75 80 85
V a lo re s p redi to s (D% ) 65 70 75 80
Figura 2 – Valores experimentais da quantidade de proteínas dessorvida em função dos valores preditos pelo modelo.
Os resultados experimentais mostraram que as melhores condições de trabalho para a dessorção das proteínas α-la e β-lg dentro da faixa estudada foram: μ do sal fosfato de potássio igual a 1,37 gmol.L-1
Nestas condições foi obtida a maior recuperação do adsorvato ligado ao adsorvente. Foi observado também que as proteínas adsorvidas na coluna cromatográfica, não foram dessorvidas totalmente, ou seja não foi possível recuperar 100% das proteínas que ficaram ligadas à resina na etapa de adsorção. Este fato pode ter ocorrido devido: a) a uma forte ligação entre o grupo trocador da resina e as proteínas ou b) ao efeito de “salting out” observável em concentrações muito elevadas de sal. Para obter maiores quantidades recuperadas de proteínas podem ser empregados deslocadores específicos como, por exemplo, o ácido fítico (LUO e ANDRADE, 2000) .
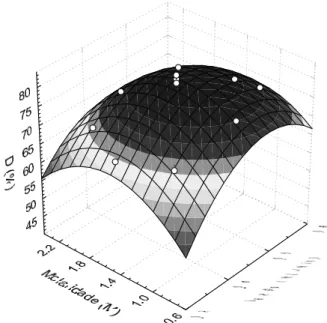
As Figuras 3 e 4 mostram as superfícies de resposta da quantidade de proteínas dessorvida (% mássica) da resina de troca iônica Accell Plus QMA® para os valores de μ e Q utilizados na dessorção das proteínas α-la e β-lg, respectivamente.
Figura 4 – Superfície de resposta para a dessorção de β-lactoglobulina com relação à força iônica de FFP e vazão da fase móvel
Na maioria de estudos envolvendo a purificação de proteínas mediante cromatografia, a etapa de dessorção tem sido avaliada com informações relacionadas com a resolução dos picos, única variável utilizada para analisar o grau de separação. Em situações onde o tempo de operação, a diluição do produto, a pureza e o rendimento alteram o custo e eficiência do processo a simples medida da resolução não é a mais adequada para definir a eficiência global da separação no processo cromatográfico (LUO e HSU, 1997). Portanto, alguns autores têm incluído novas variáveis objetivando detalhar o processo de dessorção e conseqüentemente a separação de biomoléculas com técnicas cromatográficas. LUO e HSU (1997), por exemplo introduziram uma variável, o “fator de otimização da resolução”, que define a eficiência da separação em um processo cromatográfico; porém, esta nova variável é função somente da resolução e do tempo de dessorção, não considerando o rendimento ou recuperação da biomolécula adsorvida na matriz cromatográfica.
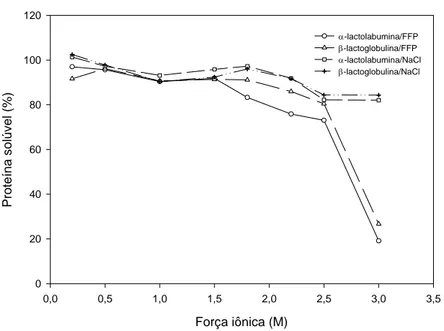
iônica ou do pH do meio, permite recuperar as moléculas adsorvidas (DORSEY et al., 1998). Quanto maior a força iônica do tampão, maior será a recuperação das biomoléculas, devido à competição entre as proteínas e os íons presentes na fase móvel pelo sítio de adsorção da resina (PHARMACIA, 1999). No entanto, no presente trabalho, quando a força iônica do sal aumentou, observou-se que a quantidade de proteínas recuperada diminuiu; este fato deve-se, provavelmente, à alteração da solubilidade das proteínas com a variação da força iônica. Para verificar este efeito, foram realizados testes experimentais de solubilidade da α-la e β-lg. A Figura 5 mostra o comportamento de ambas proteínas em função da força iônica dos sais fosfato de potássio e cloreto de sódio. Nota-se que quando a força iônica aumentou a solubilidade das proteínas diminuiu, devido provavelmente à precipitação das proteínas, com uma conseqüente redução da sua concentração no sobrenadante. Este fato pode justificar a redução da quantidade de proteínas dessorvidas em forças iônicas elevadas. Segundo SGARBIERI (1997), as proteínas precipitam pelo efeito de “salting out”, no qual a solubilidade das proteínas decresce, devido à competição entre estas e os íons salinos pelas moléculas de água, ocasionando maior interação proteína-proteína e conseqüente agregação das moléculas de proteína, seguida de precipitação.
Como observado na Figura 5, em soluções de NaCl a solubilidade das proteínas foi pouco alterada ao variar a força iônica, em comparação com soluções de FFP. Segundo ARAÚJO (1999) o FFP é mais efetivo do que o NaCl na precipitação de proteínas, devido à sua maior carga de íons. Este fato possivelmente aumentou a recuperação de proteínas na dessorção ao empregar o NaCl.
Na avaliação da dessorção das proteínas uma solução de NaCl com diferentes forças iônicas também foi testada como eluente. Os resultados mostraram que a quantidade de proteínas dessorvidas aumentou com o emprego de NaCl, principalmente, em realação à β-lg; porém, as diferenças ao redor de 4%, não foram significativas, este fato justificou a sua não utilização como eluente na dessorção, visto que o FFP seria usado para partição das proteínas na etapa posterior de extração líquido-líquido com sistemas aquosos bifásicos.
eficiência do processo. Foi observado que este parâmetro influenciou também no rendimento da dessorção das proteínas. O efeito da vazão, nos processos cromatográficos, está ligado diretamente à produtividade do processo (RICKER e SANDOVAL, 1996), mas não foram encontrados na literatura outros relatos referentes à sua influência na recuperação de compostos. Este parâmetro afeta de alguma forma o processo de dessorção, pois foi verificado a influência da vazão sobre a taxa de transferência de massa, a forma e a simetria dos picos de proteínas (DORSEY et al., 1998).
Força iônica (M)
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5
P
rote
ína s
o
lúvel (%)
0 20 40 60 80 100 120
α-lactolabumina/FFP
β-lactoglobulina/FFP
α-lactolabumina/NaCl
β-lactoglobulina/NaCl
Figura 5 – Solubilidade das proteínas α-lg e β-lg em função da força iônica de soluções de FFP e NaCl.
Dentre os estudos existentes, para a separação de proteínas do soro de queijo, usando cromatografia de troca iônica, o sal de maior uso na etapa de dessorção das proteínas é o NaCl, como observado na Tabela 6.
disponíveis referem-se ao tipo de sal, aos valores de força iônica e a vazão da fase móvel. Somente HEDDLESSON et al. (1997) apresentam a porcentagem de proteínas recuperadas ao empregar a cromatografia de bioafinidade para imobilizar trans-retinal em celite, que também foi utilizada como uma matriz seletiva para adsorção da β-lactoglobulina do soro de queijo. A β-lg foi dessorvida com uma solução de fosfato de sódio 0,4 gmol.L-1, pH 7 a uma vazão de 1 mL.min-1, obtendo-se nestas condições uma recuperação de proteínas de aproximadamente 87,1%, indicando assim que uma quantidade considerável de β-lg ficou ainda retida na coluna.
Este comportamento também foi verificado no presente trabalho, pois as porcentagens de recuperação de α-la e β-lg foram de aproximadamente 71,04% e 81,33%, respectivamente, indicando um bom resultado para o caso em estudo, onde foi avaliado o processo dessortivo simultâneo de duas proteínas, a α-la e a β-lg.
Tabela 6 - Sais empregados na dessorção das proteínas do soro de queijo
Tipo de sal μ (M) Q (mL.min-1) Referência
NaCl 0,3 2 YOSHIDA, 1990
NaCl, NaAc 0,7 2 MANJI et al., 1985
NaCl 0,1 – 1,0 3,3 HANH et al., 1998
NaAc 0,05 – 0,1 50 GERBERDING e BYERS, 1998
NaCl 0,3 - YE et al., 2000
NaCl 0,1 – 0,5 0,15 GURGEL, 2001
4. Conclusões
A solução salina de fosfato de potássio, empregada para a dessorção das proteínas, foi adequada para a dessorção das mesmas, apresentando diferenças mínimas em comparação com a solução de NaCl. Mediante o método de superfície de resposta foi possível otimizar o processo de dessorção das proteínas, sendo as condições operacionais ótimas de dessorção das proteínas α-la e β-lg: 1,37 gmol.L-1
Nestas condições foi recuperado 71,04% e 81,33% para α-la e β-lg, respectivamente.
5. Referências Bibliográficas
ARAÚJO, J. M. A. Química de alimentos/teoria e prática. Viçosa: UFV, imprensa Universitária , 1999, 415p.
BOX, G. E. P., DRAPER, N. R. Empirical model-building and response surfaces, United States of américa: Jhon Wiley & Sons, Inc, 1987, 669p.
DORSEY, J. G., COOPER, W. T., SILES, B. A., FOLEY, J. P., BARTH, H. G. Liquid chromatography: theory and methodology, Analitical Chemistry, v. 70, p.591-644, 1998.
ETZEL, M. R. Whey protein isolation and fractionation using ion exchangers. In: Bioseparation Processes in Foods. Edited by SINGH, R. K and RIZVY, S.S. N.Y. 1995. p. 389-415.
FERREIRA, R. C. Separação de α-lactoalbumina e β-lactoglobulina de proteínas do soro de queijo por adsorção em colunas de leito fixo, Viçosa, MG: DTA, UFV, 2001. Dissertação (Mestrado), Departamento de Tecnologia de Alimentos, Universidade Federal de Viçosa , 2001, 81p.
GERBERDING, S. J., BYERS, C. H. Preparative ion-exchange chromatography of proteins from dairy whey. Journal of Chromatography, v. 808, p.141-151, 1998.
GIRALDO ZUÑIGA, A. D., COIMBRA, J. S. R., FERREIRA, R. C., MINIM. L. A. Quantificação de proteínas do soro de queijo através de cromatografia líquida de fase reversa. Revista do Instituto de Laticínios Cândido Tostes. v 54, n.316, p 17-21, 2000.
GU, T., TSAI, G., TSAO, G. T. Some considerations for optimization of desorption chromatography. Biotechnology and Bioengineering, v.37, p. 65-70, 1991. GURGEL, P. V., CARBONELL, R.G., SWAISGOOD, H. Fractionation of whey
proteins with a hexapeptide ligand affinity resin. Bioseparation, v. 9, p.385-392, 2001.
HAHN, R., SHULZ, P. M., SCHAUPP, C., JUNGBAUER, A. Bovine whey fractionation based on cation-exchange chromatography. Journal of Chromatography, v. 795, p.277-287, 1998.
HOCH, G. J. Whey to go. Food processing, v. 58, n. 3, p. 51, 1997.
KONRAD, G., LIESKE, B., FABER, W. A large-scale isolation of native b-lactoglobulin: characterization of physicochemical properties and comparison with other methods. International Dairy Journal, v. 10, p. 713-721, 2000. LEVISON, P. R. Large-scale ion-exchange column chromatography of proteins
comparison of different formats. Journal of Chromatography, v.1, p. 123-135, 2002.
LUO, Q., ANDRADE , J. D. Phytic acid as an efficient low-molecular-mass displacer for anios-exchange displacement chromatography of proteins. . Journal of Chromatography B , v. 741, p.23-29, 2000.
LUO, R. G., HSU, J. T. Optimization of gradient profiles in ion-exchange chromatography for protein purification. Industrial and Engineering Chemical Research v. 36, p.444-450, 1997.
MANJI, B., HILL, A., KAKUDA, Y., IRVINE, D. M. Rapid separation of milk proteins by anion exchange chromatography. Journal of Dairy Science, v. 68, p.3176-3179, 1985.
MORR, C., HA, E. W. Whey protein concentrates and isolates processing and functional properties critical reviews. Food Science and Nutrition, v.33, n.6, p.431-476, 1993.
NETO, B, D., SCARMINIO, I. S., BRUNS, R, E. Como fazer experimentos – pesquisa e desenvolvimento na ciência e na indústria. Editorada Unicamp. SP, Brasil, 401p.
NIVEN, G. W. Separation processes for biotechnology in the food industry. In: Food processing: recent developments. Elsevier Science. N.Y, p. 143-195, 1995.
PASECHNIK, V. A., PHLS, J, M. Large-scale extraction and purification of enzymes and other proteins. In: HandbooK of Enzyme Biotechnology. Edited by Wiseman. N.Y. p.31-82. 1995.
PEREIRA, J. A. M. Adsorção de beta-galactosidase de Scopulariopsis sp. em resina trocadora de íons objetivando a purificação e a ampliação de escala, Campinas, SP: FEQ, UNICAMP, 1999. Dissertação (Doutorado), Faculdade de Engenharia Química, Universidade Estadual de Campinas, 138p. 1999.
RICKER, R. D., SANDOVAL, A. A. Fast, reproducible size-exclusion chromatography of biological macromolecules. Journal of Chromatography, v. 743, p.43-50, 1996.
SAS. Institute INC.SAS/STAT® User´s Guide, version 6, 4th ed, Volume 2, cary, NC: SAS Institute Inc., 1989, 846p.
SGARBIERI, V. C. Proteínas do leite e derivados. IN: Proteínas em alimentos protéicos. Propriedades. Degradações. Modificações. São Paulo- SP: Ed. Livraria Varela. p 139-157, 1996.
WATERS CORPORATION, WWW.waters.com/SPE.chem.htm#qma (capturado em 04/03/2002).
YE, A., SINGH, H. Influence of calcium chloride addition on the properties of emulsions stabilized by whey protein concentrate. Food Hydrocolloids, v.14, p. 337-346, 2000.
SEPARAÇÃO E PURIFICAÇÃO DA α-LACTOALBUMINA E
β-LACTOGLOBULINA POR INTEGRAÇÃO DA CROMATOGRAFIA DE TROCA IÔNICA, SISTEMAS AQUOSOS BIFÁSICOS E CROMATOGRAFIA DE
EXCLUSÃO MOLECULAR
Laboratório de Processos de Separação (LPS) / Departamento de Tecnologia de Alimentos (DTA), Universidade Federal de Viçosa, MG – Brasil, CEP 36571-000
Resumo
1. Introdução
As proteínas são componentes cuja função básica é fornecer a quantidade de aminoácidos essenciais da dieta necessária para a sobrevivência de animais e homens. Dentre os diferentes tipos de proteínas existentes, as do soro de queijo destacam-se pelas suas excelentes propriedades funcionais e nutricionais pois contêm peptídeos e proteínas bioativas que podem ser empregadas no preparo de alimentos funcionais, filmes comestíveis, alimentos nutracêuticos e fórmulas alimentícias infantis, dentre outras aplicações (FRIEDMAN, 1996; MANN, 2000; GIRALDO–ZUÑIGA et al., 2002). Estas proteínas, em forma purificada, são benéficas à saúde e permitem o desenvolvimento de alimentos especiais como, por exemplo, formulados para fenilcetonúricos. Frações enriquecidas com α-lactoalbumina, rica em triptofano, são empregadas no preparo de alimentos com elevado teor de triptofano e com baixas concentrações de β-lactoglobulina, proteína que estimula reações alergênicas e a diarréia (GRASSELLI et al., 1997; BRAMAUD et al., 1997; HUGUNIN, 1999; ETZEL, 2000).
MCINTOSHI et al. (1998) evidenciaram também que o consumo de proteínas do soro de queijo auxiliou na redução da incidência de câncer. Na Tabela 1 são mostradas algumas propriedades biológicas das proteínas α-la e β-lg.
Tabela 1 - Funções biológicas das proteínas α-lactoalbumina e β-lactoglobulina.
Proteína Função Biológica
α-lactoalbumina Anti-carcinogênica
Reguladora do sono e da vigília
β-lactoglobulina Digestiva
Suplemento alimentício Anti-carcinogênica Fonte: MCINTOSHI et al. (1998); GRASELLI et al. (1997)
(ANUALPEC, 2002) e b) a preocupação com poluição do meio ambiente, ocasionada pelo descarte do soro de queijo no solo ou em leitos de rios sem tratamento prévio, ratificam a necessidade da implementação de um processo de recuperação destas proteínas que agregue valor ao sub-produto soro de queijo e diminua a poluição ambiental.
No processo de recuperação e purificação de biomoléculas, tais como enzimas e proteínas, os processos cromatográficos destacam-se devido à sua eficiência na separação e ao seu elevado poder de resolução que levaram ao aumento do seu emprego em larga escala (PASECHNIK e PHLS, 1995) e, também, por não provocar desnaturação dos biocompostos (NIVEN, 1995). Dentre as diferentes técnicas cromatográficas, a cromatografia de troca iônica e a cromatografia de exclusão molecular são de vasto uso na purificação de proteínas. Estas metodologias vem sendo utilizadas com sucesso na purificação de biomoléculas pelas indústrias de química fina e farmacêutica (GERBERDING e BYERS, 1998). Na literatura são encontradas diversas referências de aplicações destas técnicas, inclusive relacionadas à separação de proteínas do soro de queijo, porém usando quantidades mínimas de amostras.
Uma outra operação de separação de biomoléculas é a extração líquido-líquido usando sistemas aquosos bifásicos (SAB). Os SAB são constituídos por duas fases distintas, que promovem a separação de biomoléculas, em condições amenas e em um ambiente adequado, de forma que sejam preservadas as suas principais características (ALBERTSSON, 1986).A alta concentração de água, de 65% a 90%, em tais sistemas favorece a estabilidade das proteínas durante a separação quando comparados com sistemas tradicionais, compostos com solventes orgânicos (LI et al., 1997).
tratamento da solução clarificada em uma coluna de troca aniônica. A fração contendo α-la foi recuperada mediante a lavagem da coluna com água deionizada. A fração rica em β-lg foi obtida por meio da eluição da proteínas com uma solução de NaCl. O inconveniente em usar uma solução salina na eluição é a necessidade da posterior separação da proteína da fase salina.
A ultrafiltração por membranas é usada para obter concentrados protéicos do soro (WPC) apesar da membrana ser rapidamente obstruída pelas fosfolipoproteínas e partículas suspensas do soro, levando à diminuição no fluxo de filtração (GRASSELLI et al., 1997). Industrialmente são comercializados também diferentes tipos de isolados protéicos do soro de queijo (IPS). Estes produtos, cujo conteúdo protéico é de aproximadamente 91%, conte]êm todas as proteínas do soro. Uma rota usada para a produção de IPS é o uso combinado da cromatografia de troca iônica, ultrafiltração e secagem por atomização (USDEC, 1997), mas os processos produtivos destes IPS não estão disponíveis na literatura. A comercialização individual das proteínas em forma purificada ainda é baixa embora exista demanda para estes produtos.
O pequeno número de relatos sobre a separação de proteínas de soro de queijo incentiva a busca por processos de separação e purificação alternativos que possam ser aplicados em escala contínua, que sejam técnica e economicamente viáveis bem como de fácil aumento de escala, pois a maioria dos estudos de purificação destas proteínas geram frações com níveis de pureza baixos e são de difícil aumento de escala.
2. Materiais e métodos
2.1. Proteínas do soro
Foi empregada uma solução 1 % (fração em massa) de isolado protéico de soro de queijo em pó (Biopro, Davisco Foods, USA®), na qual estavam presentes as proteínas de interesse, α-la e β-lg.
2.2. Equipamentos
O equipamento utilizado no presente trabalho para as operações de separação foi o sistema cromatográfico “ÄKTA® purifier” (Pharmacia, Suécia). O sistema é composto por duas bombas dosadoras (P-900), um misturador (m-925), uma válvula de injeção (INV-907), um detector (UV-900), um controlador de pH (pHC-900), um sistema de controle (EIC-900) e um coletor de frações (FRAC-900). Este sistema é monitorado via o software UNICORN®. Para análise e quantificação das proteínas foi empregado o cromatógrafo líquido de alta eficiência (HPLC) da SHIMADZU (Série LC - 10Avp) equipado com uma coluna de fase reversa (C-18).
A coluna empregada no sistema “ÄKTA® purifier” foi do tipo HR 10/10 de 1 cm de diâmetro por 10 cm de comprimento (Pharmacia, Suécia) empacotada com a ajuda do equipamento para empacotamento HR 10 (Pharmacia). As resinas utilizadas foram a Accell Plus QMA® (Waters) e Shepadex G-25® para a cromatografia de troca iônica e de exclusão molecular, respectivamente.
2.3. Purificação das proteínas
A metodologia para a purificação das proteínas α-la e β-lg, foi desenvolvida com a integração da: a) adsorção e dessorção das proteínas por cromatografia de troca iônica, b) partição/separação das proteínas com sistemas aquosos bifásicos e c) purificação das proteínas usando cromatografia de exclusão molecular. Cada uma destas etapas é descrita a seguir.
2.3.1. Adsorção e dessorção
preparada em tampão Tris-HCL 0,05 M e pH 7,6 e filtrada em filtro de acetato de celulose (0,4 μm). A adsorção foi realizada mediante a injeção contínua da amostra através da coluna empacotada com a resina Accell Plus QMA® até atingir a saturação. Para tanto foi usado um “Superloop” de 200 mL (Pharmacia). Após a saturação a coluna foi lavada com água deionizada, filtrada e degaseificada para a retirada do material não adsorvido.
Após a lavagem da coluna as proteínas foram dessorvidas do leito, usando uma solução de fosfato de potássio 1,37 gmol.L-1, pH 7,0 a uma vazão de 0,54 mL.min-1. A determinação destas condições foi obtida em um experimento prévio realizado para testar a influência do tipo de sal sobre a dessorção das proteínas.
2.3.2. Partição em sistema aquoso bifásico (SAB)
Para a partição das proteínas foi empregado o sistema aquoso bifásico composto por 18% de fosfato de potássio (FFP) pH 7,0 + 18% de polietilenoglicol (PEG) de massa molar 1500 Da + 64% de água. Estas condições foram estabelecidas por GIRALDO-ZUNIGA et al. (2001) como as melhores para a partição de α-la e β-lg em SAB.
O SAB foi formado adicionando à solução salina, originária da dessorção na coluna de troca iônica, o PEG e a água em quantidades adequadas para formar o sistema. O sistema foi pesado em um becker e em seguida agitado magneticamente, durante duas horas e deixados em repouso por 12 horas, para a separação das fases.
2.3.3. Cromatografia de exclusão molecular (CEM)
viscosidade, e injetada em volume de 0,5 mL. A vazão da fase móvel foi de 2 mL.min-1 .
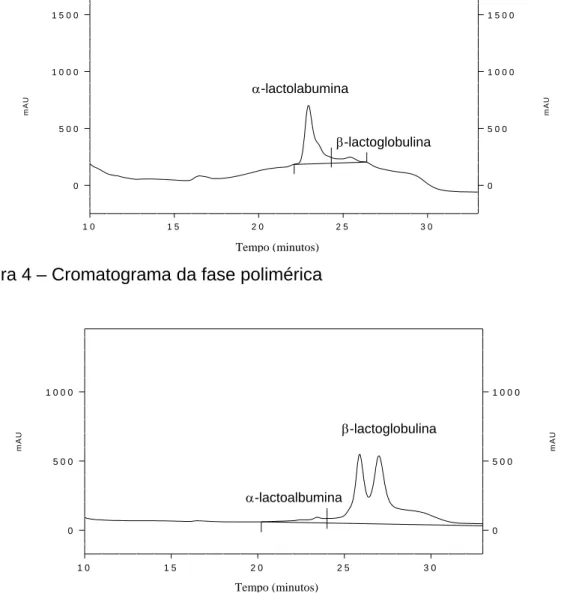
O eluente contendo PEG foi monitorado por absorção de UV a 280nm e aquele contendo sal foi monitorado por condutividade elétrica. As frações foram coletadas após cada injeção em um coletor de frações (Frac-900, Pharmacia). As frações contendo as proteínas foram inicialmente congeladas a -40°C e então liofilizadas em um equipamento LABCONCO X-23, por um tempo aproximado de 8 horas.
2.4. Análise e quantificação das proteínas
2.4.1. Eletroforese (SDS-PAGE)
As proteínas foram analisadas qualitativamente mediante a eletroforese em gel de poliacrilamida, utilizando SDS, segundo a metodologia descrita por LAEMMLI (1970). A concentração do gel de separação foi igual a 15%. Esta técnica foi escolhida por permitir detectar compostos de difícil análise na cromatografia além de possibilitar uma comparação entre todas as etapas do processo de purificação em um único gel.
Foi utilizado o equipamento com sistema vertical de placas (140 mm x 160 mm, espaçamento de 0,75 mm, SIGMA ALDRICH, MO, USA). Foi aplicada uma voltagem de 60V no gel de empilhamento e uma de 120 V no gel de separação. (fonte EC-154, E-C Apparatus Corporation) até que o marcador de frente atingisse aproximadamente 1 cm da borda inferior do gel.
Para revelação das bandas nos géis estes foram imersos em solução fixadora, contendo metanol 40% (v/v) e ácido tricloroacético 20% (m/v), por uma hora. Em seguida foram corados em solução de azul de comassie R-250 (0,25%, v/v), metanol (50%, v/v) e ácido acético (10%, v/v) por um período de 3 horas e descorados em solução de metanol (10%, v/v) e ácido acético (5%, v/v). Após revelação os géis foram armazenados em solução de glicerol 10% (v/v).
2.4.2. Cromatografia líquida de fase reversa (HPLC-RP)
fase reversa (CLAE-FR, cromatógrafo SHIMADZU Série LC - 10Avp) de acordo com a metodologia descrita por GIRALDO-ZUÑIGA et al. (2000). As análises foram feitas em duplicata, em uma coluna do tipo C18 .
3. Resultados e discussão
3.1. Adsorção e dessorção das proteínas α-la e β-lg
Para a adsorção das proteínas foi empregada a solução de isolado protéico descrita no item 2.3.1. O tempo de duração de cada experimento adsortivo dependeu da vazão de trabalho e foi calculado mediante a construção das curvas de ruptura e quantificação das proteínas no eluente na saída da coluna usando CLAE-FR (item 2.4.2). A Figura 1 mostra uma curva de ruptura obtida para a α-la; observa-se que 150 minutos após o início do processo de adsorção a coluna foi praticamente saturada. Nesta condição, a concentração de saída será igual à concentração inicial.
Tempo (min)
0 50 100 150
C/C
0
0.0 0.2 0.4 0.6 0.8 1.0
Figura 1 - Curva de ruptura para a α-lactoalbumina (vazão de 0,5 mL.min-1 ).