i
Epidemiologia e diagnóstico de dermatofitose em
humanos e animais: uma abordagem
“One Health”
Dissertação de Mestrado em Biotecnologia para as Ciências da Saúde
Sofia Teixeira Saraiva
Orientadores: Profª. Doutora Ana Cláudia Correia Coelho Profª. Doutora Maria Manuela do Outeiro Correia de Matos
iii
Epidemiologia e diagnóstico de dermatofitose em
humanos e animais: uma abordagem
“One Health”
Dissertação de Mestrado em Biotecnologia para as Ciências da Saúde
Sofia Teixeira Saraiva
Orientadores: Profª. Doutora Ana Cláudia Correia Coelho Profª. Doutora Maria Manuela do Outeiro Correia de Matos
v
Epidemiologia e diagnóstico de dermatofitose em
humanos e animais: uma abordagem
“One Health”
Dissertação de Mestrado em Biotecnologia para as Ciências da Saúde
Sofia Teixeira Saraiva
Orientadores: Profª. Doutora Ana Cláudia Correia Coelho Profª. Doutora Maria Manuela do Outeiro Correia de Matos
Composição do júri:
vii
Este trabalho é uma obra original realizado para a obtenção do grau de
Mestre em Biotecnologia para as Ciências da Saúde.
ix
António Fontainhas Fernandes agradeço a possibilidade de realizar este trabalho.
À Professora Doutora Ana Cláudia Coelho por aceitar ser minha orientadora de estágio, assumindo o compromisso de me acompanhar nesta etapa, guiando-me, mas principalmente pela sua disponibilidade, ajuda, apoio e ensinamentos. À Professora Doutora Manuela Matos, minha coorientadora pela sua simpatia, ajuda e conhecimentos transmitidos.
À D. Fátima Fraga, D. Sónia Dias, D. Lurdes Campos e D. Fátima Peixoto por todo o auxílio prestados nos seus laboratórios, agradecendo especialmente a sua disponibilidade, gentileza, compreensão e amizade.
À Doutora Sandra Martins, pela amizade, carinho e ajuda.
À Ana Sofia Soares pela ajuda e apoio dado no seguimento do trabalho.
À Daniela Alves, melhor companheira de trabalho, pelo companheirismo, ajuda, amizade e apoio.
À Rita Santos pela ajuda, pelas opiniões e principalmente pela partilha de conhecimentos, nervosismos e inseguranças não só nesta reta final mas em todo o nosso percurso académico.
xi
mais frequentes a nível mundial (Shimamura et al., 2012; Hube et. al, 2015) afetando também a maioria dos animais de companhia, ruminantes e vida selvagem (Chermette et al., 2008). Desta forma apresentam uma preocupação a nível da saúde pública e veterinária.
A finalidade deste trabalho foi efetuar um estudo epidemiológico de dermatófitos isolados em animais selvagens, animais domésticos e em humanos. Esta parte do trabalho foi realizada recorrendo a métodos microbiológicos. A partir desses resultados foi calculada a prevalência de dermatófitos em diferentes espécies.
Com uma prevalência total de 7,9% de isolados de dermatófitos obtidos, a coexistência destes fungos com animais selvagens foi comprovada para raposas e sacarrabos. Nos animais domésticos a prevalência de isolamento foi de 9,3% correspondendo a amostras de animais assintomáticos. Um teste à sensibilidade e especificidade do DTM demonstrou a fragilidade deste método e os erros que podem vir associados. Um estudo de caso em humanos demonstrou a presença do fungo Aspergillus num quadro clínico representativo de dermatofitose.
Recorrendo a técnicas moleculares pretendeu efetuar-se uma otimização das mesmas de forma a obter um método complementar de diagnóstico mais fiável e rápido usando “primers” específicos para a identificação de dermatófitos. A identificação de dermatófitos através de “primers” específicos não obteve resultados satisfatórios e por isso foi estudada a diversidade genética das estirpes de dermatófitos isoladas através da análise das mesmas com recurso a marcadores moleculares, mais especificamente, os ISSRs.
Mostra-se então de extrema importância inferir acerca do papel dos animais estudados na infeção de dermatofitoses e realizar mais estudos que permitam o estudo epidemiológico e molecular dos dermatófitos de forma a permitir uma melhor identificação, levando ao melhoramento das técnicas de diagnóstico.
xiii
common infections at a world level (Shimamura et al., 2012; Hube et. al, 2015). They also affect the majority of the pets, ruminants and wild life (Chermette et al., 2008). This way they represent a concern on a level of public and veterinarian health.
The finality of this study was to do an epidemiologic study of isolated dermatophytes in wild animals, domestics and in humans. This part was realized using microbiologic techniques. The prevalence of the dermatophytes in different species was calculated through this results.
In regards to the prevalence of 7,9% of dermatophytes isolates, the coexistence of this moulds with wild animals was verified to Vulpes vulpes and Herpestes ichneumon. In the domestic animals the prevalence was 9,3% corresponding to asymptomatic animals. A test to the sensibility and specificity revealed the fragility of this method and the errors associated. A case report of humans demonstrated the presence of the Aspergillus mould in a clinical scenario of dermatophytosis.
Using molecular methods, we tried to make an optimization in order to obtain a complementary screening method more viable and fast using specific primers. The identification of dermatophytes trough specific primers had unsatisfactory results and therefore the genetic diversity of the isolated dermatophyte strains was study using molecular markers, namely ISSRs.
It shows then utmost importance infer the role of infection in the animals studied in the dermatophytosis and further work must be executed to enable epidemiological and molecular studies of dermatophytes to allow better identification, leading to improvement of diagnostic techniques.
xv
INTRODUÇÃO ... 1
1.1 INTRODUÇÃO AOS FUNGOS/DERMATÓFITOS ... 1
1.2 CLASSIFICAÇÃO DOS FUNGOS/DERMATÓFITOS ... 2
1.3 ETIOLOGIA ... 3 1.4 EPIDEMIOLOGIA ... 6 1.4.1 Prevalência ... 6 1.4.1.1 Prevalência em Humanos ... 7 1.4.1.2 Prevalência em animais ... 8 1.5 POTENCIAL ZOONÓTICO ... 9 1.6 PATOGENIA ...10 1.7 QUADRO CLÍNICO ...12 1.8 DIAGNÓSTICO LABORATORIAL ...14 1.8.1 Biologia molecular...15
1.9 PROFILAXIA, TRATAMENTO E CONTROLO...19
OBJETIVOS ...23
MATERIAL E MÉTODOS ...23
3.1 AMOSTRAS ...23
3.1.1. Amostras de animais selvagens ...23
3.1.2. Amostras de humanos e animais selvagens ...24
3.2 COLHEITA E ENVIO DO MATERIAL AO LABORATÓRIO ...24
3.3 DIAGNÓSTICO LABORATORIAL ...24
3.3.1 Métodos micológicos - Isolamento e identificação de dermatófitos ...24
3.3.2 Cálculo da sensibilidade e especificidade do DTM ...25
3.3.3 Métodos moleculares ...25
3.3.3.1 Extração de DNA ...25
3.3.3.2 Protocolo da extração de DNA ...26
Preparação do lisado ...26
3.3.4 PCR específico ...27
3.3.4.1 Seleção de “primers” ...27
3.3.4.2 PCR ...28
3.3.4.3 Purificação de DNA ...30
3.3.4.4 Eletroforese em gel de agarose ...30
3.4 ANÁLISE DE RESULTADOS ...31
RESULTADOS ...33
4.1 ISOLAMENTO E IDENTIFICAÇÃO DE DERMATÓFITOS EM SELVAGENS ...33
xvi
4.4.1 Estudo de caso de lesões compatíveis com dermatofitoses no couro cabeludo40
4.5 ANÁLISE DO DNA EXTRAÍDO...40
4.6 REAÇÕES DE PCR PARA O GENE ESPECÍFICO DA METALOPROTEINASE-1...41
4.6.1 Com Master Mix da Thermo Scientific® ...41
4.7. ESTUDO DE VARIABILIDADE INTRA GENÉROS COM “PRIMERS” ISSRS ...45
4.7.1 Seleção de “primers” ...45 4.7.2 Resultados ISSRs ...45 4.7.3 Análise filogenética ...47 DISCUSSÃO ...49 CONCLUSÕES ...57 BIBLIOGRAFIA ...59 ANEXOS ...65
xvii
FIGURA 2. MACROCONIDIA REFERENTE A MICROSPORUM CANIS, MICROSPORUM GYPSEUM E
MICROSPORUM NANUM. ... 6
FIGURA 3. MACROCONÍDIA REFERENTE A TRICHOPHYTON MENTAGROPHYTES... 6
FIGURA 4. MARCADOR DE PESO MOLECULAR DE DNA UTILIZADO ...31
FIGURA 5.TRICHOPHYTON SPP. ISOLADO DAS AMOSTRAS DR 644, DSR 1986 E DR 2107.34 FIGURA 6.MICROSPORUM CANIS. ISOLADO DAS AMOSTRAS DSR 2117 E 2068. ...34
FIGURA 7. MUDANÇA DE COR NO MEIO DTM. AMOSTRA DR 644. ...36
FIGURA 8. ESTRUTURA MICROSCÓPICA DO GÉNERO MICROSPORUM SPP. ISOLADO DAS AMOSTRAS DAS AMOSTRAS D35 E D44. ...38
FIGURA 9.ESTRUTURA MICROSCÓPICA DE MICROSPORUM NANUM. ISOLADO DAS AMOSTRAS DAS AMOSTRAS D20 E D25. ...38
FIGURA 10. ESTRUTURA MICROSCÓPICA DE GÉNERO MICROSPORUM GYPSEUM. ISOLADO DA AMOSTRA D42...39
FIGURA 11. ESTRUTURAS MICROSCÓPICAS DA AMOTRA H6, GÉNERO ASPERGILLUS...40
FIGURA 12. RESULTADO DA PCR COM "PRIMER" ISSR 812 COM COMPONENTES DA MIX SEPARADOS. ...41
FIGURA 13.DNA GENÓMICO DAS AMOSTRAS EXTRAÍDAS. ...41
FIGURA 14. RESULTADOS PCR COM "PRIMER" ESPECÍFICO DA METALOPROTEINASE. ...42
FIGURA 15. RESULTADOS PCR COM "PRIMER" METALOPROTEINASE-1...42
FIGURA 16. RESULTADOS PCR "PRIMERS" METALOPROTEINASE-1...43
FIGURA 17. RESULTADOS PCR "PRIMERS" METALOPROTEINASE-1 ...43
FIGURA 18. RESULTADOS PCR "PRIMERS" METALOPROTEINASE-1...44
FIGURA 19.PRODUTOS DE AMPLIFICAÇÃO POR PCR, REFERENTES AO “PRIMER” UBC810.45 FIGURA 20. DENDROGRAMA COM AS RELAÇÕES FILOGENÉTICAS ENTRE AS 6 AMOSTRAS DE DERMATÓFITOS USADAS NESTE ESTUDO COM BASE NOS MARCADORES ISSRS, APLICANDO O MÉTODO UPGMA E O COEFICIENTE DICE. ...48
ÍNDICE TABELAS
TABELA 1. PRINCIPAIS AGENTES ETIOLÓGICOS DAS DERMATOFITOSES CONSOANTE OS SEUS HOSPEDEIROS.. ... 4TABELA 2. “PRIMERS” USADOS NESTE TRABALHO. ...28
TABELA 3.CONSTITUINTES DA REAÇÃO DE METALOPROTEINASE COM ENZIMA TAQ POLIMERASE DA NZYTECH E RESPETIVOS VOLUMES. ...29
TABELA 4. CONSTITUINTES DA REAÇÃO DE ISSRS COM TAQ POLIMERASE NZYTECH E RESPETIVOS VOLUMES. ...29
TABELA 5. CONDIÇÕES DE CICLOS E TEMPERATURAS PARA A METALOPROTEINASE. ...29
TABELA 6. CONDIÇÕES DE CICLOS E TEMPERATURAS PARA ISSRS. ...29
TABELA 7. DETEÇÃO DE DERMATÓFITOS POR FAMÍLIAS E ESPÉCIES TAXONÓMICAS PARA OS MAMÍFEROS SELVAGENS DURANTE O PERÍODO DE 2009 A 2013. ...35
xviii
14 DIAS, EM 127 CULTURAS. ...37 TABELA 10. TABELA DE CONTINGÊNCIA PARA O CÁLCULO DA ESPECIFICIDADE E SENSIBILIDADE.
...37 TABELA 11.NUMERO DE BANDAS OBTIDAS PARA CADA UM DOS “PRIMERS” USADOS...46
TABELA 12. RESULTADOS OBTIDOS PELA AMPLIFICAÇÃO POR PCR PARA CADA “PRIMER”
xix
bp – base pair (pares de bases)
dNTPs - deoxynucleotide triphosphates
DNA – deoxyribonucleic acid (Ácido desoxirribonucleico) DTM – Dermatophyte Test Medium
HIV - Vírus da Imunodeficiência Humana IC – intervalo de confiança
ITS – internal transcribed spacer ISSR - Inter-Simple Sequence Repeat KOH - hidróxido de potássio
MgCl2 – cloreto de magnésio MM – marcador molecular mtDNA – DNA mitocondrial NTS – non-transcribed spacer
PCR – Polymerase chain reaction (Reação em cadeia da polimerase) PDA – Potato Dextrose Agar
RAPD- Random Amplification of Polymorphic DNA rRNA – RNA ribossomal
Taq – Thermus aquaticus
TBE- tampão constituído por Tris/Borato/EDTA tRNA – RNA de transferência
1
Dermatofitoses no paradigma “One Health”
Introdução
1.1 Introdução aos fungos/dermatófitos
As doenças fúngicas dermatológicas localizadas a nível superficial como as dermatofitoses ou tinha são das infeções mais frequentes a nível mundial (Shimamura et al., 2012; Hube et. al, 2015). Afetam também a maioria dos animais de companhia, ruminantes e vida selvagem (Chermette et al., 2008). Desta forma representam uma preocupação a nível da saúde pública e veterinária (Cafarchia et al., 2013). Estas doenças são contagiosas entre os animais, e à parte do aspeto inestético das lesões, torna-se ainda impedimento à realização de exibições de animais, atividades desportivas ou transações comerciais (Chermette et al., 2008). Apresentam ainda consequências a nível do crescimento dos animais, na produção de leite, da carne e ainda na indústria do couro e da pele visto que a sua qualidade diminui (Agnetti et al., 2014). Para além de terem um elevado custo de tratamento e o seu controlo não ser fácil, a tinha nos animais apresenta também um risco para a saúde pública visto que a maioria dos dermatófitos isolados dos animais apresentam um potencial zoonótico elevado (Chermette et
al., 2008).
As dermatofitoses são causadas maioritariamente por fungos Ascomycota da família dos dermatófitos (Segal & Frenkel, 2015), queratinofílicos e queratinolíticos, ou seja, que conseguem danificar e utilizar a queratina encontrada em cabelos, pelos e pele (Akcaglar et al., 2011; Khaled et al., 2014). Por vezes, certas infeções cutâneas semelhantes são provocadas por algumas espécies de leveduras do género Candida e pelos fungos basidiomicetes do género
Malassezia (Segal & Frenkel, 2015) e nestes casos são consideradas dermatomicoses
oportunistas (Akcaglar et al., 2011). As designações utilizadas para identificar as infeções em humanos não são baseadas no organismo responsável mas sim no tipo e na localização anatómica das infeções (Hube et al., 2015). Como tal surge a palavra tinea seguida da palavra em latim do local do corpo afetado. Segundo as manifestações clínicas pode ocorrer a tinea
barbae (afeta a barba e o bigode), tinea capitis (afeta o escalpe, sobrancelhas e pestanas), tinea corporis (afeta pele sem pelo), tinea cruris (afeta as virilhas), tinea imbricata (o principal
agente causador é T. concentricum), tinea manuum (afeta as mãos), tinea pedis (afeta os pés- conhecido pé de atleta) e tinea unguium (afeta as unhas). Vários locais do corpo podem ser afetados pela mesma espécie de dermatófitos e diferentes espécies podem causar as mesmas lesões (Weitzman et al.,1995).
2
A distribuição dos dermatófitos varia consoante a sua proveniência geográfica e outros fatores epidemiológicos como a idade, o sexo e as estações do ano (Cafarchia et al., 2013), assim como a transmissão destes fungos para os humanos pode variar consoante o país e o tipo de relações entre os humanos e os animais (Chermette et al., 2008).
1.2 Classificação dos fungos/dermatófitos
Inicialmente, os dermatófitos foram classificados em quatro géneros, Achorion,
Epidermophyton, Microsporum e Trichophyton por Raimond Sabouraud, na sua obra de 1910,
tendo como base os aspetos clínicos da doença e observações microscópicas (Weitzman et al., 1995, Cafarchia et al., 2013). Em 1934, Chester Emmons modificou essa taxonomia, estabelecendo a classificação atual com base na morfologia dos esporos e dos órgãos acessórios. Desta forma, apenas existem três géneros: Microsporum, Trichophyton e Epidermophyton, (Khaled et al., 2015). Segundo a sua morfologia, estes são considerados os fungos imperfeitos ou estados anamórficos, visto que se descobriu mais tarde a existência de espécies telemórficas (fungos perfeitos) (Cafarchia et al., 2013) pertencentes ao género Arthroderma (Chermette et
al., 2008). Os anamórficos correspondem ao estado em que ocorre reprodução assexuada ou
somática e os telemórficos ao estado em que ocorre a reprodução sexuada (Simpanya, 2010). A reprodução de forma sexuada tem sido demonstrada em diversas espécies e requer duas estirpes compatíveis (“+” e “-“) e um meio adequado (Simpanya, 2010).
Os dermatófitos apresentam também 3 fontes de infeção ou 3 biótipos (Segal & Frenkel, 2015), quer isto dizer que podem ser antropofílicos, zoofílicos ou geofílicos consoante o seu habitat natural (Akcaglar et al., 2011; Cafarchia et al., 2013). Os dermatófitos antropofílicos infetam os humanos e raramente atingem outros animais. Já os zoofílicos estão associados com os animais e podem ocasionalmente infetar os humanos. Por fim, os geofílicos relacionam-se com materiais queratinofílicos que se dissociam dos organismos vivos e se encontram em processo de decomposição nos solos e podem causar infeção a humanos e animais (Segal & Frenkel, 2015). Sendo assim, todos os fungos pertencentes a estes três grupos podem infetar humanos causando as dermatofitoses, por via direta ou indireta e daí a importância do seu estudo (Weitzman et al., 1995). A distinção entre dermatófitos geofílicos e zoofílicos é baseada numa análise ecológica e pode não ser fácil em estudos de baixa escala. Muitas infeções por dermatófitos zoofílicos parecem ser adquiridas por fómites de animais que não apresentam sinais clínicos (Weitzman et al., 1995).
3
1.3 Etiologia
Nesta revisão bibliográfica apenas se vai abordar as espécies e subespécies de dermatófitos relacionadas com o trabalho. As espécies mais preocupantes são Microsporum
canis que se encontra normalmente em gatos e cães, Trichophyton verrucosum que aparece em
ruminantes e Trichophyton mentagrophytes encontrado em roedores e lagomorfos e uma grande variedade de outros hospedeiros (Chermette et al., 2008). Estes dermatófitos são zoofílicos e responsáveis por grande parte das dermatofitoses nos humanos em todo o mundo (Cabañes, 2000) visto que a tinha corporal em humanos tem como principais agentes etiológicos T.
rubrum, T. mentagrophytes e M. canis (Shimamura et al., 2012).
Na tabela 1 podem-se observar os principais agentes etiológicos das dermatofitoses consoante os seus hospedeiros.
Microsporum canis representa 90% dos isolados felinos na maioria dos estudos feitos a
nível mundial (Chermette et al., 2008; Bond, 2010). A sua frequência é menor nos cães e nos cavalos podendo também ser isolado em coelhos, roedores, e todos os tipos de mamíferos, incluindo a vida selvagem (Chermette et al., 2008).
T. erinacei encontrado em cães é associado frequentemente ao ouriço (Chermette et al.,
2008; Bond, 2010). Trichophyton equinum encontra-se em cavalos, mas infeções em gatos, cães e humanos por este fungo também já foram detetadas (Chermette et al., 2008). Da mesma forma, M. gallinae infeta aves e T. simii é encontrado, raramente, em aves, carnívoros e primatas.
Nos ruminantes, a tinha é causada na maior parte dos casos pelo fungo zoofílico T.
verrucosum (Bond, 2010), representando o seu reservatório natural (Seebacher et al., 2008)
podendo, no entanto, infetar outros hospedeiros (Chermette et al., 2008). T. mentagrophytes (Bond, 2010) e T. megninii. são outros fungos encontrados com muita frequência em ruminantes (Agnetti et al., 2014). T. mentagrophytes é comum em roedores, mas também pode ser encontrado em carnívoros, cavalos, coelhos e, com menos frequência, em ruminantes e em suínos (Chermette et al., 2008) podendo, no entanto, infetar outros hospedeiros.
T. mentagrophytes apresenta dois estados: o aveludado (var. interdigitale) associado
com a tinea pedis e o granular (var. granulare) associado com infeções em animais ou em humanos (Georg, n.d.). Desta forma este dermatófito não pode ser classificado apenas em antropofílico ou apenas zoofílico. O complexo T. mentagrophytes apresenta duas formas sexuadas, A. vanbreuseghemii e A. behamiae. O seu estado imperfeito, T. mentagrophytes var.
4
interdigitale têm uma grande importância na saúde pública visto ser o principal agente de
pé-de-atleta e, morfologicamente identifica-se com A. vanbreuseghemii (Simpanya, 2010). O complexo M. gypseum é representado por dermatófitos geofílicos que apenas são responsáveis por um pequeno número de dermatofitoses em animais e em humanos (Cabañes, 2000). Estas espécies são, no entanto, os dermatófitos geofílicos mais comuns entre os animais, numa vasta variedade de hospedeiros, passando por cães, gatos e cavalos (Cafarchia et al., 2004; Chermette et al., 2008).
De uma forma mais rara, foram também isolados dermatófitos antropofílicos como M.
audouini, T. rubrum, T. tonsurans, T. violaceum em animais. É importante ter isto em conta
quando se trata da observação de culturas micológicas provenientes de animais, visto que os fungos isolados podem ser o reflexo da microbiota dos humanos que se encontram na mesma área geográfica e não uma infeção patogénica nos animais (Chermette et al., 2008).
Tabela 1. Principais agentes etiológicos das dermatofitoses consoante os seus hospedeiros. (Adaptado de
Cabañes, 2000).
Hospedeiro Dermatófitos
Cães e Gatos M. canis
Outros: T. mentagrophytes, M. gypseum,
M. persicolor
Cavalos T. equinum
Outros: M. canis, M. equinum, M.
gypseum,
T. mentagrophytes, T. verrucosum
Bovinos, ovelhas e cabras T. verrucosum
Outros: M. canis, M. gypseum,
T. mentagrophytes, T. equinum
Coelhos T. mentagrophytes
Outros: M.canis
Porcos M. nanum
Outros: M. canis, M. gypseum,
T. mentagrophytes, T. verrucosum
Aves M. gallinae
5
As espécies de dermatófitos que afetam os animais são conhecidas como espécies ectotrix pois as hifas septadas invadem os fragmentos de pele e de pelo dividindo-se em artrospóros formando um revestimento á volta das estruturas infetadas. As macro e microconídias só se observam na cultura em laboratório (Quinn et al., 1994). Os fungos
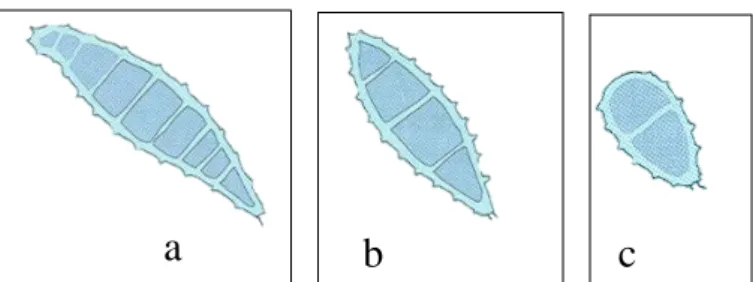
Microsporum spp. são caracterizados por macroconídias em forma de fuso ou barco (Figura 1)
e os Trichophyton spp. em forma de charuto alongado, com septos que as dividem entre 3 a 8 células (Figura 1). Já em termos de microconídias, estas são raras no primeiro género (Figura 1) e costumam ser em forma de gota, ao contrário do segundo género onde estas são abundantes e por vezes encontram-se em conjunto em forma de uva (Figura 1). Microsporum nanum difere dos restantes por apresentar as macroconídias em forma de pera e normalmente com duas divisões (Quinn et al., 1994).
As colónias de Microsporum canis são brancas com aspeto sedoso ao centro e a periferia costuma ser amarelada, assim como a parte reversa. As macroconídias em forma de fuso, acabam como que numa forma de maçaneta (Figura 2) (Quinn et al., 1994). As colónias planas com bordas de aspeto pulverulento são características de M. gypseum. A parte frontal é caracterizada por uma cor de canela e a reversa por um amarelo pálido. A macroconídia é abundante, em forma de barco, com bordas redondas e com paredes grossas (Figura 2). Por último, M. nanum produz no início uma colónia branca e com aspeto de algodão que mais tarde progride para uma colónia granular mais acastanhada com parte reversa laranja a vermelho acastanhado. A macroconídia também é abundante, em forma de pera. Usualmente apresenta 2 células, podendo apresentar 1 a 3 células (Figura 2) (Quinn et al., 1994).
Figura 1: Macro e Microconídia referente a Microsporum (a) e Trichophyton (b). (Adaptado de Quinn et al.,
1994).
6
Figura 2. Macroconidia referente a Microsporum canis (a), Microsporum gypseum (b) e Microsporum nanum
(c) (Adaptado de Quinn et al., 1994).
A espécie, Trichophyton mentagrophytes pode produzir dois tipos de colónias: uma granular (mais comum quando recolhido dos animais) e uma com aspeto de lã. A primeira com cor creme, por vezes acastanhada, que por trás varia entre tons mais claros a mais escuros de castanho. O segundo tipo de colónia é branco sendo que colónias mais antigas começam a apresentar a cor creme. A parte reversa varia de branco a amarelo ou mesmo castanho (Quinn
et al., 1994). A macroconídia é abundante nas colónias granulares sendo em forma de charuto
e com paredes finas (Figura 3).
Figura 3. Macroconídia referente a Trichophyton mentagrophytes (Adaptado de Quinn et al., 1994).
1.4 Epidemiologia
O conhecimento da epidemiologia é importante quer no controlo da infeção quer nos vários problemas de saúde relacionados com as dermatofitoses (Weitzman et al., 1995).
Estima-se que cerca de 20% da população mundial apresente infeções cutâneas e, no caso das dermatofitoses, a epidemiologia revela-nos que os dermatófitos são encontrados mais frequentemente em climas tropicais (Segal & Frenkel, 2015).
1.4.1 Prevalência
A prevalência da tinha, tal como foi referido, varia consoante o clima e os reservatórios naturais presentes (Chermette et al., 2008), de acordo com a raça e a localização geográfica,
7
migrações e fatores socioeconómicos e culturais (Akcaglar et al., 2011). Por outro lado, verifica-se um aumento na prevalência desta doença devido ao número elevado da incidência de doenças, como por exemplo, infeção por HIV e ao grande número de terapias que utilizam imunossupressores (esteroides sistémicos ou quimioterapia) que aumentam o risco de desenvolvimento de infeção nesses pacientes (Hube et al., 2015). Outras razões responsáveis por este aumento podem ser o historial médico familiar dos pacientes, as suas ocupações, estilo de vida, fisiologia associada e ainda o aumento do número de pessoas que vivem numa grande proximidade entre si (Akcaglar et al., 2011).
1.4.1.1 Prevalência em Humanos
Nos últimos 70 anos, o espetro de dermatófitos isolados de lesões da pele tem sofrido muitas alterações. Na Europa Central e Norte, M. audouinii e E. floccosum eram os fungos mais isolados, no entanto, desde os anos 50 do último século que o dermatófito mais isolado em humanos é T. rubrum sendo responsável por 69,5% de todas as infeções causadas por
Trichophyton, seguido de T. mentagrophytes. Estes dados podem ser relacionados com o
aumento da incidência da tinha do pé. No sul da Europa e nos países Árabes as espécies mais isoladas são M. canis e T. verrucosum. Nos países mediterrâneos da Europa, a ocorrência das infeções por M. canis tem aumentado nos últimos anos, sendo este o dermatófito mais frequente na tinha do couro cabeludo nas crianças (Seebacher et al., 2008). Desta forma, pode-se afirmar que os dermatófitos zoofílicos e as infeções correspondentes são as mais frequentes na Europa do Sul sendo que na Europa Central e do Norte predominam os agentes antropofílicos, principalmente, T. rubrum, e consequentemente, a tinha do pé e as onicomicoses (Seebacher et
al., 2008).
Em muitas partes do globo, a infeção por dermatófitos mais frequente é a tinea corporis (cerca de 70%) ou a tinea circinata, seguida da tinea cruris, tinea pedis e onicomicoses (Hube
et al., 2015). Estas percentagens podem variar de região para região. Como exemplo temos três
estudos, um na Turquia onde a tinha que apresentou mais prevalência foi a tinea unguium (Akcaglar et al., 2011) assim como na Itália e na Etiópia onde a tinea unguium representava 39% e 51,1% das dermatofitoses, respetivamente, seguida da tinea corporis e tinea pedis (Vena
et al., 2012; Teklebirhan & Bitew, 2015). Em crianças as infeções mais comuns são a tinea corporis e a tinea capitis, enquanto que nos adolescentes as mais comuns são a tinea cruris, a tinea pedis e a tinea unguium (Ely et al., 2014). O pé de atleta e a tinha genital tem uma maior
prevalência nos homens do que nas mulheres (Kaushik et al., 2015). A tinea capitis têm uma maior prevalência entre crianças entres os 3 e os 7 anos (Kaushik et al., 2015).
8
A espécie antropofílica T. rubrum é a mais comum nas infeções da pele e das unhas. As infeções que afetam o cabelo (tinea capitis), podem ser causadas pelo fungo M. canis, através do contato com animais contaminados, sintomáticos ou assintomáticos (Segal & Frenkel, 2015).
A repartição da tinea pedis e, em paralelo, de T. rubrum, é influenciada por fatores exógenos. Götz e Hantschke (1965) relacionaram a elevada prevalência de pé de atleta nos mineiros com o uso de chuveiros públicos, assim como, o aumento do risco de infeção com a duração da atividade na mina. Outras publicações referem o elevado risco do aparecimento da tinha do pé em desportos recreativos (Seebacher et al., 2008) e ainda as piscinas, e as suas instalações, são descritas como um fator de risco pois podem servir como reservatório de restos de pele de indivíduos infetados que podem transmitir a infeção. Outros autores demonstraram que piscinas sob condições subtropicais encontram-se mais contaminadas tendo sido isolados principalmente dermatófitos antropofílicos como T. mentagrophytes (interdigitale) e T. rubrum (Detandt & Nolard, 1988). Segal e Frenkel (2015) referenciaram também que existem diferenças sazonais, com um maior isolamento de dermatófitos na primavera e no verão.
A tinea capitis afeta os cabelos das crianças antes da sua puberdade e raramente afetam os adultos. Esta dermatofitose é muito contagiosa e apresenta um tratamento prolongado sendo esses os seus principais problemas. O principal dermatófito responsável pela tinea capitis na Europa é M. canis, segundo Schwinn e seus colaboradores (1995). No entanto, outros estudos realizados na Suécia e em Espanha apresentam resultados contraditórios onde T. violaceum e
T. tonsurans eram os mais prevalentes (Cuetara et al., 1997)
Tinea capitis profunda (Kerion Celsi) e outras micoses inflamatórias da pele são
frequentemente causados por T. verrucosum, (Seebacher et al., 2008) sendo os bovinos a maior fonte de infeção por este dermatófito (Seebacher et al., 2008; Segal & Frenkel, 2015). As infeções humanas devido a este fungo são encontradas na sua maioria em população rural e podem ser devidas a contato direto com animais infetados ou a contato indireto por pelos desses mesmo animais que são transportados nas roupas dos agricultores (Georg, n.d.).
Os dermatófitos zoofílicos, sem contar com a tinea capitis, causam normalmente tinea
corporis (incluindo tinea faciei) em pessoas de qualquer grupo de idade e raramente causam tinea cruris e onicomicoses (Weitzman et al., 1995).
1.4.1.2 Prevalência em animais
Os dermatófitos, especialmente M. canis, são isolados também de animais assintomáticos, normalmente cães e gatos, que servem como portadores (Chermette et al.,
9
2008). De acordo com estudos efetuados em alguns países como Croácia, Brasil, França, EUA e Itália em gatos e cães, com e sem lesões, M. canis parece ser o dermatófito mais comum, com pequenas exceções em que M. gypseum foi o mais isolado (Chermette et al., 2008). Num estudo realizado no sul de Itália onde 424 animais com lesões (incluindo gatos e cães) foram examinados, a prevalência de dermatófitos foi de 23,3% o que corresponde a 99 animais infetados. M. canis foi o fungo mais isolado em cães seguindo-se o dermatófito geofílico M.
gypseum e T. terrestre (Cafarchia et al., 2004). No mesmo estudo, nos gatos predominou o
isolamento de M. canis seguido de M. gypseum e de T. mentagrophytes. Em diversos estudos, em vários países, a prevalência deste dermatófito também se encontrou elevada mesmo em animais assintomáticos (Seebacher et al., 2008).
Os gatos Persa e Angorá e os cães Yorkshire apresentam uma maior predisposição à dermatofitose do que outras raças. Apesar de não haver nenhum fator racial evidenciado, a contaminação parece ser mais fácil em animais com pelo longo (Chermette et al., 2008). Da mesma forma, animais mais jovens apresentam mais frequentemente tinha do que os mais velhos, o que pode estar relacionado com o desenvolvimento do sistema imunitário mais resistente em animais adultos devido aos diversos contatos com fungos que têm ao longo da sua vida.
1.5 Potencial zoonótico
A transmissão de dermatofitoses por dermatófitos zoofílicos pode acontecer de forma direta, pelo contato com animais infetados ou, de forma indireta, por contato com fómites contaminadas sendo favorecida por fatores predisponentes (Chermette et al., 2008). A elevada resistência dos conídios dos dermatófitos no ambiente (meses ou mesmo anos) também aumenta o risco de contaminação quando se partilha material entre animais, seja pela escovagem ou pelo transporte. Os solos são o reservatório dessas fómites e portanto o risco de contaminação é maior para animais que têm contato com o exterior (Chermette et al., 2008).
Em carnívoros selvagens, as dermatofitoses causadas por T. mentagrophytes ou M. canis são muitas vezes reportadas em animais de pelo com interesse comercial tendo grandes consequências económicas, o que justifica o uso de vacinas para o seu controlo. Estas duas espécies de fungos também já foram isoladas de raposas que apresentam lesões típicas de tinha ou assintomáticas. As raposas habitam locais de contato com humanos e juntamente com o aumento da sua população começam a representar um risco de contaminação para os animais domésticos e os humanos (Chermette et al., 2008).
10
T. erinace é o fungo mais comum responsável pela tinha em ouriços selvagens e tem
sido isolado em dermatofitoses zoofílicas em humanos (Molina-Lopez et al., 2012). Os diversos centros de reabilitação que existem na Europa para estes animais e, o facto de serem animais pequenos e relativamente mansos, facilita o contato com os humanos representando então um risco para a saúde pública (Molina-Lopez et al., 2012).
A possibilidade de os animais domésticos serem uma fonte de dermatofitoses para humanos tem sido relatada na literatura. Os mais comuns, gatos e cães podem ser a fonte de infeção por M. canis ou por T. mentagrophytes. Outros como coelhos ou porcos podem estar relacionados com infeções por T. mentagrophytes ou mesmo pelo Trichophyton erinace (Segal & Frenkel, 2015).
1.6 Patogenia
A infeção por dermatófitos é geralmente cutânea pois estes não possuem a capacidade de penetrar tecidos ou órgão mais internos, a não ser que o indivíduo se encontre imunodeprimido (Weitzman et al., 1995). A reação a uma infeção deste tipo tem um espectro que vai desde leve/aguda a grave/severa, sendo acompanhadas de inflamação, por vezes crónica (Hube et al., 2015). As lesões caracterizam-se por eritema e prurido e são normalmente circulares (Hube et al., 2015). Os dermatófitos zoofílicos e geofílicos normalmente formam lesões com maior grau de inflamação (pois encontram-se menos adaptados com a coexistência com os humanos) do que as formadas pelos antropofílicos mas apresentam uma maior probabilidade de serem curadas espontaneamente (Weitzman et al., 1995).
A ocorrência diversificada de tinha nas diversas espécies de hospedeiros, assim como a distribuição das lesões, pode ser explicada devido a diversos fatores como a composição e estrutura variáveis da queratina, a capacidade enzimática dos dermatófitos em causa e ainda a existência de genes responsáveis pela virulência (Chermette et al., 2008). O estado de saúde do organismo também interfere na suscetibilidade aos dermatófitos, visto que a presença de determinadas doenças ou o uso de determinados tratamentos que incluam corticosteróides podem favorecer a infeção devido a problemas na imunidade. Desta forma, a apresentação clínica destas infeções pode ser bastante variável e é o resultado combinado de fatores patogénicos do fungo e da resposta imunitária do hospedeiro (Hube et al., 2015). Fatores referentes aos fungos podem incluir a adaptação ao hospedeiro, a produção de fatores inflamatórios, a produção de toxinas e de agentes imunomodeladores e ainda a secreção de enzimas, como as queratinases. São as enzimas queratinolíticas, as queratinases, que provocam
11
danos nas camadas de queratina da pele e dos pelos e levam ao aparecimento de uma reação inflamatória no local da infeção, tendo um papel essencial na patogenia dos dermatófitos (Hube
et al., 2015).
A infeção por dermatófitos pode ser dividida em três fases. A primeira fase passa pela inoculação do fungo na pele seguida de adesão ao extrato córneo (Hube et al., 2015). Várias barreiras cutâneas são impostas aos fungos nesta fase como as camadas inteiras de queratina da pele e das mucosas, a presença de ácidos gordos com ação fungiostática e ainda o pH da pele (Martinez-Rossi et al., 2008). A segunda fase consiste no crescimento do fungo que após germinação, dissemina-se pelo extrato córneo através das suas hifas, invadindo as estruturas queratinizadas. As camadas córneas da pele não possuem um sistema imunitário específico para conseguirem reconhecer este tipo de infeção, no entanto, são desencadeadas as reações imunitárias humorais e mediadas por células e ainda mecanismos de defesa do hospedeiro que atuam e eliminam os fungos, prevenindo assim, o avanço da infeção para tecidos viáveis mais profundos. Estes mecanismos consistem num inibidor a2-macroglobulina queratinase, transferrina insaturada, descamação da epiderme, linfócitos, macrófagos, neutrófilos e mastócitos (Weitzman et al., 1995). No prazo de dias a umas semanas começa-se a observar sinais comuns desta reação inflamatória que incluem vermelhidão, inchaço, calor e alopecia, sendo esta a terceira fase da infeção (Hube et al., 2015). No entanto, estes fungos podem ser invasivos e causar uma infeção severa e disseminada, acompanhada de granulomas, em pacientes que se apresentem imunodeprimidos. Tecidos subcutâneos ou órgãos internos não costumam ser afetados por estes fungos (Hube et al., 2015).
Após instalados, os dermatófitos precisam de nutrientes para o seu crescimento e em resposta a uma reserva baixa de nutrientes produzem determinadas proteínas estruturais como permeases e enzimas da parede celular, assim como, provocam a secreção de proteínas e enzima hidrolíticas como as nucleases, lípases, proteases e queratinases (Martinez-Rossi et al., 2008).
Tendo o objetivo de sobreviver, os dermatófitos precisam de encontrar um equilíbrio que permita a sua existência no hospedeiro enquanto destroem os tecidos desse mesmo organismo. Isto porque um grande dano pode levar a uma grande resposta por parte do hospedeiro provocando efeitos adversos para os dois lados, podendo levar mesmo à eliminação do agente patogénico (Hube et al., 2015). De facto, é referenciado no estudo dos autores anteriores que quanto melhor um dermatófito se encontra adaptado a um hospedeiro humano, mais branda parece ser a resposta inflamatória o que pode representar uma estratégia de sobrevivência por parte dos dermatófitos.
12
1.7 Quadro clínico
Uma grande variedade de sintomas podem aparecer nas pessoas que sofrem de tinea
corporis, sendo as diferenças baseadas no tamanho das lesões, do grau de inflamação e a
profundidade da mesma (Kaushik et al., 2015). A mais comum caracteriza-se por uma lesão vermelha, anular, com escamação e prurido. As lesões podem apresentar-se sozinhas ou serem múltiplas (Ely et al., 2014). A tinea manuum apresenta as mesmas características descritas anteriormente (Kaushik et al., 2015).
O pé de atleta afeta a pele entre os dedos podendo espalhar-se para a planta, lados ou dorso do mesmo pé (Ely et al., 2014) com lesões hiperqueratosas, secas, com escamação (Nenoff et al., 2014). Numa forma aguda, esta infeção apresenta eritema entre os dedos (Ely et
al., 2014) e o prurido é uma das queixas mais frequentes (Kaushik et al., 2015), aparecendo um
prurido moderado (Nenoff et al., 2014).
Na tinea cruris as lesões costumam ser unilaterais a começar na parte superior da coxa podendo-se observar manchas em forma de lua e escamação. A pele à volta da lesão pode tornar-se vermelha, apresentar-se menos escamosa e desenvolver pápulas (Kaushik et al., 2015).
Quando a infeção se encontra no escalpe também podem ocorrer diversas manifestações (Kaushik et al., 2015) existindo três tipos de tinea capitis (Ely et al., 2014), consoante o tipo de infeção que pode ser causada por microsporos com padrão ectotrix, macrospóros com padrão endotrix,e macrospóros com padrão endotrix (Kaushik et al., 2015). A tinea capitis pode progredir para quérion (Ely et al., 2014) que representa uma reação inflamatória severa com uma massa de aspeto tumoral endurecida e com pústulas (Ely et al., 2014; Kaushik et al., 2015).
A tinea unguium é normalmente identificada por unhas descoloradas, quebradiças e grossas (Ely et al., 2014). Estas podem começar a separar-se, a enrijecer e a desenvolver pontos brancos podendo mesmo tornar-se distróficas (Hube et al., 2015).
Embora raramente, os dermatófitos podem afetar as mãos dando origem à tinea manus levando a lesões com escamação e eritema, com crescimento centrífugo e hiperqueratóticas (Nenoff et al., 2014). Lesões parecidas caracterizam a tinea faciei encontrando-se nesse caso nas bochechas, pálpebras ou na região submandibular.
Existem casos em que corticosteroides são administrados erradamente como tratamento tópico provocando um diagnóstico diferencial pois a tinha torna-se difícil de distinguir. Nesses casos, a tinha é denominada tinea incognito (Nenoff et al., 2014).
13
Os animais podem ser infetados por uma grande variedade de dermatófitos, maioritariamente zoofílicos mas também geofílicos. Normalmente, essas dermatofitoses são caracterizadas por uma alopecia regular escamosa e com eritema, no entanto, vários graus de infeção podem modificar esse aspeto (Chermette et al., 2008; Bond, 2010; Segal & Frenkel, 2015). O prurido não faz parte da regra, no entanto é encontrado muitas vezes. As lesões podem localizar-se em qualquer parte do corpo, embora sejam mais frequentes na parte anterior do corpo ou na cabeça, e são simples ou múltiplas. As múltiplas lesões podem unir-se aparecendo sinais de cicatrização acompanhadas de crescimento de pelo no centro. De acordo com os dermatófitos ou hospedeiros envolvidos podem ser observados aspetos mais específicos nas lesões (Chermette et al., 2008).
As lesões nos animais domésticos como cães e gatos são bem demarcadas com bastante inflamação na periferia sendo mais comuns no focinho ou nos membros (Bond, 2010). Quando os hospedeiros são os gatos, principalmente os jovens, as lesões expressam-se em primeiro lugar no nariz, nas margens das orelhas, na parte distal das pernas e na cauda. Em gatos adultos as lesões costumam ser pequenas o que requer uma boa observação para a sua deteção. Dermatite miliar, unhas encravadas ou ainda a inflamação da epiderme à volta da unha são outros sinais clínicos que os gatos podem apresentar. Excecionalmente foram reportadas lesões como micetomas, maioritariamente em gatos persa, onde o dermatófito se desenvolve na derme e na hipoderme. Os gatos portadores de dermatófitos podem não apresentar sinais clínicos e ter apenas pelos infetados ou serem portadores mecânicos, sem qualquer ligação a uma infeção. (Chermette et al., 2008). Nos cães, a tinha leva a lesões não pruriginosas e sem pelo, bem circunscritas, múltiplas ou isoladas. T. mentagrophytes ou M. canis e ainda M. gypseum, mas com menor frequência, podem causar também o aparecimento de quérion. Neste caso, as lesões são normalmente únicas ou em número reduzido e localizam-se normalmente na cara. Têm forma oval e são proeminentes na pele, apresentando inflamação e pus em caso de palpação. Podem ser acompanhadas de prurido e de dor (Chermette et al., 2008). O contato frequente dos cães farejadores com o solo, roedores ou insetos explica como M. gypseum, M. persicolor, T.
mentagrophyes ou T. erinacei são isolados frequentemente de lesões faciais, maioritariamente
na cana do nariz, da área periocular e nas margens das orelhas. Em casos muito graves de infeções crónicas, casos de inflamações severas com prurido e total alopecia são observados (Chermette et al., 2008).
14
1.8 Diagnóstico laboratorial
O método mais simples de verificar a presença de algum fungo microscopicamente, em raspagens de pele, unhas ou pelos, é o exame de KOH (hidróxido de potássio) onde se usa KOH a 20% (Nenoff et al., 2014) e se pode observar as hifas e os artrósporos dos fungos (Bond, 2010). O maior número de hifas encontram-se no bordo ativo da infeção, sendo a melhor área para recolher uma amostra para este teste (Kaushik et al., 2015). No entanto, este método, apesar de rápido, demonstra fraca sensibilidade, apresentando uma percentagem de 5 a 15% de falsos negativos (Nenoff & Ginter, 2014; Sanchez et al., 2014) e não foi usado neste trabalho. Para visualizar pelos infetados com fungos do género Microsporum pode ser usada a lâmpada de Wood que, numa sala escura, permite que esses pelos apresentem uma fluorescência verde (Bond, 2010; Kaushik et al., 2015).
Outro método é o de cultura de fungos que é considerado o mais sensível (Bond, 2010). As amostras recolhidas para esta metodologia devem ser raspadas ou arrancadas após a passagem da lesão por álcool de forma a reduzir a contaminação por saprófitas e por bactérias (Bond, 2010). Os pelos devem ser arrancados e nunca cortados com tesoura visto que a maior quantidade de material costuma encontra-se na parte basal do pelo. Quando a amostra é de pele, a raspagem deve ser feita nas bordas das lesões pois é a área onde a probabilidade dos dermatófitos serem viáveis é maior (Quinn et al., 1994). Os fungos sendo organismos heterotróficos precisam de um meio com determinados nutrientes orgânicos que lhes permitam crescer e reproduzir (Nenoff et al., 2014). O meio mais usado em laboratórios de diagnóstico é o “Sabouraud dextrose agar” (desenvolvido por Sabouraud tendo o nome em sua homenagem) (Weitzman et al., 1995), normalmente suplementado com cicloheximida (inibidor de síntese proteico usado para inibir fungos não patogénicos como bolores e leveduras saprófitas) e cloranfenicol (Bond, 2010). O meio principal utilizado neste trabalho foi o DTM (Dermatophyte Test Medium), seguido do PDA (Potato Dextrose Agar). As culturas dos fungos têm depois de ser incubadas a temperaturas entre os 26-32ºC, num prazo de 3 a 4 semanas com supervisão de crescimento duas vezes por semana (Nenoff et al., 2014). Esta metodologia pode apresentar alguns erros devido a alguns pormenores que podem não ser cumpridos como a inspeção diária do crescimento da colónia, variação na temperatura de incubação ou mesmo uma identificação errada de fungos saprófitas que induzem mudanças de coloração no meio (Bond, 2010).
O meio DTM é constituído por soitona, glucose, cicloheximida, gentamicina (antibiótico), clortetraciclina (antibiótico de largo espetro), o vermelho de fenol e agar
15
(Liofilchem s.r.l). A soitona representa a fonte de nitrogénio necessária aos fungos, contendo uma mistura de péptidos e aminoácidos livres e a glucose é a fonte de energia. O pH ácido inibe o crescimento de bactérias (exceto as acidofílicas). Os três agentes seletivos têm como objetivo impedir o cescimento de batérias e fungos saprófitas. O vermelho de fenol é um indicador de pH que indica a acidificação do meio (Liofilchem s.r.l, 2010). Os dermatófitos produzem metabolitos alcalinos que ao alcalinizar o meio que por si é ácido, provoca a mudança de cor do indicador de fenol vermelho, passando este de amarelo para vermelho, sinalizando assim o crescimento dos dermatófitos (Nenoff et al., 2014).
A diferenciação de dermatófitos e de outros fungos é depois feita macroscopicamente (pigmentação, textura das colónias) e microscopicamente (através da formação de macro e microconídias) (Nenoff et al., 2014) ou ainda por propriedades bioquímicas (teste da urease).
Os métodos microbiológicos apresentam contudo desvantagens como ser necessário cerca de duas a quatro semanas para a obtenção de resultados, a fraca sensibilidade principalmente na observação ao microscópio que pode ser, por vezes, um tanto subjetiva e pelo risco de contaminação por fungos saprófitas e leveduras dos meios com agar (Coelho et
al., 2011). O uso de técnicas histológicas têm sido referido como método para aumentar a
sensibilidade do diagnóstico mas a necessidade de profissionais qualificados e de equipamento acabam por dificultar a implementação dessa técnica (Coelho et al., 2011).
O diagnóstico molecular pode ser a solução para preencher as lacunas deixadas pelo diagnóstico micológico ou mesmo para providenciar uma resposta mais rápida. Hoje em dia, várias técnicas baseadas na amplificação de ácidos nucleicos estão disponíveis e permitem este tipo de diagnóstico (Nenoff et al., 2014). Segundo os mesmos autores, a única desvantagem prende-se com o fato de ser um procedimento mais caro e portanto espera-se que os métodos moleculares apenas sejam usados para complementar os métodos micológicos convencionais.
1.8.1 Biologia molecular
À partida, a nomenclatura dos fungos poderá sofrer uma grande mudança quando se tiver em consideração os dados moleculares. Estes dados são obtidos por diferentes métodos desenvolvidos nos últimos anos para a deteção e determinação de variações genéticas. O desenvolvimento destes métodos advém da dificuldade e as limitações que caracterizam a identificação morfológica dos fungos (Cafarchia et al., 2013). Como referido anteriormente, apesar de específico, o método de cultura como diagnóstico é demorado podendo levar até quatro semanas para se obter os resultados ou pode mesmo não permitir a obtenção dos mesmos.
16
Para além disso, o próprio polimorfismo que caracteriza os dermatófitos dificulta a identificação morfológica (Dąbrowska et al., 2014).
De forma a ser possível efetuar estudos moleculares, foi necessário obter e comparar as sequências genómicas de diferentes espécies de dermatófitos, estudos esses que foram publicados em 2011 e 2012 (Burmester et al., 2011; Martinez et al., 2012). As espécies selecionadas pretendiam ser representativas tanto dos três tipos de dermatófitos (geofílicos, zoofílicos e antropofílicos), espécies anamórficas e telemórficas e espécies que provocam infeções agudas e crónicas. Aqui incluem-se os seguintes dermatófitos: T. rubrum, T. tonsurans,
T. equinum, M. canis, M. gypseum, A. benhamie e T. verrucosum (White et al., 2014). Estes
estudos permitiram confirmar alguns aspetos da biologia destes fungos como as estirpes serem haploides, os genomas terem aproximadamente o mesmo tamanho (23-24 Mb), poucas sequências repetitivas e ainda a filogenia do genoma completo coincidir com a filogenia baseada em estudos baseados em rRNA (White et al., 2014). Relacionados com a patogenicidade destes fungos e em concordância com o seu nicho ecológico apresentam bastantes genes que codificam para endo e exoproteases, genes de metabolitos secundários que podem produzir moléculas responsáveis pela interação com o sistema imunitário do hospedeiro, genes que codificam para cinases que podem ser cruciais em sinalização e para proteínas com domínios LysM que podem servir para disfarçar a parede dos fungos e despistar o sistema imunitário (White et al., 2014).
É importante ter em atenção que a identificação molecular refere-se à aplicação de ferramentas moleculares para a identificação de isolados fúngicos (Santhi et al., 2015).
As técnicas moleculares baseadas na reação em cadeia da polimerase (PCR) (“polymerase chain reaction”) demoram menos tempo permitindo um diagnóstico mais rápido e apresentando elevada sensibilidade e especificidade quando comparadas com as técnicas convencionais (Dąbrowska et al., 2014). O TRFLP (“PCR-terminal restriction fragment lenght polymorphism”), o nested PCR e o PCR- ELISA também podem ser usados para a identificação de dermatófitos em cultura (Dąbrowska et al., 2014).
Os métodos moleculares revelam-nos a quantidade de variações genéticas existentes entre espécies sendo a tipagem de estirpes muito importante em estudos de epidemiologia pois permite a relação entre as estirpes dos dermatófitos em causa (Abdel-rahman et al., 2008). A grande maioria de estudos de genotipagem de estirpes de espécies de dermatófitos têm sido efetuados para caracterizar o grau de variação genética existente numa população de isolados,
17
fornecendo uma caracterização inicial da diversidade existente numa determinada espécie (Abdel-rahman et al., 2008).
Entre estas técnicas, as que têm sido mais utilizadas para estudar os dermatófitos são aquelas que envolvem a amplificação de regiões não identificadas do genoma e consistem em obter um padrão de bandas de forma a criar um “fingerprinting” único para casa estirpe (Abdel-rahman et al., 2008). Podem-se destacar os RAPD (“random amplified polymorphic DNA”), os AP-PCR (“arbitrarily primed polymerase chain reaction”), os RAMD (“randomly amplified monomorphic DNA”, os SSCP (“single-stranded conformation polymorphism”) e os AFLP (“amplified fragment lenght polymorphism”) (Abdel-rahman et al., 2008). Os métodos de “fingerprinting” podem ser usados para detetar variações genómicas nas sequências mesmo quando não se tem qualquer tipo de informação prévia disponível. No entanto, apresentam muitas limitações devido ao uso de marcadores pouco específicos. Por exemplo, os RAPD e os AFLP têm permitido a identificação de espécies de dermatófitos mas não permitem a diferenciação em estirpe (Cafarchia et al., 2013). O “fingerprinting” usando “primers” não específicos como (AC)10, (GTG)5, M13 e AP3 permitiu a diferenciação entre géneros mas apenas mostrou variabilidade intraespécie para quatro das seis variedades de T. mentagrophytes (T. interdigitale, T. mentagrophytes, T. erinacei e Trichophyton spp. de A. benhamiae) (Cafarchia et al., 2013).
As técnicas referenciadas são rápidas e relativamente económicas, no entanto, apresentam várias limitações. Entre elas está a reprodutibilidade dentro e entre laboratórios, sendo que esta pode ser afetada por mudanças na metodologia, reagentes, misturas de reação, e temperatura da amplificação (Santhi et al., 2015). O grande número de bandas geradas pode também complicar a diferenciação entre isolados e um padrão de bandas parecido não nos garante que estamos perante o mesmo isolado (Santhi et al., 2015). Por outro lado, bandas que apresentam o mesmo padrão podem não ser homólogas.
Os microssatélites, por sua vez, têm ganho popularidade devido à sua natureza altamente variável e rápida mutabilidade (Abdel-rahman et al., 2008) sendo que que oferecem uma melhor estratégia quando se trata de analisar a variabilidade intraespecífica dos dermatófitos, principalmente se associarmos aos resultados a origem geográfica (Cafarchia et al., 2013). O seu uso em dermatófitos é recente mas como exemplo, surge o marcador T1 que permitiu a deteção de quatro alelos polimórficos (dois em T. rubrum e outros dois em T. violaceum) num conjunto de 130 estirpes (Ohst et al., 2004). Com a adição de mais seis marcadores de microssatélites, estudos posteriores possibilitaram a identificação de 55 genótipos em 233
18
isolados de T. rubrum conduzindo à hipótese de que os genótipos poderão ser associados com o local da infeção no hospedeiro e com o seu local geográfico de origem (Gräser et al., 2007). Num estudo similar, mas estando em causa o complexo M. canis, o marcador AC11 permitiu a sub divisão de M. audouinii em dois genótipos e o marcador C235 evidenciou duas estirpes do
M. ferrugineum e de M. canis (Kaszubiak et al., 2004).
Por essas razões, para métodos baseados em PCR a escolha dos marcadores tem sido focada numa região alvo (marcador genético ou locus), ou seja, em loci específicos e tem de conter polimorfismos suficientes que permitem a delineação em espécies. Por outro lado, caso o objetivo seja a identificação ao nível das estirpes ou populações, variações nas sequências, dentro da mesma espécie, são esperadas. Para distinguir diversas espécies de dermatófitos têm sido utilizados vários loci como genes de DNA mitocondrial (mtDNA), chitin synthase-1 (chs-1) e da topoisomerase II (TOP2) e em particular, genes da subunidade pequena (18S rRNA) e grande (28S rRNA) do RNA ribossomal (Cafarchia et al., 2013).
Sequências individuais de genes normalmente tem poucos locais que permitem a distinção de espécies sendo que podem levar a resultados pouco coerentes no que diz respeito a árvores filogenéticas. Por outro lado, a análise do genoma mitocondrial completo permite a obtenção de resultados mais fidedignos, sendo que continua a ser mais económico e viável que sequenciar o genoma completo do organismo. Para além disso, pode fornecer informações sobre conteúdo genético, a sua ordem e posição, intrões e ainda regiões intergénicas (Wu et al., 2009). O número de genomas mitocondriais totalmente sequenciados tem vindo a aumentar devido à colaboração interdisciplinar do Programa “Organelle Genome Megasequencing”. Neste programa é já possível encontrar centenas de sequências de mtDNA completas de organismos que diferem muito ao nível taxonómico, incluindo fungos, plantas e animais (Wu
et al., 2009). O genoma mitocondrial típico de um fungo alberga 14 genes conservados que
codificam proteínas, 22 a 26 genes de tRNA e 2 genes de rRNA. A divergência a nível deste genoma está normalmente associado com alterações nas regiões intergénicas, nas sequências intrónicas e na ordem dos genes (Wu et al., 2009). No que diz respeito aos genomas mitocondriais dos dermatófitos estes apresentam-se bastante conservados podendo indicar que estes fungos são muito relacionados entre si. Análises filogenéticas apontam também para que os dermatófitos tenham evoluído muito tarde dos fungos Ascomycota (Wu et al., 2009).
A sequenciação de regiões ITS (internal transcribed spacer) também é usada para análises filogenéticas e identificação de espécies de dermatófitos. O uso deste método com outros de “fingerprinting” como os AFLPs foram usados para uma reorganização da taxonomia
19
dos complexos de T. mentagrophytes, M. canis e T. rubrum (Cafarchia et al., 2013). No entanto, este método não é o mais aconselhado para distinguir estirpes de dermatófitos visto que apenas um número limitado de variações neste tipo de sequências conseguem efetivamente discriminar espécies muito próximas (Abdel-rahman et al., 2008). Por outro lado, as regiões NTS (non-transcribed spacer) do rDNA mostraram melhores resultados na genotipagem dos dermatófitos. Jackson e os seus colaboradores (2006), sabendo que esta região era conhecida por ser altamente polimórfica em outros fungos, concluíram vários estudos que descrevem as variações nas sequências das regiões NTS dos dermatófitos.
No que diz respeito a sequenciar o genoma completo dos fungos para análises filogenéticas, um estudo de T. rubrum e de mais quatro dermatófitos permitiu a diferenciação desse grupo com outros fungos. Estes fungos distinguiam-se em termos de hospedeiros, reprodução e progressão da doença e também se conseguiram diferenciar entre si através de algumas características encontradas no estudo dos seus genomas. (Martinez et al., 2012). Em cada espécie foram encontrados também um número variável de genes específicos, sendo que alguns se relacionavam com a escolha do hospedeiro. Este estudo também permitiu encontrar famílias de genes que são importantes para a compreensão dos mecanismos de infeção dos dermatófitos, da sua interação com os tecidos epiteliais e ainda com a resposta desencadeada pelo hospedeiro (Martinez et al., 2012). O estudo a este nível pode levar a uma maior compreensão das interações dos dermatófitos com o hospedeiro a nível molecular permitindo uma resolução melhor da doença aquando e após o tratamento da mesma (Cafarchia et al., 2013). Uma outra questão que também poderá ser resolvida com os métodos moleculares é a questão da reativação ou reinfeção, isto é, após um indivíduo ter sido infetado e ter feito o tratamento, o aparecimento de uma nova infeção pode ser a reativação de uma infeção anterior ou uma nova infeção. As ferramentas moleculares podem ajudar a resolver essa questão pois possuem um maior poder de discriminação entre espécies e estirpes (White et al., 2008).
Contudo, falta criar um protocolo molecular que seja rápido, fidedigno e reproduzível e que possa ser utilizado em laboratórios para a análise de espécies clínicas em larga escala e num curto espaço de tempo. O maior desafio prende-se no entanto com a falta de um procedimento fiável de extração de DNA fúngico intacto diretamente das amostras (Dąbrowska et al., 2014).
1.9 Profilaxia, tratamento e controlo
A prevenção e controlo das infeções por dermatófitos devem ter em conta a área onde se encontram, o agente etiológico e a fonte da infeção (Weitzman et al., 1995).
20
É importante localizar o reservatório animal das infeções zoofílicas causadas por M.
canis e T. mentagrophytes (Weitzman et al., 1995). No estudo publicado por Mantovani e seus
colaboradores (1982) podemos verificar que existem muitos animais selvagens que podem ser portadores de dermatófitos sem apresentarem lesões mesmo quando os fungos que transportam são patogénicos. O papel dos roedores como reservatórios de fungos zoofílicos é bem comprovado neste estudo, especialmente do dermatófito T. mentagrophytes var.
mentagrophytes. Estes animais movem-se entre diferentes biótopos, sendo responsáveis pela
transmissão destes fungos a humanos, animais domésticos e outros animais selvagens. Agricultores e caçadores apresentam maior probabilidade de contato com estes animais. Os fungos geofílicos são frequentemente encontrados em animais e humanos com bastante contato com o solo havendo a hipótese de que conseguem sobreviver após o contato com a pele ou pelo dos animais (Mantovani et al., 1982). O enriquecimento do solo com pelos, crostas ou outro material orgânico animal parece também favorecer a proliferação dos fungos queratinofílicos ao mesmo tempo que pessoas que trabalham com animais vivos podem ser grupos de risco.
Já no caso dos dermatófitos antropofílicos, como por exemplo os que causam tinea
corporis e tinea cruris, estes podem ser transmitidos por toalhas, roupa e lençóis e por isso
aconselha-se a sua desinfeção após o uso e não devem ser partilhados com indivíduos infetados (Weitzman et al., 1995).
A propagação da tinea pedis ou “pé de atleta” afeta a economia, visto que é acompanhado por um aumento paralelo das onicomicoses e ambas implicam diversos custos. Nos países em desenvolvimento as micoses aparecem de forma endémica começando pelas crianças e o tratamento falha na maioria das vezes devido à falta de antifúngicos eficazes (Seebacher et al., 2008). Os pacientes com tinea pedis, na sua maioria, disseminam dermatófitos no ambiente, no entanto a sua distribuição pode variar. Os artrósporos ou fragmentos das hifas, são as formas de dispersão dos dermatófitos, sendo a maioria deles espalhados com células cornificadas (com queratina) durante o processo de descamação (Seebacher et al., 2008).Desta forma, é importante referenciar a importância da desinfeção do chão dos espaços públicos e a população deve ser informada das diferentes formas de transmissão destes fungos e de medidas profiláticas que podem ser tomadas (Seebacher et al., 2008). A prevenção começa por uma boa higiene dos pés, evitar hidratação em excesso e ainda usar sandálias ou sapatos que deixem respirar, evitar causar trauma e não partilhar toalhas, meias ou mesmo sapatos (Weitzman et
al., 1995; Seebacher et al., 2008). Visto ser contagiosa, o controlo pode ser também
21
não andem descalços em piscinas, balneários e não partilhem calçado, de forma a restringir a infeção (Weitzman et al., 1995). Sugimoto e seus colaboradores demonstraram o risco de transmissão da infeção entre membros da família de pacientes com pé de atleta (Sugimoto et
al., 1995). Anderson (1979) nos seus estudos mencionou que dermatófitos patogénicos para
humanos podem sobreviver na areia e na água das praias.
Por outro lado, há que considerar também a possível associação entre determinada ocupação laboral com a incidência de infeção por dermatófitos. Para além dos trabalhos que possuem balneários também os que envolvem o cuidado das unhas, apresentam um risco para os clientes. Sekula e seus colaboradores (2002) registaram o isolamento de leveduras (Candida
albicans) e bactérias em material para manicure e pedicure. Um aspeto interessante é o uso de
unhas artificiais pelos trabalhadores no ramo do cuidado da saúde que, segundo Hederwick e colaboradores (2000) acumulam mais agentes patogénicos (bactérias e leveduras) que as unhas naturais. O risco de onicomicose pelo uso de unhas artificiais foi também evidenciado por Shemer e colaboradores (2008) que aconselharam o desuso dessas unhas por parte de empregadores da área da saúde e da indústria da restauração para diminuir o risco de infeção. Uma publicação recente aponta também para a necessidade de educar os trabalhadores de salões de beleza para melhorar o controlo das infeções nesse ambiente (Segal & Frenkel, 2015).
No que diz respeito ao tratamento, existem duas classes principais de agentes antifúngicos, a classe dos azóis (imidazóis e triazóis) e das alilaminas (amorfolina, butenafina, naftifina e terbinafina) juntamente com a griseofulvina, ciclopirox e o tolnaftato. Todos estes agentes podem ser encontrados em forma oral ou tópica (Ghannoum, 2015). O tratamento sistémico é usado em infeções mais difíceis de erradicar.
O reduzido avanço científico nos medicamentos antifúngicos deve-se ao fato de haver poucos casos de doenças fúngicas relativamente graves e à dificuldade de encontrar agentes com toxicidade seletiva para o fungo e não para o hospedeiro. Esta dificuldade está associada às características partilhadas entre as células fúngicas e humanas pois ambas são eucarióticas (Ghannoum, 2015).