Universidade de Trás-os-Montes e Alto Douro
Seroprevalência e análise dos fatores de risco associados ao vírus
respiratório sincícial bovino em efetivos leiteiros da Ilha Terceira
Dissertação de Mestrado Integrado em Medicina Veterinária
Breno Lourenço de Gouveia
Orientadora: Professora Doutora Ana Cláudia Correia Coelho
Coorientador: Doutor Mário Jorge Fontes da Silveira
ii
Universidade de Trás-os-Montes e Alto Douro
Seroprevalência e análise dos fatores de risco associados ao vírus
respiratório sincícial bovino em efetivos leiteiros da Ilha Terceira
Dissertação de Mestrado Integrado em Medicina Veterinária
Breno Lourenço de Gouveia
Orientadora: Professora Doutora Ana Cláudia Correia Coelho
Coorientador: Doutor Mário Jorge Fontes da Silveira
iii
Universidade de Trás-os-Montes e Alto Douro
Seroprevalência e análise dos fatores de risco associados ao vírus
respiratório sincícial bovino em efetivos leiteiros da Ilha Terceira
Dissertação de Mestrado Integrado em Medicina Veterinária
Breno Lourenço de Gouveia
Orientadora: Professora Doutora Ana Cláudia Correia Coelho
Coorientador: Doutor Mário Jorge Fontes da Silveira
Composição do Júri:
Presidente: Professora Doutora Maria da Conceição Medeiros Castro Vogal: Professor Doutor Nuno Francisco Fonte-Santa Alegria Vogal: Professora Doutora Ana Cláudia Correia Coelho
iv
DECLARAÇÃO
NOME: Breno Lourenço de Gouveia
C.C.: 13442389
CORREIO ELECTRÓNICO: breno-lourenco@hotmail.com
DESIGNAÇÃO DO MESTRADO: Mestrado Integrado em Medicina Veterinária
TÍTULO DA DISSERTAÇÃO DE MESTRADO INTEGRADO EM MEDICINA VETERINÁRIA:
Seroprevalência e análise dos fatores de risco associados ao vírus respiratório sincícial bovino em efetivos leiteiros da ilha terceira
ORIENTADORA: Professora Doutora Ana Cláudia Correia Coelho
COORIENTADOR: Doutor Mário Jorge Fontes da Silveira
ANO DE CONCLUSÃO: 2017
Declaro que esta dissertação de mestrado é resultado da minha pesquisa e trabalho pessoal e das orientações dos meus supervisores. O seu conteúdo é original e todas as fontes consultadas estão devidamente mencionadas no texto e na bibliografia final. Declaro ainda que este trabalho não foi apresentado em nenhuma outra instituição para obtenção de qualquer grau académico.
Vila Real, fevereiro de 2017
v
Dedico
Ao meu avô Francisco, Grande companheiro da minha vida, minha maior referência de vida. Onde quer que estejas um grande abraço.
“Aqueles que passam por nós, não vão sós, não nos deixam sós. Deixam um pouco de si, levam um pouco de nós.” Antoine de Saint-Exupéry
vi
Agradecimentos
Agradeço ao Magnífico Reitor da Universidade de Trás-os-Montes e Alto Douro pelas facilidades concedidas na realização desta dissertação.
Agradeço a todos os Docentes da Universidade de Trás-os-Montes e Alto Douro que fizeram parte da minha formação pessoal e profissional.
À Professora Doutora Ana Cláudia Coelho, a quem tive o enorme prazer de ter como orientadora, por toda a ajuda, disponibilidade, amizade e conhecimentos transmitidos ao longo do meu percurso académico e nesta minha última etapa.
Ao Doutor Mário Silveira, meu coorientador, por ser uma referência pela experiência que possui, pelos conhecimentos e ideias transmitidas, por toda a ajuda e colaboração quer na preparação dos estágios quer nos ensinamentos que me transmitiu no trabalho prático de um médico veterinário, e acima de tudo pela amizade.
A toda a restante equipa da UNICOL – Cooperativa Agrícola, CRL: Dr. João Fagundes, Dr. Tiago Oliveira, Dr. Pedro Garcia, Dra. Marlene Ribeiro pelas lições, companheirismo e dedicação na minha formação enquanto estagiário de medicina veterinária, assim como na realização deste trabalho.
Ao Professor Doutor João Simões, à Doutora Carla Azevedo e Doutora Deolinda Silva pelo delineamento do trabalho e auxílio com o processamento das amostras analisadas.
Aos pilares da minha vida, a minha mãe Eugénia e o meu avô Francisco, que embora não estando já entre nós, agradeço o amor, dedicação e orientação que hoje fazem de mim um homem de princípios, com garra para abraçar qualquer sonho e desafio. Graças ao seu exemplo e à força que me injetam, vivo de cabeça erguida, com a certeza de que estarão sempre comigo, onde quer que estejam.
Ao meu irmão Caio, por toda a ajuda, motivação e conselhos quer na realização deste trabalho quer ao longo da nossa vida.
À minha irmã Aline, que embora seja a mais nova, tanto me tem ensinado ao longo deste nosso percurso.
À Bá, por todo o carinho que demonstrou e amor incondicional por mim desde pequeno.
vii
À minha família e amigos pelo interesse e apoio na minha formação pessoal e académica.
À família da Rua Direita por todos os momentos passados ao longo da minha vida. Ao Senhor Alberto, mais conhecido pelo avô da Francisca, o meu muito obrigado por ter sido tão atencioso durante o meu estágio, e restante pessoal do departamento de veterinária e inseminação artificial.
Às minhas amigas Flávia Poças, Maria Manso, Isa Nascimento e Denise Coelho, pelos momentos gloriosos durante a faculdade.
À Rafaela Guimarães obrigado pelos momentos bons, menos bons mas acima de tudo os momentos maravilhosos que passamos e com esperança que se perpetuem durante a nossa vida.
A todos que de alguma forma participaram na minha vida e demonstraram apreço por mim.
viii
Resumo
O vírus respiratório sincícial bovino (BRSV), agente etiológico da doença respiratória bovina, causa grandes prejuízos económicos, principalmente, em vitelos. O BRSV já foi relatado em Portugal com prevalências sorológicas elevadas em adultos e residuais em vitelos. Assim, o presente estudo teve como objetivo determinar a seroprevalência e caracterizar a epidemiologia da infeção pelo BRSV em explorações leiteiras da Ilha Terceira.
Este estudo foi realizado entre os meses de dezembro 2014 a fevereiro de 2015, recorrendo ao método ELISA, através do kit CIVTEST® BRSV/VRS, a 184 vitelos, não vacinados, provenientes de 92 explorações leiteiras pertencentes à Ilha Terceira. Também se realizou um questionário epidemiológico.
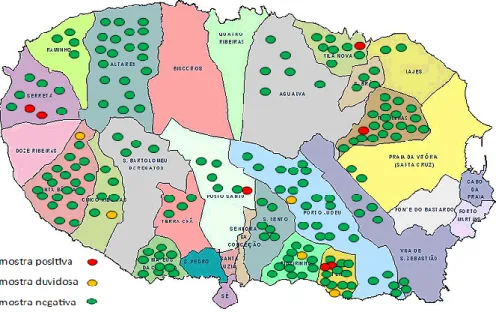
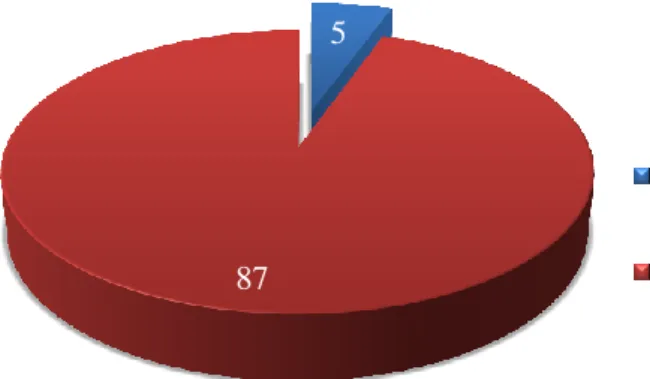
Verificou-se que 7 animais eram seropositivos distribuídos por 5 explorações, o que pressupõe uma seroprevalência individual de BRSV 3,8% (IC 95%: 1,0%-6,6%), em vitelos dos 90 aos 180 dias de idade (média de idades 133.23 dias).
Os resultados deste estudo evidenciam a necessidade de novos estudos com amostras que abranjam animais de diferentes idades, para que se possa caracterizar de outra forma os efetivos leiteiros na ilha Terceira em relação ao BRSV, para que se possam recomendar medidas profilácticas e de maneio adequadas.
Palavras-chave: Vírus Sincícial Respiratório Bovino (BRSV), ELISA, seroprevalência, epidemiologia.
ix
Abstract
Respiratory syncytial bovine virus (BRSV), the etiological agent of bovine respiratory disease, causes great economic losses, mainly in calves. BRSV has already been reported in Portugal with high serological prevalence in adults and residual in calves. Thus, the present study aimed to determine seroprevalence and to characterize the epidemiology of BRSV infection in dairy farms in Terceira Island.
This study was carried out between December 2014 and February 2015, using the ELISA method, through the CIVTEST® BRSV / VRS kit, to 184 unvaccinated calves from 92 dairy farms belonging to Terceira Island. An epidemiological questionnaire was also carried out.
It was verified that 7 animals were seropositive distributed by 5 farms, which presupposes an individual seroprevalence of 3.8% BRSV (95% CI: 1.0% -6.6%), in calves from 90 to 180 days of age (medium age of 133.23 days).The results of this study showed the need for new studies with samples that cover animals of different ages, so that the dairy herds on Terceira Island can be characterized in a different way in relation to BRSV, so that appropriate prophylactic and management measures can be recommended.
Keywords: Respiratory syncytial bovine virus (BRSV); ELISA; Seroprevalence; Epidemiology.
xi
Índice
Capitulo I ... 1
1. Introdução ... 1
1.1. Caracterização da Ilha Terceira ... 1
1.2. Vírus Sincícial Respiratório Bovino ... 1
1.3. Classificação do BRSV ... 2
1.4. Estrutura e Organização genómica ... 2
1.5. Replicação viral ... 4
1.6. Variabilidade genética do BRSV ... 4
1.7. Síndrome Respiratório Bovina ... 5
2. Epidemiologia ... 7
2.1. Fatores predisponentes do SRB ... 7
2.1.1. Fatores imunitários ... 7
2.1.1.1. Predisposição dos bovinos ... 7
2.1.1.2. Colostro ... 8 2.1.2. Fatores ambientais ... 9 2.1.2.1. Nutrição ... 9 2.1.2.2. Maneio ... 11 2.1.2.3. Desmame ... 12 2.1.2.4. Transporte ... 12 2.1.2.5. Condições climáticas ... 13 2.1.2.6. Instalações ... 14
2.1.3. Fatores associados a outros agentes patogénicos ... 16
2.2. Forma de transmissão ... 17
2.3. Prevalência ... 18
3. Quadro clínico e lesional... 22
4. Imunidade e Imunopatogenia ... 26 5. Diagnóstico ... 27 5.1. Diagnóstico clínico ... 27 5.2. Diagnóstico laboratorial ... 27 5.2.1. Culturas celulares ... 29 6. Profilaxia... 29 6.1. Profilaxia sanitária ... 29 6.2. Profilaxia médica ... 30
6.2.1. Implicações da diversidade antigénica para as vacinas ... 31
6.2.2. Desenvolvimento de novas vacinas ... 32
7. Metafilaxia do SRB ... 32 8. Tratamento ... 35 Capítulo II... 37 1. Objetivos ... 37 Capitulo III ... 39 1. Material e Métodos ... 39
1.1. Seleção e identificação dos animais ... 39
1.1.1. Seleção da amostra ... 40
1.1.1.1. Amostragem intra – exploração ... 40
1.1.1.2. Questionário epidemiológico ... 41
1.2. Critérios de inclusão / exclusão e eliminação dos animais ... 41
2. Colheita do material ... 41
xii 4. Análise de Dados ... 42 Capítulo IV ... 43 1. Resultados ... 43 1.1. Caracterização da amostra ... 43 1.1.1. Vacinação para BRSV ... 44
1.1.2. Características das explorações em estudo ... 44
1.2. Seroprevalência da infeção por BRSV em bovinos... 47
1.3. Seroprevalência da infeção por BRSV em explorações ... 49
1.4. Prevalência verdadeira ... 51
1.5. Cálculo da seroprevalência verdadeira ... 51
Capítulo V ... 53 1. Discussão ... 53 Capítulo VI ... 63 1. Conclusão ... 63 Capítulo VII ... 65 2. Bibliografia ... 65 Anexo ... 71
xiii
Índice de figuras
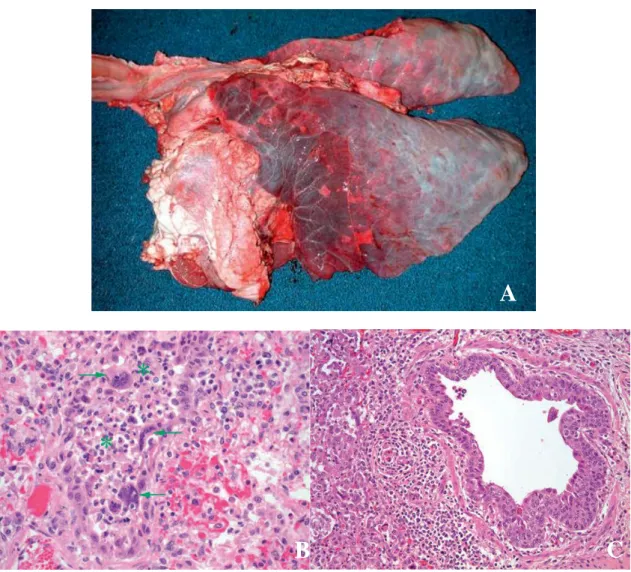
Figura 1. Infeção por vírus sincícial respiratório bovino ... 25
Figura 2. Distribuição dos animais em estudo pelo sexo. ... 43
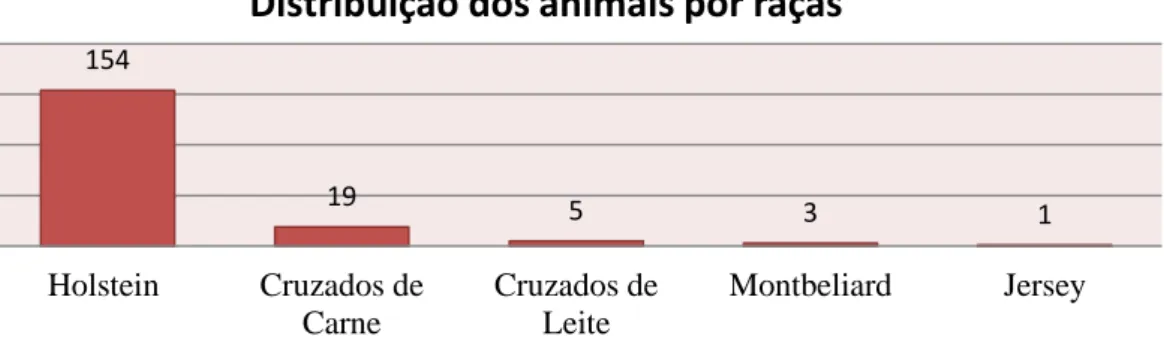
Figura 3. Distribuição dos animais sujeitos ao estudo por raças. ... 43
Figura 4. Percentagem das vacinas utilizadas nas explorações que vacinam. ... 44
Figura 5. Material das camas dos vitelos até ao desmame. ... 46
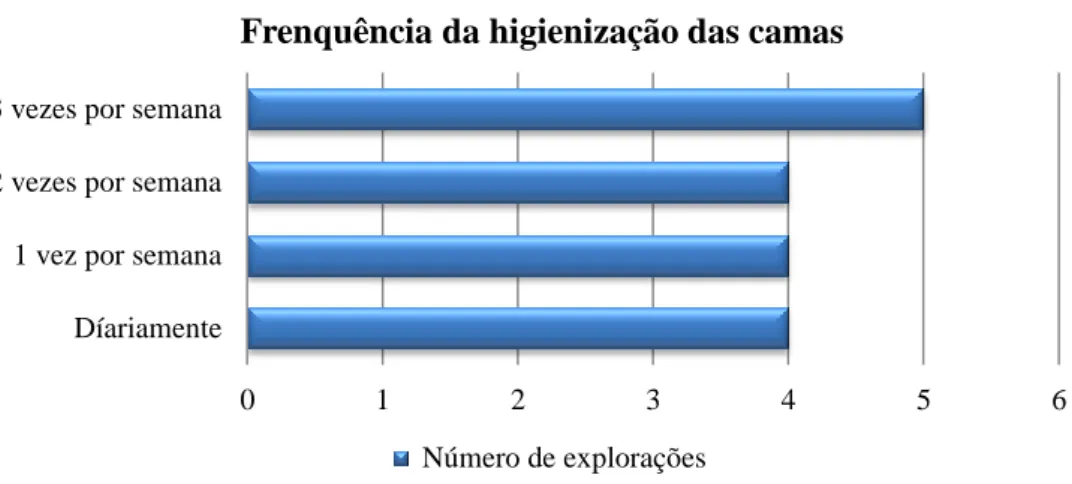
Figura 6. Frequência da higienização das camas dos vitelos. ... 46
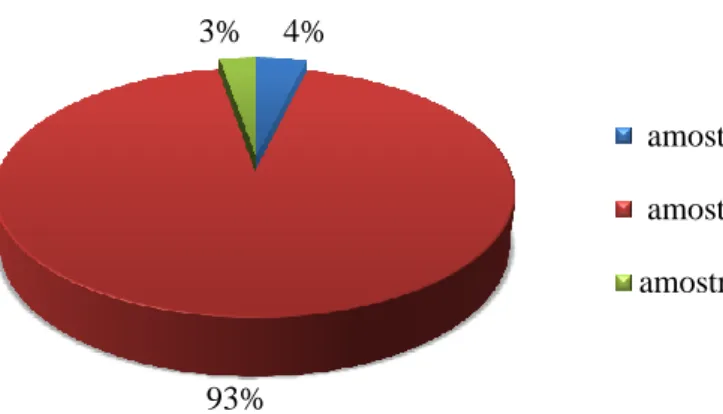
Figura 7. Resultado das amostras sorológicas pela técnica de ELISA. ... 47
Figura 8. Distribuição das amostras de acordo com o seu resultado na região estudada.. ... 48
Figura 9. Distribuição do número de animais por raças seropositivas. ... 48
xiv
Lista de Abreviaturas
°C – Grau Celsius
BHV-1 – Bovine Herpesvirus type 1 (Herpesvirus Bovino tipo 1)
BRSV – Bovine Respiratory Syncytial Virus (Virus Sincicial Respiratório Bovino) BVD – Bovine Viral Diarrhea (Diarreia Viral Bovina)
BVDV – Bovine Viral Diarrhea Viral (Virus da Diarreia Viral Bovina)
CRSV – Caprine Respiratory Syncytial Virus (Virus Sincicial Respiratório Caprino) DNA – Deoxyribonucleic Acid (Ácido Desoxirribonucleico)
DNAc – Complementary Deoxyribonucleic Acid (Ácido Desoxirribonucleico)
ELISA – Enzyme-linked Immunosorbent Assay (Ensaio de Imunoabsorção Enzimática) EUA – Estados Unidos da América
g – grama
HRSV – Human Respiratory Syncytial Virus (Virus Sincicial Respiratório Humano) IBR – Infectious Bovine Rhinotracheitis (Rinotraqueíte Infeciosa Bovina)
IgA – Imunoglobulinas A IgG – Imunoglobulinas G IgM – Imunoglobulinas M
IL-1 – Interleucinas pró Inflamatórias
ISCOM – Immunostimulating Complexes (Complexos imunoestimulantes) Kg – Quilograma
m/s – Metro por segundo m2 - Metro quadrado m3 – Metro cúbico min – Minuto mm – Milímetros
xv
MRSV – Mouse Respiratory Syncytial Virus (Virus Sincícial Respiratório dos Murganhos) ORSV – Ovine Respiratory Syncytial Virus (Virus Sincícial Respiratório Ovino)
p.v. – Peso Vivo
PCR – Polymerase Chain Reaction (Reação em Cadeia da Polimerase)
PCR-RT – Reverse transcription polymerase chain reaction (Reação em Cadeia da Polimerase- Trancrição reversa)
PI-3 – Parainfluenza Virus- 3 (Vírus Parainfluenza – 3) ppm – partes por milhão
RNA – Ribonucleic Acid (Ácido Ribonucleico)
SNIRA – Sistema Nacional de Identificação e Registo Animal SRB – Síndrome Respiratório Bovino
TH2 – T helper 2 (Linfócitos tipo T-2)
TNF – Tumor Necrosis Factors (Fatores de Necrose Tumoral) UNICOL – União das Cooperativas de Lacticínios Terceirense
1
Capitulo I
1. Introdução
1.1. Caracterização da Ilha Terceira
A Terceira é uma das nove ilhas que integram o Arquipélago dos Açores, fazendo parte do Grupo Central. Ostentando uma forma elítica, tem uma área de cerca de 402,2 quilómetros quadrados, sendo a maior deste grupo. Possui um clima ameno, favorável à produção de pastagens durante todo o ano (Empreendimentos e Atividades - Direção Regional do Turismo - Secretaria Regional da Economia - Governo dos Açores 2012). O principal setor económico desta região é a bovinicultura, principalmente a produção de bovinos de leite. Os animais são na sua maioria de raça Holstein-Frísia, mas também se podem observar outras raças como a Jersey, Vermelha Dinamarquesa, Montbeliard, bem como raças de carne e as raças autóctones Ramo Grande e Touro de Lide. O pastoreio é a base da alimentação da maioria destes animais, sendo praticamente exclusiva em algumas raças como é a Touro de lide. No entanto, também existem animais estabulados permanentemente, e animas em regime de semi-estabulação. Sendo assim, a alimentação baseia-se na pastagem, sendo suplementada com concentrado, silagem de erva e/ou de milho e suplementos vitamínicos e minerais. Devido ao facto dos animais pastorearem em diversas zonas, a grande maioria das explorações tem a necessidade de ordenhas móveis, para que este processo seja feito nas próprias pastagens onde os animais se encontram.
1.2. Vírus Sincícial Respiratório Bovino
O Vírus Sincícial Respiratório Bovino (BRSV), agente etiológico relacionado com a doença respiratória bovina, causa grandes prejuízos económicos, quer em bovinos adultos, quer durante a recria de vitelas de reposição, entre outros animais. Este agente tem uma prevalência significativa em explorações de leite (mais de 80%), como recentemente foi observado por Klem et al. (2014). Este estudo também refere que seriam os animais jovens aqueles que providenciam melhores indicadores do estatuto sanitário das explorações. Em Portugal, o BRSV já foi relatado com prevalências sorológicas igualmente elevadas (Stilwell et al, 2007), em vacadas ribatejanas. No entanto, ao nosso conhecimento, não existem dados publicados sobre prevalências, nem foram determinados os fatores envolvidos na disseminação do vírus nos efetivos leiteiros da Ilha Terceira.
2
1.3. Classificação do BRSV
O BRSV foi isolado pela primeira vez em 1967, em bovinos com pneumonia (Spilki e Arns, 2008). Este vírus tem distribuição mundial, sendo uma causa grave de doença respiratória em bovinos jovens, caracterizada por bronquite e pneumonia intersticial, de forma semelhante à patologia respiratória decorrente da infeção pelo Vírus Sincícial Respiratório Humano (HRSV) em crianças (Taylor et al., 2015; Vandermeulen et al., 2016).
O HRSV e o BRSV pertencem ao género Pneumovirus, sub-familia Pneumovirinae, família Paramyxoviridae e à ordem Mononegavirales. Outros vírus pertencentes ao género Pneumovirus e intimamente ligados são o Vírus Sincícial Respiratório dos Murganhos (MRSV), o Vírus Sincícial Respiratório Ovino (ORSV) e o Vírus Sincícial Respiratório Caprino (CRSV) (Valarcher e Taylor, 2007; Spilki e Arns, 2008; Sacco et al., 2014; Taylor et al., 2015; Jubb e Palmer’s, 2016). Segundo Blodörn et al.( 2015) apesar de os altos valores de seroprevalência, os surtos ocorrem frequentemente durante os meses de outono e inverno em climas temperados.
1.4. Estrutura e Organização genómica
O BRSV é um vírus pleomórfico, com envelope lipídico que deriva da membrana plasmática das células do hospedeiro, esférico ou moldado de forma e tamanho variável (Valarcher e Taylor, 2007; Sarmiento-Silva et al.,2012; Sacco et al., 2014; Tuncer e Yeşilbağ 2015; Jubb e Palmer’s, 2016). Possui partículas esféricas que têm entre 80 a 450nm de diâmetro e partículas filamentosas que medem aproximadamente 1mm e 100nm de diâmetro (Spilki e Arns, 2008; Jubb e Palmer’s, 2016).
O genoma viral codifica 10 proteínas, que são a glicoproteína G, responsável pela mediação da ligação do vírus às células hospedeiras; a proteína F, que induz a fusão das células infetadas; as proteínas da matriz (M, M2 ou 22K); a proteína do nucleocápside (N); a fosfoproteína (P); a polimerase (L); a proteína pequena SH (do inglês small hydrophobic); e as proteínas não estruturais (NS1 e NS2) (Spilki e Arns, 2008).
A membrana plasmática do BRSV possui 3 glicoproteínas na superfície membranar, que estão organizadas na superfície do mesmo. Dentro destas glicoproteínas, existem as glicoproteínas (G), responsáveis pelo ataque viral às células do hospedeiro, proteínas de fusão (F) que induzem a fusão das células infetadas, e proteínas hidrofóbicas (SH) (Valarcher e
3
Taylor, 2007; Sarmiento-Silva et al., 2012; Sacco et al., 2014; Jubb e Palmer’s, 2016). A proteína G não é essencial à replicação viral in vitro, mas desempenha um importante papel na infeção in vivo pois possui grande capacidade de glicosilação semelhante à mucina, facilitando a penetração do vírus através do muco no epitélio respiratório (Spilki e Arns, 2008). Sendo assim, a principal proteína alvo do sistema imunitário é a G, porém, a proteína F em associação com a G vão ser alvo do sistema imunitário do hospedeiro, direccionando os seus anticorpos com o objetivo de neutralizar a função de ambas as glicoproteínas e consequentemente o BRSV (Valarcher e Taylor, 2007; Jubb e Palmer’s, 2016).
A formação de sincícios quer in vitro, quer in vivo, é responsável pela proteína F como foi dito anteriormente (Jubb e Palmer’s, 2016). A proteína SH, é uma proteína integral de membrana inserida no envelope viral, cuja função ainda é desconhecida (Valarcher e Taylor, 2007). Segundo Spilki e Arns (2008) a proteína de matriz M é uma proteína não-glicosídea, interna à partícula viral.
O nucleocápside engloba um nucleoplasmídeo helicoidal que consiste em nucleoproteínas N, fosfoproteínas P e RNA polimerase dependente. A fosfoproteína P atua como uma chaperona para a forma solúvel da proteína N. A proteína P ainda serve como um co-fator para a polimerase viral L, após a sua fosforilação. A polimerase viral L é a fração mais importante do complexo RNA polimerase dependente (Spilki e Arns, 2008). As proteínas N, P e L são responsáveis e suficientes para a replicação do RNA viral. Além disso o nucleocápside contém RNA genómico com cerca de 15000 nucleótidos, uma matriz proteica M, responsável pela sua interação com as membranas biológicas, devido à sua capacidade hidrofóbica (Spilki e Arns, 2008), sendo também responsável pela construção de uma camada superficial ao envelope vírico (Gershwin, 2012). São também estruturas constituintes do vírus o fator M2-1 transcricional anti terminação. Além disso, o genoma codifica a proteína do M2-2 que regula o RNA e duas proteínas não estruturais NS1 e NS2 (Valarcher e Taylor, 2007), que inibem a síntese e ação de interferões alfa e beta pela célula hospedeira, através do bloqueio da activação do fator 3 do interferão, diminuindo a resposta da célula à ação dos interferões (Spilki e Arns, 2008).
A partícula viral é provida também de proteínas celulares, como a actina, que é encontrada na superfície do vírus, caveolina e moléculas da matriz classe 1 da matriz extracelular (Valarcher e Taylor, 2007).
4
O RNA genómico é o modelo para replicação e transcrição. O RNA que é transcrito é uma sequência que codifica 10 RNA mensageiros ( Klem et al., 2014). Os 10 RNA mensageiros são traduzidos em 11 proteínas virais (Valarcher e Taylor,2007).
1.5. Replicação viral
Os vírus do género Pneumovirus ligam-se aos recetores celulares e aos glicosaminoglicanos encontrados na matriz celular, através da proteína G (Feldman et al., 2000). Esta etapa é completada com uma segunda ligação da proteína F à proteína de superfície da membrana celular (Stilwell et al., 2008). Depois da ligação do vírus à célula, por fusão do envelope viral à membrana celular, que permite a entrada do invólucro nuclear e material genético para interior da célula hospedeira, ocorrerão todos os processos da replicação do BRSV (Feldman et al., 2000; Larsen et al., 2001; Easton et al., 2004 ). Após esta inserção no ambiente intracelular, inicia-se a transcrição do genoma viral em RNA’s mensageiros, por ação do complexo RNA polimerase RNA-dependente (Spilki e Arns, 2008). Os invólucros nucleares são formados no citoplasma, (Valarcher e Taylor, 2007), iniciando-se o processo pela associação da proteína N livre aos genomas ou antigenomas, formando um complexo ribonucleoproteico de simetria helicoidal (Moussa, 1994; Schlender et al., 2003). Numa segunda etapa, as proteínas P e L ligam-se ao complexo ribonucleoproteico, formando-se o involucro nuclear (Moussa, 1994). A proteína M direciona os invólucros para as regiões da membrana celular, ricas em proteínas de superfície viral, e mais apropriados à exocitose da partícula viral (Moussa, 1994). O vírus atinge a sua maturidade na superfície da célula hospedeira, permanecendo aí firmemente aderido à membrana celular (Zimmer et al., 2003; König et al., 2004).
1.6. Variabilidade genética do BRSV
A variabilidade genética do BRSV está muito dependente da proteína G, uma vez que esta última evolui rapidamente, devido à sua tolerância à fixação de mutantes (Sarmiento-Silva et al., 2012; Affonso et al., 2014; Jubb e Palmer’s, 2016). Em contra partida, o gene da proteína F parece estar sobre fortes restrições seletivas estruturais, o que limita a sua evolução (Affonso, 2013). Assim, estima-se que o vírus esteja em constante evolução na natureza, proporcionado pela seleção exercida como resultado da resposta imune induzida pelo uso de
5
vacinados (Affonso, 2013) e pela imunidade adquirida por reinfeções nos locais onde não é habitual o uso das mesmas (Spilki e Arns, 2008; Affonso, 2013).
Foram diversas as diferenças encontradas entre os BRSV isolados, analisadas por intermédio de anticorpos monoclonais, evidenciando três subgrupos antigénicos A, AB e B (Spilki e Arns, 2008), classificação adquirida com base nas diferenças antigénicas e genéticas apresentadas. No entanto, ainda existem vírus isolados respiratórios sincíciais que não se enquadram na classificação acima mencionada ( Furze et al., 1994; Furze et al., 1997;).
Segundo Sacco et al. (2014), são as glicoproteinas F e G que contém os epítopos neutralizadores e protetores principais. Para o BRSV, a proteína de ligação é o alvo principal na resposta anti-BRSV por parte do hospedeiro. Existem seis grupos genómicos diferentes, devido à presença de quatro variantes do subgrupo antigénico AB (Spilki e Arns, 2008).
Em concordância com diversos estudos, foi possível identificar os locais mundiais onde os subgrupos se encontram com maior expressividade. Conclui-se que o subgrupo A é encontrado nos Estados Unidos da América, Japão, Reino Unido e alguns Países da Europa. O subgrupo AB encontra-se também na Europa e Japão. Por fim, o subgrupo B foi isolado no Reino Unido e Brasil (Spilki e Arns, 2008).
1.7. Síndrome Respiratório Bovina
O vírus sincícial respiratório bovino é o maior desafio do Síndrome Respiratório Bovino (SRB) (Klem et al., 2014), tendo outras nomenclaturas como Doença Respiratória Bovina, Complexo Respiratório Bovino e Doença Respiratória Bovina Indiferenciada ou Febre Indiferenciada (Radostits, 2001; Radostits et al., 2007; González-Martín et al., 2011). Independentemente da nomenclatura, o SRB é considerado como a patologia mais devastadora na bovinicultura em todo o mundo (Sacco et al., 2014), causando surtos agudos de pneumonia em todos os sistemas e fases de produção (Edwards, 2010; Ackermann et al., 2010). É a principal causa de morbilidade (70%-80%) e mortalidade (40%-50%) em explorações de bovinos e contribui para perdas substanciais no desempenho e na qualidade das carcaças (Edwards, 2010).
Esta patologia manifesta-se como uma broncopneumonia multifatorial, desencadeada por uma panóplia de fatores que predispõe os animais à doença (Antonis et al., 2010). Em vitelos de aptidão leiteira é muitas vezes designada de Pneumonia Enzoótica e é comum a infeção em vitelos confinados, quer para recria ou para engorda, sendo que neste último caso, é frequentemente chamada de Febre dos Transportes, uma vez que em vitelos de engorda a
6
maior incidência de broncopneumonia ocorre depois do transporte para as explorações de engorda.
O SRB é resultado da complexa interação de uma tríade de fatores que se combinam para desencadear a doença (Sañudo et al., 2008; Stokka, 2010). Fatores relativos ao ambiente, e ao hospedeiro são variáveis predisponentes da patologia respiratória (Sañudo et al., 2008; Nickell e White, 2010).
Segundo Cerviño e Calvo (2007), a presença de agentes infeciosos nas vias respiratórias é essencial para que ocorra SRB, mas não suficiente, sendo necessário um estado de imunodepressão inicial, para que permita a colonização dos agentes patogénicos, nas vias aéreas inferiores. A imunodepressão deriva de um processo desencadeado por fatores stressantes, ambientais ou resultado da ação direta de agentes imunodepressores, tais como são os vírus de Rinotraqueite Infecciosa Bovina (IBR) e Diarreia Viral Bovina (BVD) (Cerviño e Calvo, 2007; Stilwell et al., 2007).
A influência da capacidade defensiva dos animais desencadeia, pela ação do stresse, uma estimulação do hipotálamo-hipofise, que, consequentemente, responde aumentando a secreção da hormona adrenocorticotropica (ACTH), cuja principal função é a estimulação da produção de corticoesteroides na glândula adrenal (Reece, 2006; Cerviño e Calvo, 2007). O resultado efetivo destes corticoesteroides é a depressão do sistema imunitário em várias frentes de inibição do sistema imunitário humoral, diminuindo a produção de imunoglobulinas, que levam a quadros de linfocitopenia e eosinopenia, e o bloqueio da resposta inflamatória e dos processos de cicatrização (Cerviño e Calvo, 2007). São exemplos de fatores ambientais imunodepressores que podem mesmo afetar aspectos básicos do sistema imunológico: o transporte; desmame; elevada densidade de animais; mudanças na estrutura social dos animais; alterações ambientais; sons; mudanças alimentares; alterações de maneio e condições de alojamento (Ackermann et al., 2010).
Os numerosos agentes infeciosos que estão associados ao SRB são ubiquitários em populações de ruminantes, e as bactérias mais frequentemente correlacionadas com esta broncopneumonia fazem parte da microbiota nasofaríngea destes animais (Smith, 2009). Os agentes virais, tais como o herpesvírus bovino tipo 1 (BHV-1), o vírus respiratório sincícial bovino e o vírus parainfluenza-3 (PI-3), podem produzir uma sintomatologia clínica compatível com SRB, mas o seu envolvimento é geralmente considerado como antecedente ou concomitante com infeções bacterianas (Taylor et al., 2010). Em termos etiológicos, o SRB deve ser considerado uma patologia de maneio ou ambiental, em vez de uma doença
7
infeciosa, embora seja imprescindível a presença de agentes infeciosos (Sañudo et al., 2008), sendo que os agentes bacterianos, geralmente, associados ao SRB são Mannheimia haemolytica, Pasteurella multocida, Histophilus somni e Mycoplasma bovis (Vandermeulen et al., 2016).
Segundo Panciera e Confer (2010), as formas mais fatais de SRB são as pneumonias bacterianas, que ocorrem 6 a 10 dias depois de um período de stresse.
A prevenção e controlo do SRB deve consistir em diferentes tipos de estratégias: Minimização, o mais possível, dos fatores stressantes que predispõem a
doença, boas práticas de maneio e higiene fundamentalmente;
Aplicação de metafilaxia e instauração de um sistema profilático vacinal eficaz;
Diagnóstico precoce da doença;
Tratamento propriamente dito de animais doentes (Sañudo et al., 2008).
2. Epidemiologia
2.1. Fatores predisponentes do SRB
2.1.1. Fatores imunitários2.1.1.1. Predisposição dos bovinos
Os bovinos têm um conjunto de particularidades e características fisiológicas, histológicas, imunológicas e sociais que os levam a ter predisposição para doenças respiratórias, comparativamente com outras espécies (Cerviño e Calvo, 2007; Ackermann et al., 2010).
De acordo com Cerviño e Calvo (2007), anatomicamente, os bovinos têm pulmões pequenos relativamente ao seu volume corporal, dotados de poucos alvéolos e escassos capilares, levando-os a ter uma menor capacidade respiratória (mais evidente em raças de carne e em machos com maior volume muscular). Por outro lado, os pulmões dos bovinos têm septos interlobulares que limitam a interdependência, aumentam a resistência, e diminuem a ventilação colateral, o que reduz a eficácia da resposta imune (Ackermann et al., 2010). Têm também uma árvore traqueobrônquica longa e estreita, aumentando o volume de espaço morto
8
do trato respiratório, permitindo uma maior área de superfície e a deposição de partículas e gases nocivos (Cerviño e Calvo, 2007; Ackermann et al., 2010).
A estratégia fisiológica que os bovinos encontraram para satisfazer a ventilação por minuto foi aumentar a frequência respiratória, em vez de aumentar o volume inspirado. Sendo assim, a velocidade do ar inspirado é maior e tem consequências como o acumular de partículas e a colonização das vias respiratórias baixas, propiciando a colonização de bactérias presentes nas vias aéreas superiores (Cerviño e Calvo, 2007).
A velocidade de movimentos ascendentes da barreira mucociliar nos bovinos é 15 mm/min, metade da eficiência em relação às restantes espécies (32 mm/min). Os bovinos possuem também um menor número de macrófagos e estes são mais esquivos quando expostos a agentes infeciosos (Cerviño e Calvo, 2007). No entanto, os bovinos possuem 100 a 1000 vezes mais mastócitos que as restantes espécies, que desencadeiam uma violenta resposta inflamatória, regulada por retroação positiva (Cerviño e Calvo, 2007).
Por estas razões, Ackermann et al. (2010) referem que por forma direta ou indireta, os bovinos são uma espécie propensa a doenças respiratórias.
A forma social como os bovinos vivem em manadas é uma peculiaridade que aumenta a taxa de contágio de agentes infeciosos.
2.1.1.2. Colostro
A constituição da placenta nos bovinos impede a transferência feto-materna de anticorpos, sendo que por isso, os vitelos nascem praticamente sem estas glicoproteínas (Climeni et al., 2008). Desta forma, a proteção contra doenças é conferida pela administração do colostro nas primeiras amamentações do vitelo. Todas as classes de imunoglobulinas maternas (IgG, IgM e IgA) são absorvidas ou permanecem no intestino conferindo proteção local na mucosa (IgM e IgA) (Stokka, 2010). Além das imunoglobulinas, existem no colostro, outros imunoprotetores, tais como, citocinas e interleucinas pró-inflamatórias (IL-1) e fatores de necrose tumoral (TNF), que têm como função ativar a imunidade inata e adquirida do vitelo. Pelo colostro também é-lhe facultado linfócitos maternos, que aparentemente, são uma importante proteção quer ao nível da mucosa intestinal quer nos linfonodos mesentéricos (Stokka, 2010).
Segundo Stokka (2010), existem diferenças quantitativas na transferência que resultam em incidências diferentes no síndrome respiratório bovino e na performance dos animais.
9
Algumas horas após o parto, a capacidade de absorção de imunoglobulinas e a qualidade do colostro diminuem abruptamente. Por esta razão, o colostro deve ser administrado até um máximo de 6-8 horas após o parto, sendo idealmente fornecido o mais rápido possível (Climeni et al., 2008).
Um outro fator importante relativo à transferência de imunidade ao vitelo está relacionado com as progenitoras. Por exemplo, as novilhas têm menos imunoglobulinas no colostro que uma multípara, conferindo assim, uma menor proteção ao vitelo. O inverso ocorre nas multíparas, que conferem maior imunidade e com maior durabilidade, que pode interferir com o desenvolvimento da imunidade adquirida do vitelo. A vacinação das vacas antes do parto contribui para o reforço da qualidade colostral (Taylor et al., 2010 a).
O volume de colostro em vacas de carne é significativamente menor ao produzido por vacas de leite, no entanto, é muito mais concentrado em imunoglobulinas. Um estudo canadiano estimou que o recém-nascido em vacas de carne precisa consumir cerca de 2,3 litros de colostro, para que a transferência de imunoglobulinas cubra os requerimentos do vitelo (300 g) (Stokka, 2010). E, segundo Gorden e Plummer (2010), uma vitela Holstein que esteja dentro dos padrões, deve ingerir 3,78 litros, num curto período de tempo, preferencialmente até às duas horas após o parto. Em relação a vitelos mais pequenos como é o caso da raça Jersey, deve ingerir 2,83 litros no tempo mencionado anteriormente.
Stokka (2010) refere que a administração de suplementos colostrais, substitutos e colostro congelado, não podem substituir nem igualar a qualidade do colostro fresco.
Para Taylor et al. (2010 a) as falhas da imunidade passiva continuam a ser um dos maiores riscos de SRB.
2.1.2. Fatores ambientais 2.1.2.1. Nutrição
Em concordância com Gorden e Plummer (2010), é base fundamental uma nutrição adequada, não só para o crescimento adequado dos animais como também para o desenvolvimento e resposta do sistema imunitário. Um dos mais dispendiosos processos fisiológicos quanto ao gasto de energia é a resposta imunitária a invasões de agentes patogénicos, comprovado por diversos estudos. Animais em bom estado nutricional têm maior capacidade de defesa face a doenças infeciosas (Gorden e Plummer, 2010).
10
No que diz respeito à qualidade do alimento fornecido aos animais, este interfere direta ou indiretamente com a sua saúde em todas as etapas de produção dos mesmos. Desde a alimentação das mães até às últimas etapas de produção, a alimentação deve ser a constante preocupação, ajustada às necessidades dos animais. Existem períodos críticos, ao longo da vida do animal, como é o caso do período neonatal, o desmame e a chegada às explorações de novos animais (Taylor et al., 2010 a.)
De acordo com estudos de Stokka (2010) a suplementação de proteínas no período peri-parto, às vacas, melhorou o peso ao nascimento, o ganho de peso dos vitelos e a qualidade das carcaças. O mesmo autor provou que a condição corporal das vacas no pré-parto foi inversamente relacionada com o tempo que os vitelos demoraram a colocar-se em pé influenciando a ingestão e absorção do colostro (Stokka, 2010).
Um dos principais desafios são as necessidades nutricionais dos vitelos desmamados ou recém-nascidos. As rações formuladas devem ter em atenção as necessidades de proteínas, energia, vitamínas e minerais. Um componente fundamental é o selénio que está intimamente ligado com a imunidade humoral e com o crescimento dos vitelos (Reffett et al., 1987; Beck et al., 2005). É sempre um duelo conseguir uma nutrição balanceada. Se por um lado, rações deficientes em nutrientes suprimem o sistema imune e conduzem a más respostas vacinais, infeções e tratamentos, por outro lado, rações desequilibradas ou agressivas conduzem à diminuição do consumo, da digestibilidade e consequentemente causam patologias digestivas que reprimem a eficiência produtiva dos animais (Sweiger e Nichols, 2010). Os animais chegados à exploração, os vitelos de alto risco podem ter um mau funcionamento ruminal e consequentemente não responder à alimentação, devendo ser objetivo dos proprietários aumentar a vigilância a estes animais. Anorexia, ou, empiricamente, a diminuição do grau de repleção capilar são sinais importantíssimos como indicadores de saúde dos animais. Para retornar os estímulos da função ruminal devem ser fornecidas rações de transição, com um aporte maior de proteínas e minerais (Sweiger e Nichols, 2010). Deve haver preocupações com a higiene dos comedouros e bebedouros, devendo estes estarem livres de detritos e alimentos contaminados, antes da entrada de um novo lote. Planos profilácticos devem ser implementados nesta altura ou previamente, pois a carga parasitária reduz o apetite e não optimiza a absorção de nutrientes (Sweiger e Nichols, 2010).
Numa síntese de Sweiger e Nichols (2010), a nutrição adequada pode ser insuficiente para evitar o stresse ou a doença, no entanto pode diminuir os seus efeitos e aumentar as probabilidades de recuperação dos animais.
11 2.1.2.2. Maneio
Um dos fatores que leva ao aumento do nível de stresse, provocando a disseminação de agentes patogénicos, é a comercialização, manipulação e posteriormente a sua habituação a novos espaços e animais (Sweiger e Nichols, 2010). Taylor et al. (2010 a) referiram que, enquanto os fatores ambientais são muitas vezes, variáveis e incontroláveis, as práticas de maneio podem ser as causas mais importantes na prevenção e mitigação da SRB. Os transportes, misturas de lotes e transferência de lotes para novas instalações provocam o aumento de stresse e maior exposição a agentes patogénicos ( Taylor et al., 2010 a), levando a maiores probabilidades de despoletar SRB. Outro erro comum em explorações de bovinos é a introdução de novos animais num grupo.
Os agentes infeciosos que causam maior preocupação, devido a serem mais virulentos, são aqueles que estão em animais refratários aos tratamentos. Posto isto, estes animais deveriam estar em zonas isoladas e longe dos recém chegados (Sweiger e Nichols, 2010). A gestão da mistura de grupos de animais é crítica, e por isso, deve ser ponderada e analisada sobre o ponto de vista da bioconteção de doenças. Os agentes patogénicos que circulam dentro de um grupo de animais são mais facilmente controláveis sem a introdução de novos agentes através de novos animais (Sweiger e Nichols, 2010). Os lotes devem ser geridos com o número de animais adequado, segundo as normas europeias, a densidade animal não deve ultrapassar um metro quadrado por 100 kg de peso vivo, uma vez que a elevada densidade de animais é dos fatores mais importantes causadores de stresse entre os vitelos (Sañudo et al., 2008). Idealmente, a manipulação dos animais, para realizar a profilaxia e metafilaxia, deve ser efetuada antes de um período de stresse, como o transporte e desmame, para que haja uma separação dos períodos de stresse e não uma soma dos mesmos (Taylor et al., 2010 b). Esta, deve ser realizada minimizando o stresse imposto aos animais, com o mínimo de ruído e pressão, e visto que os bovinos são animais de hábitos, as práticas de maneio, alimentação e limpeza devem ser rotineiras (Sañudo et al., 2008).
Outra prática que deve ser efetuada ao nascimento é a desinfeção dos cordões umbilicais dos vitelos. Este procedimento reduz a mortalidade dos vitelos e reduz a SRB de 19% para 5% (Gorden e Plummer, 2010).
12 2.1.2.3. Desmame
O desmame dos vitelos é um período muito stressante para o animal, quer seja pela separação do animal da mãe, quer seja pela alteração da dieta. Agravado por muitas alterações ambientais, sistemas de produção, transporte e comercialização, há o aumento da predisposição dos animais para doenças respiratórias (Gorden e Plummer, 2010; Lorenz et al., 2011). Sendo por isso imperativo minimizar os efeitos cumulativos dos vários fatores de stresse no desmame, com programas profiláticos, vacinais e alimentação no pré desmame, de modo a reduzir significativamente a morbilidade e mortalidade (Edwards, 2010; Taylor et al., 2010 b; Lorenz et al., 2011). Estudos provam que animais suplementados com concentrados antes do desmame, tiveram menos redução nas defesas imunológicas. Esta prática também é defendida como um meio de redução do stresse nos vitelos desmamados, pela familiarização progressiva a uma alimentação palatável. Outra medida ainda é atrasar, por algumas semanas, a mudança dos vitelos para outro ambiente (Taylor et al., 2010 b).
Práticas como a utilização de dispositivos anti sucção, ou a não separação visual entre os vitelos e as mães durante um período de transição são medidas de eficácia questionável quanto à redução dos comportamentos de stresse nos vitelos (Lorenz et al., 2011). Quando os vitelos são misturados em grupos pós-desmame, é importante permitir o espaço adequado por vitelo, ambiente fresco e acesso fácil ao alimento e água (Gorden e Plummer, 2010).
2.1.2.4. Transporte
O transporte é o fator de risco, não infecioso, universalmente mais aceite do SRB, daí o termo "Febre dos transportes" (Radostits, 2001; Taylor et al,.2010 a).
A forma de maneio dos bovinos, garante que praticamente todos os vitelos sejam transportados pelo menos uma vez na vida. Logo, a maioria dos investigadores assumem o transporte como a componente com maior efeito sobre a incidência do SRB (Taylor et al., 2010 a)
Aparentemente, outros fatores stressantes têm maior importância no risco de contração do SRB do que a distância do transporte (Radostits, 2001). Segundo Taylor et al. (2010 a) a manipulação dos animais aquando da classificação, carregamento e movimentação inicial, são provavelmente as componentes mais stressantes do transporte. Portanto, é certo, que independentemente da distância de transporte, os animais devem ser manipulados com o mínimo de excitação possível. Isso é tanto mais válido quanto mais jovens forem os animais transportados.
13
A desidratação é uma grande preocupação durante os transportes e tem sido sugerido como um mecanismo pelo qual o transporte tem impacto na doença (Taylor et al., 2010 a). É por isso necessário garantir as regras do transporte de longo curso proporcionando aos animais horas de descanso, água e alimento, em instalações preparadas para o efeito (Radostits, 2001). De acordo com as normas europeias, o Regulamento 1/2005 diz que após 14 horas de viagem, deve haver um período de repouso de pelo menos 1 hora para os animais serem abeberados e, se necessário, alimentados. Depois deste período de repouso, podem ser transportados por mais um período de 14 horas (Regulation Nº 1/2005, 2004). À chegada ao seu destino, os animais devem ter acesso a água e alimentos frescos e um local seco para se deitarem e poderem descansar.
De acordo com Sweiger e Nichols (2010), as primeiras 24 horas após a chegada são as mais críticas. Os animais devem ser avaliados cuidadosamente em busca de sinais clínicos evidentes de doença ou evidência de anorexia.
Isto é particularmente importante se atrasos inesperados no transporte tiverem ocorrido, e consequentemente aumentado os níveis de stresse nos animais. Hoje em dia, as ligações rodoviárias são melhores e os veículos de transporte são mais rápidos e confortáveis, encurtando significativamente a viagem dos animais aos seus destinos (Radostits, 2001).
2.1.2.5. Condições climáticas
As condições meteorológicas são fatores importantes no SRB, visto que, esta patologia é aparentemente mais comum no Outono e Inverno. Porém, podem estar associados fatores nutricionais e maneio próprios da época (Sañudo et al.,2008; Taylor et al., 2010 a).
Animais saudáveis são capazes de lidar com temperaturas ambientais amplas, desde que recebam quantidades adequadas de energia, camas secas e abundantes, ar limpo e sem correntes de ar ( Sañudo et al., 2008; Gorden e Plummer 2010; Lorenz et al., 2011).
A amplitude térmica tolerada pelos vitelos é dada em função da idade dos mesmos, animais mais velhos toleram temperaturas mais baixas, dependendo também da velocidade do ar e do tipo de cama ou solo onde estão alojados. De acordo com Lorenz et al. (2011) e Sañudo et al. (2008) um dos exemplos de cama que permite isolar temperaturas frias é a palha.
Em concordância com os estudos de Sañudo et al. (2008), a temperatura ambiente recomendada para animais com mais de quatro meses de idade, varia entre -5ºC e os 25ºC. Muitos autores sugerem que a amplitude térmica ao longo do dia, ou as mudanças bruscas das
14
condições climáticas, deixam os bovinos com maior predisposição à doença, ao invés de situações em que é alcançada uma temperatura constante no tempo (Sañudo et al., 2008; Taylor et al., 2010; Gorden e Plummer, 2010). Estes fatores são facilmente entendidos se pensarmos que as variações de temperatura deprimem o sistema imunitário e aumentam a incidência de doença respiratória (Sañudo et al., 2008). Embora a alteração brusca de temperatura seja um fator predisponente, este pode ser revogado com estudos que expõem que o SRB tem um período de incubação, incompatível à ocorrência da infeção logo a seguir a um período de alterações climáticas (Gorden e Plummer 2010; Taylor et al., 2010 a).
2.1.2.6. Instalações
Um dos grandes desafios da bovinicultura é o desenho das explorações, e pavilhões quando estes existem. Apropriar as instalações ao tipo de produção é fundamental para minimizar fatores que possam vir a ter impacto na produção e rentabilidade do efetivo. Deve-se ter Deve-sempre em conta as práticas de maneio da exploração, as condições de bem-estar e saúde dos animais e a qualidade de vida dos trabalhadores (Sañudo et al., 2008).
A construção de uma exploração confinada deve ter em atenção diversos aspetos a ser considerados como o espaço disponível para a sua localização, as condições impostas pelo produtor, o capital disponível, as necessidades básicas de bem estar animal, etc. ( Sañudo et al., 2008; Gorden e Plummer, 2010).
Em suma, não existe espaços perfeitos mas sim uma súmula de condições com o objetivo e maior eficiência e produtividade dos bovinos. O objetivo é desenhar explorações funcionais que disponham de uma adequada liberdade de movimentos e conforto, adequadas condições ambientais (temperatura, ventilação e iluminação) e facilidade de maneio, limpeza e manutenção de camas, permitindo alcançar um adequado nível de bem-estar animal, com o mínimo de stresse, que se reflita num ótimo funcionamento do sistema imunitário (Sañudo et al., 2008). O desequilíbrio destas variáveis reflete-se no aumento de patologias e despesas médicas.
Segundo Sañudo et al (2008), as instalações de vitelos devem ter no topo das suas preocupações condições ambientais e conforto dos animais. O excesso de animais, a higiene, a temperatura ambiente, a humidade relativa, a qualidade e velocidade do ar devem ser considerados de forma simultânea para minimizar a carga microbiana no ambiente
15
diminuindo a prevalência de patologias respiratória (Sañudo et al., 2008 ;Gorden e Plummer, 2010).
Com o objetivo de diminuir a competição e agressividade entre animais e
posteriormente a prevalência de doença, cada vitelo deve ter espaço suficiente para manifestar os seus comportamentos normais. O espaço social de cada animal implica um espaço físico necessário para o seu descanso, mais uma área de intolerância ou tolerância zero. Esse espaço está calculado, por aproximação, em 1 m2/100 kg de p.v. (Sañudo et al., 2008). Lorenz et al., (2011) provou que o sobrepovoamento numa produção “indoor”, exige mais habilidade dos operadores na gestão das patologias respiratórias. A densidade de animais, para além de ser um influente fator de stresse, interfere com os níveis de humidade, calor e gases nocivos ambientais, assim como também aumenta as taxas de contágio de doenças (Sañudo et al., 2008).
Uma das regras básicas de higiene que devem ser tidas em conta é a mudança das camas. Esta prática deve ser bastante frequente, para evitar o acumulo de urina e fezes que consequentemente aumentam a humidade, as concentrações de gases nocivos e a carga bacteriana (Lorenz et al., 2011).
As instalações com o objetivo de renovação do ar, devem ser ventiladas quer natural quer artificialmente (Lorenz et al., 2011). A orientação dos pavilhões deve ser perpendicular à direção dos ventos dominantes. O volume de ar estático representa o volume mínimo disponível por vitelo no interior dos edifícios e recomenda-se que esteja compreendido entre os 20-25 m3 por cada vitelo de 500 kg de p.v. (Sañudo et al., 2008). A superfície de entrada de ar deve ser pelo menos o dobro da superfície de saída de ar e deve estar a 2 metros de altura do solo para evitar correntes de ar sobre os animais. A velocidade de ar não deve exceder os 0,3 m/s no Inverno, nem os 0,5 m/s no Verão (Sañudo et al., 2008).
Uma das medidas a ter em conta são as concentrações de amoníaco, que não devem ultrapassar as 10 ppm, e a humidade relativa deve estar compreendida entre valores de 60% a 70% para uma temperatura de 15ºC, não devendo ultrapassar os 85% (Sañudo et al., 2008; Lorenz et al., 2011). Este último valor é discordante no estudo apresentado por Gorden e Plummer (2010) que referem que a humidade relativa não deve mesmo ultrapassar os 75%.
Outra forma de instalações, e com bons resultados, são os iglôs ou pequenas gaiolas. Pequenas estruturas que protegem os animais das condições atmosféricas adversas, que, permitem que os vitelos estejam separados ou em grupo. Este sistema permite aos animais serem colocados ao ar livre, de forma protegida onde se têm sido observadas diminuições nas
16
prevalências do SRB (Gorden e Plummer, 2010). Idealmente estas estruturas devem ser colocadas fora de zonas que possam contaminá-las, como por exemplo, exaustores e fossas. Deve-se ter com prática de maneio movimentá-las entre novos lotes, para permitir uma redução dos microrganismos presentes na superfície inferior das mesmas.
Por fim, mas não menos importante os vitelos jovens, em condições de estabulação devem estar situados nos locais de melhor acesso e melhor qualidade, e evitar o contacto com animais mais velhos.
2.1.3. Fatores associados a outros agentes patogénicos
De acordo com o que já foi referido anteriormente o SRB é uma doença complexa causada pela interação de diversos agentes patogénicos (Ackermann et al., 2010). A participação dos vírus neste síndrome predispõe a pneumonias bacterianas graves (Panciera e Confer, 2010).O herpesvírus bovino tipo 1 (BHV-1), o vírus da rinotraqueíte infeciosa bovina (IBR), o vírus respiratório sincícial bovino (BRSV) e o vírus parainfluenza-3 (PI-3) são conhecidos como patogénicos respiratórios primários. Outros vírus como o adenovírus, rinovírus e coronavírus ainda estão sobre investigação quanto à sua participação neste síndrome (Stilwell et al., 2007; Panciera e Confer, 2010 ). O vírus da diarreia viral bovina (BVDV) tem um papel importante na patogenia desta doença pelo seu efeito imunodepressor, que prejudica a função ou destrói os macrófagos alveolares (Panciera e Confer, 2010; Griffin et al., 2010;Lorenz et al., 2011; Hay et al., 2016). O BHV-1, o PI-3, o BRSV e o BVDV podem causar algum grau de doença respiratória aguda mas, à exceção do BRSV, a fatalidade não é geralmente associada a estas infeções sozinhas (Klem et al., 2014). Em vez disso, o seu papel é criar um ambiente favorável à colonização e replicação bacteriana (Panciera e Confer 2010). Acredita-se que predispõem o animal à infeção bacteriana por dois mecanismos principais: o primeiro é a alteração dos mecanismos de “clearance” do trato respiratório e da superfície da mucosa, facilitando a translocação de bactérias do trato respiratório superior e a adesão bacteriana no parênquima pulmonar. O segundo é a alteração da resposta imunitária, inibindo a função dos macrófagos alveolares e a proliferação linfocitária, induzindo também a apoptose de linfócitos e modificando citocinas e outros mediadores da resposta inflamatória (Panciera e Confer, 2010, Taylor et al., 2010 a).
A maior causa de morbilidade e mortalidade do SRB é a pneumonia causada por agentes bacterianos. A maioria destas bactérias não são capazes de induzir doença
17
significativa sem a presença de fatores predisponentes, uma vez que são bactérias comensais do trato respiratório superior que oportunamente podem proliferar nos pulmões (Griffin et al., 2010; Panciera e Confer, 2010; Snowder et al., 2014). Mannheimia haemolytica é a mais comum e grave destes agentes bacterianos, associada a formas agudas e hiperagudas, geralmente fatais do SRB. Outros agentes importantes do SRB são Pasteurella multocida, Histophilus somni, Arcanobacterium pyogenes, Mycoplasma bovis e, mais recentemente descrita, Bibersteinia trehalosi (Panciera e Confer, 2010; Snowder et al., 2014). Mycoplasma bovis é encontrado em doentes crónicos, que não evoluem no ganho de peso e não respondem ao tratamento (Taylor et al., 2010 a).
Sendo assim, é evidente que o SRB é causado por uma combinação ou simbiose de vários agentes etiológicos associados a fatores predisponentes.
2.2. Forma de transmissão
A infeção dos bovinos é paralela aos bovinos de carne e leite (Affonso, 2013; Jubb e Palmer’s, 2016). Os casos mais severos são observados em animais com menos de um ano (Taylor et al., 2015 a). Segundo Affonso (2013) em explorações com aptidão de carne, a infeção é aparentemente tardia, enquanto que nas explorações com aptidão leiteira a infeção tem maior incidência em animais novos, entre as duas semanas e os cinco meses de idade, com o pico de incidência entre o primeiro e o terceiro mês de idade. Esse facto pode estar relacionado às diferenças na forma de maneio praticadas entre as explorações (Taylor et al., 2015 a ; Jubb e Palmer’s, 2016).
A maior incidência da doença ocorre nos meses compreendidos entre as estações de outono e inverno (Sacco et al., 2014; Jubb e Palmer’s, 2016). Esta ocorrência pode estar relacionada com a variação de temperatura anteriormente descrita, associada à aglomeração dos animais, promovendo a contaminação entre eles, e consequentemente aumentando a morbilidade do vírus nos animais que estão mais sujeitos a fatores predisponentes (Taylor et al., 2010 a). Porém embora, a maioria dos surtos ocorra nos meses frios, algumas infeções também podem ocorrer nos meses quentes de verão, devido à combinação de diversos fatores sendo o principal o stress térmico causado pelas temperaturas elevadas (Van der Poel ,1993; Bidokhti et al., 2012; Sarmiento-Silva et al., 2012).
As formas de transmissão podem ser as secreções nasais, aerossóis em distâncias curtas, quer por contato direto quer indireto, ou ainda, mediado por fomites. Porém, os
18
mecanismos de introdução e manutenção dentro do animal não estão ainda bem esclarecidos (Affonso, 2013; Taylor et al., 2015 a). De acordo com Sarmiento-Silva et al. (2012) os médicos veterinários e outros profissionais do setor da bovinicultura podem ser indiretamente mediadores da propagação viral, quer dentro das explorações, quer entre explorações. Desta forma é importante assegurar as regras de biossegurança, como por exemplo o uso de material descartável entre animais, e indumentária adequada para os operadores, entre outras medidas, principalmente em explorações de grandes dimensões, onde a manifestação da doença pode ter um grande impacto económico.
O BRSV pode ser detetado em animais sem sintomatologia de patologia respiratória (Spilki e Arns, 2008; Sacco et al., 2014; Jubb e Palmer’s, 2016). A elevada prevalência sorológica comparada com a baixa incidência da doença em alguns locais leva-nos a acreditar que a maioria das infeções ocorre de forma subclínica (Figueroa-Chávez et al., 2012; Francoz et al., 2015).
A patologia respiratória com sintomatologia clinica é mais comum em vitelos muito jovens (Jubb e Palmer’s, 2016). É importante reter a informação, que devido aos bovinos mais velhos apresentarem maioritariamente infeções subclínicas, são as principais fontes de infeção. As reinfeções pelo BRSV em manadas são maioritariamente por outro subtipo de BRSV (Affonso, 2013).
Em relação ao mecanismo de ação do BRSV, parece estar associado a mecanismos imunomediados. Assim, crê-se que o vírus multiplica-se maioritariamente nos pneumócitos tipo II e nas células ciliadas do epitélio respiratório, no entanto não têm efeito citopatogénico (Affonso, 2013).
2.3. Prevalência
De acordo com diversas pesquisas concluiu-se que o BRSV está amplamente difundido no mundo, provavelmente devido ao comércio, movimento de animais e transumância.
Independentemente da região, o espectável são prevalências elevadas, sugestivas que a transmissão viral é bastante comum entre manadas (Sarmiento-Silva et al., 2012).
O vírus BRSV tem sido alvo de estudo desde há muito tempo em vários países do mundo, e foi isolado pela primeira vez em 1967, a partir de casos de pneumonia em bovinos (Paccaud e Jacquier, 1970), entretanto, com o desenvolvimento das formas de análises,
19
tornou-se mais acessível a forma de diagnostico de BRSV nas manadas. Grande parte dos estudos anteriores foram feitos com base nas prevalências sorológicas de antigénios. Porém, novas formas de diagnóstico foram encontradas com os objetivos de identificar as diferenças entre subtipos de BRSV, bem como quantificar a prevalência do agente em estudo nas diversas regiões mundiais.
Em Portugal, a situação das prevalências do BRSV não são muito conhecidas (Stilwell et al., 2007). Contudo, foi elaborado um estudo por Stilwell et al. (2007) em 8 vacadas diferentes, 4 da raça Mertolenga, 2 da raça Preta e 2 de explorações com animais cruzados. Neste estudo foram testadas 136 vacas de um total de 550 fêmeas adultas e 73 vitelos, em idade de desmame, pertencentes às mesmas vacadas, que nunca tinham sido vacinados contra nenhum vírus respiratório. Utilizou-se Kit Hipra BRSV, técnica imunoenzimática, método bi-indireto, detecção de IgG anti-BRSV, onde se observou uma seroprevalência total de 55%, o que sugeria uma circulação generalizada do vírus. Porém, ficou comprovada uma reduzida prevalência de anticorpos na raça Mertolenga (36%), mesmo a ausência de anticorpos em duas vacadas da mesma raça e uma prevalência residual em vitelos (Stilwell et al ., 2007).
Diversos autores têm-se debruçado a estudar as prevalências do BRSV na Europa, onde se tem encontrado diversas regiões com prevalências altas.
A situação da Escócia tem sido relatada, embora não existam dados conclusivos sobre a sua prevalência (Hotchkiss et al., 2010). No entanto, a prevalência de 0,7% foi mencionada num estudo realizado por Hotchkiss et al. (2010).
Na Inglaterra, pesquisas de anticorpos anti-BRSV, em amostras de leite de tanque têm sido descritas (Sarmiento-Silva et al.,2012).
Outros países, como a Turquia, têm demonstrado seroprevalências elevadas (43%) (Yeşilbaǧ e Güngör, 2008). Porém, segundo Tuncer e Yeşilbağ (2015), após estudar 94 vitelos com limite máximo de idade 12 meses, distribuídos por 10 explorações intensivas, obteve uma prevalência superior, 96%.
Perante um estudo realizado transversalmente em diversas regiões na Noruega observou-se que a prevalência neste país era elevada, nomeadamente 71,7% (Gulliksen et al., 2009). Neste estudo vários colaboradores recolheram amostras em 6 vitelos com idades compreendidas entre 5 e 12 meses, de 135 explorações leiteiras norueguesas, e foram analisados através do método de ELISA, SVANOVA® (Kit comercial), com 95% de sensibilidade e 100% de especificidade. Outros estudos foram efetuados por Klem et al. (2013), também na Noruega, concluindo-se que as prevalências eram ligeiramente mais
20
baixas que o estudo mencionado anteriormente, que concluiram que a prevalência era de 54% utilizando também o SVANOVAB®. Noutro ensaio de Klem et al. (2014), igualmente na Noruega, mais propriamente na região Akershus, concluiu-se que a prevalência das explorações, com base na análise do leite do tanque das explorações, estava compreendida entre 83-85%. Recentemente, na Noruega, um estudo observou uma prevalência era de 49,1% através de amostras de leite no tanque e analisados também pelo método ELISA indireto, SVANOVIR® BRSV-ab, com sensibilidade 94% e especificidade 100% (Toftaker et al., 2016).
Diversas pesquisas na Suécia foram desenvolvidas e a situação na Suécia não se mostrou diferente do restante panorama. Estudos diferentes mostraram altas frequências de vírus em circulação. Uma pesquisa sueca para anticorpos BRSV em amostras de leite mostrou uma prevalência de 84% a 89%, nas regiões Sul, e menor prevalência no norte da Suécia, com prevalências compreendidas entre 41 a 51% (Elvander, 1996). Num trabalho desenvolvido com um total de 354 animais, divididos por 118 explorações, decorreu um estudo durante 11 meses, em que, numa primeira fase as novilhas com idades compreendidas entre 5 e 11 meses tinham uma prevalência de 71% para o BRSV e, numa segunda fase, onde as novilhas tinham idades compreendidas entre 7 e 21 meses (em algumas destas foram recolhidas amostras pela segunda vez) a prevalência aumentou para 90% (Hägglund et al., 2006). Segundo o autor, este fato deveu-se ao aproximar da segunda fase dos meses frios e estabulação dos animais e, consequentemente, maior contacto entre eles. Além disso, alguns dos animais eram mais velhos e, consequentemente, poderiam ser portadores de reinfeções por BRSV ( Hägglund et al., 2006). Mais recentemente, Beaudeau et al. (2010) efetuou um estudo de prevalências onde veio a deparar-se com novos valores de prevalência, igualmente elevados, entre 66,8% e 69,2%. Um estudo diferente, que visou comparar explorações biológicas de explorações convencionais, detetou que as prevalências variaram entre 78,5%-81,3% e 73,4%-82,3%, respetivamente em explorações biológicas e convencionais (Wolff et al., 2015).
Na Dinamarca, semelhante às restantes realidades, trabalhos foram efetuados que demostraram elevados valores de BRSV em circulação, com uma prevalência de 54% (Klem et al., 2013).
Na Bélgica, como espectável, não se observaram diferenças nas elevadas prevalências de BRSV nas manadas belgas (Pardon et al., 2011).
Uma investigação de Luzzago et al. (2010) em 59 explorações leiteiras italianas, onde recolheu amostras de 573 animais de dois lotes de idades diferentes, novilhas com idades
21
compreendidas entre os 6 e os 24 meses e vacas com mais de 24 meses, teve como intuito de analisar a prevalência do BRSV e os fatores de risco associados ao vírus, onde obteve uma prevalência global de 69,1%, em que as prevalências das novilhas e vacas são respectivamente 43% e 79%.
Recentemente, um ensaio elaborado na Austrália com 1484 animais distribuídos por diversas zonas da Austrália, obteve uma seroprevalência de 50% (Moore et al., 2015).
A prevalência da doença varia muito nos Estados Unidos da América (EUA). Os primeiros estudos mostraram uma prevalência de 67% em bovinos adultos em 1970 (Rossi e Kiesel, 1974). Porém, alguns dos estudos efetuados demonstraram que 100% dos animais dentro das explorações analisadas tinham estado em contacto com o BRSV e produziram anticorpos BRSV. Posteriormente, artigos foram publicados indicando que até 81% das manadas tinham anticorpos BRSV (Smith et al., 1975; Olchowy et al., 1994).
É de salientar que a taxa de positivos está estritamente ligada à idade dos bovinos, sendo maior a prevalência em animais mais velhos. Além disso, as regiões do sul dos EUA exibem maiores valores de prevalência que as do norte (Grubbs et al., 2001). Esta disparidade pode estar associada a medidas de maneio, diferenças nas práticas de profilaxia vacinal ou erros da amostragem. Em suma, a frequência de infeção por BRSV numa determinada região está sujeita a uma série de fatores que alteram drasticamente a prevalência da doença (Grubbs et al., 2001).
No Canadá, estudos iniciais mostraram que o vírus estava presente em 36% das manadas (Sarmiento-Silva et al., 2012). Estudos posteriores confirmaram uma maior frequência da doença entre as explorações em regime intensivo, com aptidão de carne (Sarmiento-Silva et al., 2012).
No Québec, uma região do Canadá, foi realizado um estudo em 95 vitelos de aptidão leiteira de onze explorações que eram frequentemente assistidas pelo ambulatório clínico da Faculdade de Medicina Veterinária de Montréal, onde se utilizou a técnica de PCR com amostras de zaragatoas nasais para análise das prevalências do BRSV. Neste estudo, apenas um vitelo era positivo para o BRSV. Porém, como a excreção nasal do vírus é curta (inferior a uma semana) pode ser explicada a baixa prevalência de animais positivos neste estudo (Francoz et al., 2015).
De acordo com o estudo efetuado por Figueroa-Chávez et al. ( 2012), na região de Colima, no México, que utilizaram um kit comercial ELISA desenvolvido por SVANOVABiotech®, foram testados, de novembro de 2007 a março de 2008, 369 animais de