Universidade de Trás-os-Montes e Alto Douro
Síndrome Metabólico Equino em Cavalos Lusitanos
Dissertação de Mestrado em Medicina Veterinária
Daniela Filipa Matos Tavares
Orientador: Mário Pedro Gonçalves Cotovio
Coorientador: Nuno Filipe Gomes Bernardes
III
Universidade de Trás-os-Montes e Alto Douro
Síndrome Metabólico Equino em Cavalos Lusitanos
Dissertação de Mestrado em Medicina Veterinária
Daniela Filipa Matos Tavares
Orientador: Mário Pedro Gonçalves Cotovio
Coorientador: Nuno Filipe Gomes Bernardes
Composição do Júri:
Professora Doutora Maria da Conceição Medeiros Castro Fontes
Professor Doutor Filipe da Costa Silva
Professor Doutor Mário Pedro Gonçalves Cotovio
Vila Real, 2018
V
DECLARAÇÃO DE RESPONSABILIDADE PESSOAL DAS IDEIAS APRESENTADAS
NOME: DANIELA FILIPA MATOS TAVARES
CORREIO ELECTRÓNICO: danielatavares93@gmail.com
DESIGNAÇÃO DO MESTRADO: MESTRADO INTEGRADO EM MEDICINA
VETERINÁRIA
TÍTULO DA DISSERTAÇÃO DE MESTRADO EM MEDICINA VETERINÁRIA:
SÍNDROME METABÓLICO EQUINO EM CAVALOS LUSITANOS
ORIENTADOR: DOUTOR MÁRIO PEDRO GONÇALVES COTOVIO
COORIENTADOR: DR. NUNO FILIPE GOMES BERNARDES
ANO DE CONCLUSÃO: 2018
DECLARO QUE ESTA DISSERTAÇÃO DE MESTRADO É RESULTADO DA MINHA PESQUISA E TRABALHO PESSOAL E DAS ORIENTAÇOES DO MEU SUPERVISOR. O SEU CONTEUDO É ORIGINAL E TODAS AS FONTES CONSULTADAS ESTÃO DEVIDAMENTE MENCIONADAS NO TEXTO E NA BIBLIOGRAFIA FINAL. DECLARO AINDA QUE ESTE TRABALHO NÃO FOI APRESENTADO EM NENHUMA OUTRA INSTITUIÇÃO PARA OBTENÇÃO DE QUALQUER GRAU ACADÉMICO.
VILA REAL, JUNHO DE 2018.
VII
IX
Agradecimentos
Ao Prof. Mário Cotovio, pela sua orientação, apoio, disponibilidade, pela colaboração no solucionar de dúvidas.
Ao Dr. Nuno Bernardes cujo trabalho foi muito para além da co-orientação técnica, pelas oportunidades que me ofereceu, pelo saber que me transmitiu, pelo total apoio e disponibilidade, pelo estágio e amostras deste trabalho.
Á Eng. Maria João Fradinho, pela total disponibilidade e aprendizagens, por me permitir e facilitar o acesso aos materiais para o trabalho laboratorial. Á Faculdade de Medicina Veterinária da Universidade de Lisboa que fez com que este trabalho fosse possível.
Á Dra. Elisa Bettencourt, ao Departamento de Medicina Veterinária da Universidade de Évora e à Coudelaria de Alter Real, por toda a organização e colaboração, permitindo-me o acesso aos animais deste estudo. Aos médicos veterinários da Unidade Clínica da Coudelaria de Alter Real por todo o auxílio e apoio que me prestaram no dia do trabalho experimental.
Á Helga, pela presença constante, pelo incentivo e motivação, pela amizade, pelas boleias e pela oportunidade de saber mais e ser melhor. À Raquel, por ser a prova viva de que mesmo longe é possível estar tão perto, pela amizade, carinho e preocupação.
Aos amigos Xico, João, Pilão, Portugal, Rufino, Barbosa, Laura, Beatriz, Mariana e Christophe (o original) por terem enriquecido esta jornada, pela boa disposição e animação, pela amizade e carinho, por não me deixarem desistir da “nossa” Vila.
Á Maria por todo o carinho, apoio e palavras de incentivo. Á minha cunhadinha pelos conhecimentos estatísticos e da Língua Portuguesa em momentos de aperto.
À Margarida e à Rute pela amizade de uma vida, por ser sempre tão bom o regresso a casa. Ao meu namorado que nunca desiste de mim, pela presença e amor.
Aos meus pais, um especial agradecimento, por serem modelos de coragem, pelo seu apoio incondicional, incentivo, amizade e paciência ao longo de toda esta caminhada. Sem eles nada seria possível.
Por último, não posso deixar de agradecer à Universidade de Trás-os-Montes e Alto Douro e à cidade de Vila Real por me ter proporcionado 5 anos que levarei comigo para a vida.
XI
Resumo
O Síndrome Metabólico Equino (SME) é uma condição que reflete um conjunto de alterações fisiológicas que ocorre geralmente em animais obesos e sobrealimentados. Representa um importante papel na clínica de equinos devido à sua frequente associação com o desenvolvimento de laminites.
O SME pode ser identificado clinicamente através da presença de um conjunto de características sendo as mais importantes a presença de obesidade generalizada e/ou acumulações regionais de gordura, sendo a localização mais comum o pescoço designando-se vulgarmente por “Cresty Neck”, e também pela predisposição para o desenvolvimento de laminites. Estas alterações físicas estão associadas a alguns distúrbios metabólicos como a resistência à acção da insulina, que pode ser definida como uma insensibilidade dos tecidos alvo à sua acção, e consequente hiperinsulinemia.
Actualmente acredita-se que existe uma maior predisposição para o desenvolvimento de SME em cavalos Morgan, Paso Fino, Árabe, Saddlebred, Quarter Horse, Tennessee Walking Horse e em póneis. Dada a falta de informação sobre este síndrome em cavalos da raça Lusitana este trabalho tem como objetivo a recolha de dados relativos à sua condição corporal, ao seu peso, ao Cresty Ceck e à concentração de insulina em animais desta raça de forma a avaliar a sua eventual predisposição para o desenvolvimento de SME.
Durante este trabalho foi selecionado um grupo de 20 animais, no qual se pretendeu avaliar a resistência à insulina através do “oral sugar test” (OST), um teste dinâmico no qual se avalia a concentração de insulina. Como grupo controlo foram usados 5 animais sem suspeita de SME. Dos 20 animais usados no estudo, 15 eram machos e 5 eram fêmeas, com idades compreendidas entre os 3 e 9 anos (média 4,8 anos) e com pesos que variavam entre os 447 Kg e 562 Kg (média 513,2 Kg). Não foram encontradas alterações significativas nas concentrações de insulina 90 minutos pós a administração do xarope rico em açúcar, tanto no grupo controlo como no grupo de suspeitos, encontrando-se os valores dentro do esperado para animais saudáveis.
De acordo com os resultados obtidos, não foi possível determinar a ocorrência de resistência a insulina neste grupo de animais da raça Lusitana, apesar do número relativamente elevado de animais encontrados com características fenotípicas de SME. No entanto, uma vez que a amostra utilizada foi bastante reduzida serão necessários mais estudos
no sentido de conhecer melhor a predisposição do cavalo Lusitano para este distúrbio metabólico.
Palavras-chave: Equinos; Síndrome Metabólico Equino; Laminite; Obesidade; Resistência à
XIII
Abstract
Equine Metabolic Syndrome (EMS) is a condition that reflects a set of physiological changes that usually occurs in obese and overfeeded animals. It plays an important role in the
equine clinical practice due to its frequent association with the development of laminitis. EMS can be clinically identified through the presence of a set of characteristics, the most important of which are the presence of generalized obesity and/or regional accumulations of fat, the most common location being the neck commonly known as Cresty Neck, and also predisposition to the development of laminitis. These physical changes are associated with some metabolic disorders such as the peripheral insulin resistance, wich can be definedas an insensitivity of the target tissues to their action, and consequent hyperinsulinemia.
It is currently believed that there is a greater predisposition for the development of EMS in Morgan horses, Paso Finos, Arabians, Saddlebreds, Quarter Horses, Tennessee Walking Horses and ponies. Given the lack of information about this syndrome in Lusitano horses, this work aims to collect data on body condition, weight, Cresty Neck and insulin concentration in animals of this breed in order to evaluate its possible predisposition to the development of EMS.
During this study, were selected a group of 20 animals in which it was intended to evaluate insulin resistance through oral sugar test (OST), a dynamic test in which the insulin concentration is evaluated. As a control group 5 animals were used without suspected EMS. Of the 20 animals used in the study, 15 were males and 5 were females, aged between 3 and 9 years (mean 4,8 years) and weight between 447 kg and 562 kg (mean 513,2 kg). No significant changes in insulin concentrations were found 90 minutes after the administration of sugar-rich syrup, both in the control group and in the suspect group, and the values were within the expected range for healthy animals.
According to the results obtained, it was not possible to determine the occurrence of insulin resistance in this group of the Lusitano breed animals, despite the relatively high number of animals found with phenotypic characteristics of SME. However, since the sample used was greatly reduced, further studies are needed to better understand the predisposition of the Lusitano horse to this metabolic disorder.
XV Índice INTRODUÇÃO ... 1 I. REVISÃO BIBLIOGRÁFICA ... 3 1.1. O Cavalo Lusitano ... 3 1.2. A Alimentação do Cavalo ... 3
1.3. Síndrome Metabólico Equino e seu Fenótipo ... 4
1.4. Classificação da Condição Corporal e Cresty Neck ... 9
1.5 A Laminite ... 11
1.6. Predisposição a SME ... 13
1.7. Fisiopatologia ... 14
1.8. Métodos de Diagnóstico ... 16
1.9. Estratégias de Controlo e Maneio ... 22
II. OBJECTIVOS DO TRABALHO ... 25
2.1. Material e Métodos ... 25
2.2. Resultados ... 29
2.3. Discussão ... 31
2.4. Conclusão ... 35
III. REFERÊNCIAS BIBLIOGRÁFICAS ... 36
XVII
Índice de Figuras
Figura 1: Esquema representativo da desregulação do metabolismo da insulina ... 5
Figura 2: Áreas corporais palpáveis para estimativa da condição corporal ... 9
Figura 3: Regiões de avaliação manual na escala francesa ... 10
Figura 4: Xarope de milho Karo ® Light Corn Syrup ... 17
Figura 5: Teste ITT completo ... 18
Figura 6: 2-Step Test ... 19
Figura 7: Gráfico do Combined Glucose Insulin Test (CGIT) ... 21
Figura 8: Balança. ... 26
Figura 9: Kit de reagentes do teste Mercodia: Equine Insulin ELISA. ... 27
Figura 10: Folha de identificação das amostras nos pocinhos do kit de ELISA. ... 27
Figura 11: (A) Placa após a leitura espectrofotométrica. (B) Placa após o tempo de incubação e antes da adição do substrato TMB do kit de ELISA. ... 27
XIX
Índice de Tabelas
Tabela 1: Média ±Desvio Padrão do peso, condição corporal e Cresty Neck dos animais do
grupo de controlo e do grupo de suspeitos ... 29
Tabela 2: Resultados do Teste-T para amostras independentes relativos à concentração de
insulina (μU/mL) no t0' e no t90' ... 30
Tabela 3: Distribuição dos resultados de concentração de insulina (μU/mL) nos grupos de
controlos e de suspeitos no tempo 0' (A) e no tempo 90' (B) ... 30
Tabela 4: Comparação de variáveis em estudos semelhantes sobre Síndrome Metabólico
Equino (SME) ... 34
Tabela 5: Comparação dos parâmetros peso, condição corporal, Cresty Neck e insulina entre
XXI
Abreviaturas
ADN Ácido Desoxirribonucleico
APSL Associação Portuguesa de Criadores do Cavalo Puro Sangue Lusitano ASA Amilóide Sérica A
CGIT Combined Glucose Insulin Test EEG Equine Endocrinology Group
EHC Euglicemic Hyperinsulinemic Clamp ELISA Enzyme-linked immunosorbent assay ET-1 Endotelina-1
FSIGTT Frequently sampled intravenous glucose tolerance test GLUT 4 Glucose transporter type 4
IGF 1 Insulin like growth factor 1 IL-3 Interleucina - 3
IL-6 Interleucina - 6
INRA Institut National de la Recherche Agronomique ITT Insulin tolerance test
LES Lâminas epidérmicas secundárias MAPK Mitogen activated protein kinase MEC Matriz extracelular
MMP Matrix metalloproteinases
NAD(P)H Nicotinamida adenina dinucleótido fosfato NO Nitric oxide
OGT Oral glucose test OST Oral sugar test
PI-3K Phosphatidylinositol 3 – kinase PPID Pituitary Pars Intermedia Dysfunction RI Resistência à insulina
SME Síndrome metabólico equino SMH Síndrome Metabólico Humano SOCS 3 Suppressor of cytokine signaling 3 TLR Toll like receptor
TIMP Tissue inhibitors of metalloproteinases TNF α Tumoral necrosis factor α
1
INTRODUÇÃO
O Síndrome Metabólico Equino (SME) é o resultado da combinação de uma série de alterações fisiológicas, nomeadamente, obesidade, adiposidade regional, resistência à insulina e hiperinsulinemia (Frank et al., 2010) que apresenta uma elevada importância em cavalos e póneis devido à sua associação com o desenvolvimento de laminites (Frank, 2009). O desenvolvimento desta condição é favorecido quando animais mais predispostos são expostos durante longos períodos de tempo a determinados factores ambientais. Não só uma reduzida atividade física como também uma alimentação rica em açúcares, quer seja devido ao fornecimento de uma quantidade excessiva de ração, quer devido ao acesso ilimitado ao pasto, são considerados favorecedores do desenvolvimento do SME (Carter et al., 2009; Mcgowan et al., 2013). Actualmente este síndrome tem apresentado uma enorme importância na clínica de equinos, sendo alvo de várias investigações. Esta condição pode trazer consequências graves para estes animais, em particular, o desenvolvimento de laminites que poderão mesmo incapacitar os animais afectados (Frank, 2009).
Segundo Geor & Harris (2009) e Frank (2011) a hipótese da existência de uma predisposição genética para o desenvolvimento do SME em raças como Morgan, Paso Fino, Árabe, Saddlebred, Quarter Horse, Tennessee Walking Horse e principalmente em póneis é uma realidade bastante credível.
Em grande parte dos casos, a primeira abordagem diagnóstica é do tipo presuntivo, sendo baseada nas alterações fenotípicas características do síndrome e no historial de episódios de laminite ligeira e recorrente (Johnson et al., 2010). Contudo, o diagnóstico definitivo é feito com base na avaliação da resposta do organismo à administração de glucose através da avaliação da concentração sérica de insulina (Schuver et al., 2014). Na avaliação desta resposta é de esperar que os animais afectados pelo SME mantenham os níveis séricos de insulina aumentados 90 minutos após a administração do açúcar (Banse & McFarlane, 2014).
Nos casos em que o diagnóstico de SME é definitivo, o tratamento incide fundamentalmente em alterações de maneio que visam a diminuição e controlo do peso do animal, de forma a favorecer a acção da insulina nos tecidos (Geor & Harris, 2009). Após a confirmação deste diagnóstico deve ser fornecida uma alimentação com reduzido teor de hidratos de carbono não estruturais, mantendo no entanto as quantidades necessárias de
proteína, vitaminas e minerais (Frank, 2009; Mcgowan et al., 2013). O acesso ao pasto, devido à sua riqueza em açúcares, também deve ser restringido até ser alcançada a perda de peso desejada. A introdução de exercício físico é também fundamental neste processo. Há no entanto que considerar as eventuais limitações físicas do animal, decorrentes de quadros mais ou menos severos de laminite (Secombe & Lester, 2012). Em casos mais resistentes à perda de peso através deste maneio alimentar e da promoção do exercício físico, pode ter que ser dado um suporte farmacológico (Frank et al., 2008; Durham, Rendle, & Newton, 2008; Geor & Harris, 2009).
3
I. REVISÃO BIBLIOGRÁFICA
1.1. O Cavalo Lusitano
As primeiras evidências do uso de cavalos montados na Península Ibérica datam de ainda antes do primeiro milénio AC tendo permanecido até aos dias de hoje (Fradinho, 2016).
Em Portugal a raça Puro Sangue Lusitano é dirigida desde 1967 pelo Livro genealógico onde só podem ser inscritos animais filhos de outros previamente inscritos. A seleção dos animais foi sempre feita com base na sua grande funcionalidade e mediante o padrão morfo-funcional descrito nesse mesmo livro genealógico (Oom, 1992). Estes animais apresentam uma aptidão natural para a concentração e grande habilidade para a execução de exercícios de Alta Escola, no trabalho de campo, no maneio de gado e nas touradas a cavalo, atividades nas quais desde sempre foram utilizados preservando as suas características e tendo dado origem a uma raça que ainda hoje é conhecida pela sua rapidez, coragem e agilidade (Oom, 1992; Fradinho, 2016 )
Segundo a Associação Portuguesa de Criadores do Cavalo Lusitano, APSL, o cavalo Lusitano é um animal de porte médio, que pesa em média 500 Kg, detentor de um perfil sub-convexo em todo o corpo e contornos arredondados. A sua altura, medida ao garrote, deve ser de 1.55m para fêmeas e de 1.60m para machos. Reconhecido também pela sua docilidade e coragem é atualmente considerado uma das melhores raças de cavalos de sela do mundo (APSL, 2016).
1.2. A Alimentação do Cavalo
Em termos de alimentação, 50 a 80% do alimento ingerido por cavalo durante um ano é composto por pastagem fresca e forragens, podendo em muitos casos ser a totalidade do seu alimento diário (Mira glia et al., 2006; Virkajärvi et al., 2012). As pastagens podem ser naturais ou semeadas e são constituídas essencialmente por gramíneas e leguminosas (Paço & Fradinho, 2011). Contudo, cada vez mais as dietas forrageiras são suplementadas com dietas à base de grãos aumentando o seu teor em calorias, açúcares, micronutrientes e proteínas (Hoffman, 2009).
1.3. Síndrome Metabólico Equino e seu Fenótipo
O Síndrome Metabólico Equino (SME) é uma designação relativamente recente proposta em 2002 por Johnsone que caracteriza um síndrome clínico fortemente associado com o desenvolvimento de laminite ( Frank et al., 2010; Frank, 2011), ainda que o seu fenótipo não seja totalmente conhecido (McCue et al., 2015). Este síndrome, já reconhecido em algumas raças de cavalos e póneis (Frank, 2009), é o resultado da combinação entre um desajuste no metabolismo da insulina, que envolve resistência à acção da insulina e hiperinsulinemia, a obesidade e o desenvolvimento de laminites (Johnson et al., 2010; Frank & Tadros, 2014). Os animais afectados são frequentemente designados como easy keepers, ou seja, são animais que mantêm facilmente a sua condição corporal mesmo quando lhes é fornecida menor quantidade de alimento (Johnson et al., 2010).
A laminite é uma doença que ocorre em equídeos quando a interface dermo-epidérmica das lâminas do casco é danificada e pode dificultar ou incapacitar a locomoção dos animais, podendo provocar-lhes vários graus de dor e claudicação (Laat et al., 2011; Luthersson et al., 2017). A ocorrência recente ou história pregressa com relatos de laminites recorrentes é, não só a principal como a mais grave consequência do SME, sendo também um importante sinal que deve servir como alerta para a possível presença do síndrome (Frank et
al., 2010; Johnson et al., 2010). No inicio do desenvolvimento do SME os episódios de
laminite são frequentemente ligeiros ou moderados, podendo ser recorrentes, e ocorrem principalmente durante a Primavera e o Verão. No entanto podem tornar-se um problema permanente.
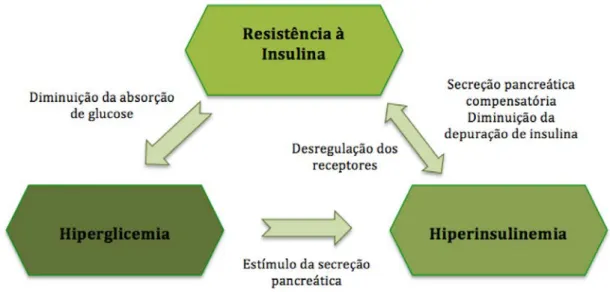
A resistência à insulina pode ser definida como a reduzida capacidade de uma certa concentração de insulina, quer esta seja normal ou aumentada, conseguir diminuir a concentração de glucose no sangue devido à diminuída responsividade dos tecidos (Frank, 2006). Esta hormona é responsável não só pela estimulação da captação de glucose sanguínea
5
2009) e está fortemente relacionada com o desenvolvimento de laminites em cavalos e póneis (Asplin et al., 2007; De Laat et al., 2010).
Figura 1: Esquema representativo da desregulação do metabolismo da insulina (Adaptado de Frank & Tadros, 2014)
No entanto, em animais com SME, o organismo consegue estabelecer um equilíbrio na captação de glucose pelas células do músculo e tecido adiposo e clinicamente os animais apresentam hiperinsulinemia e apesar disso euglicemia (Johnson et al., 2004; Treiber et al., 2006).
A obesidade nos cavalos é um problema que parece ter vindo a aumentar nos últimos anos (Wyse et al., 2008). Esta é uma questão que pode em parte estar associada à errada percepção de condição corporal por parte dos proprietários. Num estudo realizado na Austrália, Potter et al., 2016, demonstraram que num total de 229 animais, 23.1% eram obesos e que 40% dos proprietários subestimaram a condição corporal do seu cavalo. A mesma situação ocorreu no Reino Unido, onde foi realizado um inquérito com o objectivo de avaliar a percepção de obesidade pelos proprietários e tratadores de cavalos. No inquérito foram mostradas aos participantes imagens de 12 cavalos, dos quais 6 tinham excesso de peso, e foi-lhes pedido que identificassem todos os animais obesos. Dos 539 inquiridos, apenas 11% identificaram corretamente os 6 animais obesos. Considerando individualmente cada imagem, 3 delas foram identificadas corretamente entre 65% e 98% e as restantes 3 obtiveram entre 37% e 41% de identificações corretas (Morrison et al., 2017).
O aumento da prevalência da obesidade dentro da população equina tem vindo a suscitar uma preocupação acrescida com as consequências associadas à acumulação excessiva de lípidos (Owers & Chubbock, 2013). Um animal pode ser considerado obeso quando a sua classificação da condição corporal é maior ou igual a 7 em 9 na escala desenvolvida por Henneke, que será descrita no subcapítulo seguinte. A partir desta pontuação começam a ser bastante evidentes depósitos de gordura ao longo do garrote, pescoço e atrás da espádua, (Henneke et al., 1983; Geor, 2008), sendo que, 20 a 30% da sua massa corporal total é constituída por tecido adiposo (Dugdale et al., 2012). A obesidade generalizada ou na forma de acumulações regionais de gordura são apontadas como uma das principais características dos animais com SME (Frank et al., 2010).Existem várias regiões anatómicas a ter em conta quando se avalia a adiposidade regional nestes animais, nomeadamente na base da cauda, no prepúcio dos machos, perto da glândula mamária nas fêmeas e na zona da espádua (Johnson
et al., 2010), sendo que a localização mais característica ocorre ao nível do pescoço, sendo
vulgarmente designado de “Cresty Neck” ou, na gíria, de “gato” (Agne, 2010).
Para além da obesidade, da resistência à insulina e da hiperinsulinemia, tem sido estudada a possibilidade de, tal como sucede no Síndrome Metabólico em humanos (SMH), considerar outros parâmetros tais como a hipertensão arterial, a dislipidemia, o aumento das citocinas pró-inflamatórias e a ativação de proteínas de fase aguda, e a diminuição da concentração de adiponectina como elementos integrantes do fenótipo de SME(Eckel et al., 2005; Bailey et al., 2008; Maury & Brichard, 2010; Wooldridge et al., 2012; Suagee et al., 2013).
Uma das características que compõem o SMH é a presença de dislipidemia e hipertensão arterial nos indivíduos afetados (Eckel et al., 2005). De acordo com a literatura existente (Treiber et al., 2006; Bailey et al., 2008; Ertelt et al., 2014) parece haver uma grande semelhança entre o SMH e o SME. Num estudo de Treiber et al. (2006), realizado
7
ocorrer devido a vários factores ou da conjugação destes. A resistência à insulina provoca um aumento do fluxo de ácidos gordos livres para o fígado, estimulando a síntese de triglicerídeos neste órgão, o que irá aumentar a quantidade de triglicéridos na circulação sanguínea. Por outro lado, a insulina também tem efeito lipogénico, aumentando a transcrição e a atividade enzimática de muitos genes relacionados com a síntese de triglicéridos (Eckel et
al., 2005). Posto isto, de acordo com o estudo já referido de Bailey et al. (2008), o facto dos
poneis predispostos à laminite não serem obesos e terem as mesmas condições corporais que os de controlo, levou à conclusão de que o aumento dos trigliceridos está associado à resistencia à insulina, assim como se observa em humanos. Tais descobertas, favorecem a comparação do mesmo síndrome em humanos e animais.
A produção de citocinas associadas com os mecanismos de resposta inflamatória, como são o Fator de Necrose Tumoralα (TNFα), a Interleucina-3 (IL-3) e a Interleucina-6 (IL-6), ocorre em macrófagos residentes no tecido adiposo. Com a obesidade surge uma desregulação no metabolismo do tecido adiposo que poderá provocar um aumento da produção destas citocinas através da ativação destes macrófagos, promovendo não só um estado inflamatório crónico, como de resistência à insulina (Rasouli & Kern, 2008). Contrariamente, Suagee et al., 2013 mostraram que a obesidade não provocou o aumento da concentração de TNFα e IL-6 nos cavalos avaliados. Foi no entanto possível verificar a existência de uma correlação positiva entre estas citocinas e a população do sexo feminino, que apresentaram maiores concentrações séricas do que os machos nas mesmas circunstâncias, podendo ser colocada a hipótese de haver uma implicação relacionada com o sexo no desenvolvimento destas alterações. A IL-6 apresentou-se também aumentada em animais mais velhos, sendo que, nesta faixa etária se revelou ainda mais alterada nos animais obesos. A Amilóide Sérica A (ASA) é uma proteína de fase aguda e um importante marcador inflamatório em cavalos, cuja produção ocorre após estímulos inflamatórios (Zhao et al., 2010). No mesmo estudo de Suagee et al., 2013 foi possível constatar uma associação positiva entre o aumento da condição corporal e o aumento da concentração de insulina com a concentração de ASA. A condição corporal aumentada e o aumento da concentração de insulina mostraram ter uma grande influência na concentração de ASA aumentando-a, o que faz desta proteína um melhor marcador de inflamação associada à obesidade e de risco de laminite do que as outras citocinas inflamatórias.
O tecido adiposo branco é o principal local de armazenamento energético de mamíferos e aves, mas também lhe é atualmente atribuída uma importante função endócrina,
nomeadamente a secreção de proteínas como a adiponectina (Trayhurn & Wood, 2004; Radin
et al., 2009). A importância da adiponectina recai no facto de a avaliação da sua concentração
poder ser utilizada como um marcador de obesidade, uma vez que, contrariamente ao que poderia ser esperado a adiponectina não aumenta com o aumento da gordura. Estes parâmetros são inversamente proporcionais, sendo as concentrações de adiponectina menores em animais obesos (Kearns et al., 2006). Outras funções importantes desta proteína são a sua ação como sensibilizador da insulina e também as suas propriedades anti-inflamatórias (Deng & Scherer, 2010). Assim sendo uma diminuição da sua produção pode contribuir positivamente para o desenvolvimento de um estado pró-inflamatório e insulino resistente (Maury & Brichard, 2010).
A ação da insulina não pode ser resumida apenas à promoção da captação de glucose pelas células do tecido muscular e adiposo (Huntington et al., 2010). Esta hormona possui também um importante papel nas vias de síntese da phosphatidylinositol 3-kinase (PI-3K) e da mitogen-activated protein kinase (MAPK) que contribuem para a regulação da tonicidade vascular. Estudos realizados em humanos demonstram que a resposta da vasculatura periférica à insulina é determinada pelo equilíbrio destas duas vias insulino-dependentes, a via PI3K que regula a produção e ativação de óxido nítrico (NO), um importante vasodilatador e anti-inflamatório, e a via MAPK que controla a secreção de Endotelina-1 (ET-1), um potente vasoconstrictor. Num cenário de resistência à acção da insulina, irá ocorrer ao nível endotelial, uma redução da biodisponibilidade de NO devido ao bloqueio das vias de activação da PI3K, enquanto que a via MAPK irá permanecer funcional ou até aumentada mantendo a secreção de ET-1 (Muniyappa & Sowers, 2013). Este desequilíbrio entre o NO e a ET-1 vai favorecer a vasoconstrição e inflamação periféricas podendo ser apontado como o elemento promotor do desenvolvimento de laminite (Eades et al., 2007; Geor & Frank, 2009). O desequilíbrio provocado por estas alterações vai favorecer a vasoconstrição e promover a
9
póneis do grupo de controlo, quando avaliados durante o verão.
1.4. Classificação da Condição Corporal e Cresty Neck
A classificação da condição corporal através da aplicação dos sistemas desenvolvidos para a sua avaliação são atualmente um método bastante eficaz na monitorização da gordura corporal dos animais (Dugdale et al., 2012).
Esta classificação é uma importante ferramenta para se conseguir determinar o estado nutricional dos animais e proceder a alterações no maneio alimentar se necessário (Caldeira, 2005). Diversas metodologias podem ser utilizadas de forma a determinar a condição corporal de um animal, no entanto, a aplicação de escalas de classificação de condição corporal nas quais se faz a avaliação dos depósitos de gordura palpável, popularizou-se devido à sua praticidade em condições de ambulatório (Fradinho, 2016).
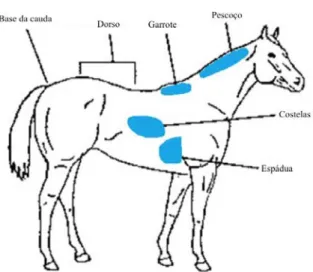
Embora existam referências a outros sistemas de classificação, os mais utilizados são o proposto por Henneke et al. (1983) e o proposto pelo Institut National de la Recherche
Agronomique (INRA) (INRA, 1997).
No primeiro caso a classificação é feita com base numa avaliação visual do animal e avaliação da gordura palpável em 6 áreas corporais, nomeadamente, pescoço, garrote, espádua, zona das costelas, região lombar e base da cauda (Figura 2). Nesta escala podem ser atribuídas classificações de 1 a 9, correspondendo o 1 a animais emaciados e o 9 a animais obesos (Anexo I).
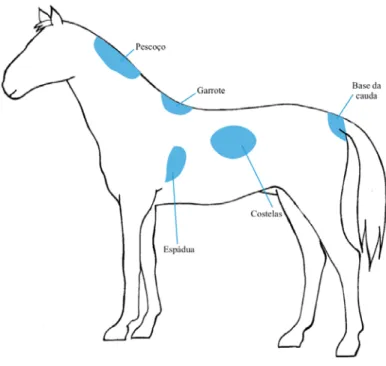
Semelhantemente à escala de Henneke, a escala desenvolvida pelo INRA baseia-se na avaliação por palpação de zonas corporais específicas, neste caso 5, o pescoço, o garrote, a espádua, a zona entre a 10ª e a 14ª costelas e na base da cauda (Figura 3). O que este modelo tem de diferente é a necessidade de também ser feita a avaliação visual da linha do dorso e da garupa. Aqui são utilizadas classificações de 0 (animal emaciado) a 5 (animal obeso), sendo que podem ser atribuídos meios pontos e quartos de ponto, no caso de avaliadores mais experientes, de maneira a ilustrar de forma mais precisa a condição corporal do animal caso a descrição de um determinado ponto não corresponda inteiramente à percepção que se obtém através da palpação (Anexo II).
Figura 3: Regiões de avaliação manual na escala francesa (adaptado de INRA-HN-IE, 1997).
11
1.5 A Laminite
A laminite é uma grave consequênciaassociada ao SME. No entanto, os mecanismos pelos quais ocorrem as alterações que favorecem o seu desenvolvimento ainda não estão totalmente esclarecidos (Ertelt et al., 2014).
Uma das hipóteses propostas é a de que a laminite se desenvolve devido a um estado inflamatório ligeiro e crónico juntamente com um aumento do stress oxidativo. A NAD(P)H oxidase é um complexo enzimático das membranas celulares que produz o radical livre superóxido. O aumento da atividade deste complexo, juntamente com a diminuição da atividade de algumas das enzimas do sistema de defesa antioxidante, como a superóxido dismutase e a glutationa peroxidase, resulta num aumento da produção de radicais livres de oxigénio e, consequentemente, o aumento do stress oxidativo. Estas alterações conduzem a uma disfunção endotelial nos vasos sanguíneos do casco e consequente hipoperfusão (Roberts & Sindhu, 2009). O aumento da atividade do Toll Like Receptor 4, responsável por promover a inflamação através da produção e secreção de citocinas pró-inflamatórias e a activação das vias inflamatórias, também tem sido apontado como outro dos fatores desencadeadores de laminite. Esta alteração contribui para o estado inflamatório crónico, encontrando-se associada à diminuição da resposta à insulina pela via supressora da sinalização de citocinas 3 (SOCS3), proteínas reguladoras do sistema imunitário. As alterações induzidas nestas vias vão contribuir indiretamente para a resistência à insulina e para a ocorrência de danos no endotélio vascular (Shi et al., 2006; Mancia et al., 2007; Taleb et al., 2009). O aumento da expressão do TNFαencontrado no casco num estudo realizado em póneis vem corroborar a hipótese da presença de um estado inflamatório crónico como tendo um importante papel na fisiopatologia da laminite (Carter et al., 2009). No entanto, é necessário salientar que num outro estudo, já anteriormente referido, o TNFαmostrou ter alguma propensão para afetar um dos sexos tendo preferencialmente sido encontrado um aumento da sua expressão em fêmeas (Suagee et al., 2013).
Uma outra causa possível para o desenvolvimento de laminite pode estar relacionada com um aumento da produção de factores de coagulação pelo fígado. Este aumento poderá levar a isquemia devido a um estado de hipercoagulação (Krauss & Siri, 2004).
Uma terceira hipótese assenta na resistência à insulina e mais concretamente na hiperinsulinemia como um dos principais factores responsáveis pelo aumento da probabilidade de desenvolver laminite em cavalos e póneis (Geor & Frank, 2009). Esta hipótesetem vindo a ser comprovada por vários estudos, nomeadamente Asplin et al., 2007 e
Laat et al., 2010, que conseguiram induzir o desenvolvimento de laminite em animais clinicamente saudáveis através da exposição a uma hiperinsulinemia prolongada. A indução continua de hiperglicemia seguida de hiperinsulinemia endógena pode também ter o mesmo efeito (De Laat et al., 2012).
Histopatologicamente ocorrem inúmeras alterações antes do aparecimento dos sinais clínicos de laminite. Nos estados iniciais do desenvolvimento da laminite as lâminas epidérmicas secundárias (LES) tornam-se mais alongadas e estreitas o que pode dever-se ao aumento da proliferação das células epidérmicas e a desorganização celular que ocorre após o inicio da hiperinsulinemia. Estas alterações comprometem a suspensão da falange distal dentro do casco o que pode explicar as alterações de posicionamento que ocorrem em estados mais avançados da doença. Ainda no inicio da progressão da laminite verifica-se nas células laminares o aumento da morte celular e desorientação nuclear. O aumento da proliferação das células laminares é outra das evidências e que pode estar associada a fatores mitogénicos como a insulina e citocinas. O alongamento causado nas LES pelo aumento da densidade celular pode estar relacionado com a disfunção laminar e o aparecimento da claudicação. Foi também observado um enfraquecimento das células da membrana basal ainda que sem presença de alterações severas, o que pode ser indicativo de que a sua separação é uma lesão secundária (de Laat et al., 2013).
Dado que estão presentes na vasculatura periférica receptores de insulina, uma das hipóteses proposta como mecanismo desencadeador de laminite é que esta hormona participe na regulação da resposta da vasculatura periférica podendo causar disfunções endoteliais que deixam as lâminas mais sensíveis à ocorrência de lesões (Geor & Frank, 2009).
As lâminas do casco estão situadas numa camada dermo-epidérmica entre a taipa e a falange distal. A junção entre a derme e a epiderme ocorre através de uma membrana basal composta por uma matriz extracelular (MEC) (Jansová et al., 2015). Ao longo do tempo a
13
resultados obtidos para as MMP-2, a concentração e expressão génica das MMP-9 mostrou-se aumentada no tecido laminar afectado, ainda que na forma inativa, podendo esta sim atuar na patogénese da laminite.
Sabe-se que a MMP-9 deriva principalmente dos leucócitos (Goetzl et al., 1996), e poderia ser estabelecida uma relação entre eles visto que a infiltração de leucócitos no tecido laminar aumenta. No entanto, no modelo de laminite induzida pela insulina, este aumento ocorre de forma muito moderada sendo encontrado apenas um pequeno número de leucócitos, o que juntamente com a não evidência de grandes lesões na membrana basal leva a crer que o contributo da MMP-9 na fisiopatologia da laminite induzida pela insulina é mínimo (de Laat
et al., 2013).
Por outro lado, existe um polipéptido denominado insulin-like growth factor 1 (IGF1) que tem mostrado ter também um papel na patogénese da laminite. O IGF1 atua na ativação da proliferação celular e no crescimento e reparação dos tecidos (De Laat et al., 2013). Em estudos realizados mantendo uma euglicemia e hiperinsulinemia prolongadas, durante o período de desenvolvimento e na fase aguda da laminite induzida pela insulina foram encontradas concentrações baixas do IGF 1 assim como do seu receptor, o que indica algum grau de sensibilidade à concentração de insulina. A diminuição da expressão génica para o receptor do IGF1 provocada pela hiperinsulinemia pode levar à proliferação inadequada das células da epiderme laminar e ao enfraquecimento laminar.
Podemos concluir que a patogénese do SME e o consequente desenvolvimento da laminite não devem ser vistos como consequência de apenas um factor mas sim como o resultado de um conjunto de alterações quer pro-inflamatórias, de resistência à insulina, de hipercoagulação, de hipertensão ou de lesão endotelial, que se encontram interligadas. Dada a falta de certezas acerca de todos os processos implicados, e do peso de cada um na fisiopatologia do SME, devem ser realizados mais estudos de forma a esclarecer as dúvidas que ainda existem e poderem ser desenvolvidos protocolos de atuação precoce no sentido de prevenir o desenvolvimento de laminite em animais diagnosticados com SME.
1.6. Predisposição a SME
Actualmente pensa-se que o desenvolvimento de SME é resultado de uma predisposição genética em conjunto com a ação de várias influências ambientais (McCue et
Num grupo de póneis laminíticos percebeu-se que existiam diferenças nas concentrações séricas de glucose, após a administração de insulina, quando comparados com um grupo de animais saudáveis. Estas diferenças levaram a que se descobrisse que estes animais possuíam um certo grau de insensibilidade à insulina. Esta característica pode, num processo de seleção natural, ter atuado como uma vantagem metabólica para estes animais quando tinham de sobreviver em condições de clima severo e menor disponibilidade alimentar (Field & Jeffcott, 1989). Para os animais que tinham de sobreviver neste tipo de ambientes era vantajosa a existência no seu ADN de genes “económicos”, ou seja, que lhes permitissem manter a sua condição corporal mesmo estando sujeitos a pouca quantidade e qualidade alimentar (Treiber et al., 2006). No entanto, quando existem melhores condições alimentares, estes animais têm tendência para a obesidade. Esta torna-se difícil de combater mesmo quando a quantidade de alimento fornecida é diminuída consideravelmente, sendo estes animais vulgarmente designados pelos seus proprietários como “easy keepers” (Frank et
al., 2010).
Com a melhoria das condições alimentares e o aumento do fornecimento de alimentos ricos em grãos, muitas vezes em quantidades desadequadas, o que outrora era uma vantagem face às adversidades alimentares, é atualmente uma predisposição para o desenvolvimento de certas condições como o SME (Treiber et al., 2006; McCue et al., 2015).
Perante este conhecimento é no entanto importante perceber que um animal com estas caraterísticas genéticas não irá necessariamente desenvolver SME, assim como um animal com uma menor predisposição genética não se encontra completamente livre de perigo de desenvolver esta condição. Assim sendo, o seu desenvolvimento, ou não, é determinado pela interação entre a componente genética de cada animal com as componentes ambientais às quais o animal é sujeito durante a sua vida (McCue et al., 2015).
15
do tecido adiposo e de outros marcadores inflamatórios sistémicos induzidos pela inflamação do tecido adiposo (Rasouli & Kern, 2008; Alemany, 2013).
A acumulação de gordura intracelular que ocorre em tecidos sensíveis à insulina, tais como o músculo esquelético, fígado e pâncreas, bem como a inibição da acção da insulina pelas citocinas pró-inflamatórias, vão contribuir para a instalação de uma das principais características do SME: a resistência à insulina (Summers, 2006; Kashyap & Defronzo, 2007). O aumento do stress oxidativo vai também contribuir para o estabelecimento do estado insulino resistente. Por um lado, este stress é causado pelos radicais do óxido nítrico que são responsáveis por causar alterações nos receptores de insulina influenciando o correto desempenho das suas funções. Por outro lado, o aumento do stress oxidativo pode também diminuir consideravelmente a expressão na superfície celular de transportadores de glucose dependentes de insulina, nomeadamente o GLUT 4, em tecidos como o músculo e o tecido adiposo (De La Monte & Wands, 2006; Waller et al., 2011).
Em humanos sabe-se que a diminuição da sensibilidade à acção da insulina pelo músculo e tecido adiposo provoca o aumento da chegada de ácidos gordos livres ao fígado provocando o aumento da produção de triglicéridos pelos hepatócitos (Alexander et al., 2003). No entanto, este aumento de produção e a acumulação dos triglicéridos no fígado irão resultar numa degenerescência gorda hepática e aumento da produção de proteína C reativa, fibrinogénio, fatores de coagulação e angiotensinogénio, que por sua vez poderão induzir o desenvolvimento de problemas de coagulação, tromboses, oclusão vascular e perpetuar a inflamação (Krauss & Siri, 2004).
No SMH o aumento dos ácidos gordos livres foi também relacionado com o sobrecrescimento bacteriano e o aumento da permeabilidade intestinal. A grande problemática associada a este tipo de alterações é o consequente extravasamento de endotoxinas e bactérias. Estes, quando atingem o fígado, juntamente com os ácidos gordos livres ativam os Toll Like
Receptors do sistema imunitário responsáveis por promover a inflamação, como referido
anteriormente (Shi et al., 2006; Tsukumo et al., 2007; Saberi et al., 2009; Li et al., 2013). A deficiência em magnésio é também uma característica que requer mais investigação no sentido de determinar se estará ou não associada ao SME. Sabe-se quem em humanos esta deficiência contribui para o desenvolvimento de hipertensão, intolerância à glucose e hiperlipidemia (Djurhuus et al., 1995; Chaudhary et al., 2010), características que já foram associadas ao SME.Além disso, sabe-se também que uma deficiência em magnésio contribui para um desequilíbrio entre o rácio cálcio/magnésio intracelular contribuindo para um
aumento da tonicidade vascular e hipoperfusão do casco. Este processo pode também favorecer o desenvolvimento de laminite nos cavalos (Djurhuus et al., 1995; Chaudhary et al., 2010).
1.8. Métodos de Diagnóstico
O diagnóstico de SME é na maioria dos casos presuntivo e baseia-se no historial clínico de episódios de claudicação recorrente e na avaliação da condição corporal do animal que deverá, por norma, revelar um animal obeso e com depósitos regionais de gordura, nomeadamente o vulgarmente designado “gato” ou “Cresty Neck”. Estes últimos são manifestações fenotípicas características do síndrome (Agne, 2010).
No entanto, o diagnóstico definitivo pode e deve ser feito de forma a comprovar a resistência à insulina e hiperinsulinemia (Frank et al., 2016).
A medição apenas da concentração basal de insulina após um período de jejum é um método que apresenta uma baixa sensibilidade, apresentando um risco acrescido de ocorrência de falsos negativos, uma vez que a hiperinsulinemia só persiste enquanto esta compensação por parte do organismo for adequada. Assim que o deixa de ser a concentração de insulina diminui (Kronfeld et al., 2005). Contudo esta análise pode ser realizada. Se for detetada hiperinsulinemia em jejum obtemos a confirmação da existência de resistência à insulina. Ainda assim, se o resultado for negativo deve ser complementada com a realização de um teste dinâmico para a sua validação (Schuver et al., 2014).
Em condições de ambulatório o teste ideal deverá ser fácil e rápido de realizar (Schuver et al., 2014).
Actualmente o Oral Sugar Test (OST) é teste o recomendado para utilizar em condições de ambulatório. Dentro deste teste existem duas variantes, o in feed Oral Glucose
17
referentes a cada teste. E por último, após a administração da forma de açúcar correspondente a cada teste, são recolhidas novas amostras de sangue. No caso do OGT a amostra deve ser recolhida aos 120 min (t120), enquanto que no OST deve recolher-se o sangue entre os 60-90
min t60-t90.
Figura 4: Xarope de milho Karo ® Light Corn Syrup
No OGT um animal é considerado resistente à insulina quando a concentração de insulina é >85μUI/mL aos 120 min (t120) pós administração da glucose (Frank & Geor,
2014). No OST o estado de resistência à insulina é confirmado quando a concentração de insulina é >60μUI/mL entre os 60-90 min, tempo em que deve ser recolhida a amostra referente ao t60-t90 (Tadros & Frank, 2013; Frank & Geor, 2014; Banse & McFarlane, 2014).
As características do material a utilizar para a recolha e conservação das amostras de sangue devem respeitar as normas do kit de análises que irá ser utilizado.
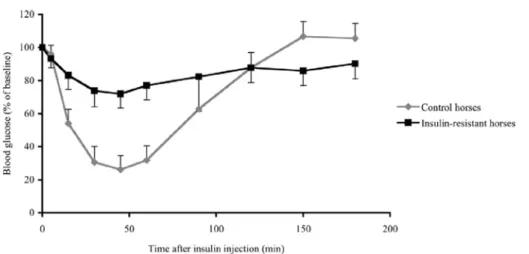
Caltabilota et al., 2010 desenvolveram um Insulin Tolerance Test (ITT) no qual se observa o comportamento da glucose após uma administração de insulina recombinante humana. Um cateter deve ser colocado na veia jugular, de forma a facilitar todo o procedimento. É recolhida uma amostra de sangue antes da administração da insulina (t0) que
irá ser utilizada para a determinação da concentração basal de glucose. De seguida, são administradas rapidamente 0,1 UI/Kg de peso vivo de insulina recombinante humana. São então retomadas as recolhas das amostras sanguíneas aos 5, 15, 30, 45, 60, 90, 120, 150 e 180 minutos após a administração da insulina. Os valores da concentração de glucose obtidos serão utilizados para determinar a sensibilidade do animal à insulina. Se após a administração da insulina a concentração de glucose chegar a um valor igual ou inferior a 50 % da
concentração basal considera-se que o animal é sensível. Pelo contrário, se este valor nunca for atingido o animal é considerado resistente à insulina (Figura 5).
Figura 5: Teste ITT completo.Concentração de glucose (% da concentração basal), medida aos 5, 15, 30, 45, 60, 90, 120, 150 e 180 minutos após a administração de insulina, em cavalos saudáveis (controlo ) e cavalos resistentes à insulina () (Adaptado de: Bertin & Sojka-Kritchevsky, 2013).
Devido à extensão e tamanho de amostragem necessárias Bertin & Sojka-Kritchevsky (2013) desenvolveram um 2-step test baseado no teste completo de resposta à insulina. Todo o procedimento é semelhante, excepto a quantidade de amostras sanguíneas para determinação da concentração de glucose que neste caso são apenas recolhidas aos 0 minutos (t0) e 30 minutos (t30), após a administração da insulina. A amostra t0, assim como no teste
completo, é utilizada para determinar a concentração basal de glucose. Dentro dos 30 minutos de realização do teste o limiar menos de 50% da concentração basal de glucose deve ser atingido de maneira a que animal possa ser considerado sensível à insulina, caso contrário deve ser classificado como resistente à insulina. Num animal considerado insulino-resistente,
19
possível hipoglicemia, uma vez que neste 2-step test a monitorização da concentração de glucose não é tão longa como no teste completo.
Figura 6: 2-Step Test. Tempo que, por norma, é necessário para que a concentração de glucose atinja 50% da concentração basal após a administração da insulina em cavalos resistentes à insulina () e em cavalos saudáveis (controlo ) (Adaptado de: Bertin & Sojka-Kritchevsky, 2013).
Outros métodos como o Euglicemic Hyperinsulinemic Clamp (EHC), o Frequently
Sampled Intravenous Glucose Tolerance Test (FSIGTT) e o Combined Glucose Insulin Test
(CGIT) também podem ser utilizados para determinar a resposta da insulina, possuindo medidas mais diretas da sua sensibilidade (Kronfeld et al., 2005; Dunbar et al., 2016).
No EHC o objectivo é induzir e manter um estado de hiperinsulinemia, mantendo em simultâneo a euglicemia, de forma a determinar a sensibilidade dos tecidos à insulina (Rijnen & Kolk, 2003; Pratt et al., 2005). Este método, considerado o “Gold Standard” para a determinação da sensibilidade à insulina, dado que em condições controladas mede diretamente o efeito da insulina na glucose, baseia-se no princípio de que a quantidade de glucose necessária para manter a euglicemia é igual à absorvida pelos tecidos e que, por sua vez, esta é menor em indivíduos com resistência à insulina do que em indivíduos com sensibilidade normal (DeFronzo et al., 1979; Rijnen & Kolk, 2003; Pratt-Phillip et al., 2015). Nesta técnica são recolhidas amostras de sangue no t0 do teste para determinar os valores
basais de glucose e insulina. De seguida o cavalo é ligado a uma bomba infusora que irá administrar insulina recombinante humana, inicialmente a uma dosagem de 323μmol/Kg de peso vivo, dissolvida em 50 mL de solução salina e durante 10 minutos. Após esta primeira administração é iniciada uma infusão contínua de insulina a uma taxa de 43μmol/Kg/min. É
também administrado um bolus de glucose em simultâneo com a insulina para evitar uma situação de hipoglicemia. As amostras de sangue para determinação da glicemia são obtidas a cada 5 minutos. De acordo com a concentração de glucose em cada momento, são administradas diferentes quantidades de uma solução de dextrose a 50%, de forma a manter a euglicemia que é definida pelo valor de 5mmol/L. Para determinação da concentração de insulina são recolhidas amostras a cada 15 minutos. Os resultados dos primeiros 90 minutos do teste devem ser descartados pois são considerados um período de adaptação, enquanto que, os últimos 60 minutos do teste são considerados o período de estabilização do qual são retirados os dados necessários para os cálculos de absorção de glucose e índice de sensibilidade à insulina. Esta técnica tem geralmente uma duração total de 180 minutos (Pratt
et al., 2005).
O FSIGTT é uma técnica que foi pela primeira vez utilizada em cavalos por Hoffman
et al. (2003). Esta técnica quantifica a sensibilidade à insulina através de uma fórmula
matemática avaliando a utilização de glucose, dependente e independente de insulina, e simultaneamente estima a sensibilidade das células β-pancreáticas à glucose (Ward et al., 1991; Pratt et al., 2005). No procedimento utilizado por Hoffman et al. (2003) é feita uma recolha de sangue em t0 minutos seguida da administração intravenosa de um bolus de
0.3g/Kg de peso vivo de dextrose a 50%. Posteriormente é feita a recolha de várias amostras nos tempos 1, 2, 3, 4, 5, 6, 7, 8, 10, 12, 14, 16 e 19 minutos. Ao t20 minutos após a
administração da dextrose é administrada também por via intravenosa uma dose de 30 mUI/Kg de peso vivo de insulina após a qual são retomadas as recolhas de sangue, que ocorrem aos 22, 23, 24, 25, 27, 30, 35, 40, 50, 60, 70, 80, 90, 100, 120 e 180 minutos (Caumo
et al., 2000; Hoffman et al., 2003). As amostras permitirão determinar as concentrações de glucose e insulina.
21
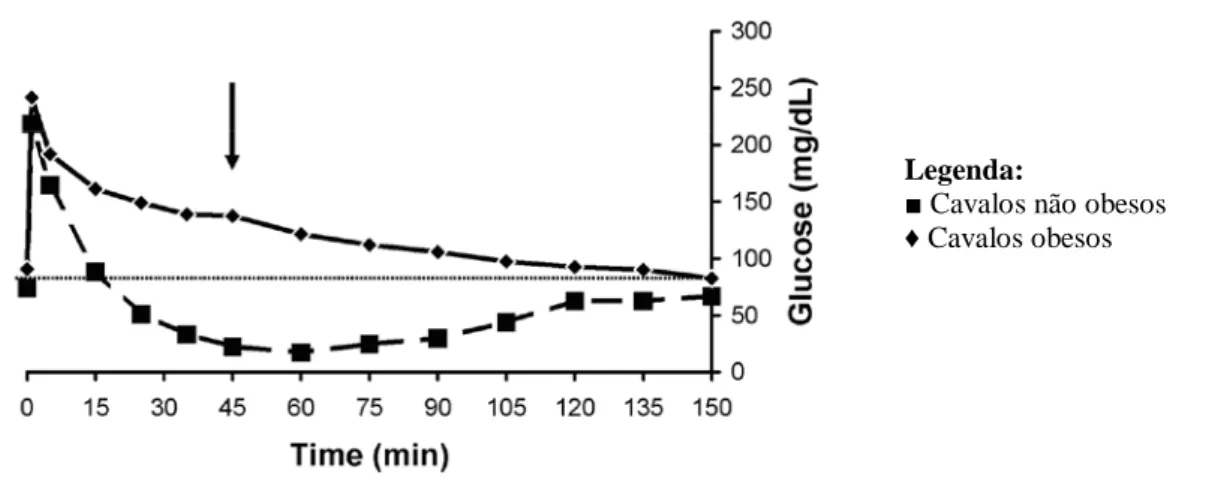
glucose, que é seguida por uma fase negativa que cai abaixo da linha basal e que corresponde à hipoglicemia. Em animais saudáveis a curva deve chegar à linha basal em cerca de 30 minutos após a administração de glucose e insulina, enquanto que em cavalos com resistência à insulina a fase positiva será mais prolongada podendo demorar 45 minutos ou mais a chegar à base (Frank et al., 2006).
Figura 7: Gráfico do Combined Glucose Insulin Test (CGIT). A concentração de glucose dos cavalos não obesos regressou à linha basal 15 minutos após a administração do bolus de glucose, enquanto que, no caso dos cavalos obesos a concentração de glucose permaneceu acima da linha base durante o tempo do teste (Adaptado de: Frank et al., 2006).
Por outro lado, existe também a possibilidade de utilizar métodos indiretos que pela sua relação com a obesidade, resistência à insulina e aumento da probabilidade de desenvolvimento de laminite, nos podem dar alguma indicação da presença de SME. Neste caso podemos recorrer à medição da concentração plasmática de adiponectina de elevado peso molecular e à avaliação da concentração plasmática de triglicéridos (Frank et al., 2016).
A adiponectina, como já foi referido anteriormente é uma proteína do tecido adiposo que atua como sensibilizadora da insulina e que tem propriedades anti-inflamatórias. Dado que a sua concentração diminui com a obesidade, quando esta é medida e são encontrados valores menores que 3.2 ug/mL estes são indicativos de um desajuste no metabolismo do tecido adiposo, e que por sua vez existe um risco aumentado do desenvolvimento de laminites (Menzies-Gow et al., 2016).
A hipertrigliceridémia é uma característica associada à obesidade assim como à alteração do metabolismo da insulina. Como foi referido anteriormente, o aumento da concentração plasmática de triglicéridos já mostrou estar associado com o aumento do risco
Legenda:
■ Cavalos não obesos ♦ Cavalos obesos
de desenvolvimento de laminite em póneis. Assim, a medição da concentração plasmática de triglicéridos pode ser usada como factor de previsão do risco do animal desenvolver laminite (Treiber et al., 2006; Carter et al., 2009).
Como podemos concluir, existe atualmente uma grande variedade de testes que podem ser usados de forma a comprovar o diagnóstico de SME. A escolha do melhor método deve ser feita consoante o orçamento disponível e as condições existentes para a sua realização. Embora o EHC seja considerado o “Gold Standard” no diagnóstico de resistência à insulina (RI), neste, no FSIGTT e no CGITT os animais necessitam de hospitalização, estão associados a um maior custo económico e demoram várias horas a concluir. Em condições de ambulatório o que se pretende é utilizar testes que sejam adaptáveis às condições de campo e que sejam rápidos de concluir, como é o caso dos OST, OGT ou 2-step ITT. As determinações indiretas poderão ser interessantes como complemento, de forma a perceber qual o risco de um animal vir a desenvolver laminite. Estas estão geralmente associadas a um custo mais elevado.
1.9. Estratégias de Controlo e Maneio
Uma vez diagnosticado o SME o tratamento fundamental passa por estabelecer uma dieta apropriada e um plano de exercício físico de forma a reduzir o volume de tecido adiposo do animal. A perda de massa gorda terá como objectivo aumentar a sensibilidade dos tecidos à insulina, diminuindo a RI e a hiperinsulinemia. O ideal será que o animal atinja uma condição corporal óptima, o que irá corresponder a uma classificação de 3 em 5 na escala francesa (INRA-HN-IE, 1997; Geor & Harris, 2009) do INRA.
Em primeiro lugar devem ser retirados da alimentação do animal obeso, ainda que gradualmente, todos os grãos e alimentos compostos. Devido ao seu alto teor em hidratos de carbono não estruturais apenas irão contribuir para um agravamento do problema (Geor &
23
nutrientes pois é importante que nunca seja provocado um défice de proteína. Para um animal de 500Kg devem ser ingeridas diariamente 630g de proteína, juntamente com vitaminas e minerais. Se necessário pode e deve ser dado juntamente com o feno um suplemento a fim de suprir estas necessidades nutricionais (Longland et al., 2011; Frank et al., 2016). Em casos mais complicados, nos quais a perda de peso não é alcançada nos primeiros 30 dias da nova dieta, é seguro reduzir a ingestão de matéria seca até 1.25% da massa corporal e até atingir o objectivo inicialmente projetado (Argo et al., 2012). O feno pode ainda ser demolhado em água de forma a diminuir o seu teor em hidratos de carbono solúveis (Longland et al., 2011).
É recomendada a realização de exercício físico diário de forma a acelerar o processo de perda de peso. Este deve ser adequado às capacidades do animal, sendo recomendável iniciar-se com 2 a 3 sessões por semana com duração de 20 a 30 minutos devendo aumentar a sua frequência e duração ao longo do tempo. Contudo a atividade física é desaconselhada em animais com laminite ativa ou com graves consequências da mesma (Geor & Harris, 2009; Secombe & Lester, 2012).
Em casos severos ou refractários pode ser utilizado um adjuvante farmacológico (Geor & Harris, 2009), sendo os mais recomendados a levotiroxina e a metformina.
A levotiroxina é uma hormona sintética utilizada para o tratamento de hipotiroidismo em humanos (Mandel et al., 1993). Em cavalos é recomendado o seu uso em animais resistentes à perda de peso mesmo com a dieta apropriada ou em casos de laminite ativa em que se pretenda uma diminuição do peso corporal rápida (Frank et al., 2016). Num estudo realizado em cavalos saudáveis foi detectada uma diminuição significativa do peso corporal após a administração de levotiroxina durante 8 semanas, sem que aparentemente tenham ocorrido alterações significativas noutros parâmetros vitais (Sommardahl et al., 2005). Pensa-se que esta diminuição na massa corporal possa ocorrer devido a um aumento na lipóliPensa-se ou a um aumento no gasto energético (Oppenheimer et al., 1991; Frank et al., 2005). Foi também avaliado o efeito da levotiroxina na concentração plasmática de triglicéridos, colesterol total e lipoproteínas de muito baixa densidade, conhecidas pela sigla VLDL, e percebeu-se que após 8 semanas de tratamento estes valores tinham diminuído significativamente (Frank et al., 2005). O tratamento com levotiroxina já mostrou também provocar um aumento na sensibilidade à insulina, melhorando a sensibilidade dos tecidos a esta hormona até 1,9 vezes em 48 semanas de tratamento, como também promoveu um aumento significativo na taxa de eliminação de insulina (Frank et al., 2008).Esta hormona deve ser administrada diretamente por via oral ou misturada no alimento, numa dose única de 0,1 mg/Kg de peso vivo, e uma
vez por dia. Após ter sido atingido o peso ideal, o tratamento deve ser cessado fazendo um desmame gradual. A duração máxima do tratamento deverá ser de 6 meses (Frank et al., 2016).
No caso da metformina falamos de uma molécula anti-diabética que é utilizada em humanos para melhorar a sensibilidade à insulina (Bertolani & Marra, 2008). Esta é indicada nos casos em que o proprietário não se mostra cooperante com a nova dieta prescrita, em animais que mesmo com a nova alimentação a hiperinsulinemia permanece, ou nos casos em que apesar da perda de peso ter sido atingida o animal vai voltar a ter acesso ao pasto (Frank
et al., 2016). Num estudo realizado em 18 animais porDurham et al. (2008),foi utilizada uma dosagem de metformina de 15 mg/Kg de peso vivo por via oral a cada 12 horas, resultando numa melhoria significativa da sensibilidade à insulina e numa diminuição da hiperinsulinemia. Contudo, foi sugerido posteriormente que esta molécula possui uma baixa biodisponibilidade em cavalos podendo conduzir a uma diminuição na sua eficácia (Hustace
et al., 2009). Num estudo mais recente levado a cabo por Frank (2011), foi utilizada uma
dosagem mais alta de metformina, 30 mg/Kg de peso vivo a cada 12h, mostrando também ter efeitos positivos na concentração de insulina com sua a respectiva diminuição após o tratamento. No entanto, não apresentou melhorias na sensibilidade à insulina. Foram também obtidos resultados positivos por Rendle et al. (2013), que demonstraram que a administração de metformina 1 hora antes da administração de dextrose levou a uma redução nos picos de glucose e na concentração de insulina, tanto em animais saudáveis como com resistência à insulina induzida experimentalmente.
Ainda que o modo de ação da metformina em cavalos ainda não esteja totalmente esclarecido, em animais de laboratório sujeitos ao tratamento por via oral, esta provocou uma diminuição da absorção de hidratos de carbono, o que pode contribuir para a diminuição da concentração de insulina e glucose no plasma sem que haja influência na sensibilidade à
25
II. OBJECTIVOS DO TRABALHO
O presente trabalho teve como objectivo identificar uma possível predisposição para o desenvolvimento de SME numa população de cavalos Lusitanos através da determinação da presença de resistência à insulina, da avaliação da condição corporal e da classificação do
Cresty Neck.
2.1. Material e Métodos
Animais
No presente trabalho foram utilizados 20 cavalos de raça Puro Sangue Lusitano propriedade da Coudelaria de Alter Real, em Alter do Chão. Foram utilizados 15 machos com aptidão desportiva e 5 fêmeas utilizadas para reprodução. Estes animais encontravam-se estabulados em boxe e eram alimentados com feno ad libitum e com alimento concentrado, em quantidades de 1 a 5 Kg (M = 3,8 Kg), repartido em duas refeições fornecidas de manhã e ao fim do dia.
Dos 20 animais usados no estudo, 5 animais considerados saudáveis e sem fenótipo de SME (3 machos e 2 fêmeas) foram incluídos no grupo controlo. No grupo de animais suspeitos foram incluídos os restantes 15 animais (12 machos e 3 fêmeas), em que alguns apresentavam história pregressa de claudicação com causa desconhecida e/ou fenótipo compatível com SME.
Todos os animais foram classificados quanto à sua condição corporal com base na escala proposta pelo INRA (INRA-HN-IE, 1997), na qual se atribuem notas de 0 a 5.
A classificação do Cresty Neck foi feita com base na escala de Carter et al. (2009), na qual são atribuídos pontos de 0 a 5.
Figura 8: Balança.
Protocolo e Obtenção de Amostras
Os cavalos foram mantidos na coudelaria de Alter Real, local onde foi desenvolvido o trabalho experimental. Aos animais apenas foi fornecido feno seco ad libitum nas 8 horas que antecederam o jejum necessário para a realização do teste. Após um período de jejum de 8h, foi recolhida uma amostra de sangue, por punção da veia jugular, correspondente ao tempo 0h. De seguida foram administrados por via oral, e com recurso a uma seringa, 0,15 mL/Kg de peso vivo de um xarope de milho rico em açúcar, Karo Corn Syrup®. Uma hora e trinta minutos após esta administração foi recolhida por punção da veia jugular a 2ª amostra de sangue correspondente ao tempo 90 min.
O sangue para determinação da concentração de insulina foi recolhido para tubos com heparina e refrigerado. Posteriormente as amostras foram centrifugadas a 1000 rpm durante 10 minutos e conservadas a -20ºC antes de ser realizada a análise.
27
Análise de Determinação da Concentração de Insulina
A concentração de insulina no plasma sanguíneo foi determinada utilizando um kit de ELISA (Mercodia: Equine Insulin ELISA). O presente kit está validado para uma determinação quantitativa da concentração de insulina no plasma sanguíneo de equinos (Mercodia, 2010).
Figura 9: Kit de reagentes do teste Mercodia: Equine Insulin ELISA.
Figura 10: Folha de identificação das amostras nos pocinhos do kit de ELISA.
Figura 11: (A) Placa após a leitura espectrofotométrica. (B) Placa após o tempo de incubação e antes da adição do substrato TMB do kit de ELISA.
Análise Estatística
Quanto à análise dos dados referentes à concentração de insulina foram utilizados os seguintes testes: para averiguar a igualdade de variâncias foi realizado o teste-F e para verificar a existência de diferenças significativas entre as médias foi realizado o teste-T para amostras independentes, tanto para o tempo t 0’ como para o t 90’.
29
2.2. Resultados
Os 20 animais usados no estudo tinham idades compreendidas entre os 3 e os 9 anos (M = 4,8), com peso entre 447 Kg e 562 Kg (M = 513,2 Kg).
A média de peso dos animais do grupo de controlo foi de 498,4 ± 19,45 Kg e dos animais do grupo de suspeitos foi de 518,13 ± 34,37 Kg.
Relativamente à Condição Corporal (CC) os animais do grupo controlo obtiveram classificações entre 3 e 3,5 (M = 3,15 ± 0,22) e os do grupo de suspeitos entre 3 e 3,5 (M = 3,22 ± 0,21), quanto à Classificação de Cresty Neck (CN) as notas encontram-se entre 2 e 4 nos dois grupos, sendo que a média no grupo de controlo foi de 2,5 ± 0,87 e no grupo de suspeitos de 2,87 ± 0,72 (Tabela 1).
Variáveis Grupo Controlo Grupo Suspeitos
Peso (Kg) 498,4 ± 19,45 518,13 ± 34,37
Condição Corporal 3,15 ± 0,22 3,22 ± 0,21
Cresty Neck 2,5 ± 0,87 2,87 ± 0,72
Tabela 1: Média ±Desvio Padrão do peso, condição corporal e Cresty Neck dos animais do grupo de controlo e do grupo de suspeitos
Figura 12: Avaliação da condição corporal.
Quanto à concentração de insulina, no tempo 0’, os animais do grupo controlo obtiveram uma média de 1,062 ± 0,293 μUI/mL e no grupo de suspeitos foi registada uma média de 1,631 ± 0,788 μUI/mL, não existindo diferenças estatisticamente significativas entre o grupo de controlo e o grupo de suspeitos, t (18) = -1.55, p = .137.
Relativamente ao tempo 90’, foram encontradas médias de 2,475 ± 0,627 μUI/mL e 3,028 ± 1,512 μUI/mL no grupo de controlo e no grupo de suspeitos, respectivamente, não existindo diferenças estatisticamente significativas entre o grupo de controlo e o grupo de suspeitos,
t(18) = -.784, p = .443 (Tabela 2). Controlo (n=5) Média (DP) Suspeitos (n=15) Média (DP) t(18) Concentração de insulina no t0’ 1,062 (0,293) 1,631 (0,788) -1.55 Concentração de insulina no t90’ 2,475 (0,627) 3,028 (1,512) -.784
Tabela 2: Resultados do Teste-T para amostras independentes relativos à concentração de insulina (μU/mL) no t0' e no t90'
Na tabela 3 está apresentada a distribuição dos resultados obtidos para a concentração de insulina. Para as concentrações basais de insulina (gráfico A) todos os animais do grupo de controlo apresentaram valores entre os 0,500 e os 1,500 μU/mL, no caso do grupo de suspeitos, 66,67% dos animais encontravam-se entre 1,000 e 2,000 μU/mL de insulina, sendo que dos restantes, 13,3% se encontrava abaixo e 20,03% se encontra acima destes valores.