UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Mestrado em Genética Molecular Comparativa e Tecnológica
Efeito do extracto de folhas de Ginkgo biloba em
células HepG2 tratadas com Paraquato.
Sandra Cristina Machado da Silva
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Mestrado em Genética Molecular Comparativa e Tecnológica
Efeito do extracto de folhas de Ginkgo biloba em
células HepG2 tratadas com Paraquato.
Sandra Cristina Machado da Silva
II
Júri de Apreciação
Presidente: ______________________________________________
1º Vogal: _______________________________________________
2º Vogal: _______________________________________________
Classificação: ____________________________________________
Data: __/__/____
III
A Orientadora
Prof. Doutora Isabel O’Neill M. Gaivão Departamento de Genética e Biotecnologia
UTAD
A Co-orientadora
Prof. Doutora Fernanda Leal Departamento de Genética e Biotecnologia
IV
“Para ser grande, sê inteiro: nada
Teu exagera ou exclui. Sê todo em cada coisa. Põe quanto és No mínimo que fazes. Assim em cada lago a lua toda Brilha, porque alta vive.”
V
Agradecimentos
Ao finalizar esta etapa da minha vida resta-me apenas agradecer a todos os que me ajudaram a conseguir alcançá-la.
À Universidade de Trás-os-Montes e Alto Douro em nome do Professor Doutor
Carlos Alberto Sequeira, Reitor da UTAD, pelas facilidades concedidas na realização
deste trabalho.
Ao Coordenador do 2º Ciclo de Genética Molecular, Comparativa e Tecnológica, em nome do Professor Doutor Valdemar Pedrosa Carnide, pelas facilidades na realização deste trabalho e pela disponibilidade para esclarecimentos.
À Professora Doutora Isabel Gaivão, minha orientadora, por todo o apoio e incentivo que me deu ao longo deste ano.
À Professora Doutora Fernanda Leal, minha co-orientadora, por todos os conselhos sábios dados na altura certa. Agradeço toda a compreensão, simpatia, companhia e disponibilidade.
Ao laboratório de Biologia Celular e Bioenergética do Departamento de Biologia e
Ambiente da Universidade de Trás-os-Montes e Alto Douro, na pessoa da Professora Doutora Amélia Maria Silva, por todo o apoio e disponibilidade que me
foram concedidos e pelo conhecimento científico que me foi transmitido. Muito obrigada!
Ao Instituto Dr. Ricardo Jorge (Porto), na pessoa do Dr. João Paulo Teixeira, por sempre tão simpática e prontamente se ter disponibilizado a receber-me.
Ao Jorge Soares não há palavras para agradecer porque muitíssimo obrigada é muito pouco!
Aos meus Avós Luís Machado e Otília Martins por serem os responsáveis pela realização do meu sonho. Agradeço-vos toda a ajuda que me deram e todos os conselhos e experiência de vida que partilharam comigo. Estou-vos muito grata por tudo! Avó, serás sempre para mim o maior exemplo de dignidade que alguma vez
VI
poderei ter! Eras a pessoa com que mais desejava partilhar este momento, mas sei que, onde quer que estejas, estás feliz por mim.
À minha Mãe por me ter ajudado a ultrapassar esta etapa da minha vida que em muitos momentos não foi nada fácil. Obrigado por seres a melhor mãe do Mundo e por seres minha!
Ao meu Pai pelos conselhos sábios que me dá, por me amar e por ser o melhor Pai do Mundo! Obrigada por tudo!
À minha Irmã Ana por estar sempre presente. És a pessoa que eu mais amo no Mundo! A todos os Amigos nomeadamente: Tânia Lopes, Jorge Ferreira, Mónica Batista,
Leandro Costa, por terem sido verdadeiros amigos. Muito obrigado por tudo o que me
deram: pelas folias, pela compreensão, por tentarem manter-me sempre animada e confiante em alturas de desespero. Obrigada pelas vivências que partilhamos e por todos os momentos que passamos juntos.
Ao Cazé Pinto por ser o melhor namorado do Mundo. Obrigado por acreditares em mim, muitas vezes mais que eu própria!
Aos Colegas de Mestrado, pelo companheirismo, sempre com uma palavra amiga e um sorriso.
A todos que não referi aqui, mas que tiveram do meu lado ao longo deste trabalho, o meu muito obrigado a todos.
VII
Resumo
O extracto de folhas de Ginkgo biloba L. é um dos fármacos de origem vegetal mais vendido no Mundo. Relativamente a este extracto o presente trabalho estudou a sua genotoxicidade/antigenotoxicidade e esclarecer se este detém um efeito quimioprotector contra os danos induzidos pelo agente indutor de espécies reactivas de oxigénio (ROS), o Paraquato (PQ), usando a versão alcalina do Ensaio do Cometa para medir as quebras de cadeia de DNA basais e medir as 8-oxoguaninas e outras purinas alteradas (sítios FPG) pela incubação com formamidopirimidina DNA glicosilase (FPG). O PQ é um herbicida que origina a produção de ROS dentro das células e tem sido apontado como um factor relevante no desenvolvimento da doença de Parkinson. Neste estudo analisou-se a sua genotoxicidade e pretendeu-analisou-se contribuir para o estabelecimento de um protocolo alternativo aos métodos usados para a indução de danos oxidativos.
O efeito de diferentes concentrações de Paraquato (1; 1,5; 2 e 5 µM) foi testado em células HepG2. Diferentes concentrações de extracto vegetal (0,5; 5 e 10 g/L) foram testadas sozinhas ou combinadas com Paraquato (1 e 1,5 µM), ao longo do tempo (de uma a 24 horas de incubação), de modo a avaliar o efeito mutagénico/antimutagénico deste extracto vegetal.
A incubação das células HepG2 com o extracto vegetal (10 g/L) durante uma hora aumentou os danos no DNA (quebras de cadeia e dano oxidativo), provavelmente devido aos ácidos ginkgólicos presentes no extracto bruto. A incubação com 0,5 g/L ao longo do tempo (uma, 4 e 24 horas) indicou que, 4 horas após a incubação das células HepG2, o dano é sobretudo oxidativo. Os tratamentos com Paraquato conduziram a um aumento do dano oxidativo no DNA, nas concentrações 1 e 1,5 µM, após 4 horas de incubação. O pré-tratamento de 24 horas das células HepG2 com Ginkgo biloba L. (0.5 e 5 g/L), antes do tratamento com PQ (1 e 1,5 µM, durante 1 hora), aumentou o dano oxidativo no DNA, revelando, ao contrario do que seria de esperar, efeitos genotóxicos quando usado nesta concentração e tempo.
VIII
Abstract
Ginkgo biloba L. leaf extract is one of the most widely used nutritional supplements in
the world. The aim of this work was to study the genotoxic/antigenotoxic effect of the
Ginkgo biloba L in HepG2 cells, and testify the protective effect of this extract against
damage induced by the potent reactive oxygen species (ROS) inducer Paraquat (PQ), using the alkaline comet assay to measure basal DNA strand breaks (SBs) and to measure 8-oxoguanines and other altered purines (FPG sites) by incubation with formamidopyrimidine DNA glycosylase (FPG). PQ is an herbicide that produces ROS inside the cells and it has been appointed as a relevant factor in the development of Parkinson’s disease. In this study we analyzed its genotoxicity and it was intended to contribute to the establishment of an alternative protocol to the methods used for the induction of oxidative damage.
The effect of different concentrations of PQ (1; 1.5; 2 and 5 µM) was tested on HepG2 cells. Different concentrations of plant extract (0.5; 5 and 10 g/L) have been tested alone and combined with PQ (1 and 1.5 M), over time (from 1 h to 24 h of incubation), to evaluate the mutagenic/antimutagenic effect of plant extract.
Incubating HepG2 cells with plant extract (10 g/L) for 1 h increased the DNA damage (strand breaks and oxidative damage), probably due to ginkgolic acids present in crude extract. Incubation with 0.5 g/L over time (1, 4 and 24 h) indicated that, at 4 h after HepG2 cells incubation, the damage is mainly oxidative. PQ treatment leads to an increasing of the oxidative DNA damage, at concentration of 1 and 1.5 µM, after 4 h of incubation. A 24 h pre-treatment of HepG2 cells with Ginkgo biloba L. (0.5 and 5 g/L), before PQ treatment (1 and 1.5 µM, for 1 h), increased the oxidative DNA damage, revealing, in contrast to the expectations, its genotoxic effects when used at this concentration and time.
IX
Índice Geral
Agradecimentos ... V Resumo ... VII Abstract ... VIII Índice Geral ... IX Índice de Figuras ... XI Índice de Quadros ... XIV Índice de Tabelas ... XIV Lista de abreviaturas e símbolos ... XVI1. Introdução... 1
1.1 Espécies Reactivas de Oxigénio e Stresse Oxidativo ... 1
1.1.1. Espécies reactivas de oxigénio: o seu local de produção e sua reactividade 2 1.1.2. Defesas Celulares Contra Espécies Reactivas de Oxigénio ... 4
1.1.3. Consequências in vivo da geração de radicais livres de oxigénio ... 7
1.2. Ginkgo biloba ... 12
1.3. Linha Célular HepG2 ... 18
1.4. Ensaio do Cometa ... 19
1.5. Paraquato (PQ) ... 21
2. Objectivos... 24
3. Material e Métodos... 25
3.1. Material Biológico ... 25
3.2. Meios de Cultura e Soluções ... 25
3.2.1. Meio de cultura completo ... 25
3.2.2. Meio de cultura sem soro... 26
X
3.3. Extracto de folhas de Ginkgo biloba ... 27
3.4. Preparação da solução stock de Paraquato ... 28
3.5. Desagregação das células HepG2 com tripsina ... 28
3.6. Contagem das células ... 28
3.7. Avaliação da genotoxicidade e citoprotecção em células HepG2: Ensaio do Cometa ... 29
3.7.1. Procedimento ... 29
4. Resultados ... 34
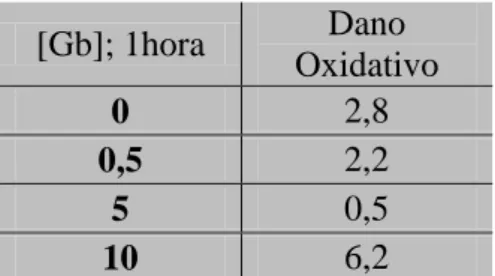
4.1. Avaliação do efeito do extrato de Ginkgo biloba no DNA ... 35
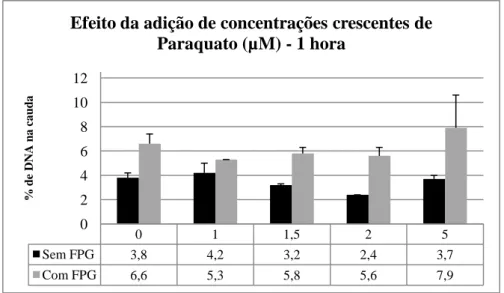
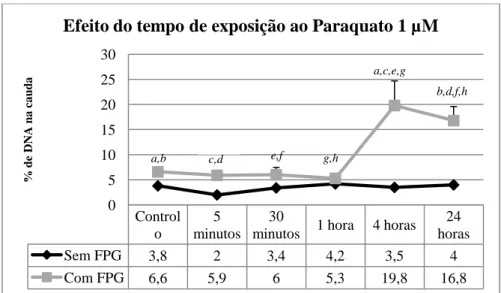
4.2. Avaliação do efeito genotóxico do Paraquato ... 37
4.3. Avaliação do efeito do extracto de Ginkgo biloba em células HepG2 tratadas com Paraquato ... 42
5. Discussão ... 47
6. Conclusões ... 56
XI
Índice de Figuras
Figura 1: Produção e reparação enzimática de resíduos 8-oxoguanina no DNA (Fonte: Adaptado de Nash et al, 1996). ... 11 Figura 2: Visão global do mecanismo das espécies reactivas de oxigénio e o mecanismo
de lesão oxidativa de tecidos que conduz a condições patológicas (Fonte: Adaptado de Bandyopadhyay et al, 1999). ... 12 Figura 3: Estrutura de cinco ginkgolides e do bilobalide (Fonte: Stromgaard e
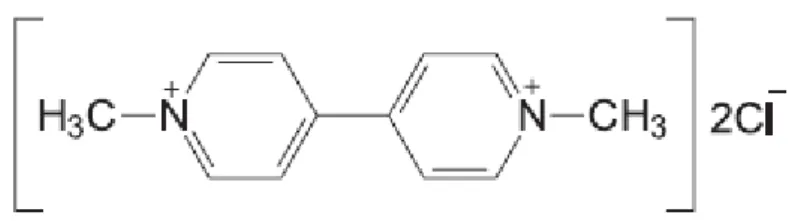
Nakanishi, 2004). ... 14 Figura 4: Fórmula de estrutura do Paraquato. ... 21 Figura 5: Formação de radicais livres na célula aumentada via exposição ao Paraquato
com consequente peroxidação lipídica (Fonte: Adaptado de Bus et al, 1975 citado por Schmitt et al, 2006). ... 23 Figura 6: Imagens de ensaios do cometa realizados em células HepG2 após a coloração
do seu DNA com Brometo de Etídeo. A) Experiência controlo em que as células não foram sujeitas a nenhum tratamento – a inexistência de cauda demonstra os baixos níveis de danos no DNA das células HepG2 utilizadas; B, C e D) Danos no DNA resultantes da incubação das células com diferentes tratamentos; B) Paraquato 1 µM (4 horas); C) Extracto de Ginkgo biloba 0,5 g/L (4 horas) e D) Extracto de Ginkgo biloba 0,5 g/L (24 horas) + Paraquato 1,5 µM (1 hora). Ensaios com tratamento enzimático FPG. Exemplos ilustrados com setas. Todas as imagens foram obtidas numa ampliação de 400 vezes. ... 34 Figura 7: Dano no DNA de células HepG2 tratadas com diferentes concentrações do
extracto de folhas de Ginkgo biloba (g/L) durante uma hora. Para cada tratamento foram feitos ensaios com e sem tratamento enzimático FPG. A avaliação dos danos de DNA é expressa em percentagem (%) de DNA na cauda. Os valores de média e desvio padrão foram obtidos a partir da análise dos cometas obtidos em quatro géis (letras iguais indicam diferenças significativas). ... 35 Figura 8: Dano no DNA de células HepG2 tratadas com Ginkgo biloba 0,5 g/L ao longo
do tempo (0, 1, 4 e 24 horas). Para cada tratamento foram feitos ensaios com e sem tratamento enzimático FPG. A avaliação dos danos de DNA é expressa em
XII
percentagem (%) de DNA na cauda. Os valores de média e desvio padrão foram obtidos a partir da análise dos cometas obtidos em quatro géis (letras iguais indicam diferenças significativas). ... 37 Figura 9: Dano no DNA em células HepG2 tratadas com diferentes concentrações de
Paraquato (µM) durante 30 minutos. Para cada tratamento foram feitos ensaios com e sem tratamento enzimático FPG. A avaliação dos danos de DNA é expressa em percentagem (%) de DNA na cauda. Os valores de média e desvio padrão foram obtidos a partir da análise dos cometas obtidos em quatro géis (letras iguais indicam diferenças significativas). ... 38 Figura 10: Dano no DNA em células HepG2 tratadas com diferentes concentrações de
Paraquato (µM) durante uma hora. Para cada tratamento foram feitos ensaios com e sem tratamento enzimático FPG. A avaliação dos danos de DNA é expressa em percentagem (%) de DNA na cauda. Os valores de média e desvio padrão foram obtidos a partir da análise dos cometas obtidos em quatro géis (letras iguais indicam diferenças significativas). ... 39 Figura 11: Dano no DNA de células HepG2 tratadas com Paraquato 1 µM ao longo do
tempo (0, 5 e 30 minutos, 1, 4 e 24 horas). Para cada tratamento foram feitos ensaios com e sem tratamento enzimático FPG. A avaliação dos danos de DNA é expressa em percentagem (%) de DNA na cauda. Os valores de média e desvio padrão foram obtidos a partir da análise dos cometas obtidos em quatro géis (letras iguais indicam diferenças significativas). ... 40 Figura 12: Dano no DNA de células HepG2 tratadas com Paraquato 1,5 µM ao longo do
tempo (0, 5 e 30 minutos, 1, 4 e 24 horas). Para cada tratamento foram feitos ensaios com e sem tratamento enzimático FPG. A avaliação dos danos de DNA é expressa em percentagem (%) de DNA na cauda. Os valores de média e desvio padrão foram obtidos a partir da análise dos cometas obtidos em quatro géis (letras iguais indicam diferenças significativas). ... 41 Figura 13: Dano no DNA de células HepG2 tratadas com Paraquato 1 µM durante uma
hora após uma pré-incubação das células com Gb 0,5 g/L (24 horas). Apresentam-se valores de dano com e Apresentam-sem a enzima FPG. A avaliação dos danos de DNA é expressa em percentagem (%) de DNA na cauda. Os valores de média e desvio
XIII
padrão foram obtidos a partir da análise dos cometas obtidos em quatro géis (letras iguais indicam diferenças significativas). ... 43 Figura 14: Dano no DNA de células HepG2 tratadas com Paraquato 1,5 µM durante
uma hora após uma pré-incubação das células com Gb 0,5 e 5 g/L (24 horas). Apresentam-se valores de dano com e sem a enzima FPG. A avaliação dos danos de DNA é expressa em percentagem (%) de DNA na cauda. Os valores de média e desvio padrão foram obtidos a partir da análise dos cometas obtidos em quatro géis (letras iguais indicam diferenças significativas). ... 44 Figura 15: Comparação entre o dano no DNA de células HepG2 tratadas com Paraquato
(1 e 1,5 µM) durante uma hora com uma pré-incubação das células com Gb 0,5 g/L (24 horas) e a adição conjunta de Paraquato e Gb 0,5 g/L às células durante uma hora. Apresentam-se valores de dano com e sem a enzima FPG. A avaliação dos danos de DNA é expressa em percentagem (%) de DNA na cauda. Os valores de média e desvio padrão foram obtidos a partir da análise dos cometas obtidos em quatro géis (letras iguais indicam diferenças significativas). ... 46
XIV
Índice de Quadros
Quadro 1: Principais espécies reactivas de oxigénio e o seu metabolismo (Fonte: Nordberg e Arnér, 2001). ... 8 Quadro 2: Enzimas metabolizadoras de xenobióticos presentes em células humanas
HepG2 (Adaptado de Knasmuller et al, 1998). ... 19 Quadro 3: Plano de preparação das células para o ensaio do cometa... 30
Índice de Tabelas
Tabela 1: Valores de dano oxidativo obtidos para a avaliação do efeito da adição de concentrações crescentes de extracto de Ginkgo biloba (g/L) a células HepG2 durante 1 hora. ... 36 Tabela 2: Valores de dano oxidativo obtidos para a avaliação do efeito do tempo de
exposição das células HepG2 ao extracto de Ginkgo biloba 0,5 g/L (em horas). ... 37 Tabela 3: Valores de dano oxidativo obtidos para a avaliação do efeito da adição de
concentrações crescentes de Paraquato (µM) a células HepG2 durante 30 minutos. ... 38 Tabela 4: Valores de dano oxidativo obtidos para a avaliação do efeito da adição de
concentrações crescentes de Paraquato (µM) a células HepG2 durante 1 hora. ... 39 Tabela 5 Valores de dano oxidativo obtidos para a avaliação do efeito do tempo de
exposição das células HepG2 ao Paraquato 1 µM. ... 40 Tabela 6 Valores de dano oxidativo obtidos para a avaliação do efeito do tempo de
exposição das células HepG2 ao Paraquato 1,5 µM. ... 42 Tabela 7: Valores de dano oxidativo obtidos para a avaliação do efeito da adição de
Ginkgo biloba 0,5 g/L às células HepG2 24 horas antes da adição de Paraquato 1
XV
Tabela 8: Valores de dano oxidativo obtidos para a avaliação do efeito da adição de
Ginkgo biloba 0,5 e 5 g/L às células HepG2 24 horas antes da adição de Paraquato
1,5 µM durante uma hora. ... 45 Tabela 9: Valores de dano oxidativo obtidos para a avaliação do efeito da adição de
Ginkgo biloba 0,5 g/L 24 horas antes da adição de Paraquato (1 e 1,5 µM) e da sua
XVI
Lista de abreviaturas e símbolos
·OH Radical hidroxilo
8-oxoGua 8-oxo-7, 8 desidro-2’-desoxiguanosina ATP Adenosina-trifosfato
BB Bilobalide
BE Brometo de etídio
BER Reparação por excisão de base (Base Excison Repair) CO2 Dióxido de carbono
Cu Cobre
Cu/Zn-SOD Superóxido dismutase Cobre-zinco
CYP Citocromo P
dGTP Desoxiguanina trifosfato
DMEM Dulbeco’s Modified Eagles Medium (Meio de cultura) DNA Ácido desoxirribonucleico
e- Electrão
EGb761 Extracto de Ginkgo biloba padrão
Fe Ferro
FPG Formamidopirimidina-DNA-glicosilase
GA Ginkgolide A
Gb Ginkgo biloba
GB Ginkgolide B
GlyRs Receptores da glicina GPx Glutationa Peroxidase GSH Glutationa reduzida GSSG Glutationa oxidada
XVII
H2O Água
H2O2 Peróxido de hidrogénio
HepG2 Linha celular derivada de carcinoma hepatocelular HOCl Ácido hipocloroso
LMP Agarose de baixo ponto de fusão (Low Melting Point) Mn-SOD Superóxido dismutase de manganês
NADH Nicotinamida adenina dinucleótido fosfato
NADPH Nicotinamida adenina dinucleótido fosfato (reduzida) NMP Agarose de normal ponto de fusão (Normal Melting Point) O2 Oxigénio molecular
O2- Radical superóxido
ºC Graus Celsius
PAF Factor de agregação plaquetária
PBR Receptores benzodiazepínicos periféricos PBS Tampão fosfato salino
PQ Paraquato
Prx Peroxirredoxinas
RNA Ácido ribonucleico
RO· Radicais alcoxi
ROO· Radicais peróxidos
ROOH Hidroperóxido
ROS Espécies reactivas de oxigénio (Reactive Oxygen Species) Sítio AP Lesão apurínica/apirimidínica
SOD Superóxido dismutase
SS Quebras de DNA de cadeia simples UV Radiação ultravioleta
1
1. Introdução
Desde que o stresse oxidativo foi considerado como o principal factor que conduz ao envelhecimento e às doenças neurodegenerativas relacionadas com a idade (Ames et al, 1993), as terapias antioxidantes adequadas para controlar estes processos têm sido alvo de uma atenção especial a nível mundial. O isolamento de um factor antioxidante não tóxico proveniente de fontes naturais seria uma das melhores abordagens para o controle da patogenese mediada por espécies reactivas de oxigénio (Bandyopadhyay et al, 1999).
1.1 Espécies Reactivas de Oxigénio e Stresse Oxidativo
O oxigénio é vital para os processos de vida aeróbia. Os organismos aeróbios utilizam o oxigénio molecular (O2) para a respiração ou para a oxidação de nutrientes de modo a
obter energia. No entanto, cerca de 5% desse O2 é convertido em espécies reactivas de
oxigénio (ROS), designadamente o radical superóxido (O2-), o peróxido de hidrogénio
(H2O2) e o radical hidroxilo (·OH) (Cabiscol et al, 2000; Bandyopadhyay et al, 1999).
As espécies reactivas de oxigénio formam-se principalmente devido à “fuga” de electrões da cadeia transportadora na mitocôndria. A exposição a radiação ionizante, radiação ultravioleta (UV), drogas quimioterapeuticas e toxinas ambientais induz uma sobreprodução de espécies reactivas de oxigénio (Salmon et al, 2004).
O stresse oxidativo surge quando a concentração de oxigénio activo aumenta para um nível que excede a capacidade de defesa da célula. O stresse oxidativo, através de uma série de eventos, desregula as funções celulares podendo conduzir a várias condições patológicas, incluindo disfunções cardiovasculares, doenças neurodegenerativas, patogenese gastroduodenal, disfunções metabólica, cancro e envelhecimento prematuro. O stresse oxidativo atinge, como alvos biológicos, os ácidos nucleicos (DNA e RNA), as proteínas e os lípidos (Cabiscol et al, 2000; Bandyopadhyay et al, 1999).
Até determinado nível, a presença de espécies reactivas de oxigénio é fundamental para a célula e para o organismo visto que desempenham duas funções principais: defesa contra infecções e regulação redox da actividade dos factores de transcrição.
2
Quando os fagócitos são activados produzem ROS em quantidade suficiente para eliminar o agente infeccioso. Nesta situação o complexo NADPH oxidase converte o O2
em O2-. O superóxido é posteriormente reduzido pela enzima superóxido dismutase
(SOD) a H2O2 que é depois convertido em ácido hipocloroso (HOCl) e
espontaneamente origina-se o radical hidroxilo. Estas espécies reactivas de oxigénio são tóxicas para as bactérias captadas pelos fagócitos. O ácido hipocloroso destrói a ligação do DNA à membrana, pondo fim à replicação bacteriana (Nordberg e Arnér, 2001). As espécies reactivas de oxigénio podem também afectar directamente a conformação e/ou a acção de todas as moléculas que contenham sulfidril através da oxidação deste grupo (-SH). Este tipo de regulação redox afecta muitas proteínas importantes na transdução de sinal, enzimas e receptores de membrana. Para muitos factores de transcrição as ROS funcionam como mediadores fisiológicos do controlo da transcrição (Nordberg e Arnér, 2001).
1.1.1. Espécies reactivas de oxigénio: o seu local de produção e sua reactividade
O O2 sofre redução num processo sequencial univalente formando-se vários
intermediários, tais como o superóxido, o peróxido de hidrogénio e o radical hidroxilo que colectivamente são denominados como espécies reactivas de oxigénio (ROS) (Bandyopadhyay et al, 1999).
O2 (e-) O2-(e-) H2O2 (e-) ·OH (e-) H2O
A redução do O2 é limitada pela enzima citocromo oxidase da cadeia mitocôndrial de
transporte de electrões, que reduz o O2 a H2O sem libertar qualquer O2- ou H2O2.
O2 + 4H+ + 4e- 2H2O
No entanto, o O2- é sistematicamente produzido na respiração celular (Fridovich, 1983)
devido à "fuga" de um electrão num local específico da cadeia de transporte de electrões da mitocôndria, resultando numa inadequada redução de electrão único do oxigénio a O2- (Chance et al, 1979 citado por Bandyopadhyay et al, 1999; Loschen et al, 1974)
3
As células fagocíticas, quando activadas durante a fagocitose, dão origem a O2- e H2O2
através da activação da NADPH oxidase. A dismutação espontânea de O2- em pH neutro
ou a dismutação pela enzima superóxido dismutase resulta na produção de H2O2
(Bandyopadhyay et al, 1999).
Exceptuando episódios de exposição anormal a radiação ionizante, a geração de ·OH in
vivo exige a presença de quantidades vestigiais de metais de transição como o ferro ou o
cobre. A simples mistura de H2O2 e sais de Fe2+ dá origem a ·OH (reacção de Fenton).
Fe2+ + H2O2 Fe3+ + ·OH + OH-
Vestígios de Fe3+ podem também reagir com o H2O2.
Fe3+ + H2O2 Fe2+ + O2– + H+
A geração de ·OH pode também ter origem na reacção de duas espécies reactivas de oxigénio.
O2– + H2O2 OH– + ·OH + O2.
A constante de velocidade desta reacção é muito baixa, mas pode ser aumentada se for catalisada por vestígios de iões de metais de transição - reacção de Haber-Weiss (Halliwell e Gutteridge, 1984). Fe3+ + O2 – Fe2+ + O2 Fe2+ + H2O2 Fe3+ + ·OH + OH -____________________________________________ O2– + H2O2(sal de ferro) O2 + ·OH + OH-
Tanto o ferro como o cobre existem nos sistemas biológicos ligados a proteínas, membranas, ácidos nucleicos ou agentes quelantes (Halliwell e Gutteridge, 1984). No entanto, durante uma situação extraordinária de isquemia e acidose celular, por exemplo, os iões destes metais são libertados de algumas metaloproteínas
4
O O2- mostra uma elevada reactividade em ambientes hidrofóbicos, mas uma baixa
reactividade em soluções aquosas. Devido ao seu estado de carga, o O2- não pode
atravessar as membranas biológicas, com excepção da membrana dos eritrócitos, que possui um canal de aniões, que auxilia a sua passagem. Uma acção deletéria indirecta do O2- é a sua dismutação a H2O2, que é sensível à catalase. Num sistema livre de metais de
transição, o H2O2 mostra uma toxicidade limitada. No entanto, o seu elevado tempo
médio de vida e o facto de ser semipermeável às membranas conferem-lhe a capacidade de se difundir até uma distância considerável do seu local de geração. Pelo contrário, o ·OH é extremamente reactivo tendo um tempo de meia vida muito curto e uma capacidade de difusão muito limitada. Este radical ataca e danifica quase todas as moléculas que se encontrem na sua proximidade. Assim, a extensão dos danos às células pelo O2- e pelo H2O2 aumenta na presença de iões de metais de transição, devido
à geração do radical mais poderoso o ·OH (Bandyopadhyay et al, 1999).
1.1.2. Defesas Celulares Contra Espécies Reactivas de Oxigénio
O aparecimento do oxigénio na atmosfera acarretou o desenvolvimento de mecanismos de defesa celular que mantêm a concentração de radicais derivados do O2 em níveis
toleráveis e que reparam os danos oxidativos. Tanto as células procariotas como as eucariotas possuem estes mecanismos. Os mecanismos de defesa incluem: enzimas como a superóxido dismutase, a catalase, várias peroxidases e moléculas constitutivamente presentes na célula que mantêm um ambiente intracelular de redução e que captam o oxigénio reactivo (Cabiscol et al, 2000).
1.1.2.1. A defesa primária contra ROS: Remoção catalítica por enzimas antioxidantes
A superóxido dismutase (SOD), a catalase e as peroxidases constituem um grupo de apoio mútuo na defesa das células contra as ROS. Enquanto a SOD diminui o nível de O2-, a catalase e as peroxidases fazem o mesmo para o H2O2.
5
1. Superóxido Dismutase (SOD; E.C. 1.15.1.1)
O O2- é tóxico para o crescimento da célula e é a superóxido dismutase (SOD), que
recolhe estes radicais.
A SOD foi a primeira enzima metabolizadora de ROS a ser descoberta. Existem duas isoenzimas SOD: a Mn-SOD presente na mitocôndria e a Cu/Zn-SOD presente no citoplasma. Na reacção catalisada pela SOD, duas moléculas de superóxido formam peróxido de hidrogénio e oxigénio molecular (Nordberg e Arnér, 2001).
2O2- + 2H+ H2O2 + O2
A biossíntese de SOD é controlada principalmente pelo seu substrato, o O2- (Nordberg e
Arnér, 2001; Bandyopadhyay et al, 1999).
2. Glutationa Peroxidase (GPx; E.C. 1.11.1.9)
A glutationa peroxidase catalisa a reacção dos hidroperóxidos com a glutationa reduzida (GSH) para formar glutationa dissulfeto (GSSG) e o produto de redução do hidroperóxido.
ROOH + 2GSH ROH + GSSG + H2O
O substrato desta enzima varia entre o H2O2 e hidroperóxidos orgânicos. É uma enzima
selénio. Localiza-se no citoplasma e na mitocôndria (Bandyopadhyay et al, 1999).
3. Peroxirredoxinas (Prx; E.C. 1.11.1.15)
As peroxirredoxinas (Prx) reduzem directamente os peróxidos como o peróxido de hidrogénio (Roos e Messens, 2011; Nordberg e Arnér, 2001).
2 e- + 2 H+ + H2O2 2 H2O
6
4. Catalase (E.C. 1.11.1.6)
A catalase está presente em quase todas as células de mamíferos e localiza-se nos peroxissomas ou nos microperoxissomas. É uma hemoproteína e catalisa a decomposição do H2O2 em água e oxigénio molecular.
2H2O2 O2 + 2H2O
A catalase reduz o risco de formação de radicais hidroxilo a parir do peróxido de hidrogénio via reacção de Fenton. Esta enzima liga-se ao NADPH que protege a enzima da inactivação e aumenta a sua eficiência (Nordberg e Arnér, 2001; Bandyopadhyay et
al, 1999).
O Quadro 1 resume a origem das espécies reactivas de oxigénio, o sistema enzimático de defesa e os produtos resultantes.
1.1.2.2. Defesa secundária contra ROS: “captadores” de radicais livres
A defesa secundária contra as espécies reactivas de oxigénio é constituída por moléculas (os "captadores") que reagem com os radicais para produzir outros compostos de radical. Quando os captadores produzem uma espécie radical menos prejudicial, denominam-se antioxidantes.
Estes antioxidantes não enzimáticos, são nomeadamente o NADH e o NADPH, o ácido ascórbico, o tocoferol, o ácido úrico, o β-caroteno e a glutationa (GSH) (Cabiscol et al, 2000).
O α-tocoferol, o ascorbato e a glutationa reduzida (GSH) actuam em conjunto como antioxidantes celulares: o α-tocoferol está presente nas membranas celulares e lipoproteínas plasmáticas. Quando o radical tocoferol é formado migra para a superfície da membrana e é reconvertido em α-tocoferol através da sua reacção com a ascorbato ou com a glutationa. O radical ascorbato resultante pode depois regenerar o ascorbato por redução com a GSH. A GSH também capta directamente as espécies reactivas de
7
oxigénio, e a GSSG resultante regenera a GSH através do sistema NADPH-glutationa redutase (Bandyopadhyay et al, 1999).
1.1.3. Consequências in vivo da geração de radicais livres de oxigénio
As espécies reactivas de oxigénio, devido à sua elevada reactividade causam danos em componentes celulares vitais como os ácidos gordos polinsaturados, as proteínas e os ácidos nucléicos, sendo potencialmente tóxicas, mutagénicas e carcinogénicas. Em menor medida, os hidratos de carbono também são alvos das ROS (Cabiscol et al, 2000; Bandyopadhyay et al, 1999).
Estas reacções podem alterar as propriedades intrínsecas de membrana como a fluidez e o transporte de iões, conduzir à perda da actividade enzimática, formação de proteínas com ligação cruzada e/ou inibição da sua síntese e danos no DNA nomeadamente cisão de cadeia, a modificação de bases (Pacifici et al, 1993; Stadtman, 1990; Moody e Hassan, 1982).
Os ácidos gordos polinsaturados, devido às suas múltiplas ligações duplas, figuram-se como excelentes alvos para o ataque dos radicais livres. Esta oxidação está na origem da formação de placas ateroscleróticas (Cabiscol et al, 2000).
A peroxidação lipídica é iniciada pelo radical ·OH, radicais alcoxi (RO·) e radicais peróxidos (ROO·) (Turrens e Boveris, 1980). Isto conduz a um processo de auto perpetuação uma vez que os radicais peróxidos são iniciadores bem como os produtos de peroxidação lipídica. Os radicais peróxido de lípidos reagem com outros lípidos, proteínas e ácidos nucleicos propagando assim a transferência de electrões e provocando a oxidação de substratos.
Comparando com os radicais livres reactivos, os aldeídos têm um tempo de vida superior e podem difundir-se do local da sua origem alcançando e atacando alvos distantes. Actuam como "segundos mensageiros tóxicos" das reacções em cadeia iniciadas (Cabiscol et al, 2000; Bandyopadhyay et al, 1999).
8 Quadro 1: Principais espécies reactivas de oxigénio e o seu metabolismo (Fonte: Nordberg e Arnér, 2001).
Molécula ROS Principais Origens Sistema enzimático
de defesa Produto (s) Superóxido (O2-) “Fuga” de electrões da cadeia transportadora de electrões Fagócitos activados Xantina oxidase Flavoenzimas Superóxido dismutase (SOD) H2O2 + O2 Peróxido de Hidrogénio (H2O2) Do O2- via SOD NADPH-oxidase (neutrófilos) Glucose oxidase Xantina oxidase Glutationa Peroxidase H2O + GSSG Catalases H2O + O2; Peroxirredoxinas (Prx) H2O Radical Hidroxilo (·OH) Do O2- e H2O2 via metais de transição (Fe2+ ou Cu2+)
9
Quando as proteínas são expostas a espécies reactivas de oxigénio ocorrem alterações nas cadeias laterais de aminoácidos e a estrutura da proteína é alterada. Estas modificações oxidativas conduzem a alterações funcionais que perturbam o metabolismo celular. Os estudos sobre o processo de envelhecimento demonstram a acumulação de enzimas cataliticamente inactivas ou menos activas e mais termolábeis além de um aumento no nível de conteúdo carbonil (indicador da oxidação catalisada por metais). Contudo, na célula o dano oxidativo de proteínas é um processo normal, provocado de modo a degradar as proteínas danificadas e assim promover a síntese de novas proteínas (Cabiscol et al, 2000; Bandyopadhyay et al, 1999).
As modificações oxidativas no DNA foram descobertas por Kasai e Nishimura, 1984 durante um estudo sobre os efeitos de alimentos cozinhados e as modificações que estes podem provocar no DNA. Mas estas alterações foram também descobertas num estudo independente deste por Dizdarogiu em 1985 (Poulsen et al, 1999).
As espécies reactivas de oxigénio causam danos oxidativos no DNA, tanto nuclear como mitocôndrial. Os seus alvos são bases azotadas e açúcares originando-se quebras de cadeia simples e duplas. Ocorre conjuntamente a formação de lesões apurínicas/apirimidínicas (sítios AP) e ligações cruzadas do tipo DNA-proteínas. Estas lesões bloqueiam a replicação do DNA (Cabiscol et al, 2000). Devido a estas modificações químicas, a acção das ROS é considerada mutagénica caso os sistemas de reparação do DNA não sejam capazes de regenerar de imediato esta biomolécula. O radical ·OH dá origem a diversos produtos a partir das bases do DNA que incluem particularmente a hidroxilação da guanina em C-8 para formar 8-oxo-7, 8 desidro-2’-desoxiguanosina (8-oxoGua), a 2,6-diamino-4-hidroxi-5-formamimodipirimidina (Fapy), a 8-OH-adenina, a 2-OH-adenina, a timina glicol e a citosina glicol (Wiseman e Halliwell, 1996).
Está demonstrado o envolvimento das ROS na indução de mutações no proto-oncogene humano C-Ha-ras-1 e no gene supressor de tumor p53. Estas mutações desempenham um papel vital na transdução de sinal conduzindo à proliferação e transformação celular. As ROS regulam os factores de transcrição pela modulação oxidativa das cascatas de proteínas cinases. As ROS induzem ainda genes de resposta ao stresse como o fos,
10
As espécies reactivas de oxigénio estão envolvidas na regulação dos factores de transcrição AP-1 e NFkB (Sen e Packer, 1996; Amstad et al, 1992). Estes ligam-se a
regiões promotoras de genes regulando a expressão de várias proteínas, tais como o factor de necrose tumoral-alfa (TNFα), interleucinas (IL) 1 e 2, colagenase e metaloproteinases de matriz, proteínas estas envolvidas em respostas inflamatórias e lesão de tecidos.
As bases azotadas são particularmente afectadas sofrendo uma oxidação possivelmente genotóxica (Nash et al, 1996). A base modificada 8-oxoguanina (Figura 1) pode ser incorporada no genoma através do ataque das ROS aos resíduos de guanina adicionados ao DNA ou através da oxidação dos dGTP a 8-oxo-dGTP que são depois usados como substrato pelas DNA polimerase. Mas independentemente da forma de incorporação, o emparelhamento preferencial dos resíduos 8-oxoGua com a adenina (A) durante a replicação dá origem a mutações por transversão de guanina:citosina (G:C) para timina:adenina (T:A). Esta tendência de emparelhamento juntamente com o elevado número de resíduos de 8-oxoGua produzidos no genoma a cada geração celular permite que estes resíduos sejam os mutagénios endógenos mais significativos (Cabiscol et al, 2000; Nash et al, 1996).
O dano oxidativo do DNA mitocôndrial também envolve a modificação de bases e quebras de cadeia, que leva à formação de componentes da cadeia transportadora de electrões imperfeitos. Isto reflecte-se na geração de mais ROS através do aumento da perda dos electrões e em danos celulares adicionais, sendo isto um ciclo vicioso (Reiter, 1997; Richter, 1988;).
Ainda que existam mecanismos de defesa endógenos contra as espécies reactivas de oxigénio, quando o sistema antioxidante celular fica indisponível ou quando as ROS atingem níveis anormalmente elevados, ocorre dano oxidativo nas células que, em última instância, conduz a várias condições patológicas. Em doenças como artrite reumatóide, cancro, aterosclerose, fibrose cística, ulcerogenese gastrointestinal, doença de Alzheimer e de Parkinson foi já relatado o envolvimento de ROS (Das et al, 1997; Wiseman e Halliwell, 1996).
11 Figura 1: Produção e reparação enzimática de resíduos 8-oxoguanina no DNA (Fonte: Adaptado de Nash et al, 1996).
O stresse oxidativo mediado por ROS pode conduzir à morte celular por apoptose. Como consequência desenvolvem-se as doenças neurodegenerativas e ocorre uma perda progressiva de linfócitos T em casos de infecção pelo vírus da imunodeficiência humana (Khalid e Ashraf, 1993). Foi já demonstrado que o produto do gene p35 actua como um antioxidante captando os radicais livres e prevenindo o processo de apoptose (Bandyopadhyay et al, 1999).
Eversince Harman foi o primeiro investigador a propor o envolvimento dos radicais livres no processo de envelhecimento, em 1956. A base molecular do envelhecimento e o papel das ROS neste processo tem atraído uma atenção considerável nos últimos anos sendo consensual que o envelhecimento e as doenças relacionadas com a idade resultam do dano oxidativo nas biomoleculas (Bandyopadhyay et al, 1999; Harman, 1981).
A Figura 2 representa as fontes de espécies reactivas de oxigénio, os seus “captadores” e as consequências da sua acção.
12 Figura 2: Visão global do mecanismo das espécies reactivas de oxigénio e o mecanismo de lesão oxidativa de tecidos que conduz a condições patológicas (Fonte: Adaptado de Bandyopadhyay et al, 1999).
Foi em 1974 que Gebhart detectou os primeiros antimutagénicos. Desde então têm sido feitos numerosos estudos em compostos que possam proteger as células contra danos causados no seu DNA por xenobióticos prevenindo as consequências que daí podem advir (Mersch-Sundermann et al, 2004).
1.2.Ginkgo biloba
A árvore Ginkgo (Ginkgo biloba L.) é o único membro sobrevivente da família
Ginkgoaceae, família esta com origem no período Jurássico. Por esta razão, esta árvore
é considerada um fóssil vivo. Por ser distinta de todas as outras plantas vivas esta árvore insere-se na sua própria divisão, a Ginkgophyta. A Ginkgo biloba é dióica, pode crescer mais de 35 metros de altura e chegar a uma circunferência de até 10 metros. Além disto,
13
é capaz de atingir idades superiores a mil anos. Esta árvore é um sobrevivente resiliente em ambientes poluídos, crescendo onde outras árvores sentem dificuldades. É excepcionalmente resistente a ataques por fungos e insectos. A descoberta de anterozóides móveis por parte de um botânico japonês fornece uma conexão crítica entre os ciclos de vida de plantas inferiores e superiores (Stromgaard e Nakanishi, 2004).
A Ginkgo biloba, sendo a árvore mais velha do Mundo, possui uma vasta história do seu uso na medicina tradicional chinesa. Os extractos das suas folhas têm sido usados desde o ano 3000 a.C. para o tratamento da asma e bronquites (Ritch, 2000). O seu uso foi descrito no livro de Liu Wen-Tai em 1505 e no Chinese Materia Medica por Pen Tsao Ching (1578) para o tratamento de sintomas de senilidade dos membros mais velhos da corte real chinesa (Stromgaard e Nakanishi, 2004; Thiagarajan et al, 2002).
O extracto de folha de Ginkgo biloba é actualmente o fármaco de origem vegetal mais vendido na Europa e um dos dez mais vendidos nos Estados Unidos da América (Stromgaard e Nakanishi, 2004; Sierpina et al, 2003). As preparações feitas com base nas suas folhas foram introduzidas no mundo ocidental por volta de 1965 pela companhia alemã Dr. Willmar Schwabe. Mais tarde, esta companhia em colaboração com a companhia francesa Beaufour-Ipsen desenvolveu o extracto de Ginkgo biloba padrão – o EGb761, utilizado em investigação científica e vendido em farmácias e parafarmácias (Stromgaard e Nakanishi, 2004).
O extracto de folhas de Ginkgo biloba possui mais de 60 compostos bioactivos sendo os principais os flavonóides, os glicosídeos, os terpenóides (ginkgolides e biobalide) e o ácido anacárdico (Thiagarajan et al, 2002; Ritch, 2000).
Os ginkgolides (A, B, C, J e M) e o biobalide são compostos exclusivamente encontrados na árvore Ginkgo biloba (Figura 3).
14 Figura 3: Estrutura de cinco ginkgolides e do bilobalide (Fonte: Stromgaard e Nakanishi, 2004).
O estudo dos efeitos dos componentes individuais do extracto de Ginkgo biloba é essencial para fornecer uma documentação científica completa dos seus potenciais efeitos terapêuticos. Mas além do contributo individual de cada composto os efeitos sinergéticos são um ponto importante a considerar. A biodisponibilidade destes compostos é também um parâmetro que deve ser tida em conta. Os flavonóides no extracto de Ginkgo biloba não são capazes de transpor a barreira hemato-encefálica ou, pelo menos, não em quantidade suficiente para exercer efeitos fisiológicos no sistema nervoso central. Já a biodisponibilidade dos ginkgolides e do biobalide é de 70 a 80%, com um tempo médio de vida de 3 a 5 horas. O carácter lipofílico destes torna-os permeáveis à barreira hemato-encefálica e por isto, a presença destas estruturas únicas é decisiva na concretização das melhorias associadas ao extracto de Ginkgo biloba (Stromgaard e Nakanishi, 2004).
Os ensaios com extracto de Ginkgo biloba são vários e permitiram descrever várias acções biológicas, nomeadamente: acção vasorreguladora com o aumento do fluxo sanguíneo, melhorias em casos de zumbidos de origem vascular, melhoria cognitiva, da resposta imunitária, protecção contra a apoptose celular, melhoria dos sintomas da doença de Alzheimer em fase inicial e atraso na progressão desta doença, alívio do stresse, efeitos antioxidantes, capacidade de antagonizar o receptor do factor de agregação plaquetária, inibição de episódios agudos de asma, inibição da formação de β-amilóide, melhorias em casos de depressão emocional, glaucoma, tonturas e dores de cabeça, acção reguladora genética, aumento da longevidade, efeito protector na progressão de retinopatias diabéticas (Ritch, 2000), neuroprotecção, efeitos positivos
15
em casos de disfunção sexual secundária, doença das alturas e diminuição da vasoactividade em resposta ao frio, melhoria do metabolismo da glicose no cérebro, vertigens e melhoria dos sintomas congestivos da síndrome pré-mestrual (Stromgaard e Nakanishi, 2004; Thiagarajan et al, 2002; Sierpina et al, 2003; Ritch, 2000). O extracto de Ginkgo biloba tem também uma actividade antineoplásica tendo demonstrado um efeito anticlastogénico em estudos com vítimas do acidente nuclear de Chernobyl (Ritch, 2000).
Dados da Organização Mundial de Saúde (OMS) demonstram que, em 2010, 50 a 60% da população mundial com mais de 65 anos sofreu de alguma doença degenerativa. Informação de 2012 aponta já para a existência de 35,6 milhões de pessoas a sofrer de demência estimando-se que este valor duplique até 2030 e triplique até 2050. Para já os tratamentos existentes são pouco eficazes e vitalícios. Para já a OMS recomenda o uso de Ginkgo biloba na doença de Raynaud e síndrome pós flebítica (Sierpina et al, 2003). A primeira actividade biológica significativa dos ginkgolides foi descoberta em 1985 quando demonstraram ser potentes antagonistas do receptor do factor de agregação plaquetária (PAF) (Stromgaard et al, 2004). Os ginkgolides, nomeadamente o ginkgolide B, são responsáveis pela capacidade neuroprotectora, antioxidante, capacidade de captação de radicais livres e de relaxamento do endotélio. Os ginkgolides inibem também a formação de β-amilóide (Sierpina et al, 2003).
O factor de agregação plaquetária está envolvido na modulação de vários processos do sistema nervoso central e periférico. O PAF é produzido por basófilos, neutrófilos, monócitos, plaquetas e células endoteliais, e induz a agregação de neutrófilos, aderência e quimiotaxia. A sua presença aumenta a permeabilidade vascular, a libertação de lisossomas e a síntese de superóxido (Ritch, 2000).
Os níveis de PAF aumentam no Sistema Nervoso Central durante um trauma e nestes casos a acção dos antagonistas do PAF é reduzir o dano neuronal pela limitação do aumento da concentração de iões cálcio induzido pelo PAF. Os inibidores do PAF diminuem o tamanho do enfarte cerebral e aumentam a recuperação da actividade metabólica cerebral após isquemia. (Stromgaard e Nakanishi, 2004; Ritch, 2000). O potencial problema clínico mais importante que envolve a ingestão de Ginkgo biloba está precisamente relacionado com a sua capacidade de inibição do factor de activação
16
plaquetária. Posto isto, o uso desta planta medicinal não deve ser concomitante com a ingestão de outros agentes antiplaquetários (Sierpina et al, 2003).
Os ginkgolides A, C e J, mas principalmente o ginkgolide B são antagonistas dos receptores da glicina (GlyRs). Os ligandos dos GlyRs, como moduladores da sua função podem ser usados como relaxantes musculares, agentes sedativos e analgésicos (Stromgaard e Nakanishi, 2004).
Os ginkgolides, particularmente os GA e GB são ainda moduladores da acção dos receptores benzodiazepínicos periféricos (PBR). A função dos PBRs relaciona-se com a proliferação celular, stresse e desordens de ansiedade. Em casos de desordens neurodegenerativas e após danos cerebrais ocorre um aumento no número de PBRs. O efeito neuroprotector dos GA e GB prende-se com a inibição da expressão de PBRs (Stromgaard e Nakanishi, 2004).
Relativamente à sua capacidade antioxidante, os estudos demonstram que o extracto de
Ginkgo biloba protege os neurónios cerebrais expostos a stresse oxidativo induzido por
espécies reactivas de oxigénio: o pré-tratamento destes com Ginkgo biloba prolonga a sua sobrevivência após exposição a um agente indutor de stresse como o peróxido de hidrogénio. O seu potencial antioxidante é comparável ao do ácido ascórbico, glutationa e alfa-tocoferol. Este extracto é um eficaz captador de radicais peroxilo e superóxido além de conseguir captar o óxido nítrico e inibir a sua produção, impedindo a oxidação da oxihemoglobina (Ritch, 2000).
O extracto de Ginkgo biloba preserva também o metabolismo mitocondrial e a produção de ATP em vários tecidos e previne alterações morfológicas e os índices de dano oxidativo associado ao envelhecimento mitocondrial (Ritch, 2000).
Sabe-se que o extracto de Ginkgo biloba tem um importante efeito protector contra os danos causados por radicais livres ao nível da peroxidação lipídica em vários tecidos e sistemas experimentais. A este nível a sua acção prende-se com o aumento dos níveis de GSH e da actividade da GSSG reductase (Ritch, 2000).
Alguns estudos clínicos realizados com o extracto de Ginkgo biloba demonstraram a sua eficácia contra o choque séptico induzido por bactérias Gram-negativas e em casos de falha renal pós-transplante (Stromgaard e Nakanishi, 2004).
17
O extracto de Ginkgo biloba melhora o fluxo sanguíneo cerebral e periférico, um efeito que tem sido atribuído à fracção não flavonóide. Ocorre ainda a diminuição da viscosidade do sangue e o aumento da deformabilidade dos eritrócitos. Pacientes com doença cardíaca coronária, hipertensão, hipercolesterolemia e diabetes têm melhorado os níveis de fibrinogénio e a viscosidade do plasma após tratamento com este extracto. Este inibe ainda a formação do trombo arterial (Ritch, 2000).
A Ginkgo biloba e o bilobalide inibem a redução, in vitro, da quantidade de ATP, nas células endoteliais, induzida por hipoxia e atrasa o início da glicólise. Suprime ainda o colapso na membrana induzido por hipoxia no cérebro (Ritch, 2000).
O extracto de Ginkgo biloba é útil no tratamento do fenómeno de Raynaud, que ocorre em resposta à hipotermia ou stresse emocional.A Gingko biloba é capaz de aumentar a captação de glucose e a síntese de glicogénio nas células do músculo liso arterial (Ritch, 2000). Os ginkgolides têm efeitos cardioprotectores, sendo o GA o composto mais efectivo (Stromgaard e Nakanishi, 2004).
O bilobalide (BB) modula os principais neurotransmissores do cérebro (glutamato e ácido γ - aminobutírico (GABA)). Exibe também uma actividade anticonvulsiva (Stromgaard e Nakanishi, 2004).
Mas os estudos que utilizam o extracto de Ginkgo biloba estão, neste momento, muito voltados para a sua potencial utilização no tratamento da doença de Alzheimer. Os tratamentos com base nesta planta medicinal permitiram o abrandamento do desenvolvimento dos sintomas cognitivos desta demência e a regressão de certos aspectos cognitivos nos doentes foi atrasada cerca de 7 a 8 meses. Os estudos demonstram também que os efeitos do extracto de Ginkgo biloba são mais expressivos em situações de comprometimento cognitivo leve a moderado em vez de casos de demência severa sugerindo que a sua função será estabilizar ou atrasar o início dos sintomas. Os efeitos clínicos observados podem explicar-se pela descoberta de que este extracto inibe a agregação β-amilóide, que se acredita ser de importância significativa no desenvolvimento desta patologia (Stromgaard e Nakanishi, 2004).
A Ginkgo biloba é geralmente bem tolerada sendo raros os efeitos colaterais, normalmente leves, e incluem náuseas, vómitos, diarreia, dores de cabeça, tonturas, palpitações, inquietação, fraqueza ou erupções cutâneas. Deve ser prestado principal
18
cuidado à ingestão de folhas de Ginkgo biloba não processadas pois estas contêm ácidos ginkgólicos que são tóxicos (Sierpina et al, 2003).
Para qualquer um dos efeitos pretendidos com a ingestão de Ginkgo biloba, o tempo de tratamento e a quantidade diária ingerida são factores importantes no surgimento dos efeitos benéficos. As indicações de dosagem são 120 a 140 mg por dia, em duas a três doses (Stromgaard e Nakanishi, 2004).
1.3. Linha Célular HepG2
A linha celular HepG2 foi isolada pela primeira vez em 1972 por Aden e colaboradores a partir de um hepatoblastoma primário de um rapaz argentino de 11 anos (Mersch-Sundermann et al, 2004). A sua escolha como modelo in vitro em estudos de genotoxicidade deve-se ao facto de esta linha celular ser capaz de mimetizar as respostas dadas in vivo. Em primeiro lugar, a escolha de linhas celulares imortais prende-se com a sua disponibilidade em grandes quantidades, poderem ter origem em diferentes espécies e serem facilmente mantidas em cultura. As linhas celulares derivadas de carcinomas são ainda capazes de reter a capacidade de exercer funções específicas das células e tecido in vivo (Dehn et al, 2004). A linha celular de hepatoma humano usada neste estudo retém muitas das funções especializadas que caracterizam os hepatócitos humanos normais, nomeadamente a actividade de enzimas da fase I e II (Quadro 2), envolvidas na activação metabólica e destoxificação de carcinogénios genotóxicos e os antioxidantes (Dehn et al, 2004; Majer et al, 2004; Mersch-Sunderman
et al, 2004; Miura et al, 1999; Peppard e Knap, 1999). Por último, a escolha de uma
linha celular de origem humana deve-se ao facto da capacidade de activação das enzimas metabolizadoras de xenobióticos e as especificidades relativamente ao seu substrato apresentarem uma variação interespecífica (Mersch-Sundermann et al, 2004). A toxicidade de algumas substâncias nos hepatócitos pode ser medida recorrendo a varias estratégias que avaliam diferentes parâmetros e que permitem detectar perturbações estruturais e funcionais que prejudicam as capacidades normais de uma célula e produzem danos (Dehn et al, 2004).
19 Quadro 2: Enzimas metabolizadoras de xenobióticos presentes em células humanas HepG2 (Adaptado de Knasmuller et al, 1998).
Enzimas de Fase I Enzimas de fase II
Citocromo P450 (CYP) CYP 1A CYP 1A1 CYP 1A2 CYP 2B CYP 2C CYP 3A CYP 2E1
Arilhidrocarbono hidroxilase (AHH) Nitroredutase
N-demetilase Catalase Peroxidase
Oxidases de Função Mista (MFO) NAD(P)H: citocromo c redutase
Citocromo P450 redutase NAD(P)H: quinona oxirredutase
Epóxido hidrolase Sulfotransferase ST Glutationa S-transferase (GST) Uridina glucuronosil transferase
N-acetiltransferase
UDP-glucuroniltransferase (UDPGT) Oxidases de Função Mista (MFO)
1.4. Ensaio do Cometa
A Electroforese em Gel de Célula Isolada ou Ensaio do Cometa é um método simples, sensível, versátil, rápido e económico que permite a avaliação de quebras nas cadeias do DNA em células eucarióticas (Collins et al, 2008; Burlinson et al, 2007; Collins, 2004). Nesta técnica, as células são colocadas num gel de agarose com baixo ponto de fusão colocado sobre uma lâmina de microscópio previamente revestida com agarose de ponto de fusão normal. Segue-se a sua desproteinização pela incubação numa solução de lise sendo depois sujeitas a electroforese. A coloração do DNA com um fluorocromo revela
20
uma imagem semelhante a um cometa onde se pode distinguir uma cabeça e uma cauda de DNA quando visualizado num microscópio de fluorescência. As células com um maior número de quebras no DNA apresentam uma cauda maior e/ou uma maior concentração de DNA nesta estrutura (Collins et al, 2008).
Nas células o DNA está organizado em nucleossomas: DNA enrolado em volta de um núcleo de histonas criando em superenrolamento (negativo). Após a lise a maioria das histonas é removida mas o DNA continua superenrolado. Uma quebra de cadeia simples (SS) vai relaxar o superenrolamento de DNA na “ansa” em que esta ocorreu, permitindo que este se movimente sob um campo electroforético (Collins et al, 2008; Collins, 2004).
A primeira demonstração do ensaio de electroforese em gel de célula única foi feita em 1984 por Östling e Johanson utilizando pH=10. Actualmente estas condições não são normalmente adoptadas sendo que a maioria dos ensaios envolve um tratamento em pH>13, procedimento este que foi sugerido poucos anos depois por dois grupos de investigação independentes: Singh et al (1988) e Olive et al (1990). Estas condições de pH permitem detectar quebras de cadeia e sítios alcali-lábeis no DNA (Collins et al, 2008; Collins, 2004).
Os sítios alcali-lábeis são sítios apurínicos e apirimidínicos ou sítios AP. Surgem da perda de uma base danificada, conduzindo à existência de um açúcar sem base no esqueleto de DNA. Os sítios AP ocorrem como intermediários no processo de reparação por excisão de base (BER) ou devido a alterações na estabilidade química do DNA (Collins et al, 2008; Burlinson et al, 2007; Collins, 2004).
A sensibilidade e a especificidade dos ensaios cometa podem ser melhoradas se ao procedimento padrão se acrescentarem etapas específicas (Collins et al, 2008; Collins, 2004).
Nas células normais as bases oxidadas ocorrem, pelo menos, em tão grande número como as quebras de cadeia e os sítios AP. Este dano pode ser detectado em ensaios cometa através da digestão do DNA por endonucleases especificas de lesão após a etapa de lise celular (Collins, 2009; Collins et al, 2008).
Algumas destas enzimas mais comummente utilizadas são a endonuclease III que reconhece pirimidinas oxidadas e a formamidopirimidina-DNA-glicosilase (FPG),
21
utilizada neste estudo, que detecta o principal produto de oxidação de purinas, a 8-oxoguanina, purinas de anel imidazol aberto ou formamidopirimidinas (fapy Ade e fapy Gua). O local sensível à enzima é convertido numa quebra de cadeia aumentando a intensidade da cauda do cometa (Collins, 2009; Collins et al, 2008; Collins, 2004). Estas enzimas são utilizadas principalmente para avaliar o efeito da suplementação com antioxidantes e analisar o espectro de danos induzido por um agente genotóxico (Collins, 2009; Collins et al, 2008; Collins, 2004).
Nos ensaios do cometa, o DNA é visualizado através de microscopia de fluorescência. Os corantes mais comummente utilizados são o brometo de etídio (BE) e o DAPI (4,6-diamidino-2-fenilindole) (Collins et al, 2008; Collins, 2004).
A análise dos cometas pode ser feita através de uma avaliação visual em que cada cometa é classificado numa de cinco categorias sendo 0 (zero) células não danificadas (cometas sem cauda ou com cauda dificilmente perceptível) e 1 a 4, células com um aumento relativo na intensidade da cauda, ou através da análise de imagens que utiliza uma câmara ligada a um computador com um software de análise adequado (Collins et
al, 2008; Collins, 2004).
1.5. Paraquato (PQ)
O 1,1'-dimetil-4,4'-bipiridina-dicloreto ou Paraquato (Figura 4) foi pela primeira vez sintetizado por Weidel e Russo em 1882, sendo que as suas propriedades herbicidas foram apenas descobertas em 1955 e a sua utilização iniciou-se em 1962 (Schmitt et al, 2006; Serra et al, 2003).
22
Devido ao número de casos de intoxicação e mortes por paraquato vários países já suspenderam ou restringiram o seu uso e adoptaram medidas como diminuir a sua concentração no produto final e acrescentar substâncias odoríferas, corantes e eméticas nas preparações comerciais (Schmitt et al, 2006).
Têm sido descritos vários mecanismos subjacentes à citotoxicidade do paraquato. O modelo geralmente aceite pela comunidade médica e científica refere que os danos nos tecidos se devem a um aumento na formação de radicais livres e espécies reactivas de oxigénio (Schmitt et al, 2006; Fukushima et al, 2002).
Nas células, o paraquato é reduzido formando-se o radical livre monocatiónico PQ+ que, em condições aeróbias, é rapidamente oxidado enquanto se geram radicais superóxido que iniciam uma cascata de reacções que conduzem à produção de mais espécies reactivas de oxigénio, principalmente peróxido de hidrogénio e radical hidroxilo, que causam danos no DNA, destroem os lípidos das membranas celulares (Figura 5) e podem conduzir à morte celular. Desde que haja NADPH e suprimento de oxigénio, o radical paraquato continuará a oxidar-se, produzindo danos celulares (Li et al, 2011; Schmitt et al, 2006).
23 Figura 5: Formação de radicais livres na célula aumentada via exposição ao Paraquato com consequente peroxidação lipídica (Fonte: Adaptado de Bus et al, 1975 citado por Schmitt et al, 2006).
Estudos epidemiológicos e laboratoriais indicam o paraquato como um factor etiológico ambiental na doença de Parkinson ao mediar a morte celular dos neurónios dopaminérgicos através da indução de stresse oxidativo (Yang et al, 2009).
24
2. Objectivos
A realização deste trabalho teve como principais objectivos:
Analisar a genotoxicidade de um composto indutor de espécies reactivas de oxigénio sob condições específicas – o Paraquato (PQ);
Contribuir para o estabelecimento de um protocolo alternativo aos métodos usados para a indução de danos oxidativos no DNA;
Estudar o efeito citotóxico e genotóxico do extracto de folhas de Ginkgo
biloba no DNA;
Avaliar um potencial efeito antigenotóxico do extracto de folhas de Ginkgo
biloba contra o stresse oxidativo induzido quimicamente pelo Paraquato.
Para este estudo, utilizaram-se células da linha celular de carcinoma hepatocelular humano – HepG2 e a técnica do Ensaio do Cometa.
25
3. Material e Métodos
3.1. Material Biológico
Neste estudo a linha celular utilizada foi a linha do carcinoma hepatocelular humano HepG2 (ATCC). Estas células foram mantidas em meio de cultura completo e numa incubadora (Binder) à temperatura de 37ºC com 5% de CO2 no laboratório de
Biologia Celular e Bioenergética do Departamento de Biologia e Ambiente da Universidade de Trás-os-Montes e Alto Douro.
A manipulação das células foi sempre realizada em condições assépticas, numa câmara de fluxo laminar, classe II (Faster, BH-EN 2004) de modo a prevenir quaisquer contaminação de origem bacteriana, fúngica ou viral.
3.2. Meios de Cultura e Soluções
Os meios de cultura são formulados de modo a fornecer às células os nutrientes essenciais ao seu metabolismo, crescimento e proliferação. Contêm vitaminas, aminoácidos, glicose e iões inorgânicos. Os meios de cultura, quando não utilizados de imediato, foram mantidos a 4ºC.
Neste estudo utilizaram-se duas formulações de meio: uma com soro designada por meio de cultura completo e outra sem soro.
3.2.1. Meio de cultura completo
DMEM (Dulbeco’s Modified Eagles Medium, Gibco), suplementado com 2 mM de L-glutamina (Gibco, Life Technologies), 10% (v/v) de soro fetal bovino, FBS (Gibco, Life Technologies) e antibióticos (200 U/mL de Penicilina e 200 µg/mL de Estreptomicina (Gibco, Life Technologies). Este meio base contém 25 mM de glicose e 0,1 g/L de piruvato.
26 3.2.2. Meio de cultura sem soro
DMEM (Dulbeco’s Modified Eagles Medium, Gibco), suplementado com 2 mM de L-glutamina (Gibco, Life Technologies) e antibióticos (200 U/mL de Penicilina e 200 µg/mL de Estreptomicina (Gibco, Life Technologies). Este meio base contém 25 mM de glicose e 0,1 g/L de piruvato.
3.2.3. Soluções
É descrito em seguida o nome e a composição das soluções utilizadas neste estudo.
3.2.3.1. Solução de PBS 1x
A solução tampão PBS (tampão fosfato) contém 137 mM NaCl; 2,7 mM KCl; 1,75 mM KH2PO4 e 10 mM Na2HPO4.2H2O. O pH foi ajustado a 7,4 com HCl 1M.
3.2.3.2. Solução de lise
Esta solução contém 2,5 M NaCl; 0,1 M EDTA; 0,01 M Tris e 5 mL de NaOH 10 M. O pH foi ajustado a 10 com NaOH. Para a sua utilização nos ensaios cometa adiciona-se Triton X-100 à concentração de 1% (v/v).
3.2.3.3. Solução de electroforese
Esta solução é feita com 300 mM de NaOH e 1 mM de EDTA dissolvidos em água destilada.
27 3.2.3.4. Tampão F
Preparou-se uma solução de tampão F 10x concentrada, contendo 0,04 M HEPES; 0,1 M KCl; 0,0005 M EDTA e 2% (p/v) BSA. Em cada utilização diluiu-se 50 mL de tampão F em 450 mL de água destilada.
3.3. Extracto de folhas de Ginkgo biloba
As folhas de Ginkgo biloba L. utilizadas neste estudo foram recolhidas em Novembro de 2010 de um espécime localizado na Universidade de Trás-os-Montes e Alto Douro. A preparação do extracto foi realizada como descrito por Ding e colaboradores (2004).
As folhas foram lavadas com água destilada, os pecíolos dispensados e seguiu-se uma secagem ao ar, à temperatura ambiente durante aproximadamente três semanas. De seguida, as folhas foram moídas utilizando um moinho doméstico de modo a obter-se um pó fino. Este pó foi armazenado em frascos de vidro fechados até ser utilizado para extracção.
Preparou-se uma solução stock de Ginkgo biloba de concentração 120 g/L pesando 3,6 g de pó de folhas que foram transferidas para um tubo de polipropileno de 50 mL. A este tubo adicionaram-se 30 mL de água destilada. Esta mistura foi aquecida em banho-maria a 100 ºC durante 5 minutos. Seguiu-se uma centrifugação a 2000 g durante 15 minutos. Aproveitou-se o sobrenadante e repetiram-se as etapas de banho-maria e centrifugação. O novo sobrenadante obtido foi filtrado utilizando filtros de 0,5 µm o seu pH ajustado a 6,5 com NaOH e armazenado a -20ºC.
Para a adição do extracto de Ginkgo biloba às células HepG2 nas concentrações de 0,5; 5 e 10 g/L procedeu-se às diluições da solução stock a 5; 50 e 100 g/L tendo em conta que, para a adição às células, a cada 900 µL de meio de cultura sem soro se adiciona 100 µL de extracto (dilui-se 10x).