UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE CIÊNCIAS
DEPARTAMENTO DE BIOQUÍMICA E BIOLOGIA MOLECULAR PROGRAMA DE PÓS-GRADUAÇÃO EM BIOQUÍMICA
JAMYLA LIMA SABOYA DE CASTRO
A TOXIDADE DO ÁCIDO ASCÓRBICO EM PLANTAS DE ARROZ SILENCIADAS NAS APXs CLOROPLÁSTICAS INDUZ ESTRESSE OXIDATIVO NÃO
DEPENDENTE DA FOTOSSÍNTESE
JAMYLA LIMA SABOYA DE CASTRO
A TOXIDADE DO ÁCIDO ASCÓRBICO EM PLANTAS DE ARROZ SILENCIADAS NAS APXs CLOROPLÁSTICAS INDUZ ESTRESSE OXIDATIVO NÃO
DEPENDENTE DA FOTOSSÍNTESE
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Bioquímica da Universidade Federal do Ceará, como requisito parcial à obtenção do Título de Mestre em Bioquímica.
Orientador: Prof. Dr. Joaquim Albenísio Gomes da Silveira
JAMYLA LIMA SABOYA DE CASTRO
A TOXIDADE DO ÁCIDO ASCÓRBICO EM PLANTAS DE ARROZ SILENCIADAS NAS APXs CLOROPLÁSTICAS INDUZ ESTRESSE OXIDATIVO NÃO
DEPENDENTE DA FOTOSSÍNTESE
Dissertação de Mestrado apresentada ao Programa de Pós-Graduação em Bioquímica da Universidade Federal do Ceará, como requisito parcial à obtenção do Título de Mestre em Bioquímica.
Orientador: Prof. Dr. Joaquim Albenísio Gomes da Silveira
À Deus,
OFEREÇO
À minha família,
DEDICO
Em primeiro lugar, agradeço a Deus por ter me concedido graças, paciência, sabedoria, persistência, força, coragem e determinação em minha caminhada acadêmica.
A meus Pais, pelo incentivo, que torceram e se alegraram com minhas conquistas e me apoiaram em todos os momentos, pelo esforço que fizeram para oferecer a mim e meu irmão uma boa educação.
A minha família por todo apoio, incentivo e ajuda na minha caminhada. Ao Prof. Dr. Joaquim Albenísio Gomes da Silveira, pela oportunidade e por ter acreditado no meu potencial, aceitando me orientar durante o mestrado, oferecendo todo o suporte técnico, conselhos e todo tipo de contribuição para esta importante etapa da minha formação profissional.
À Profa. Dra. Márcia Margis-Pinheiro, da UFRGS, pelo fornecimento das plantas silenciadas e pelas demais colaborações neste trabalho.
Ao Prof. Dr. Evandro Nascimento da Silva e Dr. Milton Costa Lima Neto, pela aceitação do convite para participar da banca examinadora e devidas contribuições.
Aos integrantes e ex-integrantes do LABPLANT, Adilton, Amnon, Ana Karla, Cinthya, Cristina, Carol, Fabrício, Girlaine, Glaydson, João Victor, Jones, Jordânia, Juliana, Lara, Marcio, Petterson, Rachel, Rafael, Sérgio e Tathiana, presentes durante o período do meu mestrado.
Ao programa de Pós-graduação em Bioquímica da Universidade Federal do Ceará e aos funcionários do Departamento de Bioquímica e Biologia Molecular e da coordenação da Pós-Graduação em Bioquímica da UFC.
Ao coordenador da Pós-Graduação, Prof. Dr. Márcio Viana Ramos.
A Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) pela bolsa concedida.
RESUMO
O ácido ascórbico (AA) é um dos antioxidantes mais importante na proteção das plantas contra o estresse oxidativo gerado por estresses abióticos. Em células animais, diversos trabalhos têm demonstrado que concentrações elevadas desse ácido podem causar toxicidade e morte celular. O mecanismo proposto é de uma ação pro-oxidante, por meio da redução de Fe+3 para Fe+2 e ação desse último na reação de Fenton, com geração de espécies reativas de oxigênio (EROs). Até o nosso conhecimento, esse mecanismo ainda não foi relatado em plantas. O objetivo deste trabalho foi elucidar mecanismos de toxicidade de concentrações elevadas de AA em plantas, utilizando como modelo mutantes de arroz com deficiência (silenciamento gênico) nas duas APX de cloroplasto (estromal e tilacoidal). Plantas silenciadas e não transformadas (NT) com 45 dias de idade foram expostas a 10 mM (concentração moderada) e 50 mM (concentração elevada) de AA exógeno (pulverizado nas folhas). Essas concentrações foram definidas a partir de experimentos dose-dependente de 0 a 50 mM utilizando segmentos foliares em placa. No sentido de avaliar o efeito protetor (antioxidante) do AA, plantas e segmentos foliares foram expostos a intensidade de luz elevada (1000 µmol m-2 s-1)
para induzir estresse fotoxidativo. Concentrações de AA acima de 30 mM induziram estresse oxidativo (aumento no nível de TBARS) em segmentos de folhas e esse efeito foi potencializado por luz elevada. Além de dano oxidativo, esses níveis de AA induziram aumento no dano de membrana (vazamento de eletrólitos) e redução na integridade do fotossistema II (Fv/Fm). É interessante notar que as concentrações de 10 e 20 mM de AA não mitigaram os efeitos negativos causados pelo o excesso de luz. A concentração elevada de AA (50 mM) induziu senescência foliar na presença de luz elevada, indicada por redução nos conteúdos de clorofilas e carotenoides. As plantas deficientes nas duas APXs de cloroplasto (APX7/8) apresentaram maior sensibilidade a toxicidade do AA, especialmente na combinação com luz elevada. Esses efeitos foram indicados por exibirem maiores níveis de TBARS (peroxidação lipídica), vazamento de eletrólitos, H2O2 e radical superóxido. Curiosamente, as plantas mutantes na presença de AA elevado não apresentaram diferenças em diversos parâmetros da fotossíntese: taxa de assimilação de CO2 e indicadores de eficiência do FSII (ΦPSII, ETR, NPQ e Fv/Fm) e FSI (ΦPSI, ETR e P700), além da
toxicidade de AA não ter alterado os parâmetros da fotossíntese nas plantas deficientes em APX, a presença de luz elevada, isoladamente, causou mudanças em alguns parâmetros da atividade fotoquímica nessas plantas. O conjunto dos dados deste trabalho mostra que o excesso de AA pode causar toxicidade em plantas. A intensidade desses efeitos é fortemente potencializada pelo excesso de luz, mas eles não são dependentes da fotossíntese. O papel das duas APXs de cloroplasto e da luz elevada na toxicidade de AA não ficou claro neste trabalho, apesar das plantas deficientes terem mostrado maior sensibilidade. Aparentemente, o mecanismo de toxicidade de AA em plantas é semelhante ao proposto para células animais. Esse antioxidante quando em excesso pode atuar como pro-oxidante estimulando as reações de Fenton, induzindo a acumulação de EROs e gerando estresse oxidativo. Novos estudos são necessários para elucidar o papel das APXs de cloroplasto e da luz elevada na toxicidade de ácido ascórbico em plantas.
Palavras-chave: Ácido ascórbico. Peroxidases do ascorbato. Estresse oxidativo.
ABSTRACT
of this work shows that the excess of AA may cause toxicity in plants. The intensity of these effects is strongly enhanced by the excess of light but they are not dependent on photosynthesis. In this work, the roles of the two chloroplastic APX and/or high light on the AA toxicity still unclear, despite the deficient plants had showed increased sensibility. Apparently, the mechanism of AA toxicity in plants is similar to the proposed for animal cells. This antioxidant, when in excess, can act as a pro-oxidant stimulating Fenton reactions, inducing the accumulation of ROS and resulting oxidative stress. Further studies are needed to elucidate the role of the chloroplast APXs and high light on the toxicity of ascorbic acid in plants.
LISTA DE ILUSTRAÇÕES
CAPÍTULO 1
Figura 1 – Resumo simples das principais espécies químicas de oxigênio (A) e os dois caminhos principais de redução de oxigênio (B). ... 21 Figura 2 – Duas das principais vias para o metabolismo de H2O2 em plantas. ... 23 Figura 3 – A rede ascorbato - fotossíntese - respiração - ciclo TCA. ... 27 Figura 4 – Papel de do reciclagem ascorbato em processos relacionados com a
fotossíntese. ... 30 CAPÍTULO 2
Figure 1. Changes in (A) membrane damage, (B) Fv/Fm and (C) φPSII in leaf
segments of non-transformed (NT) rice plants treated with different ascorbic acid (AA) concentrations after 24h in low light (200 µmol m-2 s -1) and high light (1000 µmol m-2 s-1). Asterisks indicate significant
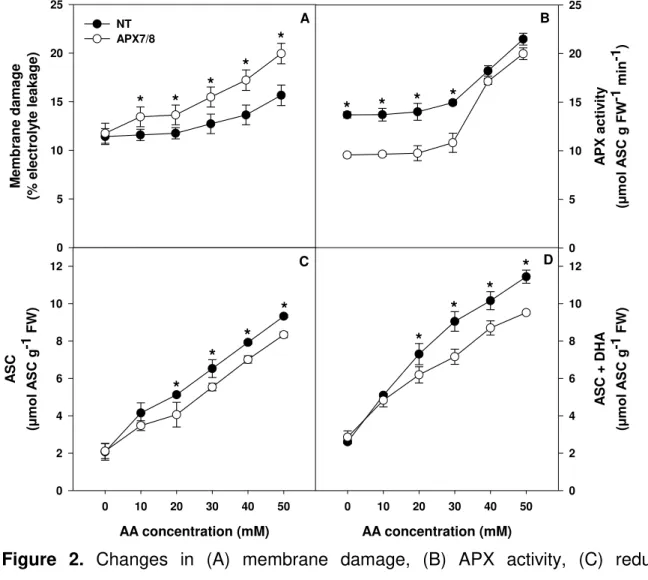
difference between treatments, within a same AA concentration, at a confidence level of 0.05. Points are averages of 4 replicates ± SD. ... 70 Figure 2. Changes in (A) membrane damage, (B) APX activity, (C) reduced
ascorbate content (ASC) and (D) total ascorbate content (ASC + DHA) in leaf segments of non-transformed (NT) and APX7/8-silenced rice plants exposed to different ascorbic acid (AA) concentrations after 24h in the dark. Asterisks indicate significant difference between treatments, within a same AA concentration, at a confidence level of 0.05. Points are averages of 4 replicates ± SD. ... 71 Figure 3. Changes in (A) membrane damage, (B) lipid peroxidation, (C) Fv/Fm and
(D) hydrogen peroxide in leaf segments of non-transformed (NT) and APX7/8-silenced rice plants treated with 0 and 50 mM ascorbic acid (AA) after 24h of dark and high light (1000 µmol m-2 s-1). Lowercase letters represent significant difference between the treatments within of the light treatments (dark and HL), and different capital letters represent significant difference between light treatments within the treatments at a confidence level of 0.05. Bars represent the average of 4 replicates ± SD. ... 72 Figure 4. Changes in (A) chlorophylls and (B) carotenoids in leaf segments of
mM ascorbic acid (AA) after 24h of dark and high light (1000 µmol m-2 s -1). Lowercase letters represent significant difference between the
treatments within of the light treatments (dark and HL), and different capital letters represent significant difference between light treatments within the treatments at a confidence level of 0.05. Bars represent the average of 4 replicates ± SD. ... 73 Figure 5. Appearance of NT and APX7/8-silenced leaf segments of rice plants
exposed to control or 50 mM ascorbic acid (AA) after 24h of dark and high light (1000 µmol m-2 s-1). The pictures were selected as the most representative from four independent replicates... 74 Figure 6. In situ localization of superoxide using NBT dye in NT and APX7/8 leaf
segments of rice plants exposed to control or 50 mM ascorbic acid (AA) after 24 h of dark. The pictures were selected as the most representative from four independent replicates... 75 Figure S1. Habitus of representative plants from four replicates (each replicate
represented by a pot containing two plants). Non-transformed (NT) and
OsApx7/8-silenced plants after 45 days of growth in a complete nutrient
solution under normal growth conditions……… 76 Figure S2. Characterization of chloroplastic OsAPX7 and OsAPX8 genes in
Apx7/8s silenced plants. (A) Expression of all OsAPX genes in Apx7/8s
plants at generation T2 compared to the expression observed in NT plants. (B) APX activity in NT and APX7/8-silenced leaf segments of rice plants under control conditions. Bars represent the average of 3 replicates ± SD. Different letters represent significant differences among the Apx7/8s silenced and NT plants……… 77 Figure S3. Appearance of leaf segments in NT rice plants exposed different acid
LISTA DE TABELAS
CAPÍTULO 2
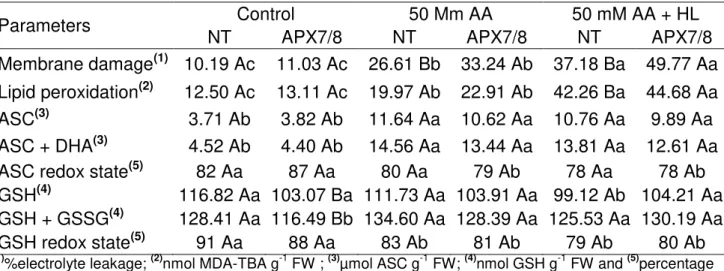
Table 1. Changes in membrane damage, lipid peroxidation, contents of ASC, ASC + DHA, GSH and total GSH, and redox state of ASC and GSH in non-transformed (NT) and APX7/8-silenced rice leaves, control and sprayed in absence or 10 mM ascorbic acid (AA) in presence of high light (1000 µmol m-2 s-1). Lowercase letters represent significant difference between treatments within genotypes and capital letters represent significant difference between genotypes within treatments at confidence level of 0.05. Data are average of 4 replicates ± SD and averages were compared
by Tukey’s test. ... 66 Table 2. Changes in membrane damage, lipid peroxidation, contents of ASC, ASC
+ DHA, GSH and total GSH, and redox state of ASC and GSH in non-transformed (NT) and APX7/8-silenced rice leaves, control and sprayed with 50 mM ascorbic acid (AA) in presence of high light (1000 µmol m-2 s-1) or moderate light (500 µmol m-2 s-1). Lowercase letters represent significant difference between treatments within genotypes and capital letters represent significant difference between genotypes within treatments at confidence level of 0.05. Data are average of 4 replicates ±
SD and averages were compared by Tukey’s test... 67 Table 3. Gas exchange and photochemical parameters of PSII and PSI in
non-transformed (NT) and APX7/8-silenced rice intact leaves, control and sprayed in absence or 10 mM ascorbic acid (AA) in presence of high light (1000 µmol m-2 s-1). Lowercase letters represent significant difference between treatments within genotypes and different capital letters represent significant difference between genotypes within treatments at a confidence level of 0.05. Data are average of 4 replicates ± SD and averages were
compared by Tukey’s test. ... 68 Table 4. Gas exchange and photochemical parameters of PSII and PSI in
different capital letters represent significant difference between genotypes within treatments at a confidence level of 0.05. Data are average of 4
LISTA DE ABREVIATURAS E SIGLAS
APX Peroxidase do Ascorbato AA Ácido ascórbico
ASC Ascorbato; ascorbato reduzido cAPX Peroxidase do Ascorbato citosólica CAT Catalase
chlAPX Peroxidase do Ascorbato cloroplástica CTE Cadeia de Transporte de Elétrons DHA Dehidroascorbato
DHAR Dehidroascorbato redutase EROs; ROS Espécies Reativas de Oxigênio FSI; PSI Fotossistema I
FSII; PSII Fotossistema II
GSH Glutationa; Glutationa reduzida GSSG Glutationa oxidada
mCTE Cadeia de Transporte de Elétrons mitocondrial MDHA Monodehidroascorbato
MDHAR Monodehidroascorbato redutase MV Metilviologênio
sAPX Peroxidase do Ascorbato do estroma SOD Superóxido Dismutase
SUMÁRIO
CAPÍTULO 1 ... 176
1 INTRODUÇÃO GERAL... 17
2 REFERENCIAL TEÓRICO ... 19
2.1 Modelo vegetal: arroz... 19
2.2 Estresse oxidativo: Espécies reativas de oxigênio ... 19
2.3 Processos fotossintéticos e produção de EROs ... 23
2.4 Estresse de alta luz ... 25
2.5 Ascorbato e peroxidase do ascorbato ... 26
3 HIPÓTESE E OBJETIVOS ... 33
3.1 Hipótese ... 33
3.2 Objetivo geral ... 33
3.3 Objetivos específicos... 33
REFERÊNCIAS ... 34
CAPÍTULO 2 ... 41
Abstract ... 42
1 INTRODUCTION ... 44
2 MATERIALS AND METHODS ... 46
2.1 Constructing the plant vector, plant transformation and growth conditions ... 46
2.2 Ascorbic acid and high light supplying in leaf segments ... 47
2.3 Ascorbic acid and high light supplying to entire plants ... 47
2.4 Gas exchange, chlorophyll a fluorescence and P700 absorption measurements ... 48
2.5 Electrolyte leakage and lipid peroxidation ... 48
2.6 H2O2 content determination ... 49
2.7 Determination of ascorbate and glutathione ... 49
2.8 Pigment determination ... 50
2.9 Enzymatic activity assays ... 50
2.10 Statistical analyses and experimental design ... 50
3 RESULTS ... 51
3.2 High light enhanced exogenous ascorbic acid toxicity and APX7/8 mutants were more sensitive than NT utilizing leaf segments ... 51 3.3 Exogenous AA toxicity was strongly enhanced by HL and APX7/8 mutants suffered higher oxidative stress compared with NT plants ... 52 3.4 High exogenous AA in presence of HL induced higher oxidative stress in APX7/8 plants but they presented similar oxidation-reduction states of ASC and GSH ... 53 3.5 Exogenous AA induces strong impairment in photochemical activity and CO2 assimilation under HL but APX7/8 mutant plants were similarly affected .. 55
C
APÍTULO1
1 INTRODUÇÃO GERAL
As plantas são continuamente expostas aos estresses ambientais, incluindo a luz alta, a irradiação UV, seca, salinidade, calor e frio. Estes estresses perturbam o equilíbrio metabólico das células, o que resulta numa maior produção de espécies reativas de oxigênio (EROs), tais como peróxido de hidrogénio (H2O2), o radical superóxido (O2-), o radical hidroxil (•OH) e oxigênio singleto, levando a danos oxidativos (ASADA 1999; MITTLER, 2002; SHIGEOKA et al. 2002; ISHIKAWA;
SHIGEOKA 2008). Recentemente tornou-se claro que as EROs também são reguladores-chave de muitos processos biológicos, tais como o crescimento, o ciclo celular, a morte celular programada, a sinalização hormonal, as respostas ao estresse abiótico e biótico, e desenvolvimento (MITTLER et al., 2004; FOYER;
NOCTOR, 2005; FUJITA et al., 2006). Portanto, o estado redox celular, que consiste
em um delicado equilíbrio entre a produção e remoção de EROs, deve ser estritamente controlado. O desbalanço entre a produção e eliminação destas EROs leva ao estresse oxidativo. (MÜLLER et al., 2001; GUO et al., 2006).
A fotorredução de oxigênio molecular através do fotossistema I (FSI) leva à formação de O2-, que, por sua vez, torna-se rapidamente dismutado a H2O2, quer espontaneamente ou por via enzimática por meio da superóxido dismutase (SOD) (ASADA, 1999). O H2O2 é então convertido em água pela peroxidase do ascorbato (APX). Embora o nível das EROs seja utilizado como indicador do nível de estresse sofrido pela planta, o conteúdo destes precisa ser mantido sob controle a fim de evitar seus efeitos danosos (MITTLER, 2002; MOLLER et al., 2007). Para tal, a
célula possui um sistema de defesa compostos por antioxidantes enzimáticos e não enzimáticos que são responsáveis em manter os níveis aceitáveis das EROs levando a proteção contra danos oxidativos (del RIO et al., 2002; VRANOVÁ et al.,
2002).
Nas células vegetais, a síntese do ascorbato (ASC) é comum em plantas superiores. O ASC é considerado um dos principais compostos antioxidantes solúveis ativamente sintetizadas em tecidos verdes, bem como em órgãos de armazenamento, e é formada em plantas através de várias vias de biossíntese (MASTROPASQUA et al., 2012). O ASC está envolvido em muitos processos
hidrogênio na reação catalisada pela APX, ou primariamente, pela interação direta com diferentes EROs, como o H2O2, O2-, •OH, 1O2 e hidroperóxidos de lipídios (SMIRNOFF, 1996; NOCTOR; FOYER, 1998; SHAO et al., 2008).
O ASC é uma das primeiras linhas de defesa oxidativa e o seu sistema redox, constituído pelos diferentes estados de oxidação da molécula, é um importante mecanismo de manutenção do estado redox celular, sob condições fisiológicas normais ou de estresses (NOCTOR; FOYER, 1998). O ácido L-ascórbico é o antioxidante primário solúvel em água, em plantas e animais. Dada a importância desta vitamina para a saúde animal e vegetal, o aumento do teor de ascorbato têm sido o objetivo de muitos estudos para melhorar o valor nutritivo das plantas e suas respostas ao estresse (CHEN et al., 2003; HANCOCK; VIOLA, 2005; NAQVI et al.,
2009).
2 REFERENCIAL TEÓRICO
2.1 Modelo vegetal: arroz
O arroz está entre os cereais mais consumidos do mundo (MAPA, 2014), caracterizando-se como principal alimento para mais da metade da população mundial. É a terceira maior cultura cerealífera do mundo, apenas ultrapassado pelo milho e pelo trigo. O arroz cultivado é uma planta herbácea incluída na classe Liliopsida (Monocotiledônea), ordem Poales, família Poaceae, gênero Oryza. O arroz
(Oryza sativa L.) é uma gramínea anual, classificada no grupo de plantas C3,
adaptada a ambientes aquáticos. Esta adaptação é devido à presença de aerênquima no colmo e nas raízes das plantas, possibilitando a passagem de oxigênio do ar para a camada da rizosfera (SOSBAI, 2005).
Foram identificados no genoma do arroz oito genes que codificam para a enzima APX, APXs de 1 a 8, e variam de acordo com a localização subcelular: APX1 e APX2 são codificadores das APXs citosólicas; APX3 e APX4, das peroxissomais; APX5 e APX6, das mitocondriais; e APX7 e APX8, das cloroplastídicas (TEIXEIRA
et al., 2004; 2006). O estudo de como a ausência de um dos genes codificadores de
APX pode alterar o metabolismo oxidativo de plantas transformadas de arroz aparenta ser um enfoque importante.
2.2 Estresse oxidativo: Espécies reativas de oxigênio
O termo estresse oxidativo ainda carece de uma definição precisa, mas as características principais são: (1) aumento da carga oxidativa (aumento da produção de EROs); (2) o potencial de oxidação descontrolada devido a taxas de produção serem superiores as taxas de metabolismo; (3) o dano oxidativo aos componentes celulares, o que pressupõe que a taxa de oxidação é superior a reparação ou substituição; causando (4) a acumulação de componentes celulares danificados de alguma forma que conduzem à perda de função e eventual morte (FOYER; NOCTOR, 2011).
produzidas em diferentes compartimentos celulares, tais como cloroplastos, mitocôndrias, peroxissomos, membrana plasmática, entre outros. Quando produzidos em excesso, prejudicam a homeostase metabólica através de danos oxidativos a lipídeos (destruindo as membranas lipídicas), proteínas e ácidos nucléicos, por serem altamente reativos a estes tipos de moléculas (McCORD, 2000; APEL; HIRT, 2004; MUNNS, 2005; SHARMA et al., 2012). As EROs controlam
várias vias de sinalização em plantas envolvidas nas respostas a estresses e patógenos, fotossíntese, morte celular programada, a ação hormonal, crescimento e desenvolvimento (SCANDALIOS, 2002; APEL; HIRT, 2004).
As EROs superóxido (O2•-) e oxigênio singleto (1O2) são produzidas nos cloroplastos pela fotorredução de oxigênio e transferência de energia da clorofila no estado excitado tripleto ao oxigênio, respectivamente. O peróxido de hidrogênio (H2O2) e radicais hidroxil (•OH) podem se formar como resultado das reações de O2•. Normalmente, os níveis de EROs em plantas são regulados pelos sistemas antioxidantes e mantido a um nível constante (WANG et al., 2013).
O dano por EROs é um dos principais mecanismos subjacentes aos estresses bióticos e abióticos, incluindo secas, luz alta, ferimento, sal, ou infecção por patógeno (KARPINSKI et al., 1997; NOCTOR; FOYER, 1998; MITTLER et al.,
2004). As células desenvolveram mecanismos altamente regulados para manter um equilíbrio entre a produção e a destruição de EROs (MILLER et al., 2007). Esta rede
é composta por mais de 150 genes que codificam para proteínas produtoras de EROs tais como NADPH oxidases e enzimas de limpeza de EROs tais como superóxido dismutase (SODs), catalases (CATs), e as peroxidases do ascorbato (APXs) (MITTLER et al., 2004).
Entre as diferentes EROs, o H2O2 é o menos reativo (Figura 1). No entanto, ainda não há consenso sobre os teores foliares prováveis ou concentrações em diferentes compartimentos intracelulares, e a quantificação do mesmo desta relativamente estável EROs é problemática por causa de uma série de potenciais artefatos, por exemplo, ligados a ascorbato (QUEVAL et al., 2008; VELJOVIC–
Figura 1 – Resumo simples das principais espécies químicas de oxigênio (A) e os dois caminhos principais de redução de oxigênio (B).
Fonte: Adaptado de FOYER; NOCTOR, 2009.
O esquema mostra apenas as principais formas pensadas para existir em condições fisiológicas. As formas protonadas de superóxido e formas desprotonadas de H2O2 também existem.As reatividades
relativas dos diferentes ROS são indicadas por asteriscos em (A). O termo “ROS” se refere a
qualquer espécie de oxigênio tripleto que é mais reativa que o O2; um radical é definido como uma
molécula que transporta um elétron não emparelhado; um íon refere-se a um composto que transporta uma carga (isto é, o número total de elétrons não é igual ao número total de prótons).
poliaminas têm sido descritos na defesa de morte celular programada em respostas ao estresse abiótico (MOSCHOU et al., 2008).
Apesar da grande eficiência antioxidante, o ascorbato também age paradoxalmente como pró-oxidante in vitro. Soluções de ascorbato e ferro são
usadas há décadas para induzir modificações oxidativas em lipídios, proteínas e DNA (HALLIWELL; GUTTERIDGE, 1999). Assim, o ácido ascórbico pode atuar como catalisador na reação de Fenton, promovendo a redução de íons férricos em íons ferrosos, conforme mostrado na equação 2 e 3 (reação entre um antioxidante e com radicais livres e com íon férrico). Portanto, o ácido ascórbico pode ser tanto um antioxidante, quanto um pró-oxidante dependendo das condições (DENISOV;
AFANAS’EV, β005).
AH2 + R. AH. + RH (2)
AH2 + Fe3+ AH. + Fe2+ + H+ (3) Enquanto o oxigênio singleto e radical hidroxil são pensados para ser
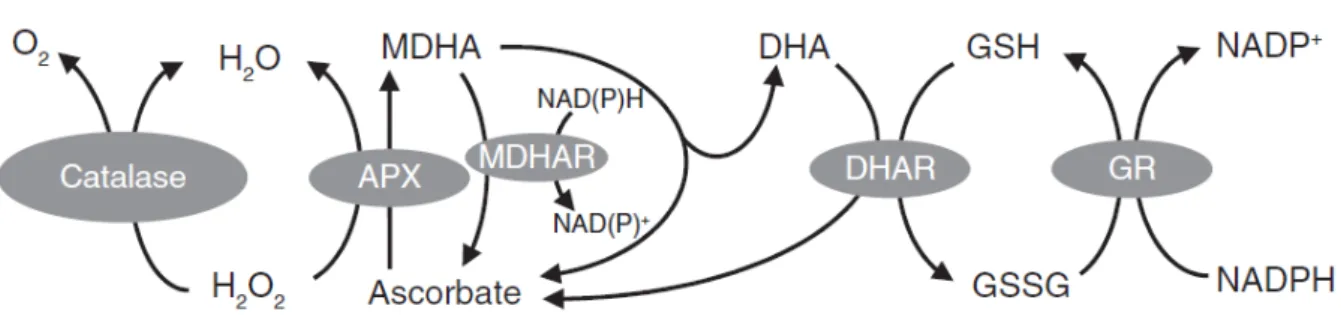
Figura 2– Duas das principais vias para o metabolismo de H2O2 em plantas.
Fonte: FOYER; NOCTOR, 2009.
APX, peroxidase do ascorbato; DHAR, dehidroascorbato redutase; GR, glutationa redutase; GSH, glutationa; GSSG, glutationa oxidada; MDHAR, monodehidroascorbato redutase.
O ciclo ascorbato-glutationa (ASC-GSH) tem uma função importante na eliminação de H2O2, e o metabolismo do ciclo ASC-GSH pode ser estimulado em plantas por moderar as condições de estresse para eliminar EROs (RAO et al.,
1995). O ácido ascórbico e a glutationa, dois antioxidantes de baixo peso molecular, são envolvidos em reações do ciclo de ASC-GSH e são de grande importância para a preservação de uma ampla gama de processos metabólicos (DRAZKIEWICZ et al.,
2003). Eles são associados com o equilíbrio redox celular, e as proporções de ASC/DHA e GSH/GSSG pode funcionar como sinais para a regulação dos mecanismos antioxidantes (MITTLER, 2002).
2.3 Processos fotossintéticos e produção de EROs
A fotossíntese é uma fonte bem estabelecida de EROs em plantas. A cadeia de transporte de elétrons (CTE) opera em um ambiente aeróbio; assim, os sistemas de regulação são necessários para minimizar a produção de EROs. Além disso, uma rede de antioxidante eficaz também é essencial, a fim de processar eficazmente EROs e para manter o pool de EROs intracelulares em níveis baixos. A importância da rede antioxidante na manutenção de altas taxas de fotossíntese foi demonstrada em muitos estudos usando a abordagem de genética molecular tanto para desativar, aumentar as atividades de enzimas antioxidantes ou alterar a abundância de antioxidantes de baixo peso molecular, como ascorbato (ASC) e glutationa reduzida (GSH) (FOYER; SHIGEOKA, 2011).
papéis de EROs nas respostas das plantas ao estresse têm sido sobre os tecidos fotossintetizantes. É frequentemente afirmado que o teor de oxigênio dos cloroplastos é significativamente mais elevado do que o resto da célula fotossintética (ASADA, 1999, 2006). É interessante notar, no entanto, que, apesar de cloroplastos gerar oxigênio na face interior da membrana do tilacóide, ainda há tão poucas provas que tanto o tilacóide ou membranas envelope dos cloroplastos apresentam uma barreira significativa para a difusão do oxigênio. De longa data os dados experimentais sugerem que a evolução do O2 na fotossíntese faz com que haja apenas um aumento modesto nas já elevadas concentrações de O2 nos cloroplastos [~20% durante a fotossíntese (STEIGER et al., 1977)]. No entanto, as células
fotossintéticas têm indiscutivelmente várias vias produtoras de EROs únicas e uma multiplicidade de sistemas de metabolização de EROs.
A alta concentração de EROs pode causar alterações no metabolismo vegetal devido a uma restrição dos processos fotossintéticos (CATTIVELLI et al.,
2008). O dano oxidativo a qualquer parte dos fotossistemas diminui a eficiência e a taxa máxima de fotossíntese, um processo chamado de fotoxidação ou fotoinibição (KOK, 1956; MATSUBAR; CHOW, 2004). As alterações causadas ao processo fotossintético em plantas sob condições de estresse levam a uma produção excessiva de EROs. Na ausência de mecanismos eficientes de proteção (enzimáticos ou não), o metabolismo pode ser seriamente alterado e resultar em danos oxidativos (PAN et al., 2006).
Dentro do contexto da hipótese de "dano induzido pelo estresse oxidativo", a proteção adicional da fotossíntese durante o estresse, que têm sido obtido através do reforço da rede antioxidante do cloroplasto, fornece evidências de que é possível reduzir as reações potencialmente nocivas causadas pela carga oxidativo (LOGAN et al., 2006). Por exemplo, plantas de tabaco transgênico
(Nicotiana tabacum) e Arabidopsis com superexpressão da APX ligada à membrana
2.4 Estresse de alta luz
A luz é um dos fatores ambientais essenciais para as plantas (MA et al.,
2014). Plantas expostas à luz excessiva podem sofrer fotoinibição, sérios danos ao aparato fotossintético e degradação de proteínas de fotossíntese. Estresse de luz também pode levar à acumulação de EROs e ativação de enzimas antioxidantes (MITTLER, 2002).
Condições de luz alta desencadeia o excesso de redução da cadeia de transporte de elétrons com subsequente formação de EROs. O quenching não
fotoquímica (NPQ) reduz a pressão de elétrons dirigido pela luz e geração de EROs nos fotossistemas I e II. O oxigênio singleto é gerado no FSII e ânions superóxido no FSI. A desintoxicação de EROs neutraliza os desequilíbrios redox e mantém a aptidão da planta. No cloroplasto, SOD catalisa a síntese de H2O2 e O2 a partir de duas moléculas de O2-. O H2O2 é desintoxicado pela via dependente de ascorbato usando APX ou a via independente de ascorbato usando oxidases de tiol, tais como peroxirredoxinas (ALSHARAFA et al., 2014).
As respostas das isoenzimas de APX para estresse fotoxidativo foram estudadas em folhas de espinafre durante estresse de alta luz. A atividade e transcrições da APX citosólicas foram aumentadas durante o estresse de alta luz, porém os níveis de proteína não foram alterados. As atividades das isoformas de APX cloroplásticas (chlAPXs) mostrou um decréscimo gradual, ao passo que as outras isoenzimas não mostraram nenhuma variação significativa nos níveis de transcrição e de proteínas, assim como a atividade (YOSHIMURA et al., 2000). No
trigo, uma linha mutante mostrando diminuição da atividade da APX tilacoidal (tAPX) apresentaram redução na atividade fotossintética e acúmulo de biomassa quando cultivado sob alta intensidade de luz, o que sugere que tAPX é essencial para a fotossíntese (DANNA et al., 2003). Mutantes individuais de Arabidopsis que faltam
tAPX ou APX do estroma apresentaram níveis mais elevados de H2O2 e proteínas oxidadas do que as plantas não transformadas quando expostos a estresse de alta luz e metilviologênio (MV). O efeito mais forte de estresse fotoxidativo foi observado em plantas que faltam tAPX, estas mostrando aumento do acúmulo de H2O2 e proteínas oxidadas (MARUTA et al., 2010). Quando folhas maduras de duplos
susceptibilidade (KANGASJARVI et al., 2008). Estes resultados indicam que as
isoformas de APXs são indispensáveis sob estresses ambientais em diferentes espécies, especialmente sob condições de estresse de luz.
2.5 Ascorbato e peroxidase do ascorbato
Ascorbato: A molécula, que levanta novas questões e fornece novas descobertas continuamente. O conhecimento sobre o seu papel convencional, mas crucial na defesa antioxidante, bem como na proteção de estresse se aprofundou (CONKLIN et al., 1996; SZARKA et al., 2012).
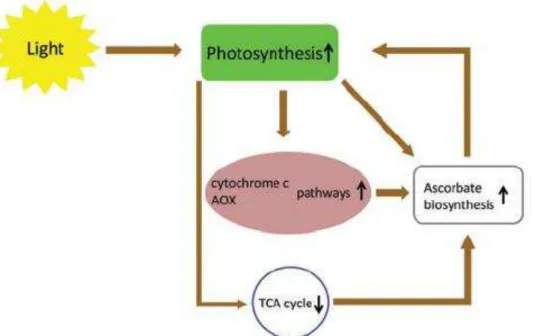
Figura 3 – A rede ascorbato - fotossíntese - respiração - ciclo TCA.
Fonte: SZARKA et al., 2013.
O fluxo de elétrons através da CTE fotossintética aumento das capacidades do citocromo c mitocondrial, das vias de AOX, e da biossíntese de ácido ascórbico. Além disso, a atividade da própria AOX aumenta a taxa de biossíntese do ascorbato. Uma vez que o ascorbato é sintetizado firmemente acoplado à CTE mitocondrial, a oxidação da L-galactono-1,4-lactona para ascorbato proporciona elétrons do complexo IV, no caso de inibição do ciclo do TCA.A sobrecarga redutora da respiração pode ser diminuída em função da inibição do ciclo do TCA e ciclo TCA ligada à respiração durante condições de luz.A inibição do ciclo do TCA (por abordagens genéticas) é acompanha pelo aumento dramático nos níveis de ascorbato. O ascorbato pode elevar a intensidade da fotossíntese por seus múltiplos papéis na fotoproteção.Quaisquer mudanças em qualquer um desses elementos desta rede influenciar os demais. AOX, oxidase alternativa.
O ASC está presente na maior parte dos compartimentos da célula, incluindo citosol, cloroplastos, mitocôndrias e vacúolos, além da matriz extracelular; a distribuição de ASC nos diferentes compartimentos foi determinada recentemente em folhas de Arabidopsis, por imunomarcação utilizando um anticorpo criado contra ASC acoplado a albumina sérica bovina (ZECHMANN et al., 2011). As
concentrações mais elevadas foram encontradas no citosol (20-60 mM) e peroxissomos (cerca de 20 mM). A exposição à luz elevada aumentou a sua concentração no citosol, cloroplastos (a partir de 10 a 20 mM) e vacúolo (de 2 a 12 mM) (TÓTH et al, 2013). Outros estudos avaliam que as concentrações de ASC
transporte do ASC são necessários para manter a concentração de ASC em várias organelas e tecidos (YOSHIMURA et al., 2014).
O ASC é um antioxidante eficaz, porque tem um baixo potencial de redução e, portanto, podem reagir com uma variedade de oxidantes e radicais biologicamente relevantes (CARR; FREI, 1999). Além disso, monodehidroascorbato (MDHA) tem uma reatividade baixa devido à estabilização de ressonância de seu elétron não emparelhado e prontamente catalisa a ascorbato e dehidroascorbato (DHA) (TÓTH et al., 2013). Juntamente com a glutationa, o ASC também participa
da remoção enzimática de EROs na chamada "reação de Mehler" ou "ciclo água-água".
A reação de Mehler é uma importante fonte de EROs nos cloroplastos de plantas expostas à luz (ASADA, 1999). Nesta reação, a fotorredução do oxigênio molecular através do FSI leva à formação de O2-, que, por sua vez, torna-se rapidamente dismutado a H2O2, quer espontaneamente ou por via enzimática por meio da SOD (ASADA, 1999). O H2O2 é então convertido em água pela APX. A reação geral de transferência de elétrons é referida como o ciclo água-água (ASADA, 1999). Uma APX solúvel está presente no estroma do cloroplasto (sAPX), enquanto que uma outra APX está ancorada na membrana tilacóide (tAPX) através de um domínio transmembranar do terminal C, com seu sítio catalítico voltado para o estroma (SHIGEOKA et al., 2002, ISHIKAWA; SHIGEOKA, 2008).
prejudicado, por exemplo, sob luz alta (MANO et al., 1997, 2004), com fotorredução
de MDHA por ferrodoxina (Fd) (Figura 4) mantendo o transporte de elétrons quando NAPD+ é limitante (FORTI e EHRENHEIM, 1993; GRACE et al, 1995.).
O ascorbato têm sido classificado como componente chave do sistema antioxidativo das plantas, estando relacionado aos estresses bióticos a abióticos (SMIRNOFF et al., 2001; DIPIERRO et al., 2005). A peroxidase do ascorbato
desempenha um papel importante na regulação dos níveis de EROs celulares e são componentes centrais das redes de eliminação de peróxido de hidrogênio (SUZUKI
et al., 2013). As APXs são enzimas de ligação do heme, que reduzem o peróxido de
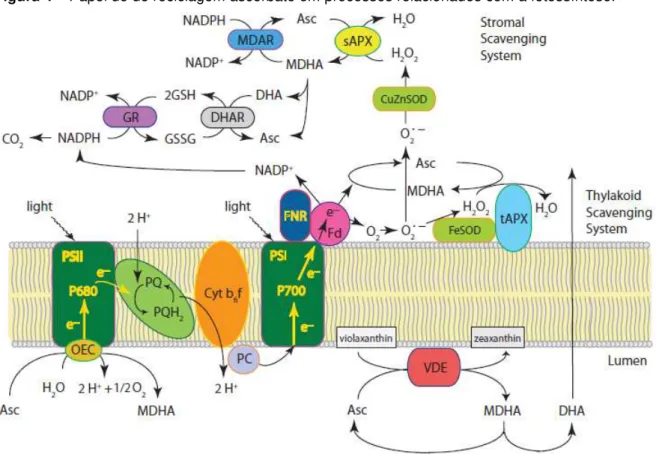
Figura 4– Papel de do reciclagem ascorbato em processos relacionados com a fotossíntese.
Fonte: GALLIE, 2013.
O transporte de elétrons através de FSII e FSI na membrana tilacóide é mostrado. A transferência de elétrons da ferredoxina (Fd) no FSI para O2 gerando superóxido (O2•-) constitui a Reação de Mehler.
Embora não mostrado, MDAR pode também reduzir O2 para O2•- no FSI. A FeSOD e a tAPX, ambas
associadas a membrana tilacoidal, são parte do sistema de eliminação de EROs do tilacóide e desentoxificam o superóxido gerado no fotossistema I. Apesar de não mostrada, uma SOD cobre zinco (CuZnSOD) direcionada ao cloroplasto e associada ao tilacóide funciona no sistema de defesa antioxidante do mesmo. A peroxidase do ascorbato estromal (sAPX), CuZnSOD, MDAR, DHAR e GR constituem o sistema limpeza estromal. Enquanto ASC pode doar elétrons aos fotossistemas e é usado como um cofator para a violaxantina de-epoxidase (VDE), nenhum sistema de reciclagem do ASC está presente no lúmen tilacoidal. MDHA lumenal disprotona-se não-enzimaticamente em ASC e DHA, que é transportado para o estroma. PSII, fotossistema II; OEC, complexo em evolução de oxigênio; P680, dímero de clorofila especializada referente ao fotossistema II; PQ, plastoquinona; cit b6f, complexo citocromo b6f; PC, plastocianina; PSI, fotossistema I; P700, dímero de clorofila especializada referente ao fotossistema I; FNR, Fd-NADP+ redutase; ASC, ascorbato.
Estudos têm mostrado que APXs desempenham um importante papel na remoção de EROs em plantas (SCANDALIOS, 2002). Em Arabidopsis, APXs citosólicas (cAPXs) são fundamentais para homeostase celular e desempenham um papel importante na proteção oxidativa de cloroplastos sob estresses abióticos, incluindo alta luz, calor, metilviologênio e estresse hídrico (KOUSSEVITZKY et al.,
2008; PNUELI et al., 2003). Em comparação com a catalase (outra enzima
baixas concentrações de APX devido a sua elevada afinidade para o H2O2, esta enzima é capaz de regular finamente estes EROs (De GARA et al., 2010).
A APX foi identificada em muitas plantas superiores, onde a natureza multigênica desta enzima têm sido revelada. Uma variedade de isozimas de APX foi observada no citoplasma, estroma do cloroplasto e tilacóides, onde a expensas de ascorbato, estas isozimas removem H2O2 e protegem as células das plantas contra os potenciais efeitos destrutivos de H2O2 (SHIGEOKA et al., 2002). A reação
catalisada por APX é a seguinte:
C6H8O6 (ascorbato) + H2O2 C6H6O6 (DHA) + H2O (1) As sequências genômicas de cDNA da APX foram obtidas a partir de uma grande variedade de espécies de plantas, mostrando que APX estão amplamente distribuídas no reino vegetal. As diferentes isoformas são classificadas de acordo com sua localização subcelular. As isoformas solúveis são encontradas no citossol (cAPX), mitocôndria (mitAPX) e estroma do cloroplasto (sAPX), enquanto que as isoformas ligadas à membrana são encontradas em peroxissomos e glioxissomos (mAPX) e tilacóides do cloroplastos (tAPX) (CAVERZAN et al., 2012).
As APXs foram parcialmente caracterizadas em algumas espécies de plantas.Na planta modelo Arabidopsis thaliana L., a presença de nove genes APX
foi descrito (CHEW et al., 2003). Em outro importante modelo de planta, o arroz, a
família de gene APX é composta por oito membros (TEIXEIRA et al., 2004; 2006).
As isoenzimas APX são instáveis na ausência do ascorbato. Assim, elevado nível de ascorbato endógeno é essencial para manter a eficácia do sistema antioxidante que protege as plantas de danos oxidativos (SHIGEOKA et al., 2002).
Estudos recentes utilizando mutantes de Arabidopsis nocauteados (KO-tAPX e KO-sAPX) sem (KO-tAPX e sAPX tem confundido a compreensão da função fisiológica de chlAPXs na fotoproteção. Verificou-se que os mutantes individuais KO-tAPX e KO-sAPX e até mesmo os duplos mutantes não apresentaram sintomas visíveis de estresse após longo prazo (1-14 d) da exposição à alta luz (2000 µmol fótons m-2 s-1) (GIACOMELLI et al. 2007). Além disso, a falta de chlAPXs não afetou os níveis e/ou estado redox de H2O2, ascorbato, glutationa e a atividade de transporte de elétrons nas mesmas condições de alta luz (GIACOMELLI et al. 2007).
Por outro lado, Kangasjärvi et al. (2008) relataram que, embora os mutantes simples
KO-tAPX e KO-sAPX apresentaram fenótipos semelhantes aos das plantas de tipo selvagem sob forte estresse fotoxidativo (50 uM MV sob alta luz), os duplos
mutantes exibiram fenótipos graves sob as mesmas condições. Além disso, os níveis de vazamento de íons e a atividade de transporte de elétrons fotossintéticos nos mutantes individuais foram semelhantes aos do tipo selvagem (KANGASJÄRVI et
al., 2008). Estes resultados sugerem que chlAPXs podem não ser uma enzima
3 HIPÓTESE E OBJETIVOS
3.1 Hipótese
O suprimento externo de ascorbato irá favorecer o ciclo água-água, aumentando a atividade da peroxidase do ascorbato do cloroplasto (APX7/8), minimizando os danos oxidativo e favorecendo a fotossíntese, sendo as plantas silenciadas nas APX7/8 mais beneficiadas.
3.2 Objetivo geral
Avaliar a participação do ascorbato na atividade fotoquímica e na fotoproteção de plantas de arroz duplamente silenciadas para os genes OsAPX7 e OsAPX8.
3.3 Objetivos específicos
Comparar o estado geral de plantas tipo selvagem e mutantes OsAPX7/8.
Avaliar o desempenho de plantas de arroz tipo selvagem e silenciadas para o gene OsAPX7/8 quando submetidas a diferentes doses de ascorbato e
diferentes comprimentos de onda de luz (alta e baixa luminosidade).
Entender o grau de participação das APXs cloroplásticas (estromal e tilacóidal) em resposta a estresses.
Diferenciar o desempenho fotossintético entre as plantas silenciadas
OsAPX7/8 e plantas não transformadas submetidas aos tratamentos.
Avaliar o grau de relação do ascorbato exógeno nas plantas de arroz tipo selvagem e OsAPX7/8 submetidas à alta luz (fotoproteção) e se o ascorbato
REFERÊNCIAS
ALLEN, J.F.; HALL D.O. The relationship of oxygen uptake to electron transport in photosystem I of isolated chloroplasts: The role of superoxide and ascorbate.
Biochemical and Biophysical Research Communications, v. 58, p. 579–585, 1974.
ALSHARAFA, K.; VOGEL, M.O.; OELZE, M.L.; MOORE, M.; STINGL, N.; KÖNIG, K.;
et al. Kinetics of retrograde signalling initiation in the high light response of
Arabidopsis thaliana. Philosophical transactions of the Royal Society B, v. 369, p. 1–9, 2014.
APEL, K.; HIRT, H. Reactive oxygen species: Metabolism, oxidative stress, and signal transduction. Annual Review of Plant Biology, v. 55, p. 373–399, 2004.
ASADA, K. The water–water cycle in chloroplasts: scavenging of active oxygen and dissipation of excess photons. Annual Review of Plant Physiology and Plant Molecular Biology, v. 50, p. 601–639, 1999.
ASADA, K. Production and scavenging of reactive oxygen pecies in chloroplasts and their functions. Plant Physiology, v. 141, p. 391–396, 2006
CARR, A.; FREI, B. Does vitamin C act as a pro-oxidant under physiological conditions? The FASEB Journal, v. 13, p. 1007–1024, 1999.
CATTIVELLI, L.; RIZZA, F.; BADECK, F.W.; MAZZUCOTELLI, E.; MASTRANGELO, A.M.; FRANCIA, E.; MARÉ, C.; TONDELLI, A.; STANCA, A.M. Drought tolerance improvement in crop plants: An integrated view from breeding to genomics. Field Crops Research, v. 105, p. 1–14, 2008.
CAVERZAN, A.; PASSAIA, G.; ROSA, S.B.; RIBEIRO, C.W.; LAZZAROTTO, F.; MARGIS-PINHEIRO, M. Plant responses to stresses: role of ascorbate peroxidase in the antioxidant protection. Genetics and Molecular Biology, v. 35, p. 1011–1019, 2012.
CHEN, Z.; YOUNG, T.E.; LING, J.; CHANG, S-C; GALLIE, D.R. Increasing vitamin C content of plants through enhanced ascorbate recycling. Proceedings of the National Academy of Sciences, v. 100, p. 3525–3530, 2003.
CHEW, O.; WHELAN, J.; MILLAR, A.H. Molecular definition of the ascorbate-glutathione cycle in Arabidopsis mitochondria reveals dual targeting of antioxidant defenses in plants. The Journal of Biological Chemistry, v. 278, p. 46869–46877, 2003.
DANNA, C.H.; BARTOLI, C.G.; SACCO, F.; INGALA, L.R.; SANTA-MARIA, G.E.; GUIAMET, J.J.; UGALDE, R.A. Thylakoid-bound ascorbate peroxidase mutant exhibits impaired electron transport and photosynthetic activity. Plant Physiology, v. 132, p. 2116–2125, 2003.
DENISOV, E.T.; AFANAS’EV, I.B. Oxidation and antioxidants in organic chemistry and biology. Boca Raton: CRC Taylor & Francis Group, 2005. 981p.
De GARA, L.; LOCATO, V.; DIPIERRO, S.; de PINTO, M.C. Redox homeostasis in plants. The challenge of living with endogenous oxygen production. Respiratory Physiology & Neurobiology, v. 173, p. S13–S19, 2010.
del RIO, L.A.; CORPAS, F.J.; SANDALIO, L.M.; PALMA, J.M.; GOMEZ, M.; BARROSO, J.B. Reactive oxygen species, antioxidant systems and nitric oxide in peroxisomes. Journal of Experimental Botany, v. 53, p. 1255–1272, 2002.
DIPIERRO, N.; MONDELLI, D.; PACIOLLA, C.; BRUNETTI, G.; DIPIERRO, S. Changes in the ascorbate system in the response of pumpkin (Cucurbita pepo L.)
roots to aluminium stress. Journal of Plant Physiology, v. 162, p. 529–536, 2005.
DRAZKIEWICZ, M.; POLIT, E.S.; KRUPA, Z. Response of the ascorbate–glutathione cycle to excess copper in Arabidopsis thaliana (L.). Plant Science, v. 164, p. 195–
202, 2003.
FORTI, G.; EHRENHEIM, A.M. The role of ascorbic acid in photosynthetic electron transport. Biochimica et Biophysica Acta, v. 1183, p. 408–412, 1993.
FOYER, C.H.; HALLIWELL, B. The presence of glutathione and glutathione reductase in chloroplasts: A proposed role in ascorbic acid metabolism. Planta, v. 133, p. 21–25, 1976.
FOYER, C.H. Oxygen metabolism and electron transport in photosynthesis. In:
Oxidative Stress and the Molecular Biology of Antioxidant Defenses, edited by Scandalios JG. New York: Cold Spring Harbor, p. 587–621, 1997.
FOYER, C.H.; NOCTOR, G. Redox homeostasis and antioxidant signaling: a metabolic interface between stress perception and physiological responses. Plant Cell, v. 17, p. 1866–1875, 2005.
FOYER, C.H.; NOCTOR, G. Redox Regulation in Photosynthetic Organisms: Signaling, Acclimation, and Practical Implications. Antioxidants & Redox Signaling, v. 11, p. 861–905, 2009.
FOYER, C.H; NOCTOR, G. Ascorbate and Glutathione: The Heart of the Redox Hub1. Plant Physiology, v. 155, p. 2–18, 2011.
FUJITA, M.; FUJITA, Y.; NOUTOSHI, Y.; TAKAHASHI, F.; NARUSAKA, Y.; YAMAGUCHI-SHINOZAKI, K. Crosstalk between abiotic and biotic stress responses: a current view from the points of convergence in the stress signaling networks.
Current Opinion in Plant Biology, v. 9, p. 436–442, 2006.
GALLIE, D.R. The role of l-ascorbic acid recycling in responding to environmental stress and in promoting plant growth. Journal of Experimental Botany, v. 64, p. 433–443, 2013.
GIACOMELLI, L.; MASI, A.; RIPOLL, D.R.; LEE, M.J.; VAN WIJK, K.J. Arabidopsis thaliana deficient in two chloroplast ascorbate peroxidases shows accelerated light-induced necrosis when levels of cellular ascorbate are low. Plant Molecular Biology, v. 65, p. 627–644, 2007.
GRACE, S.C.; PACE, R.; WYDRZYNSKI, T. Formation and decay of monodehydroascorbate radicals in illuminated thylakoids as determined by ESR spectroscopy. Biochimica et Biophysica Acta, v. 1229, p. 155–165, 1995.
GUO, Y.P.; ZHOU, H.F.; ZHANG, L.C. photosynthetic characteristics and protective mechanisms against photoxidation during high temperature stress in two citrus species. Scientia Horticulturae, v. 108, p. 260–267, 2006.
HALLIWELL, B.; GUTTERIDGE, J.M.C. Free Radicals in Biology and Medicine, 4th ed. Claredon Press: Oxford, 1999. 704p.
HANCOCK, R.D.; VIOLA, R. Improving the nutritional value of crops through enhancement of l-ascorbic acid (vitamin C) content: rationale and biotechnological opportunities. Journal of Agricultural and Food Chemistry, v. 53, p. 5248–5257, 2005.
HEIBER, I.; CAI, W.; BAIER, M. Linking Chloroplast Antioxidant Defense to Carbohydrate Availability: The Transcript Abundance of Stromal Ascorbate Peroxidase Is Sugar-Controlled via Ascorbate. Molecular Plant, v. 7, p. 58–70, 2014.
ISHIKAWA, T.; SHIGEOKA, S. Recent advances in ascorbate biosynthesis and the physiological significance of ascorbate peroxidase in photosynthesizing organisms.
Bioscience, Biotechnology, and Biochemistry, v. 72, p. 1143–1154, 2008.
KANGASJARVI, S.; LEPISTO, A.; HANNIKAINEN, K.; PIIPPO, M.; LUOMALA, E.M.; ARO, E.M.; RINTAMAKI, E. Diverse roles for chloroplast stromal and thylakoid-bound ascorbate peroxidases in plant stress responses. Biochemical Journal, v. 412, p. 275–285, 2008.
KOK, B. On the inhibition of photosynthesis by intense light. Biochimica et Biophysica Acta, v. 21, p. 234-244, 1956.
KOUSSEVITZKY, S.; SUZUKI, N.; HUNTINGTON, S.; ARMIJO, L.; SHA, W.; et al.
Ascorbate peroxidase 1 plays a key role in the response of Arabidopsis thaliana to stress combination. The Journal of Biological Chemistry, v. 283, p. 34197–34203, 2008.
LOGAN, B.A.; KORNYEYEV, D.; HARDISON, J.; HOLADAY, A.S. The role of antioxidant enzymes in photoprotection. Photosynthesis Research, v. 88, p. 119–
132, 2006.
MA, G.; ZHANG, L.; SETIAWAN, C.H.; YAMAWAKI, K.; ASAI, T.; NISHIKAWA, F.; et al. Effect of red and blue LED light irradiation on ascorbate content and expression of
genes related to ascorbate metabolism in postharvest broccoli. Postharvest Biology and Technology, v. 94, p. 97–103, 2014.
MANO, J.; USHIMARU, T.; ASADA, K. Ascorbate in thylakoid lumenas an endogenous electron donor to photosystem II: protection of thylakoids from photoinhibition and regeneration of ascorbate in stroma by dehydroascorbate reductase. Photosynthesis Research, v. 53, p. 197–204, 1997.
MANO, J.; HIDEG, E.; ASADA, K.. Ascorbate in thylakoid lumen functions as an alternative electron donor to photosystem II and photosystem I. Archives of Biochemistry and Biophysics, v. 429, p. 71–80, 2004.
MAPA, Ministério da Agricultura, Pecuária e Abastecimento. Disponível em: < http://www.agricultura.gov.br/vegetal/culturas/arroz> Acessado em: 03 de Junho de 2014.
MARUTA, T.; TANOUCHI, A.; TAMOI, M.; YABUTA, Y.; YOSHIMURA, K.; ISHIKAWA, T.; SHIGEOKA, S. Arabidopsis chloroplastic ascorbate peroxidase isoenzymes play a dual role in photoprotection and gene regulation under photooxidative stress. Plant & Cell Physiology, v. 51, p. 190–200, 2010.
MASTROPASQUA, L.; BORRACCINO, G.; BIANCO, L.; PACIOLLA, C. Light qualities and dose influence ascorbate pool size in detached oat leaves. Plant Science, v. 183, p. 57–64, 2012.
MATSUBARA, S.; CHOW, W.S. Populations of photoinactivated photosystem II reaction centers characterized by chlorophyll a fluorescence lifetime in vivo.
Proceedings of the National Academy of Sciences, v. 101, p. 18234–18239, 2004.
McCORD, J.M.; The evolution of free radicals and oxidative stress. The American Journal of Medicine, v. 108, p. 652–659, 2000.
MILLER, G.; SUZUKI, N.; RIZHSKY, L.; HEGIE, A.; KOUSSEVITZKY, S., et al.
complex mode of interaction between reactive oxygen species, plant development, and response to abiotic stresses. Plant Physiology, v. 144, p. 1777–1785, 2007.
MITTLER, R. Oxidative stress, antioxidants and stress tolerance. Trends in Plant Science, v. 9, p. 405–410, 2002.
MITTLER, R.; VANDERAUWERA, S.; GOLLERY, M.; VAN BREUSEGEM, F. Reactive oxygen gene network of plants. Trends in Plant Science, v. 9, p. 490–498, 2004.
MØLLER, I.M.; JENSEN, P.E.; HANSSON, A. Oxidative modifications to cellular components in plants. Annual Review of Plant Biology, v. 58, p. 459–481, 2007.
MOSCHOU, P.M.; PASCHALIDIS, K.A.; DELIS, I.D.; ANDRIOPOULOU, A.H.; LAGIOTIS, G.D.; YAKOUMAKIS, D.I.; ROUBELAKIS–ANGELAKIS, K.A. Spermidine exodus and oxidation in the apoplast induced by abiotic stress is responsible for H2O2 signatures that direct tolerance responses in tobacco. Plant Cell, v. 20, p. 1708–1724, 2008.
MÜLLER, P.; LI, X.P.; NIYOGI, K.K. Non-photochemical quenching. A response to excess light energy. Plant Physiology, v. 125, p. 1558–1566, 2001.
MUNNS, R. Genes and salt tolerance: bringing them together. New Phytologist, v. 167, p. 645–663, 2005.
NAQVI, S.; ZHU, C.; FARRE, G.; et al. Transgenic multivitamin corn through
biofortification of endosperm with three vitamins representing three distinct metabolic pathways. Proceedings of the National Academy of Sciences, v. 106, p. 7762–
7767, 2009.
NOCTOR, G.; FOYER, C.H. Ascorbate and glutathione: Keeping Active Oxygen Under Control. Annual Review of Plant Physiology and Plant Molecular Biology, v. 49, p. 249–279, 1998.
PAN, Y.; WU, L.J.; YU, Z.L. Effect of salt and drought stress on antioxidant enzymes activities and SOD isoenzymes of liquorice (Glycyrrhiza uralensis Fisch). Plant Growth Regulation, v. 49, p. 157–165, 2006.
PNUELI, L.; LIANG, H.; ROZENBERG, M.; MITTLER, R. Growth suppression, altered stomatal responses, and augmented induction of heat shock proteins in cytosolic ascorbate peroxidase (Apx1)-deficient Arabidopsis plants. The Plant Journal, v. 34, p. 187–203, 2003.
QUEVAL, G.; HAGER, J.; GAKIÉRE, B.; NOCTOR, G. Why are literature data for H2O2 contents so variable? A discussion of potential difficulties in quantitative assays of leaf extracts. Journal of Experimental Botany, v. 59, p. 135–146, 2008.
SCANDALIOS, J.G. The rise of ROS. Trends in Biochemical Sciences, v. 27, p. 483–486, 2002.
SHAO, H.B.; CHU, L.Y.; LU, Z.H.; KANG, C.M. Primary antioxidant free radical scavenging and redox signaling pathways in higher plant cells. International Journal of Biological Sciences, v. 4, n. 1, p. 8–14, 2008.
SHARMA, P.; JHA, A.B.; DUBEY, R.S.; PESSARAKLI, M. Reactive oxygen species, oxidative damage, and antioxidative defense mechanism in plants under stressful conditions. Journal of Botany, v. 2012, p. 1–26, 2012.
SHIGEOKA, S.; ISHIKAWA, T.; TAMOI, M.; MIYAGAWA, Y.; TAKEDA, T.; YABUTA, Y.; YOSHIMURA, K. Regulation and function of ascorbate peroxidase isoenzymes.
Journal of Experimental Botany, v. 53, p. 1305–1309, 2002.
SMIRNOFF, N. The function and metabolism of ascorbic acid in plants. Annals of Botany., v. 78, p. 661–669, 1996.
SMIRNOFF N. Ascorbic acid: metabolism and functions of a multifaceted molecule.
Current Opinion in Plant Biology, v. 3, p. 229–235, 2000.
SMIRNOFF, N.; CONKLIN, P.L; LOEWUS, F.A. Biosynthesis of ascorbic acid in plants: a renaissance. Annual Review of Plant Physiology and Plant Molecular Biology, v. 52, p. 437–467. 2001.
SOSBAI. Sociedade Sul-Brasileira De Arroz Irrigado. Arroz Irrigado:
Recomendações técnicas da pesquisa para o Sul do Brasil. Santa Maria, 159 p., 2005.
STEIGER, H.M.; BECK, E.; BECK, R. Oxygen concentrations in isolated chloroplasts during photosynthesis. Plant Physiology, v. 60, p. 903–906, 1977.
SUZUKI, N.; MILLER, G.; SEJIMA, H.; HARPER, J.; MITTLER, R. Enhanced seed production under prolonged heat stress conditions in Arabidopsis thaliana plants deficient in cytosolic ascorbate peroxidase 2. Journal of Experimental Botany, v. 64, p. 253–63, 2013.
SZARKA A.; TOMASSKOVICS B.; BÁNHEGYI G. The ascorbate-glutathione-α -tocopherol triad in abiotic stress response. International Journal of Molecular Sciences, v. 13, p. 4458–4483, 2012.
SZARKA A.; BÁNHEGYI G.; ASARD H. The Inter-Relationship of Ascorbate Transport, Metabolism and Mitochondrial, Plastidic Respiration. Antioxidants & Redox Signaling, v. 19, p. 1036–1044, 2013.
TEIXEIRA, F.K.; MENEZES-BENAVENTE, L.; GALVÃO, C.V.; MARGIS, R.; MARGIS-PINHEIRO, M. Rice ascorbate peroxidase gene Family encodes functionally diverse isoforms localized in different subcellular compartments. Planta, v. 224, p. 300–312, 2006.
TÓTH, S. Z.; SCHANSKER, G.; GARAB, G. The physiological roles and metabolism of ascorbate in chloroplasts. Physiologia Plantarum, v. 148, p. 161–175, 2013.
VELJOVIC–JOVANOVIC, S.D.; NOCTOR, G.; FOYER, C.H. Are leaf hydrogen peroxide concentrations commonly overestimated? The potential influence of artifactual interference by tissue phenolics and ascorbate. Plant Physiology Biochemical, v. 40, p. 501–507, 2002.
VRANOVÁ, E.; INZE, D.; van BREUSEGEM, F. Signal transduction during oxidative stress. Journal of Experimental Botany, v. 53 n. 372, p. 1227–1236, 2002.
WANG, J.; ZENG, Q.; ZHU, J.; LIU, G.; TANG, H. Dissimilarity of ascorbate–
glutathione (AsA–GSH) cycle mechanism in two rice (Oryza sativa L.) cultivars under experimental free-air ozone exposure. Agriculture, Ecosystems and Environment, v. 165, p. 39–49, 2013.
YOSHIMURA, K.; YABUTA, Y.; ISHIKAWA, T.; SHIGEOKA, S. Expression of spinach ascorbate peroxidase isoenzymes in response to oxidative stresses. Plant Physiology, v. 123, p. 223–234, 2000.
YOSHIMURA, K.; NAKANE T.; KUME S.; SHIOMI Y.; MARUTA T.; et al. Transient
expression analysis revealed the importance of VTC2 expression level in light/dark regulation of ascorbate biosynthesis in Arabidopsis. Bioscience, Biotechnology, and Biochemistry, v. 78, p. 60-66, 2014.
C
APÍTULO2
Sensitivity to ascorbic acid toxicity in chloroplast-APX silenced rice leaves is enhanced by high light but is not photosynthesis dependent
(in submission phase)
Jamyla L. S. Castro1, Antonio G. S. Feitosa2, Jones B. Vidal2, Yugo Lima-Melo1, Milton C. Lima Neto1, Marcia Margis-Pinheiro3 and Joaquim A. G. Silveira1*
1Departamento de Bioquímica e Biologia Molecular, Universidade Federal do Ceará,
Brasil
2Departamento de Ciências do Solos, Universidade Federal do Ceará, Brasil 3Departamento de Genética, Universidade Federal do Rio Grande do Sul, Brasil
Abstract
by the decrease in chlorophyll and carotenoids contents. The plants deficient in two chloroplast APX (APX7/8) displayed higher sensibility to AA toxicity, especially in combination with high light. These effects were indicated by exhibition of higher levels of TBARS, electrolyte leakage, H2O2 and superoxide radical. Curiously, the transgenic plants under high AA concentrations did not exhibited differences for several photosynthetic parameters: CO2 assimilation rate and PSII (ΦPSII, ETR, NPQ e Fv/Fm) and PSI efficiency indicators (ΦPSI, ETR e P700+) when compared to NT. The data set of this work shows that the excess of AA may cause toxicity in plants. The intensity of these effects is strongly enhanced by the excess of light but they are not dependent on photosynthesis. In this work, the roles of the two chloroplastic APX and/or high light on the AA toxicity still unclear, despite the deficient plants had showed increased sensibility. Apparently, the mechanism of AA toxicity in plants is similar to the proposed for animal cells.
1 INTRODUCTION
Plants are frequently challenged by several environmental stresses. These stressful conditions induce imbalance between scavenging and production of reactive oxygen species (ROS), especially H2O2, which might cause cellular damage or act as signaling in several processes (ASADA, β006; ŚLESAK et al., 2007). To maintain
adequate H2O2 homeostasis, especially under adverse conditions, plants have developed several antioxidant mechanisms represented mainly by a set of peroxidases and non-enzymatic antioxidants (MUNNÉ-BOSCH et al., 2013). In
cytosol and chloroplasts, the ascorbate peroxidases (APX, EC 1.11.1.11) are considered the most important in scavenging excess H2O2 as well in maintaining suitable levels of this ROS for cellular signaling (SHIGEOKA et al., 2002).
Non-enzymatic antioxidants are found in all cellular compartments and these antioxidant compounds are defined as substances that are distributed virtually in all compartments of plant cells (HALLIWELL; GUTTERIDGE, 1999). Under this definition are components with intrinsic properties such as α-tocopherol (vitamin E), -carotene, ascorbate (vitamin C) and glutathione (GSH). In addition, are included in this class flavonoids, alkaloids, and carotenoids (APEL; HIRT, 2004; SCANDALIOS, 2005). These may act directly in the detoxification of reactive oxygen species and radicals derived or then act as reducing substrates for antioxidant enzymes (Mittler, 2002).
In plants, ascorbato (ASC) is found in virtually all cellular compartments of most cell types. The ability to donate electrons in enzymatic and non-enzymatic reactions does the ASC an important ROS‐detoxifying compound in the aqueous phase. ASC can directly eliminate superoxide, hydroxyl radicals and singlet oxygen and also reduce hydrogen peroxide to water via ascorbate peroxidase reaction (BLOKHINA et al., 2003).The ascorbate is also involved in the regulation of cell
division, in the progression from G1 to S phase of the cell cycle and cell elongation(BLOKHINA et al., 2003).
H2O2 have been described in defense and programmed cell death responses to abiotic stress (MOSCHOU et al., 2008).
Despite the large antioxidant efficiency, the paradoxically ascorbate also acts as a pro-oxidant in vitro.Solutions of ascorbate and iron are used for decades to
induce oxidative modifications of lipids, proteins and DNA. Thus, ascorbic acid can act as a catalyst in the Fenton reaction, promoting the reduction of ferric ions into ferrous ions. Therefore, the ascorbic acid can act both as an antioxidant and as a pro-oxidant, depending on conditions (DENISOV; AFANAS’EV, β005).
In rice plants, a small gene family encodes APX isoforms which are targeted to distinct subcellular compartments: mitochondria (miAPX), cytosol (cAPX), peroxisome/glyoxysomes (mAPX), thylakoid membranes (tAPX) and stroma (sAPX) in chloroplasts (TEIXEIRA et al., 2006). APX found in organelles scavenges H2O2
produced within the organelles, whereas cytosolic APX eliminates H2O2 produced in the cytosol, apoplast or that diffused from organelles (MITTLER; ZILINSKAS, 1992). The chloroplastic and cytosolic APX isoforms are specific for ASC as electron donor while the cytosolic isoenzymes are less sensitive to depletion of ASC than the chloroplastic isoenzymes, including stromal and thylakoid bound enzymes (SHARMA; DUBEY, 2004; ISHIKAWA et al., 1998). Decreases in ASC levels and
inactivation of APXs in chloroplasts have been considered to be limiting factors in the efficiency of the water–water cycle and photo-oxidative protection under stress conditions (ISHIKAWA; SHIGEOKA et al., 2008).
2 MATERIALS AND METHODS
2.1 Constructing the plant vector, plant transformation and growth conditions
A chimeric gene producing mRNA with a hairpin structure (hpRNA) was constructed based on the sequence of the OsAPX7 (LOC_Os04g35520) and OsAPX8 (LOC_Os02g34810) genes. The following primer pairs were used to amplify
a 238-bp RNAiOsAPX7/8 sequence: 5’-CACCCTCTAAAGCTTGTCCAAC-γ’ and 5’
-TCAAGACCCATCCTGTAA-γ’. PCR products were cloned into the Gateway vector
pANDA, in which hairpin RNA is driven by the maize ubiquitin promoter and an intron placed upstream of the inverted repeats (MIKI and SHIMAMOTO, 2004). Agrobacterium tumefaciens-mediated transformation was performed as described previously Upadhyaya et al., 2002.
The rice plants knockdowns for both OsAPX7 and OsAPX8 were obtained
by A. tumefaciens-mediated transformation of rice embryogenic calli (Oryza sativa L. ssp. japonica cv. Nipponbare) induced from seeds and cultivated in NB medium (UPADHYAYA et al., β00β) at β8◦C in the dark. Rice seeds from the Tβ generation of
non-transformed (NT) and transgenic lines, in which the chloroplastic OsAPX7 and
OsAPX8 genes (Apx7/8s) had been silenced, were germinated in MS medium
(Sigma–Aldrich) supplemented with hygromycin under controlled conditions (150 µmol m−2 s−1 photosynthetic photon flux density (PPFD), β5◦C, 80% relative humidity
and a 12 h photoperiod). Two weeks after being sown, the rice seedlings were transferred to 3 L plastic pots filled with half-strength Hoagland-Arnon’s nutritive