UNIVERSIDADE
CATÓLICA DE
BRASÍLIA
PRÓ-REITORIA DE PÓS GRADUAÇÃO
STRICTO SENSU EM EDUCAÇÃO FÍSICA
Mestrado
RESPOSTAS HEMODINÂMICAS E ATIVIDADE DE CALICREÍNA
PLASMÁTICA EM DIABÉTICOS TIPO 2 E NÃO DIABÉTICOS APÓS
TESTE INCREMENTAL E EXERCÍCIO REALIZADO A 90% DO
LIMIAR DE LACTATO
Autora: Daisy Fonseca Motta
Orientadora: Profª Drª Carmen Sílvia G. Campbell
Co-orientador: Dr. Herbert Gustavo Simões
DAISY FONSECA MOTTA
RESPOSTAS HEMODINÂMICAS E ATIVIDADE DE CALICREÍNA
PLASMÁTICA EM DIABÉTICOS TIPO 2 E NÃO DIABÉTICOS APÓS
TESTE INCREMENTAL E EXERCÍCIO REALIZADO A 90% DO
LIMIAR DE LACTATO
Dissertação apresentada ao Programa de Pós Graduação Stricto Sensu em Educação Física da Universidade Católica de Brasília, como requisito para obtenção do Título de mestre em Educação Física.
Orientadora: Profa.Dra. Carmen S. G. Campbell
Co-Orientador: Prof. Dr. Herbert Gustavo Simões
TERMO DE APROVAÇÃO
Dissertação defendida e aprovada como requisito parcial para a obtenção do Título de Mestre em Educação Física, defendida e aprovada em 19 de Maio de 2008, pela banca examinadora constituída por :
Nome do Professor
Nome do Professor
Nome do Professor
DEDICATÓRIA
Dedico este trabalho a minha mãe Elizete Fonseca Motta por ser a primeira a apoiar minha escolha profissional e durante o curso me auxiliar em meus estudos;
A minha avó Elzi Valle da Fonseca pelo seu carinho e delicadeza; Ao meu pai Cleider Motta, que através de sua força, honestidade e caráter representa um exemplo para mim;
À minha irmã Denise, que está comigo desde que eu era apenas uma célula e me transformei em várias;
Aos meus irmãos Débora e Silvio Romero, pela amizade e companheirismo durante este período em que estive ausente;
AGRADECIMENTOS
A Profa. Dra. Carmen Silvia Grubert Campbell Ao Prof. Dr. Herbert Gustavo Simões
A Profa. Msc. Rosângela Fonseca Araújo Ao Prof. Dr. Ricardo Jacó de Oliveira Ao Dr. Ronaldo Benford
Ao Prof. Msc. Kelerson Castro À Profa.Dra. Nancy França Ao Prof. Msc. José Arthur À Mônica Alves Miranda Ao Elias Tavares
À CAPES e PROCAD
A amiga Pâmella Karoline e Gisele Soares Mendes e aos amigos de Londrina Lúcio Flávio Soares Caldeira e Nilo Okuno
Aos colegas e amigos, Prof. Msc.Guilherme Puga, Marcelo Magalhães, Msc. Sérgio Rodrigues Moreira, Msc. Carlos Ernesto, Msc. Laila Cândida, Msc. Emerson Pardono, Msc. Sandro Soares de Almeida, Gisela Arsa e Carlos Humberto Luz.
As amigas Cecília Grissi, Cynthia Dias, Renata Mitri, Mariana Leal, Flávia Perdigão
As pedagogas sempre presentes Carolina Câmara, Maria Emília Seabra, Junia Xavier, Aléxia Guimarães, Ana Carolina Barbosa
Ao gerente técnico da academia FitWay Beto Barros e à proprietária do studio Personal Pilates Kênya Maria Sousa Sampaio
À Universidade Católica de Brasília – UCB, à Universidade de Mogi das Cruzes - UMC e Universidade Paulista de Medicina - UNIFESP
RESPOSTAS HEMODINÂMICAS E ATIVIDADE DE CALICREÍNA PLASMÁTICA EM DIABÉTICOS TIPO 2 E NÃO DIABÉTICOS APÓS TESTE INCREMENTAL E
EXERCÍCIO REALIZADO A 90% DO LIMIAR DE LACTATO
Resumo
O diabetes mellitus tipo 2 traz diversas complicações e a hipertensão arterial (HA) é principal fator de risco para doenças cardiovasculares podendo ocorrer devido a vários fatores dentre os quais se destacam alterações no sistema calicreína-cinina (SCC) e na variabilidade da freqüência cardíaca (VFC). O exercício físico auxilia no controle da HA, porém é desconhecido os efeitos de diferentes intensidades de exercício na pressão arterial (PA), atividade de calicreína plasmática (ACP) e VFC em diabéticos tipo 2 (DM2). O objetivo, portanto foi analisar e comparar respostas de PA, de ACP e componentes da VFC em DM2 e não diabéticos tipo 2 (NDM2) após teste incremental (TI) e exercício aeróbio realizado a 90% do limiar de lactato (90% LL). Participaram do estudo 23 indivíduos sedentários, sendo 13 DM2 e 10 NDM2. Foram realizadas 3 sessões experimentais randomizadas (exceto TI): a) sessão controle (CON), 20 min de repouso sentado; b) sessão 90% LL, 20 min de exercício em cicloergômetro com intensidade relativa a 90% do LL; c) sessão TI, teste em cicloergômetro (incrementos de 15W a cada 3 min até exaustão). A PA foi mensurada pré teste a cada 5 min por 20 min e após o fim da sessão a cada 15 min durante 135 min. Coletas de sangue capilarizado do lóbulo da orelha (lactato e glicemia) foram realizadas pré teste aos 20 min, e pós teste a cada 15 min em todas as sessões por 135 min. Coletas de sangue venoso (ACP) ocorreram aos R15, R45, R90 e R135 min da recuperação em todas as sessões. A análise da VFC foi realizada em intervalos de 5 min em repouso e no período de recuperação em R15, R30 e R45 min. Foi utilizada ANOVA two way e post-hoc de Bonferroni para análise de PA, teste de Friedman e post hoc de Dunn para análise da ACP e ANOVA two way, Mauchly (quando necessária correção de Huynh-Feld) e post hoc LSD para os componentes de VFC. No grupo DM2, ocorreu hipotensão pós-exercício (HPE) de PAS, somente após TI (R45, R60 e R75) não sendo verificada após 90% LL. Em NDM2, ocorreu HPE de pressão arterial sistólica (PAS) tanto após TI (R30 e R45) quanto após 90% LL (R30, R45 e R120). Não foram observadas HPE na pressão arterial diastólica em ambos os grupos nas intensidades avaliadas. A ACP aumentou apenas em NDM2 após 90% LL (R15) não se alterando após nenhuma sessão de exercício em DM2. Na VFC não houve alterações no componente LF em ambos os grupos nas duas intensidades (TI e 90% LL). O HF em NDM2, não diferiu no período de recuperação, já em DM2 aumentou após TI (R30 e R45). O LF/HF, em NDM2 aumentou após 90% LL (R15) e TI (R15 e R30), porém em DM2 aumentou apenas após 90% LL (R15) (p ≤ 0,05). Pode-se concluir que o exercício demonstrou ser efetivo no controle da PA em DM2 através da HPE e a intensidade interfere nas respostas pressóricas, de calicreínas e VFC tanto em DM2 quanto em NDM2.
HEMODYNAMIC RESPONSES AND KALLIKREIN ACTIVITY IN TYPE 2 DIABETICS AND NON DIABETICS AFTER MAXIMAL INCREMENTAL TEST AND EXERCISE
PERFORMED AT 90% LACTATE THRESHOLD
Abstract
The type 2 diabetes can lead several complications and arterial hypertension (AH) is main risk factor for cardiovascular disease causes by several factors like changes in the kallikrein-kinin system (KKS) and the heart rate variability (HRV). The exercise helps to prevent and control AH, but the effects of different intensities of exercise on blood pressure (BP), plasmatic kallikrein activity (PKA) and HRV in type 2 diabetics (T2D) is unknown. The aim of this study was to analyze and compare BP, PKA and components of HRV responses in T2D and non diabetics (NT2D) after maximal incremental test (GXT) and aerobic exercise performed at 90% of the lactate threshold (90% LT). Twenty-three sedentary subjects participated in the study: 13 T2D and 10 NT2D underwent 3 different sessions in randomized trial (except GXT): a) control session (CON), 20 minutes of rest sitting b) 90% LT session, 20 min of exercise in cycle performed at 90% of LT c) GXT session, a maximal incremental test (increments of 15W every 3 min until exhaustion). The BP was measured before session every 5 min during 20 min and after the session every 15 min during 135 min. Collections of capillarized blood of the ear lobe (lactate and glucose levels) were performed before the test (20 min), and recovery time every 15 min in all sessions during 135 min. Collections of venous blood (PKA) occurred at R15, R45, R90 and R135 min of recovery in all sessions. The HRV analysis was conducted at intervals of 5 min at rest and during the recovery in R15, R30 and R45 min. It was used two way ANOVA and post-hoc analysis of Bonferroni to BP, Friedman test and post hoc analysis of Dunn to PKA and two way ANOVA, Mauchly (when necessary Huynh-Feld) and post hoc LSD for components of HRV. In group T2D, occurred post-exercise hypotension (PEH) of systolic blood pressure (SBP), only after GXT (R45, R60 and R75) not being observed after 90% LT. In NT2D, occurred PEH of SBP after GXT (R30 and R45) and 90% LT (R30, R45 and R120). Did not occur PEH in diastolic blood pressure in both groups at intensities evaluated. The PKA increased only in NT2D after 90% LT (R15) and did not change after any session of exercise in T2D. In HRV there were no changes in LF component in both groups in the two intensities (GXT and 90% LT). The HF in NT2D, did not differ in the recovery period, and in T2D increased after GXT (R30 and R45). The LF / HF in NT2D increased after 90% LT (R15) and GXT (R15 and R30), but in T2D increased only after 90% LT (R15) (p ≤ 0.05). It was concluded that the exercise was effective in decrease BP in T2D (after GXT) by PHE and the intensity can influence the pressoric, PKA and HRV responses in T2D and NT2D.
SUMÁRIO
1. INTRODUÇÃO ... 15
2. OBJETIVOS ... 19
2.1. OBJETIVO GERAL... 19
3. JUSTIFICATIVA E RELEVÂNCIA ... 20
4. REVISÃO DE LITERATURA... 21
4.1. DIABETES MELLITUS... 21
4.2. HIPERTENSÃO ARTERIAL (HA) ... 23
4.3. DISFUNÇÃO AUTONÔMICA CARDÍACA... 24
4.4. RESISTÊNCIA À INSULINA E COMPLICAÇÕES CARDIOVASCULARES... 25
4.5. RISCO DE DOENÇA ARTERIAL CORONARIANA E O SISTEMA CALICREÍNA-CININA (SCC) 27 4.6. O PAPEL DO EXERCÍCIO FÍSICO NO TRATAMENTO DO DIABETES TIPO 2 ... 29
4.6.1. Parâmetros de intensidade de Exercício Físico ... 31
4.6.2. Influência do exercício na captação de glicose... 34
4.6.3. Hipotensão Pós-Exercício ... 35
5. MATERIAIS E MÉTODOS ... 39
5.1. PROCEDIMENTOS... 39
5.2. ESTUDOS 1 E 2 - HIPOTENSÃO PÓS-EXERCÍCIO: ATIVIDADE DA CALICREÍNA PLASMÁTICA E VARIABILIDADE DA FREQÜÊNCIA CARDÍACA... 39
5.3. VOLUNTÁRIOS... 40
5.3.1. Critérios de Inclusão ... 41
5.4. TESTES... 42
5.4.1. Teste Incremental (TI) e determinação do Limiar de Lactato (LL) ... 42
5.4.2. Sessão de Exercício retangular a 90% do Limiar de Lactato (90% LL) e Sessão Controle (CON) ... 43
5.5. REFEIÇÃO PADRÃO... 45
5.6. MENSURAÇÃO DA PRESSÃO ARTERIAL... 46
5.7. COLETAS SANGUÍNEAS... 46
5.8. ANÁLISE DO LACTATO SANGUÍNEO E GLICEMIA... 47
5.9. ANÁLISE DA CALICREÍNA PLASMÁTICA... 47
5.10. ANÁLISE DA VARIABILIDADE DA FREQUÊNCIA CARDÍACA... 48
5.11. TRATAMENTO ESTATÍSTICO... 48
6. RESULTADOS ... 50
7. DISCUSSÃO ... 79
8. CONCLUSÃO... 96
9. REFERÊNCIAS BIBLIOGRÁFICAS ... 97
ANEXO A. TERMO DE CONSENTIMENTO LIVRE E ESCLARECIDO ... 109
ANEXO B. FICHA DE AMAMNESE - HISTÓRICO DE SAÚDE ... 112
ANEXO C- FICHA DE AVALIAÇÃO (COLETA)... 1
LISTA DE FIGURAS
Figura 1. EstágiosMetabólicos do Diabetes Tipo 2
Figura 2. Identificação do Limiar de lactato
Figura 3. Esquema das Sessões de Exercício retangular a 90% do Limiar Anaeróbio e Sessão Controle
Figura 4. Delta de pressão arterial sistólica em DM2 após as sessões experimentais
Figura 5. Delta de pressão arterial sistólica em NDM2 após as sessões experimentais
Figura 6. Delta de pressão arterial diastólica em DM2 após as sessões experimentais
Figura 7. Delta de pressão arterial diastólica em NDM2 após as sessões experimentais
Figura 8. Delta de pressão arterial média em DM2 após as sessões experimentais.
Figura 9. Delta de pressão arterial média em NDM2 após as sessões experimentais
Figura 10. Frequência Cardíaca em DM2 e NDM2 durante sessão controle.
Figura 11. Frequência Cardíaca em DM2 e NDM2 após sessão a 90 % LL.
Figura 12. Frequência Cardíaca em DM2 e NDM2 após TI.
Figura 13. Duplo Produto em DM2 e NDM2 durante sessão controle.
Figura 14. Duplo Produto em DM2 e NDM2 após sessão a 90 % Limiar de Lactato.
Figura 15. Duplo Produto em DM2 e NDM2 após TI
Figura 16. Lactato em DM2 e NDM2 durante sessão controle.
Figura 17. Lactato em DM2 e NDM2 após sessão a 90 % Limiar de Lactato
Figura 18. Lactato em DM2 e NDM2 após TI.
Figura 19. Atividade da calicreína plasmática individual nos grupos DM2 e NDM2 em jejum.
Figura 10. Resposta da Pressão Arterial Sistólica (PAS) e atividade da calicreína plasmática no grupo DM2 e NDM2 durante sessão controle
Figura 21. Resposta da Pressão Arterial Sistólica e atividade da calicreína plasmática no grupo DM2 e NDM2 após sessão de exercício à 90% Limiar de Lactato.
LISTA DE TABELAS
Tabela 1. Limites diagnósticos para diabetes e alterações na regulação da glicose
Tabela 2. Classificação da pressão arterial para adultos acima de 18 anos.
Tabela 3.Caracterização da amostra
Tabela 4.Parâmetros Hemodinâmicos e Metabólicos
Tabela 5. Parâmetros de aptidão aeróbia em DM2 e NDM2
Tabela 6. Correlação entre variáveis antropométricas, metabólicas e hemodinâmicas em DM2
Tabela 7. Correlação entre variáveis antropométricas e de aptidão física em DM2
Tabela 8. Correlação entre variáveis antropométricas e hemodinâmicas em NDM2
Tabela 9 . Correlação entre variáveis antropométricas e de aptidão física em NDM2
Tabela 10. Valores em média e desvio padrão da pressão arterial sistólica PAS (mmHg) em DM2 e
NDM2 após as sessões experimentais
Tabela 11.Valores em média e desvio padrão da pressão arterial diastólica (PAD) (mmHg) em
DM2 e NDM2 após as sessões experimentais (n=20)
Tabela 12. Valores médios e desvio padrão da pressão arterial média (PAM) (mmHg) em DM2 e
LISTA DE ABREVIATURAS
DM = Diabetes Mellitus
PA = Pressão Arterial
SNS = Sistema Nervoso Simpático
HVE = Hipertrofia Ventricular Esquerda
SRA = Sistema Renina-Angiotensina
SCC = Sistema Calicreína-Cinina
HA = Hipertensão Arterial
HPE = Hipotensão Pós-exercício
LL = Limiar de lactato
VFC = Variabilidade de frequência cardíaca
DM2 = Diabéticos tipo 2
NDM2= Não diabéticos tipo 2
PAS= pressão arterial sistólica
PAD = pressão arterial diastólica
90%LL= 90% do limiar de lactato
SBD= Sociedade Brasileira de Diabetes
DC = débito cardíaco
RVP = resistência vascular periférica
FC= freqüência cardíaca
VE= volume de ejeção
SNA = sistema nervoso autonômico
IR = receptor de insulina
IRS1 = receptor de insulina 1
IRS2 = receptor de insulina 2
PI3-K = fosfatidil-inositol-3-quinase
ACSM = American College Sports Medicine
AHA= American Heart Association
LL= limiar de lactato
PROCAD= Programa de Cooperação Acadêmica
ECG = eletrocardiograma
TI= Teste Incremental
PSE= Percepção Subjetiva de Esforço
CON= Sessão controle
PKSI- plasmatic-kallikrein serine protease inhibitor
IMC= índice de massa corporal
Circ = circunferência abdominal
Glic Jej= glicemia de jejum
W máx: potência máxima
FC máx: freqüência cardíaca máxima atingida no teste incremental
Lac Pico= pico de lactato durante o teste incremental
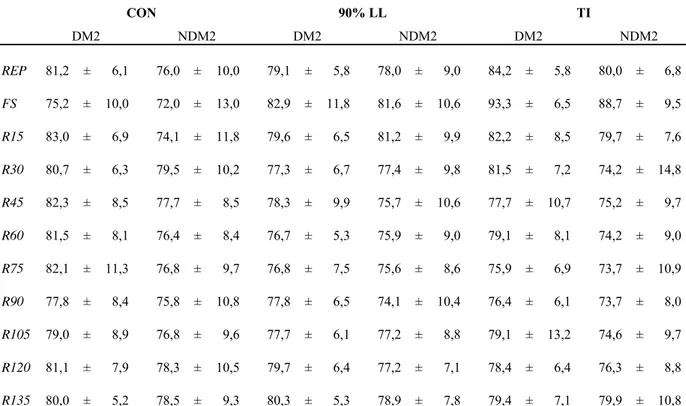
REP= repouso
FS= final da sessão
PAM= pressão arterial média
DP= duplo produto
DM2A= diabéticos tipo 2 ativos
DM2S= diabéticos tipo 2 sedentários
1. INTRODUÇÃO
Atualmente o mundo caminha para um preocupante problema de saúde pública devido ao aumento do número de diagnósticos de diabetes mellitus (DM). Cerca de 177 milhões de pessoas sofrem de DM no mundo e este número deverá dobrar até 2030. Aproximadamente 4 milhões de mortes no mundo por ano são atribuíveis a complicações do DM (Wild, Roglic, Green, Sicree, & King, 2004).O Brasil está entre os dez principais países afetados.
A hiperglicemia crônica, principal característica do DM, está associada a danos em longo prazo, tais como disfunção e deficiência em vários órgãos e distúrbios incluindo cardiopatias induzidas principalmente pelo aumento da pressão arterial, retinopatias, neuropatias, nefropatias, entre outros (American Diabetes Association., 2008). Isto ocorre devido a modificações metabólicas que acarretam degeneração das artérias e alterações funcionais e estruturais nos rins e nervo óptico (Aronoff, Berkowitz, & Shreiner, 2004).
A resistência à insulina, característica da fase inicial do desenvolvimento do DM, leva a um aumento da produção de insulina, a hiperinsulinemia, o que contribui para a elevação da pressão arterial (PA) através de diversos mecanismos que incluem alterações na ação da angiotensina II e aldosterona induzindo aumento da resistência vascular. Aumento da atividade do sistema nervoso simpático (SNS), dislipidemia, aterosclerose, aumento do estresse oxidativo, hipercoagubilidade, hipertrofia ventricular esquerda (HVE), mudanças estruturais no funcionamento renal, gomeruloesclerose e doença progressiva renal são alguns mecanismos que estão associados a elevação da PA em diabéticos (El-Atat, Stas, McFarlane, & Sowers, 2004).
A regulação da PA ocorre através de alterações no débito cardíaco e resistência vascular periférica, sendo estes dependentes, dentre outros fatos, da função endotelial, da ação dos barorreceptores e da regulação autonômica, e atividade do sistema renina-angiotensina (SRA) e sistema calicreína-cininas (SCC) entre outros (Beevers et al., 2001; Mayet & Hughes, 2003).
induzir queda da pressão arterial (hipotensão), diurese, natriurese, aumento do fluxo sanguíneo renal, vasodilatação e redução da resistência vascular periférica (Sharma, Uma, Noor, & Rahman, 1996). A relação entre o SCC e a utilização de glicose deve-se ao aumento da sensibilidade à insulina e translocação do GLUT4 induzido por este sistema, podendo ser influenciado pelo exercício físico (Taguchi et al., 2000).
O aumento da captação de glicose promovida pelo exercício físico auxilia na prevenção e controle do DM. A concentração sanguínea de glicose e a PA são fatores determinantes para complicações em diabéticos, relacionando-se ao risco de eventos cardíacos influenciado pela produção e ação da insulina no organismo (Marliss & Vranic, 2002; Skyler, 2004).
O índice das complicações cardiovasculares é duas a quatro vezes maior em indivíduos diabéticos comparados a indivíduos não diabéticos. Por este motivo, o adequado controle da PA reduz em 32% as mortes relacionadas ao DM, diminui em 44% o risco de infarto, e 34% o risco de doenças macrovasculares, bem como decréscimo significante de outras complicações, sendo particularmente importante em diabéticos e hipertensos (Russell, Dunbar, Salisbury, Sketris, & Kephart, 2005).
A atividade física, através de mecanismos como a hipotensão pós-exercício (HPE), promove efeitos benéficos no controle da PA e glicemia. A manutenção da PA em valores próximos do normal é tão importante quanto à manutenção da glicemia para redução de problemas cardiovasculares em indivíduos diabéticos (American Diabetes Association, 2008). Segundo Wright & Swan, (2001), para manutenção da saúde recomenda-se 30 minutos de atividade física moderada por dia e para indivíduos hipertensos deve-se realizar exercícios dinâmicos em intensidade moderada por 50- 60 minutos de 3 a 4 vezes na semana. Segundo posicionamento do Colégio Americano de Medicina Esportiva (American College Sports Medicine, 1998) é recomendado pelo menos três sessões não consecutivas de exercício por semana progredindo para cinco, com duração de 30 minutos e intensidade entre 40 e 70% VO2máx, a fim de promover benefícios cardiovasculares e aumento de dispêndio energético em
diabéticos (Albright et al., 2000).
Um parâmetro de avaliação física empregado para prescrição do exercício é o Limiar de Lactato (LL) definido por Meyer et al., (2005) como um indicador de capacidade aeróbia que representa baixo estresse metabólico. Por este motivo, o LL tem sido utilizado como intensidade segura na prescrição de exercícios para grupos especiais como cardiopatas, hipertensos e diabéticos (Kunitomi et al., 2000; Belli et al., 2007).
A prescrição de exercícios para indivíduos diabéticos tipo 2 (DM2), utilizando-se o LL, deve objetivar reduzir fatores de risco para complicações cardiovasculares. Estudos demonstram que o exercício auxilia tanto no controle da glicemia (Hayashi, Wojtaszewski, & Goodyear, 1997; Y. Hayashi et al., 2005) quanto da PA (MacDonald et al., 1999; Forjaz, Cardoso, Rezk, Santaella, & Tinucci, 2004) porém, a compreensão dos mecanismos responsáveis e a identificação de intensidades adequadas ainda não foram estabelecidos.
A PA e a glicemia são afetadas diretamente pela intensidade do exercício e, portanto necessita ser individualizada uma vez que o exercício físico traz benefícios para o seu controle. Durante testes incrementais máximos bem como em determinadas intensidades de exercícios, a pressão arterial sistólica (PAS) aumenta (Syme et al., 2006) e após o fim do exercício, a PAS e pressão arterial diastólica (PAD) podem apresentar uma redução comparada aos valores pré-exercício denominada como HPE (MacDonald., 2002). A HPE ocorre como resposta fisiológica a um exercício máximo ou submáximo e representa um mecanismo protetor contra eventos cardiovasculares. MacDonald, (2002), citam em seus trabalhos, quedas de aproximadamente 8/9 mmHg PAS/PAD em normotensos, 14/9 mmHg PAS/PAD em hipertensos “borderline” e 10/7 mmHg PAS/PAD em hipertensos entretanto, HPE em diabéticos ainda não foi claramente estabelecida.
Os mecanismos relacionados à HPE incluem inibição simpática após o exercício (alterações nos componentes de variabilidade de freqüência cardíaca - VFC) e atividade de substâncias vasodilatadoras como cininas (Halliwill, Dinenno, & Dietz, 2003). Indivíduos diabéticos podem apresentar neuropatia autonômica cardiovascular (Vinik, Freeman, & Erbas, 2003; Maser & Lenhard, 2005) e prejudicado controle autonômico (Kudat et al., 2006) comparado a não diabéticos o que pode prejudicar a resposta vasodilatadora após o exercício. O SCC em hipertensos e normotensos é outro fator que parece estar envolvido na HPE. Alguns estudos demonstraram aumento nas concentrações de cininas no período de recuperação pós –exercício (Moraes et al., 2007; Pontes et al., 2008).
2. OBJETIVOS
2.1.Objetivo Geral
Analisar e comparar as respostas de pressão arterial, atividade de calicreínas plasmáticas e parâmetros de variabilidade da freqüência cardíaca em diabéticos tipo 2 e em indivíduos não diabéticos antes e após teste incremental e exercício aeróbio realizado a 90% do limiar anaeróbio em cicloergômetro.
- Analisar o efeito da intensidade comparando teste incremental e exercício aeróbio a 90% LL sobre a atividade de calicreínas plasmáticas e a resposta de pressão arterial pós-exercício em diabéticos tipo 2 (DM2) e não diabéticos (NDM2).
3. JUSTIFICATIVA E RELEVÂNCIA
O DM2 faz parte do grupo de doenças crônico não transmissíveis que vem crescendo e alcançando proporções epidêmicas. O número de indivíduos com diabetes aumenta devido ao crescimento populacional, envelhecimento, urbanização, aumento da obesidade e sedentarismo (Wild et al., 2004).
Atualmente são reconhecidamente estabelecidos os inúmeros benefícios do exercício relacionado à saúde, assim como seus efeitos positivos nas respostas fisiológicas, psicológicas, capacidades funcionais, em diversas doenças, saúde mental e qualidade de vida (Vuori, 1998). Além disso, cardiopatias, diabetes e obesidade, são as principais causas de mortalidade e incapacidade no mundo, e o sedentarismo é um dos principais fatores de risco para o seu desenvolvimento. Desta forma, diversos órgãos e entidades têm criado programas para o incentivo da prática de atividade física (Waxman, 2003; Brandes & Walter, 2007; Richert, Webb, Morse, O'Toole, & Brownson, 2007; Liou, 2008). Entretanto, são necessários mais estudos a fim de se compreender os mecanismos responsáveis pelos benefícios e possibilitar prescrição adequada de exercícios físicos.
Os principais benefícios do exercício para DM2 são a melhora do controle glicêmico, redução do risco cardiovascular, redução do peso corporal e melhora da auto-estima (Sigal, Kenny, Wasserman, Castaneda-Sceppa, & White, 2006; Sociedade Brasileira de Diabetes, 2008).
A redução do risco cardiovascular está diretamente relacionada ao controle da PA. Indivíduos DM2, comumente apresentam hipertensão arterial o que aumenta o risco de doenças cardiovasculares devido a alterações durante a progressão da doença na integridade vascular e no miocárdio (De Jager et al., 2006). Algumas destas mudanças estão relacionadas à função endotelial e ação de peptídeos vasoativos envolvidos no sistema calicreína-cinina (Resnick & Howard, 2002; Henry et al., 2003; De Jager et al., 2006; Spillmann, Van Linthout, Schultheiss, & Tschöpe, 2006).
4. REVISÃO DE LITERATURA
4.1. Diabetes Mellitus
A relação entre DM e insulina foi estabelecida em 1889, quando o médico Oskar Minkowski demonstrou em seus estudos que através da retirada do pâncreas de cachorros a urina se tornava alvo de moscas. Verificou-se que havia açúcar na urina dos animais. Por meio desta simples observação, concluiu-se que o pâncreas produzia alguma substância que controlava a concentração de açúcar no sangue e que quando retirado resultava em DM. Após cerca de 30 anos, Frederick Banting e colaboradores identificaram o princípio ativo no pâncreas como sendo a insulina. A concepção do papel da insulina como principal componente no controle da glicemia foi então reconhecido em 1921. Através desta descoberta, a etimologia do DM foi associada com o metabolismo anormal de glicose (McGarry, 1992).
O DM não se caracteriza apenas por um simples problema no mecanismo de captação de glicose, e sim por um grupo heterogêneo de distúrbios metabólicos que aumentam o risco cardiovascular. Vários processos estão envolvidos no desenvolvimento do DM sendo a deficiência e/ou resistência à insulina o principal fator relacionado a falência das células beta do pâncreas. Estas características freqüentemente aparecem juntas no mesmo indivíduo sendo a causa primária de aumento da glicemia no sangue - hiperglicemia (Garber et al., 2004).
diagnosticado após os 40 anos e estar associado à hipertensão, dislipidemia e obesidade (Sociedade Brasileira de Diabetes, 2008).
Os métodos e critérios para o diagnóstico do diabetes mellitus tipo 2 além das classificações indicadas abaixo na Tabela 1 incluem segundo a Sociedade Brasileira de Diabetes, 2008:
- sintomas de poliúria, polidipsia e perda ponderal acrescidos de glicemia acima de 200mg/dl;
- glicemia de jejum ≥ 126 mg/dl;
- glicemia de 2 horas pós-sobrecarga de 75g de glicose acima de 200mg/dl.
Tabela 1- Limites diagnósticos para diabetes e alterações na regulação da glicose
Categoria Glicemia de jejum 2h alimentado
Normal < 100 mg/dl (< 5,6 mmol/l)
< 140 mg/dl (< 7,8 mmol/l)
Intolerância a glicemia de jejum
100 – 125 mg/dl
(5,6 – 6,9 mmol/l) _
Intolerância a glicemia
pós-prandial _
140 – 199 mg/dl (7.8 – 11.0 mmol/l) Diabetes ≥ 126 mg/dl (≥ 7,0
mmol/l)
≥ 200 mg/dl (≥11,1 mmol/l)
(Adaptado do American Diabetes Association. Diagnosis and Classification of Diabetes Mellitus, Follow-up Report on the Diagnosis of Diabetes Mellitus. Diabetes Care 31 Suppl 1:S55-60, 2008)
4.2.Hipertensão arterial (HA)
A hipertensão arterial (HA) é uma das doenças com maior prevalência no mundo sendo caracterizada pelo aumento da pressão arterial. A manutenção da pressão arterial normal depende do balanço entre débito cardíaco (DC) e resistência vascular periférica (RVP) (Beevers, Lip, & O'Brien, 2001).
O DC refere-se à freqüência cardíaca (FC) multiplicada pelo volume sistólico (VS), portanto fatores que afetam estes componentes alteram o DC. Já a RVP geralmente é alterada devido a anormalidades na estrutura das artérias que envolvem a combinação de processos de remodelamento. Na maior parte dos casos de HA o DC não sofre alteração, apenas a RVP (Intengan & Schiffrin, 2000).
A HA relaciona-se ao estreitamento do lúmen interno, ocasionado pela aterosclerose e aumento da espessura da parede da artéria, devido ao remodelamento eutrófico. Tal remodelamento está associado com alterações nas propriedades elásticas e colágenas da parede das artérias aumentando a RVP (Rizzoni et al., 1996; Rizzoni et al., 2001).
Outros fatores que contribuem para a elevação da PA incluem mudanças no sistema renina-angiotensina (SRA), sistema nervoso autonômico (SNA), hipercoagubilidade, substâncias vasoativas, disfunção endotelial e redução da capacidade vasodilatadora, sensibilidade à insulina e fatores genéticos (Beevers et al., 2001).
O aumento da PA é o principal fator de aumento do risco cardiovascular, sendo sua classificação descrita abaixo (Tabela 2).
Tabela 2 - Classificação da pressão arterial para adultos acima de 18 anos. Classificação Pressão Arterial Sistólica
(mmHg)
Pressão Arterial Diastólica (mmHg)
Normal < 120 e < 80
120 – 129 e 80 - 84
Pré-Hipertensão
130 – 139 ou 85 - 89
Hipertensão nível 1 140 – 159 ou 90 - 99
160 – 179 ou 100 - 109
Hipertensão nível 2
≥180 ou ≥110
4.3.Disfunção Autonômica Cardíaca
A disfunção autonômica cardíaca, ou disautonomia cardíaca, é um distúrbio funcional que resulta em alterações nos componentes do sistema nervoso autonômico. Uma prejudicada função autonômica cardiovascular tem sido relatada em cerca de 20% dos diabéticos assintomáticos e relaciona-se a neuropatia autonômica (Boulton et al., 2005).
Diversos mecanismos estão envolvidos na neuropatia autonômica os quais incluem ativação hiperglicêmica do mecanismo da via do poliol, levando a acumulação de sorbitol que pode causar danos neuronais periféricos e cardíacos. Outro fator é a maior ativação da proteína C reativa, comumente associada a diabéticos tipo 2, causando vasoconstrição acarretando redução fluxo do sanguíneo neural. O aumento de estresse oxidativo, desencadeado pela vasoconstrição, e conseqüente aumento na produção de radicais livres, causa danos endoteliais vasculares e reduz a biodisponibilidade de óxido nítrico. (Vinik et al., 2003). Alguns estudos apontam para uma prejudicada ação do tônus parassimpático e simpático em diabéticos tipo 2, o que afetaria o controle da pressão arterial e aumentaria o risco cardíaco (Vecchione, Argenziano, Fratta, Pompeo, & Trimarco, 2000; Huggett et al., 2003).
A análise espectral apresenta três principais componentes LF (Low Frequency ou Baixa Freqüência), HF (High Frequency ou Alta Freqüência) e a razão LF/HF. O LF relaciona-se a atividade tônica barorreflexa, que se refere predominantemente a ação simpática. O HF, expressa exclusivamente a influência parassimpática sobre o nodo sinusal. Já o LF/HF, representa a razão entre as áreas espectrais absolutas de baixa (LF) e de alta freqüência (HF), que é um índice do balanço vago-simpático (Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology, 1996).
4.4.Resistência à insulina e complicações cardiovasculares
A resistência à insulina diminui a translocação do transportador de glicose para a borda da membrana celular elevando a glicemia plasmática. A elevação glicêmica, denominada hiperglicemia é percebida pelas células ß do pâncreas que aumentam a secreção de insulina resultando em hiperinsulinemia. A estimulação continuada da secreção de insulina causa resistência à insulina, hipertrofia das células ß e posteriormente falha na secreção adequada de insulina (Saltiel, 2000) (Figura.1).
Figura 1 - Estágios Metabólicos do Diabetes Tipo 2 (Adaptado de Saltiel, 2000).
A hiperinsulinemia pode resultar em um aumento de reabsorção de sódio e água pelos rins (DeFronzo, Cooke, Andres, Faloona, & Davis, 1975) o que prejudica o controle da pressão arterial. Além disso, provoca alterações na modulação autonômica e aumento do
Resistência à Insulina
Intolerância à glicose
Diabetes fase inicial
Diabetes fase tardia
Hiperinsulinemia
Diminuição da ação da insulina
Falência célula β
tônus simpático conforme já relatado em indivíduos obesos e com resistência à insulina (Landsberg, 1999).
A hipertensão arterial e resistência à insulina têm sido relacionadas através de anormalidades no fluxo sanguíneo e vasodilatação. Laakso., et al (1990), relataram em seu estudo, que insulina intravenosa em sujeitos não diabéticos causa vasodilatação e esta resposta apresenta-se deficiente em obesos, indivíduos resistentes à insulina e diabéticos tipo 2.
A vasodilatação arterial é mediada pelo endotélio vascular e sua disfunção está relacionada a perda da propriedade vasoprotetora do endotélio e representa a etapa inicial de vários processos de lesão vascular, hipercolesterolemia, aterosclerose, HA, entre outros (Iturry-Yamamoto, Alves, & Picon, 1997). A disfunção endotelial relaciona-se diretamente com a resistência à insulina e hiperglicemia pelo fato de lesões na parede vascular impedirem a ação da insulina e captação de glicose. Este efeito resulta em decréscimo de produção endotelial de moléculas de óxido nítrico anti-aterogênicas presentes nas artérias de indivíduos diabéticos e aumento da proliferação de células musculares vasculares lisas ocasionando aterosclerose e HA (Brownlee, 2001).
A aterosclerose leva à obstrução das artérias tanto pela aumento da glicemia quanto pelo acúmulo de lípides (principalmente colesterol) em suas paredes. Seu desenvolvimento baseia-se em desordens metabólicas (hiperglicemia levando a hiperinsulinemia), sendo precedida por relativa ineficiência no relaxamento endotélio dependente mediado pelo óxido nítrico. Em condições de hiperglicemia tal disfunção endotelial se desenvolve rapidamente
(minutos ou horas) aumentando o risco cardiovascular (Marfella, Quagliaro, Nappo, Ceriello, &
Giugliano, 2001).
4.5.Risco de Doença Arterial Coronariana e o Sistema Calicreína-Cinina (SCC)
O sistema calicreína-cinina (SCC) foi descoberto em 1909, quando Abelous e Bardier detectaram a presença de uma substância hipotensiva na urina de homens sadios o qual chamaram de “urohipotensina”. Entretanto, o sistema de formações de cininas somente foi reconhecido em 1926, quando Frey e colaboradores observaram queda na PA após injeção intravenosa de secreção pancreática e urina em cachorros normotensos anestesiados. Uma hipótese para este efeito seria um princípio ativo presente na urina e no pâncreas, que nomearam de calicreína do grego que significa pâncreas. Mais tarde, foi demonstrado que a calicreína sozinha não era responsável por esta resposta e sim um “sistema” que envolvia outras substâncias (Sharma et al., 1996).
O SCC exerce funções importantes para o controle da PA. Os efeitos vasodilatadores natriuréticos e diuréticos das cininas são mediados pela liberação de hormônios através da ação de enzimas proteolíticas como as cininoginases, contrapondo-se ao sistema de vasoconstrição, mediado pelo sistema renina-angiotensina (Schmaier, 2002).
As calicreínas do tecido atuam sobre o cininogênio formando peptídeos vasoativos, as cininas, sendo a mais importante delas a bradicinina. Cininas, ainda apresentam função de regulação renal e do fluxo sanguíneo e excreção de água e sódio atuando no controle da PA (Sharma & Sharma, 2002). As cininas são peptídeos pró-inflamatórios que mediam numerosas respostas vasculares e de dor em caso de lesões teciduais. Dois receptores de cininas foram subdivididos, identificados e classificados em B1 e B2. O receptor B2 atua em resposta a bradicinina (Leeb-Lundberg, Marceau, Müller-Esterl, Pettibone, & Zuraw, 2005).
Em indivíduos diabéticos, o SCC apresenta mecanismos cardioprotetores através de melhora na captação de glicose e outros fatores. A lenta taxa no transporte de glicose para a membrana sarcoplasmática provavelmente causa depleção dos transportadores de glicose (GLUT 1 e 4) em diabéticos tipo 2. A bradicinina tem demonstrado melhorar a sensibilidade à insulina estimulando a translocação do GLUT4 prevenindo a desfosforilação de IRS1 nas células musculares esqueléticas.
diastólica. Possui ainda, propriedades anti-inflamatórias, anti-fibróticas e angiogênese o que faz do sistema um alvo potencial para estratégias terapêuticas (Spillmann et al., 2006).
O DM ocasiona alterações quantitativas e qualitativas na parede elástica da artéria e colágeno, mudanças estruturais causadas pela hiperglicemia, hiperinsulinemia, estresse oxidativo, inflamação crônica, disfunção endotelial, aterosclerose e ação ineficiente do SCC (Rizzoni et al., 2001; Henry et al., 2003; De Jager et al., 2006).
4.6.O Papel do Exercício Físico no tratamento do Diabetes Tipo 2
O exercício pode auxiliar diabéticos no controle glicêmico e de pressão arterial, minimizando riscos de hiperglicemia os quais previnem o desenvolvimento e progressão de macro e microangiopatias como demonstrado em diversos estudos (Parson, Holton, Marliss & Vranic, 2002; Nunnold, & Vinik, 2003;Chakraphan et al., 2005; Colberg, Praet et al., 2006; Tsatsoulis & Fountoulakis, 2006). O efeito do exercício é similar a ação da insulina na captação de glicose (Hayashi, 1997; Hayashi, 2005).
A sinalização intracelular da insulina em tecidos insulino sensíveis inicia-se com a ligação do hormônio a um receptor específico de membrana. O receptor de insulina (IR) é formado por duas subunidades α localizadas na parte externa da membrana e duas subunidades β transmembrana. Uma vez ligada a subunidade α, a insulina estimula a autofosforilação da região intracelular do receptor, correspondente a subunidade β. A autofosforilação do receptor de insulina ativa a fosforilação de vários substratos protéicos como os membros da família dos substratos do receptor de insulina (IRS-1,2,3 e 4) (Brownlee, 2001). Os principais substratos do receptor de insulina são IRS-1 e o IRS-2, que quando fosforilados em tirosina se ligam e ativam proteínas como a fosfatidil-inositol-3-quinase (PI 3-K). A PI 3-K quando ativada é essencial para o transporte de glicose pois estimula a translocação do transportador de glicose para a membrana permitindo a captação de glicose (Kirwan & del Aguila, 2003).
O exercício em jovens sedentários aumenta a sinalização do receptor de insulina IRS-2 associado à atividade da PI 3-K no músculo esquelético conforme constatado por (Howlett, Sakamoto, Yu, Goodyear, & Hargreaves, 2006). Estes resultados ocorrem segundo os autores devido à ação de proteínas e cinases induzidas pelo exercício com duração de 60 minutos a 75% do VO2 pico.
A comparação entre a ativação de IRS-1 associada a PI3-K em jovens sedentários e treinados também comprovou que o exercício regular aumenta a ativação da PI3-K associada ao IRS-1 facilitando a captação de glicose mediada pela insulina (Kirwan et al., 2000).
glicose no músculo esquelético resistente à insulina. Sessão única de exercício aeróbio com duração de 30-60 minutos, e intensidade relativa à 60-70 % do VO2máx pode reduzir
significativamente as concentrações de glicemia plasmática (Henriksen, 2002).
Estudos demonstram que o exercício induz translocação do GLUT4 no músculo esquelético em indivíduos com ou sem DM2 (Kennedy, 1999; Hayashi, 2005; Suh, 2007), por meio de uma via não insulino dependente podendo o SCC ser um dos fatores responsáveis tanto pela estimulação da captação de glicose durante o exercício (Kishi, 1998; Taguchi, 2000) quanto pela maior biodisponibilidade de óxido nítrico (Maiorana, 2003) auxiliando desta forma na melhora da sensibilidade à insulina e no controle da PA.
Já os benefícios cardiovasculares decorrentes do exercício físico, ocorrem principalmente por meio da melhora da função vasodilatadora endotelial (Chakraphan et al., 2005; Zhu, Zhong, Yu, & Li, 2007) e aumento da sensibilidade à insulina uma vez que a elevação da glicemia representa fator de risco cardiovascular (Jaap, 1997; Brownlee, 2001; Praet, 2006). O exercício físico agudo promove diversas mudanças em parâmetros hemodinâmicos cardiovasculares alterando a função vasodilatadora e aumentando o fluxo sanguíneo para os músculos ativos (Andersen & Saltin, 1985; Walløe & Wesche, 1988).
No início do exercício a ação mecânica de contração e relaxamento do músculo esquelético cria uma “bomba-muscular” que causa um imediato aumento do fluxo sanguíneo para o trabalho muscular. Com a continuidade da atividade muscular, metabólitos com propriedades vasoativas são liberados dos músculos para o fluido intersticial e agem diretamente nas arteríolas terminais. Substâncias que estão envolvidas na vasodilatação incluem íons potássio, metabólitos como adenosina e a liberação do óxido nítrico do endotélio dos vasos do músculo ativo (Maiorana, O'Driscoll, Taylor, & Green, 2003).
A redução da biodisponibilidade de óxido nítrico está relacionada a disfunção endotelial (Guerci, Kearney-Schwartz, Böhme, Zannad, & Drouin, 2001) podendo ser minimizada através da prática do exercício físico que atua aumentando a capacidade vasodilatadora (Clarkson et al., 1999; Chakraphan et al., 2005; De Filippis et al., 2006; Farsidfar, 2008). Atletas idosos treinados, apresentam maior vaso reatividade endotelial comparada a indivíduos sedentários de mesma idade (Rywik et al., 1999).
(Oliveira, Luz, & Ramires, 1998). A avaliação da função endotelial durante e após o exercício possibilita identificar risco cardiovascular e auxiliar na prescrição mais adequada e eficiente.
Colberg et al., (2003), avaliaram os efeitos de sessão aguda de exercício em cicloergômetro na disfunção endotelial de DM2 e não diabéticos tipo 2 (NDM2) através do fluxo sanguíneo do pé utilizando doppler. Indivíduos diabéticos apresentaram menor fluxo sanguíneo comparado aos não diabéticos independentemente da atividade física. Entretanto, os indivíduos diabéticos após exercício apresentaram maior fluxo sanguíneo comparado aos diabéticos que não se exercitaram apesar dos valores de óxido nítrico não se alterarem no período pré e pós-teste. Concluiu-se que o exercício atua prevenindo ou reduzindo falhas nas respostas de fluxo sanguíneo encontradas em DM2.
As respostas agudas ao exercício no perfil bioquímico, hemodinâmico e de estresse oxidativo em DM2 foram descritas por Villa-Caballero et al., (2007). Neste estudo, foram investigados os efeitos de uma única sessão de exercício incremental em esteira a 85% do VO2máx em DM2 sedentários, DM2 ativos e NDM2 sedentários. DM2 ativos apresentaram
melhores respostas hemodinâmicas e glicêmicas durante e após o exercício. Os efeitos pós-exercício foram avaliados somente por alguns minutos.
Os benefícios do exercício são inúmeros e diversos estudos, como os citados acima buscam melhor compreender os mecanismos responsáveis pela captação de glicose durante o exercício e melhora das respostas hemodinâmicas em indivíduos diabéticos. Entretanto nenhum deles investigou as respostas de PA por algumas horas após o término da atividade e suas possíveis relações com o SCC em DM2.
4.6.1. Parâmetros de intensidade de Exercício Físico
et al., 2000). Já a Associação Americana de Diabetes - American Diabetes Association (ADA) indicam 150min/semana de atividade física aeróbia moderada, ou pelo menos 90 minutos de atividade física vigorosa distribuídos em pelo menos 3 dias por semana (Sigal et al., 2006). A Sociedade Brasileira de Diabetes - SBD, por meio de suas diretrizes propõe exercício aeróbio 3 a 5 vezes na semana com duração de 30 a 60 minutos ou acúmulo de 150 minutos/semana em intensidade moderada (Sociedade Brasileira de Diabetes, 2008).
Para o ACSM, a atividade de baixa a moderada representa 40-70% do VO2máx, para a
ADA a atividade moderada compreende de 40-60% VO2máx e para a SBD 50-70% VO2máx.
Diferenças entre delimitações de intensidade dificultam a prescrição adequada do exercício. Pode-se observar que o VO2máx é bastante utilizado como parâmetro de intensidade
de exercício físico e representa a mais alta captação de oxigênio alcançada por um indivíduo, sendo considerada por muitos como padrão ouro na avaliação da aptidão aeróbia que reflete uma integração entre os sistemas cardiovascular, respiratório e muscular (Astrand, 1956).
Alguns estudos demonstraram, entretanto, baixa correlação do VO2máx com o
desempenho, e propõem o limiar de lactato (LL) como um meio mais sensível e eficaz da avaliação e prescrição aeróbia (Kawaji, 1989; Belman, 1991; Meyer, 2005).
O LL é considerado um bom parâmetro de avaliação de intensidade de exercício físico uma vez que delimita as intensidades entre a transição aeróbia e anaeróbia e ou de equilíbrio entre a produção e remoção de lactato (Hollmann, 1985; Kindermann, Simon, & Keul, 1979). Parâmetros ventilatórios identificam o LL acima da qual a concentração sanguínea de lactato aumenta de forma progressiva e a ventilação pulmonar se intensifica também de maneira desproporcional ao oxigênio consumido (Wasserman, Van Kessel, & Burton, 1967). Alguns estudos descrevem a utilização do LL como segura e eficiente na avaliação e prescrição do exercício para indivíduos diabéticos por representar uma intensidade de baixo estresse metabólico (Belli et al., 2007; Kunitomi et al., 2000).
As recomendações de intensidade para prescrição de exercícios para indivíduos diabéticos interferem nos benefícios alcançados, porém não existem estudos que investigaram as respostas hemodinâmicas e de calicreínas durante as intensidades recomendadas para esta população e nem em intensidades próximas ao LL.
Hayashi et al., (2005) compararam os efeitos de sessão aguda de exercício com duração de 20 min seguindo as recomendações do ACSM (70% VO2máx) e do ADA (50%
4.6.2. Influência do exercício na captação de glicose
Em diversos estudos, foram encontrados efeitos benéficos do exercício na captação de glicose (Rose, 2005; Hayashi, 2005; Villa-Caballero, 2007). Os resultados evidenciando o aumento na captação de glicose e melhora da sensibilidade à insulina relacionam-se a um mecanismo não-insulino dependente uma vez que durante o exercício ocorre redução da liberação de insulina. Neste período, a regulação de glicose está relacionada à contração muscular, e o treinamento físico acarreta um aumento de 20-30% na estimulação do metabolismo de glicose (Yu et al., 2001). Adaptações celulares, moleculares e fisiológicas contribuem para estes resultados incluindo maior captação de glicose pelo músculo esquelético, aumento do fluxo sanguíneo e capilarização , aumento da atividade enzimática no músculo, aumento da translocação de GLUT4 e aumento da sinalização insulínica (Kirwan & del Aguila, 2003).
Segundo Holloszy, (2005), algumas evidências apontam que a depleção de glicogênio causada pelo exercício físico reduz a ação da insulina, porém aumenta a sua sensibilidade e os números de transportadores de glicose pelo músculo esquelético (GLUT4) promovendo maior captação. Além disso, existe a hipótese de que a translocação do GLUT4 seja mediada pela “força” de sinalização gerada, sendo o exercício, devido a maior sinalização, responsável pelo maior aumento da translocação do GLUT4 e captação de glicose quando comparado à insulina.
4.6.3. Hipotensão Pós-Exercício
O exercício físico além de aumentar a captação de glicose auxilia também no controle da PA. Entre diversos efeitos anti-hipertensivos destaca-se a Hipotensão Pós-Exercício (HPE) como importante fator contibuidor na redução da PA.
A HPE é um fenômeno que se caracteriza pela diminuição dos valores de pressão arterial comparado ao repouso pré-exercício por minutos ou horas após sessão aguda de exercício físico. Diversos estudos confirmam a ocorrência de HPE (MacDonald et al., 1999; Melo, Alencar Filho, Pescatello et al., 2003; Dujić et al., 2006; Tinucci, Mion, & Forjaz, 2006) sendo a magnitude da queda dependente de diversos fatores.
Segundo Kenney & Seals (1993); a magnitude de queda da PA pode chegar após exercícios máximos a 18 - 20 mmHg na PAS e 7 - 9 mmHg na PAD em hipertensos e entre 8 - 10 mmHg na PAS e 3 - 5 mmHg na PAD em normotensos.
4.6.3.1.Possíveis mecanismos envolvidos na Hipotensão Pós-Exercício (HPE)
Os possíveis mecanismos envolvidos na HPE incluem sistema hormonal, sistema nervoso simpático, liberação de substâncias vasoativas e mudanças hemodinâmicas. Como a PA é resultado do débito cardíaco e da resistência vascular periférica, alterações nestes componentes podem resultar em redução da PA (Kenney & Seals, 1993).
Alterações no volume sanguíneo, termorregulação, atividade nervosa simpática, adrenalina e noradrenalina, sistema renina angiotensina, vasopressina, potássio, adenosina e prostaglandinas, opióides e serotonina além de sensitividade vascular reduzida são os principais fatores que afetam o débito cardíaco e a resistência vascular periférica e por estes motivos envolvidos na HPE (MacDonald, 2002).
elevada ou não sofrer alteração após o exercício, a redução do débito cardíaco é mediada principalmente pelo volume sistólico segundo estes autores.
Fatores periféricos como o aumento do fluxo sanguíneo durante o exercício está associado com a estimulação do endotélio vascular e liberação de óxido nítrico. Estudos sugerem que o exercício aumenta a liberação de óxido nítrico que atenua a vasoconstrição em resposta a estimulação do receptor α adrenérgico (Halliwill, Minson, & Joyner, 2000; Maiorana et al., 2003).
O endotélio é ativado durante o exercício e o treinamento está associado ao aumento da capacidade vasodilatadora (Halliwill et al., 2000; Maiorana et al., 2003). Os efeitos agudos, porém ainda não foram totalmente esclarecidos. O SCC pode estar envolvido na HPE (Moraes, 2007; Pontes, 2008) já que sua deficiência (redução na excreção de calicreína) está relacionada ao desenvolvimento de hipertensão arterial (Sharma et al., 1996) e durante o exercício pode ocorrer maior liberação de cininas (Taguchi et al., 2000) que podem desencadear vasodilatadores e natriuréticos.
4.6.3.2.Fatores que influenciam a Resposta de Pressão Arterial pós-exercício
A resposta de pressão arterial pós-exercício pode ser influenciada por vários fatores como liberação de substâncias vasodilatadoras, perda do controle simpático eferente, intensidade, tipo e duração do exercício, nível de atividade física e função autonômica cardíaca.
Os valores de PA pré-exercício parecem ser determinantes nas respostas pós exercício uma vez que indivíduos hipertensos apresentam maior HPE quando comparados a indivíduos normotensos (Forjaz et al., 2000; MacDonald et al., 2002). Pelo fato de indivíduos hipertensos possuírem grandes benefícios com a HPE a maior parte dos estudos foram conduzidos com esta população (Blanchard et al., 2006; MacDonald et al., 2002; Melo et al., 2006). Indivíduos diabéticos possuem maior probabilidade de desenvolver HA, sendo assim, sugere-se que a resposta da PA pós-exercício poderia ser mais evidenciada, entretanto fatores como disfunção autonômica e endotelial poderiam prejudicar tais respostas.
& Krassioukov, 2006). A neuropatia periférica é uma síndrome de perda sensorial, atrofia e fraqueza muscular, e decréscimos nos reflexos profundos e sintomas vasomotores comumente associados ao diabetes. Desta forma indivíduos DM2 podem apresentar alterada resposta ao exercício devido à neuropatia periférica e autonômica interferir na resposta simpática eferente.
A intensidade, duração e tipo do exercício tem grande influência na PA pós-exercício. O efeito da intensidade e duração foi investigado por diversos autores (Forjaz, Matsudaira, Rodrigues, Nunes, & Negrão, 1998; Forjaz et al., 2004; Pescatello et al., 2004). Apesar de não estar totalmente estabelecido, o exercício mais intenso e de maior duração parece produzir maior decréscimo e sustentação da HPE. Indivíduos DM2 apresentam menor capacidade ao exercício (Kuo, Yen, Chen, Yu, & Bean, 2007; Sui et al., 2008) o que pode interferir na intensidade e duração do mesmo.
O nível de condicionamento físico e sua interferência na HPE foram investigados por Senitko, Charkoudian, & Halliwill, (2002) no qual foi constatada HPE resultante de vasodilatação arterial em sedentários homens e mulheres. A mesma resposta de HPE foi verificada em mulheres treinadas, entretanto, em homens treinados a HPE ocorreu devido à redução do débito cardíaco comprovando assim, a influência de diferentes mecanismos causadores de HPE.
A comparação de respostas hipotensoras entre diferentes tipos de exercício, esteira e cicloergômetro, foi realizada no estudo de Lizardo, Modesto, Campbell, & Simões, (2007). Foram encontradas maiores respostas hipotensoras em esteira ergométrica, sendo maiores os valores de FC máx e FC final nas sessões realizadas em esteira. Este fato pode ser explicado segundo os autores, devido o exercício em cicloergômetro ser interrompido devido à fadiga local de membros inferiores antes que o desempenho máximo tenha sido atingido.
A atividade nervosa simpática pode ser influenciada pela liberação da insulina (Fossum et al., 2004), e assim afetar as respostas hemodinâmicas. Os efeitos da infusão de insulina (hiperinsulinemia) pós-exercício na atividade nervosa simpática muscular e HPE, foram investigados por Forjaz et al., (1999) em jovens saudáveis (30 ± 2 anos). A sessão de exercício (45 minutos a 50% VO2 pico) não alterou a sensibilidade à insulina e exacerbou o
aumento da atividade nervosa simpática muscular sem alterar a resistência vascular, o fluxo sanguíneo do antebraço e a pressão arterial em resposta a hiperinsulinemia pós-exercício (Forjaz et al., 1999).
5. MATERIAIS E MÉTODOS
5.1.Procedimentos
As sessões de coleta de dados foram realizadas no Laboratório de Avaliação Física e Treinamento (LAFIT) e Laboratório de Estudos em Educação Física e Saúde (LEEFES) localizados no Campus da Universidade Católica de Brasília - UCB (Taguatinga), e contaram com a presença de um médico cardiologista. Os laboratórios possuem adequada infra-estrutura para a realização de pesquisas envolvendo grupos especiais como diabéticos, bem como desfibrilador e medicamentos necessários em ocorrências emergenciais.
As coletas dos dados para a pesquisa foram aprovadas pelo Comitê de Ética em Pesquisa com Seres Humanos da Secretaria Estadual de Saúde do Distrito Federal n. 210/2006 CEP SES DF.
O presente estudo foi aprovado e financiado pelo Comitê Assessor de pesquisa do Programa de Cooperação Acadêmica (PROCAD) da CAPES (Coordenação de Aperfeiçoamento de Pessoal de Nível Superior) em janeiro de 2006.
5.2.Estudos 1 e 2 - Hipotensão pós-exercício: atividade da calicreína plasmática e variabilidade da freqüência cardíaca
5.3.Voluntários
Foram selecionados para a pesquisa 23 voluntários, sendo 13 DM2 que não apresentaram complicações diabéticas (macroangiopatias, retinopatias, nefropatias, neuropatias, pé diabético com feridas) e 10 NDM2, ambos com idade entre 40 e 60 anos. Os voluntários foram informados sobre os procedimentos, riscos e benefícios da pesquisa e assinaram um Termo de Consentimento Livre e Esclarecido - TCLE (Anexo A).
A pesquisa foi realizada por meio de 4 visitas e 3 sessões experimentais, em dias distintos no período da manhã, com intervalo de no mínimo 24h entre elas num período de no máximo 10 dias. As datas das coletas foram agendadas com o voluntário de acordo com sua disponibilidade. Os dados coletados foram e serão utilizados para fins acadêmicos, mantendo-se sigilo total quanto à identificação dos participantes, utilizando-mantendo-se para isso as iniciais dos nomes dos voluntários.
Na primeira visita, foram realizadas a anamnese (Anexo B), coleta de sangue capilarizado e venoso para dosagem da glicemia e atividade de calicreína em jejum. Na segunda visita, que ocorreu no laboratório (LAFIT), foram realizadas avaliações antropométricas - peso, estatura, perímetros, dobras cutâneas e eletrocardiograma (ECG) de repouso e posteriormente o Teste Incremental. A terceira e quarta visitas, randomizadas, constituíram da sessão de exercício a 90% LL e sessão controle.
Tabela 3 – Disposição dos voluntários que participaram da pesquisa
DM2 NDM2 Total
Estudo 1* 10 10 20
Estudo 2** 5 5 10
Estudo 1 e 2*** 2 5 7
Tabela 4a - Caracterização da amostra do estudo 1
Grupo Idade
(anos)
Peso
(kg)
IMC
(kg.m2-1)
Circunferência Abdominal
(cm)
VO2pico
(mlO2.kg.min -1)
Tempo de DM2
(anos)
DM2 53,6 ±6,5* 89,3 ± 16,9 30,6 ± 5 104,3 ± 14,2 20,5 ± 4,9* 5,9 ± 4,3
NDM2 47,5±5,2 84,3±11,9 28,3±4,3 95,1±8,1 24,8 ± 4,4 -
DM2: 10 indivíduos diabéticos tipo 2, NDM2: 10 indivíduos não diabéticos tipo 2; * p ≤ 0,05 em relação ao grupo NDM2. IMC: índice de massa corporal.
Tabela 4b-Caracterização da amostra do estudo 2
Grupo Idade
(anos)
Peso
(kg)
IMC
(kg.m2-1)
Circunferência Abdominal
(cm)
VO2pico
(mlO2.kg.min -1)
Tempo de DM2
(anos)
DM2 53,6 ± 3,8 74,7 ± 13,5 28,8 ± 2,3 98,8 ± 7,1 20,4 ± 4,2* 6,2 ± 4,7
NDM2 49,2 ± 6,2 79,8 ± 12,9 27,7 ± 3,3 92,8 ± 9,2 29,9 ± 7,4 -
DM2: 5 indivíduos diabéticos tipo 2, NDM2: 5 indivíduos não diabéticos tipo 2; * p ≤ 0,05 em relação ao grupo NDM2. IMC: índice de massa corporal.
5.3.1. Critérios de Inclusão
1) Ser portador de diabetes mellitus tipo 2, com glicemia controlada por meio de dieta ou medicamentos;
2) Não fazer uso de insulina exógena; 3) Ter idade entre 40 e 60 anos;
4) Não ter problemas cardiovasculares e não ter histórico de infarto agudo do miocárdio;
5.4.Testes
5.4.1. Teste Incremental (TI) e determinação do Limiar de Lactato (LL)
O voluntário foi orientado para comparecer ao laboratório (LAFIT) não tendo realizado atividades físicas e não tendo ingerido bebidas alcoólicas e/ou cafeinadas 24h precedentes ao Teste Incremental (TI), assim como em todas as sessões experimentais (90% LL e CON). O café da manhã padronizado, (descrito detalhadamente no item 5.5. Refeição Padrão) foi entregue anteriormente para ser consumido 2h antes da realização do TI e de todas as sessões (90% LL e CON).
Antes da realização do TI, o voluntário permaneceu sentado em uma cadeira confortável durante 20 minutos sendo a PA (BP 3AC1-1; Microlife, Berneck, Suíça) e FC (Polar S810i; Kempele, Finland) mensuradas a cada 5 minutos. Ao final dos 20 minutos de repouso, foram coletados 25 µL de sangue capilarizado do lóbulo da orelha para análise de lactato e glicemia e 6ml de sangue venoso para análise da atividade da calicreína plasmática (descritos posteriormente no item 5.7. Coletas sanguíneas).
Foi realizado um eletrocardiograma (ECG) em repouso (MARQUETTE HELLIGE©, Medical Systems, modelo: CardioSmart, versão 3.0 CS-MI) e durante o TI com o objetivo de monitorar e avaliar as respostas cardiovasculares ao exercício físico até exaustão voluntária máxima.
O valor de VO2pico foi obtido no TI, por meio do analisador de gases (Cortex
Biophysik, modelo Metalyzer 3B) estando conectado ao sistema computadorizado ERGOPC Elite® versão 2.0 (MICROMED©, Brasília, DF).
Após o TI, foram continuamente avaliadas a PA, FC, lactato e atividade de calicreína plasmática (ACP) no estudo 1 durante 135 minutos pós-exercício. A VFC foi continuamente avaliada no estudo 2 por 45 minutos após o TI.
A identificação do LL deu-se através da inspeção visual da curva de lactato respectivamente por pelo menos dois avaliadores independentes e experientes. A intensidade em que houve a perda da linearidade com um aumento abrupto e exponencial da curva da lactatemia foi considerada como sendo o LL.
Figura 2. Identificação do Limiar de Lactato
5.4.2. Sessão de Exercício retangular a 90% do Limiar de Lactato (90% LL) e Sessão Controle (CON)
REPOUSO CON , 90% LL ou TI**
RECUPERAÇÃO
min
5 10 15 20 R15 R30 R45
#
R60 R75 R90 R105 R120 R135
6
10 20
6 6 6 6
PA e FC a cada 5 min, coleta de sangue capilarizado e venoso aos 20 min
PA, FC, PSE e coleta de sangue capilarizado aos 10 e 20 min e **TI: ao final de cada estágio de 3 min.
PA, FC e coleta de sangue capilarizado a cada 15 minutos e coleta de sangue venoso aos 15, 45, 90 e 135 min
Figura 3a - Esquema das Sessões Experimentais no estudo 1.
PA: pressão arterial, FC: freqüência cardíaca, PSE: percepção subjetiva de esforço. 6 - Coleta sanguínea venosa para dosagem da atividade da calicreína plasmática. # Ingestão de carboidrato.
No dia da sessão CON não foi realizado exercício físico e foram repetidos todos os procedimentos da sessão 90% LL, exceto a realização do exercício. Foram repetidas as coletas nos mesmos momentos.
Aos 45 minutos pós-exercício (recuperação), no estudo 1, foi administrada uma solução contendo dextrose (0,5g de dextrose por kg de peso corpóreo diluídos em 5ml de água para cada g de dextrose), acrescidas de 10g de limão.
REPOUSO CON , 90% LL ou TI**
RECUPERAÇÃO
min 5 10 15 20 10 20 R15 R30 R45
PA e FC a cada 5 min, coleta de sangue capilarizado aos 20 min e análise da VFC nos 5 min finais do repouso.
PA, FC, PSE e coleta de sangue capilarizado aos 10 e 20 min e no **TI: ao final de cada estágio de 3 min.
PA e VFC de 10-15, 25-30, 40-45 minutos
Figura 3b - Esquema das Sessões Experimentais no estudo 2.
PA: pressão arterial, FC: freqüência cardíaca, PSE: percepção subjetiva de esforço, VFC: variabilidade da freqüência cardíaca.
5.5.Refeição Padrão
elaborado por uma nutricionista. Este 'kit' foi composto por um Mini Bolo de 40g sabor Baunilha (Pullman®), um Suco Light de 200 ml sabor manga (Minute Maid Mais®) e um Biscoito Salgado Integral de 30g (Pit Stop®). As quantidades de nutrientes foram pré-estabelecidas de maneira a haver uma proporção entre carboidratos, proteínas e gorduras adequado para a população diabética. No total, foram oferecidas 315 kcal provenientes de 51,6g de carboidrato (66%), 4,6g de proteínas (6%) e 9,5g de gorduras (27%). O índice glicêmico foi de 73,9%.
5.6.Mensuração da Pressão Arterial
A aferição da PA foi realizada no braço esquerdo à altura do coração utilizando-se esfigmomanômetro de coluna de mercúrio (Esotec, São Paulo, Brasil) durante o exercício, a final de cada estágio de 3 minutos do Teste Incremental (TI), e aos 10 e 20 minutos das sessões 90% LL e CON. As mensurações durante o repouso (5, 10, 15, 20 minutos), e a cada 15 minutos durante o período de recuperação foram realizadas na posição sentada, utilizando-se o aparelho automático BP 3AC1-1 (Microlife, Berneck, Suíça), recomendado e validado pelo protocolo internacional da Sociedade Européia de Hipertensão (Topouchian, El Assaad, Orobinskaia, El Feghali, & Asmar, 2005).
5.7.Coletas sanguíneas
Amostras de sangue capilarizado, para dosagem do lactato, foram obtidas através de punção do lóbulo direito da orelha após 20 minutos de repouso sentado pré-exercício, ao final de cada estágio de 3 minutos do teste incremental, aos 10 e 20 minutos da sessão a 90% LL e CON e durante 135 minutos de recuperação pós-exercício a cada 15 minutos.
realizados procedimentos de assepsia e posteriormente foi inserido cateter intravenoso conectado ao scalp onde foram introduzidos os tubos de ensaio a vácuo.
5.8.Análise do Lactato sanguíneo e Glicemia
A mensuração da glicemia e lactato foram feitas por meio da análise de 25 µL de sangue coletados do lóbulo da orelha durante teste incremental (LL), exercício retangular a 90% LL e a sessão controle (CON). A amostra de sangue foi armazenada em tubos eppendorfs contendo 50 µL de fluoreto de sódio. Durante as coletas de sangue foram utilizadas luvas cirúrgicas e lancetas descartáveis. As amostras foram analisadas pelo método eletro-enzimático, utilizando-se de um analisador de lactato e glicose sanguíneo (YSI 2.700 STAT, Ohio, EUA).
5.9.Análise da Calicreína Plasmática
As amostras sanguíneas foram depositadas em tubos de ensaio de 10ml contendo 100 µl de uma solução contendo 60mg/ml de citrato e 95mg/ml de EGTA, com pH ajustado para 7,0, e posteriormente centrifugadas a 1.500rpm por 15min para separação de alíquotas de 500 µl de plasma para mensuração da atividade de proteínas plasmáticas como as do sistema calicreína-cininas.
por meio da adição de 7,2µl de substrato ZFR-MCA a 3,9mM, que foram acompanhadas por até 5min, com um feixe de luz de ex=380nm e em =460nm e 700V. Estes métodos de
dosagem foram adaptados para permitir o acompanhamento das reações de hidrólise em um escpectrofluorímetro (Hitach F- 2500, Japan) em cubeta de quartzo 10,00mm (Hellma, Germany) com volume de 2ml. A diferença de velocidade de hidrólise do substrato na presença e na ausência de PKSI pode então ser atribuída à atividade de calicreína presente na amostra.
5.10. Análise da Variabilidade da Frequência Cardíaca
A variabilidade da freqüência cardíaca coletada através de intervalos R-R, por meio do frequencímetro Polar S810i (Kempele, Finland) (Gamelin, Berthoin, & Bosquet, 2006) foi transferida via infravermelho por meio de um computador para o software Polar Precision Performance SW e analisada pelo programa HRV Analysis – MatLab (Mathworks Inc., Natick, MA, USA) . Foram analisados (Task Force of the European Society of Cardiology and the North American Society of Pacing and Electrophysiology., 1996) 5 minutos finais do período de repouso, 5 minutos finais do período de exercício ou controle (CON, 90% LL e TI) e na recuperação de 10-15, 25-30 e 40-45 minutos totalizando 45 minutos de pós-exercício. Foi utilizada análise espectral para comparar os componentes de domínio da freqüência: HF (High Frequency– 0,15 – 0,4 Hz), LF (Low Frequency– 0,04 – 0,15 Hz) e LF/HF.
5.11. Tratamento Estatístico
Para o estudo 1, a comparação dos valores da PA durante o período de recuperação pós-exercício em relação ao repouso pré-exercício, foram analisados utilizando-se Anova two-way e quando identificado a presença de valores significantes post hoc de Bonferroni foi aplicado. Para comparações entre as sessões TI, 90% LL e CON foi aplicado Anova one way e post hoc de Bonferroni.
O coeficiente de correlação de Pearson foi utilizado para avaliação das associações entre variáveis antropométricas, metabólicas e hemodinâmicas e de aptidão física em DM2 e NDM2. Foi avaliada também a correlação nas sessões 90%LL e TI entre a PAS de repouso pré-exercício e o menor valor de PAS após o exercício (verificado em R45).
Na análise da atividade da calicreína plasmática no estudo 1, os dados não apresentaram normalidade quanto a sua distribuição e por este motivo foi utilizado o teste não paramétrico de Friedman e quando houve diferença significante o post hoc de Dunn foi empregado para identificar os momentos (tempos).