Núcleo de Pesquisas em Ciências Biológicas - NUPEB
Laboratório de Imunopatologia - LIMP
“Imunogenicidade e Eficácia da Vacina LBSap
em Cães Após Desafio Intradérmico com
Leishmania (Leishmania) chagasi
e
Extrato de Glândula Salivar de
Lutzomyia longipalpis
”
BRUNO MENDES ROATT
BRUNO MENDES ROATT
“Imunogenicidade e Eficácia da Vacina LBSap
em Cães Após Desafio Intradérmico com
Leishmania (Leishmania) chagasi
e
Extrato de Glândula Salivar de
Lutzomyia longipalpis
”
Orientador: Dr. Alexandre Barbosa Reis – Laboratório de Imunopatologia, Núcleo de Pesquisas em Ciências Biológicas, Universidade Federal de Ouro Preto
Co-orientador: Dr. Rodolfo Cordeiro Giunchetti – Laboratório de Imunopatologia, Núcleo de Pesquisas em Ciências Biológicas, Universidade Federal de Ouro Preto
Dissertação apresentada ao Programa de Pós-Graduação em Ciências Biológicas do Núcleo de Pesquisas em Ciências Biológicas da Universidade Federal de Ouro Preto, como parte integrante dos requisitos para obtenção do Título de Mestre em Ciências Biológicas, área de concentração: Imunobiologia de Protozoários.
Catalogação: sisbin@sisbin.ufop.br R628i Roatt, Bruno Mendes.
Imunogenicidade e eficácia da vacina LBSap em cães após desafio
intradérmico com Leishmania chagasi e extrato de glândula salivar de Lutzomyia longipalpis [manuscrito] / Bruno Mendes Roatt. - 2010.
xv, 69f.: il., color; graf., tabs.
Orientador: Prof. Dr. Alexandre Barbosa Reis.
Dissertação (Mestrado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas. Área de concentração: Imunobiologia de protozoários.
1. Leishmaniose visceral canina - Teses. 2. Leishmaniose - Vacinas - Teses. 3. Lutzomyia - Vacinas - Teses. I. Universidade Federal de Ouro Preto. II. Título.
Colaboradores
Dra. Marta LanaI
Dr. Rodrigo Corrêa-OliveiraII Dr. Olindo Assis Martins FilhoIII
Dra. Andréa Teixeira CarvalhoIII Dr. Nelder Figueiredo GontijoIV
Dr. Marcos José MarquesV
I – Laboratório de Doença de Chagas, Núcleo de Pesquisas em Ciências Biológicas, Universidade Federal de Ouro Preto, Ouro Preto, Minas Gerais.
II – Laboratório de Imunologia Celular e Molecular, Instituto René Rachou, Fundação Oswaldo Cruz, Belo Horizonte Minas Gerais.
III – Laboratório de Biomarcadores de Diagnóstico e Monitoração, Instituto René Rachou, Fundação Oswaldo Cruz, Belo Horizonte, Minas Gerais.
IV – Laboratório de Fisiologia de Insetos Hematófagos, Departamento de Parasitologia, Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais, Belo Horizonte, Minas Gerais.
IV – Laboratório de Biologia Molecular e Biotecnologia, Universidade Federal de Alfenas, Alfenas, Minas Gerais.
Suporte Financeiro
FAPEMIG – Fundação de Amparo a Pesquisa de Minas Gerais – Projeto No 2222/2002 CBB
PAPES IIIB – Programa de Apoio a Pesquisa em Saúde, FIOCRUZ/RJ
Convênio CPqRR/UFOP/FEOP/Canil de Experimentação em Leishmanioses.
CAPES – Capacitação de Ensino Superior – Bolsa de Mestrado.
Apoio
Aos meus amados pais Míriam e Salmeron pela minha formação pessoal, pelo exemplo de vida e honestidade;
Ao meu irmão Alexandre, pelo
companheirismo e apoio incondicional na busca dos meus objetivos;
"Ainda não descobri o segredo de acertar sempre. Mas já aprendi a fórmula certa de
fracassar: querer agradar a todos ao mesmo tempo"
A Deus, em primeiro lugar, pelo dom da vida e pela oportunidade de realizar este trabalho, iluminando meu caminho e dando forças para sempre seguir em frente.
A minha família, em especial aos meus pais (Míriam e Salmeron), por se abdicarem muitas vezes dos seus sonhos para realizarem os meus, por serem as pessoas que são me ensinando sempre o caminho correto a seguir com honestidade e perseverança e acima de tudo pela construção da minha formação pessoal. Mãe e Pai, amo vocês. Ao meu irmão Alexandre, que com seu companheirismo e apoio sempre me mostrou um lado diferente da vida, obrigado por me ensinar que com trabalho e dedicação podemos sempre conquistar nossos objetivos.
Aos meus avós Selda e Alarico (in memoriam) e Jarmir e Izabel (in memoriam) por
torcerem por mim, pelos exemplos de vida e pela imensa contribuição no meu processo de formação pessoal que permitiu com que eu superasse limites, sei que aqui ao meu lado e de onde estiverem estão felizes com esta conquista.
A Paula, pela presença, incentivo, compreensão e carinho sempre constantes. Obrigado por estar comigo na realização deste trabalho, sabendo entender meus momentos de ansiedade, nervosismo e preocupação dando sempre uma palavra de conforto e companheirismo, pela sua cumplicidade e por caminhar sempre ao meu lado. Amo você!
Ao meus tio Maurício e Nilce, por sempre estarem presentes nos momentos de tristezas e alegrias, apoiando-me na busca de meus ideais e de minhas conquistas. Aos meus tios e tias, primos e primas que sempre torceram por mim e que participaram me apoiando nas decisões do dia a dia, obrigado.
Aos irmãos cruzvermelhanos e aos amigos da gloriosa República Cruz Vermelha, por fazerem parte importantíssima da minha formação nesses 5 anos de vivência na graduação e “morada” constante em Ouro Preto. Ao irmão e amigo Mr. Bin, por me ensinar o quão é importante aceitar que nem sempre somos os donos da verdade.
Ao meu orientador e amigo professor Alexandre Barbosa Reis, pela confiança depositada em mim para conclusão desse projeto. Obrigado por me ensinar a trabalhar e fazer ciência de modo profissional sempre propondo novos desafios nessa difícil escolha que é a carreira científica. Pelas preciosas oportunidades de desenvolvimento profissional e pessoal. Fica aqui o meu voto de profunda gratidão.
Ao meu co-orientador e amigo professor Rodolfo Cordeiro Giunchetti, pelos ensinamentos na bancada em relação às técnicas e metodologias desenvolvidas nesse trabalho, pela paciência e disposição em compartilhar suas experiências profissionais que foram de grande valia para construção de um pensamento mais crítico em relação à visão científica. Muito obrigado.
À Dra. Andréa Teixeira Carvalho que me auxiliou muito desde os experimentos na bancada, análises, sugestões e entendimento dos resultados. Muito obrigado pela disponibilidade e ajuda em diferentes momentos deste trabalho.
Ao Dr. Rodrigo Corrêa Oliveira, pela colaboração neste trabalho e pelo apoio e estímulo que vem sendo fundamentais ao crescimento e amadurecimento do nosso grupo. Grande parte dos resultados deste trabalho foi obtida em seu laboratório que sempre esteve aberto para nós, desde já meu muito obrigado.
Ao amigo Rodrigo Dian, pelos anos de convivência desde a iniciação científica até o mestrado, pela enorme ajuda na realização deste trabalho, andamos juntos nesse projeto e estamos colhendo juntos os frutos proporcionados por ele. Valeu cara!!!
A todos os amigos do laboratório de Imunopatologia, pela convivência e colaboração nesse trabalho. Em especial aos hoje mestrandos Samuel e Henrique, além dos ICs Levi, Jamille e Fernando por estarem sempre dispostos mesmo às 4:30 da manhã para ajudar nas coletas e processamento do material em Ouro Preto. Ao doutorando Wendel por me ensinar as reações de ELISA anti-Leishmania e sempre se mostrar disposto a ajudar. À
Juliana e Nádia, companheiras de longas datas, pela convivência saudável construída ao longo de 7 anos de trabalho, muito obrigado.
Ao professor Wanderson, Amanda, Carolzinha, Kátia, Sheler, Carol, Caio, Micheline, Lucilene, Lorena, Kelly, Taís, Luíza, Lígia, Isadora, Philipe, Liliane e Flávia pela agradável convivência.
À Maria Chaves pela amizade e preciosa ajuda na manutenção das atividades diárias de nosso laboratório, possibilitando seu funcionamento e organização adequados. À Tânia, atual coordenadora de qualidade e biossegurança em nosso laboratório pelos ensinamentos e ajuda na melhoria da qualidade do nosso ambiente de trabalho.
À Cida, pela presteza e precisão nos serviços da secretaria do programa de pós graduação e pelo empenho em resolver nossos problemas sempre com bom humor.
Aos funcionários do Biotério da UFOP, Hugo, Cristina, Érica, Valton e Jorge, pela grande dedicação na manutenção diária dos animais em experimentação.
Índice
Índice de Tabelas ...VIII Índice de Figuras...IX Índice de Ilustrações ... X Lista de Abreviaturas ...XI Resumo ...XIII Abstract ...XIV
1. Introdução ... 2
2. Revisão da Literatura ... 6
2.1 - Leishmania e Leishmanioses ... 7
2.2 – Aspectos epidemiológicos da leishmaniose visceral canina... 8
2.3 – Bases imunológicas da leishmaniose visceral... 11
2.4 – Vacinologia em Leishmanioses... 17
2.5 – Vacinologia na leishmaniose visceral canina ... 20
3. Justificativa ... 27
4. Objetivos... 29
4.1 – Objetivo Geral... 30
4.2 – Objetivos Específicos ... 30
5. Material e Métodos ... 31
5.1 – Manejo da colônia de cães destinados a experimentação... 32
5.2 – Desenho Experimental... 33
5.2.1 – Produção do antígeno vacinal e preparo do adjuvante saponina... 33
5.2.2 – Grupos experimentais ... 34
5.3.2 – Infecção Experimental ... 34
5.3 – Avaliações imunológicas e Ensaios de Imunogenicidade Pós Vacinal... 38
5.3.1 – Obtenção de amostras de sangue periférico... 38
5.3.2 – Leucograma... 38
5.3.3 – Avaliação da resposta imune humoral anti-Leishmania ... 38
5.3.3.1 – Obtenção do antígeno para a reação imunoenzimática anti-Leishmania... 38
5.3.3.2 – Pesquisa de anticorpos anti-Leishmania... 39
5.3.4 – Imunofenotipagem por citometria de fluxo... 40
5.3.4.1 – Citometria de fluxo... 40
5.3.4.2 – Obtenção e preparo da suspensão de leucócitos do sangue periférico para imunofenotipagem ex vivo utilizando microplacas... 42
5.3.4.3 – Ensaio de imunofenotipagem celular em leucócitos do sangue periférico no contexto ex vivo e in vitro utilizando microplacas... 42
5.3.4.4 – Ensaio de imunofenotipagem celular em leucócitos do sangue periférico no contexto ex vivo utilizando tubos... 44
5.3.5 – Avaliação da resposta celular no contexto in vitro... 45
5.3.5.1 – Obtenção do antígeno solúvel vacinal (VSA) de L. braziliensis e do antígeno solúvel de L. chagasi (SLcA) para os ensaios in vitro... 46
5.3.5.3 – Ensaio de proliferação linfocitária e obtenção das células
mononucleares do sangue periférico pós-cultivo para imunofenotipagem ... 47
5.4 – Avaliações parasitológicas... 49
5.4.1 – Punção de medula óssea, cultivo em NNN/LIT e confecção das lâminas.. 49
5.4.2 – PCR... 50
5.5 – Análise estatística dos dados... 52
6. Resultados ... 53
6.1 – Resposta Imune Humoral ... 55
6.1.1 - Análise da reatividade de IgG total, IgG1 e IgG2 anti-Leishmania no soro de cães imunizados com a vacina LBSap e seus constituintes vacinais, antes e após desafio com L. chagasi ... 55
6.2 – Resposta Imune Celular... 58
6.2.1 – Leucograma de cães imunizados com a vacina LBSap e seus constituintes vacinais, antes e após desafio com L. chagasi ... 58
6.2.3 – Análise do número de linfócitos sanguíneos e do perfil fenotípico de células T (CD5+, CD4+ e CD8+) e células B (CD21+) circulantes no sangue periférico de cães imunizados com a vacina LBSap e seus constituintes vacinais, antes e após desafio com L. chagasi ... 60
6.2.4 – Avaliação do número de monócitos CD14+ sanguíneos, do perfil de ativação linfocitária pela expressão de CD80, MHC-I e MHC-II de cães imunizados com a vacina LBSap e seus constituintes vacinais, antes e após desafio com L. chagasi ... 63
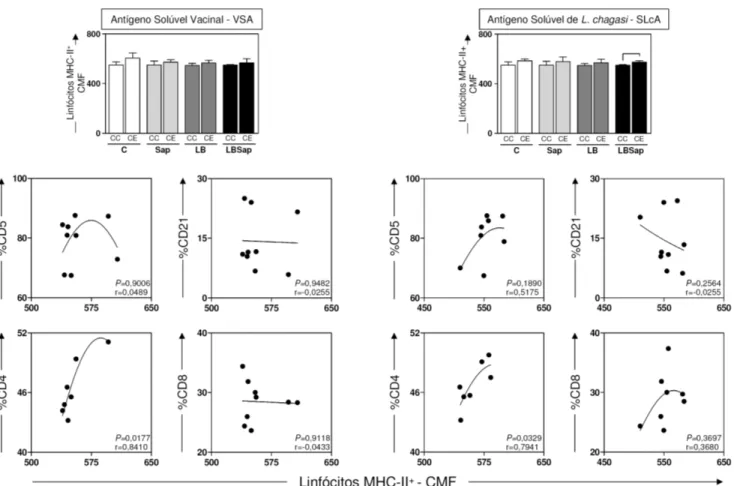
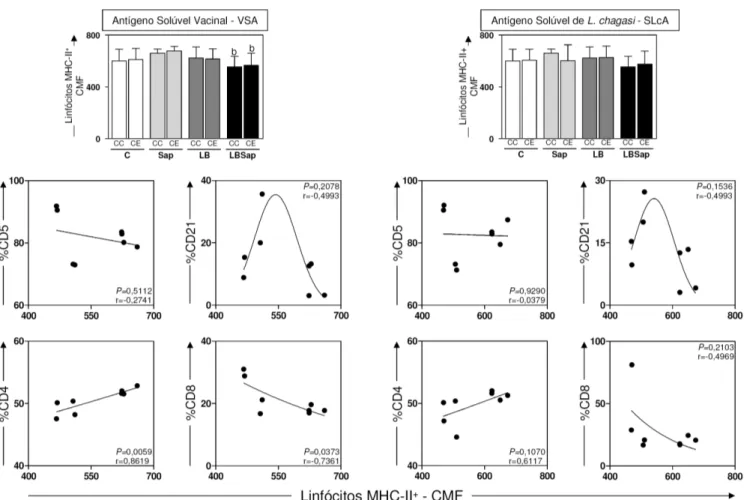
6.2.5 – Avaliação da atividade linfoproliferativa e do perfil imunofenotípico de linfócitos (CD5+, CD4+, CD8+, CD21+) submetidos a estimulação antigênica com antígeno solúvel vacinal (VSA) e antígeno solúvel de L. chagasi (SLcA) em células de cães imunizados com a vacina LBSap e seus constituintes vacinais após desafio com L. chagasi ... 66
6.2.6 – Avaliação do perfil de ativação de linfócitos pela expressão de MHC-II+ e sua correlação com o perfil imunofenotípico de linfócitos T (CD5+, CD4+, CD8+) e linfócitos B (CD21+) submetidos a estimulação antigênica com antígeno solúvel vacinal (VSA) e antígeno solúvel de L. chagasi (SLcA) em células de cães imunizados com a vacina LBSap e seus constituintes vacinais, após desafio com L. chagasi... 69
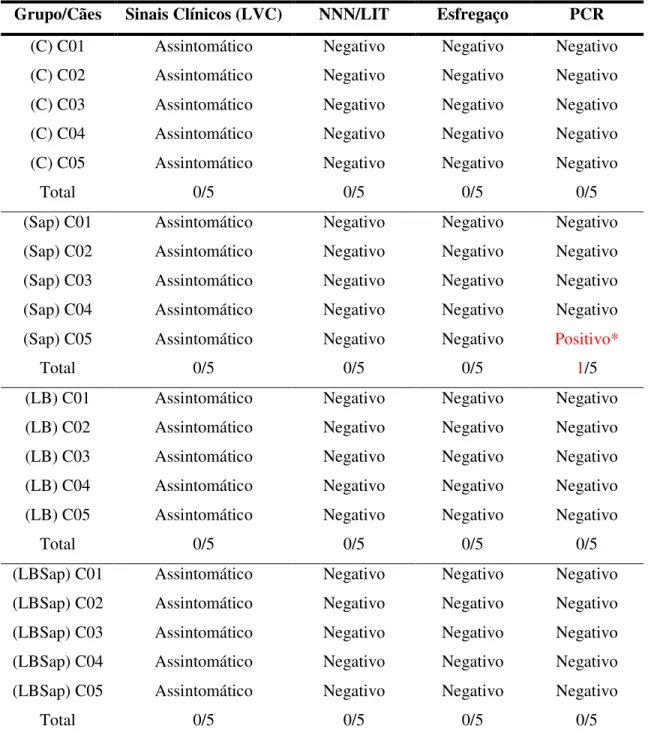
6.3 – Avaliação Clínica e Diagnóstico Parasitológico... 72
6.3.1 – Avaliação clínica e diagnóstico parasitológico da medula óssea através de isolamento em meio NNN/LIT, análise de esfregaço e PCR em cães, imunizados com a vacina LBSap e seus constituintes vacinais, após desafio com L. chagasi.. 72
7. Discussão ... 74
8. Conclusões ... 87
9. Perspectivas... 89
Índice de Tabelas
Índice de Figuras
Figura 1: Reatividade humoral anti-Leishmania em soros de cães controle, submetidos
a diferentes protocolos vacinais antes e após desafio intradérmico experimental com L. chagasi e extrato de glândula salivar de L. longipalpis... 57 Figura 2: Perfil celular de linfócitos circulantes em cães controle, submetidos a diferentes protocolos vacinais antes e após desafio intradérmico experimental com
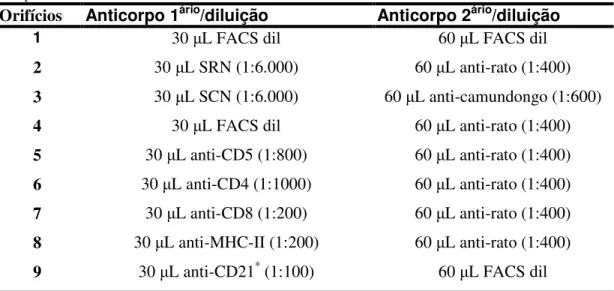
L.chagasi e extrato de glândula salivar de L. longipalpis. ... 62 Figura 3: Potenciais células apresentadoras de antígenos [monócitos (MON) CD14+] e
perfil de ativação linfocitária em cães controle, submetidos a diferentes protocolos vacinais antes e após desafio intradérmico experimental com L. chagasi e extrato de
glândula salivar de L. longipalpis... 65 Figura 4: Índice de proliferação médio e desvio padrão de células mononucleares do sangue periférico (PBMC) obtido pela análise em contagens por minutos (CPM) em linfócitos de cães controle, submetidos a diferentes protocolos vacinais, 90 dias pós desafio (90Dpd) intradérmico experimental com L. chagasi e extrato de glândula salivar
de L. longipalpis... 67 Figura 5: Índice de proliferação médio e desvio padrão de células mononucleares do sangue periférico (PBMC) obtido pela análise em contagens por minutos (CPM) em linfócitos de cães controle, submetidos a diferentes protocolos vacinais, 435 dias pós desafio (435Dpd) intradérmico experimental com L. chagasi e extrato de glândula
salivar de L. longipalpis... 68 Figura 6: Análise da expressão de linfócitos MHC-II+ e da correlação entre perfil de ativação linfocitária (MHC-II) e as frequências de linfócitos T (LT) CD5+, CD4+, CD8+ e linfócitos B (LB) CD21+ considerando resultados obtidos em 90Dpd (90 dias pós desafio), após estímulo com antígeno solúvel vacinal (VSA; painel esquerdo) e estímulo com antígeno solúvel de L. chagasi (SLcA; painel direito) em cães controle, submetidos
a diferentes protocolos vacinais e após desafio intradérmico experimental com
L. chagasi e extrato de glândula salivar de L. longipalpis... 70 Figura 7: Análise da expressão de linfócitos MHC-II+ e da correlação entre perfil de ativação linfocitária (MHC-II) e as frequências de linfócitos T (LT) CD5+, CD4+, CD8+
e linfócitos B (LB) CD21+ considerando resultados obtidos em 435Dpd (435 dias pós desafio), após estímulo com antígeno solúvel vacinal (VSA; painel esquerdo) e estímulo com antígeno solúvel de L. chagasi (SLcA; painel direito) em cães controle, submetidos
a diferentes protocolos vacinais e após desafio intradérmico experimental com
Índice de Ilustrações
Diagrama 1: Desenho experimental utilizado na avaliação de cães controle, imunizados com a vacina LBSap e seus constituintes separadamente, antes e após desafio intradermico experimental com L. chagasi acompanhados durante 435 dias pós desafio..
Lista de Abreviaturas Ac - Anticorpo
Ag - Antígeno
APC - Células apresentadoras de antígeno
BCG - Bacillus Calmette-Guérin CCZ - Centro de controle de zoonoses CD - Cluster of differentiation
CD5 - Marcador de superfície celular de linfócitos T
CD4 - Marcador de superfície celular da
subpopulação de linfócitos T
auxiliares/indutores
CD8 - Marcador de superfície celular da
subpopulação de linfócitos T
citotóxicos/supressores
CD14 - Marcador de superfície celular de monócitos e granulócitos
CD21 - Marcador de superfície celular de linfócitos B
CD80 - Molécula co-estimulatória presente em linfócitos B e monócitos para ativação de LT
CMBlast - Meio de cultura celular CMSP - Células mononucleares do sangue periférico
CPM - Contagem por minuto
CMF - Canal médio de fluorescência Con-A - Concavalina A
Dpd - Dias Pós Desafio
DTH - Hipersensibilidade do tipo tardia EDTA - Anticoagulante quelante de cálcio
ELISA - Enzyme linked immunosorbent
assay
FACS - Fluorescence Activated Cell Sorter
FACSdil - Solução diluente de anticorpos
FL1 - Fluorescência do tipo 1 - Isoticianato de Fluroceína
FL2 - Fluorescência do tipo 2 – Ficoeritrina
FL3 - Fluorescência do tipo 3 - Cy-5 FITC - Isotiocianato de fluoresceína FSC - Forward Scatter (Dispersão frontal relativo a tamanho)
gp – glicoproteína
HRPO – Horsedarish Peroxidase ID - via intradérmica de inoculação IDR - Intradermorreação
IFN-γ - Interferon-gama IL-2 - Interleucina 2 IL-4 - Interleucina 4 IL-6 – Interleucina 6 IL-10 - Interleucina 10 IL-12 – Interleucina 12 IL-13 – Interleucina 13 IL-18 – Interleucina 18 LB - linfócitos B
LC – Leishmaniose Cutânea Leishmune® - Vacina anti-LVC Leish-Tec® - Vacina anti-LVC
Leishvacin® - Vacina anti-LTA
SGE – sand fly gland extract (Lutzomyia longipalpis)
LT - linfócitos T
LTA - Leishmaniose Tegumentar Americana
LV - Leishmaniose Visceral
LVC - Leishmaniose Visceral Canina LVH – Leishmaniose Visceral Humana MAPA – Ministério da Agricultura, Pecuário e Abastecimento
MHC-I – complexo de
histocompatibilidade principal de classe I
MHC-II - complexo de
histocompatibilidade principal de classe II
MS – Ministério da Saúde NaCl – Cloreto de sódio
NNN - Nicole, Novy & Neal (Meio de cultivo bifásico)
NO - óxido nítrico
OMS - Organização Mundial de Saúde OPAS – Organização Pan Americana da Saúde
PBS - Phosphate buffer saline pH - Potencial hidrogeniônico
PHA – mitógeno fitohemaglutinina A RIFI - Reação de Imunofluorescência Indireta
RPMI 1640 – Roswell Park Memory Institute (Meio de Cultivo Celular) rpm - rotação por minuto
SCN – Soro de Camundongo Normal SFB - Soro Fetal Bovino
SLcA – Soluble Leishmania chagasi
Antigen
SRN - Soro de rato normal
SSC - Side Scatter (Dispersão lateral relativo a granulosidade)
TA – Temperatura Ambiente Tad – Tempo Antes do Desafio
TGF-β – Fator de Crescimento transformante tipo β
Th - Células T helper
Th1 - Células T CD4+ secretoras do
padrão 1 de citocinas (IL-2 e IFN-y) Th2 - Células T CD4+ secretoras do padrão 2 de citocinas (IL-4, IL-5, IL-6, IL-10, IL-13)
TM - Teste de Montenegro
TNF- α - Fator de Necrose Tumoral tipo α
Resumo
Medidas de controle na infecção em cães por L. chagasi/L. infantum são fundamentais
para interromper o avanço atual da leishmaniose visceral humana. Recentemente têm sido desenvolvidos inúmeros candidatos a vacinas contra leishmaniose visceral canina (LVC), sendo que, a compreensão dos mecanismos imunes envolvidos na imunogenicidade pós vacinação e pós desafio são cruciais para definir um padrão de resposta associado à proteção contra infecção por Leishmania. Assim, neste trabalho foi
investigada a imunogenicidade e o efeito protetor da vacina LBSap em cães após o desafio intradérmico com L. chagasi. Vinte cães sem raça definida foram subdivididos
em quatro grupos experimentais: i) controle (n = 5) receberam 1 mL de solução salina estéril 0,9%, ii) Sap (n = 5) receberam 1 mg de saponina em 1 mL de solução salina estéril 0,9%; iii) LB (n = 5) receberam 600 g de proteína de L. braziliensis em 1mL de
solução salina estéril 0,9%; iv) LBSap (n = 5) receberam 600 g de proteína de
L. braziliensis associado a 1mg de saponina em 1mL de solução salina estéril 0,9%. O
protocolo vacinal constou de três imunizações pela via subcutânea em intervalos de 4 semanas. Posteriormente, os cães foram infectados por via intradérmica com 1 × 107 promastigotas de Leishmania (L.) chagasi em fase estacionária de crescimento
associado a extrato de glândula salivar de Lutzomyia longipalpis e acompanhados por
um período de 435 dias pós desafio (435Dpd). A análise da resposta imune humoral mostrou que antes e durante o acompanhamento longitudinal após o desafio, o grupo LBSap mostrou aumento dos níveis de IgG total, IgG1 e IgG2, sugerindo uma possível resposta imune mista (tipo I e II). A análise inicial da resposta imune celular revelou aumento da freqüência de linfócitos e monócitos no grupo LBSap. A Avaliação do perfil imunofenotípico de células mononucleares do sangue periférico (CMSP) mostrou aumento no número absoluto de linfócitos T CD4+ e linfócitos B CD21+, bem como
contagens elevadas de monócitos CD14+ circulantes no grupo LBSap. Além disso, elevados níveis de linfócitos T CD5+ e LT CD8+ circulantes, foram diretamente correlacionados com a alta expressão de MHC-II em linfócitos no grupo LBSap. Estes resultados mostram que cães imunizados com a vacina LBSap apresentam variações em diversos biomarcadores imunológicos criando um padrão de memória imunológica favorável a uma vacina protetora através de uma maior capacidade na apresentação de antígenos e ativação celular. Além disso, o grupo de cães vacinados com LBSap apresentaram aumento da atividade linfoproliferativa in vitro após estímulo antigênico
com VSA (antígeno solúvel vacinal) ou SLcA (antígeno solúvel de L. chagasi), bem
como aumento na frequência de linfócitos T CD4+. O perfil de ativação linfocitária in vitro foi marcado pelo aumento da expressão de linfócitos SLcA-MHC-II específicos ao
Abstract
The control of L. chagasi/L. infantum infection in dogs is essential to interrupt the
current spread of human visceral leishmaniasis. Most recently, various potentials candidates to vaccines against canine visceral leishmaniasis (CVL) have been developed. To obtain a successful vaccine, the understanding of those immunogenicity mechanisms involved after vaccination and challenge is crucial to define the protective responses associated against Leishmania infection. Thus, in this work it was
investigated the immunogenicity and protective effect of LBSap vaccination in dogs after challenge. Twenty mongrel dogs were categorized into four groups: i) control (n = 5) received 1 mL of sterile saline 0.9%; ii) Sap (n = 5) received 1 mg of saponin in 1 mL of sterile saline 0.9%; iii) LB (n = 5) received 600 g of L. braziliensis
promastigote protein in 1ml sterile 0.9% saline; iv) LBSap (n = 5) received 600 g of
L. braziliensis promastigote protein plus 1mg of saponin in 1ml sterile 0.9% saline. The
immunization protocol consisted of three subcutaneous injections at intervals of 4 weeks. Afterwards, the dogs were intradermally infected with 1×107 late-log-phase promastigotes of Leishmania (L.) chagasi in the presence of sand fly saliva of Lutzomyia longipalpis and accompanied by a follow-up of 435 days post challenge
(435dpc). Analysis of the humoral immune response showed that before and during the longitudinal follow-up after the challenge, the LBSap group showed increased levels of total IgG, IgG1 and IgG2, suggesting a possible mixed immune response (type I and II) after vaccination. Analysis of the cellular immune response revealed increased frequency of lymphocytes and monocytes in the LBSap group. The investigation based on the immunophenotypic profile of peripheral blood mononuclear cells (PBMC) showed an augment in the absolute number of both CD4+ and CD21+ lymphocytes as well as higher counts of circulating CD14+ monocytes in the LBSap group. Moreover,
high counts of circulating CD5+ T and CD8+ T lymphocytes were directly correlated with high expression of MHC-II on lymphocytes in the LBSap group. These findings show that LBSap immunized dogs exhibit changes in several immunological biomarkers that may create a pattern of immunological memory favorable to an effective vaccine through a higher ability in antigen presentation and cell activation. In addition, the LBSap group exhibited increased lymphoproliferative activity upon in vitro antigenic stimuli with VSA (vaccine soluble antigen) or SLcA (soluble L. chagasi
antigen) as well as increaded frequency of CD4+-lymphocytes. The in vitro profile of
As leishmanioses são causadas por parasitos protozoários inseridos na ordem
Kinetoplastida, família Trypanosomatidae e gênero Leishmania (Ross, 1903; Lainson &
Shaw, 1987), apresentando-se sob três formas morfológicas principais: paramastigota e promastigota no tubo digestivo do inseto vetor e a forma amastigota encontrada parasitando células do Sistema Monocítico Fagocitário (SMF) do hospedeiro vertebrado.
Estimativas da Organização Mundial de Saúde (OMS) indicam que no mundo cerca de 350 milhões de pessoas estão sob o risco de contrair leishmaniose e entre 12 e 14 milhões estão infectadas (WHO, 2005). Além disto, a incidência anual para leishmaniose cutânea (LC) varia de 1-1,5 milhões de casos e para leishmaniose visceral (LV) cerca de 500.000 casos (Desjeux, 2004; Alvar, et al., 2004; WHO, 2005).
Atualmente, a LV encontra-se entre as seis endemias mais importantes no mundo, atingindo aproximadamente 65 países. Principalmente, são nas nações pobres como Índia, Sudão, Nepal, Bangladesh e Brasil onde a doença é mais frequente concentrando 90% dos casos (Desjeux, 2004; WHO/TDR, 1990). O Brasil, em relação às Américas, é responsável por 90% dos casos registrados em todo continente (Arias et al., 1996,
Desjeux, 2004, MS, 2006). Atualmente, a LV encontra-se em expansão para novas áreas (Enserink, 2000) e centros urbanos (Silva et al., 2000, MS, 2006) destacando-se o
aparecimento da doença em países do Mercosul, considerados anteriormente como indenes para LV, cuja forma clínica de ocorrência principal era leishmaniose tegumentar americana (LTA). Neste contexto, temos o cenário epidemiológico atual da Argentina, país em que os casos de LV humana começaram a aparecer a partir de 2005 e que nestes últimos anos não pararam de crescer, com aumento gradativo do número de casos e de óbitos mostrando assim a força de expansão e urbanização dessa doença (Salomón & Orellano, 2005; Salomón et al, 2008; Salomón et al, 2009; Salomón et al,
2009b).
A expansão da LV no mundo vem ocorrendo devido principalmente à migração de populações das áreas rurais para os centros urbanos, além de outros fatores relacionados ao aumento da pobreza, desnutrição, AIDS e aumento do número de cepas resistentes aos fármacos atuais e mais recentemente as conseqüências geradas pelo aumento da temperatura do planeta (Desjeux, 2004; Sutherst, 2004; WHO, 2005; Cardenas et al., 2008). Estes fatores, além da grande capacidade da Lutzomyia
longipalpis domicilar ambientes urbanos, contribuíram de forma decisiva para a
cidades e áreas metropolitanas do Brasil como: Belo Horizonte, Montes Claros, Rio de Janeiro, Salvador, Fortaleza, Governador Valadares, Araçatuba, Santarém, Corumbá, Teresina, Natal, São Luís, Camaçari e mais recentemente, nos municípios de Três Lagoas, Campo Grande e Palmas (Arias et al., 1996; Silva et al., 2000; Bevilacqua et
al., 2001; Franca-Silva et al., 2003; MS, 2006; Malaquias et al., 2007; OPAS, 2007).
Considerando a grande dificuldade na manutenção das medidas de controle da LV (Desjeux, 2004), seja em relação a identificação e combate vetorial bem como o controle e eliminação de cães soropositivos, tem-se estudado medidas alternativas com grande tendência a serem incorporadas ao clássico tripé de ações num futuro próximo. Dentre as medidas alternativas que estão sendo propostas, encontram-se: uso de inseticidas com ação residual de longa duração e ou coleiras impregnadas e estratégias buscando a imunoprofilaxia ou mesmo o tratamento de cães, com o objetivo de se obter cura parasitológica evitando assim a eutanásia desses animais (Neogy et al., 1994,
Moreno et al., 1999, Rhalem et al., 1999, Baneth & Shaw, 2002, Nieto et al., 2003, Noli
& Auxilia, 2005, Saridomichelakis et al., 2005, Pasa et al., 2005, Vouldoukis et al.,
2006). Os esquemas terapêuticos atuais para tratamento da leismaniose visceral humana (LVH), baseados em antimoniais pentavalentes, não são indicados para o tratamento da leishmaniose visceral canina (LVC) (MS, 2004, MS, 2008). Este fato está relacionado a inabilidade dos antimoniais em promover cura parasitológica no cão, mantendo a transmissão do parasito para flebotomíneos devido a permanência do parasitismo dérmico mesmo após a terapêutica com esses fármacos (Gradoni et al., 1987; Alvar et
al., 1994; Guarga et al., 2002). Diante da incapacidade do tratamento em proporcionar
cura parasitológica, o desenvolvimento de uma vacina anti-LVC seria a melhor alternativa para combater a crescente expansão e contribuir de forma efetiva nos programas de controle da LV (Marzochi et al., 1985; Genaro, 1993; Hommel et al.,
1995; Genaro et al., 1996a; Gradoni, 2001; Handman, 2001; Palatinik et al., 2001;
Mauel, 2002; Brodskyn et al., 2003; Desjeux, 2004; Ravindran & Ali, 2004; Requena et
al., 2004).
Utilizando-se de novas metodologias capazes de investigar em detalhes aspectos da resposta imune em cães, tornou-se possível uma avaliação mais acurada da imunopatologia e consequentemente, um melhor entendimento da história natural da LVC (Reis, 2001; Giunchetti, 2004; Reis et al., 2005; Giunchetti et al., 2006; Reis et
utilizadas em diversos estudos de avaliação de testes vacinais, esquemas terapêuticos, imunoterapêuticos e imunoquimioterapêuticos (Baneth & Shaw, 2002; Murray et al,
2002; Oliva, et al, 2004; Noli & Auxilia 2005; Giunchetti et al., 2007; Miret et al, 2008;
Ribeiro et al, 2008; Giunchetti et al., 2008c; Borja-Cabrera, et al, 2010). A partir dos
resultados promissores utilizando-se vacinas de primeira geração compostas por promastigotas de Leishmania dermatotrópicas foi proposta a realização de novos
estudos que pudessem incorporar avaliações detalhadas da imunogenicidade pós-vacinal.
Nosso grupo de pesquisa tem investido nos últimos anos grandes esforços para criação e estabelecimento do centro de referência em testes de drogas e vacinas para leishmanioses. Atualmente, este centro conta com uma grande infra-estrutura interdisciplinar, interdepartamental (NUPEB, EF/UFOP) e interinstitucional (UFOP, FIOCRUZ/MG e UFMG), testando nos últimos anos diferentes propostas de vacinas anti-LVC em ensaios de fase I, II e III. Hoje, com o apoio destas instituições e do Departamento de Ciência e Tecnologia do Ministério da Saúde (DECIT) além de
financiamento de um Programa de Núcleos de Excelência
(PRONEX/FAPEMIG/CNPq) foi possível ampliar as instalações (laboratórios, biotérios de roedores e canis) e consolidar-se na excelência em testes vacinais, especificamente para LVC. Assim, é de fundamental importância os investimentos científicos e biotecnológicos com ênfase no desenvolvimento de vacinas que possam ser aplicadas em programas governamentais de controle da LV.
Neste sentido, recentemente foi proposto o estudo de dois novos imunobiológicos compostos por antígenos brutos de promastigotas de L. braziliensis
associados ao adjuvante saponina (LBSap) e/ou saliva de Lutzomyia longipalpis
(LBSapSal) (Giunchetti, 2007; Giunchetti et al., 2007; Giunchetti et al., 2008c). Os
resultados obtidos mostram que estas vacinas não induzem alterações clínicas e/ou alterações adversas que contra-indicariam seu uso. Desta forma, a utilização destas vacinas foi considerada segura para uso como imunoprofilático em cães (Giunchetti, 2007; Vitoriano-Souza et al., 2008).
Além disto, a vacina LBSap tem demonstrado forte imunogenicidade, tanto no âmbito da resposta celular quanto humoral, indicando o estabelecimento de mecanismos imunoprotetores potencialmente capazes de atuarem contra a infecção pelo agente etiológico da LVC (Giunchetti et al., 2007). Assim, o potencial imunogênico da vacina
expansão clonal de linfócitos T CD8+ do sangue periférico, aumento na intensidade de proliferação celular além de elevada produção de óxido nítrico in vitro (Giunchetti,
2007; Giunchetti et al., 2007).
Outra evidência de forte imunogenicidade promovida pela vacina LBSap foi o aumento da frequência de linfócitos T CD8+ após estímulo específico com componentes vacinais (VSA) e de antígenos solúveis de L. chagasi (SLcA) observados em células
mononucleares do sangue periférico (CMSP) estimuladas in vitro. Em relação a
resposta imune humoral, essa vacina foi capaz de induzir intensa reação imunogênica, caracterizada por elevados níveis de anticorpos IgG total e das subclasses (IgG1 e IgG2) anti-Leishmania.
Considerando estes resultados promissores de imunogenicidade e a necessidade de se compreender a resposta imune e aspectos parasitológicos após o desafio experimental com L. chagasi da vacina LBSap, propomos o presente estudo. Além
disso, o presente trabalho buscou ainda ampliar as avaliações de fase I e II em cães imunizados com a vacina LBSap (Giunchetti, 2007; Giunchetti et al, 2007),
empregando-se uma análise detalhada da imunogenicidade e um acompanhamento longitudinal de 435 dias pós desafio intradérmico com L. chagasi adicionadas a extrato
de glândula salivar de L. longipalpis. Vale ressaltar ainda, que este trabalho pretende
2.1 - Leishmania e Leishmanioses
As leishmanioses são um complexo de doenças parasitárias multifacetadas amplamente distribuídas ao redor do mundo, com vasta complexidade biológica relacionada à espécie e genética do parasito causador da doença, fatores eco-epidemiológicos, imunidade e fatores nutricionais ligados ao hospedeiro (Garnham, 1987; McMahon-Pratt & Alexander, 2004). Em função da amplitude e do caráter espectral de suas manifestações clínicas, a OMS classifica as leishmanioses em quatro formas clínicas principais: cutânea, cutâneo mucosa, cutânea difusa e visceral. A leishmaniose cutânea é uma doença de baixa gravidade em que frequentemente observa-se cura espontânea. Já a forma clínica cutâneo mucosa ou mucocutânea pode causar lesões extremamente mutilantes na região oronasal e faringeal, enquanto a forma difusa, além de ser um grande desafio terapêutico, apresenta-se com o estigmatizante aspecto hanseniforme. A leishmaniose visceral, a mais devastadora de todas as formas clínicas, possui alta mortalidade quando não tratada (WHO/TDR, 1990; Desjeux, 2004) podendo manifestar-se desde uma forma assintomática ou inaparente, passando por uma forma oligosintomática ou subclínica até atingir a forma sintomática que pode ser aguda ou crônica (Kalazar, propriamente dito). A caracterização da LV sintomática crônica está bem descrita na literatura tendo como principais sinais/sintomas: febre irregular de longa duração, perda de peso, esplenomegalia, hepatomegalia, linfadenopatia, anemia, leucopenia, edema, epistaxe, hipergamaglobulinemia, hematêmese, emagrecimento e debilidade progressiva (Alencar & Neves, 1982).
A principal forma de transmissão da LV ocorre por meio da picada de fêmeas infectadas de dípteros da família Psychodidae, subfamília Phebotominae, sendo a
Lutzomyia longipalpis a principal espécie no Novo Mundo e diversas espécies do
gênero Phlebotomus responsáveis pela transmissão no Velho Mundo (Lainson & Shaw,
1987). Atualmente, cogita-se a possibilidade de outras espécies de Lutzomyia (L. evansi
e L. cruzi) estarem agindo como vetores da LV no Novo Mundo (Travi et al., 1996,
Galati et al., 1997). Os hospedeiros vertebrados reconhecidos como reservatórios são
mamíferos da família Canidae (Deane, 1956).
Três espécies de Leishmania são as principais responsáveis pela leishmaniose
visceral no mundo (Lainson & Shaw, 1987), formando o denominado complexo
“Donovani”, dentre elas a Leishmania (Leishmania) donovani (Laveran & Mesnil,
como único hospedeiro mamífero o homem. Essa espécie é também responsável pela leishmaniose dérmica pós-calazar encontrada em áreas restritas dos países em que ela acomete. Alguns vetores conhecidos dessas regiões são o Phlebotomus argentipes e P.
alexandri (Lainson & Shaw, 1987).
A Leishmania (L.) infantum (Nicolle, 1908) encontra-se amplamente distribuída
no Velho Mundo (Ásia, África e Europa) tendo como hospedeiro doméstico o cão,
Canis familiaris, que é o principal reservatório do parasito para o homem. Além do cão
alguns animais silvestres como o chacal (Canis aureus) e a raposa (Vulpes vulpes)
podem funcionar como hospedeiros. Entre as espécies de flebotomíneos transmissores são citados: P. perniciosus, P. major, P. alexandri, P. chinensis e P. longicuspis
(Martins et al., 1978).
Já a Leishmania (L.) chagasi (Cunha & Chagas, 1937) apresenta-se amplamente
distribuída no Novo Mundo, principalmente países da América do Sul e Central. As raposas foram incriminadas como os primeiros reservatórios silvestres de L. chagasi no
Brasil e na Venezuela (Deane, 1956; Lainson & Shaw, 1987) sendo Lycalopex vetulus e
Cerdocyon thous as principais espécies encontradas no Brasil. Os cães (Canis familiaris) são considerados os principais reservatórios domésticos e identificados como
principais fontes de infecção para os flebotomíneos (Deane & Deane, 1954; Deane, 1956; Sherlock et al., 1984; Marzochi et al., 1985; Sherlock, 1996; MS, 2006).
Recentes estudos têm proposto que L. chagasi e L. infantum sejam a mesma espécie em
função de suas características bioquímicas e genéticas serem muito semelhantes (Maurício et al., 1999;Mauricio et al., 2000; Lukes et al., 2007). Estes autores propõem
ainda que estas espécies possam ser apenas uma, e que teria sido introduzida em nosso continente pelos colonizadores europeus (Maurício et al., 2000). No presente estudo,
será utilizada a denominação de L. chagasi para o agente etiológico da LV no Brasil,
considerando que nenhum encontro oficial de taxonomistas foi ainda realizado afim de oficializar novas propostas de nomeclatura desta espécie (Shaw, 2006).
2.2 – Aspectos epidemiológicos da leishmaniose visceral canina
O primeiro estudo acompanhado de observação científica de LV em canídeos foi realizado por Nicolle & Comte (1908) na Tunísia ao infectarem um cão jovem com uma cepa de L. infantum isolada de uma criança com Kalazar. Estes autores, ao realizarem a
Mais tarde resultados semelhantes foram observados por Laveran (1914) no Instituto Pasteur, ao reproduzir a infecção experimental por L. infantum em 25 cães encontrando
e descrevendo o parasito na pele, baço e outros órgãos destes animais.
Os primeiros estudos epidemiológicos no Brasil datam de 1940 quando Chagas, Ferreira, Deane & Guimarães encontraram na cidade de Abaeté – PA uma incidência da LV em torno de 1,5% de infecção na população humana e de 4,5% de infecção na população canina.
No Brasil em meados da década de 50, o prof. Leônidas Deane descreveu pela primeira vez casos de cães naturalmente infectados, em área de ocorrência da infecção humana (Deane, 1956). A partir dessa data um amplo estudo foi conduzido no estado do Ceará, uma área de grande endemicidade para LV em 1955, evidenciando a importância dos canídeos na epidemiologia da doença (Deane & Deane, 1954; Deane, 1955). Este estudo, realizado por Deane (1956) comparou a infecção humana e canina por L.
chagasi, onde os autores encontraram parasitos na pele de 16% dos humanos, e de
quase 78% na pele dos cães estudados. Estes pesquisadores, também avaliaram a capacidade de infecção experimental de flebotomíneos alimentados em cães (75%) e no homem (29%). Assim, Deane (1956) e Deane (1961) confirmaram a importância do cão como reservatório doméstico de L. chagasi, e se consagraram como um dos principais
pesquisadores da LV no mundo por terem elaborado a proposta do ciclo epidemiológico da L. chagasi no Novo Mundo. Outros membros da família Canidae também foram
apontados como reservatórios: Dusicyon vetulus (Deane & Deane, 1954) e Cerdocyon
thous (Lainson et al., 1969; Lainson & Shaw, 1987). De forma geral, apenas os cães
desempenham papel importante na transmissão de L. chagasi para o homem, ficando
aos demais canídeos a manutenção do ciclo silvestre da LV (Alvar et al., 2004;
Dantas-Torres & Brandão-Filho, 2006; Costa, 2008).
A partir destes estudos foram desenvolvidas estratégias que visam o controle e combate da LV no Brasil baseados em programas específicos para o combate dessa doença (Magalhães et al., 1980; Lacerda, 1994; WHO, 1990). Neste sentido, as ações
com ausência total de sinais clínicos tornando questionável seu recolhimento e eutanásia (Desjeux, 2004).
No Brasil, a alta prevalência da infecção canina próximo aos locais de ocorrência da doença em humanos parece estar fortemente relacionada a preferência alimentar não-antropofílica do vetor e a abundância deste, que convive em íntima proximidade tanto com a população canina quanto os seres humanos, fortalecendo a participação do cão na disseminação e manutenção da LVH (Brener, 1957; Lainson & Shaw, 1979). Além disto, considerando que os cães são altamente susceptíveis à infecção por L. chagasi e apresentam elevado parasitismo cutâneo são considerados os
principais reservatórios do parasito no ambiente urbano, tornando-se assim um dos principais pilares a serem trabalhados nos programas de controle da LV(Dantas-Torres & Brandão-Filho, 2006).
Geralmente o aparecimento de casos humanos é precedido da infecção canina sendo ainda, mais incidente e prevalente que a doença humana, reforçando as hipóteses de principal fonte alimentar para o vetor. No âmbito doméstico, a maioria dos cães com sorologia reagente não apresenta sinais clínicos, atuando, desta forma, como fonte de infecção permanente de L. chagasi aos flebotomíneos (Moreno & Alvar, 2002; Silva et
al., 2005; Costa-Val et al., 2007).
Segundo Palatnik-de-Souza et al (2001), o Brasil é o único país endêmico que
estudos sobre o impacto das ações de controle dirigidas contra os vetores; e a possibilidade de cães PCR+ e soronegativos servirem de fontes de infecção atuando também como reservatórios ou mesmo como elementos mantenedores das elevadas taxas de incidência (Ashford, 1996; Costa & Vieira, 2001; Gontijo & Melo, 2004).
Considerando que a prática quimioterápica na LVC é ainda ineficaz e que na profilaxia da LV as medidas anti vetoriais são pouco eficientes, a possibilidade de uma vacina anti-LVC para fins imunoprofiláticos apresenta-se como uma importante alternativa a ser considerada para controlar a infecção canina e humana. A possibilidade de aplicação de uma vacina para o controle da LVC seria uma importante medida sanitária, economicamente viável, reforçando assim os programas de controle da LV já existentes. Nesse sentido, alguns autores sugerem o uso de vacinas, seja animal ou para uso humano, como importante estratégia para minimizar a eutanásia de cães infectados com L. chagasi e diminuir a incidência de LVH (Marzochi et al., 1985; Dunan et al.,
1989; Dye, 1996; Da Silva, 2001; Gontijo & Melo, 2004; Dantas-Torres & Brandão-Filho, 2006). Desta forma se torna evidente e eminente a necessidade de se desenvolver novas vacinas que sejam capazes de proteger cães contra L. chagasi na tentativa de se
quebrar o elo de transmissão do parasito.
2.3 – Bases imunológicas da leishmaniose visceral
Nas leishmanioses em geral a resposta imune celular é considerada fundamental e determina a resistência ou susceptibilidade frente a infecção. Na leishmaniose cutânea experimental utilizando camundongos isogênicos infectados com Leishmania
(Leishmania) major, foi incialmente estabelecido um paradigma vinculando a
subpopulação de linfócitos T CD4+ produtoras principalmente de IFN-γ (denominada T “helper” 1 = Th1) e linfócitos T CD8+ sendo associados à resistência. Por outro lado, a subpopulação de linfócitos T CD4+ produtores de IL-4 e IL-10 (denominada T “helper” 2 cells = Th2) foi relacionada à suscetibilidade para infecção por L. major (Mosmann et
al., 1986; Barral et al., 1993; Bogdan, 2001; Kane et al., 2001; Murray et al., 2002;
Trinchieri et al., 2003; Trinchieri et al., 2007). Quanto às citocinas envolvidas, a
Th0) para Th1, com a participação de IL-12. De forma interessante, TGF-β, IL-4, IL-13 e IL-10 estariam ligadas à suscetibilidade ou persistência da infecção por Leishmania.
De forma semelhante, em modelos murinos utilizados em estudos de leishmaniose visceral, a resistência a infecção envolve tanto células T CD4+ quanto T CD8+ e citocinas como IL-2, IFN- γ e IL-12, esta última num mecanismo dependente de IFN-γ ativando células apresentadoras de antígenos (APC) que atuam controlando e proporcionando desta forma, resistência a infecção (Murray et al., 1983; Squires et al.,
1989; Bacellar et al., 1996; Engwerda, et al., 1998; Bacellar et al., 2000). É consenso na
literatura que a citocina imunomodulatória IL-10 está envolvida na suscetibilidade a infecção por Leishmania, determinando a patogênese da LV. Essa citocina atuaria
comprometendo a apresentação de antígenos, inibindo os mecanismos de co-estimulação e proliferação de células T além da secreção de citocinas do tipo 1 e ativação macrofágica (Bogdan et al., 1991; Cenini et al., 1993; Ghalib et al., 1993;
Karp et al., 1993; Miralles et al., 1994; Gassim et al., 1998; Melby et al., 1998;
Barcellar et al., 2000; Belkaid et al., 2001; Bhattacharyya et al., 2001; Moore et al.,
2001; Murray, 2002; Nylén & Sacks, 2007).
Buscando ampliar o estudo dos processos imunopatológicos envolvidos no curso da LV, diferentes modelos experimentais têm sido empregados no intuito de se entender melhor, mecanismos de resistência e susceptibilidade a infecção. Dentre os modelos de maior importância destacam-se: camundongos, hamsters e cães (Hommel et al., 1995;
Garg & Dube, 2006). Considerando que o cão é o principal hospedeiro e reservatório doméstico da L. chagasi, além de potencial paciente na clínica de pequenos animais
quando infectado, tem sido proposto que ensaios neste modelo experimental seriam a melhor estratégia para o estudo de novas abordagens terapêuticas e imunoprofiláticas (Gradoni, 2001; Giunchetti et al., 2007; Giunchetti et al., 2008c). Desta forma, estudos
neste modelo experimental seriam uma excelente alternativa considerando que o cão apresenta uma grande proximidade genética com o homem em relação aos modelos experimentais camundongo e hamster (Kirkness et al., 2003; Starkey et al., 2005)
favorecendo não apenas o estudo de enventos imunopatológicos como também a triagem de imunobiológicos aplicados a espécie humana.
Neste sentido, progredir nos estudos que ampliem o conhecimento da LVC resultará consequentemente em benefícios para o controle da doença em humanos (Reis, 2001; Giunchetti et al., 2008a; Giunchetti et al., 2008b). Considerando ainda o fato que
ainda mais o uso desse modelo experimental para LV humana (Genaro, 1993; Moreno & Alvar, 2002; Alvar et al., 2004; Reis et al., 2006a; Reis et al, 2009). Vários trabalhos
têm demonstrando a importância da utilização deste modelo na determinação de parâmetros patológicos, imunológicos e clínicos causados pela infecção com L.
infantum/L. chagasi (Abranches et al., 1991; Pinelli et al., 1994a; Santos-Gomes et al.,
2003; Rodríguez-Cortés et al., 2007a). Entretanto, o alto custo de manutenção de uma
colônia de cães, associado à falta de marcadores imunológicos e reagentes, dificulta o progresso da imunologia canina em detrimento dos estudos em humanos e camundongos (Moreno & Alvar, 2002). Por outro lado, mais recentemente o uso de cães naturalmente infectados com L. chagasi/L. infantum resgatou o emprego deste
modelo em estudos relacionados a imunopatologia da LVC. Tais estudos propõem biomarcadores de resistência e susceptibilidade a infecção por L. chagasi que passaram
a ser fundamentais nas avaliações terapêuticas e imunoprofiláticas que empregam essse modelo experimental (Reis, 2001; Reis et al., 2006a, Reis et al., 2006b, Reis et al.,
2006c; Lage et al., 2007; Giunchetti, 2004; Giunchetti et al., 2006; Giunchetti et al.,
2008a, Giunchetti et al., 2008b; Reis et al., 2009).
De forma semelhante à infecção humana, clinicamente a LVC evolui de uma forma assintomática, comumente relacionada ao controle do parasitismo, passando por uma forma intermediária oligossintomática, podendo evoluir até uma forma clínica sintomática caracteristicamente debilitante, relacionada ao comprometimento do controle do parasitismo ocasionado pelo exacerbado grau de imunossupressão que conduz o animal inevitalvelmente ao óbito (Mancianti et al., 1988; Pinelli et al., 1994a;
Pinelli et al., 1995; Reis, 2001; Giunchetti et al., 2006; Reis et al., 2006a; Reis et al.,
2006b; Reis et al., 2006c; Giunchetti et al., 2008a; Giunchetti et al., 2008b; Reis et al.,
2009). Entre os sinais clínicos mais comumente observados na LVC destacam-se a presença de alterações dermatológicas (opacificação, queda de pêlos, úlceras de pele, dermatites localizada ou generalizada), perda de peso, onicogrifose, hepatoesplenomegalia, ceratoconjuntivite, ceratite com opacificação de córnea e paresia dos membros posteriores, que geralmente compõem o quadro clínico sintomático (Genaro, 1993; Reis, 2001; Giunchetti et al., 2006).
Do ponto de vista da resposta imune humoral é importante salientar que a LVC é marcada pela ativação policlonal de linfócitos B com consequente elevação na produção de todas imunoglobulinas (Abranches et al., 1991; Genaro, 1993; Martinez-Moreno et
existe até o momento um consenso na literatura em relação ao subtipo de imunoglobulina anti-Leishmania que poderia estar associada a um perfil de
resistência/susceptibilidade na LVC (Day, 2007). Entretanto, nosso grupo de pesquisa relata em cães assintomáticos, presença predominante de IgG1 associada a uma menor frequência de intensidade parasitária em diversos tecidos (Reis et al., 2006a,c). Por
outro lado, cães sintomáticos apresentariam elevada produção de imunoglobulinas (IgG2, IgA, IgM e IgE) (Reis et al., 2006a,c). A presença marcante de IgG2 e IgE na
forma clínica sintomática indicaria uma possível associação dessa forma clínica com a resposta imune do tipo 2 (Pinelli et al., 1994a; Martinez-Moreno et al., 1995; Reis et al.,
2006c).
No âmbito da avaliação da resposta celular o quadro hematológico (hemograma) de cães sintomáticos mostra uma anemia marcante associada a uma intensa leucopenia em relação aos cães assintomáticos (Reis et al., 2006a). Resultados semelhantes são
observados em cães agrupados de acordo com a carga parasitária da medula óssea, sendo observado anemia, linfocitopenia e monocitopenia em cães com alta carga parasitária quando comparados aos cães não infectados e com baixo parasitismo (Reis et
al., 2006b; Guerra et al., 2009). Estes resultados indicam que a progressão clínica da
LVC, bem como o aumento do parasitismo na medula óssea induz a um grave quadro hematológico de repercussão sistêmica levando a imunossupressão celular.
Alguns trabalhos relacionam a sintomatologia da LVC com alterações imunológicas envolvendo células T. Essas mudanças incluem debilidade na resposta de hipersensibilidade do tipo tardia (DTH) para antígenos de Leishmania (Cardoso et al.,
1998; Solano-Gallego et al., 2000) e diminuição do número de células T no sangue
periférico (Pinelli et al., 1994a; Martinez-Moreno et al., 1995; Bourdoiseau et al.
1997a; De Luna et al., 1999; Reis, 2001; Reis et al., 2006b).
Mais recentemente alguns estudos buscaram avaliar resistência/susceptibilidade a infecção na LVC, de forma semelhante ao incialmente descrito para o modelo murino (Mosmann et al., 1986; Reis, 2001; Reis et al., 2009; Guerra et al., 2009). Uma das
estratégias realizadas para identificar estes perfis foi a categorização pela manifestação clínica dos cães em assintomático (perfil resistente) e sintomático (perfil susceptível). Esta estratégia permitiu identificar aspectos imunopatológicos da LVC associados a resposta imune celular e a produção de citocinas.
Pinelli et al. (1994a), Pinelli et al. (1994b), Pinelli et al. (1995), Pinelli, (1997) e Pinelli
et al. (1999). Estes estudos permitiram propor uma associação entre um perfil de
resposta relacionado à resistência em cães assintomáticos, caracterizado pela produção de citocinas como IL-2, TNF-α e IFN-γ. Nesses mesmos trabalhos foi observado que cães sintomáticos produziam citocinas como IL-4 ou IL-10, indicando uma possível participação destes mediadores no desenvolvimento de manifestações clínicas da doença. Posteriormente Bourdoiseau et al. (1997b), avaliaram o fenótipo celular do
sangue periférico em cães naturalmente infectados por L. infantum verificando que cães
sintomáticos apresentavam queda no percentual de linfócitos T CD4+ e linfócitos B CD21+ circulantes em relação aos animais assintomáticos.
Além disto, Andrade et al. (1999) demonstraram que a resposta
linfoproliferativa em CMSP frente a estímulo específico in vitro por antígeno de
Leishmania, foi detectada apenas em cães assintomáticos e oligossintomáticos
naturalmente infectados com L. chagasi, não sendo evidenciada em cães sintomáticos.
Tem sido descrito ainda que o aumento da atividade linfoproliferativa na LVC estaria associada a produção de IFN-γ que induziria a atividade citotóxica de linfócitos T CD8+ e a lise de macrófagos infectados (Ruitenberg et al., 2001). Já em cães sintomáticos
estes autores relataram uma resposta imune celular caracterizada principalmente pela queda na população de linfócitos T CD4+ e linfócitos B CD21+, e marcada redução na resposta linfoproliferativa in vitro frente ao estímulo antigênico-específico, sem
produção significativa de IFN-γ e consequentemente, menor ação de linfócitos T CD8+ em promover a lise de macrófagos infectados (Ruitenberg et al., 2001).
O fenótipo de leucócitos do sangue periférico na LVC também foi e vem sendo amplamente estudado por nosso grupo de pesquisa (Reis, 2001; Reis et al., 2006b; Reis
et al., 2009) sendo relatado aumento de linfócitos T CD5+ e das subpopulações de
linfócitos T (CD4+ e CD8+) em cães assintomáticos e redução na população de linfócitos B CD21+ nos animais sintomáticos. Quando os animais foram reagrupados levando-se em conta a carga parasitária da medula óssea, resultados semelhantes foram observados, com aumento de linfócitos T CD5+ e da subpopulação de linfócitos T CD8+ nos grupos com baixo e médio parasitismo. Além disto, o grupo com alto parasitismo apresentou queda na população de linfócitos B CD21+ e monócitos CD14+. A avaliação
expressão de MHC-II em linfócitos do sangue periférico estão diretamente relacionados com a modulação do sistema imune controlando o parasitismo e conduzindo esses animais a um melhor prognóstico clínico na doença (Reis, 2001; Reis et al., 2006b; Reis
et al., 2009).
Além do estudo do fenótipo de leucócitos circulantes, a análise do perfil de citocinas também tem contribuído para a melhor compreensão de mecanismos imunopatológicos na LVC. Neste sentido, trabalhos realizados por Quinnell et al.
(2001) e Santos-Gomes et al. (2002) demonstraram que cães naturalmente infectados
por L. chagasi expressam maiores níveis de IFN-γ, sem apresentarem aumento da expressão de IL-4, IL-18 e IL-10. Chamizo et al. (2005) avaliaram de forma
semi-quantitativa a expressão de citocinas em CMSP de cães experimentalmente infectados com L. infantum e observaram que a expressão de TNF-α, IL-2, IFN-γ, IL-10 e IL-18 foi semelhante à aquela observada em cães não infectados. Apenas a expressão de IL-4 foi detectada em níveis inferiores no grupo de cães assintomáticos. Já Lima et al. (2007)
demonstraram que em soro de cães naturalmente infectados por L. chagasi apresentando
a doença ativa, IL-6 está presente em maiores concentrações quando comparado com animais não infectados. Já TNF-α foi encontrada em níveis semelhantes em ambos os grupos. Em trabalho mais recente, Boggiatto et al (2010) observaram que em cães
naturalmente infectados por L. infantum, um bom prognóstico clínico está relacionado
com aumento na produção de IFN-γ, na produção de anticorpos da classe IgG e aumento gradativo na resposta linfoproliferativa antígeno-específica em CMSP. Esses mesmos autores observaram ainda que, a severidade da doença está relacionada ao aumento marcante na produção de IL-10 e PCR+ para Leishmania no sangue.
A resposta imune compartimentalizada foi estudada por Corrêa et al. (2007) pela
avaliação da produção de IFN-γ, TGF-β e IL-10 em extratos de baço e fígado de cães assintomáticos e sintomáticos. Neste trabalho, foi verificada maior produção de TGF-β no grupo de cães assintomáticos, enquanto que IL-10 e IFN-γ apresentaram altos níveis em ambos os grupos de cães. Resultados diferentes foram observados por Lage et al.
(2007) que estudaram o perfil de citocinas expressas por esplenócitos durante o processo de infecção natural por L. chagasi em diferentes formas clínicas e em cães
parasitismo foi correlacionado tanto com a expressão de IL-10 como de IFN-γ. Desta forma foi proposto que a evolução clínica na leishmaniose visceral canina é marcada por uma produção balanceada de citocinas do tipo 1 e 2, com expressão predominante de mRNA de IL-10 e IFN-γ que estão relacionados à intensidade parasitária (Lage et al.,
2007).
Considerando a complexidade existente na relação parasito/hospedeiro durante a história natural da infecção por L. chagasi/L. infantum em cães e a limitação imposta
devido a escassez de reagentes para se avaliar o sistema imune canino, o estudo dos aspectos imunopatológicos da LVC é um dos grandes desafios aos pesquisadores que buscam o entendimento dos processos relacionados à resposta imune na doença. Assim, os estudos prévios realizados foram e são muito importantes, pois além de contribuirem com as diversas inovações metodológicas no campo da imunologia veterinária, geraram perspectivas importantes para os trabalhos atuais, que buscam avaliar a imunogenicidade e eficácia de novas estratégias vacinais ou a resposta imune frente a quimioterápicos anti-LVC.
2.4 – Vacinologia em Leishmanioses
Os métodos atuais utilizados para o controle de doenças parasitárias de alta complexidade como a Leishmaniose estão intimamente relacionados ao controle vetorial ou a eliminação em massa de seus reservatórios. Devido a isto, os programas governamentais, enfrentam grandes dificuldades na implementação, consolidação e permanência através das ações contínuas e de sustentabilidade da vigilância epidemiológica principalmente nos países pobres, devido ao seu alto custo e problemas relacionados com aplicabilidade das ações (Thakur & Kumar, 1992; Gafurov, 1999; Dantas-Torres & Brandão-Filho, 2006). Além disso, problemas relacionados com a alta toxicidade dos fármacos de escolha utilizados para tratamento nos países em desenvolvimento (antimoniais pentavalentes), além do considerável aumento no número de cepas resistentes do parasito vêm dificultando o combate a essa doença (Khalil et al.,
1998; Bryceson, 2001; Croft & Coombs, 2003; Dube et al., 2005; Croft et al., 2006;
Hadighi et al., 2006). Dessa forma se faz necessário a busca por vacinas (Ahluwalia et
al., 2003; WHO, 2004; Torres & Brandão-Filho, 2006), que sejam eficazes na proteção
forma que possam ser empregadas em programas de controle pelo Mininstério da Saúde.
Relatos sobre procedimentos de imunização contra leishmaniose foram descritos em antigas sociedades tribais Bedouin ou Kurdistani que tinham como costume expor
crianças a picadas de flebotomíneos no intuito de se evitar lesões faciais causadas por espécies de Leishmania dermatotrópicas (Handman, 2001). O advento da possibilidade
de cultivo do parasito in vitro estabelecido por Nicolle (1908) marcou uma nova etapa
em vacinação contra Leishmaniose. A Leishmanização, nome dado ao processo de inoculação de espécies vivas de Leishmania dermatotrópicas, tem sido praticada há mais
de um século (Wenyon, 1911; Greenblatt, 1988). Esse inóculo de parasitos viáveis produzia lesões presumivelmente controladas além de induzir imunidade protetora mediada por células T (Nadim et al., 1983). A Leishmanização foi usada com sucesso
por um longo tempo nas repúblicas da ex-União Soviética, Israel e mais atualmente no Irã (Greenblatt, 1980, Kellina et al., 1981; Mauel, 2002). No entanto, esta prática tem
sido abandonada na maioria dos países, principalmente devido aos efeitos indesejáveis advindos da utilização de promastigotas virulentas vivas (Mauel, 2002), como desenvolvimento de lesões cutâneas de crescimento incontrolado, exacerbação de doenças cutâneas como a psoríase e imunossupressão (Handman, 2001).
Posteriormente estudos desenvolvidos no Brasil focalizaram na utilização de extrato de promastigotas de Leishmania dermatotrópicas mortas em fenol (vacinas de 1ª
geração), em pacientes com LTA (Salles-Gomes, 1939). Este estudo permitiu a identificação da redução das lesões cutâneas à medida que o tratamento avançava. Seguindo o mesmo pensamento, Pessoa desenvolveu uma vacina constituída por 18 cepas dermatotrópicas de Leishmania, provenientes de seis localidades do Estado de
São Paulo, tornando-se o primeiro ensaio clínico vacinal realizado em humanos (Pessoa & Pestana, 1940; Pessoa, 1941a; Pessoa, 1941b). Após 20 meses de acompanhamento, foi observado que 18% do grupo controle e 3,2% do grupo vacinado adquiriram infecção, representando uma redução de 80% da doença no grupo vacinado.
Nas décadas de 1970 e 1980 Mayrink e colaboradores desenvolveram uma vacina composta de cinco isolados de Leishmania contendo quatro espécies diferentes
(Mayrink et al., 1979; Mayrink et al., 1985; Antunes et al., 1986; Mayrink et al., 1986).
Posteriormente esta vacina foi simplificada para uma única espécie de Leishmania (L.
amazonensis) sendo sua produção para fins científicos realizada pela extinta



![Figura 3: Potenciais células apresentadoras de antígenos [monócitos (MON) CD14 + ] e perfil de ativação linfocitária em cães submetidos aos diferentes protocolos vacinais, antes e após desafio com L](https://thumb-eu.123doks.com/thumbv2/123dok_br/15725291.632966/83.1188.103.1153.164.610/potenciais-apresentadoras-antígenos-monócitos-ativação-linfocitária-submetidos-diferentes.webp)