UNIVERSIDADE FEDERAL DO CEARÁ
FACULDADE DE FARMÁCIA, ODONTOLOGIA E ENFERMAGEM PROGRAMA DE PÓS-GRADUAÇÃO EM ODONTOLOGIA
MARIANA VASCONCELOS GUIMARÃES
A Matricaria recutita PREVINE A PERDA ÓSSEA ALVEOLAR OSTEOCLÁSTICA
INDUZIDA POR LIGADURA EM RATOS VIA INIBIÇÃO DAS CITOCINAS TNF- E
IL-1β
MARIANA VASCONCELOS GUIMARÃES
A Matricaria recutita PREVINE A PERDA ÓSSEA ALVEOLAR OSTEOCLÁSTICA
INDUZIDA POR LIGADURA EM RATOS VIA INIBIÇÃO DAS CITOCINAS TNF- E
IL-1β
Dissertação a ser apresentada ao Programa de Pós-Graduação em Odontologia, da Universidade Federal do Ceará, como requisito parcial para a obtenção do título de Mestre em Odontologia. Área de Concentração: Clínica Odontológica. Linha de Pesquisa: Terapêutica Clínica e Experimental Aplicada.
Orientadora: Profa Vilma de Lima
Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará
Biblioteca de Ciências da Saúde
G979m Guimarães, Mariana Vasconcelos.
A Matricaria recutita previne a perda óssea alveolar osteoclástica induzida por
ligadura em ratos via inibição das citocinas TNF- E IL-1 / Mariana Vasconcelos Guimarães. – 2014.
113 f. : il.
Dissertação (Mestrado) – Universidade Federal do Ceará. Faculdade de Farmácia, Odontologia e Enfermagem. Programa de Pós-Graduação em Odontologia, Fortaleza, 2014.
Área de Concentração: Clínica Odontológica. Orientação: Profa. Dra. Vilma de Lima
1. Reabsorção Óssea. 2. Citocinas. 3. Osteoclastos. 4. Matricaria. I. Título.
MARIANA VASCONCELOS GUIMARÃES
A Matricaria recutita PREVINE A PERDA ÓSSEA ALVEOLAR OSTEOCLÁSTICA
INDUZIDA POR LIGADURA EM RATOS VIA INIBIÇÃO DAS CITOCINAS TNF- E
IL-1β
Dissertação apresentada ao Programa de Pós-Graduação em Odontologia, da Universidade Federal do Ceará, como requisito parcial para a obtenção do título de
Mestre em Odontologia.
Aprovada em 27 de novembro de 2014
A Deus, pelo dom da vida, por me inspirar todos os dias a força, a coragem e a capacitação essenciais na realização deste trabalho; À Maria Santíssima, por sua intercessão constante e seu olhar de mãe que me aliviam em todos os momentos;
Aos meus pais, Carlos Alberto Guimarães e Maria de Fátima Vasconcelos Guimarães, pelo amor e apoio incondicional para que esta conquista fosse possível desde o primeiro instante de minha existência;
Às minhas irmãs, Maria Tatiana Vasconcelos Guimarães e Lidiana Maria Vasconcelos Guimarães, pelo carinho, cumplicidade, companheirismo e conselhos que nunca me faltaram;
A toda minha família, especialmente à Margareth Maria Vasconcelos de Oliveira, à Raimunda Souza Vasconcelos (in memoriam) e à Maria de Lourdes Sousa Frota, e aos meus cunhados João Albino Neto e Augusto César Fernandes Costa, pelas palavras de incentivo e compreensão que foram muito importantes nesta concretização;
Ao meu namorado Francisco de Assis Bernardino da Silva Júnior, o qual tem me dedicado muita atenção e carinho importantes na reta final desta caminhada.
AGRADECIMENTOS
À minha orientadora, professora Vilma de Lima, por sua dedicação à minha formação profissional e, também, pessoal, a qual foi demonstrada desde o princípio, ainda nos primeiros semestres de minha graduação, quando me acolheu em seu laboratório, como monitora de farmacologia e, posteriormente, estudante de iniciação científica. Sua confiança depositada em minha capacidade, o que muito contribuiu para o meu aprimoramento, e seus conhecimentos perpetuarão por toda minha vida;
À professora Luzia Kalyne Almeida Moreira Leal e à sua aluna Aline Holanda Silva, pela disponibilidade na produção do extrato seco de camomila, de modo a enriquecer este estudo;
Ao professor Ronaldo de Albuquerque Ribeiro, cuja pronta cessão de seu espaço laboratorial foi essencial para a realização de alguns procedimentos experimentais delineados nesta dissertação;
Aos professores do Programa de Pós-Graduação em Odontologia e do Programa de Pós-Graduação em Farmacologia, pelo empenho ao transmitir-me seus conhecimentos;
Aos professores participantes da comissão avaliadora desta dissertação, Professores Doutores Ronaldo de Albuquerque Ribeiro e Sérgio Luís Pereira Silva, por dedicarem suas experiências científicas à melhoria deste trabalho;
À pós-doutoranda Deisy Viviana Tenazoa Wong, por compartilhar seus conhecimentos e pela disponibilidade em auxiliar nas dosagens de citocinas realizadas no presente estudo;
À pós-graduanda Iracema Matos Melo, por ter me guiado nesta tarefa desde o início, pelo carinho que me dedicou durante anos de companheirismo, pelos ensinamentos de protocolos experimentais e por sua ajuda imprescindível, sempre com serenidade e competência;
Aos pós-graduandos Thayanne Brasil Calcia, José Carlos Viana Ribeiro, Karinn Soares Araújo e Ana Patrícia Souza de Lima Alcântara, pelos bons momentos de descontração vivenciados no laboratório;
Aos estudantes de iniciação científica, Ana Carla da Silva Santos, Tereza Cristina Marques Forte, Edgar Maia Lassance Cunha Neto, Bianca Moreira Kurita e Gabriel Henrique Cavalcante Nogueira, por suas disponibilidades junto aos experimentos e cuidados dos animais;
Às turmas de monitoria da disciplina de Farmacologia Geral para Odontologia, as quais me proporcionaram experiências que certamente contribuíram para aprimorar minha didática docente;
À minha turma de Pós-Graduação, pelos bons momentos de convivência;
Aos funcionários da Universidade Federal do Ceará e prestadores de serviços Alceu Machado de Sousa, Lúcia Ribeiro Marques Lustosa, Janaíne Marques Leal, Alana Carvalho Bezerra Viana, Naiara Felipe Alves, Antonio Haroldo Pinheiro Ferreira, Maria Silvandira França Pinheiro e Adaulto Rodrigues de Sousa, pela atenção no decorrer desta etapa;
“Deus não escolhe os capacitados, capacita os escolhidos. Fazer ou não fazer algo só depende de nossa vontade e perseverança"
(Albert Einstein)
Agir, eis a inteligência verdadeira. Serei o que quiser. Mas tenho que querer o que for. O êxito está em ter êxito, e não em ter condições de êxito. Condições de palácio tem qualquer terra larga, mas onde estará o palácio se não o fizerem ali?
RESUMO
A periodontite é uma doença imunoinflamatória onde a participação de mediadores químicos culmina em destruição de osso alveolar. Muito se reconhece a respeito de sua patogênese, contudo, frequentemente alguns pacientes respondem de forma insatisfatória aos tratamentos convencionais, o que faz com que alternativas farmacológicas sejam buscadas. Neste contexto, a Matricaria recutita (MTR), conhecida como camomila, destaca-se na
literatura por sua propriedade anti-inflamatória e sua variedade de constituintes, especialmente o flavonoide apigenina. Assim, o presente estudo avaliou a participação de citocinas nas atividades anti-inflamatória e antirreabsortiva da MTR na reabsorção óssea alveolar (POA) induzida por ligadura em ratos. Para isso, utilizou-se extrato seco de MTR (teor de apigenina de 128,5±0,99 mg/g). A POA foi induzida em 90 ratos Wistar (199,3±3,2
g) por ligadura (náilon 3.0) do 2° molar superior esquerdo, e contralateral como controle. Os ratos receberam v.o. Tween 80 (TW) ou MTR (10, 30 e 90 mg/kg) diariamente até o 11º d, quando foram mortos. As hemiarcadas foram processadas para macroscopia (mm2) ou para
análises histométrica, histológica e imunohistoquímica para o ligante do receptor ativador do fator nuclear kappa-B (RANKL), a osteoprotegerina (OPG) e a fosfatase ácida resistente ao tartarato (TRAP). Amostras de sangue foram coletadas para dosagem de fosfatase alcalina óssea (FAO), enquanto que o tecido gengival foi utilizado para a dosagem da atividade de mieloperoxidase (MPO; mg/g), do fator de necrose tumoral-alfa (TNF-) e da interleucina-1
(IL-1 ) (pg/mg) por ELISA. Sistemicamente, foram feitas dosagens séricas AST/ALT, ureia e creatinina, avaliados leucograma, os aspectos macroscópicos de fígado, rins e baço, além da variação de massa corpórea. Considerou-se p<0,05 (#) para Normais, (*) para TW e () para MTR 10 mg/kg; Aspectos éticos: Comissão de Ética para Uso de Animais-UFC nº 70/13. Verificou-se que a ligadura durante 11 dias causou intensa POA, com lesão pronunciada de furca e reabsorção de osso alveolar e cemento na região entre o primeiro e segundo molares, redução dos níveis séricos de FAO, intenso infiltrado leucocitário no periodonto destes animais, aumento significante de MPO, de TNF-, de IL-1 no tecido
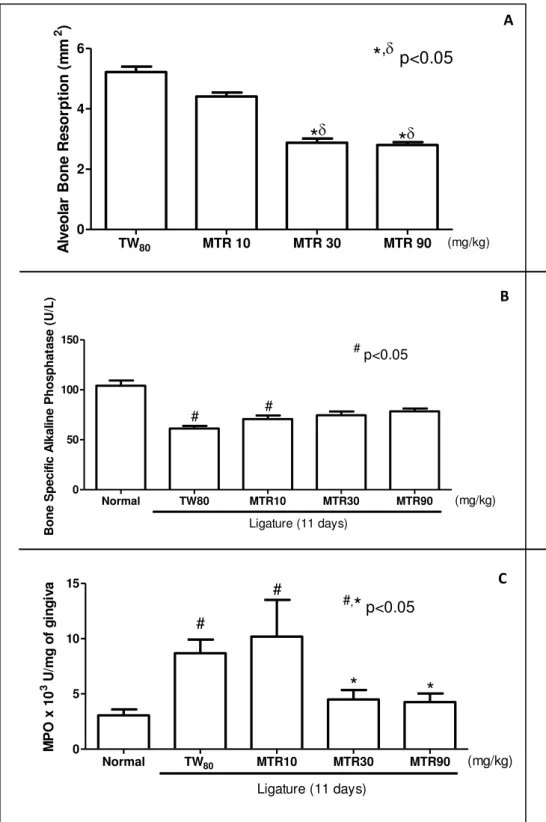
gengival subjacente à área desafiada, além de imunomarcação aumentada para RANKL e TRAP, e reduzida para OPG. Sistemicamente, observou-se leucocitose com predomínio de mononucleares. Não foram observadas alterações importantes de órgãos e peso dos animais. MTR foi capaz de prevenir, de forma significante, a POA induzida por ligadura [TW=5,5±0,2; MTR (10)=4,4±0,1*; (30)=2,9±0,1*; (90)=2,8±0*], sendo corroborada pela redução das lesões de furca [Normal=10,4±0,8; TW=137,4±23,3#; MTR (90)=81,0±9,6#*] e
preservação de osso alveolar e cemento [(Normal=0(0-0); TW=3(1-3)#; MTR (90)=1(1-3)#*]
em comparação ao grupo TW, embora não demonstrou atividade anabólica óssea por não prevenir a redução dos níveis séricos de FAO induzida pela ligadura [Normal=99,4±3,4; TW=61,3±2,6#; MTR (10)=70,6±3,6#; (30)=74,5±3,7#; (90)=78,5±2,8#); p>0,05]. Entretanto,
MTR preveniu significantemente o infiltrado leucocitário e o aumento da atividade de MPO [Normal=3,6±0,5; TW=9,4±0,9#; MTR (10)=10,2±3,3; (30)=4,5±0,8*; (90)=4,2±0,7*], dos
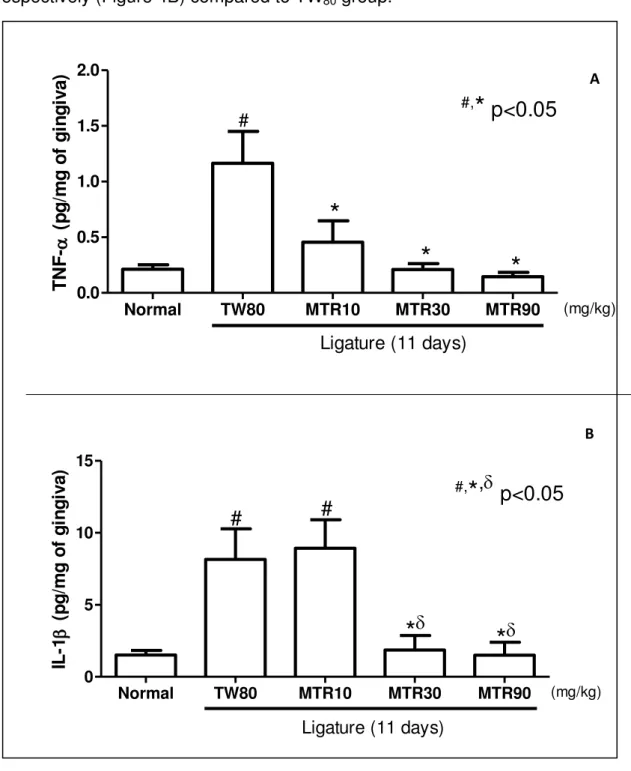
níveis de TNF- [Normal=0,2±0; TW=1,2±0,2#; MTR (10)=0,4±0,2*; (30)=0,2±0,1*;
(90)=0,1±0*] e de IL-1 [Normal=1,5±0,γ; TW=8,0±1,4#; MTR (10)=8,9±1,9#; (30)=1,8±1,0*; (90)=1,5±0,9*], proporcionando imunomarcação reduzida para RANKL e TRAP, e aumentada para OPG, em comparação ao grupo TW. Adicionalmente, a MTR preveniu a leucocitose causada pela ligadura e não alterou as condições hepáticas, renais, esplênicas e a variação de massa corpórea. Em suma, a MTR preveniu a POA via redução de TNF- e IL-1, prevenindo, assim, a ativação osteoclástica decorrente do eixo RANK-RANKL-OPG, sem interferir no anabolismo ósseo.
ABSTRACT
Periodontitis is an immunoinflammatory disease in that the involvement of chemical mediators culminates in destruction of alveolar bone. Long recognized regarding its pathogenesis, however, frequently some patients do not respond insatisfactorily to conventional treatments, which makes pharmacological alternatives are sought. In this context, Matricaria recutita (MTR), known as chamomile, stands out in the literature for its
anti-inflammatory and a variety of constituents, especially apigenin (APG) flavonoid. Thus, the present study evaluated the involvement of cytokines in the anti-inflammatory and antiresorptive activities of MTR in alveolar bone resorption (ABR) induced by ligature in rats. For this, we used the dry extract of MTR (apigenin content 128.5±0.99 mg/g). The ABR was induced in 90 wistar rats (199.3 ± 3.2 g) by ligation (nylon 3.0) of 2° upper left molar, and contralateral was used as control. The rats received v.o. Tween 80 (TW) or MTR (10, 30 and 90 mg/kg) daily until 11 d, when they were killed. The hemiarcadas were processed for macroscopic (mm2) or histometric, histological and immunohistochemical analyzes for the
ligand of the receptor activator of nuclear factor kappa B (RANKL), osteoprotegerin (OPG) and tartrate-resistant acid phosphatase (TRAP). Blood samples were collected for measurement of bone alkaline phosphatase (BALP), while the gingival tissue was used for measuring of mieloperoxidase activity (MPO; mg/g) and of tumor necrosis factor-alpha
(TNF-) and interleukin-1 (IL-1 ) levels (pg/mg) by ELISA. Systemically, serum bone alkaline phosphatase (BALP), AST/ALT, urea and creatinine, and white blood count were made, and we evaluated of macroscopic aspects of liver, kidneys and spleen, in addition to variation in body mass. Was set at p <0.05 (#) for Normal, (*) for TW and () for MTR 10 mg/kg; Ethical aspects: the Ethics Committee for Animal Use-UFC 70/13. It was found that ligation for 11 days caused intense ABR with furcation lesion pronounced, resorption of alveolar bone and cementum in the region between the first and second molars, reduction of serum BALP, intense leukocyte infiltrate in the periodontium these animals, increasing significant MPO, TNF-, IL-1 in challenged area underlying gingival tissue, and increased to RANKL and
TRAP immunostaining, and reduced to OPG. Systemically, there was leukocytosis with a predominance of mononuclear cells. No major changes in organs and weight of animals were observed. MTR prevented, significantly, the ligature-induced ABR [TW=5.5±0.2; MTR (10)=4.4±0.1*; (30)=2.9±0.1*; (90)=2.8±0*], corroborating the reduction of furcation lesions [Normal=10.4±0.8; TW=137.4±23.3#; MTR (90)=81.0±9.6*#] and the preservation of the
alveolar bone and cementum [(Normal=0(0-0); TW=3(1-3)#, MTR (90)=1(1-3)#*] compared to
the TW group while no bone anabolic activity was showed because MTR dit not prevent the reduction of serum BALP induced by ligature [Normal=99.4±3.4; TW=61.3±2.6#; MTR
(10)=70.6±3.6#; (30)=74.5±3.7#; (90)=78.5±2.8#); p>0.05]. However, MTR significantly
prevented the leukocyte infiltration and the increase of MPO activity [Normal=3.6±0.5; TW=9.4±0.9#; MTR (10)=10.2±3.3; (30)=4.5±0.8*; (90)=4.2±0.7*], of TNF- [Normal=0.2±0;
TW=1.2±0.2#; MTR (10)=0.4±0.2*; (30)=0.2±0.1*; (90)=0.1±0*] and of IL-1 [Normal=1.5±0.3;
TW=8.0±1.4#; MTR (10)=8.9±1.9#; (30)=1.8±1.0*; (90)=1.5±0.9*] levels caused by ligature, and reduced immunostaining for RANKL and TRAP, and increased for OPG, comparing to TW group. Additionally, MTR prevented the leukocytosis caused by ligation and did not alter liver, kidney, spleen conditions or the variation of body mass. In short, the MTR prevented the ABR by reducing TNF- and IL-1 , thus preventing the osteoclast activation due RANK -RANKL-OPG axis, without interfering with bone anabolism.
LISTA DE ABREVIATURAS
AKT Quinase serina/treonina antiapoptótica
AP Ativador de proteína
APG Apigenina
AST Aspartato Aminotransferase
ALT Alanina Aminotransferase
BMPs Proteínas morfogenéticas ósseas
Cbfa1 Fator transcripcional associado à diferenciação osteoblástica1
CLAE Cromatrografia Líquida de Alta Eficiência
C-FMS Receptor do fator estimulante de colônia macrofágico
Cn Calcineurina
COX-2 Ciclo-oxigenase-2
DKK1 Proteína Dickkopf 1
FAO Fosfatase Alcalina Óssea
Fc R Receptor Fc
ICAM-1 Molécula de adesão intercelular-1
IFN- Interferon-
IL Interleucina
Jak Janus Kinase
LIF Fator inibidor da leucemia
LPS Lipopolissacarídeo
LRPs Receptores de lipoproteína de baixa densidade
MAPKs Proteínas quinase ativadas por mitogénos
M-CSF Fator estimulante de colônia macrofágico
MMPs Metaloproteinases de matriz
MPO Mieloperoxidase
MTR Matricaria recutita
NFATc1 Fator nuclear de ativação de células T citoplasmático 1
NF-B Fator nuclear Kappa-B
OPG Osteoprotegerina
PTH Hormônio da paratireoide
RANKL Ligante do receptor ativador do fator nuclear Kappa B
RANK Receptor ativador do fator nuclear Kappa B
RUNX2 Fator transcricional relacionado a RUNT 2
Stat Proteína transdutora de sinal e ativadora de transcrição
TGF- Fator de transformação do crescimento-
TNF Fator de necrose tumoral
TRAF Fatores associados ao receptor de TNF
TW Tween 80
SUMÁRIO
1 INTRODUÇÃO 12
1.1 Metabolismo ósseo 13
1.2 Perda óssea inflamatória na periodontite 20
1.3 Matricaria recutita 24
1.4 Modelos experimentais de indução da periodontite 28
2 PROPOSIÇÃO 30
3 CAPÍTULO 32
3.1 Capítulo 1. Matricaria recutita L. (Chamomile) prevents ligature-induce alveolar bone resorption in rats via inhibition of TNF- and
IL-1 33
4 CONSIDERAÇÕES FINAIS 65
5 CONCLUSÃO 70
6 REFERÊNCIAS 72
7 APÊNDICES 84
Apêndice A – Metodologia 85
Apêndice B – Resultados 98
8 ANEXOS 109
1 INTRODUÇÃO
1.1 Metabolismo ósseo
A remodelação óssea é um processo contínuo que envolve a atuação essencialmente de dois tipos celulares responsáveis pela formação e reabsorção do osso, os osteoclastos e os osteoblastos, respectivamente (Sims; Gooi, 2008; Redlich; Smolen, 2012). Durante o crescimento e o estabelecimento da arquitetura estrutural do esqueleto, a formação de tecido ósseo ocorre independentemente da sua reabsorção, caracterizando a modelagem óssea. Enquanto isso, o processo de remodelação óssea envolve, necessariamente, a formação primária de uma lacuna de reabsorção através da ativação inicialmente de osteoclastos (Sims; Gooi, 2008; Redlich; Smolen, 2012; Sims; Martin, 2014). Para isso, tais células se anexam a superfície óssea mineralizada e iniciam a reabsorção pela secreção de íons de hidrogênio e de enzimas lisossomais, particularmente a catepsina K, que degrada os componentes da matriz óssea, incluindo o colágeno (Raisz, 1999). Em seguida, a ativação de osteoblastos culmina no preenchimento da lacuna de reabsorção com a formação de nova matriz óssea por tais células (Raisz, 1999; Sims; Gooi, 2008; Redlich; Smolen, 2012). O desenvolvimento e a ativação de osteoclastos e de osteoblastos são processos fortemente regulados e uma rede complexa de vias de sinalização está envolvida na mediação de seus efeitos (Redlich; Smolen, 2012).
Os osteoclastos são derivados de células estaminais hematopoiéticas e seu desenvolvimento envolve a interação do fator estimulante de colônia macrofágico (M-CSF) e do seu receptor C-FMS, o qual é encontrado na superfície de tais células progenitoras (Arai et al., 1999; Ross, 2006; Redlich; Smollen, 2012). Através da estimulação de uma quinase antiapoptótica (AKT), mediada via ativação do receptor C-FMS, ocorre indução da proliferação e da sobrevivência dos progenitores de osteoclastos (Glantschnig et al., 2003). Adicionalmente, uma vez que osteoclastos são derivados de células precursoras de monócitos e macrófagos, as quais também expressam o receptor Fc (Fc R) em sua superfície, a presença de complexos
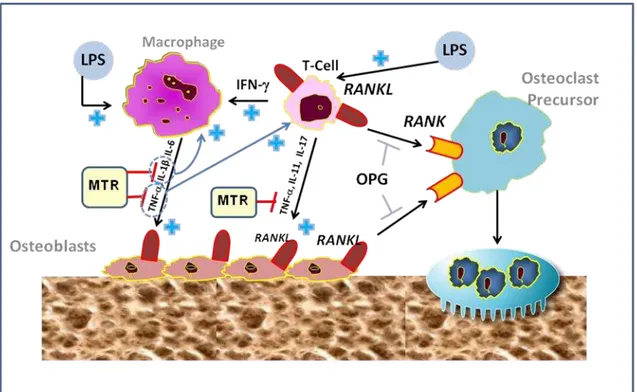
Um dos principais receptores envolvidos na ativação de osteoclastos também é o receptor ativador do fator nuclear Kappa B (RANK), o qual é um membro da família do fator de necrose tumoral (TNF). O mecanismo de perda óssea envolvendo este receptor se inicia com sua ligação ao ligante RANKL, promovendo a diferenciação e a ativação de osteoclastos. Diferentemente, a osteoprotegerina (OPG), presente como molécula solúvel no plasma, bloqueia a ligação de RANKL ao seu receptor RANK, prevenindo a osteoclastogênese e a reabsorção óssea (Bartold et al., 2010; Pacifici, 2010; Kular et al., 2012; Koide et al., 2013).
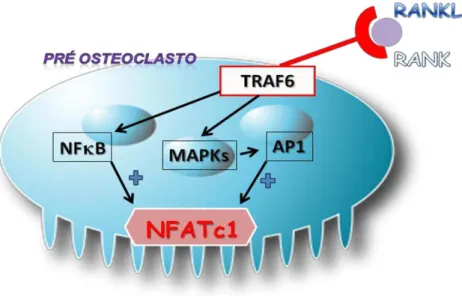
Figura 1 – Vias de sinalização intracelulares responsáveis pela ativação do fator nuclear de ativação de células T citoplasmático 1 (NFATc1) em osteoclastos.
Após a ativação do receptor ativador do fator nuclear kappa-B (RANK) na superfície de pré-osteoclastos, ocorre o recrutamento intracelular de moléculas adaptadoras, principalmente do fator associado ao receptor de TNF-6 (TRAF-6). Após essa interação, há ativação direta do fator nuclear Kappa-B (NF-B) e de proteínas quinase ativadas por mitogénos (MAPKs). Esta última induz a formação posterior do fator transcricional ativador de proteína (AP)1. Como resultado da ativação de NF-B e de AP1, há subsequente estimulação do fator nuclear de ativação de células T citoplasmático 1 (NFATc1), considerado um regulador mestre na diferenciação de osteoclastos. Consequentemente tal processo aumenta a responsividade de RANK à ligação de seu ligante, RANKL.
Fonte: Gohda et al., 2005; Takayanagi et al., 2002; Nakashima et al., 2012; Redlich e Smollen, 2012.
sugerindo que a expressão de NFAT em osteoblastos regula negativamente a função destas células (Zanotti et al., 2011).
Os osteoblastos se desenvolvem a partir de células progenitoras mesodérmicas que, quando completamente diferenciadas, produzem matriz óssea. Para a evolução desta linhagem de células altamente especializadas, as células progenitoras mesenquimais expressam RUNX2 (Komori, 2010), também conhecido como Cbfa1. RUNX2 é um membro da família de fatores transcricionais RUNT (Komori, 2010) e é considerado importante fator de transcrição que regula a formação de osteoblastos. Este gene está envolvido nas duas fases de diferenciação osteoblástica, a primeira que consiste na diferenciação das células mesenquimais multipotenciais em pré-osteoblastos, e a segunda que é a diferenciação destes em células maduras (Karsenty, 2008; Komori, 2010; Nakashima et al., 2012). É importante complementar que, ao contrário do que ocorre em osteoblastos imaturos, RUNX2 é pouco expresso em osteoblastos maduros, de forma que sua expressão reduz com a maturidade dos osteoblastos (Komori, 2010).
A ativação de RUNX2 pode ser induzida através de proteínas citoplasmáticas denominadas SMADS, as quais são fosforiladas após a interação de proteínas morfogenéticas ósseas (BMPs) em seus receptores localizados na superfície da célula mesenquimal (Javed et al., 2008) (Figura 2). Tal interação também culmina na ativação de outros genes relacionados à atividade de osteoblastos, ademais de RUNX2, como o gene Osterix. Este é ativado na segunda fase de diferenciação osteoblástica, onde pré-osteoblastos se diferenciam em osteoblastos maduros e age, provavelmente, suprimindo fatores transcricionais que direcionariam essas células a se diferenciarem em condrócitos (Karsenty, 2008). De fato, animais deficientes de Osterix não apresentam formação óssea normal apesar de possuírem níveis normais de RUNX2 (Nakashima et al., 2012).
quinase p38 (Greenblatt et al., 2010), aumentam diretamente a expressão de RUNX2 e ativam a transcrição gênica através da formação intracelular de um ativador de proteína (AP1) (Redlich; Smollen, 2012).
Outro sistema central na diferenciação e ativação de osteoblastos é a via de sinalização WNT (Figura 2), cujos ligantes constituem um grande número de glicoproteínas (Bodine; Komm, 2006; McDonald et al., 2009) que são secretadas por células especialmente do estroma da medula óssea e pelas próprias células estaminais hematopoiéticas (Yamane et al., 2001; Logan; Nusse, 2004; McDonald et al., 2009). As glicoproteínas WNT se ligam a um complexo de receptor formado pela associação do chamado receptor de Frizzled aos receptores de lipoproteína de baixa densidade (LRPs), e juntos tais receptores sinalizam diretamente via -catenina para promoverem a ativação transcricional da célula mesenquimal pré-osteoblástica (Yamane et al., 2001; Logan; Nusse, 2004; Bodine; Komm, 2006; McDonald et al., 2009).
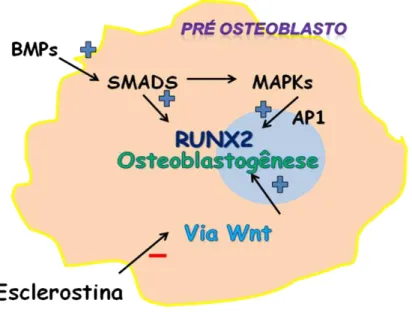
Figura 2 – Vias de sinalização intracelulares relacionadas à ativação de osteoblastos.
é a via de sinalização WNT, cujos ligantes constituem um grande número de glicoproteínas. Tal via tem como principal inibidor a esclerostina, citocina liberada exclusivamente por osteócitos, tornando-se, este, um processo muito importante no controle da osteoblastogênese.
Fonte: Yamane et al., 2001; Logan e Nusse, 2004; Bodine e Komm, 2006; McDonald et al., 2009; Redlich e Smollen, 2012.
Por fim, a osteoblastogênese também é induzida pela oncostatina M, uma glicoproteína com efeitos proliferativos em células tronco produzida por osteoblastos e osteócitos. Ao atuar em seu receptor na superfície de células estromais, especificamente no receptor do fator inibidor da leucemia (LIF) (Walker et al., 2010), a oncostatina M ativa diretamente a transcrição gênica de osteoblastos (Jay et al., 1996; Levy et al., 1996; Walker et al., 2010) e a formação óssea, atuando através do maior sistema alternativo de segundos mensageiros, o sistema Jak (Janus Kinase) –
Stat (proteína transdutora de sinal e ativadora de transcrição) (Jak-Stat) (Levy et al., 1996; Walker et al., 2010).
A expressão de osteocalcina (Carpenter et al., 1998), do receptor do hormônio da paratireoide (PTH) (Huang et al., 2004) e de RANKL, bem como produção de OPG (Thomas et al., 2001), são características da atividade de osteoblastos. Além disso, a ativação osteoblástica resulta em produção da matriz óssea e de reguladores da mineralização, como a osteopontina e a osteonectina (Roach, 1994).
Em relação aos osteócitos, estas células também estão incluídas na “Unidade
Básica Multicelular” do esqueleto, juntamente aos osteoblastos e osteoclastos,
demonstrando participar ativamente na remodelação do tecido ósseo (Bonewald,
Johnson, β008; O’Brien et al., 2013), apesar de terem sido considerados inertes
Fisiologicamente, a reabsorção óssea primária que ocorre na remodelação óssea é necessária para a remoção da cartilagem calcificada durante o crescimento ósseo, a modelagem do osso durante o crescimento, a adaptação do tecido ósseo a estímulos externos e a manutenção da homeostase de minerais e a erupção dos
dentes (O’Brien et al., 2013), sendoregulada por inúmeros fatores sistêmicos
(Hadjidakis; Androulakis, 2006).
As funções metabólicas do esqueleto são controladas por hormônios como o PTH, o qual estimula a formação óssea quando administrado de forma intermitente e a reabsorção óssea quando secretado continuamente (Kim et al., 2003); a calcitonina, um inibidor da atividade de osteoclastos e da reabsorção óssea, (Granholm et al., 2007) ao interagir em seu receptor presente em osteoclastos maduros (Quinn et al, 1999), e o calcitriol, considerado a forma biologicamente mais ativa da vitamina D, que está atrelada a reabsorção de cálcio e de fósforo no intestino (Sahay; Sahay, 2012), além de apresentar efeito anabólico sobre o
turnover ósseo (Feng et al., 2013). Tais hormônios atuam, principalmente, no controle dos níveis séricos de cálcio em adultos (Hadjidakis; Androulakis, 2006).
Hormônios da tireoide, como o T3, também são importantes para o turnover ósseo, de tal maneira que este exerce efeitos anabolizantes sobre o tecido ósseo durante o crescimento e remodelação óssea, porém tem efeitos catabólicos no esqueleto adulto para estimular a reabsorção óssea necessária à remodelação deste tecido (Williams, 2009). Além disso, a deficiência de estrógeno leva a uma alteração do saldo líquido final da remodelação óssea em que a reabsorção supera a formação, havendo destruição de massa óssea (Cenci et al., 2000). Já os glicocorticoides são fatores hormonais que, em altos níveis, estimulam a reabsorção de tecido ósseo por induzir a proliferação de osteoclastos através da supressão da OPG e do aumento da expressão de RANKL (Humphrey et al., 2006), bem como induzem alterações na secreção de PTH (Lanna et al., 2002) e na atividade estrogênica (Gong et al., 2008).
inibirem a formação óssea por supressão da função de osteoblastos (Hardy; Cooper, 2009; Redlich; Smollen; 2012).
Uma vez que osteoclastos adquirem um nível de hiperatividade ou osteoblastos são insuficientemente ativos de tal forma que a lacuna de reabsorção formada primariamente não é preenchida de maneira adequada por nova matriz, por conseguinte, a perda óssea patológica ou excessiva acontece (Raisz, 1999).
De fato, algumas doenças inflamatórias são caracterizadas por perda óssea excessiva (Hardy; Cooper, 2009). Dentre estas patologias, destacam-se a artrite reumatoide, onde ocorre erosão óssea focal nas margens da articulação afetada (Nanjundaiah et al., 2013), e a periodontite, acompanhada por destruição óssea alveolar (Cochran, 2008). Tem sido demonstrado que, nestas condições, o grau de resposta inflamatória está ligado à extensão da perda óssea e que a inibição de citocinas pró-inflamatórias pode reduzir o dano ósseo (Taubman et al., 2005; Mundy, 2007; Hardy; Cooper, 2009; Nanjundaiah et al., 2013; Yucel-Lindberg et al., 2013). Tais achados estabelecem uma relação aproximada entre os sistemas imunológico e ósseo.
1.2 Perda óssea inflamatória na Periodontite
na periodontite (Taubman et al., 2005, 2007; Cochran, 2008; Deo; Bhongade, 2010). Tal resposta envolve a ativação de numerosas células infamatórias, incluindo neutrófilos, células T e B, monócitos e macrófagos (Araya et al., 2003; Madianos et al., 2005; Shaju et al, 2011) e a consequente liberação de mediadores inflamatórios incluindo citocinas, quimiocinas, metabolitos do ácido araquidônico e de enzimas proteolíticas, que contribuem conjuntamente para a degradação do tecido e a reabsorção óssea por ativação de várias vias distintas degradativas hospedeiro (Deo; Bhongade, 2010; Yucel-Lindberg et al., 2013).
Entre os produtos associados às bactérias do biofilme e que estão envolvidos no desenvolvimento da doença, estão os peptidoglicanos e os lipopolissacarídeos (LPS) (Yucel-Lindberg et al., 2013). Estes, ao serem reconhecidos por receptores toll-like (Myneni et al., 2013), localizados na superfície de células residentes nos tecidos do hospedeiro, como fibroblastos, macrófagos e mastócitos, induzem a iniciação da resposta inflamatória através da produção e da liberação de citocinas pró-inflamatórias. Desta forma, mastócitos residentes exercem sua atividade inflamatória, atuando por meio da liberação imediata de histamina, que se encontra pré-formada no interior de seus grânulos, bem como de TNF- (Deo; Bhongade, 2010; Yucel-Lindberg et al., 2013). Vale salientar que a liberação de mediadores inflamatórios por macrófagos residentes ocorre mais tardiamente, uma vez que tais mediadores não se encontram pré-formados no interior destas células.
A partir da atuação destes mediadores em células endoteliais, ocorrem alterações vasculares, caracterizadas por vasodilatação e pelo aumento da permeabilidade vascular e da expressão de moléculas de adesão no endotélio, como molécula de adesão intercelular-1 (ICAM-1) e vascular-1 (VCAM-1), P-selectinas e E-P-selectinas (Zhang et al., 2001). Seguidamente, há o recrutamento primário de neutrófilos, responsáveis pela liberação de enzimas lisossomais, como a mieloperoxidase (MPO), que contribuem para a degradação tecidual (Zhang et al., 2001).
2013) e prostaglandina (PG) E2 (Noguchi; Ishikawa, 2007; Lima et al., 2008; Bage et
al., 2011), incluindo metaloproteinases de matriz (MMPs) (Yucel-Lindberg et al., 2013).
Na patogênese da periodontite, evidenciam-se, também, eventos celulares ocorridos a partir da interação entre os antígenos bacterianos e as células T virgens, resultando na diferenciação destas em células Th1, Th2, Th17 e células T reguladoras (Ohlrich et al., 2009; Yucel-Lindberg et al., 2013). Células Th1 conduzem a amplificação da resposta inflamatória ao produzirem interferon-
(IFN-), o que contribui para a superativação de macrófagos. Adicionalmente, células Th-17 também secretam mediadores pró-inflamatórios, como IL-Th-17, IL-23, IL-22, IL-6 e TNF- na presença de IL-1 e IL-6 (Ohlrich et al., 2009). Entre estes mediadores citados, a IL-17 apresenta-se como citocina essencial capaz de estimular a produção de TNF-, PGE2, IL-6 e IL-1 por macrófagos (Takahashi et al., 2005).
Quanto às células T reguladoras, estas desempenham um papel crítico na manutenção da homeostase imune. Enquanto isso, células Th2 produzem mediadores considerados anti-inflamatórios, como IL-4, L-10, IL-13, além do fator de transformação do crescimento- (TGF- ), na presença de IL-4 (Ohlrich et al., 2009; Yucel-Lindberg et al., 2013).
Sabe-se que a participação de TNF-, IL-6, IL-1 , IL-17 e PGE2 promove a
indução da reabsorção óssea diretamente, uma vez que estes possuem efeitos antiapoptóticos sobre osteoclastos, prolongando sua vida útil, e estimulam sua formação através da atuação em seus precursores estromais (Pacifici, 2010; Lacativa; Farias, 2010). De fato, como demonstrado anteriormente, células estaminais hematopoiéticas, precursoras de osteoclastos, possuem receptores passíveis de ligação por tais citocinas.
O TNF- é uma citocina que também possui efeitos antiapoptóticos sobre osteoclastos, o que prolonga sua vida útil, e estimula a formação de osteoclastos, agindo diretamente em seus precursores estromais (Lacativa; Farias, 2010). Esta citocina atua em diferentes vias, através da ativação do NF-ĸB (Schütze et al., 1995; Redlich; Smolen, 2012), o qual está envolvido com a transcrição de inúmeros genes inflamatórios, ou de MAPKs, que ativam a transcrição osteoclástica por meio da formação de AP1 intracelular (Redlich; Smolen, 2012). Complementarmente, a importância de TNF- na perda óssea periodontal inflamatória também está relacionada ao fato de tal citocina induzir a expressão de NFATc1 e, consequentemente, aumentar a fusão celular e a diferenciação osteoclástica em resposta a RANKL, potencializando reabsorção óssea (Yarilina et al., 2010).
Tais citocinas apresentam efeitos semelhantes aos de IL-1 sobre osteoclastos, que também previnem a morte e estimulam a atividade destas células, induzindo a reabsorção óssea (Lacativa; Farias, 2010). Refletindo a sinalização sequencial de TNF- e IL1, é importante salientar que TNF- induz a expressão de IL1 e de seu receptor em precursores de osteoclastos e regula a expressão de RANKL via IL-1 (Wei et al., 2005). Também tem sido observado que IL-1, na presença de RANKL, pode supra regular a expressão do fator nuclear NFATc1 em osteoclastos, favorecendo a osteoclastogênese (Jules et al., 2012).
Em relação ao efeito de TNF- e IL-1 diretamente sobre osteoblastos, é importante salientar que estes mediadores impedem a formação destas células. Em parte, este processo ocorre a partir da atuação destes mediadores em receptores localizados na superfície de células mesenquimais, levando a inibição de MAPK e de ativadores de transcrição Jak-Stats, bem como da indução da ubiquitinação de SMADs citoplasmáticas. Adicionalmente, estas citocinas pró-inflamatórias também estimulam a proteína Dickkopf 1 (DKK1), que inibe a via WNT por se ligar ao LRP, formando um complexo ternário que está sujeito a endocitose, e estimulam a produção de esclerostina, considerada um antagonista desta via (Redlich; Smolen, 2012).
et al., 1998), perpetuando tal resposta do hospedeiro, bem como de induzir diretamente a osteoclastogênese (Yago et al.,2009) e de ativar o NF-B (Ju et al., 2008). Vale salientar, também, que a capacidade osteoclastogênica de IL-17 está associada à indução do fator M-CSF em células estromais precursoras de osteoclastos (Iwakura; Ishigame, 2014).
Complementarmente, outras biomoléculas osteoclastogênicas também participam na perda óssea observada na periodontite, dentre elas RANKL, cuja expressão é elevada por citocinas pró-inflamatórias, como TNF-, IL-1 , IL-6, IL-11 e IL-17 (Cochran, 2008), além de PGE2 (Mayahara et al., 2012), liberados por
macrófagos e linfócitos T estimulados por endotoxinas bacterianas, e de MMPs (Cochran, 2008).
Assim, apesar do processo de remodelação óssea em tecidos não inflamados serem regulados pelo eixo RANK-RANKL-OPG, verifica-se que a concentração de citocinas pró-inflamatórias no periodonto pode influenciar diretamente o metabolismo ósseo, contribuindo, também, indiretamente para a reabsorção por aumentar a proporção RANKL/OPG (Darveau, 2010). De fato, a literatura demonstra que os níveis de RANKL apresentam-se elevados em pacientes com doença periodontal (Crotti et al., 2003; Kawai et al., 2006; Wara-aswapati et al., 2007), enquanto que os níveis de OPG encontram-se reduzidos nestes pacientes (Crotti et al., 2003).
Embora existam terapias para o tratamento dos defeitos periodontais, incluindo uma variedade de procedimentos cirúrgicos regenerativos e a utilização de materiais de enxertos e de fatores de crescimento (Chen; Jin, 2010), estudos prévios (Lima et al., 2000, 2004) têm demonstrado resultados promissores no tratamento periodontal quando da utilização de ferramentas farmacológicas capazes de minimizar os níveis inflamatórios e a perda óssea periodontal, ao interferirem na modulação da resposta do hospedeiro. Tal observação nos incentiva a estudar abordagens farmacológicas para as quais ainda não existe um consenso em sua utilização clínica, dentre estas se destacam as plantas medicinais, como a
Matricaria recutita, pelo seu importante papel no desenvolvimento de potentes agentes terapêuticos para minimizar as sequelas da periodontite.
Matricaria recutita L. (Chamomilla recutita L. ou Matricaria chamomilla), popularmente conhecida como camomila, é uma herbácea anual indígena originária da Europa e da Ásia Ocidental, que pertence à família Asteraceae. Caracteriza-se por ser uma erva rasteira, pouco resistente e muito ramificada. Suas folhas são alternas, estreitas e divididas em segmentos numerosos. Os capítulos florais, que possuem uma coloração amarela, constituem uma única flor e o fruto é pequeno, liso e esverdeado (McKay; Blumberg, 2006; Srisvastava et al., 2010).
As infusões, os extratos líquidos e os óleos essenciais obtidos através desta planta são preparados a partir dos seus capítulos florais frescos ou secos triturados e têm propriedades aromatizantes e corantes, sendo, portanto, usados em uma grande variedade de produtos comerciais, incluindo sabões, detergentes, perfumes, loções, pomadas, produtos de cabelo, de panificação, de confeitaria e de bebidas alcoólicas (McKay; Blumberg, 2006).
O uso de camomila como uma planta medicinal remonta à Grécia e Roma antigas. Os antigos egípcios consideravam esta erva como um dom sagrado do Deus do sol, e era usada para aliviar a febre e a insolação. No século VI, esta herbácea já era utilizada para tratar a insônia, dor nas costas, neuralgia, reumatismo, doenças de pele, indigestão, flatulência, dores de cabeça e gota (Gardiner, 2007).
Atualmente, diversos usos desta planta ainda são vistos na medicina popular, principalmente sob a forma de infusão, em casos de febre, espasmos musculares, desordens menstruais, insônia, úlceras, distúrbios gastrintestinais, dor reumática e hemorroidas (McKay; Blumberg, 2006; Srisvastava et al., 2010), ou externamente em úlceras de pele.
inflamatórias cutâneas, como o eczema atópico (Borsato et al., 2008; Lee et al., 2010).
As flores dessa planta também possuem importantes compostos fenólicos, principalmente os flavonoides apigenina, quercetina, patuletina e luteonina como glicosídeos. Outros componentes presentes nesta planta são os espiroéteres, as cumarinas, o cadineno, o furfural e o espatulenol (McKay; Blumberg, 2006). Entre tais constituintes, o flavonoide apigenina é considerado o mais promissor e o mais estudado quanto à propriedade anti-infamatória desta planta (Srisvastava et al., 2010).
A literatura relata que esta rica constituição relaciona-se às propriedades biológicas da Matricaria recutita, sobretudo imunorregulatória (Lee et al., 2010), cicatrizante (Shivananda et al., 2007; Martins et al., 2009; Duarte et al., 2011) e anti-inflamatória (Mazokopasis et al., 2005; Presibella et al., 2006; Siddiqui et al., 2010; Pavesi et al., 2011), assim como atividades antioxidante (Bezerra et al., 2009), anticancerígena (Srivastava et al., 2010), antiespasmolítica (Heidari et al., 2009), ansiolítica (Amsterdam et al., 2012), antimicrobiana (Móricz et al., 2012), demonstradas por esta planta ou por seus componentes isolados em estudos in vitro, em modelos animais e em alguns ensaios clínicos.
Quanto à propriedade imunorregulatória da Matricaria recutita, a literatura relata que a camomila é capaz de prevenir o aumento dos níveis séricos de anticorpos IgE e IgG1 por linfócitos B, bem como a produção proeminente de IL-4,
possivelmente pela habilidade deste fitoterápico em influenciar a ativação de células Th2 através do controle da produção de IL-4 por tais células (Lee et al., 2010).
O potencial cicatrizante e reparador desta planta tem sido demonstrado em modelos experimentais de úlceras na superfície dorsal de língua de ratos, bem como de mucosite oral induzida por agentes quimioterápicos em animais, evidenciando o seu efeito anti-inflamatório (Martins et al., 2009; Duarte et al., 2011; Pavesi et al., 2011).
enzima ciclo-oxigenase-2 (COX2) e, consequentemente, com a liberação de PGs por células inflamatórias estimuladas por agentes bacterianos de forma semelhante aos efeitos de inibidores seletivos da COX-2, via diminuição da expressão do seu RNA mensageiro (Srisvastava et al., 2009).
Em outro estudo mais recente, a propriedade anti-inflamatória da camomila foi evidenciada pela redução da produção de IL-6 e TNF- em uma cultura celular de macrófagos THP1, estimulados por LPS de Escherichia coli, a partir da utilização do extrato aquoso desta planta. Neste mesmo estudo, a apigenina demonstrou sua ação anti-inflamatória ao interferir com a produção destes mediadores pró-inflamatórios em uma cultura celular semelhante (Drummond et al., 2013).
De fato, vários estudos na literatura também embasam a propriedade anti-inflamatória da apigenina. Em um estudo in vitro, a apigenina demonstrou reduzir a expressão de COX-2 e, consequentemente, suprimir a síntese de PGs, além de interferir com a adesão celular através da supressão do RNA mensageiro de moléculas de adesão vascular e intercelular (VCAM-1 e ICAM-1, respectivamente) e E-selectinas (Smolinski; Pestka, 2003).
ovariectomizadas, a apigenina apresentou seu efeito antirreabsortivo no aumento do conteúdo mineral e da densidade óssea do osso trabecular (Park et al., 2008), e suprimiu a perda óssea trabecular em fêmures dos animais (Goto et al., 2014), corroborando as assertivas de estudos in vitro presentes na literatura.
Assim, diante dos benefícios do uso da Matricaria recutita ou seus constituintes isolados, especialmente o flavonoide apigenina, em modelos de inflamação, buscou-se estudar as vias pelas quais esta planta exerce efeitos anti-inflamatório e antirreabsortivo na reabsorção óssea alveolar induzida por ligadura em ratos.
1.4 Modelos experimentais de indução da reabsorção óssea alveolar
Os modelos experimentais animais são de grande valia na periodontologia, uma vez que estudos em humanos apresentam problemas, como a determinação do nível de atividade da doença e os fatores de riscos individuais que influenciam a susceptibilidade do indivíduo à progressão da doença (Schenkein, 2006; Oz; Puelo, 2011), além de questões éticas envolvidas (Weinberg; Bral, 1999).
Sabe-se que os estudos da periodontite em humanos são realizados mais facilmente de maneira retrospectiva. Enquanto isso, estudos prospectivos da periodontite realizados em animais são vantajosos por permitirem a análise da atuação de mediadores químicos da inflamação mais precisamente na progressão desta doença e a realização de mensurações diretamente em tecido ósseo. A partir destes aspectos, o uso de um modelo animal é interessante, pois possibilita a determinação de parâmetros locais e sistêmicos prospectivamente (Klausen, 1991; Lima et al., 2004).
Alguns estudos em animais têm investigado a resposta do hospedeiro frente ao desafio microbiano na periodontite e envolvido as vias pró-inflamatórias que culminam em alteração do metabolismo ósseo nesta doença, de modo a promover a perda óssea local. Para iniciar o processo de perda óssea inflamatória na periodontite experimentalmente, a ligadura é o método mais amplamente utilizado na pesquisa periodontal (Molon et al., 2014).
patogênese da perda óssea inflamatória alveolar na periodontite. Além disso, permite a avaliação do efeito de células e da atuação de mediadores inflamatórios nos tecidos, observando-se aumento da expressão gênica de citocinas pró-inflamatórias, como IL-1 e IL-6 (Molon et al., 2014), e alteração da regulação de proteínas envolvidas na osteoclastogênese, como RANKL e OPG (Benatti et al., 2012; Molon et al., 2014). Desta maneira, torna-se um modelo experimental viável ao estudo da descoberta de vias pró-inflamatórias ou anti-inflamatórias, através das quais determinados fármacos ou ferramentas farmacológicas podem influenciar na progressão da periodontite.
Por fim, diversas espécies animais têm sido utilizadas para indução da periodontite, como camundongos, ratos, cachorros e primatas não humanos. Dentre estas, os ratos representam uma das mais convenientes para tal finalidade (Graves
2 PROPOSIÇÃO
O objetivo geral deste estudo foi verificar o mecanismo anti-inflamatório e antirreabsortivo do extrato seco da Matricaria recutita (MTR), administrada por via oral, na perda óssea alveolar induzida por ligadura em ratos.
Sendo assim, os objetivos específicos foram avaliar o efeito da MTR através de:
Ao nível periodontal:
Mensuração da perda óssea alveolar das hemiarcadas maxilares;
Microscopia do osso alveolar (histometria, histologia e imunohistoquímica para RANKL, OPG e TRAP);
Dosagem sérica de Fosfatase Alcalina Óssea (FAO)
Dosagem da atividade de Mieloperoxidase (MPO) gengival;
Dosagens dos níveis gengivais de TNF- e IL-1 por ELISA.
Ao nível sistêmico:
Dosagem sérica de transaminases hepáticas AST e ALT, ureia e creatinina;
Análises do leucograma (contagens total e diferencial de leucócitos);
3 CAPÍTULO
ARTIGO A SER SUBMETIDO NA REVISTA JOURNAL OF PERIODONTOLOGY
ORIGINAL ARTICLE
TITLE PAGE
Matricaria recutita L. (Chamomile) prevents ligature-induce alveolar bone
resorption in rats via inhibition of TNF- and IL-1β.
Mariana Vasconcelos Guimarães,*† Iracema Matos de Melo,* Vilana Maria Adriano
Araújo,‡ Bianca Moreira Kurita,‡ Deisy Viviana Tenazoa Wong,‡ Cristiane Sá Roriz
Fonteles,* Thyciana Rodrigues Ribeiro,* Fábio Wildson Gurgel Costa,* Luzia Kalyne
Almeida Moreira Leal,§ Ronaldo Albuquerque Ribeiro,‡ Vilma Lima.‡
*Department of Clinical Dentistry, Federal University of Ceará (UFC), Fortaleza, CE, Brazil.
†Dentistry Couse, Leão Sampaio Faculty (FLS), Juazeiro do Norte, CE, Brazil.
‡Department of Physiology and Pharmacology, Federal University of Ceará (UFC), Fortaleza, CE, Brazil.
§Department of Pharmacy, Federal University of Ceará (UFC), Fortaleza, CE, Brazil.
Corresponding author:
Name: Vilma Lima
Address (may be published): Rua Coronel Nunes de Melo, 1127- Rodolfo Teófilo – CEP: 60.420-270, Fortaleza-Ceará-Brasil- Tele/fax: +55-85-3366.83.33 – E-mail address: villima@yahoo.com.br and vilma@ufc.br
Short running title: Matricaria recutita L. prevents alveolar bone loss in rats.
ABSTRACT
Background: Matricaria recutita (MTR) has demonstrated anti-inflammatory activity
in various animal models. Here, we evaluated the ability of the MTR to inhibit
proinflammatory cytokines and its influence on osteoclastic alveolar bone resorption
(ABR) in rats. Methods: Wistar rats were subjected to ABR by ligature with nylon
thread in the second upper right molar, with contralateral hemiarcade as control.
Rats received Tween 80 (TW80) or MTR (10, 30 and 90 mg/kg) 1 h before ligature
and daily until 11th day. The periodontium was analyzed by macroscopy, histometry,
histopathology and immunohistochemical for the receptor activator of nuclear factor
kappa-B ligand (RANKL), osteoprotegerin (OPG) and tartrate-resistant acid
phosphatase (TRAP). The gingival tissue was used to quantify the mieloperoxidase
activity (MPO) and tumor necrosis factor-alpha (TNF-) and interleukin-1 (IL-1 )
levels by ELISA. Blood samples were collected to evaluate bone-specific alkaline
phosphatase (BALP). The leukogram, liver transaminases AST/ALT, urea and
creatinina dosages, macroscopic aspects of liver, kidneys, spleen and body mass
variation were also evaluated. Results: The 11 days of ligature induced bone
resorption, low levels of BALP, leukocyte infiltration, increasing of MPO, TNF- and
IL-1 , immunostaining increased for RANKL and TRAP, and reduced for OPG, and
the leukocytosis, which were significantly prevented by MTR, except for the low
levels of BALP and the leukocytosis. Additionally, MTR did not alter organs nor body
resorption by reducing TNF- and IL-1 , preventing the osteoclast activation via the
RANKL-OPG axis, without interfering with bone anabolism.
KEY WORDS: Alveolar bone resorption; proinflammatory cytokines; RANKL; OPG;
INTRODUCTION
Bone remodeling involves a coupled activity of osteoblasts and osteoclasts
responsible for bone formation and resorption, respectively.1 Some inflammatory diseases are characterized by local or systemic bone loss due to increased
osteoclast activity or a reduced osteoblastic activity.1 Among these, stands out
chronic periodontitis, an immunoinflammatory disease2,3 of high prevalence and main cause of tooth loss in adults.4,5
In periodontitis, specific bacterial molecules, including lipopolysaccharide
(LPS) membrane,6 activate resident tissue macrophages and mast cells to produce and/or to release the early inflammatory mediators7,8 that induce changes in
endothelium and increasing expression of adhesion molecules of leukocytes to
endothelium.6,8 Indeed, the exacerbation of immunoinflammatory host response is
the main responsible for the inflammatory tissue destruction observed in periodontitis
and is characterized by activation of immune cells and release of additional
inflammatory mediators,3,6,8 such as tumor necrosis factor alpha (TNF-) and interleukins (IL)-1 ,8,9 besides IL-6,8 IL-17,9 and others that act on bone metabolism,
including prostaglandins (PGs), especially PGE2,10 matrix metalloproteinases
(MMPs)8 and nitric oxide (NO).11
These inflammatory mediators can increase the expression of receptor
activator of nuclear factor k-B ligand (RANKL) on the osteoblast surface, promoting
RANK–RANKL linkage, resulting in osteoclastogenesis.1,3,12 Coupled to this event,
the natural decoy receptor osteoprotegerin (OPG), produced by osteoblasts and
and the bone resorption.1,2,3,12
Many natural agents have been highlighted due to its adjuvant therapeutic
potential to prevent bone resorption by stimulatory activities on bone formation and
suppressive actions of bone resorption.
Matricaria recutita L. or Chamomilla recutita L. (MTR), also known as
chamomile, belongs to the Asteraceae family. It is an herbaceous plant indigenous
naturalized in Europe and Asia, being also cultivated in many countries, including in
Brazil. MTR has a sweet flavor, with yellow centers surrounded by white petals13,14 and is used in a wide variety of commercial products, especially, herbal teas.13 Infusions, liquid extracts and essential oils obtained through MTR are prepared from
fresh or dried flower heads.13
As to its anti-inflammatory activity, MTR seems to interfere in leukocyte
chemotaxis in vitro15 and in vivo,16 and in synthesis of pro-inflammatory cytokines, such as TNF-, IL-1 and IL-6,17 and PGs18 in vitro. Regarding its anti-resorptive
activity, the aqueous extract of MTR stimulated differentiation and mineralization of
osteoblasts in cell culture.19
Whereas periodontitis is characterized by an inflammatory bone resorption
and chamomile possesses anti-inflammatory activity and great antiresorptive
potential, we aimed to study its mechanism of action on alveolar bone resorption
(ABR) in rats.
MATERIALS AND METHODS
‖Sigma-Aldrich, USA, ID: P1754; ¶Collected in the Mandirituba city, State of Paraná, Brazil, and provided by private company Florien®, Piracicaba, São Paulo (Lot number 048315); #LABMAQ®,
Brazil; **Sigma – Aldrich (≥97.0% purity), USA, ID: 00720585.
Ninety male Wistar rats (199.3±3.2 g) from our own facilities at the Federal
University of Ceará were used in this study. The animals were maintained in specific
cages in temperature-controlled rooms and received water and food ad libitum. All
procedures and animal treatments were conducted after approval by Institutional
Ethics Committee for animal use of Federal University of Ceará, Fortaleza-CE, Brazil
(Protocol number 70/13).
Initially, 4 groups with an average of 19 rats each subjected to ligature and
receiving Tween 80 (TW80)‖ and MTR (10, 30 and 90 mg/kg), respectively, were
used for bone macroscopic analysis, and the underlying gingival for ELISA for
TNF-, IL-1 or myeloperoxidase activity. After that, more 2 groups of 7 rats each,
submitted to ligature and receiving TW80‖ and MTR 90 mg/kg, were used for
microscopical analysis.
Matricaria recutita Extract
The flower heads of MTR¶ were subjected to oven drying and sterilization. The microbiological analysis was in accordance with the microbiological standard
recommended by the Ministry of Health of Brazil and the presence of flavonoids
could be identified initially by the colorimetric method. For this study, we
manufactured a dry extract of MTR following standardized methodology.20
Then, the flower heads of MTR were subjected to soxhlet extraction with
ethanol for 6 hours. Following, the extract was (plant drug:solvent - 1:1) subjected to
drying by spray-drying,# with the use of silicon dioxide at a concentration of 30% compared to the solid residue (6.17%) of the ethanol extract. The analysis of the
††System Luna C8 analytical column (Phenomenex, β50 x 4.6 mm x 5 μm); ‡‡Millipore, USA; §§Calmiun® (xylazin 2% - 10 ml); ‖‖Dopalen® (ketamin - 1 g/10 ml).
performance liquid chromatography (HPLC)†† in according to previously validated
Center for Pharmaceutical Studies and Cosmetics, Federal University of Ceará.20
Before to analysis in HPLC,†† the samples were filtered through the filtering
apparatus‡‡ containing membrane filter of 0.45 mm of pore size. The determination
of the content of the apigenin-7-glucoside** on chamomile extract was performed
with the aid of the calibration curve constructed with the use of external standard‖.
The data were subjected to linear regression analysis, which allowed determining the
equation of the line and the correlation coefficient (r>0.99) proving the linearity of the
method. In chromatographic analysis of the dried extract three replicates were
employed and the results were expressed as mean ± standard deviation (SD), and
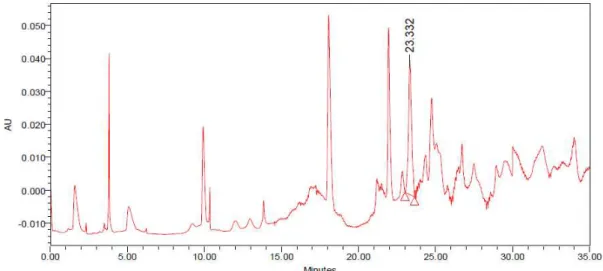
coefficient of variation (CV: SD/mean x 100). The chromatogram of the dried extract
demonstrated the detection of apigenin-7-glucoside** (retention time: 23.3 min). The
concentration of this chemical marker** in chamomile extract was 128.5±0.99 mg
apigenin/g of dry extract.
MTR extract was dissolved in TW80.‖ Animals received, by gavages, TW80‖ as
vehicle (2 ml/kg) or MTR (10, 30 and 90 mg/kg), which doses were based on Cemek
et al., 2008.21
Induction of alveolar bone resorption
A model for induction of ABR in rats was used as described previously.22,23 A nylon thread (3-0) ligature was placed around the cervix of the second left upper
molar of rats anesthetized with xylazin§§ and ketamin‖‖ (90 and 10 mg/kg, i.m, respectively), and the contralateral side was used as the unligated control. The
ligature was then knotted onto the vestibular side of the tooth, resulting in a
¶¶¶Sony Super SteadyShot® (model DSC-H1; Hong Kong, Japan); ##Image J (Image J 1.32j,
National Institute of Health; EUA)
animals submitted to periodontitis received, by gavage, TW80‖ (2 ml/kg) or MTR (10,
30 and 90 mg/kg) 30 min before ligature placement, and daily until the 11th day,
when the animals were sacrificed.
Measurement of alveolar bone resorption
The measurement of ABR was performed using the contralateral maxilla as
control. The maxillae were removed and fixed in 10% neutral formalin for 24 hours.
The left and right maxillary halves were then dissected and stained with aqueous
methylene blue (1%) in order to differentiate bone from teeth. In order to quantify
ABR, hemimaxillae were suitably placed in microscope slides to be photographed
with digital camera¶¶ ata standardized distance. The acquired images were sent to software## for ABR analysis, as previously described.22,23
For this, measurements were made along the region between the molar cusp
tip and the alveolar bone crest and subtracted from the respective area of
contralateral normal hemimaxilla (unligated control). All obtained images were
compared to well-know area (0.5x0.5 mm2).
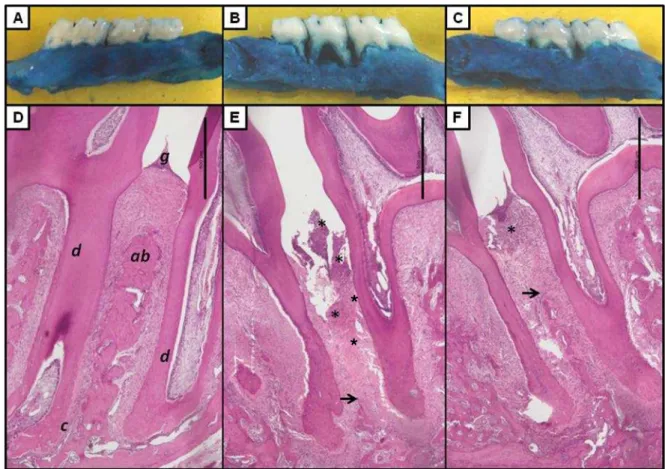
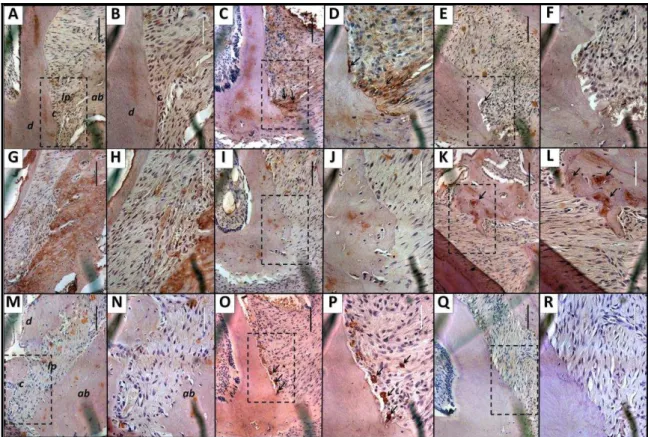
Histopathological Analysis
The histopathological analysis were made basing in previously described.22,23 For this, additional animals were submitted to ligature and received TW80‖ or the
major dose of MTR (90 mg/kg). The maxillae were removed, fixed in 10% neutral
buffered formalin and desmineralized in 10% EDTA for about a month. Following, the
specimens were dehydrated, embedded in paraffin, and sections of 4 m thickness
along the molars in a mesio-distal plane for hematoxylin-eosin (HE) staining were
***Infinity AnalyzeTM; †††Nikon Eclipse, Model: H550S; Made in Japan
evaluation. For this, the images were obtained in this region on a microscope (x100)
and launched into a computer program.*** The ABR area in the furcation was
obtained by taking the highest point of the ridge remaining bone tissue and the tooth
surface. The value correspondent to the area of ABR in this region was calculated
using software, where images were obtained directly from the microscope.†††
The area between the first and second molars was also evaluated by light
microscopy (x40). Parameters such as inflammatory cell influx, osteoclast number,
and alveolar bone and cementum integrity were analyzed by a histologist in a
single-blind fashion and graded using scores as follows: Score 0: inflammatory cellular
infiltration is absent or sparse and restricted to the region of the marginal gingiva,
few or absence of osteoclasts, preserved alveolar process and cementum; Score 1:
inflammatory cellular infiltration present all over the insert gingiva, presence of some
osteoclasts, minor ABR and intact cementum; Score 2: inflammatory cellular
infiltration present in both gingival and periodontal ligament, large number of
osteoclasts, accentuated ABR, and partial destruction of cementum; Score 3:
accentuated cellular infiltration and total destruction of alveolar process and
cementum.
The data were expressed as the median value followed by range
(smaller-larger) of scores.22,23
Bone-specific alkaline phosphatase dosage - BALP
For biochemical analyses of BALP, blood samples collected from orbital
plexus by heparinized microcapillary tubes before ligature and at 11th day were centrifuged (3000 rpm x 10 min), and the supernatants were stocked at -80 ºC until
‡‡‡Labtest®, Lagoa Santa, MG, Brazil
BALP, a thermosensible isoform of total alkaline phosphatase (TALP), were
calculated by subtracting the concentration of heated alkaline phosphatase in serum
from the concentration of TALP in serum.24 Quantification was performed through methodology of manufacturer.‡‡‡
Myeloperoxidase (MPO) Activity assay
MPO is an abundant enzyme in the azurophilic granules of neutrophils and its
activity is a marker for neutrophil presence in tissues. Here, the MPO activity in
sample of gingival tissue was also evaluated as described previously.25 For this, rats were submitted to ligature and received TW80‖ and MTR (10, 30 and 90 mg/kg). After
sacrifice, samples of the challenged gingival were removed for MPO assay. The
gingival of the contralateral hemiarcade of rats that only received TW80 was used as
normal control. The specimens were stored at -80 oC until required for assay.
Then, the tissue was weighed and triturated using a polytron ultraturrax in
ice-cold buffer solution [100 mM (w/v) NaCl, 15 mM (w/v) EDTA; 20 mM (w/v) NaPO4;
pH: 4.7] and the homogenate was centrifuged at 4 oC for 15 min (3000 rpm). The pellet was then subjected to hypotonic solution [900 µl of 0.2% (w/v) NaCl; 900 µl of
1,6% (w/v) NaCl; 900 µl of 5% (w/v) glucose] and centrifuged again at 4 oC for 15 min (3000 rpm). The final pellet was resuspended in a buffer solution [50 mM
NaPO4, 0.5% (w/v) hexadecyltrimethylammonium bromide (H-TAB) solid; pH: 5.4],
homogenized and centrifuged again at 4 oC for 15 min (10000 rpm). The supernatant was used for MPO assay using tetramethylbenzidine (1.6 mM) and H2O2 (0.5 mM),
and the concentration of MPO was determined by measuring the change in
of gingiva compared to the neutrophil standard curve constructed utilizing rat
peritoneal neutrophils. For this, neutrophil migration was induced in the peritoneum
of rats by injecting carrageenan (300 µg per animal). A standard curve relating
neutrophil (> 90% purity) numbers and absorbance was obtained by processing
purified neutrophils and assaying for MPO activity.25
TNF- and IL-1β enzyme-linked immunoassay (ELISA)
The ELISA was used for quantitative measurement of TNF- and IL-1
concentrations as described previously.26 Thus, rats were submitted to ligature and
received TW80‖ or MTR (10, 30 and 90 mg/kg). After sacrifice, samples of gingival
were removed for this analysis. The gingiva of the contralateral hemiarcade of rats
that only received TW80 was used as normal control. The specimens were stored at
-80 oC until required for assay. For the assay, the tissue homogenate was collected in PBS buffer (137 mM NaCl, 2.7 mM KCl, 8.1 mM Na2HPO4, 1.5 mM KH2PO4, pH 7.2
to 7.4) and processed. The detection of TNF- and IL-1 was determined in the
supernatant of homogenized sample by ELISA. 96-well plates were incubated for 16
h at 4 °C with anti-TNF- and anti-IL-1 antibodies. After sensitization of the plates,
the samples were added in duplicate and the standard curve was added at various
dilutions and incubated for 2 h at 4 °C.
The plates were then washed three times with PBS/Tween-20 buffer (0.05 %
SIGMA) and incubated with biotinylated monoclonal anti-TNF- and anti-IL-1
(1:1000 with BSA/Tween 1%). After incubation at room temperature for 1 h, the
plates were washed and 50 µl of streptavidin - HRP complex diluted 1:5000 were
added. After 15 minutes, the color reagent o-phenylenediamine (OPD, 50 µl) was