UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS
JANINE KARLA FRANÇA DA SILVA BRAZ
EFEITO DO ÁCIDO ASCÓRBICO SOBRE A ESPERMATOGÊNESE DE
CAMUNDONGOS COM DISTROFIA MUSCULAR DE DUCHENNE
JANINE KARLA FRANÇA DA SILVA BRAZ
Efeito do ácido ascórbico sobre a espermatogênese de camundongos com Distrofia
Muscular de Duchenne
Dissertação apresentada ao Programa de Pós-Graduação em Biologia Estrutural e Funcional da Universidade Federal do Rio Grande do Norte para obtenção do título de Mestre em Biologia Estrutural e Funcional.
Área de concentração: Ciências morfológicas
Orientador
Prof. Dr.: Carlos Eduardo Bezerra de Moura
Co-orientador
Profa. Dra.: Danielle Barbosa Morais
Autorizo a reprodução e divulgação total ou parcial deste trabalho, por qualquer meio convencional ou eletrônico, para fins de estudo e pesquisa, desde que citada a fonte.
Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências
Braz, Janine Karla França da Silva.
Efeito do ácido ascórbico sobre a espermatogênese de camundongos com Distrofia Muscular de Duchenne / Janine Karla França da Silva Braz.
– Natal, RN, 2015. 84 f.: il.
Orientador: Prof. Dr. Carlos Eduardo Bezerra de Moura. Coorientadora: Profa. Dra. Danielle Barbosa Morais
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Biologia Estrutural e Funcional.
1. Camundongo Mdx. – Dissertação. 2. Estresse oxidativo. – Dissertação. 3. Morfologia. – Dissertação. I. Moura, Carlos Eduardo Bezerra de. II. Morais, Danielle Barbosa. III. Universidade Federal do Rio Grande do Norte. IV. Título.
Nome: BRAZ, Janine Karla França da Silva
Título: Efeito do ácido ascórbico sobre a espermatogênese de camundongos com Distrofia Muscular de Duchenne
Dissertação apresentada ao Programa de Pós-Graduação em Biologia Estrutural e Funcional da Universidade Federal do Rio Grande do Norte para obtenção do título de Mestre em Biologia Estrutural e Funcional
Aprovado em:
Banca Examinadora
Prof. Dr. Carlos Eduardo Bezerra de Moura Instituição: UFERSA
Julgamento:____________________________ Assinatura:_________________________ Profa. Dra. Danielle Barbosa Morais Instituição: UFRN
Julgamento:____________________________ Assinatura:_________________________ Prof. Dr. Marcelo Barbosa Bezerra Instituição: UFERSA
AGRADECIMENTOS
À Deus por me permitir crescer através dos percalços e escolhas da vida. Esses dois últimos anos definitivamente foram de crescimento e ficarão para sempre na memória;
Ao meu marido, João Paulo Araújo Braz, agradeço pela força, bela bondade, pelo carinho, enfim, por tudo. Sem você eu não chegaria até aqui e não almejaria ir mais longe – PS.: Você já sabe;
Aos meus pais, Francisco Gilberto da Silva e Solange Araújo França, e ao meu irmão Rômulo França, por acreditarem que esse é apenas o início para fazer grandes transformações;
Ao professor orientador (pai, amigo, irmão), Carlos Eduardo Bezerra de Moura que me lançou um grande desafio e não me desamparou nos momentos de incertezas, de insegurança e de receios. À você o meu eterno agradecimento por me tornar o que sou hoje;
À professora co-orientadora, Danielle Barbosa Morais pela paciência e o cuidado com os detalhes neste trabalho. Com você aprendi que a perfeição é necessária em todos os momentos de nossa vida;
Às alunas de iniciação científica e amigas, Vilessa Gomes e Nayara Rocha por aceitarem o desafio matemático que esse trabalho exigiu com competência, ânimo e coragem. À vocês o meu imensurável obrigada;
À toda equipe do Laboratório Microcelt, em especial, à professora Naianne K. Clebis pela chance de trabalhar com a DMD e, claro, pela ajuda com as coletas, materiais de laboratório, pela conversa amiga e científica;
Ao Prof. Fernando L. Ladd pelo auxílio com as lâminas de imunohistoquímica;
Ao Prof. Moacir F. Oliveira pelas imagens de microscopia eletrônica de transmissão;
À Pró-reitoria de Pós-graduação da UFRN pelo auxílio financeiro com a bolsa de pós-graduação modalidade demanda social;
RESUMO
BRAZ, J. K. F. S. Efeito do ácido ascórbico sobre a espermatogênese de camundongos com Distrofia Muscular de Duchenne. 2015. 84f. Dissertação (Mestrado) – Centro de Biociências, Universidade Federal do Rio Grande do Norte, Natal, 2015.
Objetivou-se avaliar as alterações na espermatogênese provocadas pela Distrofia Muscular de Duchenne (DMD) e o efeito do tratamento com ácido ascórbico na prevenção dessas injúrias. Neste trabalho foram utilizados 24 camundongos, sendo 12 da linhagem C57BL/10 (não-distróficos) e 12 da linhagem C57BL/10Mdx (distróficos), divididos em seis grupos com 4 animais cada: C30 = Controle de 30 dias; D30 = Distrófico com 30 dias; C60 = Controle com 60 dias; D60 = Distrófico com 60 dias; CS = Controle com 60 dias suplementados com ácido ascórbico e DS60 = Distrófico com 60 dias suplementados com ácido ascórbico. Os animais dos grupos C30 e D30 foram eutanasiados aos trinta dias de idade, enquanto que os animais dos demais grupos aos 60 dias de idade. A suplementação com ácido ascórbico foi ministrada na água na dosagem de 0,005g/dia durante 30 dias. Após eutanasiados, os testículos (direito e esquerdo) foram coletados, pesados e seccionados transversalmente, fixados em solução de Karnovysky, incluídos em resina histológica para análises morfológicas e morfométricas, submetidos à técnica de imunohistoquímica para caspase-3 e análise ultraestrutural. A distrofia alterou a túnica própria (%), o epitélio (%), lúmen (%), o volume individual das células de Leydig e o índice Leydigossomático. As análises ultraestruturais indicaram que a suplementação não foi eficaz na reversão da apoptose mitocondrial das células de Sertoli. Contudo, o tratamento apresentou resultado satisfatório no estresse oxidativo em distróficos púberes, reduzindo a densidade de volume das células apoptóticas positivas para Caspase–3. Além disso, reverteu o quadro de hipertrofia das células de Leydig em distróficos. A distrofia na pré-puberdade apresentou vesículas lipídicas nas células de Leydig. Dessa forma, a DMD afetou a organização dos túbulos seminíferos e intertúbulo, no entanto, a suplementação com ácido ascórbico nas condições experimentais utilizadas para o tratamento da DMD foi suficiente apenas para reduzir o estresse oxidativo na região basal do compartimento tubular e a hipertrofia das células de Leydig.
ABSTRACT
BRAZ, J. K. F. S. Effect of ascorbic acid on the spermatogenesis of mice with Duchenne Muscular Dystrophy. 2015. 84f. Dissertação (Mestrado) – Centro de Biociências, Universidade Federal do Rio Grande do Norte, Natal, 2015.
The objective was to evaluate alteration in spermatogenenic caused by Duchenne Muscular Dystrophy (DMD) and the effect of treatment with ascorbic acid to prevent these injuries. In this study we were used 24 mice, 12 of C57BL / 10 strain (non-dystrophic) and 12 of the strain C57BL / 10Mdx (dystrophic), divided into six groups with four animals each: C30 = 30 days Control; D30 = Dystrophic 30 days; C60 = Control with 60 days; D60 = Dystrophic 60 days; CS = Control with 60 days supplemented with ascorbic acid and DS60 = Dystrophic 60 days supplemented with ascorbic acid. The acid ascorbic supplementation was given in water and it was administered at the dosage of 0.005g/day for 30 days. After euthanized, the testicles (right and left) were collected, weighed and sectioned, fixed in Karnovysky solution, embedded in historesin for histological studies morphological and morphometric analyzes and submitted to immunohistochemistry for caspase-3 and ultrastructural analysis. The dystrophy changed the tunica propria (%),epithelium (%), lumen (%), the individual volume of Leydig cells and the index Leydigosomatic. The ultrastructural analysis showed that supplementation was not effective in reversing the mitochondrial apoptosis of Sertoli cells. However, the treatment had satisfactory result in oxidative stress in dystrophic pubertal, reducing the volume density of apoptotic cells positive for Caspase-3. In addition, reversed hypertrophy above Leydig cells in dystrophic pubertal. The dystrophy prepubertal had lipid vesicles in the Leydig cells. Thus, the DMD affected the organization of the seminiferous tubules and intertubule, however, the ascorbic acid supplementation in the experimental conditions used for the treatment of DMD has been enough to reduce the oxidative stress in the basal region tubular and hypertrophy of Leydig cells.
SUMÁRIO
1 INTRODUÇÃO ... 12
2 OBJETIVOS... 14
2.1 OBJETIVO GERAL ... 14
2.2 OBJETIVOS ESPECÍFICOS... 14
3 REVISÃO DE LITERATURA ... 15
3.1 DISTROFIA MUSCULAR DE DUCHENNE (DMD) ... 15
3.1.1 A Distrofia Muscular de Duchenne e a reprodução ... 16
3.2 ÁCIDO ASCÓRBICO ... 17
3.3 ANATOMIA E FISIOLOGIA DO SISTEMA REPRODUTOR MASCULINO ... 18
3.3.1 Testículo ... 18
3.3.2 Espermatogênese... 18
3.3.3 Célula de Sertoli ... 19
3.3.4 Célula de Leydig ... 19
3.3.5 Ciclo do epitélio seminífero (CES) ... 20
4 MATERIAL E MÉTODOS ... 21
4.1 ANIMAIS ... 21
4.2 DIETA SUPLEMENTAR COM ÁCIDO ASCÓRBICO ... 21
4.3 EUTANÁSIA E COLETA DO MATERIAL ... 21
4.4 PROCESSAMENTO HISTOLÓGICO ... 22
4.5 ANÁLISE IMUNOHISTOQUÍMICA PARA CASPASE-3 ... 22
4.6 DENSIDADE DE VOLUME (VV) DAS CÉLULAS CASPASE 3 - POSITIVAS ... 22
4.7 ESTEREOLOGIA TESTICULAR ... 23
4.8 FREQUÊNCIA DOS ESTÁDIOS DO CICLO DO EPITÉLIO SEMINÍFERO ... 25
4.9 QUANTIFICAÇÃO DA ESPERMATOGÊNESE ... 25
4.10 ANÁLISE DA ULTRAESTRUTURA ... 26
4.11 ANÁLISE ESTATÍSTICA ... 26
ARTIGO 1: Histomorfometria da espermatogênese de camundongos mdx portadores da Distrofia Muscular de Duchenne (DMD) suplementados com ácido ascórbico ... 32
Resumo ... 32
1. Introdução ... 33
2. Material e métodos ... 34
2.1. Animais ... 34
2.2. Dieta suplementar com ácido ascórbico ... 34
2.3. Eutanásia e coleta do material ... 34
2.4. Processamento histológico ... 35
2.6. Frequência relativa dos estádios do ciclo do epitélio seminífero ... 36
2.7. Quantificação da espermatogênese ... 36
2.8. Análise da ultraestrutura ... 36
2.9. Imunohistoquímica para caspase-3 ... 37
2.10. Densidade de Volume (Vv) das células caspase 3 - positivas ... 38
2.11. Análise estatística ... 38
3. Resultados ... 38
3.1. Estereologia testicular ... 38
3.2. Frequência dos estádios do ciclo do epitélio seminífero ... 40
3.3. Quantificação da espermatogênese ... 41
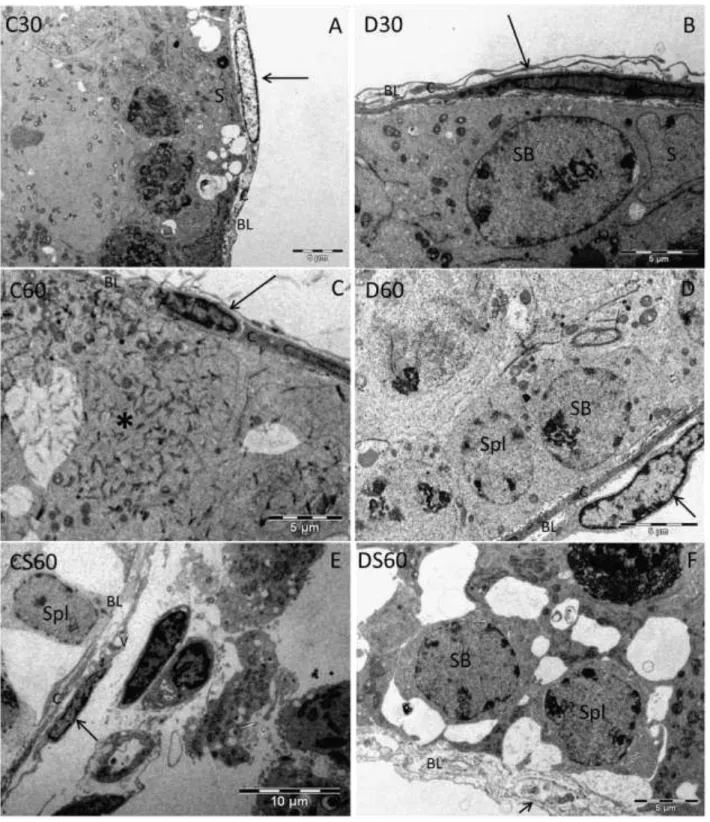
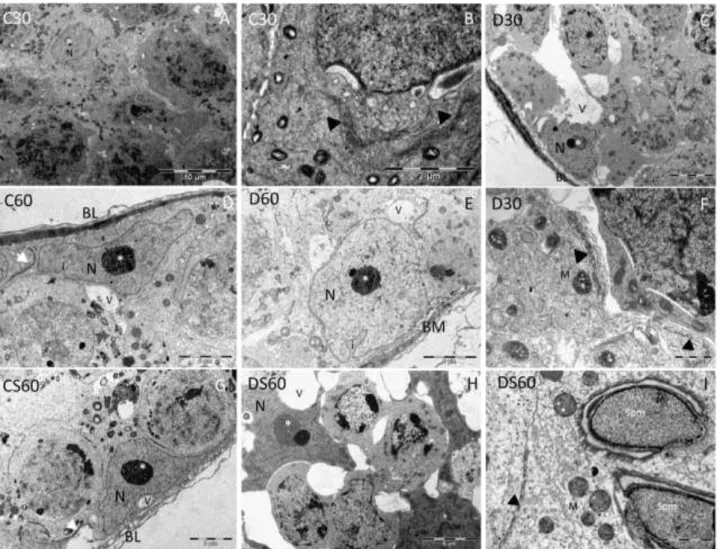
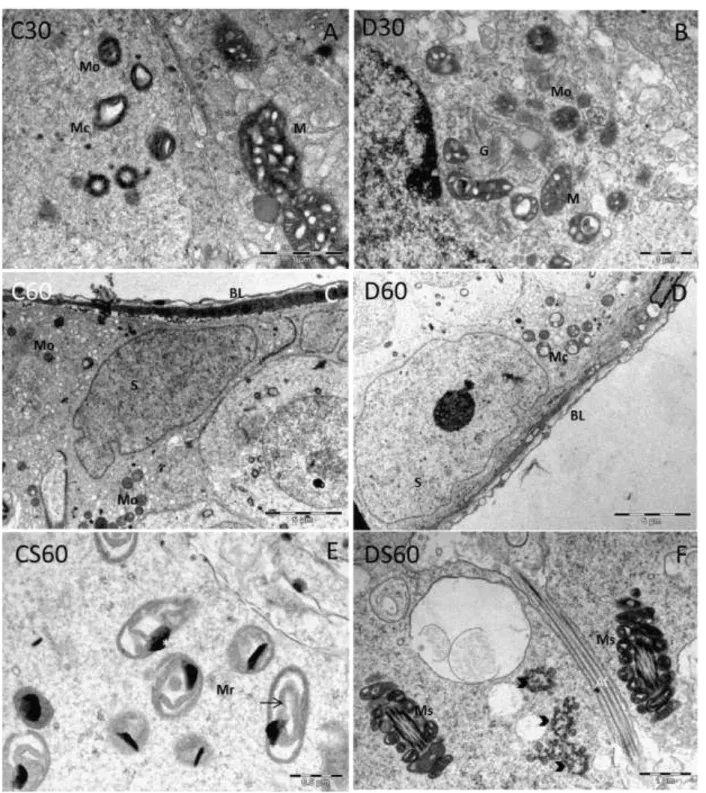
3.4. Análise ultraestrutural ... 43
3.5. Contagem de células apoptóticas ... 48
4. Discussão ... 50
Referências ... 55
ARTIGO 2: Histomorfometria do compartimento intertubular em testículos de camundongos mdx portadores da Distrofia Muscular de Duchenne, tratados com ácido ascórbico ... 62
Resumo ... 62
1. Introdução ... 63
2. Material e Métodos ... 64
2.1. Animais ... 64
2.2. Dieta suplementar com ácido ascórbico ... 64
2.3. Eutanásia e coleta do material ... 64
2.4. Processamento histológico ... 65
2.5. Estereologia testicular ... 65
2.6. Análise estatística ... 66
3. Resultados ... 67
4. Discussão ... 72
Referências ... 75
5. CONCLUSÕES ... 81
ANEXO A – Certificado Comitê de Ética no Uso dos Animais ICB/USP ... 82
1 INTRODUÇÃO
A Distrofia Muscular de Duchenne (DMD) é uma distrofinopatia que afeta 1: 3500 meninos nascidos (DALTON e SAMPSON, 2015). Os portadores apresentam os primeiros sinais clínicos dessa distrofia a partir dos 3 anos de idade, demostrando disfunção nos músculos associados ao joelho e quadril (manobra de Gower), dificultando a mobilidade (EMERY, 2002). Esses sintomas aparecem em virtude da degeneração muscular progressiva decorrente de mutação no cromossomo X, no locus gênico Xp21, o que afeta a função da proteína de membrana chamada distrofina, ausente nos portadores (HOFFMAN et al., 1987; BRADLEY e PARSONS, 1998; TERRIL et al., 2013). Portadores da DMD podem apresentar variações na gravidade da doença associadas à mesma mutação, o que dificulta e limita os métodos de intervenção (BRINKMEYER-LANGFORD e KORNEGAY, 2013).
A degeneração muscular é causada inicialmente por danos nas fibras musculares com participação de células no processo inflamatório (neutrófilos e macrófagos) que podem perdurar durante dias em virtude das injúrias causadas à membrana, passando a produzirem EROs (Espécies Reativos Oxigênio) ao realizarem fagocitose, agravando a resposta inflamatória (TIDBALL, 2005; WHITEHEAD et al., 2006). O estresse oxidativo é relevante em pacientes com DMD e camundongos mdx, uma vez que na ausência de distrofina, as espécies reativas de oxigênio estão elevadas nos músculos e permitem a oxidação de lipídios da membrana, proteínas, ou DNA (CANTON et al., 2014). Estudos do mecanismo de inflamação e da degeneração muscular de DMD em humanos são compreendidos com a utilização de cães da raça Golden Retriever, que apresentam homologia genética com a DMD em humanos, e de camundongos mdx como modelos experimentais, por possuírem uma mutação que gera o defeito bioquímico semelhante ao encontrado na DMD (HOFFMAN et al., 1987; WHITEHEAD et al., 2006; MARTINS-JÚNIOR et al., 2015).
Para reduzir as lesões musculares em DMD, pesquisadores têm realizado estudos com terapias antioxidantes a base de chá verde (DORCHIES et al., 2006), N-acetilcisteína (WHITEHEAD et al., 2008) e melatonina (HIBAOUI et al., 2011). O ácido ascórbico é um antioxidante que protege os testículos de danos decorrentes do estresse oxidativo (SÖNMEZ et al., 2005). Além disso, em homens com baixo nível de ácido ascórbico foi detectado redução no número de espermatozoides, na motilidade espermática e aumento no número de espermatozoides anormais (EBESUNUN et al., 2004).
muscular que promove a deterioração muscular progressiva e desordem sistêmica, como a atrofia testicular (CARTER e STEINBECK, 1985; AL-HARBI et al., 2008). Apesar de Askeland et al. (2013) afirmarem que pacientes portadores da DMD apresentaram morbidades urológicas à medida em que a distrofia era agravada, estudos relacionados à caracterização da espermatogênese em indivíduos portadores desse tipo de distrofia ainda não são relatados na literatura. Do mesmo modo, não há registros da ação antioxidante do ácido ascórbico nos túbulos seminíferos dos portadores da DMD, tornando relevante a aplicação deste trabalho.
2 OBJETIVOS
2.1 OBJETIVO GERAL
Avaliar as alterações na espermatogênese provocadas pela Distrofia Muscular de Duchenne (DMD) e o efeito do tratamento com ácido ascórbico na prevenção dessas injúrias.
2.2 OBJETIVOS ESPECÍFICOS
2.2.1 Avaliar os parâmetros morfométricos testiculares do compartimento tubular e intertubular em camundongos distróficos suplementados ou não com ácido ascórbico;
2.2.2 Averiguar as alterações ultraestruturais nas células de Sertoli, células de Leydig e túnica própria de camundongos distróficos tratados ou não com ácido ascórbico;
3 REVISÃO DE LITERATURA
3.1 DISTROFIA MUSCULAR DE DUCHENNE (DMD)
A Distrofia Muscular de Duchenne (DMD) é caracterizada pela perda muscular progressiva e fraqueza precoce, podendo levar o paciente a óbito ainda no final da adolescência. Essa descrição foi feita inicialmente em humanos em 1851 pelo médico inglês Edward Meryon, que postulou que a distrofia teria caráter hereditário, acometendo somente meninos, com completa degeneração do sarcolema. Apesar da relevância de suas descrições, os achados de Meryon permaneceram negligenciados por muito tempo até que o médio neurologista Guillaume Benjamin Amand Duchenne, em 1868, detalhou a clínica e a histopatologia muscular da distrofia (EMERY, 2002).
Somente em 1986 foi constatado que os pacientes com DMD apresentavam uma deleção do cromossomo Xp21, o gene da distrofina responsável pela produção da proteína de 427 Da, e sua ausência desencadeia a distrofia muscular. Esse gene é de caráter recessivo localizado no cromossomo X materno. Dessa forma, as meninas raramente manifestam a doença por serem heterozigotas, podendo ainda apresentar sinais clínicos brandos. Já os meninos podem receber o alelo recessivo do cromossomo X materno e manifestarem a doença (MUKHERJEE et al., 2003). Os sinais clínicos da DMD se manifestam por volta dos 3 a 5 anos de idade, pela fraqueza muscular dos joelhos e dos quadris fazendo com que a criança utilize as mãos como se estivesse escalando. Esse é o sinal característico da manobra de Gower. Aos 12 anos de idade a criança poderá utilizar cadeira de rodas em virtude da progressão da fraqueza muscular (MORRISON, 2011).
Um complexo distrofina-glicoproteína é formado pela distrofina e por outras proteínas, permitindo que a actina se conecte a matriz extracelular (integrante da estrutura responsável pela contratilidade muscular). A distrofina, juntamente com as sarcoglicanas e outra glicoproteínas, podem estar associadas a tecidos musculares e não-musculares, enfatizando a necessidade de conhecer a doença em diferentes aspectos e propor formas alternativas de intervenção nas diferentes áreas teciduais comprometidas pela ausência de distrofina (DAVIS, 1997; HOFFMAN E DRESSMAN, 2001).
consigo o interesse reprodutivo, que deve ser acompanhado do aconselhamento genético (DALTON e SAMPSON, 2015; PEDLOW et al., 2015).
Para o estudo da distrofia são utilizados frequentemente modelos animais, sendo o camundongo mdx o mais adequado para avaliar os mecanismos de mionecrose e regeneração na distrofia muscular de Duchenne, a fim de se desenvolver estratégias terapêuticas. Esse camundongo desenvolve a distrofia muscular recessiva associada ao cromossomo X (locus Xp21), e não possui a proteína distrofina. No desenvolvimento de sua miopatia é possível observar alterações musculares associadas à mionecrose e presença de infiltrados de linfócitos que sugerem a participação do sistema linfocitário, bem como a presença de moduladores da expressão de componentes da matriz extracelular que auxiliam no direcionamento dos linfócitos ao local da lesão (SEIXAS et al., 1997).
A ausência da distrofina na DMD eleva os nível de espécies reativas de oxigênio (EROs) nos músculos, levando a oxidação de lipídios, proteínas ou do DNA (RENJINI et al., 2012). Em murinos a degeneração muscular inicia no período pré-púbere, com um processo inflamatório, e posteriormente ocorre a progressão necrótica (DISATNIK et al., 1998). Esse processo desencadeia a degeneração, a fibrose e o déficit funcional da musculatura do diafragma, musculatura esquelética e cardíaca em camundongos mdx e em pacientes com DMD (STEDMAN et al., 1991). Todavia, antioxidantes naturais podem oferecer proteção aos danos decorrentes do estresse oxidativo em camundongos mdx, através da restauração dos níveis de glutationa (DORCHIES et al., 2009). 3.1.1 A Distrofia Muscular de Duchenne e a reprodução
Os estudos relacionados à espermatogênese na distrofia muscular estão descritos para a distrofia miotônica, obtidos por meio da medição dos níveis de testosterona sérica livre e total, bem como descrição de hipogonadismo nos indivíduos portadores (AL –HARBI, 2008).
Alguns trabalhos com cães Golden Retriever, outro modelo comumente utilizado para o estudo da Distrofia Muscular de Duchenne (GRMD), relatam alterações como criptorquidísmo, hérnia inguinoescrotal, exposição constante da glande na ausência de ereção, aspermia, maior taxa de anormalidade espermática, degeneração testicular com fibrose, hialinização e retração das fibras do músculo cremáster, o que pode comprometer a aptidão reprodutiva dos cães afetados (LUPPI, 2006).
-distroglican e superexpressão e relocalização de α-sintrofina, proteínas essas associadas ao complexo de distrofina (HERNÁNDEZ-GONZÁLES et al., 2005).
3.2 ÁCIDO ASCÓRBICO
O ácido ascórbico (AA) ou vitamina C foi isolado pela primeira vez 1928 por Szent-Gyorgyi, sendo atualmente considerada como um antioxidante solúvel em água e insolúvel na maior parte dos solventes orgânicos. Os seres humanos não o sintetizam, mas adquirem através da ingestão de frutas cítricas, morangos, tomates, brócolis, nabo e outros vegetais folhosos. Quando essa vitamina não é consumida, cerca de 3% das reservas permanecem reduzidas diariamente e o indivíduo começa a apresentar sintomas clínicos de escorbuto (GONÇALVES, 2008). Dessa forma, o AA é necessário para a realização de funções fisiológicas importantes, como o controle do colesterol sanguíneo, além de contribuir para a síntese de catecolaminas que regulam o sistema nervoso central, auxilia na absorção de ferro intestinal, e possui função imunológica e antioxidante, protegendo o DNA das células da ação dos radicais livres (IQBAL et al., 2004). Tendo em vista as propriedades antioxidantes da vitamina C, pesquisadores conseguiram reforçar a defesa antioxidante e consequentemente reduzir o estresse oxidativo na distrofia muscular do tipo facioescapulohumeral (PASSERIEUX et al., 2014).
Essa vitamina é conhecida pela fórmula molecular C6H8O6, ou pelo nome químico 2-oxi-treohexônio-1,4-lactona-2,3-enediol. Pode ser encontrada na forma reduzida e ativa (ácido ascórbico) e na forma oxidada (ácido deidroascórbico) (MORÁN et al., 2006). O ácido L-ascórbico apresenta atividade vitamínica total quando comparado ao ácido L-deidroL-ascórbico, o que corresponde a cerca de 75 a 80% de atividade de vitamina C (PINEDO, 2007). Após a ingestão de alimentos ricos em vitamina C ocorre sua absorção pela mucosa oral, estômago e intestino, para ser transportado sob a forma aniônica livre em direção ao interior dos leucócitos e eritrócitos, via difusão simples (IQBAL et al., 2004). Assim é possível que ocorra a ampla distribuição nos tecidos, embora alguns órgãos como a glândula suprarrenal, a hipófise e a retina, são grandes armazenadores de AA (ARANHA et al., 2000).
ascórbico pode melhorar os parâmetros espermáticos com aumento significativo na concentração, motilidade e morfologia dos espermatozoides (AKMAL et al., 2006).
3.3 ANATOMIA E FISIOLOGIA DO SISTEMA REPRODUTOR MASCULINO 3.3.1 Testículo
Os testículos são órgãos pares, de formato oval e estão revestidos pela túnica vaginal e albugínea. A estrutura glandular dos testículos está dividida em lobos e lóbulos, esses por sua vez são formados por túbulos seminíferos contorcidos. Os testículos produzem os gametas masculinos (espermatogênese) e os hormônios sexuais masculinos através de reações enzimáticas, que conduzem à produção de hormônios esteroides (esteroidegênese) (RUSSELL et al., 1990). A produção espermática ocorre no compartimento tubular, que consiste nos túbulos seminíferos, e a síntese de esteroides no compartimento intersticial entre os túbulos seminíferos. Apesar dos compartimentos apresentarem morfologia e função distinguíveis, eles estão intimamente ligados entre si para garantir a integridade funcional testicular (WEINBAUER et al., 2010).
Os túbulos seminíferos são avasculares e não possuem inervação sendo constituídos por uma lâmina própria, lúmen e o epitélio seminífero. A lâmina própria, que constitui a membrana basal, é uma camada de colágeno com células peritubulares (células mióides). As células mióides são contráteis que promovem a circulação de fluídos e a propulsão espermática através do lúmen dos túbulos seminíferos. O epitélio seminífero pode ser classificado como estratificado e nele são encontradas as células germinativas e as células de Sertoli (RUSSELL et al., 1990).
3.3.2 Espermatogênese
A espermatogênese é um processo que se divide funcionalmente em três fases promovendo mudanças moleculares e celulares (PARVINEN, 1982). A primeira fase é a proliferativa com a expansão clonal decorrente de mitoses sucessivas das espermatogônias até a formação dos espermatócitos. A segunda fase é a meiótica que consiste na divisão por meiose I e II dos espermatócitos para formação das espermátides. A última fase é a diferenciação das espermátides arredondas e alongadas para formação do espermatozoide (RUSSELL et al., 1990). Contudo, de acordo com Cheng et al. (2010) a espermatogênese está dividida em quatro fases distintas: a mitose, a meiose, a espermiogênese e a espermiação.
difícil visualização na microscopia em virtude do curto tempo em intérfase, e prosseguem com a segunda divisão meiótica. As espermátides arredondadas surgem como resultado da segunda divisão meiótica dos espermatócitos secundários. A partir das espermátides inicia o processo de espermiogênese, que corresponde a fase final de produção de espermatozoides. Esse é um processo complexo que envolve a formação do acrossomo, condensação e alongamento do núcleo, desenvolvimento do flagelo e a perda da maior parte do citoplasma resultando em espermatozoides no lúmen do túbulo seminífero (WEINBAUER et al., 2010).
3.3.3 Célula de Sertoli
As células de Sertoli foram descritas pelo cientista italiano Enrico Sertoli em 1865, são cilíndricas e apresentam núcleo e nucléolo tripartido com heterocromatina associada revestindo os túbulos seminíferos após a puberdade, atuando como células de ligação entre o espaço intertubular e o lúmen do túbulo seminífero. O citoesqueleto das células de Sertoli é formado por microtúbulos, filamentos de actina e filamentos intermediários de vimentina. Essa organização permite a manutenção da forma e polaridade da célula, a movimentação ou posicionamento das organelas, a formação de pseudópodes e a ancoragem das células germinativas. O domínio apical e lateral dessa célula é irregular para sustentar as células do epitélio germinativo. Já o domínio basolateral apresenta junções oclusivas entre as células de Sertoli adjacentes formando o compartimento adlumial e basal (RUSSELL, 1990; WEINBAUER et al., 2010).
Essas células possuem papel importante na sustentação, proteção e nutrição das células espermatogênicas em desenvolvimento. Além de fagocitar os corpos residuais, facilitam a liberação das espermátides maduras para o lúmen dos túbulos seminíferos (RUSSELL, 1990). A proliferação dessas células ocorre apenas durante o período pré-púbere, dessa forma o bom desenvolvimento e nessa fase são importantes para a saúde reprodutiva masculina na puberdade. Esse processo é regulado por fatores hormonais parácrinos e autócrinos (ESCOTT et al., 2014). Além de ser influenciada pelo hormônio hipofisário folículo estimulante (FSH) para síntese e secreção da proteína ligante ao andrógeno (ABP) (GRISWOLD, 1998).
3.3.4 Célula de Leydig
testosterona, que pode ser convertida em di-hidrotestosterona pela ação enzimática de 5α-redutase. As altas concentrações de testosterona durante o desenvolvimento das espermatogônias são mantidas pela ABP produzida pelas células de Sertoli em resposta ao estímulo do FSH (WEINBAUER et al., 2010).
3.3.5 Ciclo do epitélio seminífero (CES)
A espermatogênese é um processo dinâmico e ordenado formado por associações celulares em fases específicas do desenvolvimento em secções transversais dos túbulos seminíferos denominadas de estádios. Essas células evoluem de um estádio anterior para um seguinte permitindo que cada célula do epitélio seminífero seja maturada em determinado tempo e espaço, isso faz com que a nova geração celular seja sincronizada. Essa organização celular foi designada
de “ciclo espermatogênico” (REGAUD, 1901). Mas, atualmente a literatura denomina de ciclo do
epitélio seminífero (CES) (PEREY et al., 1961; LEBLONT e CLERMONT, 1962; RUSSELL et al., 1990). O ciclo é regulado por fatores intrínsecos (células de Sertoli e células germinativas), fatores extrínsecos (andrógeno e ácido retinóico) e pelo fator espécie-específico (HESS e FRANÇA, 2008). O CES pode ser classificado de acordo com o método da morfologia tubular (BERNDTSON, 1977) e o método acrossômico (NEVES et al., 2002). O método da morfologia tubular identifica 8 estádios para as associações de células germinativas dentro de muitas gerações em uma área do túbulo, levando em consideração a forma do núcleo e o posicionamento das espermátides, presença de divisões meióticas e a composição do túbulo seminífero (BERNDTSON, 1977; AMANN, 1986). Já o método acrossômico é baseado no desenvolvimento do sistema acrossômico ao longo da maturação das espermátides arredondas em alongadas e constitui estádios desde 6 estádios para o homem a 12 para camundongos (CLERMONT, 1963; RUSSELL, 1990).
4 MATERIAL E MÉTODOS
4.1 ANIMAIS
Foram utilizados 24 camundongos machos, sendo 12 da linhagem C57BL/10 (animais controle) e 12 da linhagem C57BL/10Mdx (animais distróficos), provenientes do Biotério da FIOCRUZ/ Rio de Janeiro e do Biotério do Instituto de Ciências Biomédicas da Universidade de São Paulo/ICB – USP, respectivamente. O projeto foi aprovado pelo comitê de ética do ICB/USP e chancelado pelo CEUA/UFRN (Parecer nº 164/2011 CEUA/ICB/USP e Parecer nº 064/2013 CEUA/UFRN) (Anexo A-B). Os animais foram divididos em seis grupos com 4 animais em cada: Grupo controle com 30 dias de idade (C30); Grupo distrófico com 30 dias de idade (D30); Grupo controle com 60 dias de idade (C60); Grupo distrófico com 60 dias de idade (D60); Grupo controle com 60 dias de idade suplementado com ácido ascórbico (CS60) e Grupo distrófico com 60 dias de idade suplementado com ácido ascórbico (DS60). Os animais foram mantidos no Biotério do Departamento de Anatomia, ICB/USP, em caixas de polietileno, contendo bebedouro (água) e comedouro (ração), sob temperatura controlada de aproximadamente 22ºC e iluminação com ciclo de 12 horas claro/escuro.
4.2 DIETA SUPLEMENTAR COM ÁCIDO ASCÓRBICO
Após o desmame (21 dias de idade), os animais receberam ração comercial para roedores Nuvilab® (Nuvital, São Paulo, Brasil). A partir dos 30 dias de idade os animais dos grupos suplementados com ácido ascórbico (CS60 e DS60) receberam diariamente 0,005g de ácido ascórbico (Sigma-Aldrich, St. Louis, EUA) por quilograma do peso corporal do animal, diluído em água e administrado por meio de gavagem. A concentração foi calculada de acordo com o protocolo estabelecido na literatura para modelo de camundongo com distrofia muscular, que se baseia em Guido et al. (2010) e Tonon et al. (2012).
4.3 EUTANÁSIA E COLETA DO MATERIAL
4.4 PROCESSAMENTO HISTOLÓGICO
Após fixação em Karnovsky por 24h, seguindo-se a desidratação os fragmentos testiculares destinados à morfometria foram transferidos para álcool 70%. Os fragmentos foram desidratados em concentrações crescentes de álcool etílico, para posterior inclusão em glicol-metacrilato (Historesin®, Leica Mycrosistems, Heidelberg, Alemanha). O material foi seccionado a 3µm de espessura através da técnica semi-seriada utilizando-se micrótomo rotativo Leica RM2255 (Leica Microsystems, Heidelberg, Alemanha), com intervalo de 40µm entre os cortes, as lâminas histológicas foram coradas com azul de toluidina/borato de sódio 1% (MORAIS et al., 2014). As lâminas permanentes confeccionadas foram observadas ao microscópio de luz Motic BA410 (Motic, Causeway Bay, Hong Kong) e microfotogradas para análises e comparações com câmera digital Moticam 5.0 MP (Motic Instruments Inc, Richmond, Canada). As imagens foram analisadas ao software Image-Pro Plus® (Media Cybernetics Inc., Rochville, USA).
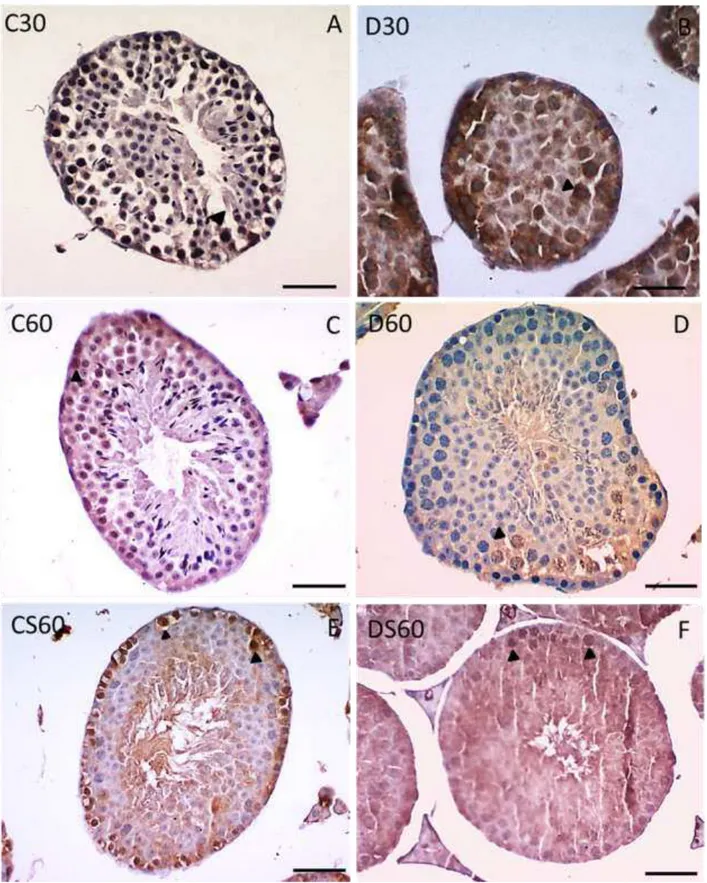
4.5 ANÁLISE IMUNOHISTOQUÍMICA PARA CASPASE-3
Para identificar células em apoptose no interior dos túbulos seminíferos foi utilizada a técnica de imunohistoquímica para caspase 3. Os cortes foram desparafinizados em uma estufa a 60°C durante 30 minutos, colocados em xilol por 5 minutos, reidratados em concentrações decrescentes de álcool etílico (absoluto, 90, 70 e 50%) e lavados em água destilada. Para desmascarar os epítopos, a recuperação antigênica foi realizada com solução de citrato de sódio 10 mM (pH 6,0 95°). Esta recuperação foi realizada em panela de pressão de micro-ondas com potência máxima de 750W, em dois ciclos de 5 minutos. Em seguida as amostras foram arrefecidas até a temperatura ambiente e lavadas com água destilada. O bloqueio da peroxidase endógena foi realizado com peróxido de hidrogênio 0,9%, seguindo-se a lavagem com água destilada e solução salina tamponada com fosfato de sódio (PBS, pH 7,4). O anticorpo primário anti-caspase 3 (diluição 1: 400, Abcam, Cambridge, Inglaterra) foi incubado durante 12h. Em seguida, os antígenos imunomarcados foram visualizados através do sistema Dako Envision+ (Dako, Carpinteria, EUA), utilizando-se 3'3-tetra-hidrocloreto de diaminobenzidina (DAB) como cromógeno. As seções foram finalmente contrastadas com hematoxilina de Harry.
4.6 DENSIDADE DE VOLUME (VV) DAS CÉLULAS CASPASE 3 - POSITIVAS
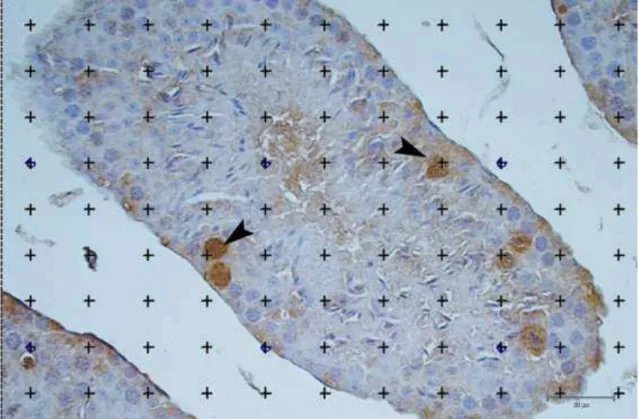
Figura 1- Sistema teste aplicado para cálculo da densidade de volume de células apoptóticas positivas para caspase-3 (ponta da seta).
4.7 ESTEREOLOGIA TESTICULAR
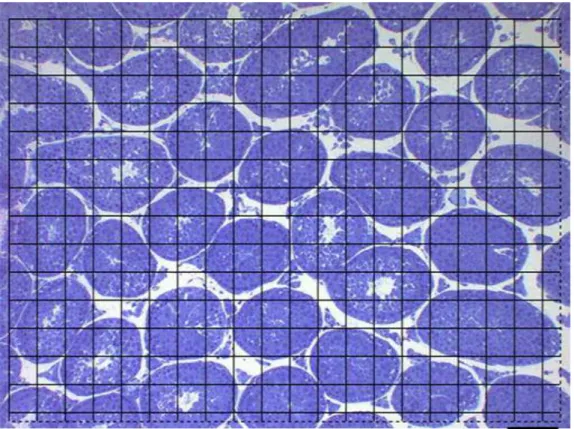
Figura 2 – Modelo de sistema teste para calcular as proporções volumétricas dos componentes testiculares. Azul de toluidina. Barra = 50µm.
O índice tubulossomático (ITS) foi obtido através da divisão do volume tubular pelo peso corporal, multiplicado por 100. Já o índice gonadossomático (IGS) foi obtido como quociente da divisão do peso dos testículos pelo peso corporal, sendo o valor, multiplicado por 100. O diâmetro dos túbulos seminíferos e altura do epitélio seminífero (mensurada da túnica própria até o lúmen tubular) foram obtidos pela mensuração de 20 secções transversais de túbulos/animal, escolhendo-se os túbulos que apreescolhendo-sentaram contorno o mais circular possível.
O comprimento dos túbulos seminíferos (CT), em metros, foi estimado a partir da fórmula CT = VTS/πR2, onde VTS é o volume dos túbulos seminíferos, πR2 é a área da secção transversal dos túbulos seminíferos, e R é o diâmetro tubular/2. O CT por grama de testículo foi obtido dividindo-se este valor pelo peso gonadal.
estimados pela equação: (% do elemento no testículo x peso do parênquima testicular / 100) (MORAIS et al., 2014b). Todas essas contagens foram feitas utilizando-se o software Image-Pro Plus® (Media Cybernetics Inc., Rochville, USA).
Os diâmetros nucleares das células de Leydig foram mensurados quando apresentaram contorno circular, cromatina perinuclear e nucléolos evidentes, quantificando-se 30 núcleos por animal. O volume nuclear (VN) e volume citoplasmático (VC) das células de Leydig por animal foram expressos em µm3, através das respectivas equações: VN = 4/3 πR3, sendo R o raio nuclear; VC = % citoplasma x VN / % núcleo. Somando-se VN + VC obteve-se o volume celular.
O cálculo do número total de células de Leydig (TCL) foi obtido pela divisão do volume total dessas células por parênquima testicular (µm3) pelo volume de cada célula de Leydig (µm3). O número de células por grama de testículo foi obtido pela divisão do TCL pelo peso gonadal total. O índice Leydigossomático (ILS), que quantifica o investimento em células de Leydig em relação à massa corporal, foi obtido através da equação: ILS = volume total de célula de Leydig por parênquima testicular / PC x 100, onde PC = peso corporal.
4.8 FREQUÊNCIA DOS ESTÁDIOS DO CICLO DO EPITÉLIO SEMINÍFERO
Os estádios que compõem o ciclo do epitélio seminífero (CES) foram descritos utilizando-se o método de morfologia tubular que descreve 8 estádios para todas as espécies, baseando-se em Berndtson (1977). A frequência relativa de cada estádio foi descrita pela caracterização e contagem de 50 túbulos por animal em secções transversal de forma randomizada.
4.9 QUANTIFICAÇÃO DA ESPERMATOGÊNESE
A partir desses dados o índice das células de Sertoli foi obtido com a finalidade de indicar a capacidade de suporte dessas células por total de células germinativas. Esse índice foi determinado através do resultado da razão entre os números corrigidos de células germinativas e o número corrigido de células de Sertoli, utilizando-se a fórmula: (A+PL-L+PQ+Ar) / Se. Os índices mitótico (PL-L / A), meiótico (Ar / PQ) e o rendimento geral da espermatogênese (Ar / A) também foram quantificados.
4.10 ANÁLISE DA ULTRAESTRUTURA
Após fixação em solução de Karnovsky por 24h, os fragmentos testiculares foram submetidos à microscopia eletrônica de transmissão (MET), seguindo o protocolo proposto por Oliveira (2004). Os fragmentos foram imersos em glutaraldeído a 2,5%, tamponado com fosfato de sódio a 0,1M, pH 7,4. Após a fixação o material foi lavado três vezes durante 10 minutos cada no mesmo tampão. Em seguida ocorreu a pós-fixação com tetróxido de ósmio 2% por duas horas. Os fragmentos foram lavados com solução tampão por três vezes durante dez minutos cada. Após esse procedimento o material foi imerso em acetato de uranila a 3% overnight, lavado com tampão fosfato e desidratado com série crescente de álcool etílico (50-100%) durante 10 minutos em cada.
Após desidratação, os fragmentos foram imersos em óxido de propileno por 10 minutos para garantir total desidratação do tecido. Em seguida o material foi embebido em resina araldite 502 (Polysciences Inc, California, EUA), seguido da confecção dos blocos. Foram então obtidos cortes semi-finos com ultramicrótomo, os quais foram corados com solução aquosa azul de toluidina a 1% para a identificação dos locais para a realização de cortes ultrafinos. Cortes de 70nm de espessura foram confeccionados com navalha de diamante e colocados em telas de cobre com 200 mesh para posterior contraste com acetato de uranila saturado a 2%, por sete a dez minutos. Em seguida utilizou-se citrato de chumbo a 0,5%, durante o mesmo período. O material foi analisado em Microscópio Eletrônico de Transmissão no Laboratório de MEV (Jeol® 100 CX II, Tóquio, Japão) da Faculdade de Medicina Veterinária e Zootecnia da USP.
4.11 ANÁLISE ESTATÍSTICA
REFERÊNCIAS
ABERCROMBIE, M. Estimation of nuclear populations from microtome sections. The Anatomical Records, v. 94, n. 2, p. 239-247, 1946.
AKMAL, M. et al. Improvement in human semen quality after oral supplementation of vitamin C. Journal of Medicinal Food, v. 9, n. 3, p. 440-2, 2006.
AL-HARBI, T. M. et al. Hypogonadism is common in men with myopathies. Journal of Clinical Neuromuscular Disease, v. 9, n. 4, p. 397–401, 2008.
AMANN, R. P.; ALMQUIST, J. O. Reproductive capacity of dairy bulls. VIII. Dand indirect measurement of testicular sperm production. Journal of Dairy Science, v. 45, n. 6, p. 774-781, 1962.
AMANN, R. P. Detection of alterations in testicular and epididymal function in laboratory animals. Environmental Health Perspectives, v. 70, p. 149-158, 1986
ARANHA, F. Q. et al. O papel da vitamina C sobre as alterações orgânicas no idoso. Revista de Nutrição da PUC-Campinas, v. 13, n. 2, p. 89-97, 2000.
ASKELAND, E. J. et al. Urological manifestations of duchenne muscular dystrophy. Journal of Urology, v. 190, n. 4, p. 1523-1528, 2013.
BERNDTSON, W. E. Methods for quantifying mammalian spermatogenesis: a review. Journal of Animal Science, v. 44, n. 5, p. 818-883, 1977.
BRADLEY, D.; PARSONS, E. Newborn screening for Duchenne muscular dystrophy. Seminars in Neonatology, v. 3, n. 1, p. 27-34, 1998.
BRINKMEYER-LANGFORD, C.; KORNEGAY, J. N. Comparative genomics of X-linked muscular dystrophies: The golden retriever model. Current Genomics, v. 14 n. 5, p. 330-342, 2013.
CANTON, M.; MENAZZA, S.; DI LISA, F. Oxidative stress in muscular dystrophy: from generic evidence to specific sources and targets. Journal of Muscle Research and Cell Motility, v. 35, n.1, p. 23-36, 2014.
CARTER, J. N.; STEINBECK, K. S. Reduced adrenal androgens in patients with myotonic
dystrophy. The Journal of Clinical Endocrinology and Metabolism,v. 60, n. 3, p. 611-614, 1985. CHENG, C. Y. et al. Regulation of spermatogenesis in the microenvironment of the seminiferous epithelium: new insights and advances. Molecular and Cellular Endocrinology, v. 315, n. 1, p. 49-56, 2010.
CLERMONT, Y. The cycle of the seminiferous epithelium in man. American Journal of Anatomy, v. 112, n. 1, p. 35-51, 1963.
COLAGAR, A. H.; MARZONY, E. T. Ascorbic Acid in human seminal plasma: determination and its relationship to sperm quality. Journal of Clinical Biochemistry and Nutrition, v. 45, n.2, p. 144-9, 2009.
COSTA, D. S. et al. Intrinsic rate of spermatogenesis in free-ranging feral pigs (Sus scrofa sp). Animal Reproduction Science, v. 125, n. 1-4, p. 165-169, 2011.
DALTON, J.; SAMPSON, J. B. Overview of Adult Muscular Dystrophies. In: GOLDMAN, J. (Org.). Genetic Counseling for Adult Neurogenetic Disease. Nova York: Springer, 2015. p. 233-237.
DAVIS, K. E. Challenges in duchenne muscular dystrophy. Neuromuscular Disorders, v. 7, n.8, p. 482-486, 1997.
DISATNIK, M. H. et al. Evidence of oxidative stress in mdx mouse muscle: studies of the pre-necrotic state. Journal of the Neurological Sciences, v. 161, n. 1, p. 77-84, 1998.
DORCHIES, O. M. et al. Green tea extract and its major polyphenol (-)- epigallocatechin gallate. The American Journal of Physiology - Cell Physiology, v. 290, n. 2, p. 616 –625, 2006.
EBESUNUN, M. O. et al. Plasma and semen ascorbic levels in spermatogenesis. The West African Journal of Medicine, v. 23, n. 4, 290–293, 2004.
EMERY, A. E. H. The muscular dystrophies. Lancet, v. 359, n. 9397, p. 687-695, 2002.
ESCOTT, M. G. et al. Mechanisms of hormonal regulation of sertoli cell development and proliferation: a key process for spermatogenesis. Current Molecular Pharmacology, v. 7, n. 2, p. 96-108, 2014.
FERLINI, A. et al. Dystrophin restoration in skeletal, heart and skin arrectorpili smooth muscle of mdx mice by ZM2 NP-AON complexes. Gene Therapy, v. 17, n. 3, p. 432-438, 2010.
GONÇALVES, A. A. S. S. Avaliação da capacidade antioxidante de frutas e polpas de frutas nativas e determinação dos teores de flavonóides e vitamina C. 2008. 88p . Tese (Mestrado em Ciência dos Alimentos). Universidade de São Paulo, São Paulo. 2008.
GRISWOLD, M. D. The central role of Sertoli cells in spermatogenesis. Seminars in Cell & Developmental Biology, v. 9, p. 411-416, 1998.
GUIDO, N. A. et al. Fiber type composition of the sternomastoid and diaphragm muscles of dystrophin‐deficient mdx mice. The Anatomical Record, v. 293, n.10, p. 1722-1728, 2010.
HAMMER, O; HARPER, D. A. T.; RYAN, P. D. PAST: Paleontological statistics software package for education and data analysis. Palaeontologia Electronica. v. 4, n. 1, p. 1-9, 2001. HERNÁNDEZ-GONZÁLEZ, E. O. et al. Absence of dp71 in mdx3cv mouse spermatozoa alters flagellar morphology and the distribution of ion channel and nNos. Journal of Cell Science, v. 118, n. 1, p. 137-145, 2005.
HOFFMAN, E. P.; DRESSMAN, D. Molecular pathophysiology and targeted therapeutics for muscular dystrophy. Trends in Pharmacological Sciences, v. 22, n. 9, p. 465-470, 2001.
HOFFMAN, E. P.; BROWN, R. H.; JR. KUNKEL, L. M. Dystrophin: the protein product of the duchenne muscular dystrophy locus. Cell, v. 51, n. 6, p. 919-928, 1987.
HUSSAIN, J.; HUSSAIN, J.; SHARMA, K. C. Fluoride and health hazards: community perception in a fluorotic area of central Rajasthan (India) an arid environment. Environmental Monitoring and Assessment, v. 162, n. 1, p. 1-14, 2010.
IQBAL, K.; KHAN, A.; KHATTAK, M. M. A. K. Biological significance of ascorbic acid (Vitamin C) in human health–a review. Pakistan Journal of Nutrition, v. 3, n. 1, p. 5-13, 2004. JOHNSON, L.; PETTY, C. S.; NEAVES, W. B. A new approach to qualification of spermatogenesis and its application to germinal cell attrition during human spermatogenesis. Biology of Reproduction, v. 25, n. 1, p. 217–226, 1981.
KARNOVSKY, M. J. A formaldehyde-glutaraldehyde fixative of high osmolarity for use in electron microscopy. The Journal of Cell Biology, v. 27, p. 137-138, 1965.
KIENY, P. et al. Evolution of life expectancy of patients with Duchenne muscular dystrophy at AFM Yolaine de Kepper centre between 1981 and 2011. Annals of Physical and Rehabilitation Medicine, v. 56, n. 6, p. 443–454, 2013.
LADD, A. A. L. et al. SCG postnatal remodelling–hypertrophy and neuron number stability–in Spix's Yellow-toothed Cavies (Galea spixii). International Journal of Developmental Neuroscience, v. 30, n. 2, p. 129-137, 2012.
LEBLOND, C. P.; CLERMONT, Y. Definition of the stages of the cycle of the seminiferous epithelium in the rat. Annals of the New York Academy of Sciences, v. 55, n. 4, p. 548-573, 1952. LUPPI, M. M. C. P. Avaliação andrológica de cães da raça Golden Retriever sadios e afetados pela distrofia muscular. 2006. 109f. Dissertação (Mestrado em Ciências) - Faculdade de Medicina Veterinária, Universidade de São Paulo, São Paulo, 2006.
MARTINS-JÚNIOR, H. A. et al. Profiles of Steroid Hormones in Canine X-Linked Muscular Dystrophy via Stable Isotope Dilution LC-MS/MS. PloS one, v. 10, n. 5, e0126585-e0126585, 2015.
MORAIS, D. B. et al. Evaluation of the cell population of the seminiferous epithelium and spermatic indexes of the bat Sturnira lilium (Chiroptera: Phyllostomidae). PloS one. v. 9, p. e101759, 2014a.
MORAIS, D. B. et al. Histomorphometric characterization of the intertubular compartment in the testes of the bat Sturnira lilium. Animal Reproduction Science, v. 147, n. 3, p. 180-186, 2014b. MORÁN, G. A. G. et al. Aspectos bioclínicos y patobiológicos de la vitamina C en la especie humana. Revista CES Medicina, v. 20, n. 2, p. 53-72, 2006.
MORRISON, L. A. Dystrophinopathies. In: AMATO, A. A.; GRIGGS, R. C. (eds.). Handbook of Clinical Neurology. Amsterdan: Elsevier, 2011. p. 11–39.
MUKHERJEE, M. et al. Denovo mutations in sporadic deletional Duchenne muscular dystrophy (DMD) cases. Experimental and Molecular Medicine, v. 35, n. 2, p. 113–117, 2003.
NEVES, E. S., CHIARINI-GARCIA, H., FRANÇA, L. R. Comparative testis morphometry and seminiferous epithelium cycle length in donkeys and mules. Biology of Reproduction, v. 67, n. 1, p. 247-255, 2002.
OLIVEIRA, M. F. Placentação em mocós, Kerodon rupestre Wied 1920. 2004. 209f. Tese (Doutorado em Anatomia dos Animais Domésticos e Silvestres) - Faculdade de Medicina Veterinária e Zootecnia da Universidade Federal de São Paulo, São Paulo, 2004.
PARVINEN, M. Regulation of the seminiferous epithelium. Endocrine Reviews, v. 3, n. 4, p. 404-417, 1982.
PASSERIEUX, E. et al. Effects of vitamin C, vitamin E, zinc gluconate, and selenomethionine supplementation on muscle function and oxidative stress biomarkers in patients with facioscapulohumeral dystrophy: a double-blind randomized controlled clinical trial. Journal of Free Radicals in Biology and Medicine, v. 81, p. 158-169, 2014.
PINEDO, R. A. Estudo da estabilização da polpa de camu-camu (Myciaria dubia (N.B.K) Vc.Vaugh) congelada visando a manutenção de ácido ascórbico e antocianinas. 2007. 108p. Tese (Doutorado em Engenharia Química). Universidade Estadual de Campinas, Campinas, 2007. PEDLOW, K. et al. Assisted standing for Duchenne muscular dystrophy. Cochrane Librar,. v.3, n. 2, p. 1-9, 2015.
PEREY, B. et al. The wave of the seminiferous epithelium in the rat. American Journal of Anatomy, v. 108, n. 1, p. 47-77, 1961.
REGAUD, C. Etudes sur la structure des tubes seminiferes et sur la spermatogenese chez les mammiferes. Archives d'Anatomie Microscopique et de Morphologie Expérimentale, v. 4, n. 101, p. 231, 1901.
RENJINI, R. et al. Oxidative damage in muscular dystrophy correlates with the severity of the pathology: role of glutathione metabolism. Neurochemical Research, v. 37, n. 4, p. 885-898, 2012 RUSSELL, L. D. et al. Histological and histopathological evaluation of the testis. Bolesta: Cache River Press, 1990. 280p.
SEIXAS, S. L. et al. Importância do camundongo mdx na fisiopatologia da distrofia muscular de duchenne. Arquivos de Neuro-Psiquiatria, v. 55, n. 3B, p. 610-617, 1997.
SPRANDO, R. L. et al. Testing the potential of sodium fluoride to affect spermatogenesis: a morphometric study. Food and Chemical Toxicology, v. 36, n. 12, p. 1117-1124, 1998.
STEDMAN, H. H. et al. The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature, v. 352, n. 6335, p. 536-539, 1991.
TERRIL, J. R. et al. Oxidative stress and pathology in muscular dystrophiefocus on protein thiol oxidation and dysferlinopathies. FEBS Journal, v. 280, n.17, p. 4149–4164, 2013.
TIDBALL, J. G. Inflammatory processes in muscle injury and repair. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology, v. 288, n.2, p. 345–353, 2005.
TONON, E. Ascorbic acid protects the diaphragm muscle against myonecrosis in mdx mice. Nutrition. v. 28, n. 6, p. 686-690, 2012
WEINBAUER, G. F. et al. Physiology of testicular function. In: NIESCHLAG E. et al. (eds.). Andrology. Heidelberg: Springer Berlin, 2010.p. 11-59.
WHITEHEAD, N. P. et al. N-Acetylcysteine ameliorates skeletal muscle pathophysiology in mdx mice. The Journal of Physiology, v. 586, n.7, p. 2003–2014, 2008.
ARTIGO 1: Histomorfometria da espermatogênese de camundongos mdx portadores da Distrofia Muscular de Duchenne (DMD) suplementados com ácido ascórbico
Resumo
Objetivou-se avaliar as alterações na espermatogênese provocadas pela Distrofia Muscular de Duchenne (DMD) e o efeito do ácido ascórbico (AA) na prevenção dessas injúrias. Foram utilizados 12 camundongos da linhagem C57BL/10 (não-distróficos) e 12 da linhagem C57BL/10Mdx (distróficos) distribuídos nos grupos: Controle com 30 dias (C30); Distrófico com 30 dias (D30); Controle com 60 dias (C60); Distrófico com 60 dias (D60); Controle com 60 dias suplementados com ácido ascórbico (CS60) e Distrófico com 60 dias suplementados (DS60). Os animais foram suplementados com ácido ascórbico 0,005g/dia. Após eutanásia, os testículos foram coletados, pesados e seccionados transversalmente. O material foi fixado e processado histologicamente para análises morfológicas, morfométricas, ultraestruturais e imunohistoquímica para caspase-3. A DMD reduziu o percentual de epitélio seminífero em D60 quando comparando a D30 (P<0,05). Verificou-se maior percentual de túnica própria em D30 em relação a C30 e D60 (P<0,05). A distrofia não alterou a morfometria das células do epitélio germinativo, logo elevou rendimento geral da espermatogênese em D60 (P<0,05). As células de Sertoli dos camundongos distróficos púberes apresentaram vacuolizações citoplasmáticas e alteração da conformação mitocondrial em relação a C60. A suplementação reduziu o número de células positivas para caspase-3 em distróficos quando comparado a CS60. Dessa forma, a DMD promoveu os danos testiculares ainda na pré-puberdade de camundongos, mas não inviabilizou a espermatogênese. Além disso, a concentração de AA utilizada reverteu o quadro apoptótico no compartimento tubular em camundongos distróficos.
1. Introdução
A Distrofia Muscular de Duchenne (DMD) é a forma mais comum das distrofias musculares, sendo uma doença autossômica recessiva ligada à mutação no cromossomo X, que afeta aproximadamente 1:3600-6000 meninos nascidos (Hoffman et al., 1987; Bradley & Parsons, 1998). O gene da DMD afeta a função da proteína de membrana chamada distrofina, que por estar ausente nos portadores da doença, acarreta degeneração muscular progressiva (Hoffman et al., 1987; Terriel et al., 2013). A distrofina funcional está associada à actina e ao complexo de glicoproteínas de membrana, protegendo a membrana de danos mecânicos durante a contração. Assim a ausência dessa proteína deixa o sarcolema mais susceptível a danos após a contração muscular, podendo induzir a necrose das fibras musculares cardíacas e esqueléticas, ocasionando inflamação com produção de Espécies Reativas do Oxigênio (ERO's) (Vandebrouck et al., 2002; Lapidos et al., 2004; Tidball, 2005; Whitehead et al., 2006). Há evidências de que os níveis elevados dos ERO's podem agravar as distrofias musculares, além de desencadear a apoptose nas células germinativas testiculares (Rao & Shaha, 2000; Tidball & Wehling-Henricks, 2007).
Para reduzir a necrose muscular promovida pelo estresse oxidativo em camundongos mdx, estudos tem utilizado antioxidantes, como o extrato de chá verde. A dieta suplementar com chá verde em camundongos distróficos protegeu o tecido muscular contra a necrose e estimulou a adaptação do músculo tornando-o mais forte e mais resistente (Dorchies et al., 2006). De acordo com Ângulo et al. (2011), a vitamina C (ácido ascórbico) é um micronutriente associado à fertilidade e sua deficiência pode ocasionar distúrbios na espermatogênese. Em um estudo realizado com camundongos que apresentavam déficit de vitamina C foi observado maior frequência de apoptose nos espermatozoides, demonstrado através da marcação de fragmentação do DNA por meio do ensaio de TUNEL (Yazama et al., 2006).
De acordo com Drucker et al. (1963) a produção e maturação dos espermatozoides nos túbulos seminíferos podem ser alteradas em portadores da distrofia muscular miotônica (DM1). Esses autores relataram desorganização na estrutura testicular, marcada pela redução progressiva da atividade espermatogênica, degeneração das células germinativas e células de Sertoli, espessamento da lâmina própria e esclerose tubular. Contudo, não há relatos na literatura que abordem quantitativamente a morfologia do compartimento tubular, bem como os efeitos decorrentes da intervenção pelo uso de ácido ascórbico na espermatogênese de pacientes portadores da DMD, tornando esse estudo relevante para a área da clínica médica e farmacológica.
consideração que esta expectativa estava em torno de 20 anos de idade (Pedlow et al., 2015). De acordo com Abbott et al. (2015) um paciente britânico do sexo masculino com 30 anos de idade possui uma vida familiar estável, casado e conseguiu ser pai, ou seja, o aumento da expectativa de vida elevou o número de portadores sexualmente ativos e a possibilidade de serem pais.
Diante do exposto, este trabalho teve como objetivo avaliar as alterações do compartimento tubular provocadas pela DMD em camundongos mdx, bem como a eficácia da suplementação com ácido ascórbico sobre estas possíveis injúrias.
2. Material e métodos
2.1. Animais
Foram utilizados 24 camundongos machos, sendo 12 da linhagem C57BL/10 (animais controle) e 12 da linhagem C57BL/10Mdx (animais distróficos), provenientes do Biotério da FIOCRUZ/ Rio de Janeiro e do Biotério do Instituto de Ciências Biomédicas da Universidade de São Paulo/ICB – USP, respectivamente. O projeto foi aprovado pelo comitê de ética do ICB/USP e chancelado pelo CEUA/UFRN (Parecer nº 164/2011 CEUA/ICB/USP e Parecer nº 064/2013 CEUA/UFRN) (Anexo A-B). Os animais foram divididos em seis grupos com 4 animais em cada: Grupo controle com 30 dias de idade (C30); Grupo distrófico com 30 dias de idade (D30); Grupo controle com 60 dias de idade (C60); Grupo distrófico com 60 dias de idade (D60); Grupo controle com 60 dias de idade suplementado com ácido ascórbico (CS60) e Grupo distrófico com 60 dias de idade suplementado com ácido ascórbico (DS60). Os animais foram mantidos no Biotério do Departamento de Anatomia, ICB/USP, em caixas de polietileno, contendo bebedouro (água) e comedouro (ração), sob temperatura controlada de aproximadamente 22ºC e iluminação com ciclo de 12 horas claro/escuro.
2.2. Dieta suplementar com ácido ascórbico
Após o desmame (21 dias de idade), os animais receberam ração comercial para roedores Nuvilab® (Nuvital, São Paulo, Brasil). A partir dos 30 dias de idade os animais dos grupos suplementados com ácido ascórbico (CS60 e DS60) receberam diariamente 0,005g de ácido ascórbico (Sigma-Aldrich, St. Louis, EUA) por quilograma do animal, diluído em água e administrado por meio de gavagem. A concentração foi calculada com base no protocolo estabelecido na literatura (Guido et al., 2010; Tonon et al., 2012).
2.3. Eutanásia e coleta do material
acordo com a técnica histológica a ser empregada: Karnovsky para morfometria testicular sob microscopia de luz e análise ultraestrutural sob microscopia eletrônica de transmissão, e Paraformaldeído 4% em solução tampão de PBS para os procedimentos de imunohistoquímica (Karnovsky, 1965; Oliveira, 2004; Morais et al., 2014a).
2.4. Processamento histológico
Após fixação em Karnovsky por 24h, os fragmentos testiculares destinados à morfometria foram transferidos para álcool 70%. Os fragmentos foram desidratados em concentrações crescentes de álcool etílico, para posterior inclusão em glicol-metacrilato (Historesin®, Leica Mycrosistems, Heidelberg, Alemanha). O material foi seccionado a 3µm de espessura através da técnica semi-seriada com micrótomo rotativo Leica RM2255 (Leica Microsystems, Heidelberg, Alemanha), com intervalo de 40µm entre os cortes, e as lâminas histológicas destinadas à morfometria foram coradas com azul de toluidina/borato de sódio 1% (Morais et al., 2014a). As lâminas permanentes confeccionadas foram observadas ao microscópio de luz Motic BA410 (Motic, Causeway Bay, Hong Kong) e microfotogradas para análises e comparações com câmera digital Moticam 5.0 MP (Motic Instruments Inc, Richmond, Canada). As imagens foram analisadas ao software Image-Pro Plus®(Media Cybernetics Inc., Rochville, USA).
2.5. Estereologia testicular
As análises morfométricas foram realizadas de acordo com os protocolos propostos por Morais et al. (2014a). As proporções volumétricas entre túbulos seminíferos e intertúbulo foram estimadas pela contagem de 266 pontos projetados sobre 10 imagens obtidas das preparações histológicas de cada animal, em objetiva de 10x, para quantificar os túbulos seminíferos, intertúbulo, túnica própria, epitélio seminífero e lúmen. Já o volume dos túbulos seminíferos foi estimado a partir do percentual ocupado pelos mesmos no testículo e do volume do parênquima testicular (Vol. Túbulo = peso gonadal líquido x Túbulo %/ 100). O volume do epitélio seminífero foi o produto do percentual do epitélio seminífero com o volume do parênquima testicular, dividido por 100. O peso da túnica albugínea foi estimado a partir da densidade de volume pela contagem de 266 pontos projetados sobre 10 imagens obtidas das preparações histológicas de cada animal, em objetiva de 10x (Vv = No de pontos contados sobre a túnica albugínea / Total de pontos contados x 100). O volume absoluto da albugínea foi resultado do produto da densidade de volume com o volume testicular, levando-se em consideração que a densidade testicular em mamíferos é aproximadamente 1 (Johnson et al., 1981; Sprando et al., 1998; Costa et al., 2011).
divisão do peso dos testículos pelo peso corporal, sendo o valor, multiplicado por 100. O diâmetro dos túbulos seminíferos e altura do epitélio seminífero (mensurada da túnica própria até o lúmen tubular) foram obtidos pela mensuração de 20 secções transversais de túbulos/animal, escolhendo-se os túbulos que apreescolhendo-sentaram contorno o mais circular possível.
O comprimento dos túbulos seminíferos (CT), em metros, foi estimado a partir da fórmula CT = VTS/πR2, onde VTS é o volume dos túbulos seminíferos, πR2 é a área da secção transversal dos túbulos seminíferos, e R é o diâmetro tubular/2. O CT por grama de testículo foi obtido dividindo-se este valor pelo peso gonadal.
2.6. Frequência relativa dos estádios do ciclo do epitélio seminífero
Os estádios que compõem o ciclo do epitélio seminífero (CES) foram descritos utilizando-se o método de morfologia tubular (Berndtson, 1977). A frequência relativa de cada estádio foi descrita pela caracterização e contagem de 50 túbulos por animal em secções transversal de forma randomizada.
2.7. Quantificação da espermatogênese
Quantificou-se a população de cada tipo celular encontrada no estádio 8 do CES, através da contagem dos núcleos das células germinativas e do nucléolo das células de Sertoli. Foram utilizadas 10 secções transversais circulares de túbulos seminíferos por animal para, então, mensurar os diâmetros nucleares de espermatogônias do tipo A (A), espermatócitos primários na transição pré-leptótenos para leptóteno (PL-L), espermatócitos primários em paquíteno (PQ), espermátides arredondadas (Ar) e nucléolos de células de Sertoli (Se) (Russell et al., 1990). As contagens foram corrigidas de acordo com a espessura do corte histológico e o diâmetro nuclear ou nucleolar das células germinativas e células de Sertoli, respectivamente, de acordo com o método de Abercrombie (1946) modificado por Amann & Almquist (1962).
A partir desses dados o índice das células de Sertoli foi obtido com a finalidade de indicar a capacidade de suporte dessas células por total de células germinativas. Esse índice foi determinado através do resultado da razão entre os números corrigidos de células germinativas e o número corrigido de células de Sertoli, utilizando-se a fórmula: (A+PL-L+PQ+Ar) / Se. Os índices mitótico (PL-L / A), meiótico (Ar / PQ) e o rendimento geral da espermatogênese (Ar / A) também foram quantificados.
2.8. Análise da ultraestrutura
glutaraldeído a 2,5%, tamponado com fosfato de sódio a 0,1M, pH 7,4. Após a fixação o material foi lavado três vezes durante 10 minutos cada no mesmo tampão. Em seguida ocorreu a pós-fixação com tetróxido de ósmio tamponado a 2% por duas horas (tamponado em fosfato de sódio 0,1M e a pH 7,4). Os fragmentos foram lavados com solução tampão por três vezes durante dez minutos cada. Após esse procedimento o material foi imerso em acetato de uranila a 3% overnight, lavado com tampão fosfato e desidratado com série crescente de álcool etílico (50-100%) durante 10 minutos em cada.
Após desidratação, os fragmentos foram imersos em óxido de propileno por 10 minutos para garantir total desidratação do tecido. Em seguida o material foi embebido em resina araldite 502 (Polysciences Inc, California, EUA), para a confecção dos blocos. Foram então obtidos cortes semi-finos com ultramicrótomo, os quais foram corados com solução aquosa de azul de toluidina a 1% para a identificação dos locais para a realização de cortes ultrafinos. Cortes de 70nm de espessura foram confeccionados com navalha de diamante e colocados em telas de cobre com 200 mesh para posterior contraste com acetato de uranila saturado a 2%, por sete a dez minutos e o citrato de chumbo a 0,5%, durante o mesmo período. O material foi analisado em Microscópio Eletrônico de Transmissão (Jeol® 100 CX II, Tóquio, Japão).
2.9. Imunohistoquímica para caspase-3
2.10. Densidade de Volume (Vv) das células caspase 3 - positivas
A densidade de volume (Vv) refere-se a fração de volume ocupada pelas células caspase 3-positivas no respectivo espaço referência, ou seja, o testículo. Para a estimativa de Vv foram obtidos 3 campos por animal e aplicado um sistema teste sobre o espaço referência. Foram contados o número total de pontos que tocam as células de interesse (Pint) os quais foram divididos pelo número total de pontos sobre o espaço referência (Pref) (Ladd et al., 2012).
2.11. Análise estatística
Os parâmetros testiculares quantitativos foram expressos em média ± desvio padrão. Estes foram submetidos à análise de variância (ANOVA) e teste de múltiplas comparações de Kruskall-Wallis, seguido do teste de Mann-Whitney com correção de Bonferroni, utilizando-se o software PAST® versão 2.17 (Hammer et al., 2001). Admitiu-se o nível de significância de P<0,05.
3. Resultados
3.1. Estereologia testicular
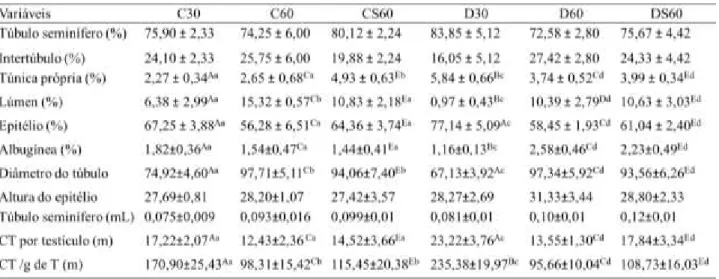
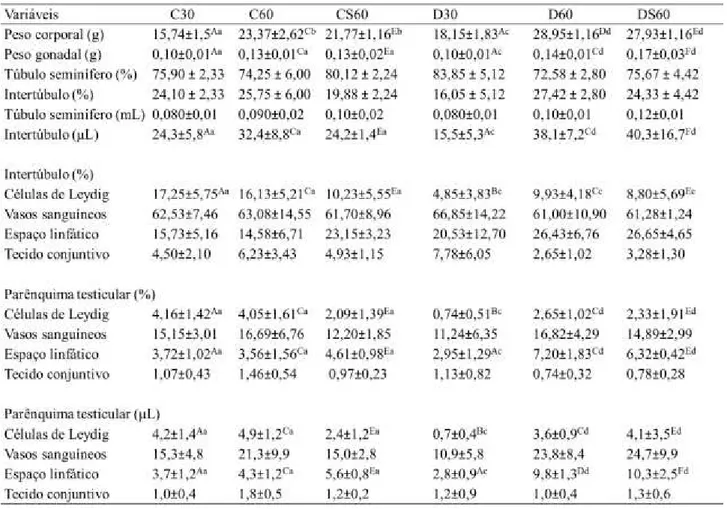
Na tabela 1 observam-se os resultados biométricos dos grupos estudados. O peso corporal dos grupos distróficos pré-púbere (D30) e púbere (D60) se comportaram semelhante ao controle, ou seja, aumentando na puberdade. A suplementação aumentou significativamente o peso corporal e da gônada dos animais distróficos quando comparado CS60, P<0,05. O IGS foi significativamente menor nos animais distróficos pré-púberes quando comparado C30. Já o ITS foi maior nos animais de 30 dias, tanto controle quanto distrófico, quando comparados, respectivamente a C60 e D60. Tabela 1 – Médias da biométrica e índices morfométricos dos testículos de camundongos portadores de Distrofia Muscular de Duchenne, nos diferentes grupos experimentais.
Médias com pares de letras maiúsculas diferentes na mesma linha (A-B; C-D; E-F) comparação entre grupos Controle e Distrófico (P<0,05); Médias com pares de letras minúsculas diferentes na mesma linha (a-b; c-d) comparação entre Controle (C30-C60; C60-CS60) e Distrófico (D30-D60; D60-DS60) (P<0,05). Não foram consideradas as comparações (C30-CS60; C30-D60; C30-DS60; C60-D30; C60-DS60; CS60-D30; CS60-D60; D30-DS60). Teste de Kruskal-Wallis seguido de Mann Whitney com correção de Bonferroni. Dados expressos em média ± D.P. C30: Controle com 30 dias, C60: Controle com 60 dias, CS60: Controle com 60 dias suplementado com ácido ascórbico, D30: Distrófico com 30 dias, D60: Distrófico com 60 dias, DS60: Distrófico com 60 dias suplementado com ácido ascórbico. IGS = índice gonadossomático e ITS = índice tubulossomático.
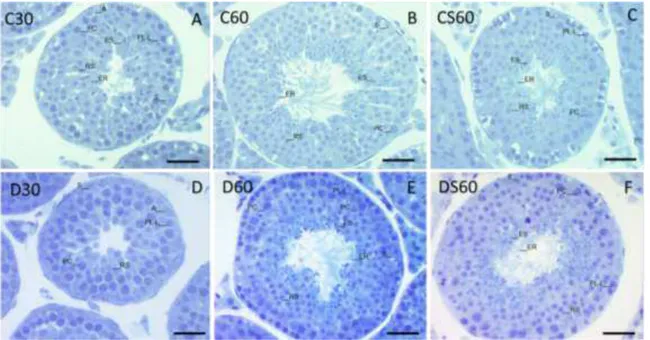
a suplementação elevou significativamente esse parâmetro em CS60 em relação a C60 (Tabela 2). Contudo, o percentual de lúmen foi reduzido pela distrofia tanto no período pré-púbere quanto no púbere quando comparando os animais dos grupos C30 e C60, respectivamente. O diâmetro tubular foi elevado em distróficos D60 em relação a D30, esse comportamento também foi evidente entre os controles C60 e C30. O percentual de epitélio foi significativamente elevado pela distrofia em D30 em relação aos distróficos 60 dias não suplementado. Os distróficos pré-púberes apresentaram redução do percentual da albugínea em relação a C30 e D60.
Tabela 2 – Médias da morfometria do compartimento tubular dos testículos de camundongos portadores de Distrofia Muscular de Duchenne, nos diferentes grupos experimentais.
Médias com pares de letras maiúsculas diferentes na mesma linha (A-B; C-D; E-F) comparação entre grupos Controle e Distrófico (P<0,05); Médias com pares de letras minúsculas diferentes na mesma linha (a-b; c-d) comparação entre Controle (C30-C60; C60-CS60) e Distrófico (D30-D60; D60-DS60) (P<0,05). Não foram consideradas as comparações (C30-CS60; C30-D60; C30-DS60; C60-D30; C60-DS60; CS60-D30; CS60-D60; D30-DS60). Teste de Kruskal-Wallis seguido de Mann Whitney com correção de Bonferroni. Dados expressos em média ± D.P. C30: Controle com 30 dias, C60: Controle com 60 dias, CS60: Controle com 60 dias suplementado com ácido ascórbico, D30: Distrófico com 30 dias, D60: Distrófico com 60 dias, DS60: Distrófico com60 dias suplementado com ácido ascórbico. Proporção volumétrica (%) e volume (mL) dos compartimentos testiculares, diâmetro tubular (µm), altura do epitélio (µm), comprimento tubular por testículo (CT) (m), comprimento tubular por grama de testículo (CT/g de T) (m).
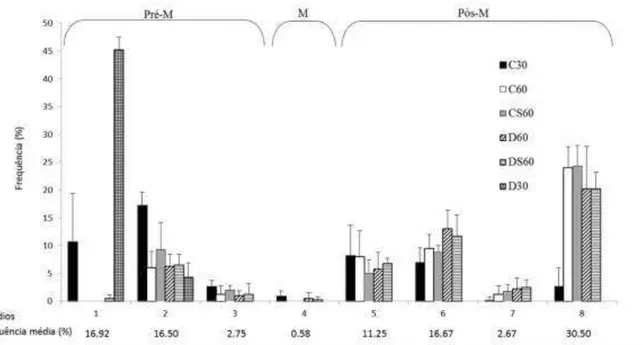
3.2. Frequência dos estádios do ciclo do epitélio seminífero