RUTHNALDO RODRIGUES MELO DE LIMA
CARACTERIZAÇÃO DO NÚCLEO
PRÉ-GENICULADO DO SAGUI (
Callithrix jacchus
):
PROJEÇÃO RETINIANA, NEUROQUÍMICA E
ATIVIDADE CELULAR (Expressão de
FOS
).
Natal-RN 2008
RUTHNALDO RODRIGUES MELO DE LIMA
CARACTERIZAÇÃO DO NÚCLEO
PRÉ-GENICULADO DO SAGUI (
Callithrix jacchus
):
PROJEÇÃO RETINIANA, NEUROQUÍMICA E
ATIVIDADE CELULAR (Expressão de
FOS
).
Dissertação apresentada à Universidade Federal do Rio Grande do Norte, para obtenção do título de Mestre em Psicobiologia.
Orientador: Jeferson de Souza Cavalcante
Título
CARACTERIZAÇÃO DO NÚCLEO PRÉ-GENICULADO DO SAGUI
(
Callithrix jacchus
): PROJEÇÃO RETINIANA, NEUROQUÍMICA E
ATIVIDADE CELULAR (Expressão de
FOS
).
Autor
RUTHNALDO RODRIGUES MELO DE LIMA
Data da Defesa
30 / 04 / 2008
Banca Examinadora
______________________________________________________
Profª Raquel Simoni Pires
Universidade Cidade de São Paulo, UNICID
______________________________________________________
Profª Miriam Stela Maris de Oliveira Costa
Universidade Federal do Rio Grande do Norte, RN
______________________________________________________
Profº Jeferson de Souza Cavalcante
AGRADECIMENTOS
“Aos meus pais, por toda dedicação e transposição dos seus sonhos nas minhas realizações”.
“Aos irmãos e demais familiares, pelo apoio e incentivo aos meus objetivos”. “A todos aqueles que um dia foram meus professores. Em especial ao Prof° Jeferson de
Souza Cavalcante e a Profª Miriam Stela Maris de Oliveira Costa, por me proporcionarem toda a inspiração e transpiração de que necessita um cientista”. “A todos os amigos cientistas. Em especial aos que colaboraram para realização desse
projeto (Equipe do LabNeuro-UFRN, Profª Carolina Virgínia, Cristiane, Aline e Gutemberg) e aos contemporâneos da turma de Psicobiologia de 2006, pelo feedback
positivo proporcionado na partilha do conhecimento”.
“Aos meus amigos. Em especial a Marcos Daniel e Rilton, pelo companheirismo nos bons e maus momentos da minha vida”.
“A João Carlos Galvão e família, a Fernando Varela e família e a Renato Torres e família, pelos bons princípios e pelo generoso acolhimento”.
“Aos compadres e comadres Harold e Andressa e João Guilherme e Larissa, pela amizade e consideração”.
“Aos concunhados, pela amizade e disponibilidade”.
“Aos músicos do Processo Uncinado e do Os Etílicos, pelas novidades e experiências proporcionadas”.
“Aos funcionários dos Departamentos de Morfologia, Fisiologia e do Núcleo de Primatologia da UFRN, por proporcionarem um ambiente saudável de trabalho”.
“Aos meus ex-alunos de Anatomia, por me ensinarem a ensinar”.
“Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq), pelo apoio a pesquisa”.
“Um homem é um sucesso quando pula da cama de manhã e
vai dormir à noite e, nesse meio tempo, só faz o que gosta”.
(Bod Dylan)
“Algo só é impossível até que alguém duvida e resolve provar
LISTA DE TABELAS E FIGURAS
TABELA 1 – Discriminação dos reagentes utilizados na imunohistoquímica.
FIG. 1 – Esquemas de secções coronais através do complexo geniculado lateral do tálamo (Macaca mullata).
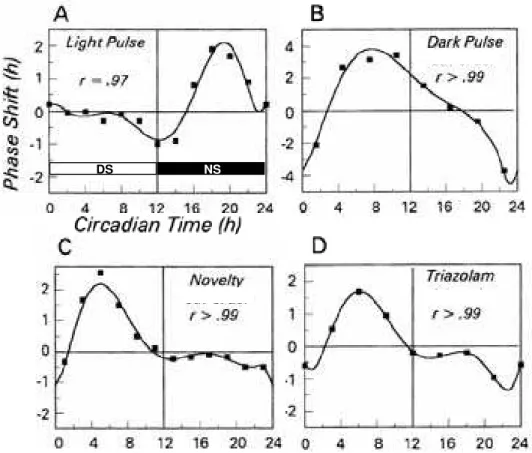
FIG. 2 – Curvas de resposta de fase para estímulos fóticos e não-fóticos. FIG. 3 – Desenho experimental da aplicação dos pulsos de escuro. FIG. 4 – Citoarquitetura do núcleo pré-geniculado (técnica de Nissl).
FIG. 5 – Citoarquitetura do núcleo pré-geniculado (Imunohistoquímica contra NeuN). FIG. 6 (A, B e C) – Citoarquitetura do núcleo pré-geniculado e relações anatômicas (NeuN). FIG. 7 – Morfologia celular do núcleo pré-geniculado (Nissl x NeuN)
FIG. 8 – Projeções retinianas ao núcleo pré-geniculado (subunidade B da toxina colérica). FIG. 9 – Imunorreatividade contra NPY no núcleo pré-geniculado.
FIG. 10 – Imunorreatividade contra ENK no núcleo pré-geniculado. FIG. 11 – Imunorreatividade contra GAD no núcleo pré-geniculado. FIG. 12 – Imunorreatividade contra 5-HT no núcleo pré-geniculado. FIG. 13 – Imunorreatividade contra SP no núcleo pré-geniculado. FIG. 14 – Imunorreatividade contra PV no núcleo pré-geniculado. FIG. 15 – Imunorreatividade contra CR no núcleo pré-geniculado. FIG. 16 – Imunorreatividade contra CB no núcleo pré-geniculado. FIG. 17 – Imunorreatividade contra GFAP no núcleo pré-geniculado.
FIG. 18 – Imunorreatividade contra FOS no núcleo pré-geniculado (Experimental x Controle). FIG. 19 – Imunorreatividade contra FOS no núcleo pré-geniculado (Experimental x Controle). FIG. 20 – Gráfico: N° de células FOS-positivas (Experimental x Controle).
FIG. 21 – Gráfico: N° de células FOS-positivas (NPGli x NPGle / Experimental x Controle). FIG. 22 – Anatomia do complexo geniculado lateral de primatas (proposta)
FIG. 24 – Actograma: Registro de atividade locomotora diária: antes, durante e pós-pulso. FIG. 25 – Gráfico: Registro de atividade locomotora por hora circadiana.
FIG. 26 – Gráfico: Registro de atividade locomotora nas horas circadianas 3 e 4, com e sem estímulo.
FIG. 27 – Gráfico: Registro de atividade locomotora nas horas circadianas 12 e 17, com e sem estímulo.
LISTA DE ABREVIATURAS
5-HT = Serotonina
τ
= Período endógenoABC = Protocolo avidina-biotina complexo peroxidase APP = polipeptídeo pancreático das aves
AvF = Avanço de fase AtF = Atraso de fase CB = Calbindina CC = Claro constante CP = Pedúnculo cerebral CR = Calretinina
CRF = Curva de resposta dependente de fase CTb = Subunidade B da toxina colérica Dors = Dorsal
DS = Dia subjetivo ENK = Encefalina
FIG = Folheto intergeniculado FT = Fator transcricional
FTC = Fator transcricional constitutivo FTI = Fator transcricional induzido GABA = Ácido gama-aminobutírico GAD = Descarboxilase do ácido glutâmico GFAP = Proteína acídica fibrilar glial
GLD / LGN= Núcleo geniculado lateral dorsal GLV = Núcleo geniculado lateral ventral GLU = Glutamato
HC = Hora circadiana IC = Cápsula interna
IEGs = Genes de expressão imediata Lat = Lateral
MF = Mudança de fase
NAAG = N-acetil-aspartil glutamato
NeuN = Proteína neuronal nuclear específica NPG = Núcleo pré-geniculado do tálamo
NPGle / PGNol = Lâmina externa do núcleo pré-geniculado NPGli / PGNil = Lâmina interna do núcleo pré-geniculado NPY = Neuropeptídeo-Y
NS = Noite subjetiva
NSQ = Núcleo supraquiasmático NT = Neurotensina
OR = Radiação óptica OT = Tracto óptico
PACAP = Polipeptídio ativador de adenilatociclase pituitária Pp = Núcleo peripeduncular
PV = Parvalbumina
PVT = Núcleo paraventricular
RT / RN = Núcleo reticular do tálamo SP = Substância P
STC = Sistema de temporização circadiana Stl = Núcleo subtalâmico
TGH = Tracto geniculo-hipotalãmico TRH = Tracto retino-hipotalâmico Ventr = Ventral
VIP = Peptídeo intestinal vasoativo VP = Vasopressina
VPI = Núcleo ventral póstero-inferior do tálamo ZI = Zona incerta
SUMÁRIO: Pág.
RESUMO 13
ABSTRACT 15
1. INTRODUÇAO 16
1.1 - A Natureza Rítmica e o Surgimento da Cronobiologia 16 1.2 – Bases Neurais dos Ritmos Biológicos 18 1.2.1 – O Núcleo Supraquiasmático 18
1.2.2 – O Folheto Intergeniculado 22
1.2.3 – O Núcleo Pré-geniculado 25
1.3 – Estímulos Fóticos e Não-fóticos 28 1.4 – Marcando a Atividade Celular 30 1.5 – Genes de Expressão Imediata e o Sistema de Temporização Circadiana 31 1.6 – Estudos Eletrofisiológicos 32
2. JUSTIFICATIVA 34
3. OBJETIVOS 35
4. MATERIAL E MÉTODOS 36
4.1 – Animais 36
4.2 – Viveiros e Gaiolas 36
4.3 – Alimentação 37
4.4 – Projeção Retiniana e Neuroquímica 37 4.5 – Processamento do tecido 38
4.5.1 – Perfusão e Microtomia 38
4.5.2 –Imunohistoquímica 39
4.5.2.1 – Imunoperoxidase simples 39
4.5.3 – Técnica de Nissl (Tionina) 41
4.7 – Expressão de proteína FOS 42
4.7.1 – Grupo Experimental 42
4.7.2 –Grupo Controle 46
4.7.3 –Curva de Resposta Dependente de Fase (CRF) 46
4.7.4 – Registro de Atividade Locomotora 46
5. RESULTADOS 48
5.1 – O Núcleo Pré-geniculado 48 5.1.1 –Citoarquitetura (Nissl e NeuN) 48
Imunoreatividade contra NPY 49
Imunoreatividade contra ENK 49
Imunoreatividade contra GAD 49
Imunoreatividade contra 5-HT 49
Imunoreatividade contra SP 50
5.1.4 –Proteínas Ligantes de Cálcio 50
Imunoreatividade contra PV 50
Imunoreatividade contra CR 50
Imunoreatividade contra CB 50
5.1.5 –Glia 51
Imunorreatividade contra GFAP 51
5.1.6 –Atividade Celular 51
Imunorreatividade contra FOS 51
5.2 – Atividade Locomotora 51
5.3 – Curva de Resposta de Fase 52
FIGURAS 53
FIG. 23 – Gráfico: Registro de atividade locomotora diária 72 FIG. 24 – Actograma: Registro de atividade locomotora diária 72 FIG. 25 – Gráfico: Registro de atividade locomotora por hora circadiana 73 FIG. 26 – Gráfico: Registro de atividade locomotora (HC 3 e 4) 74 FIG. 27 – Gráfico: Registro de atividade locomotora (HC 12 e 17) 75 FIG. 28 – Curva de resposta dependente de fase 76
6. DISCUSSÃO 77
6.1 – Citoarquitetura do Núcleo Pré-geniculado 77
6.2 – Projeção Retiniana 80
6.3 – Neuroquímica 81
6.4 – Expressão de FOS 85
6.5 – Atividade Locomotora 86
6.7 – Curva de Resposta de Fase 87
7. CONCLUSÕES 89
RESUMO
O sistema de temporização circadiana (STC) é responsável pela geração e modulação dos ritmos circadianos que são oscilações endógenas manifestadas pelos seres vivos para a maioria das funções e comportamentos, com período em torno de 24 horas. Estes ritmos são sincronizados principalmente ao ciclo claro-escuro diário. O STC é constituído por um conjunto de estruturas neurais interligadas, incluindo na sua composição um marca-passo encarregado da geração do ritmo, vias sincronizadoras e de saída aos efetores comportamentais.
O núcleo supraquiasmático do hipotálamo (NSQ) é tido como principal marca-passo circadiano. A lesão desse conjunto de células deixa o animal arrítmico para algumas funções circadianas. A principal via direta de sincronização é o tracto retino-hipotalâmico (TRH), que leva informação fótica ambiental da retina ao NSQ. Uma segunda via, tida como de sincronização indireta para o NSQ, é o tracto genículo-hipotalâmico (TGH), que se origina das células produtoras de neuropeptídeo Y (NPY) do folheto intergeniculado (FIG) do complexo geniculado lateral do tálamo de roedores. Essas células também recebem projeção direta da retina. Em primatas essa estrutura ainda não foi identificada. No entanto, um conjunto de células medial ao núcleo geniculado lateral dorsal (GLD) do tálamo, denominado de núcleo pré-geniculado (NPG), se apresenta como possível estrutura homóloga ao FIG dos roedores, já que algumas células do NPG apresentam imunorreatividade ao anticorpo contra NPY em diversos primatas estudados.
experimental um primata do novo mundo, o Callitrhix jacchus, conhecido popularmente como sagüi.
Nossos dados confirmaram a hipótese inicial de que o NPG, ou parte dele, seria homólogo ao FIG de roedores. Encontramos, em toda extensão do NPG do sagüi, neurônios imunorreativos a NPY e uma densa projeção retiniana em uma região localizada mais próxima ao GLD. Concluímos que esta área situada mais internamente, em relação ao complexo geniculado lateral do tálamo, corresponde ao FIG e a porção mais externa ao núcleo geniculado lateral ventral dos roedores.
ABSTRACT
In rodents, the suprachiasmatic nucleus (SCN) and the intergeniculate leaflet (IGL) are the main components of the circadian system. The SCN is considerate the site of an endogenous biological clock because can to generate rhythm and to synchronize to the environmental cues (zeitgebers) and IGL has been related as one of the main areas that modulate the action of SCN. Both receive projections of ganglion cells of retina and this projection to SCN is called retinohypothalamic tract (RHT). Moreover, the IGL is connected with SCN through of geniculohypothalamic tract (GHT). In primates (include humans) was not still demonstrated the presence of a homologous structure to the IGL. It is believed that the pregeniculate nucleus (PGN) can be the answer, but nothing it was still proven. Trying to answer that question, the objective of our study is to do a comparative analysis among PGN and IGL through of techniques immunohystochemicals, neural tracers and FOS expression after dark pulses. For this, we used as experimental model a primate of the new world, the common marmoset (Callithrix jacchus). Ours results may contribute to the elucidation of this lacuna in the circadian system once that the IGL is responsible for the transmission of nonphotic information to SCN and participate in the integration between photic and nonphotic stimulus to adjust the function of the SCN. In this way to find a same structure in primates represent an important achieve in the understanding of the biological rhythms in those animals.
1. INTRODUÇÃO.
1.1 – A Natureza Rítmica e o Surgimento da Cronobiologia.
O fenômeno de rotação da terra durante seu curso de translação ao redor do sol fornece um estímulo de periodicidade regular que, durante o processo evolutivo, certamente causou uma enorme pressão seletiva sobre os organismos vivos e serviu de base adaptativa para o que hoje chamamos de ritmos circadianos. O ciclo claro-escuro diário parece ser o principal agente sincronizador desses ritmos e apresenta duração de aproximadamente 24 horas, com cada uma de suas fases consumindo, de forma contínua, metade deste tempo. Entretanto, quando levamos em consideração regiões de altas latitudes ou determinadas épocas do ano, maiores discrepâncias entre a duração de cada fase podem ser evidenciadas e, da mesma maneira, diferenças na organização temporal do seres vivos. O primeiro relato formal demonstrando a relação do ciclo claro-escuro com um evento comportamental data de 1729, momento em que um astrônomo francês, Jean-Jacques D'Ortous de Mairan, descreveu um movimento cíclico de abertura e fechamento das folhas da planta Mimosa pudica. Ele ainda notou que mesmo após a privação da planta ao ciclo claro-escuro ambiental tal fenômeno continuava a ocorrer normalmente, ou seja, provavelmente possuía um caráter endógeno. Esse experimento trouxe um novo paradigma à biologia da época, já que a idéia de ritmos biológicos eram nada menos que reflexos das flutuações ambientais. Hoje, sabemos que a organização temporal de um ser vivo se expressa tanto pela reação aos estímulos ambientais quanto pela ritmicidade endógena (Moore, 1999; Rotenberg et al. 2003).
Embora existam ritmos biológicos sem correlação com o ciclo claro-escuro ambiental, percebemos que este último tem uma enorme influência em diversos desses fenômenos fisiológicos. Em mamíferos, o ciclo sono-vigília, a temperatura corporal central e a secreção de hormônios são os mais claros exemplos dessa organização rítmica. Assim, podemos dizer que os ritmos circadianos estão normalmente sincronizados ao ciclo claro-escuro diário e que a relação mantida entre ambos é de fase estável. Vale salientar que são considerados ritmos circadianos oscilações endógenas dentro de uma faixa limite, situada entre 20 e 28 horas. Caso a periodicidade do Zeitgeber se encontre fora desse limite de sensibilidade o ritmo endógeno não conseguirá sincronizar ao agente externo e entrará em livre curso, situação em que o indivíduo expressa seu ritmo endógeno (Moore, 1999; Rotenberg et al. 2003).
progressivamente o sistema nervoso e verificando o efeito das lesões nos ritmos biológicos, também apontavam para o mesmo caminho. Com a predição de que o principal agente sincronizador é o ciclo claro-escuro, Moore e Lenn (1972) começaram a buscar o “relógio biológico” pelos olhos e identificaram uma projeção das células retinianas a um pequeno par de núcleos no assoalho do hipotálamo, tal projeção foi denominada de tracto retino-hipotalâmico (TRH). Essas estruturas estavam situadas lateralmente ao terceiro ventrículo e logo acima do quiasma óptico e foram, portanto, identificadas como núcleos supraquiasmáticos (NSQs). Posteriormente, demonstrou-se que a lesão dos NSQs de ratos abolia os ritmos circadianos de atividade, ingestão de água e liberação de corticosterona (Moore e Eischler, 1972; Stephan e Zucker, 1972).
Outros estudos subseqüentes vieram a consolidar o NSQ como responsável pela geração dos ritmos biológicos e a ampliar o modelo de controle desses ritmos inferindo uma participação integrada de diversas regiões do sistema nervoso, ficando conhecido como “sistema de temporização circadiana”. Hoje, sabe-se que esse sistema consiste de um conjunto de estruturas neurais interligadas, incluindo na sua composição um marca-passo encarregado da geração do ritmo, vias sincronizadoras e vias de saídas aos efetores comportamentais (Moore-Ede et al. 1982; Moore e Card, 1994b; Moore, 1999).
Em suma: (1) as principais características dos ritmos biológicos são sua geração endógena, capacidade de sincronização a um ciclo ambiental e compensação às variações de temperatura; (2) O estudo desses ritmos é o campo de interesse da Cronobiologia; (3) e, em mamíferos, a expressão de comportamentos rítmicos estão sob o comando de um conjunto de estruturas neurais integradas, as quais compõem o sistema de temporização circadiana.
1.2 – Bases Neurais dos Ritmos Biológicos
1.2.1 – O Núcleo Supraquiasmático
bastante variadas, com predominância contralateral ou ipsilateral ou ainda de forma simétrica, dependendo da espécie em questão (Hendrickson et al. 1972). Também, na maior parte dos indivíduos estudados, foi vista uma distribuição destas fibras concentradas na porção ventrolateral do núcleo. Este conjunto de fibras ficou conhecido como tracto retino-hipotalâmico (TRH) (Hendrickson et al. 1972; Moore e Lenn, 1972). Trabalhos realizados em primatas também confirmam essas projeções (Magnin et al. 1989; Costa et al. 1999; Cavalcante et al. 2002). O TRH constitui a principal via de sincronização ao ciclo claro-escuro ambiental e sozinho pode manter o animal sincronizado (Klein e Moore, 1979). A lesão dessas fibras priva o NSQ de tal informação e leva o animal a entrar em livre-curso (Johnson et al. 1988a). Demonstrou-se que o TRH é formado por projeções axonais de um grupo especial de células fotorreceptoras retinianas, as células ganglionares (Berson et al. 2002), e que algumas continham um fotopigmento identificado como melanopsina (Provencio et al. 1998; 2000; Gooley et al. 2001; Hattar et al. 2002). Esse grupo especial de células parece contribuir massivamente no número total das eferências retinianas aos principais centros do sistema circadiano, como o NSQ, o folheto intergeniculado (FIG) e a zona subparaventricular (ZSPV) (Morin et al. 2003; Gooley e Saper, 2003). Também, não se descarta a possibilidade dos fotorreceptores clássicos participarem da fotorrecepção circadiana.
Sabe-se que o glutamato (GLU) é o principal neurotransmissor envolvido na ação das células ganglionares do TRH que se projetam para o NSQ e FIG (Ebling, 1996). Outras substâncias foram igualmente identificadas e parecem ser de suma importância no controle da atividade do marca-passo circadiano, sendo estes, o n-acetilaspartil glutamato (NAAG) (Moffet et al. 1990), a substância P (SP) (Takatsuji et al. 1991a) e o polipeptídio ativador da adenilatociclase pituitária (PACAP) (Hannibal et al. 1997; Piggins et al. 2001a).
trabalho importante veio a consolidar o NSQ como o principal oscilador circadiano, em que o transplante do NSQ fetal recuperava a ritmicidade circadiana para uma série de funções de animais arrítmicos em conseqüência da lesão bilateral dos seus NSQ (Drucker-Colin et al. 1984).
Embora apresente variações morfológicas, o NSQ de todos os mamíferos pesquisados, até o momento, se apresenta como um grupo de células localizado dorsalmente ao quiasma óptico e lateralmente ao terceiro ventrículo, separado da parede do mesmo apenas por uma faixa de células que constitui o núcleo periventricular (Moore-Ede et al. 1982; Cassone et al. 1988).
O NSQ tem sido bastante estudado no que diz respeito a sua caracterização citoarquitetônica e citoquímica, no qual identificamos duas principais sub-populações de neurônios. Nos mamíferos, de uma forma geral, encontramos a primeira população neuronal localizada na região dorsomedial do núcleo, sendo caracterizada por produzir vasopressina (VP) e a segunda localizada na porção ventrolateral do núcleo, produtora de polipeptídeo intestinal vasoativo (VIP) (Card et al. 1981; Card e Moore, 1984; Cassone et al. 1988).
No NSQ de hamsters (Card e Moore, 1984; Morin e Blanchard; 1995) e ratos (Moore et al. 2002; Morin et al. 2006) terminais imunoreativos a NPY foram encontrados somente na porção ventrolateral do núcleo (região retinorecipiente). O mesmo resultado foi obtido em sagüis (Costa et al. 1999; Cavalcante et al. 2002). Nessas espécies de roedores, a presença de NPY parece ser, em quase sua totalidade, proveniente dos neurônios do FIG, visto que a lesão do FIG provoca uma drástica redução desse neurotransmissor em seus NSQ (Harrington et al. 1985; Morin e Blanchard, 2001).
demonstrado em estudos de lesão (Smale et al. 1990; Meyer-Bernstein e Morin, 1998) ou de estimulação elétrica (Meyer-Bernstein e Morin, 1999).
Além do FIG e da rafe mesencefálica, o controle da atividade do NSQ está sob influência de uma vasta rede neural proveniente de várias regiões do sistema nervoso, sendo essa diversidade observada tanto do ponto de vista da localização quanto da função da região que fornece a aferência. Estudos realizados em diversas espécies de roedores, desde o início da década de 80, utilizando técnicas de traçadores neurais, tem mostrado essas múltiplas aferências ao NSQ, entre elas podemos destacar: córtex infralímbico, núcleos septais, subastância innominata, subículo ventral, órgão subfornical, hipotálamo ventromedial, núcleo arqueado, hipotálamo posterior, núcleos pré-tectais, lócus ceruleus, núcleo parabraquial, zona incerta, núcleo paraventricular do tálamo, entre outros. Essas conexões descritas acima representam aferências diretas ao NSQ, sendo conhecidas como projeções monossinápticas e, como estas, encontram-se catalogadas inúmeras outras regiões. Experimentos utilizando traçadores virais identificaram aferências de segunda e terceira ordens ao NSQ, conhecidas como projeções polissinápticas, como por exemplo: regiões do córtex cerebral, hipocampo, amígdala, sistema olfativo, diversas regiões do tálamo e hipotálamo, tronco encefálico (núcleos oculomotores e vestibulares) e medula espinal (Pickard, 1982; Bina et al. 1993; Mikkelsen e Vrang, 1994; Moga e Moore, 1997; Pickard et al. 2002; Krout et al. 2002).
o marca-passo circadiano, como foi apresentado, está sob influência de sinais fóticos, neuroendócrinos, autonômicos e comportamentais.
1.2.2 – O Folheto Intergeniculado
Na medida em que o NSQ se firmava como principal marca-passo circadiano, um estudo realizado em por Swanson et al. (1974), em gatos e ratos, e outro por Ribak e Peters (1975), em ratos, mostraram que a injeção de aminoácidos marcados no corpo geniculado lateral ventral (GLV) revelava uma projeção bilateral, com predominância ipsilateral, para o NSQ e que esta projeção era restrita a região ventrolateral. Hickey e Spear (1976), baseado na diferença das projeções retinianas para o complexo geniculado lateral do tálamo, observaram uma estrutura localizada entre o núcleo geniculado lateral dorsal (GLD) e o GLV. Assim, denominaram-na de folheto intergeniculado (FIG), devido sua forma fina e alongada e por localizar-se entre os núcleos geniculados laterais. Quase uma década mais tarde, Pickard (1985), mostrou que essas projeções retinianas ao FIG são provenientes das mesmas células ganglionares que se projetam para o NSQ, devido à bifurcação de seus axônios. Card e Moore (1982) identificaram a presença de terminais imunorreativos ao polipeptídeo pancreático das aves (APP) na região ventrolateral do NSQ e de neurônios marcados na borda dorsal do GLV. A lesão do GLV levava a uma diminuição da imunorreatividade a APP no NSQ, então, eles concluíram tratar-se de uma nova projeção ao marca-passo circadiano. Moore et al. (1984), encontraram resultados semelhantes para neuropeptídeo-Y (NPY). Foi denominado de tracto geniculo-hipotalâmico (TGH) a projeção do FIG ao NSQ, entretanto, sua confirmação somente foi possível a partir de estudos com traçadores neurais. A injeção de um traçador retrógrado no NSQ e uma técnica de dupla marcação imunohistoquímica para NPY e o respectivo traçador revelaram que alguns neurônios NPY-positivos do FIG projetam-se para o NSQ (Harrington et al. 1987; Goel et al. 1999; Moore e Card, 1994b).
2006). Em hamsters, ainda pode ser identificado um terceiro tipo de neurônio imunorreativo a neurotensina (NT) que apresenta uma alta co-localização com NPY (Morin e Blanchard, 2001). Nesses animais o TGH possui contribuição das células produtoras de GABA e ENK (Morin e Blanchard, 1995). Sem dúvida, uma das principais características desse folheto é a presença dessa população de neurônios imunorreativos a anticorpos contra NPY e que se projetam para o NSQ, num padrão que se superpõe à distribuição de fibras do TRH (Mantyh e Kemp, 1983).
Também pode ser encontrado imunorreatividade contra proteínas ligantes de cálcio no FIG de roedores. Em diversos trabalhos com essas espécies, tem se mostrado neurônios imunorreativos à calbindina (CB) e calretinina (CR) e uma ausência de reação positiva para parvabumina (PV) (Célio, 1990; Arai et al. 1993; Moore e Card, 1994a).
do nervo oculomotor e troclear, o núcleo de Edinger-Westphal, núcleos tegmentar lateral dorsal, cuneiforme caudal e pedúnculo-pontino (complexo oculomotor), os núcleos terminais lateral e dorsal (sistema óptico acessório), locus coeruleus (mecanismo do sono), núcleo intersticial do fascículo longitudinal medial, oliva inferior e núcleo dorsal da rafe (modulação dos ritmos circadianos) (Horowitz et al. 2004). Esses resultados descritos acima comprovam a complexidade funcional em que está envolvido o FIG, todavia, suas conexões indicam que o mesmo preferencialmente participa da regulação do ciclo sono-vigília, do controle visuomotor e da ritmicidade biológica (Harrington, 1997; Morin e Blanchard, 2005).
bilateral do FIG desses roedores uma drástica diminuição de sua atividade locomotora, uma inibição ou redução das mudanças de fase provocadas por estímulos não-fóticos (administração de triazolam, roda de atividade, entre outros) (Janik e Mrosovsky, 1994) e um aumento do período em livre-curso nas condições de escuro constante (Pickard, 1994). A hipótese do papel não-fótico do FIG é apoiada ainda pelas respostas obtidas a partir de estudos de sua própria estimulação elétrica (Rusak et al. 1989), bem como de injeções de NPY dentro do NSQ. Ambos os estímulos promovem mudanças de fase nos ritmos circadianos, no entanto, essas mudanças são diferentes daquelas promovidas pela luz. As CRF para esses estímulos se assemelham a uma CRF não-fótica. Em resumo, a ativação do sistema FIG-TGH resulta em mudanças de fase que são diferentes das provocadas pela luz, e incluem avanço de fase durante o dia subjetivo e atraso durante a noite subjetiva. Isto parece ser um mecanismo de “feedback” que regula a função do marca-passo e parece estar associado com o aumento de atividade locomotora durante o estímulo (Moore, 1992; 1999), embora alguns trabalhos mostrem que nem todos os estímulos não-fóticos mediados pelo FIG estão associados a incremento de atividade locomotora (Biello et al. 1991; 1993).
Moore e Card (1994a) sugerem que o FIG, através da projeção de suas células produtoras de NPY para o NSQ pelo TGH, integra as informações fóticas com as não-fóticas necessárias para modificar a função do marca-passo. Já os estudos de atividade celular, mapeando a expressão da proteína do gene c-fos, mostram que o FIG responde tanto a estímulos fóticos quanto não-fóticos, mas quando se verifica a neuroquímica das células envolvidas torna-se claramente evidente a participação dos neurônios imunorreativos a NPY nos eventos não-fóticos em detrimento dos fóticos (Janik et al. 1995).
1.2.3 – O Núcleo Pré-geniculado
outra situada numa região dorsomedial ao mesmo, a qual continua-se com a zona incerta medialmente (Moore, 1993).
Em relação a sua citoarquitetura, três tipos neuronais tem sido descritos empregando-se a técnica de Nissl. O primeiro tipo se caracteriza por apresentar pericário fusiforme com citoplasma escasso e pouco marcado; o segundo possui um corpo bem desenvolvido repleto de grânulos de Nissl, o que torna seu citoplasma intensamente marcado; o terceiro tipo apresenta pericário de tamanho médio com poucos grânulos de Nissl e encontra-se espalhado entre os neurônios fusiformes. O primeiro e o terceiro tipos de neurônios estão localizados na região mais interna do NPG e o segundo tipo na porção mais externa (Polyak, 1957). Um estudo realizado por Babb (1980), em Macaca mulatta, empregando as técnicas de impregnação de Klüver-Barrera e de Golgi, também identificou 3 populações neuronais distintas. Para isso, os critérios utilizados foram: a forma e o tamanho do pericário, a configuração dendrítica, o tipo de protrusão e a impregnação do axônio. Analisando tais características, ele propôs que o NPG possuía uma estrutura bilaminar, com uma lâmina interna (NPGli) e outra externa (NPGle) (Fig.1). O primeiro tipo de neurônio foi identificado ocupando a lâmina interna, caracterizando-se por apresentar pericário esférico (12-14 μm) com dendritos exibindo longas espinhas ou protrusões. O segundo tipo foi observado somente na lâmina externa, mostrando pericário poligonal (26-37 μm) e com poucas espinhas dendríticas. O terceiro tipo foi localizado ocupando ambas as lâminas, possuindo esses neurônios um pericário ovóide (19-40 μm) com dendritos curtos e largos e espinhas usualmente presentes.
ligantes de cálcio (PV e CB), fornecendo indícios dessa estrutura ser homóloga ao FIG e GLV dos roedores (Costa et al. 1998). Chevassus-au-Louis e Cooper (1998) discutem a evolução do FIG em roedores ao NPG dos primatas. Esses autores acreditam que o aumento do volume do GLD concomitante com a expansão do pedúnculo cerebral definiram as modificações observadas no complexo geniculado lateral dos primatas em comparação aos roedores. Muitos aspectos anatomofuncionais do NPG ainda não foram descritos, como sua conectividade (traçadores neurais), efeito comportamental após lesão e a atividade celular (genes de expressão imediata), por exemplo. Esses experimentos são indispensáveis para definir o papel do NPG dentro do STC.
1.3 – Estímulos Fóticos e Não-fóticos.
Os estímulos ambientais sejam eles fóticos ou não-fóticos atuam direta ou indiretamente sobre o oscilador circadiano modificando sua atividade e, assim, podem ajustar os ritmos biológicos do indivíduo à dinâmica do ecossistema no qual está inserido (Janik et al. 1995; Mikkelsen et al. 1998).
Experimentalmente, podemos manipular diversas características do ciclo claro-escuro como intensidade luminosa, duração das fases, manter em condições constantes, entre outras. Essas manipulações são utilizadas para compreender algumas propriedades dos ritmos biológicos, bem como seu efeito em diversos ritmos dos animais. Uma técnica muito comum é a aplicação de pulsos de curta duração (15 a 60 min), de luz ou de escuro, em animais previamente deixados sob condições constantes (seguro de que estão expressando seu ritmo endógeno), e a observação do que ocorre com o ciclo de atividade-repouso nos dias subseqüentes. Para os pulsos de luz os animais são mantidos em escuro constante, sendo o inverso para os pulsos de escuro. Estes pulsos podem agir modificando a fase de um determinado ritmo do animal, caso ele o inicie mais cedo que o previsto dizemos que ocorreu avanço de fase (AvF) e do outro modo chamamos de atraso de fase (AtF). Esse efeito observado depende da fase circadiana nas quais os pulsos são aplicados e pode ser representado graficamente, tal representação é conhecida como curva de resposta dependente de fase (CRF). A CRF para luz (Fig. 2A) é caracterizada por AtF no inicio da noite subjetiva e AvF a partir do meio da noite subjetiva e uma relativa insensibilidade durante o dia subjetivo. (Daan e Pittendrigh, 1976; Takahashi, 1984). A CRF para escuro (Fig. 2B) é caracterizada por AvF no início da noite subjetiva e AtF no final da noite subjetiva. Essa curva foi originalmente interpretada como sendo a imagem especular da CRF para luz. Entretanto, durante o meio do dia subjetivo verificam-se significativos avanços de fase (Boulos e Rusak, 1982a; 1982b; Ellis et al. 1982; Dwyer e Rosenwasser, 2000; 2002).
ser de claro ou escuro constante) efetivamente reflete uma resposta oposta à CRF para luz e não a obtida com os pulsos de escuro.
Evidentemente, não há o que se debater quanto à luz ser um estímulo fótico, por outro lado, o escuro parece apresentar características mistas, pois sua CRF pode ser obtida pela soma da equação polinomial da CRF não-fótica com o inverso da equação polinomial da CRF para luz. Em estudos feitos com roedores, esses autores sugerem que o pulso de escuro atue por um mecanismo fótico quando aplicado no início da noite subjetiva, onde não há incremento de atividade locomotora, e por um mecanismo não-fótico durante o dia subjetivo e no final da noite subjetiva, onde é possível verificar o aumento dessa atividade (Rosenwasser e Dwyer, 2001). Janik e Mrosovsky (1994), mostraram que a lesão bilateral do folheto intergeniculado do tálamo reduz a atividade locomotora e bloqueia as mudanças de fase provocadas por pulsos de escuro e outros estímulos devidamente caracterizados como não-fóticos. Particularmente, comparando as respostas comportamentais de estímulos não-fóticos com as de pulso de escuro, acreditamos que o último se trata de um evento não-fótico.
DS NS
Vale salientar que todos os resultados supracitados foram realizados em animais de hábitos noturnos. Estudos recentes em mamíferos diurnos revelam que há um alto grau de conservação filogenética das respostas aos estímulos ambientais. As CRF, em última análise, parecem seguir um padrão semelhante entre animais diurnos e noturnos (Lee e Labyak, 1997; Hut et al. 1999; Glass et al. 2001). Em princípio, duas estratégias temporais podem estar envolvidas, quer seja pela alteração da relação de fase entre os ciclos ambientais e o relógio circadiano ou deste último com os ciclos de atividades comportamentais (Rosenwasser e Dwyer, 2001). Pormenorizando, isso significa dizer que um mesmo tipo de estímulo pode ter significado diametralmente oposto entre as diferentes espécies e, sobretudo, fundamentado em especificidades de seus mecanismos fisiológicos.
1.4 – Marcando a Atividade Celular.
Muito já se sabe sobre as funções dos FT no sistema nervoso, entre elas podemos citar: memória (Bourtchuladze et al. 1994), apoptose (Smeyne et al. 1993), regeneração axonal (Schaden et al. 1994) e até mesmo a sincronização dos ritmos biológicos (Wollnick et al. 1995). Em relação a esta última, os principais IEGs envolvidos são c-fos e JunB. Eles formam heterodímeros e se ligam a uma região promotora do DNA conhecida como sítio AP-1(Herdegen e Leah, 1998).
1.5 – Genes de Expressão Imediata e o Sistema de Temporização Circadiana.
A expressão dos IEGs apresentam variação circadiana e está regulada por mecanismos diferentes, comparando-se distintas regiões envolvidas nos ritmos biológicos, como o NSQ, o FIG e o PVT e entre as variadas situações experimentais, seja ela de claro ou escuro constante, claro-escuro ou fotoperíodo esqueleto. Ainda, reforçando a afirmação inicial, verificou-se que a expressão de FOS no NSQ pode ser bloqueada injetando-se um antagonista glutamatérgico (MK801), e que o mesmo procedimento não surte efeito sobre o FIG (Edelstein et al. 2000).
Vale ressaltar que a maneira como esses genes se expressam nos traduzem informações interessantes acerca das propriedades dos ritmos biológicos e até mesmo de características individuais. Beaulé e Amir (1998) demonstram que a expressão de FOS e JunB no NSQ e FIG mantêm uma forte correlação com as mudanças de fase após estímulos fóticos e que a intensidade da expressão dessas proteínas apresenta forte ligação com a diferença entre as 24 horas do ciclo claro-escuro ambiental e o período endógeno do animal.
pulso de luz, já no FIG o pulso de luz também foi capaz de induzir essa expressão, mas a mesma é indiferente à fase circadiana.
Edelstein a Amir (1995), mostraram que diversos estímulos não-fóticos respondem diferentemente a fase circadiana e, ao contrário dos pulsos de luz, a expressão de FOS é bem mais pronunciada durante o dia subjetivo. Além disso, os estímulos não-fóticos não são capazes de induzir FOS no NSQ a ponto de ser estatisticamente significante quando comparado ao grupo controle (Mikkelsen et al. 1998). Entretanto, as células do FIG respondem de forma satisfatória a esses estímulos e em especial as que contêm NPY. Este grupo celular parece estar mais envolvido na transmissão da informação desses estímulos do que propriamente aos pulsos de luz (Janik et al. 1995). Ainda, a injeção de NPY dentro do NSQ reproduz o efeito dos estímulos não-fóticos, reduzindo a expressão de FOS e inibindo as mudanças de fase provocadas pela luz (Janik et al. 1995; Eldestein e Amir, 1995; 1996). Até o momento, não existem trabalhos relacionando a expressão desses IEGs com as mudanças de fase após pulsos de escuro nos centros moduladores do STC.
1.6 – Estudos Eletrofisiológicos
2. JUSTIFICATIVA.
3. OBJETIVO.
4. MATERIAL E MÉTODOS.
4.1 – Animais.
Para realização deste projeto foram requeridos 09 (nove) animais, sem parentesco, nascidos em cativeiro no Núcleo de Primatologia da Universidade Federal do Rio Grande do Norte (NP-UFRN), da espécie Callithrix jacchus, conhecido popularmente como sagüi. Todos os sagüis utilizados eram machos adultos jovens e pesavam entre 300 e 400 gramas. O estado de saúde geral dos animais foi acompanhado através de medidas dos pesos corporais (343,3g + 34,8), temperatura interna (39,3°C + 0,5), exame parasitológico de fezes (técnica de Blagg), do registro da ingestão alimentar e da observação dos padrões da atividade motora e comportamento dos mesmos. Somente foram utilizados os animais que apresentaram bom estado de saúde e peso regular durante todo o experimento. Durante a pesquisa os mantivemos em viveiros lotados no ambiente externo do NP-UFRN ou em gaiolas localizadas dentro de salas isoladas desse meio externo. Os sagüis eram alimentados 2 vezes ao dia em horários aleatórios (1 vez entre 06:00 h – 11:00 h e outra entre 13:00 h – 17:00 h) e com água ad libitum.
Os animais foram cedidos pelo NP-UFRN com autorização do IBAMA, n° 1/24/92/0039-00, sendo submetidos a procedimentos experimentais de acordo com as normas estabelecidas pelo National Research Council of National Academy publicadas no livro “Guidelines for the Care and Use of Mammals in Neuroscience and Behavioral Research”. Uma versão em formato pdf está disponível gratuitamente no site da Sociedade Brasileira de Neurociências e Comportamento (SBNeC) – http://www.sbnec.gov.br/links
4.2 – Viveiros e Gaiolas.
As gaiolas, medindo 76 cm de altura x 40 cm de largura x 60 cm de comprimento, equipadas com comedouro, bebedouro, poleiro e toca de PVC (com interior em cor preta), foram postas dentro de uma sala com isolamento acústico parcial e luminosidade (250 lx), temperatura (26,7 ± 0,3°C) e umidade controladas (78,2 ± 6%). Um exaustor era ligado sempre que necessário para renovação do ar da sala. Cada gaiola foi equipada com um sensor infravermelho sensível ao movimento que, por sua vez, estava conectado a uma placa de aquisição de dados em uma sala vizinha de onde se obtinha os registros do ciclo de atividade-repouso do animal. Cada gaiola continha apenas um animal e estavam separadas umas das outras por anteparos de madeira impedindo que os sagüis tivessem contato visual com os demais, entretanto, a relação auditiva e olfativa entre os mesmos provavelmente manteve-se inalterada.
4.3 – Alimentação.
Pela manhã os sagüis recebiam papa (composta por leite, água, pão, ovo, açúcar, banana e vitaminas), frutas da época, como banana, melancia, mamão, manga, entre outras. À tarde, a alimentação colocada de manhã era trocada por frutas da época ou batata-doce cozida. Como complemento alimentar, no turno vespertino, recebiam leite fermentado com lactobacilos vivos ou goma arábica ou ovo ou larva de tenébrio em dias específicos da semana.
4.4 – Projeção Retiniana e Neuroquímica.
A fim de investigar a projeção retiniana ao NPG usamos um traçador neural com propriedade anterógrada, a subunidade b da toxina colérica (CTb). Esse traçador é captado pelo corpo neuronal e transportado via fluxo axoplasmático aos terminais, não possuindo propriedade transináptica.
esclero-corneal a um ângulo de aproximadamente 45°, atingindo o corpo vítreo. A velocidade de injeção foi de 1μl por minuto, sob pressão, com o auxílio de uma micro-bomba. Ao término da injeção, a agulha permaneceu no local durante cerca de 15 minutos para evitar refluxo da solução. Após a cirurgia, esses animais foram devolvidos ao seu local de origem dando-os sobrevida de 7 (sete) dias, com recuperação pós-cirúrgica acompanhada por um médico veterinário. Em seguida, foram novamente capturados, anestesiados, perfunidos (via transcardíaca), removidos os encéfalos e obtidos cortes deste tecido (microtomia). Para cada animal, pelo menos um compartimento do encéfalo foi utilizado para realização de imunohistoquímica contra CTb e os outros para os demais neurotransmissores (ver tabela 1). Um compartimento do animal 4 foi separado para a realização do método de Nissl e outro para dupla marcação contra CTb e NPY. Este grupo serviu para analisarmos as características neuroquímicas, as aferências retinianas e os aspectos citoarquitetônicos do NPG, a fim de compará-las com as descritas para o FIG dos roedores. A avaliação dos resultados imunohistoquímicos foi feita com o auxílio de um microscópio óptico (Olympus, BX-41) utilizando campo claro ou escuro conforme a necessidade. As imagens foram digitalizadas utilizando uma câmera (Nikon, DXM-1200) acoplada ao microscópio e conectada a um computador, sendo subseqüentemente operacionalizadas para ajuste de brilho e contraste com o programa Adobe Photoshop 7.0. Posteriormente, analisamos os resultados baseando-se na intensidade da marcação, número de células marcadas e disposição e arranjo destas no NPG.
4.5 Processamento do tecido.
4.5.1 - Perfusão e Microtomia:
concentração de 2 ml/L, à temperatura ambiente, foram impulsionados pelo leito vascular durante 4 minutos (100 ml/min), seguindo-se 700 ml de solução fixadora (paraformaldeído a 4%, Vetec Química Fina) em tampão fosfato (PB) 0,1 M, a um pH de 7,4, também em temperatura ambiente. Metade da solução fixadora foi infundida em fluxo rápido (35 ml/min), e a outra metade em fluxo lento (17,5 ml/min), totalizando 30 min. Os encéfalos foram removidos da cavidade craniana e pós-fixados por 4 horas na mesma solução fixadora e em seguida transferidos para uma solução de sacarose a 30% (Nuclear-CAQ) em PB 0,1 M, até serem submetidos à microtomia. Dessa maneira, os encéfalos foram seccionados por microtomia de congelação (gelo seco), em um micrótomo manual. Obtivemos secções coronais de 30 μm, as quais foram distribuídas seqüencialmente em 6 compartimentos, cada compartimento contendo sempre uma de seis secções, de maneira que a distância entre uma secção e a seguinte de um mesmo compartimento era de aproximadamente 180 μm. As secções de todos os compartimentos foram armazenadas em uma solução anti-congelante contendo PB 0,1 M, pH 7,4.
4.5.2 – Imunohistoquímica:
As técnicas imunohistoquímicas foram baseadas num protocolo para marcação simples ou dupla* com imunoperoxidase e as concentrações dos anticorpos utilizados, na maioria dos casos, seguiram as especificações técnicas de cada fabricante (ver tabela 1). Analisamos qualitativamente a expressão dessas substâncias no NPG do sagüi.
*Não obtivemos sucesso na realização desta etapa (protocolo não descrito).
4.5.2.1 - Imunoperoxidase simples:
A reação foi feita pelo método ABC (protocolo avidina-biotina complexo peroxidase; ABC, kit Elite, Vector labs, Burlingame, CA, USA).
Tabela 1: Especificações técnicas das substâncias utilizadas na imunohistoquímica. Natal, RN. 2008.
Antígeno Anticorpo Primário (AP) Anticorpo Secundário (AS) Soro
Normal Fabricante (AP) Fabricante (AS)
CTb Subunidade B da
toxina colérica Cabra [1:9000] Asno [1:200] Asno [1:200] List Biological Laboratories, INC. Sigma Chemical Company NPY Neuropeptídeo-Y Coelho [1:1000] Cabra [1:1000] Cabra [1:50] Sigma Jackson Immuno-research Laboratories GAD Descarboxilase do ácido glutâmico Camundongo [1:500] Coelho [1:200] Coelho [1:50]
Protos Biotech Sigma
ENK Encefalina Camundongo [1:1000] Coelho [1:200] Coelho [1:50] Chemicon Sigma SP Substância P Rato [1:1000] Cabra [1:1000] Cabra [1:50] Chemicon Jackson Fos Coelho [1:10000] Cabra [1:1000] Cabra [1:50] Oncogene Research Products Jackson 5-HT Serotonina Coelho [1:5000] Cabra [1:1000] Cabra [1:50]
Protos Biotech Jackson
CB Calbindina
Camundongo
[1:1000] Coelho [1:200] Coelho [1:50] Sigma Sigma PV Parvalbumina Camundongo [1:5000] Coelho [1:200] Coelho [1:50] Sigma Sigma CR Calretinina Coelho [1:1000] Cabra [1:1000] Cabra [1:50] Chemicon Jackson NeuN Proteína neuronal nuclear específica Camundongo [1:1000] Coelho [1:200] Coelho [1:50] Chemicon Sigma GFAP Proteína acídica fibrilar glial Camundongo [1:2000] Coelho [1:200] Coelho [1:50] Sigma Sigma
4.5.3 – Técnica de Nissl (Tionina):
submetidos à coloração de Nissl, que consiste na desidratação do tecido passando-o em concentrações crescentes de álcoois etílicos (70% - 1 vez, por 1 h, 95% - 2 vezes, 3 minutos cada, 100% - 2 vezes, 3 minutos cada), sendo posteriormente deslipidificados em dois recipientes com xilol, por 3 e 30 minutos, nessa ordem. Na seqüência, o tecido é reidratado em concentrações decrescentes de álcoois (mesmo processo anterior, mas no sentido inverso), submergido em água destilada por 2 minutos, posteriormente colocado 30 a 40 segundos na solução de tionina a 0,25%. Para desfecho do processo, os cortes foram rapidamente submergidos e emergidos 10 vezes em água destilada e novamente desidratados e deslipidificados como descrito anteriormente, sendo acrescentado apenas uma etapa (antes da desidratação em álcool 100%) de imersão do tecido numa solução contendo álcool a 95% e ácido acético a 1%, por 3 segundos. Os cortes foram deslipidificados em xilol em dois recipientes (2 e 4 minutos, respectivamente) e finalmente cobertos com lamínula utilizando como meio de montagem o DPX.
4.7 Expressão da Proteína FOS.
4.7.1 – Grupo Experimental
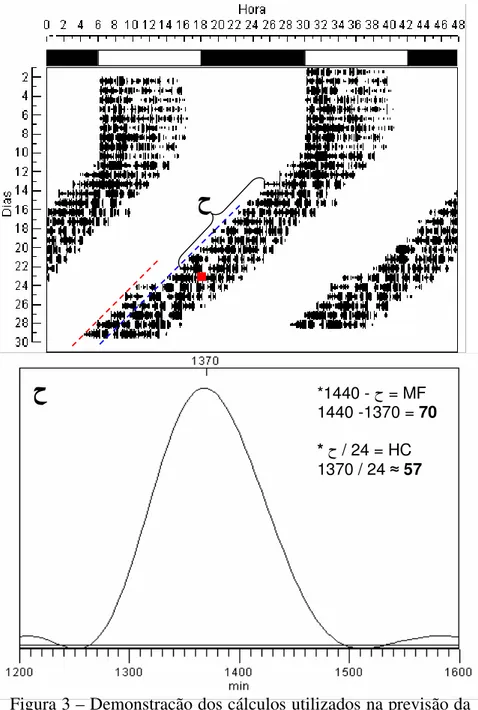
HCs (Fig.3). Assim, ajustamos o “timer” para interromper a passagem de corrente elétrica para as luzes da sala na hora prevista e com a duração desejada.
Um software (Aschoff) desenvolvido na base de pesquisa LabCrono/UFRN foi usado para registrar o ciclo de atividade/repouso de cada animal, utilizando para isto um sensor infravermelho (JFL-Equipamentos Eletrônicos, IDX-1000) adaptado à gaiola, que detecta cada movimento do animal gerando um sinal elétrico. O sinal elétrico gerado pelo sensor é enviado para uma placa de aquisição de dados, National Instruments (NI PCI – 6025E), que armazena informações de 05 minutos, totalizando 288 pontos de registro de atividade ao longo de 24 horas. Estas informações são usadas para se obter o perfil do ciclo atividade/repouso dos animais mantidos sob diversas circunstâncias experimentais. Estudos comparativos entre dados captados por softwares com dados obtidos através de registros de observação comportamental demonstram que 97% das vezes em que este tipo de sensor é ativado, o sinal corresponde ao deslocamento do animal, embora ele seja capaz de detectar qualquer tipo de movimento (Santos, 2000).
A determinação dos horários do início da atividade foi feito através da totalização dos dados em intervalos de 15 minutos e calculada a freqüência média diária de atividade. Como início da atividade (HC 0) foi considerado o primeiro intervalo de 15 minutos com valor superior ou igual a 10% da média de atividade diária, que se manteve por um mínimo de 30 minutos dentro de 1 hora. Como fim da atividade foi considerado o último intervalo de 15 minutos com valor superior ou igual a 10% da média diária, antecedido por no mínimo 30 minutos de atividade dentro de 1 hora (critério adaptado a partir de Glass et al, 2001). O critério de definição da HC atingida pelo pulso de escuro foi determinado pelo início do pulso, mesmo que o término deste se extinguisse na HC subseqüente.
encéfalos, obtido cortes deste tecido (microtomia), servindo assim como nosso grupo experimental. Posteriormente foi realizada imunohistoquímica contra a proteína FOS, utilizada como indicador de atividade neuronal, assim como uma marcação com dupla peroxidase contra FOS e NPY. Para mensurar a expressão de FOS, o grupo experimental foi comparado ao do grupo controle utilizando como parâmetro o número de células FOS-positivas por campo (coincidente com os limites do NPG), em três níveis (rostral, médio e caudal) do NPG. Quatro indivíduos leigos no assunto foram instruídos a contar essas células, apenas com a informação das características que deveriam levar em consideração para computar essas células no ato da contagem. Para confirmar se há diferença entre os grupos seria necessário aplicar o teste T (Student), no entanto, devido ao baixo tamanho da amostra, não foi possível avaliar essa condição. Apenas utilizamos a estatística descritiva para apresentação dos dados. As ferramentas para análise da imunohistoquímica e digitalização das imagens foram semelhantes a do grupo anterior.
ح
ح
*1440 - ح = MF1440 -1370 = 70
* ح / 24 = HC
1370 / 24 ≈57
4.7.2 – Grupo Controle
O sagüi 7 foi submetido a mesma condição inicial do grupo anterior, mas não se aplicou o pulso de escuro, onde, partindo-se de uma HC equivalente ao dos animais do grupo anterior, fizemos a captura, vendamento, perfusão, remoção dos encéfalos, microtomia e imunohistoquímica contra a proteína FOS, servindo assim como nosso grupo controle.
4.7.3 – Curva de Resposta Dependente de Fase (CRF).
Durante todo o experimento, os animais 5, 6, 7, 8 e 9 receberam pulsos de escuro em HC’s distintas de acordo com as especificações descritas acima. As respostas comportamentais de cada um deles serviram para construção da CRF. Os animais 8 e 9 serviram apenas como fonte de dados para as respostas de fase e logo foram devolvidos aos viveiros ao término do desenho experimental.
As mudanças de fase foram calculadas pela diferença entre os horários estimados para o início da atividade, 1 dia após a aplicação do pulso, determinados pela regressão linear (GraphPad InStat) a partir do início da atividade 1-7 dias imediatamente antes ao pulso.
4.7.4 – Registro de Atividade Locomotora.
5. RESULTADOS
5.1 - NÚCLEO PRÉ-GENICULADO
5.1.1 – Citoarquitetura (Nissl e NeuN)
Nas secções coronais do complexo geniculado lateral do tálamo, coradas pelo método de Nissl (Thionina), identificamos o NPG como um aglomerado de células localizadas dorsomedialmente ao GLD (Fig. 4A-C). Tomando como referência o GLD e baseado na morfologia celular, definimos duas regiões dentro do NPG: a primeira localizada dorsalmente, a lâmina externa do núcleo pré-geniculado (NPGle); e a segunda mais ventralmente, a lâmina interna do NPG (NPGli) (Fig. 4D-F). No todo, o NPG se assemelha a uma cunha ou capuz (Fig. 4A-C). Encontramos três tipos de neurônios: (1) Neurônios grandes e poligonais, com o citoplasma intensamente marcado, localizados exclusivamente na lâmina externa e constituindo a população menos numerosa dentro do NPG; (2) Neurônios esféricos, com citoplasma escasso e pouco marcados e presentes somente na lâmina interna; (3) Neurônios fusiformes, com poucos grânulos de Nissl e distribuídos entre os neurônios esféricos (Fig. 7A-C). O segundo e terceiro tipos representaram a população neuronal mais abundante dentro do NPG.
5.1.2 – Projeções Retinianas
Fibras e terminais imunorreativos a CTb foram visualizados em ambas as lâminas do NPG (Fig. 8A-F) e apresentaram uma forte predominância no hemisfério contralateral ao olho injetado (Fig. 8A-C). A NPGli se caracterizou por uma forte marcação e a NPGle mostrou-se com poucas fibras e terminais esparsos em ambos hemisférios (Fig. 8A-F). Constatamos que a NPGli apresenta os limites bem definidos principalmente no hemisfério ipisilateral ao olho injetado (Fig. 8D-F) . Os limites da NPGle foram imprecisos em ambos hemisférios (Fig. 8A-F).
5.1.3 – Neurotransmissores
Neuropeptídeo Y (NPY)
Encontramos neurônios imunorreativos a NPY, bem marcados (Fig. 9D-F) e concentrados apenas na lâmina interna do NPG (Fig. 9A-C). Fibras e terminas foram visualizados em toda extensão da mesma (Fig. 9A-F).
Encefalina (ENK)
Identificamos poucos neurônios imunorreativos a ENK (Fig. 10D-F), esparsamente localizados na lâmina interna do NPG (Fig. 10A-C). Fibras dispersas e uma grande quantidade de terminais foram encontrados em toda extensão desta lâmina (Fig. 10A-F).
Descarboxilase do Ácido Glutâmico (GAD)
Conseguimos visualizar neurônios imunorreativos a GAD (Fig. 11D-F) esparsamente distribuídos apenas na lâmina externa do NPG (Fig. 11A-C). Também identificamos a presença de fibras e terminais nesta região (Fig. 11A-F).
Serotonina (5-HT)
Substância P (SP)
Identificamos somente fibras e terminais imunorreativos a SP no NPG do sagüi (Fig. 13A-C). Em níveis rostrais (Figs. 13A e 13D) e caudais (Figs. 13C e 13F) essa substância se mostrou concentrada na NPGli e de distribuição esparsa da NPGle. No nível médio, a lâmina externa do NPG apresentou um padrão de imunorreatividade que permitiu delimitar dois subsetores, um dorsal e outro ventral (Figs. 13B e 13E). A NPGle foi marcada predominantemente em sua porção mais dorsal em todos os níveis (Fig. 13A-F).
5.1.4 – Proteínas Ligantes de Cálcio
Parvalbumina (PV)
Encontramos neurônios imunorreativos a PV concentrados na NPGle e de distribuição esparsa na NPGli em todos os níveis analisados (Fig. 14A-F). Em secções mais caudais a NPGli apresentou uma maior concentração de neurônios em sua porção mais ventral (Figs. 14C e 14F).
Calretinina (CR)
No nível rostral os neurônios CR-positivos apresentaram-se preferencialmente ocupando a lâmina externa do NPG delimitando bem esta porção (Figs. 15A e 15D). Nos níveis subseqüentes, os neurônios CR-positivos vão gradualmente ocupando posição mais interna (Figs. 15B e 15E) e em secções caudais observamos a predominância dessas células na NPGli (Figs. 15C e 15F).
Calbindina (CB)
5.1.5 – Glia
Proteína Acídica Fibrilar Glial (GFAP)
Nas secções rostrais (Fig. 17A) e médias (Fig. 17B), a imunorreatividade contra GFAP apresentou-se concentrada na NPGli e na porção mais dorsal da NPGle. Em segmentos caudais, essas células ocuparam predominantemente a NPGli (Figs. 17C e 17F). Encontramos uma alta concentração de vasos sanguíneos nessa região e um respectivo aumento da densidade celular em torno dos mesmos (Fig. 17D-F).
5.1.6 – Atividade Celular
Imunorreatividade contra FOS
O pulso de escuro aplicado na HC 4 promoveu um aumento na expressão da proteína FOS no NPG do sagüi. Ambas as lâminas do NPG do animal estimulado (Fig. 18A-C) apresentaram um maior número de células FOS-positivas, comparando-se com as mesmas lâminas do animal controle (Fig. 18D-F). A NPGli mostrou, em todos os níveis, um maior número de células FOS-positivas em relação a NPGle, seja considerando dentro do mesmo grupo ou entre os grupos experimental e controle (Figs. 18A-F, 19A-F, 20 e 21).
5.2 – ATIVIDADE LOCOMOTORA
diferenças, comparando-se a mesma fase nos dias imediatamente antecedentes e subseqüentes sem a respectiva estimulação (Figs. 26C e D e 27C e D).
5.3 – CURVA DE RESPOSTA DE FASE (CRF)
Figura 4 – Fotomicrografias em campo claro de secções coronais do núcleo pré-geniculado do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a citoarquitetura pelo método de Nissl. As áreas pontilhadas representam os respectivos aumentos mostrados em D-F e as áreas contínuas os limites anatômicos do NPG (A-C). A linha pontilhada divide o NPG em duas lâminas, interna (setas claras) e externa (setas escuras) (D-F). NPG, núcleo pré-geniculado; GLD, núcleo geniculado lateral dorsal; RT, núcleo reticular do tálamo; VPI, núcleo ventral póstero-inferior do tálamo; Dors, dorsal; Ventr, ventral; Lat, lateral; Med, medial. Barras: 300 μm.
GLD
RT
GLD
RT
GLD
N
N
P
P
G
G
N
N
P
P
G
G
N
N
P
P
G
G
VPI
Med Lat
Dors
Figura 5 – Fotomicrografias em campo claro de secções coronais do núcleo pré-geniculado do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando a citoarquitetura após imunohistoquímica contra NeuN. As áreas pontilhadas representam os respectivos aumentos mostrados em D-F. As linhas pontilhadas dividem o NPG em duas lâminas, interna (setas claras) e externa (setas escuras) (D-F). NPGli, lâmina interna do núcleo pré-geniculado; NPGle, lâmina externa do núcleo pré-geniculado; GLD, núcleo geniculado lateral dorsal; RT, núcleo reticular do tálamo; VPI, núcleo ventral póstero-inferior do tálamo; Dors, dorsal; Ventr, ventral; Lat, lateral; Med, medial. Barras: 300 μm.
N
N
P
P
G
G
l
l
e
e
N
N
P
P
G
G
l
l
i
i
GLD
RT
N
N
P
P
G
G
l
l
i
i
N
N
P
P
G
G
l
l
e
e
GLD
RT
GLD
N
N
P
P
G
G
l
l
i
i
N
N
P
P
G
G
l
l
e
e
VPI
Med Lat
Dors
N
NPPGGllii
N
NPPGGllee
RT
GLD
VP
ZI
Stl VL Put
Put
Cd
N
NPPGGllii
N
NPPGGllee
GLD
RT
VPL
ZI
Stl VL Put
Put Med Lat
Dors
Ventr
Med Lat
Dors
N
NPPGGllii N
NPPGGllee
GLD Pp
VPI VPL
Put
Put
RT
Figura 6 – Fotomicrografias em campo claro de secções coronais do núcleo pré-geniculado do sagüi em nível rostral (A), médio (B) e caudal (C), mostrando a estrutura bilaminar e suas relações anatômicas. Imunohistoquímica contra NeuN. NPGle, lâmina externa do núcleo geniculado; NPGli, lâmina interna do núcleo pré-geniculado; GLD, núcleo geniculado lateral dorsal; RT, núcleo reticular; VPL, núcleo ventral póstero-lateral; VL, núcleo ventrolateral; VPI, núcleo ventral póstero-inferior; Stl, núcleo subtalâmico; Pp, núcleo peripeduncular; Put, putamên; Cd, núcleo caudado; Dors, dorsal; Ventr, ventral; Lat, lateral; Med, medial. Barra = 300 μm.
Med Lat
Dors
Figura 7 – Fotomicrografias em campo claro de secções coronais do núcleo pré-geniculado do sagüi em níveis rostral (A e D), médio (B e E) e caudal (C e F), mostrando em detalhes a morfologia neuronal pelo método de Nissl (A-C) ou imunohistoquímica contra NeuN (D-F). (1) Neurônio de pericário poligonal; (2) Neurônio de pericário esférico; (3) Neurônio de pericário fusiforme; (4) Glia. (1) Presentes na NPGle; (2 e 3) Presentes na NPGli. Barra: 100 μm.
1
1
1
1
2
3
2
3
2
3
1
1
2
3
2
3
2
3
4
4
Figura 8 – Fotomicrografias em campo claro de secções coronais do núcleo pré-geniculado do sagüi em níveis rostral (A e D), médio (B e E) e caudal (C e F), mostrando a distribuição dos terminais retinianos evidenciados por imunorreatividade contra CTb. Projeções contralaterais (A-C) e ipisolaterais (D-F). A linha pontilhada divide o NPG em duas lâminas, interna (NPGli) e externa (NPGle). GLD, núcleo geniculado lateral dorsal; Dors, dorsal; Ventr, ventral; Lat, lateral; Med, medial. Barra: 300 μm. Lat Med Dors Ventr N
NPPGGllee
GLD
N
NPPGGllii
N
NPPGGllee
GLD
GLD
N
NPPGGllee N
NPPGGllii
N
NPPGGllii
GLD GLD GLD Med Lat Dors Ventr N
NPPGGllii N
NPPGGllee
N
NPPGGllii
N
NPPGGllee
N
NPPGGllii N
Figura 9 – Fotomicrografias em campo claro de secções coronais do núcleo pré-geniculado do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando o padrão de imunorreatividade contra NPY. Barra: 300 μm As áreas pontilhadas representam os respectivos aumentos mostrados em D-F. Setas escuras (neurônios) e setas claras (fibras e terminais). Barra: 100 μm. NPGli, lâmina interna do núcleo pré-geniculado; NPGle, lâmina externa do núcleo pré-geniculado; GLD, núcleo geniculado lateral dorsal; Dors, dorsal; Ventr, ventral; Lat, lateral; Med, medial.
N
N
P
P
G
G
l
l
e
e
GLD
N
N
P
P
G
G
l
l
i
i
Med Lat
Dors
Ventr
N
N
P
P
G
G
l
l
e
e
N
N
P
P
G
G
l
l
i
i
GLD
N
N
P
P
G
G
l
l
e
e
N
N
P
P
G
G
l
l
i
i
Figura 10 – Fotomicrografias em campo claro de secções coronais do núcleo pré-geniculado do sagüi em níveis rostral (A), médio (B) e caudal (C), mostrando o padrão de imunorreatividade contra ENK. Barra: 300 μm As áreas pontilhadas representam os respectivos aumentos mostrados em D-F. Setas escuras (neurônios) e setas claras (fibras e terminais). Barra: 100 μm. NPGli, lâmina interna do núcleo pré-geniculado; NPGle, lâmina externa do núcleo pré-geniculado; GLD, núcleo geniculado lateral dorsal; Dors, dorsal; Ventr, ventral; Lat, lateral; Med, medial.
N
N
P
P
G
G
l
l
e
e
GLD
N
N
P
P
G
G
l
l
e
e
N
N
P
P
G
G
l
l
i
i
GLD
N
N
P
P
G
G
l
l
e
e
N
N
P
P
G
G
l
l
i
i
GLD
N
N
P
P
G
G
l
l
i
i
Med Lat
Dors