Bioacúmulo de alumínio e seus efeitos tóxicos na fermentação
alcoólica em linhagens industriais de
Saccharomyces cerevisiae
Luís Henrique Poleto Angeloni
Dissertação apresentada, para a obtenção do título de Mestre em Ciências. Área de concentração: Ciência e Tecnologia de Alimentos
Luís Henrique Poleto Angeloni Biólogo
Bioacúmulo de alumínio e seus efeitos tóxicos na fermentação alcoólica em linhagens industriais de Saccharomyces cerevisiae
Orientador:
Prof. Dr. LUIZ CARLOS BASSO
Dissertação apresentada para a obtenção do título de Mestre em Ciências. Área de concentração: Ciência e Tecnologia de Alimentos
Dados Internacionais de Catalogação na Publicação DIVISÃO DE BIBLIOTECA E DOCUMENTAÇÃO - ESALQ/USP
Angeloni, Luís Henrique Poleto
Bioacúmulo de alumínio e seus efeitos tóxicos na fermentação alcoólica em linhagens industriais de Saccharomyces cerevisiae / Luís Henrique Poleto Angeloni. - - Piracicaba,
2009. 124 p. : il.
Dissertação (Mestrado) - - Escola Superior de Agricultura “Luiz de Queiroz”, 2009. Bibliografia.
1. Alumínio - Toxicidade 2. Fermentação alcoólica 3. Leveduras I. Título
CDD 660.62 A584b
AGRADECIMENTOS
Ao prof.Dr. Luiz Carlos Basso por compartilhar todo seu conhecimento e orientação concedida neste trabalho;
À Escola Superior de Agricultura “Luiz de Queiroz” pela oportunidade de realização deste curso;
À Fundação de Estudos Agrários Luiz de Queiroz (FEALQ) e FERMENTEC S/C Ltda, Assistência Técnica em Fermentação Alcoólica, pelo apoio financeiro às pesquisas;
Aos companheiros de Laboratório: Luiz Lucatti (Cometa), Marcos Borotte (Busina), Fernanda Sgarbosa Gomes, Maiara Quatrini, Bruno da Cruz, Thiago Olitta Basso;
À Dra. Silene de Lima Paulilo chefe dos laboratórios de Biotecnologia e Biologia Molecular da Fermentec Ltda.
Aos companheiros de Republica “Casa de mãe”, Celsao, Ciniro e Jorge.
À minha família, em especial minha mãe Lúcia Elena Poleto Angeloni, meu pai João Angeloni Júnior e irmãos Rodrigo e Bruna, pelo apoio nos momentos que mais precisei, sobretudo pela compreensão;
À minha mulher June de Oliveira Mainardi pela força, incentivo e inspiração em minha vida;
A todos que de alguma forma ajudaram a lapidar esse sonho.
Aos meus pais, LÚCIA e JOÃO ANGELONI JÚNIOR,
irmãos RODRIGO e BRUNA,
meus avós maternos ARLINDO POLETO e LIA (in memorian),
paternos JOÃO ANGELONI e MARIA THEREZINHA
pelo amor, confiança e incentivo.
Ofereço
A minha mulher JUNE, pelo incentivo e compreensão durante todos os momentos.
SUMÁRIO
RESUMO...
ABSTRACT...
LISTA DE FIGURAS...
LISTA DE TABELAS...
LISTA DE FOTOS...
1 INTRODUÇÃO...
2 REVISÃO BIBLIOGRÁFICA...
2.1 Solo e o alumínio...
2.2 Alumínio e suas interações...
2.2.1 Interação levedura – Al...
2.3 Alumínio e o processo fermentativo...
2.4 Técnica de cariotipagem na identificação de leveduras contaminantes...
3 MATERIAL E MÉTODOS...
3.1 Linhagens de Saccharomyces cerevisiae......
3.2 Multiplicação da levedura...
3.3 Ensaios fermentativos...
3.4 Experimentos com mosto de caldo-de-cana...
3.5 Determinação do pH dos vinhos delevedurados...
3.6 Determinação de álcool e densidade nos vinhos delevedurados...
3.7 Determinação glicerol e açúcares no mosto e nos vinhos delevedurados ...
3.8 Determinação da viabilidade celular e contaminação bacteriana...
3.9 Extração e determinação de trealose na levedura...
3.10 Determinação de alumínio na levedura...
3.11 Análises estatísticas...
4.1 Experimento 1...
4.1.1 Rendimento fermentativo...
4.1.2 Crescimento em biomassa...
4.1.3 Formação de glicerol...
4.1.4 Viabilidade da levedura...
4.1.5 Trealose...
4.1.6 Velocidade de fermentação...
4.1.7 Considerações sobre o experimento 1...
4.2 Experimento 2...
4.2.1 Rendimento fermentativo...
4.2.2 Formaçãode glicerol...
4.2.3 Crescimento em biomassa...
4.2.4 Trealose...
4.2.5 Acúmulo de alumínio nas células...
4.2.6 Velocidade de fermentação...
4.2.7 Considerações sobre o experimento 2...
4.3 Experimento 3...
4.3.1 Rendimento fermentativo...
4.3.2 Formação de glicerol...
4.3.3 Crescimento em biomassa...
4.3.4 Trealose...
4.3.5 Acúmulo de alumínio nas células...
4.3.6 Velocidade de fermentação...
4.3.7 Considerações sobre o experimento 3...
RESUMO
Bioacúmulo de alumínio e seus efeitos tóxicos na fermentação alcoólica em linhagens industriais de Saccharomyces cerevisiae
O presente trabalho teve por objetivo avaliar o efeito do alumínio sobre a fermentação alcoólica utilizando diferentes linhagens industriais de leveduras (CAT-1, BG-1, PE-2, Fleischmann e colônias de leveduras selvagens isoladas do processo de produção de álcool combustível denominadas C1, C5, C6, C8, C10 e C11) em diferentes concentrações de alumínio e também analisar o acúmulo do metal nessas leveduras durante o processo fermentativo com reciclos de células, semelhante ao processo industrial, para tal, foram avaliados parâmetros como: produção de etanol, rendimento fermentativo, formação de biomassa, produção de glicerol, utilização da trealose, eficiência fermentativa e acúmulo de Al pelas leveduras. Os experimentos
foram divididos em três partes: 1a avaliar a ação tóxica do alumínio frente às leveduras
industriais BG-1, CAT-1, Fleischmann e PE-2 na fermentação de mosto de caldo de
cana (19% ART) com 130 ppm Al; 2a avaliar a ação tóxica do alumínio frente à levedura
industrial CAT-1 e as colônias de leveduras C1, C5, e C6 isoladas de uma destilaria produtora de álcool combustível fermentando mosto de caldo de cana (19% ART) com
54 ppm Al com 5 reciclos de células e a 3a foi avaliar a ação tóxica do alumínio frente à
levedura industrial CAT-1 e as colônias de leveduras C8, C10, e C11 isoladas de uma destilaria produtora de álcool combustível fermentando mosto de caldo de cana (19% ART) com 54 ppm Al com 5 reciclos de células. Os resultados mostram que no primeiro experimento, a ação tóxica do alumínio em mosto de caldo acarreta efeitos estressantes diferenciados dependendo da linhagem de levedura avaliada. As linhagens CAT-1 e BG-1 são as mais tolerantes ao alumínio, quando comparadas com a PE-2 e Fleischmann, sendo esta última a mais vulnerável em relação a todos os
parâmetros estudados. No segundo experimento os resultados obtidos nos permitem
concluir que nível tóxico de alumínio em mosto de caldo exerce uma ação diferenciada em relação às leveduras industriais. Inferindo que a CAT-1 foi a mais tolerante ao metal mesmo acumulando mais alumínio, o rendimento foi o maior e os teores de trealose também foram menores. No entanto, de uma forma geral se pode inferir que as leveduras C6 e CAT-1 são mais tolerantes ao alumínio do que a levedura C1 e C5. No terceiro ensaio, concluiu-se que a CAT-1 foi a mais tolerante ao metal Al comparada com as linhagens selvagens C8, C10 e C11, tendo como principal efeito na diminuição da viabilidade e aumento do tempo fermentativo. No geral a linhagem de levedura CAT-1 apresentou melhor desempenho fermentativo frente a ação tóxica do alumínio.
ABSTRACT
Bioaccumulation of aluminium and its effects on toxic alcoholic fermentation in industries strains of Saccharomyces cerevisiae
This study aimed to assess the effect of aluminium on the alcoholic fermentation using different strains of industrial yeasts (CAT-1, BG-1, PE-2, Fleischmann and wild yeast colonies isolated from production of alcohol fuel called C1, C5 , C6, C8, C10 and C11) in different concentrations of aluminium and also examine the accumulation of metal in yeast during fermentation with reused of cells, similar to industrial process, for such parameters have been assessed as: production of ethanol, fermentation rate, formation of biomass, glycerol production, use of trehalose, fermentative efficiency and
accumulation of Al by yeasts. The experiments were divided into three parts: 1st
available the toxic action of the aluminum front of industrial yeasts BG-1, CAT-1, Fleischmann and PE-2 in the fermentation of grape juice from cane (19% TS) with 130
ppm Al. 2nd available the toxic action of the aluminium front of the yeast industrial CAT-1
and the colonies of yeast C1, C5 and C6 isolated from a distillery producing alcohol fuel molasses fermenting of sugar cane juice (19% TS) with 54 ppm Al with 5 recyclation of
cells and the 3rd was to evaluate the toxic action of the aluminium front of the industrial
CAT-1 yeast and yeast colonies of C8, C10 and C11 isolated from a distillery producing alcohol fuel molasses fermenting of sugar cane juice (19% TS) with 54 ppm Al with 5 recyclation of cell. The results showed that in the first experiment, the toxic action of aluminium in the broth must involve stressful effects depending on different strain of yeast evaluated. The strain CAT-1 and BG-1 are the most tolerant to aluminium, compared with PE-2 and Fleischmann, the latter being the most vulnerable regarding all parameters studied. In the second the results allow us to conclude that toxic levels of aluminum in the broth must exercise a differentiated action in relation to industrial yeast. Deducing that the CAT-1 was the most tolerant even the metal accumulated more aluminum, the yield was the highest levels and levels of trehalose were also lower. However, in general it can be inferred that the yeast C6 and CAT-1 are more tolerant to aluminum than the yeast C1 and C5. In the third test, it was concluded that the CAT-1 was the most tolerant to the metal Al compared with the wild strains C8, C10 and C11, with the main effect in reducing the viability and growth of fermentation time. Overall the strain of yeast CAT-1 showed better performance fermentation front of toxic action of aluminium.
LISTA DE FIGURAS
Figura – 1 Rendimento em etanol (%) no transcorrer de 5 ciclos fermentativos das leveduras BG-1, CAT-1, Fleischmann e PE-2 fermentando mosto de caldo com 130 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 52
Figura – 2 Evolução da biomassa (g de fermento) no transcorrer de 5 ciclos fermentativos das leveduras BG-1, CAT-1, Fleischmann e PE-2 fermentando mosto de caldo com 130 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 53
Figura – 3 Formação de glicerol (g/100 mL) no transcorrer de 5 ciclos fermentativos pelas leveduras BG-1, CAT-1, Fleischmann e PE-2 fermentando mosto de caldo com 130 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 54
Figura – 4 Viabilidade celular (%) no transcorrer de 5 ciclos fermentativos das leveduras BG, CAT, FL e PE fermentando mosto de caldo de cana com 130 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 55
Figura – 5 Teores celulares de trealose (% na matéria seca) no início do experimento e ao final do último ciclo, das leveduras BG-1, CAT-1, FL e PE-2 fermentando mosto de caldo de cana com 130 ppm de Al. Colunas dentro de um mesmo ciclo (inicial e final) seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 57
Figura – 6 Consumo de ácido sulfúrico (g/litro de pé de cuba) no transcorrer de 5 ciclos fermentativos pelas leveduras BG-1, CAT-1, FL e PE-2 fermentando mosto de caldo de cana com 130 ppm de Al.Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 58
Figura – 7 Velocidade de fermentação (g de CO2), no transcorrer de 5 ciclos fermentativos pelas leveduras BG-1, CAT-1, FL e PE-2 fermentando mosto de caldo de cana com 130 ppm de Al em função do tempo de fermentação... 59
Figura – 8 Rendimento em etanol (%) no transcorrer de 5 ciclos fermentativos das leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 61
Figura – 9 Formação de glicerol (g/100mL) no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 mg Al/L. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 62
Figura – 10 Evolução da biomassa (g de fermento) no transcorrer de 5 ciclos fermentativos das leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 63
Figura – 11 Viabilidade celular (%) no transcorrer de 5 ciclos fermentativos das leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 64
Figura – 12 Teores celulares de trealose (% na matéria seca) no início do experimento e ao final do último ciclo, das leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo (inicial e final) seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 65
Figura – 13 Consumo de ácido sulfúrico (g/litro de pé de cuba) no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 66
Figura – 14 Bioacúmulo de alumínio no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 67
Figura – 15 Velocidade de fermentação (g de CO2), no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al em função do tempo de fermentação... 68
Figura – 16 Acúmulo de alumínio em relação ao rendimento e a viabilidade de diferentes linhagens de leveduras (C1, C5, C6 e CAT-1) durante o primeiro, terceiro e quinto ciclos fermentativos, fermentando mosto de caldo-de-cana com 54 ppm de alumínio... 70
Figura – 17 Rendimento em etanol (%) no transcorrer de 5 ciclos fermentativos das leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 75
Figura – 18 Formação de glicerol (g/100mL) no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo de cana com 54 ppm. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 76
Figura – 19 Evolução da biomassa (g de fermento) no transcorrer de 5 ciclos fermentativos das leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 77
Figura – 20 Viabilidade celular (%) no transcorrer de 5 ciclos fermentativos das leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 78
Figura – 21 Teores celulares de trealose (% na matéria seca) no início do experimento e ao final do último ciclo, das leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo (inicial e final) seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 79
Figura – 22 Consumo de ácido sulfúrico (g/litro de pé de cuba) no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 80
Figura – 23 Bioacúmulo de alumínio no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância... 81
Figura – 24 Velocidade de fermentação (g de CO2), no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al em função do tempo de fermentação... 82
Figura – 25 Acúmulo de alumínio em relação ao rendimento e a viabilidade de diferentes linhagens de leveduras (C8, C10, C11 e CAT-1) durante o primeiro, terceiro e quinto ciclos fermentativos, fermentando mosto de caldo-de-cana com 54 ppm de alumínio... 84
LISTA DE TABELAS
Tabela – 1 Leveduras utilizadas nos experimentos... 42
Tabela – 2 Mostra as proporções das colônias que dominavam nas dornas de fermentação e outras Saccharomyces durante o processo fermentativo de uma destilaria na safra
de 2007... 42
Tabela – 3 Minerais encontrados no mosto... 51
Tabela – 4 Biomassa e respectiva viabilidade das leveduras (BG-1, CAT-1, FL e PE-2) do início e do final dos reciclos, bem como a taxa de perda de biomassa viva (em porcentagem) ao final do último ciclo fermentativo, empregando-se mosto de caldo com 130 ppm de alumínio... 56
Tabela – 5 Teor de peso de fermento úmido (g) no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al... 96
Tabela – 6 Rendimento fermentativo (%) no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al... 97
Tabela – 7 Teores de glicerol (mM) no vinho no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54
ppm de
Al... 98
Tabela – 8 Viabilidade (%) com valores do início do ensaio e no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al... 99
Tabela – 9 Consumo de ácido (g/L) apartir do segundo ciclo fermentativo pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al... 100
Tabela – 10 Teores de trealose inicial e final pelas leveduras C1, C5,C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al... 101
Tabela – 11 Liberação de CO2 no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al... 102
Tabela – 12 Teores de AR (%) e ART (%) no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al... 103
Tabela – 13 Etanol no vinho (%)no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al... 104
Tabela – 14 Teores de açúcares residuais glicose (%), frutose (%) e sacarose (%) no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5,C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al... 105
Tabela – 15 Peso de fermento (g) no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo-de-cana com 54 ppm de Al... 106
Tabela – 16 Teores de glicerol (g/100mL) no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo-de-cana com 54 ppm de Al... 107
Tabela – 17 Rendimento fermentativo (%) no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo-de-cana com 54 ppm de Al... 108
Tabela – 19 Consumo de ácido (g/L) a partir do segundo até o quinto ciclo fermentativo pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo-de-cana com 54 ppm de Al... 110
Tabela – 20 Teores de trealose (%) nas células no inicio do experimento e ao final do ultimo ciclo pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo-de-cana com 54 ppm de Al... 111
Tabela – 21 Liberação de CO2 no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo-de-cana com 54 ppm de Al... 112
Tabela – 22 Teores de AR (%) e ART (%) nos vinhosno transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo-de-cana com 54 ppm de Al... 113
Tabela – 23 Etanol no vinho (%)no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo-de-cana com 54 ppm de Al... 114
Tabela – 24 Teores de açúcares residuais glicose (%), frutose (%) e sacarose (%) no vinho no transcorrer de 5 ciclos fermentativos pelas leveduras C8, C10, C11 e CAT-1 fermentando mosto de caldo cana com 54 ppm de Al... 115
LISTA DE FOTOS
Foto – 1 Digestão Nitro-perclórica (Balão volumétrico de fundo arredondado)... 48
Foto – 2 Fotografia ao microscópio óptico na objetiva (400X) das linhagens de leveduras ao
final do 5o ciclo fermentativo: (1) C1 ,(2) C5 ,(3) C6 e (4) CAT-1... 71
Foto – 3 Linhagem C1 e levedura selecionada CAT-1 após 1 (A) e 3 minutos (B)... 73
Foto – 4 Fotografia ao microscópio óptico na objetiva (400X) das linhagens de leveduras ao
final do 5o ciclo fermentativo: (1)C8, (2) C10, (3) C11 e (4) CAT-1... 84
1 INTRODUÇÃO
O Brasil é o país mais avançado, do ponto de vista tecnológico da cana-de-açúcar, na produção e no uso do etanol como combustível seguido pelos Estados Unidos. A produção mundial do álcool aproxima-se de 40 bilhões de litros, dos quais se estima que 25 bilhões sejam destinados para fins energéticos. O Brasil responde por 15 bilhões de litros deste total, sendo utilizado em mistura com a gasolina no próprio país, nos EUA, UE, México, Índia, Argentina, Colômbia, e mais recentemente, no Japão. Sendo o uso exclusivo como combustível concentrado no Brasil (GAZZONI, 2008).
O etanol pode ser obtido a partir de diversas fontes de biomassa, sendo a cana-de-açúcar a forma mais econômica atualmente. Tendo ocorrido nos últimos anos uma expansão da área de produção dessa matéria-prima (BALSADI, 2007). Expansão esta que foi impulsionada por mercados nacionais e internacionais do açúcar e do álcool combustível, favorecendo positivamente o desempenho dessa cultura. Recentemente inovações tecnológicas vêm sendo alcançados pelo aumento de investimento em pesquisas, possibilitando parcerias entre as indústrias e as universidades, ocorrendo um grande avanço nas fronteiras agrícolas em direção a todos os centros agrícolas, em especial no sudeste e centro-oeste ampliando participações na produção brasileira. O Brasil desde o Programa Nacional do Álcool, vem se modernizando, buscando novas tecnologias em diversos campos da indústria sucro-alcooleira, ganhando tanto em rendimento quanto em eficiência e incentivando parcerias com instituições públicas e privadas. (AMORIM, 2005).
industrial. A toxidez possivelmente é aumentada devido aos reciclos de células conduzidos no processo denominado Melle-Boinot, onde as células de leveduras são reaproveitadas para uma fermentação subseqüente. O estudo da toxidez do alumínio, embora muito estudada em plantas, é pouco documentada em leveduras, e mais escassa ainda em processos industriais, níveis potencialmente tóxicos de alumínio foram encontrados em mostos industriais de produção de álcool combustível. Observou-se também um acúmulo de alumínio nas células de leveduras submetidas a reciclos fermentativos (ARANHA, 2002).
Nos últimos anos, diversas linhagens de leveduras têm sido isoladas do processo de fermentação industrial, para se estudar as habilidades fermentativas dessas leveduras, ou seja, que essas linhagens tolerem condições estressantes, como alto teor alcoólico, pH, contaminação, concentrações de metais no mosto, entre outros. Estas leveduras devem ser tolerantes a essas diversas condições peculiares de uma fermentação alcoólica industrial, mantendo sua viabilidade durante os reciclos fermentativos, mantendo um balanço de carboidratos de reserva que as protegem ajudando na manutenção da viabilidade celular, produzir pouco glicerol e ainda apresentar alto rendimento. (BASSO et al., 1995).
Essas linhagens isoladas foram estudadas simulando tanto quanto possível as condições fisiológicas da fermentação industrial, onde foram avaliados diversos parâmetros relacionados com a eficiência do processo fermentativo como rendimento em etanol, formação de glicerol, crescimento em biomassa, viabilidade celular, formação de ácidos orgânicos, mobilização dos carboidratos de reserva como trealose, glicogênio (ALVES, 1994) e acúmulo de alumínio ao longo dos reciclos fermentativos, pois tal acúmulo pode ser dependente das diferentes linhagens tolerantes ou não a esse metal (ARANHA, 2002). Faz-se necessário avaliar as diferentes linhagens de leveduras no sentido de diferenciar a tolerância ao alumínio, com o objetivo de melhorar o processo de produção de etanol.
2 REVISÃO BIBLIOGRÁFICA
2.1 Alumínio e Sistemas Biológicos
O Alumínio é o mais abundante metal encontrado na crosta da terra, compreendendo 7% da massa do solo. Desde então algumas espécies de plantas são
sensíveis asconcentrações micromolar de Al.
Segundo Zel (1993), a citotoxidade do alumínio já foi demonstrada em diversos sistemas biológicos, sendo considerado um fator limitante na produtividade de diversos cultivares. O estudo sobre alumínio é um ramo da moderna biotecnologia, embora haja registros desses estudos a partir de 1954.
Saccharomyces cerevisiae é um dos microrganismos mais conhecidos da
humanidade, devido a imensa utilização em processos biotecnológicos como, panificação, cervejas, vinhos, destilados em geral, produção de biomassa e etanol combustível. Assim, recentemente, maior atenção vem sendo dada à levedura pelo potencial de conversão de açúcar em álcool combustível na indústria sucroalcooleira do país. Há uma tendência na substituição do petróleo pelo etanol combustível por ser mais economicamente satisfatória alem de contribuir muito pouco em relação ao dióxido de carbono emitido pela gasolina na atmosfera, o que sugere a possibilidade de maior exploração do etanol produzido pela levedura, sendo assim o etanol combustível produzido a partir de fermentação de caldo-de-cana já é uma das principias fontes de energia renovável do Brasil e do mundo.
contribuído para a acidificação desses solos aumentando a quantidade de alumínio
solúvel Al3+ a forma mais tóxica do metal acarretando problemas ambientais
(KOCHIAN, 1995). Atenção esta, por ser também onde a expansão agrícola, sobre tudo a canavieira, estar se desenvolvendo com máxima rapidez para solos com essas características citadas acima. O Cerrado brasileiro ocupa uma área de, aproximadamente, 205 milhões de hectares, sendo que, da sua área total, 100 milhões de hectares estão disponíveis para o cultivo, dos quais, cerca de 12 milhões estão ocupados com culturas anuais, 40 milhões com pastagens cultivadas e 2 milhões com culturas perenes, restando, ainda, pelo menos, 46 milhões de hectares a explorar, além dos 79 milhões que constituem as reservas legais (RESCK, 2001). A maioria desses solos são Oxissolos, que são ácidos de baixa fertilidade, sendo a sua produtividade baixa em estado natural (LOPES, 1983; MALAVOLTA; KLIEMANN, 1985; RESCK, 2001). A correção da acidez e a adubação desses solos são imprescindíveis para a obtenção de elevada produtividade das culturas (FAGERIA, 2001). É importante destacar que a calagem é a prática mais efetiva e barata para a correção da acidez dos solos.
Para Lima et al. (2002) que estudou saturação por alumínio em soja nos solos de cerrado, a saturação do Al influencia principalmente a produção de massa seca de soja e que a produção desse grão em solos ácidos de Cerrado aumenta com a aplicação de calagem.
Jackson, 1982., apud MacDiarmind e Gardner (1996) demonstrou o efeito dos ácidos orgânicos cítrico e málico sobre a toxicidade do alumínio em raízes de plantas, e descobriu que o complexo Al-ácido não são tóxico para as células, e a secreção de ácidos orgânicos pelas raízes podem se sugerir a possibilidade de um mecanismo de exclusão do alumínio nas plantas.
2.2 Alumínio e suas interações
O alumínio está presente na maioria dos solos brasileiros (PRADO, 2007) no estado insolúvel, mas com uso de adubação incorreta e utilização de calcário para preparo da terra, a exposição do metal frente aos cultivares acaba aflorando na forma
de Al3+ sua forma mais solúvel e tóxica, contudo, essa toxidez acaba afetando diversas
culturas de clima tropical, sendo tóxico também para peixes, acidificando o meio em que se encontram. Em humanos, o Al está caracterizado em três efeitos tóxicos: a. efeito no trato gastrointestinal, b. um potencial que causa dano pulmonar se inalado e c. uma capacidade de exercer toxicidade sistêmica se absorvido (ALFREY, 1986). No homem é normal a concentração de alumínio no plasma sanguíneo cerca de 5 µg/L. Sendo esse metal abundante em nosso meio, estamos continuamente expostos a ele, e mesmo em concentrações baixas absorvemos ou retemos o elemento. Métodos indiretos de quantificação de alterações na urina tentando estimar o alumínio excretado e utilização de tecidos para fins de entendimento de ação do elemento em órgãos humanos vêm sendo estudados, mas não bem demonstrados na literatura.
A toxicidade do alumínio também foi relacionada a diversos estados patológicos em humanos, incluindo o distúrbio neurológico como o mal de Alzheimer (HOUELAND, 1990) e síndromes associadas ao tratamento de hemodiálises prolongadas (ARIEFF, 1990) tendo em vista que a água utilizada nesses tratamentos teria alta quantidade do metal em questão. Portanto a citotoxicidade do alumínio parece ser um fenômeno bastante generalizado, conforme sugeriram MacDiarmid e Gardner (1996).
Segundo Miller (1958) em um de seus estudos envolvendo microrganismos e concentrações de alumínio, observou que existiam evidências de que o metal afetaria o crescimento de fungos e leveduras.
indesejáveis contidos em determinados utensílios, como o alumínio entre outros, podem migrar para os alimentos durante o processo de cocção (QUINTAES, 2000).
É sabido que as leveduras acumulam metais em seu interior, indústrias de alimentos que confeccionam suplementos animais e humanos, estão utilizando leveduras para enriquecer alimentos devido à grande fonte de proteínas vindo desses microrganismos, atualmente esta prática vem crescendo a cada dia, sendo denominada como alimentos advindos de “single cell protein”. Contudo, se faz necessário estudar intensivamente para obter informações cada vez mais esclarecedoras sobre o mecanismo de ação tóxica do íon alumínio nos sistemas biológicos.
2.2.1 Interação levedura-Al
Hamilton et al. (2001) investigaram uma enzima denominada H+ATPase vacuolar
que é ativada por um stress ao alumínio em um cultivar de trigo com Al-resistente, sugerindo que a indução dessa enzima pode ser uma adaptação característica
envolvido com Al resistente. Este estudo sugere que a ativação da H+ATPase vacuolar
esta envolvida com Al resistente, pois essa enzima esta relacionada com transporte de membrana em leveduras, fazendo com que haja um desequilíbrio de potenciais eletroquímico da levedura levando a um acúmulo de prótons e diminuição do pH
citoplasmático. Sabe-se que a atividade da enzima H+ATPase vacuolar pode contribuir
com a energização do tonoplasma da membrana, possibilitando a manutenção do mesmo que regula o potencial eletroquímico que está relacionado com processo atividade de transporte secundário envolvido em Al resistente. Indicando que a levedura foi excelente modelo de microrganismo para investigar o efeito do Al sobre a ATPase em plantas.
__________________
¹BASSO, L. C. Escola Superior de Agricultura “Luiz de Queiroz”.
para a toxicidade do alumínio nos ecossistemas e em humanos. Na literatura nacional temos poucos trabalhos relatando efeitos do alumínio sobre a fermentação alcoólica e tais relatos são raros na literatura estrangeira. Neste contexto Basso (1989) e seus colaboradores verificaram os possíveis efeitos tóxicos do alumínio sobre a fermentação alcoólica utilizando fermento prensado Fleischmann em três diferentes tipos de mosto (melaço, xarope e mosto sintético), acrescido de diferentes concentrações de Al, com 6 ciclos fermentativos e concluíram que as leveduras em condições industriais podem estar expostas a doses tóxicas de alumínio e que esses efeitos tóxicos acabavam prejudicando no sentido de diminuição da viabilidade celular e consumo excessivo das reservas de carboidratos. Os efeitos mesmo em doses pequenas, 10 ppm de Al, já apresentavam toxicidade para as leveduras, não acontecendo o mesmo com doses de até 100 ppm de Al em mosto de melaço, sugerindo a possibilidade de agentes complexantes do Al como ácidos orgânicos e aminoácidos, atenuando tal toxidez.
O que muito se estuda atualmente é identificação e caracterização de leveduras
ácidos tolerantes ao alumínio Al3+, segundo Kanazawa (2005), que estudou a tal fato
para utilizar esses microrganismos como bio e fito-remediação em solos ácidos com alta concentração de Al presente. Outros estudos se baseiam em identificação de genes de leveduras que conferem resistência a competição do íon Al pelo sistema de transporte de Mg para o interior do microrganismo MacDiarmid e Gardner(1998).
O mecanismo de ação do Al sobre as leveduras não é muito conhecido pelos
pesquisadores, o modelo que se tem, aborda a ligação do íon Al3+ ao sistema ATP-Mg
tomando o lugar do Mg se tornando ATP-Al, acabando por esgotar com fonte de
energia do complexo ATP-Mg não conseguindo a levedura excretar os H+ para fora da
célula, conseqüentemente deixando de promover reações bioquímicas necessárias
para a manutenção da integridade da levedura (BASSO1).
diminuição dos teores de carboidratos de reserva trealose e glicogênio, neste experimento o autor relata que houve um aumento da produção de etanol nos primeiros ciclos, desviando mais açúcar para produzir álcool e menos para formação de biomassa, glicerol e formação dos carboidratos de reserva, concluindo que esse aumento de produção não tem vantagem alguma para processos industriais frente aos estresses impostos a levedura nos reciclos subseqüentes praticados nas indústrias de produção de etanol combustível.
Em uma dissertação de mestrado (ARANHA, 2002) mostrou o efeito do alumínio sobre a fermentação alcoólica utilizando duas leveduras, uma de panificação (Fleishmann) e outra selecionada e utilizada amplamente no processo de produção de etanol combustível. Para isso, cultivou as leveduras empregando-se mosto semi-sintético composto de extrato de levedura, e constatou que a ação tóxica do alumínio, embora discreta, foi caracterizada pela redução da formação da biomassa e diminuição da viabilidade celular. A diminuição da viabilidade ocorre possivelmente devido as reduções de trealose e glicogênio. O acúmulo do alumínio nas células é promovido pelo teor do elemento no mosto industrial e esse acúmulo é mais acentuado na levedura
Fleischmann, quando comparada com uma levedura selecionada denominada PE-2.
___________________
² CAMPOS, D. C. Fermentec: Assistência Técnica em Fermentação Alcoólica. 2.3 Alumínio e o processo fermentativo
Já foi constatadas a presença de alumínio em mosto industriais, demonstrando que quantidades tóxicas do metal a partir de 30 mg/L tanto em caldo quanto em xarope, acarreta efeito estressante sobre as leveduras (BASSO, 1989). O alumínio bloqueia o crescimento da levedura e a formação de trealose, reduzindo a velocidade de fermentação, mas em conseqüência se observa um aumento na eficiência fermentativa e diminuição na formação de glicerol, mostrados por (BASSO, 2007). Mas tais incrementos na eficiência são inequívocos, não podendo beneficiar-se dos efeitos aparentemente benéficos, pois queda acentuada na viabilidade e nos teores de trealose é evidenciada na presença do alumínio.
Na safra de 06/07 foi constatado presença de Al acima de 500 mg por litro de
caldo-de-cana em uma destilaria, conforme (CAMPOS2). Em laboratório
Mariano-da-Silva et al.(2004) constataram que concentrações mesmo que em doses milimolares, 10 mmol de Al, influenciaram o crescimento da levedura Fleischmann, uma linhagem amplamente utilizada em panificação.
2.4 Técnica de cariotipagem na identificação de leveduras contaminantes
O monitoramento dos processos de fermentação alcoólica exige o emprego de técnicas de identificação que permitam distinguir diferentes cepas de levedura, bem como a avaliação de sua performance como produtora de etanol.
Os sistemas clássicos de identificação de leveduras baseiam-se em características morfológicas e fisiológicas e são incapazes de distinguir facilmente algumas espécies e, sobretudo cepas de uma mesma espécie. Vários autores têm se empenhado na identificação de leveduras contaminantes da fermentação alcoólica. Castro (1995) isolou e identificou, a partir de amostras de vinho levedurado e fermento
centrifugado, principalmente os gêneros Candida (42,8%) e Saccharomyces (38,1%).
Oliveira et al. (1996) isolaram representantes de Saccharomyces capensis, S. bayanus,
Pichia ohmeri, Trichosporon brassicae, Torulaspora pretoriensis e Kluyveromyces vanudenii em unidades de fermentação alcoólica. Cabrini (1999a) e Gallo (1999b),
identificaram através da taxonomia numérica principalmente Saccharomyces cerevisae
no leite de leveduras de duas unidades de produção de etanol.
A técnica de cariotipagem é baseada na separação eletroforética do DNA cromossômico intacto, tal técnica que já foi utilizada na identificação de leveduras nas indústrias de vinho e cerveja, foi adaptada para fornecer informações necessárias a indústria alcooleira sobre as leveduras presentes nos processos de produção de etanol combustível, permitindo acompanhar a permanência das linhagens tradicionais ao longo de várias safras. Pesquisas mostraram que as leveduras contaminantes do processo podem vim de diferentes origens como das instalações industriais, da terra que vem do campo, da cana e do mel empregados nas indústrias atualmente, onde acabam competindo com as linhagens tradicionais empregadas no início da safra.
diferenciação de gêneros, espécies, bem como de diferentes linhagens de uma mesma espécie, permite concluir que as leveduras iniciais (TA, NF e Fleischmann), ou seja, as que começaram a safra, não permaneceram nas dornas sendo completamente substituídas após 40 dias de processo (BASSO, 1996).
Em estudo similar conduzidos por Basso e Amorim (1995), a seleção de linhagens de leveduras dominantes e persistentes no processo industrial foram identificadas e isoladas com o auxílio da técnica de cariotipagem, estudo este que abrangeu 20 a 25 destilarias, dando especial atenção às leveduras isoladas de destilarias com bom desempenho fermentativo, onde tais leveduras foram reintroduzidas no processo industrial, monitorada a sua permanência a longo da safra mostrando ótimos resultados com a linhagem PE-2 dominando quase que absoluta na dorna de fermentação.
3 MATERIAL E MÉTODOS
Os experimentos foram realizados nos laboratórios de Bioquímica do Departamento de Ciências Biológicas da Escola Superior de Agricultura “Luiz de Queiroz” (ESALQ/USP) em Piracicaba - S.P.
Os objetivos propostos foram atingidos mediante um plano de trabalho baseado
em 3 diferentes tipos de experimentos.
3.1 Linhagens de Saccharomyces cerevisiae
Foram utilizadas quatro linhagens de leveduras amplamente utilizadas pelas indústrias sucroalcooleiras, na qual são conhecidas pela capacidade de suportarem estresses de um processo industrial e permanecerem em reciclos fermentativos como é comum nos processos de produção de etanol, denominado Melle-Boinot, prática conduzida atualmente no setor sucroalcooleiro, onde faz uma recirculação de fermento
de um ciclo fermentativo para o outro. As S. cerevisiae, linhagens industriais CAT-1,
Tabela 1 – Leveduras utilizadas nos experimentos
CAT‐1 Industrial
BG‐1 Industrial
PE‐2 Industrial
FLE* Industrial
C 1** Selvagem
C 5** Selvagem
C 6** Selvagem
C 8** Selvagem
C 10** Selvagem
C 11** Selvagem
*Levedura Fleischmann de panificação
**Leveduras selvagens cariotipadas de uma destilaria (fermentando com altos teores de alumínio)
Tabela – 2 Tabela mostrando as proporções das colônias de leveduras que dominavam e outras
Saccharomyces durante o processo fermentativo. Na figura abaixo da tabela estão as bandas
dos perfis eletroforéticos das colônias de leveduras isoladas de uma destilaria no início da safra de 2007
Leveduras Observadas Proporção na Amostra (%) Perfis Eletroforéticos (Colônias)
Saccharomyces Dominante 1 (D1) 64 1,2,3,4,7,8,9
3.2 Multiplicação da levedura
Nos 3 experimentos realizados fez-se o mesmo procedimento de multiplicação das leveduras, a reativação foi feita repicando com uma alça a cultura contida no tudo com YEPD solido mais óleo mineral em tubos contendo 5 mL de meio YEPD líquido (2,0% glicose, 1,0% extrato de levedura e 1,0% peptona) seguida de incubação à 32 + 1ºC por 24 horas. Posteriormente os 5 mL foram transferidos para um erlenmeyer contendo 100 mL de meio YEPD e incubados sob mesmas condições descritas anteriormente. Após o período de incubação de 24 horas todo o volume do meio de crescimento foi transferido para um erlenmeyer contendo 500 mL de melaço industrial (mel final da Usina da Pedra safra 2006/07) autoclavado à 121ºC durante 20 minutos, diluído com água destilada até atingir 10% de ART (açúcares redutores totais) e
deixados à temperatura ambiente. Terminada a multiplicação, os recipientes foram
colocados em câmara fria (4o C) durante 48 horas para a decantação das células em
suspensão e, em seguida, foram centrifugadas a 800 xg por 20 min originando assim a massa de levedura necessária para os experimentos.
3.3 Ensaios fermentativos
Os ensaios foram realizados em 5 ciclos fermentativos, sendo a biomassa das dez diferentes linhagens, obtidas durante a fase de multiplicação, em que foram ajustadas em torno de 7,1 gramas para todos os ensaios. Cada levedura foi dividida em três tubos de ensaio, sendo consideradas repetições do mesmo tratamento, onde foram adicionados 60 mL de mosto de caldo de cana já acrescido de alumínio, fracionados em 3 porções de 20 mL cada, espaçadas de 1,5 hora. Estes tubos foram mantidos em
temperatura ambiente em torno de 29o C e a cada 1,5 hora foi determinada a
quantidade CO2 liberada. Após 21 horas de fermentação, os tubos foram centrifugados,
de etanol, açúcares, glicerol e pH. A biomassa para o inicio do ensaio foi obtida pela
ressuspensão em 20 mL de mosto, a partir do segundo ciclo a biomassa úmida foi
ressupensa com 15 mL de água milliQ mais 5 mL de vinho da fermentação anterior, dando início ao novo ciclo fermentativo. Utilizando este procedimento para os demais ciclos.
3.4 Experimentos com mosto de caldo-de-cana
O experimento 1 foi realizado empregando-se mosto de caldo de cana diluído
para 19% de ART (estimado mediante cromatografia iônica) e acrescido de AlCl3.6H2O
para resultar em 130 mg Al/L. O teor de magnésio deste mosto foi de 117 mg Mg/L,
estimado por espectrometria de chama. O pH do mosto foi ajustado para 4,0 com HCl.
Neste experimento foi realizado um estudo comparativo entre as leveduras Fleischmann de panificação, CAT-1, PE-2 e BG-1 frente ao alumínio.
Os experimentos 2 e 3 foram realizados empregando-se mosto de caldo de cana diluído para 19% de ART,contendo 88 mg Mg/L, com o pH ajustado para 4,5 (devido a
adição de AlCl3.6H2O) onde foi acrescido na proporção de 2 mM resultando em 54 mg
Al/L de caldo. Nestes experimentos foram utilizadas leveduras selvagens, aquelas que aparecem nos processos industriais devido as diversas situações ou por paradas por chuvas ou algum incidente inesperado, essas linhagens são isoladas pelo método de cariotipagem e então levadas para o laboratório para testes de desempenho fermentativo, o nome dado as referentes linhagens são de suas colônias que foram escolhidas para a cariotipagem denominadas colônias C1, C5, C6, C8, C10 e C11
comparadas em experimento com a levedura selecionada CAT-1 comercialmente
utilizada em grandes fábricas e destilarias no parque alcooleiro.
20 mL de água milliQ (deionizada) e alimentado com 60 mL de mosto de caldo de cana já acrescido de alumínio na concentração dos diferentes ensaios (primeiro ensaio 130 ppm Al e segundo e terceiro ensaio 54 ppm Al), fracionado em 3 porções de 20 mL cada, espaçadas a cada 1,5 hora. A partir da segunda fermentação, após o tratamento com ácido sulfúrico ajustando o pH para 2,5 por 1 hora, a biomassa úmida foi ressuspendida com 15 mL de água milliQ mais 5 mL de vinho da fermentação anterior (primeira fermentação), simulando assim uma concentração na centrifuga de 62-64%. Os experimentos foram conduzidos em triplicata para cada tratamento.
A velocidade de fermentação foi avaliada pela perda de (CO2) a cada 1,5 hora, e
após o seu término, os tubos foram centrifugados (800 xg por 15 minutos), sendo a massa de levedura pesada e reutilizada num ciclo fermentativo subseqüente, precedida do tratamento com ácido sulfúrico. No vinho delevedurado, foram estimados os teores de glicerol e açúcares residuais (pela técnica da cromatografia líquida de alta eficiência), teor de álcool e valor de pH, segundo preconizado por Zago et al (1989).
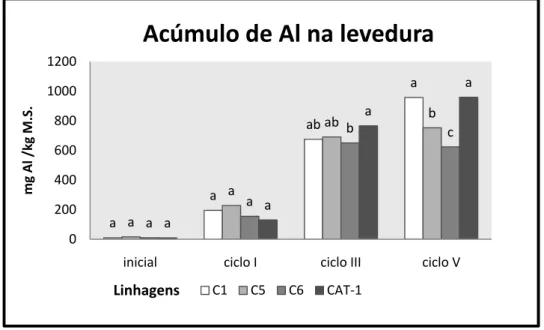
No segundo experimento foram quantificados o bioacúmulo de alumínio nas
leveduras (estimado por digestão nitroperclórica) na biomassa (inicial) do meio de
propagação (antes da adição do AlCl3.6H2O) e ao final do 1º, 3º e 5º ciclos recolhendo
alíquotas de 400 mg de matéria úmida (100 mg de matéria seca 25%) para análise. Já no terceiro experimento também foram quantificados o bioacúmulo do alumínio na biomassa inicial e ao final do 3o e 5o ciclos.
3.5 Determinação do pH dos vinhos delevedurados
3.6 Determinação de etanol e densidade no vinho delevedurado
Os vinhos brutos foram centrifugados a 800 xg por 15 minutos, em centrifuga Sorvall, modelo RT 6000D e, em seguida, 10 mL do vinho delevedurado (sobrenadante) foram transferidos com uma pipeta volumétrica para o microdestilador Kjeldhal, sendo destilados por arraste em vapor, recolhendo-se 50 mL do destilado no qual contem água, em balão volumétrico. As amostras destiladas foram transferidas para o densímetro digital Anton-Paar DMA-48. As densidades obtidas dos destilados foram transformadas em concentrações de etanol (%v/v) pelo densímetro e a concentração resultante foi multiplicada por 5, para compensar a diluição ocorrida durante a destilação (ZAGO et al., 1996).
3.7 Determinações de glicerol e açúcares no caldo e vinhos delevedurados
Nos vinhos delevedurados foram estimados os teores de glicerol e açúcares residuais pela técnica de cromatografia líquida de alta eficiência, utilizando cromatógrafo iônico Dionex-DX-300, equipado com coluna Carbopac-1 e NaOH 100 mM como eluente e detector de amperometria de pulso com eletrodo de ouro.
3.8 Determinações da viabilidade celular e contaminação bacteriana
identificação de contaminação por bactérias foi mediante coloração diferencial com azul de metileno em solução tampão fosfato, e observação ao microscópio óptico.
3.9 Extração e determinação de trealose na levedura
Foram estimados os teores de trealose nas leveduras, no início do ensaio e ao final do último ciclo fermentativo, após extração seletiva, em triplicata de 200 mg de
massa úmida com 2 mL de solução de ácido tricloroacético - CCl3COOH (0,5 mol.L-1),
em banho de gelo, durante 20 minutos (TREVELYAN; HARRINSON, 1956) seguido de centrifugação 700 xg por 5 minutos, em centrifuga Excelsa Baby da Fanem. Em seguida, foi determinada a trealose nos extratos centrifugados, através de reação
colorimétrica com antrona (500 mg.L-1) e tiouréia (10 g.L-1) em meio sulfúrico (75% de
ácido sulfúrico P.A. e 25% de água destilada) (BRIN, 1966, apud CHERUBIN, 2003). Após reação a leitura foi feita em cromatógrafo Dionex.
3.10 Determinações de alumínio na levedura
A determinação de alumínio foi realizada no mosto de caldo empregado no
segundo experimento (54 mg Al/L) e nas leveduras do início, 1o, 3o e último ciclos
fermentativos; no mosto de caldo empregado no terceiro experimento (54 mg Al/L) e
nas leveduras do início, 3o e último ciclos fermentativos, mediante digestão
extrato obtido na digestão (pH acertado para 3,5 a 4,0). Utilizou também branco e padrão de 2 ppm de alumínio, nos tubos de ensaio contendo 2,5 do extrato foram adicionados 3 mL do tampão acetato pH 3,8, 1 mL de indicador xilenol – Orange 0,15%
(15 g em 100 mL de água milliQ), deixado 1,5 hora em banho – Maria a 40oC, após o
resfriamento adicionou-se 3,5 mL de EDTA 0,0072 M, deixado em temperatura ambiente por 1 hora, após foram lidos os tubos a 550 nm no espectrofotômetro SPECTRNIC 88 – Bausch & Lomb.
Foto – 1 Bloco digestor de aquecimento com balões de digestões (fundo cônico)
3.11 Análises estatísticas
(PIMENTEL-
GOMES, 2002). Todas as análises estatísticas foram realizadas através do programa estatístico SAS (Statistical Analysis System) versão 8.2.
4 RESULTADOS E DISCUSSÃO
4.1 Experimento 1
Utilizou-se mosto de caldo de cana, pH 5,0, com 130 mg Al/L e o teor de magnésio do mosto foi de 117 mg/L, no qual comparou-se as leveduras BG-1, CAT-1, Fleischmann e PE-2, frente à ação tóxica do alumínio. As leveduras foram propagadas em anaerobiose em meio de mel (Usina São Francisco) com 10% de ART. O meio foi decantado, separando a parte liquida da biomassa onde foram coletadas as leveduras mediante centrifugação nos tubos de fermentação.
Os minerais deste mosto foram analisados pelo Instituto Agronômico (Centro de P & D de Solos e Recursos Ambientais – Qualidade de Solo), na tabela 2 se apresentam os minerais encontrados.
Tabela 3 – Minerais encontrados no mosto
Parâmetros Unidade Repetição 1 Repetição 2 Data do Ensaio
Alumínio mg de Al/L 74,9 75,2 24/1/2007 Cálcio mg de Ca/L 98,6 85,0 24/1/2007 Cobre mg de Cu/L 2,2 2,2 24/1/2007 Enxofre mg de S/L 75,6 62,6 24/1/2007 Ferro mg de Fe/L 13,3 13,4 24/1/2007 Fósforo mg de P/L 24,9 25,1 24/1/2007 Magnésio mg de Mg/L 119 115 24/1/2007 Manganês mg de Mn/L 1,8 1,8 24/1/2007 Zinco mg de Zn/L 1,0 1,1 24/2/2007 Potássio mg de K/L 620 620 24/2/2007
4.1.1 Rendimento fermentativo
No experimento 1, o rendimento fermentativo (figura 1), se apresentou, no geral, um pouco mais elevado para as leveduras PE-2 e CAT-1, mas estatisticamente apenas a Fleischmann mostrou redução neste parâmetro, enquanto a BG-1 mostrou um valor intermediário.
Figura 1 – Rendimento em etanol (%) no transcorrer de 5 ciclos fermentativos das leveduras BG-1, CAT-1, Fleischmann e PE-2 fermentando mosto de caldo com 130 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
a b
b b
a a
a a a a
a
b b c
b a
a a a a
80 85 90 95 100
1 2 3 4 5
Rendimento
(%)
BG CAT FL PE ciclos
4.1.2 Crescimento em biomassa
Ao final dos reciclos fermentativos a biomassa da levedura PE-2 foi a mais elevada enquanto a da CAT-1 foi a menor (figura 2), no entanto a viabilidade celular (figura 4) experimentou variações bem acentuadas, sendo ainda bastante elevadas ao final do último ciclo fermentativo para as leveduras BG-1 e CAT-1 (93 e 94%, respectivamente), e mais baixas para PE-2 e Fleischmann (74 e 40%).
Figura – 2 Evolução da biomassa (g de fermento) no transcorrer de 5 ciclos fermentativos das leveduras BG-1, CAT-1, Fleischmann e PE-2 fermentando mosto de caldo com 130 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
c c
b
b
d
b b
b
a
c
a a
a
b
b c
d
c b
a
7 8 9
1 2 3 4 5
Biomassa
(g/100mL)
BG CAT FL PE
4.1.3 Formação de glicerol
Tais valores expressados na (figura 3) formação de glicerol estão em concordância com as formações de glicerol, que mostraram relação inversa com o rendimento (figura 1), sem, no entanto mostrar significâncias estatísticas.
Figura – 3 Formação de glicerol (g/100 mL) no transcorrer de 5 ciclos fermentativos pelas leveduras BG-1, CAT-BG-1, Fleischmann e PE-2 fermentando mosto de caldo com 130 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
a
a b b b
b a
c c c
b a a
a
a b
b b b
c
0,0 0,2 0,4 0,6 0,8 1,0
1 2 3 4 5
Glicerol
(%)
BG CAT FL PE
4.1.4 Viabilidade da levedura
O experimento foi conduzido com sangria de 5,7% do fermento a cada ciclo fermentativo, de sorte que em função da capacidade de propagação durante a fermentação e da intensidade de morte das células de cada linhagem, se pode introduzir um novo parâmetro para se avaliar a sustentabilidade das linhagens ao longo dos reciclos. Com as quantidades de biomassa iniciais e ao final do último ciclo, bem como com as respectivas viabilidades celulares, calculou-se a perda de biomassa viva (em % da inicial) para cada linhagem em 5 ciclos fermentativos.
Figura 4 - Viabilidade celular (%) no transcorrer de 5 ciclos fermentativos das leveduras BG, CAT, FL e PE fermentando mosto de caldo de cana com 130 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
a a a a
a
a a a
a a
c c
c
c
c
b b
b
b b
30 40 50 60 70 80 90 100 110
1 2 3 4 5
Viabilidade
(%)
BG CAT FL PE
Podemos observar que a CAT-1 foi mais eficiente em manter biomassa viva ao final dos reciclos, seguida de perto pela BG-1, mas se distanciando bastante da PE-2 e da Fleischmann (figura 4). Pode-se então inferir que, em condições de fermentação com reciclos empregando-se mostos de caldo com níveis tóxicos de alumínio, as leveduras Fleischmann e PE-2 seriam mais rapidamente substituídas do que as leveduras CAT-1 e BG-1, mas com uma pequena vantagem para a linhagem CAT-1.
Tabela – 4 Biomassa e respectiva viabilidade das leveduras (BG-1, CAT-1, FL e PE-2) do início e do final dos reciclos, bem como a taxa de perda de biomassa viva (em porcentagem) ao final do último ciclo fermentativo, empregando-se mosto de caldo com 130 ppm de alumínio
Levedura
Fermento Inicial Fermento Final
Perda de Biomassa Viva (%) Biomassa
(g)
Viabilidade (%)
Biomassa (g)
Viabilidade (%)
BG‐1 7,16 100 7,2 93 6,4
CAT‐1 7,07 99,7 7,37 94 1,7
FL* 7,05 98,3 7,58 40 56,3
PE‐2 7,15 99,6 7,81 74 18,8
4.1.5 Trealose
As linhagens CAT-1 e PE-2 foram as que iniciaram as fermentações com os maiores teores de trealose quando comparadas com a BG-1 e Fleischmann (figura 5), mas a mobilização desta reserva foi diferente para cada levedura. Assim, ao final dos reciclos, a BG-1 preservava os maiores teores de trealose, enquanto a CAT-1 e Fleischmann mostraram os menores teores. Já a PE-2 mostrou teor sem diferença estatística entre ambos os grupos de leveduras.
Figura - 5Teores celulares de trealose (% na matéria seca) no início do experimento e ao final do último ciclo, das leveduras BG, CAT, FL e PE fermentando mosto de caldo de cana com 130 ppm de Al. Colunas dentro de um mesmo ciclo (inicial e final) seguidas de letras iguais não diferem estatisticamente a um nível de 5 % de significância
c
a a
b c
b b
ab
0 1 2 3 4 5 6 7 8
Inicial Final
Trealose
(%)
BG CAT FL PE
O consumo de ácido sulfúrico no tratamento do fermento foi superior para a levedura Fleischmann, mas sem diferenças estatísticas entre as demais linhagens. É provável que a intensa queda de viabilidade da levedura Fleischmann tenha incrementado o poder tamponante do pé de cuba, causando assim tal alteração neste parâmetro (figura 6).
Figura – 6 Consumo de ácido sulfúrico (g/litro de pé de cuba) no transcorrer de 5 ciclos fermentativos pelas leveduras BG, CAT, FL e PE fermentando mosto de caldo de cana com 130 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
c
b
b
c
c a b
b a
a
a
a b
b
b
b
0,0 0,1 0,2 0,3 0,4 0,5 0,6
2 3 4 5
H
2SO
4(g/L)
BG CAT FL PE
Linhagens
4.1.6 Velocidade de fermentação
A velocidade de fermentação mostra uma correlação com a viabilidade celular, sendo bem mais reduzida para a levedura Fleischmann, porém mais elevada para a levedura BG-1, embora tal linhagem tivesse apresentado viabilidade semelhante à da CAT-1 (figura 7). No caso da PE-2 a sua menor viabilidade possivelmente tenha colaborado para a redução na velocidade de fermentação, não se descartando o envolvimento de que outros fatores foram afetados pela presença do alumínio.
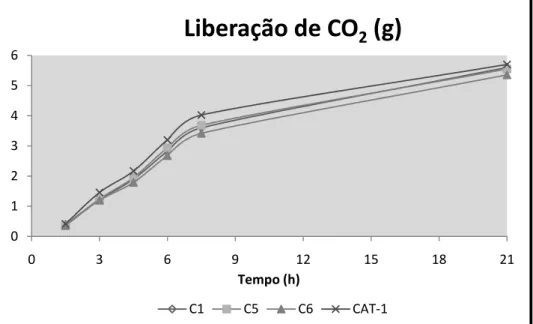
Figura - 7 Velocidade de fermentação (g de CO2), no transcorrer de 5 ciclos fermentativos pelas leveduras BG, CAT, FL e PE fermentando mosto de caldo de cana com 130 ppm de Al em função do tempo de fermentação
Os teores de açúcares residuais se apresentaram baixos e sem diferenças entre
as linhagens, assim como a contaminação bacteriana que se mostrou inferior a 105
bastonestes/ml durante os ciclos fermentativos.
0 1 2 3 4 5 6 7
0 3 6 9 12 15 18 21
Tempo (h)
Liberação
de
CO
2(g)
4.1.7 Considerações sobre o experimento 1
Os resultados obtidos, dentro das condições experimentais empregadas, permitem concluir que nível tóxico de alumínio em mosto de caldo exerce uma ação diferenciada em relação às leveduras industriais. Os diversos parâmetros analisados se mostram diferentemente alterados quando comparados com as diferentes linhagens. Diferenças sutis entre as linhagens BG-1 e CAT-1 são observadas, as quais, dependendo do parâmetro analisado podem beneficiar uma ou outra linhagem. No entanto, de uma forma geral se pode inferir que as leveduras BG-1 e CAT-1 são mais tolerantes ao alumínio do que a levedura PE-2. A linhagem Fleischmann foi a mais vulnerável em relação a todos os parâmetros avaliados.
4.2 Experimento 2
Neste experimento utilizou-se mosto de caldo de cana (~23% ART, 2,62 ppm de Al e 88 ppm de Mg contidos no clado-de-cana) diluído para 19% de ART e acrescido de
2 mM de AlCl3.6H2O para resultar em 54 mg de Al/litro. Sendo que neste estudo
4.2.1 Rendimento Fermentativo
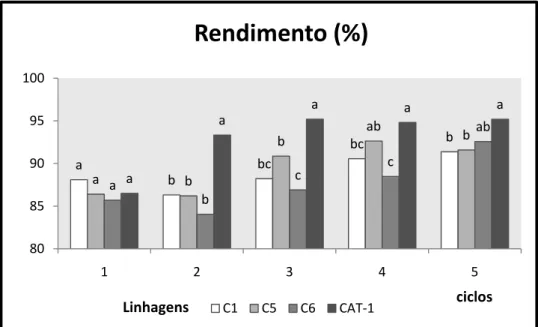
Neste experimento, pode-se observar que houve maior rendimento fermentativo (figura 8) para a levedura CAT-1 seguida pela C5 que nos dois últimos ciclos não tiveram diferenças estatísticas. Porem, as leveduras C1 e C6 mostraram menor rendimento fermentativo igualmente sem diferenças estatísticas.
O rendimento sofreu redução bem acentuada pela presença do alumínio nos três primeiros ciclos para as linhagens C1, C5 e C6, o que não ocorreu com a CAT-1, onde obteve um baixo rendimento somente no primeiro ciclo possivelmente pela levedura estar se adaptando ao meio estressante em que se encontrava.
Figura 8 – Rendimento em etanol (%) no transcorrer de 5 ciclos fermentativos das leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
a
b
bc
bc b
a b
b
ab
b
a
b
c c
ab
a
a
a a a
80 85 90 95 100
1 2 3 4 5
Rendimento
(%)
C1 C5 C6 CAT‐1
4.2.2 Formação de Glicerol
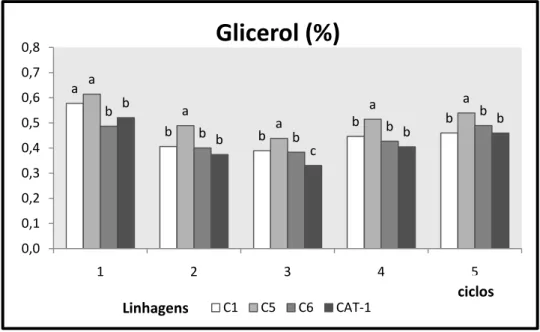
Os valores demonstrados na figura (figura 9) mostraram uma relação inversa com os valores de rendimento onde houve uma diminuição de formação de glicerol mais acentuada para a CAT-1 possivelmente pela ação estressante do metal alumínio contido no meio sem, no entanto mostrar uma diferença estatística significativa, embora se possa perceber uma tendência de aumento de formação de glicerol pela levedura CAT-1 nos 4 e 5 ciclos.
Figura - 9 Formação de glicerol (g/100mL) no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 mg Al/L. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
a
b b b b
a
a
a
a a
b
b b b
b b
b
c
b
b
0,0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
1 2 3 4 5
Glicerol
(%)
C1 C5 C6 CAT‐1
Linhagens
4.2.3 Crescimento em Biomassa
Com o progredir dos reciclos fermentativos se observa uma redução nos 2o e 3º
ciclos da biomassa da levedura C6 mas ainda se manteve com maior taxa formação de biomassa em relação a levedura CAT-1 (figura 10), o que juntamente com a diminuição no conteúdo de trealose (figura 12), permitiram um aumento na formação de etanol. Observando a viabilidade (figura 11) notamos uma queda significativa principalmente para a levedura CAT-1 nos dois últimos ciclos (75,4% e 70,9%), e mais baixo ainda para a levedura C1 (65,5%). E que em decorrência dessa diminuição na viabilidade para todas as linhagens, se observa também uma redução na velocidade de fermentação possivelmente pela presença do alumínio no meio de fermentação.
Figura – 10 Evolução da biomassa (g de fermento/100 mL) no transcorrer de 5 ciclos fermentativos das leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
bc
d b b b
c c b b b
a
a a a
a
b b
b b c
0 1 2 3 4 5 6 7 8 9 10
1 2 3 4 5
Biomassa
(g/100mL)
C1 C5 C6 CAT‐1
Figura 11 - Viabilidade celular (%) no transcorrer de 5 ciclos fermentativos das leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
b
b
b
a
b b
c c
a
a b
ab
c a
a a
a
a
a
a
30 40 50 60 70 80 90 100 110
1 2 3 4 5
Viabilidade
(%)
C1 C5 C6 CAT‐1
4.2.4 Trealose
As leveduras que iniciaram as fermentações com os maiores teores de trealose foram as C1, C5 e CAT-1 (figura 12), sendo a mobilização desta reserva diferente para cada linhagem. Ao final dos reciclos, as leveduras C1 e C5 preservavam os maiores teores de trealose, enquanto a C6 e a CAT-1 mostraram-se com menores teores, sendo que a CAT-1 mostrou teores diferentes estatisticamente das demais linhagens.
Figura - 12Teores celulares de trealose (% na matéria seca) no início do experimento e ao final do último ciclo, das leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo (inicial e final) seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
a
a b
a c
b b
c
0,0 0,5 1,0 1,5 2,0 2,5 3,0 3,5
inicial final
Trealose
(%)
C1 C5 C6 CAT‐1
Houve um aumento no consumo de ácido sulfúrico pelas linhagens C1, C5 e CAT-1 diferentemente do que observamos no terceiro ciclo, onde o consumo de ácido foi igual para todas as linhagens (figura 13).
Figura – 13 Consumo de ácido sulfúrico (g/litro de pé de cuba) no transcorrer de 5 ciclos fermentativos pelas leveduras C1, C5, C6 e CAT-1 fermentando mosto de caldo de cana com 54 ppm de Al. Colunas dentro de um mesmo ciclo seguidas de letras iguais não diferem estatisticamente a um nível de 5% de significância
b
a b
a a
a b
a b
a b b
c a
a a
0 1 2 3 4 5
2 3 4 5
H2SO4
(g/L)
C1 C5 C6 CAT‐1