UNIVERSIDADE FEDERAL DO CEARÁ – UFC
PROGRAMA DE PÓS-GRADUAÇÃO EM BIOTECNOLOGIA DOUTORADO EM BIOTECNOLOGIA
REDE NORDESTE DE BIOTECNOLOGIA – RENORBIO
ANDERSON WEINY BARBALHO SILVA
Localização de proteínas, quantificação de RNAm e papel das citocinas TNF-α e IL-1β no desenvolvimento folicular in vivo e in vitro em bovinos
LOCALIZAÇÃO DE PROTEÍNAS, QUANTIFICAÇÃO DE RNAm E PAPEL DAS CITOCINAS TNF-α E IL-1β NO DESENVOLVIMENTO FOLICULAR IN VIVO E IN
VITRO EM BOVINOS
Tese apresentada ao Curso de Doutorado em Biotecnologia da Rede Nordeste de Biotecnologia – RENORBIO, Universidade Federal do Ceará – UFC, como requisito parcial para a obtenção do grau de Doutor em Biotecnologia. Área de concentração: Biotecnologia em Agropecuária.
Orientador: Prof. Dr. José Roberto Viana Silva
Ao Criador; Aos meus pais, Sr. Silva e Sr.ª Antônia; A minha irmã Sheilliany,
A minha equipe, Aos meus alunos e futuros alunos, Com amor,
Agradeço a Deus, acima de tudo, por sua suprema bondade e infinita misericórdia de me guiar por caminhos retos, sempre em sua presença. Obrigado Senhor, por ser teu escolhido, e por desfrutar sempre da Tua Santa bondade! Sou grato por sempre iluminar meus caminhos, dando-me determinação, fé e força de vontade para nunca desistir! A luz que me guia é mais forte que os olhos que me cercam.
Aos meus amados pais, Antônia Lopes Barbalho Silva e Francisco Ferreira Silva, que por muito me amarem, renunciaram aos seus próprios sonhos para que os meus fossem prioridade. Obrigado por cada palavra de incentivo, por cada olhar que muitas vezes falaram mais que mil palavras. Vocês são os maiores exemplos de verdadeiros PAIS que nessa terra pode existir. Obrigado por terem projetado em mim o Anderson Weiny que hoje sou. Amo muito vocês! Razão do meu existir.
À minha irmã Sheilliany Barbalho, pelo nosso amor, que é o elo que nos une, fazendo com que palavras sejam inúteis para sabermos que sempre nos apoiaremos em todas as decisões de nossas vidas.
Agradeço à toda minha família, especialmente a minha iluminada Avó D. Antônia (Vovó Toinha), meus amados Tios Luiz Barbalho e Sílvia Helena, meu primo João Victor Barbalho pela admiração incondicional, pelo apoio nesta jornada, pelas doces recordações da infância e pelos grandes ensinamentos eternizados.
A todos os meus amigos, em especial os amigos Clayrtiano Alves, Jordânia Freire, Amélia Araújo, Jackson Costa, Juliane Passos, Cleuston Monteiro, Regislane Ribeiro, Eronalda Rodrigues, Luana Rodrigues Moêmia Portela, Rony Barroso, Anderson Douglas, Alana Godinho e todos aqueles que de alguma forma contribuíram para que eu pudesse viver cada etapa desta jornada, construindo sonhos e acreditando que eles seriam concretizados um a um. Agradeço por terem me proporcionado inesquecíveis momentos de abstração e aventura.
sem finalidade, sem valor. Cada pensamento, cada palavra, cada ato, representou algo para o meu destino final. A concretização de um sonho, ser Doutor (antes dos 30)! Amo Vocês!
À família Techgym Academia, em especial ao meu amigo e Personal Trainer Prof. Anderson Marques, agradeço pelo apoio e incentivo nos momentos de treino que me serviram como válvula de escape para que eu pudesse suportar as pressões e cobranças do dia-a-dia pré-defesa de tese. Não há sentido em viver mais, se não se puder viver melhor. Assim, a qualidade de vida deve ser o objetivo número um de sua lista de prioridades. Obrigado Mestre, por tudo!
À família Negreiros: Roberto Negreiros, Valéria Negreiros, Sra. Quitéria Rodrigues, Sr. José Rodrigues e Sra. Luíza Magalhães que apareceram em minha vida como anjos que caem do céu, uma história de vida que tenho como exemplo. O exímio caráter, conduta, personalidade forte e vontade de vencer sempre é o que faz a diferença na vida desta família, por quem tenho enorme carinho, admiração e apreço. Nas grandes batalhas da vida, o primeiro passo para a vitória é o desejo de vencer. Com isso, vocês se tornam essenciais. Sou grato por toda atenção e carinho que a mim é dedicado.
Ao meu orientador Prof. Dr. José Roberto Viana Silva, palavras me faltam para preencher essas linhas em forma de agradecimento. Agradeço pelas oportunidades, pelos grandes ensinamentos, por me provar que ter coragem e ousadia, acima de tudo, não temer o desconhecido é um fator imprescindível para alcançarmos o sucesso profissional e pessoal. Sou grato por todo o tempo dedicado a mim ao longo desses anos de produção de conhecimento e formação profissional. Obrigado por me “projetar” e ter acreditado em mim, por várias vezes, e ter possibilitado que hoje eu sentisse uma das maiores alegrias de minha vida, tornar-me Doutor.
Agradeço aos meus companheiros de aventura, minha equipe, meus amigos: Ellen Vasconcelos, Amélia Araújo, Glaucinete Borges, Adriel Castro, Bianca Silva, Bruno Galvão, Edilcarlos Lima, Joyla Bernardo, Kelry Lopes, Laryssa Barroso, Miguel Fernandes e Pedro Alves pela parceria de trabalho e, principalmente, por me proporcionarem a virtude do trabalho em equipe. De forma especial, curvo-me aos amigos e colaboradores Taiã Gomes, Regislane Ribeiro, Jackson Costa, Renato Passos, Lais Melo e Éverton Pimentel, obrigado por se fazerem presentes e extremamente responsáveis! Grande parte do sucesso deste trabalho pertence, por direito, a vocês.
especial minha madrinha de formatura Isana Mara, agradeço pelos “choques de realidade”, pelas longas conversas, pela amizade e pelo prazeroso convívio ao lado de vocês. Enfim, pelos momentos especiais desde a época de iniciação científica, que jamais serão esquecidos. Agradeço de coração a vocês por tudo!
Aos Professores Paulo Bayard Dias Gonçalves (UFSM), Vilceu Bordignon (McGill University) e João Francisco Coelho de Oliveira (in memorian) pela oportunidade e confiança na execução e parceria deste projeto, mas principalmente pelos ensinamentos que ajudaram a me tornar uma pessoa melhor. Sou grato a equipe do Laboratório de Biotecnologia e Reprodução Animal – BIOREP da Universidade Federal de Santa Maria (UFSM) em especial aos amigos Werner Glanzner e Andressa Minussi. Obrigado por terem posto tanta sabedoria, cuidado e dedicação em minhas atividades, por compartilhar tantas coisas boas e por marcar tantas lembranças positivas em minha vida. Obrigado por sempre serem honestos comigo, por serem gentis e sempre presente quando necessito. Agradeço ainda aos anjos que Deus colocou em minha vida na temporada em que estive morando no Rio Grande do Sul - Betty Martam, Karine Brondani, Bernardo Silva, Luane Pereira, Patrícia Mortari, Kellen Mendes e Roziane Bortoluzzi. De tantas diferentes e significativas formas, muito obrigado por tudo.
Aos colaboradores Ricássio Barberino e Vanúzia Menezes do Laboratório de Biotecnologia Aplicada ao Desenvolvimento de Folículos Ovarianos Pré-antrais – BIOFOV, da Universidade Federal do Vale do São Francisco (UNIVASF), em especial à Prof. Dra. Maria Helena Tavares de Matos, pelo compromisso e empenho nas análises de cultivo in situ.
Agradeço ao corpo técnico, aos pesquisadores e estudantes do Centro de Pesquisas Aggeu Magalhães – FIOCRUZ – PE, em especial a Profa. Dra. Christina Peixoto e a Dra. Mariana Aragão Matos Donato, pela parceria e oportunidade que me foi dada em executar parte de meus experimentos nesta instituição. Uma experiência inenarrável que levarei comigo para sempre.
Biotecnologia – Rede Nordeste de Biotecnologia (RENORBIO), pela oportunidade de realização de um Curso de Doutorado de nível reconhecido e de qualidade e seriedade inquestionáveis.
Ao Núcleo de Biotecnologia de Sobral (NUBIS), pela disponibilidade de equipamentos e todo o apoio técnico necessário.
Agradeço também a todos os funcionários da UFC Campus de Sobral, em especial a Srta. Aline Araújo, Sr. Carlos Mendes, Profa. Dra. Mirna Marques, Prof. Dr. Gerardo Cristino, Prof. Dr. Juvenal Linhares e Prof. Dr. Vicente Pinto, pelos muitos auxílios prestados a mim.
Aos animais, parte fundamental deste trabalho, obrigado por suas contribuições à ciência.
Ao Conselho Nacional de Desenvolvimento Científico e Tecnológico (CNPq) e à Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES), pelo apoio financeiro para as pesquisas – Projeto Casadinho/Procad – MCTI/CNPq/MEC/Capes – Ação Transversal nº06/2011.
Aos integrantes da Banca Examinadora, Prof. Dr. José Roberto Viana Silva, Profa. Dra. Ana Paula Ribeiro Rodrigues, Profa. Dra. Maria Helena Tavares de Matos, Profa. Dra. Mirna Marques Bezerra Brayner, Profa. Dra. Valdevane Rocha Araújo, Profa. Dra. Márcia Viviane Alves Saraiva e Prof. Dr. Rafael Rossetto de Sousa por terem gentilmente aceito o convite para participar da banca de defesa desta Tese e pela solicitude em contribuir no engrandecimento deste trabalho.
Agradeço, enfim, a todas as pessoas que contribuíram, direta ou indiretamente, para a efetivação deste sonho.
“No fim, quando você estiver lá, te dirão que você teve sorte, que é sortudo. Mas você não se sente assim. Eles não viram quantas vezes você caiu, pensou em desistir, quantas foram as noites de sono perdidas e o estresse causado pela pressão de conseguir. Não foi sorte. O caminho é longo, cheio de bura cos e desvios mas se você estiver acompanhado da coragem e da persistência, nada poderá te impedir.”
RESUMO
TNFR2 foram aumentados em CCOs cultivados por 12 h na presença de gonadotrofinas. A presença de gonadotrofinas aumentou os níveis de RNAm para IL-1R1 e IL-1RA em células do cumulus após cultivo por 24h. O TNF-α reduziu os níveis de RNAm para HAS-2, CASP3 e CASP6, enquanto que a IL-ńβ elevou os níveis de expressão de IL-β, IL-1RA e HAS-2 em células do cumulus cultivadas. Além disso, a IL-ńβ aumentou a expressão de iNOS após 24h de cultivo. A análise ultraestrutural confirmou a integridade dos CCOs cultivados na presença de TNF-α ou IL-ńβ. Em conclusão, os componentes do sistema TNF-α e do sistema interleucina 1 são expressos diferencialmente em células ovarianas. O TNF-α reduz a sobrevivência folicular in vitro, enquanto a Dexametasona mantém a ultraestrutura de folículos cultivados. Por outro lado, a IL-ńβ promove o desenvolvimento de folículos primordiais in vitro. A expressão do sistema TNF-α e do sistema IL-1 é regulada por gonadotrofinas in vivo e in vitro. A presença de TNF-α e IL-ńβ mantém a ultraestrutura normal de CCOs cultivados. Estes resultados sugerem um importante papel do sistema TNF-α e do sistema interleucina 1 na regulação da foliculogênese e ovulação em bovinos.
ABSTRACT
CASP6, whereas IL-1β increased levels of mRNA for IL-β, IL-1RA and HAS-2 in cultured cumulus cells. Furthermore, IL-1β increased iNOS expression after 24h of culture. Ultrastructural analysis confirmed the integrity of COCs cultured in presence of TNF-α or IL-ńβ. In conclusion, TNF-α system members and interleukin-1 system members are differentially expressed in ovarian cells. TNF-α reduces the follicular survival in vitro, while dexamethasone enhances the ultrastructure of cultured follicles. On the other hand, IL-1β promotes the development of primordial follicles in vitro. The expression of TNF-α system and the IL-1 system is regulated by gonadotropins in vivo and in vitro. The presence of TNF-α and IL-1β maintain the normal ultrastructure of cultured COCs. These results indicate an important role of TNF-α and interleukin 1 systems in the regulation of bovine folliculogenesis and ovulation.
LISTA DE ILUSTRAÇÕES
REVISÃO DE LITERATURA
Figura 1
Oogênese e foliculogênese. Representação esquemática da oogênese e foliculogênese em fêmeas mamíferas. Fonte: adaptado de Milewski (2013) ... 32
Figura 2 Migração das células germinativas primordiais (CGPs) a partir do saco vitelínico para as cristas gonadais. Fonte: adaptado de Senger (2003) ... 33
Figura 3
Esquema ilustrando o ovário mamífero com suas principais estruturas. Adaptado de: (<http://britannica.com/EBchecked/media/99761/The-steps-of-ovulation-beginning-with-a-dormant-primordial-follicle>)... 35
Figura 4 Fatores que controlam a ativação, a sobrevivência e o crescimento de folículos primordiais. Adaptado de Silva et al., (2016) ... 38
Figura 5
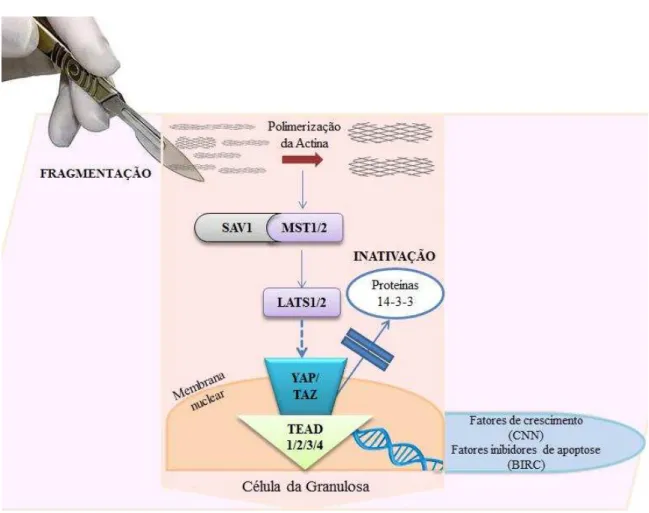
A cascata de sinalização da via Hippo inicia com a ativação de quinases, STK4 (MST1) e STK3 (MST2). Estas quinases irão fosforilar a proteína SAV1, formando um complexo que por sua vez irão fosforilar e ativar as quinases LATS1/2 da família DBF. Após ativação das proteínas LATS, ocorrerá à associação com proteínas adaptadoras MOB1A/B que irão fosforilar os co-ativadores transcricionais YAP1 e WWTR1 (TAZ). Em seguida, YAP1/WWTR1 fosforilados, se associarão com proteínas 14-3-3 que serão retidos no citoplasma e, portanto inativados. A inativação da via de sinalização Hippo leva à desfosforilação de YAP1 e TAZ seguido da translocação destes fatores para o núcleo, onde, em conjunto com outros ligantes, como o TEAD1-4, induzem a proliferação e/ou sobrevivência. ... 40
VG (diplóteno –Prófase I). A retomada da meiose in vivo é marcada pelo pico pré-ovulatório de LH que desencadeia a progressão da meiose até o estágio de metáfase II, onde ocorre a extrusão do primeiro corpúsculo polar. A meiose é então bloqueada novamente, e somente será retomada após a fertilização, seguindo da expulsão do segundo corpúsculo polar e formação do oócito haploide fecundado (adaptado de LONERGAN & FAIR, 2015) ... 48
CAPÍTULO 1
Figure 1
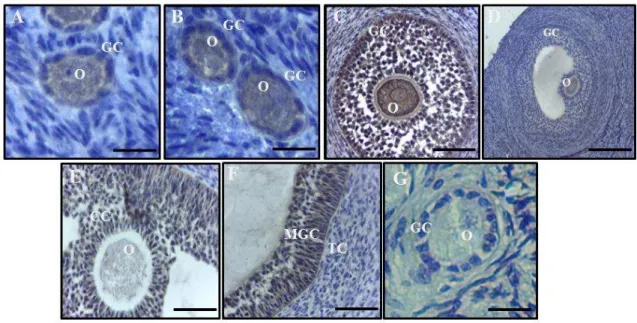
Tumor necrosis factor-alfa (TNF-α) staining in preantral and antral follicles from bovine ovaries. (A) primordial follicle, (B) primary follicle, (C) secondary follicle, (D) small antral follicle, (E) COC of a large antral follicle, (F) mural granulosa and theca cells from a large antral follicle, (G) negative control reaction. O: oocyte; GC: granulosa cells; MGC: mural granulosa cells; CC: cumulus cells; TC: theca cells. Scale bars – original magnification: A-C and G, ×400; D-F, ×ńŃŃ ……... 70
Figure 2
Tumor necrosis factor receptor type 1 (TNFR1) staining in preantral and antral follicles from bovine ovaries. (A) Primordial follicle, (B) primary follicle, (C) secondary follicle, (D) small antral follicle, (E) COC of a large antral follicle, (F) mural granulosa and theca cells from a large antral follicle, (G) negative control reaction. O: oocyte; GC: granulosa cells; MGC: mural granulosa cells; CC: cumulus cells; TC: theca cells. Scale bars – original magnification: A-C and G, ×400; D-F, ×ńŃŃ ……... 70
Figure 3
Figure 4
Western blot analysis of TNF-α system in follicular compartments from bovine large antral follicles (<10 mm). (A) TNF-α; (B) TNFR1; (C) TNFR2; (D) β-actin. TC: theca cells; GC: granulosa cells ... 72
Figure 5
Normal primary follicle in fresh control (A); normal primary follicle cultured for 6 days in the presence of dexamethasone (10 ng/mL) (B); atretic primary follicle cultured in the presence of TNF-α (200 ng/mL) (C). GC, granulosa cell; Nu, oocyte nucleus; O, oocyte. Scale bars – original magnification: ×400 ... 73
Figure 6
Percentage of morphologically normal follicles in uncultured control tissue and after 6 days of culture in α-MEM+ supplemented with different concentrations of TNF-α (1, 10, 100, or 200 ng/mL) and dexamethasone (1, 10, 100, or 200 ng/mL). ∗Differs from fresh control; Distinct uppercase letters (A/B) represent significant differences
between treatments .……… 74
Figure 7
Percentage of primordial (A) and development (B) follicles in ovarian tissue at day Ń (fresh control) and after culture for 6 days in α-MEM+ supplemented with different concentrations of TNF-α (ń, ńŃ, ńŃŃ, or 2ŃŃ ng/mL) and dexamethasone (1, 10, 100, or 200 ng/mL). ∗Differs from cultured tissues; Distinct uppercase letters (A/B) represent significant differences between treatments …………...……… 75
Figure 8
Mechanically isolated follicles visible after staining with calcein – AM (A, B – green staining) and ethidium homodimer-1 (C, D – red staining).
Scale bars represent 10 µm ……… 76
Figure 9
GC: granulosa cell; Nu, oocyte nucleus; O, oocyte; x400 magnification .. 77
Figure 10 Ultrastructural characteristics of normal (A) and (B) atretic follicles. OO: oocyte; GC: granulosa cells; V: vacuoles. ………. 79
Figure 11
Ultrastructural characteristics of follicles cultured in α-MEM+ alone (A), or supplemented with 10 ng/mL of TNF-α (B), or ńŃ ng/mL of dexamethasone (C). Bars are presented in the micrographs. GC: granulosa cells; OO: oocyte; V: vacuole …...……….……… 79
Figure 12
Levels of mRNA for tumor protein p53 (P53) (A); B-Cell CLL/lymphoma 2 (BCL-2) (B); BCL2-associated X Protein (BAX) (C); tumor necrosis factor-alpha (TNF-α) (D); caspase-3 (CASP3) (E) and caspase-6 (CASP6) (F) in fresh control and in bovine ovarian tissue cultured for 6 days in medium containing TNF-α (ńŃ ng/mL) or dexamethasone (10 ng/mL). A/B/C: significant difference between treatments. #p<0.05 compared with fresh control; *p<0.01 compared with fresh control; +p<0.05 compared with α-MEM+…………...…….………. 81
CAPÍTULO 2
Figure 1
Levels of mRNA for TNF-α (A); TNFRń (B) and TNFR2 (C) in granulosa cells (mean ± SD) from preovulatory follicles after 0h, 3h, 6h and 12h of GnRH injection. Distinct uppercase letters (A, B) represent significant differences between different times (P<0.05) …… 111
Figure 2
Immunohistochemical analyse for TNF-α (A), TNFRń (B) and TNFR2 (C) in bovine preovulatory follicles. A negative control reaction is shown in D. OO: oocyte; CC: cumulus cells; COC: cumulus-oocyte complex; TC: theca cells; GC: granulosa cells. Scale bars – 50 µm………... 112
the presence or absence of TNF-α. Distinct lowercase letters (a/b) represent significant differences after 24h of culture; *significant differences between treatments in the same time of culture, P<0.05 ….. 114
Figure 4
Levels of mRNA for CASP3 and CASP6 in bovine mural granulosa cells after 24 h of culture (means ± S.E.M.) in the presence or absence of TNF-α. Distinct uppercase letters (A/B) represent significant differences after 24h of culture; P <Ń.Ń5……….. 115
Figure 5
Representative micrographs of COCs from bovine ovarian follicles after 0, 12 and 24h of culture (means ± S.E.M.) in the presence or absence of TNF-α. (A) oocyte from uncultured COCs, (B) CC from uncultured COCs, (C) oocyte from cultured COCs in TCM-199* for 12h, (D) CC from cultured COCs in TCM-199* for 12h, (E) oocyte from cultured COCs in TNF-α for 12h, (F) CC from cultured COCs in TNF-α for 12h, (G) oocyte from cultured COCs in TCM-199* for 24h, (H) CC from cultured COCs in TCM-199* for 24h, (I) oocyte from cultured COCs in TNF-α for 24h, (J) CC from cultured COCs in TNF-α for 24h. Bars are presented in the micrographs. ZP: zona pellucida; C; cortical granules N: nucleus; V: vacuole ………. 116
Figure 6
Levels of mRNA for TNF-α, TNFR1 and TNFR2 in cumulus cells after 12 h (A) and 24 h (B) of culture (means ± S.E.M.) in the presence or
absence of gonadotropins ………. 118
CAPÍTULO 3
Figure 1
Figure 2
(A–D) Relative expression of messenger RNA (mRNA) for interleukin (IL) 1 system in bovine small antral follicles. Significantly different (P < 0.05). f. wall, follicular wall. Different superscript letters (a, b) indicate significant differences. ………...
130
Figure 3
A–D) Relative expression of messenger RNA (mRNA) for interleukin (IL) 1 system in bovine large antral follicle. Significantly different (P < 0.05). f. wall, follicular wall. Different superscript letters (a, b) indicate significant differences.………... 131
Figure 4
(A–D) Relative expression of messenger RNA (mRNA) for interleukin (IL) 1 system in small (<3 mm) and large antral follicle (>3 mm). Significantly different (P < 0.05). f. wall, follicular wall. Different superscript letters (a, b) indicate significant differences. .………... 131
Figure 5
IL-1β and IL-1RA immunoreactivity in different follicular categories. (A) Primordial follicle, (B) primary follicle, (C) secondary follicle, (D) small antral follicle, (E) COC of a large antral follicle, (F) mural granulosa and theca cells from a large antral follicle, (G) negative control reaction. O: oocyte; G: granulosa cells; MGC: mural granulosa cells; CC: cumulus cells; T: theca cells. Scale bars – Original magnification: A–C and G, x400; D-F, x100 ………... 133
Figure 6
Interleukin 1-RI and IL-1RII immunoreactivity in different follicular categories. (A) Primordial follicle, (B) primary follicle, (C) secondary follicle, (D) small antral follicle, (E) COC of a large antral follicle, (F) mural granulosa and theca cells from a large antral follicle, (G) negative control reaction. O: oocyte; G: granulosa cells; MGC: mural granulosa cells; CC: cumulus cells; T: theca cells. Scale bars – Original magnification: A–C and G, x400; D-F, x100 ………... 134
cultured for 6 d in medium containing IL-1β. *Differs significantly from fresh control follicles. AB indicates significant differences among cultured treatments (P < 0.05). IL, interleukin. ……… 135
Figure 8
Percentage (mean ± standard error of the mean) of primordial follicles in uncultured tissues and in tissues cultured for 6 d in medium containing IL-1β. *Differs significantly from control; ABCD indicates significant differences among cultured treatments (P < 0.05). IL,
interleukin. ….………. 135
Figure 9
Percentage (mean ± standard error of the mean) of developing follicles in uncultured tissues and in tissues cultured for 6 d in medium containing IL-1β. *Differs significantly from control (uncultured follicles). ABCD indicates significant differences among cultivated treatments (P < 0.05). IL, interleukin. ………. 135
CAPÍTULO 4
Figure 1
Levels of mRNA for IL-1β (A); IL-1RI (B) and IL-1RA (C) in granulosa cells (mean ± SD) from preovulatory follicles after 0h, 3h, 6h and 12h of GnRH injection. Distinct uppercase letters (A, B) represent significant differences between different times (P<0.05) …… 150
Figure 2
Levels of mRNA for IL-1β (A), IL-1RI (B) and IL-1RA (C) in cumulus cells after 24 h of culture (means ± S.E.M.) in the presence or absence of gonadotropins …...………. 151
Figure 3
Figure 4
Levels of mRNA for Has-2 (A), iNOS (B) in bovine cumulus cells after 12 and 24h of culture (means ± S.E.M.) in the presence or absence of IL-1β. Distinct uppercase letters (A/B) represent significant differences after 24h of culture; *significant differences between treatments in the same time of culture, P<0.05 ……… 154
Figure 5
LISTA DE TABELAS
REVISÃO DE LITERATURA
Tabela 1 Expressão de hormônios, receptores hormonais; fatores de crescimento e receptores que controlam a foliculogênese pré-antral em bovinos ... 43
CAPÍTULO 1
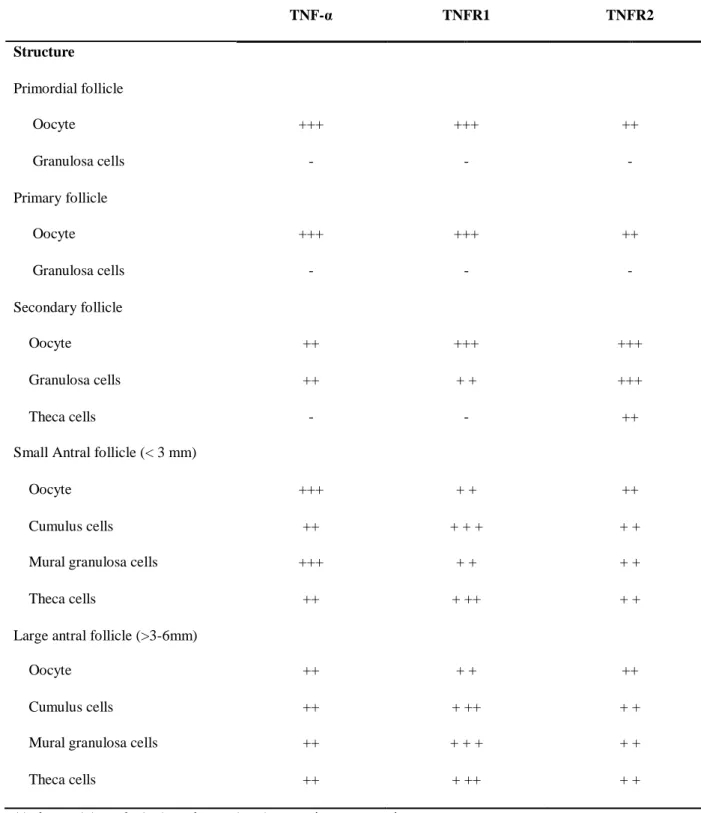
Table 1 Relative intensity of the immunohistochemical staining for TNF-α; TNFR-1and TNFR-2 protein in bovine ovarian follicles………… 69
Table 2
Percentage of apoptotic oocytes and granulosa cells before (fresh control) and after 6 days of in vitro culture in medium (α-MEM+) alone or in medium with TNF-α (ńŃ ng/mL) or dexamethasone (10
ng/mL).……… 78
Table 3 Primer pairs used in real-time PCR for quantification of TNF-α and genes expressed in apoptotic cell death. ………... 90
CAPÍTULO 2
Table 1 Primer pairs used in real-time PCR for quantification of messenger RNA in COCs from bovine ovarian follicles... 103
Table 2
Diameters of COCs from bovine follicles (3 to 8 mm in diameter) (mean ± S.E.M.) after 12 and 24h of in vitro culture in TCM-199* or supplemented with TNF-α(ńŃŃ ng/mL) ……... 113
CAPÍTULO 3
Table 2
Relative intensity of immunohistochemical staining for IL-1β, IL-1RA, IL-1RI and IL-1RII, and localization of mRNA for IL-1β, 1RA,
IL-1RI and IL-IL-1RII in the ovaries of cows... 132
CAPÍTULO 4
Table 1 Primer pairs used in real-time PCR for quantification of messenger
RNA in granulosa cells and COCs from bovine ovarian follicles …... 145
Table 2
Effect of IL-1β on cumulus expansion of COCs from bovine follicles (3 to 8 mm in diameter) (mean ± S.E.M.) after 0, 12 and 24 hours of in vitro maturation in TCM-199* alone or supplemented with IL-ńβ (ńŃ
LISTA DE ABREVIATURAS E SIGLAS
Português Inglês
ANOVA : Análise de variância Analysis of variance
As : Anti-senso Antisense
BSA : Albumina sérica bovina Bovine serum albumin
cAMP : Monofosfato cíclico de adenosina Cyclic adenosine monophosphate
cDNA : DNA complementar Complementary DNA
BAX : Proteína X associada ao BCL2 BCL2-associated X Protein
BCL-2 : Células B CLL/linfoma 2 B-Cell CLL/lymphoma 2
CASP3 : Caspase 3 Caspase 3
CASP6 : Caspase 6 Caspase 6
CGPs : Células germinativas primordiais Primordial germ cells
CO2 : Dióxido de carbono Carbon dioxide
COC : Complexo cumulus-oócito Cumulus-oocyte complex
CT : Limiar do ciclo Cycle threshold
CYP11A1 : Colesterol desmolase Cholesterol desmolase
CYP17A1 : Citocromo P45Ń ń7α hidroxilase Cytochrome P450 17α-hydroxylase
D0 : Dia 0 do tratamento Day 0 of treatment
D6 : Dia 6 do tratamento Day 6 of treatment
dATP : Deoxiadenosina trifosfato Deoxyadenosine triphosphate dCTP : Deoxicitidina trifosfato Deoxycytidine triphosphate dGTP : Deoxiguanosina trifosfato Deoxyguanosine triphosphate DNA : Ácido desoxirribonucleico Deoxyribonucleic acid
DNAse : Deoxiribonuclease Deoxyribonuclease
dNTP : Deoxiribonuclease trifosfato Deoxyribonucleotide triphosphates dTTP : 2' deoxitimidina 5' trifosfato 2'-deoxythymidine 5'-triphosphate
E2 : Estradiol Estradiol
EGF : Fator de crescimento epidermal Epidermal growth factor FGF-2 : Fator de crescimento fibroblástico Fibroblast growth factor
FIV : Fertilização in vitro In vitro fertilization
GAPDH :Gliceraldeído-3-fosfato- desidrogenase Glyceraldehyde 3-phosphate dehydrogenase GDF-9 : Fator de crescimento e diferenciação tipo 9 Growth differentiation factor type 9
GnRH : Hormônio liberador de gonadotrofinas Gonadotropin-releasing hormone
GC : Células da granulosa Granulosa cells
H : Hora Hour
HAS2 : Ácido hialuronico sintetase-2 Hyaluronan synthase 2
H2O2 : Peróxido de Hidrogênio Hydrogen peroxide
IA : Inseminação artificial Artificial insemination
ITS : Insulina-transferrina-selênio Insulin-transferrin-selenium
kDa : Quilodalton Kilodalton
KL : Kit ligand Kit ligante
LH : Hormônio luteinizante Luteinizing hormone
LHR : receptor para LH LH receptor
M : Molar Molar
MAPK : Proteína kinase ativada por mitógenos Mitogen-activated protein kinase MET : Microscopia eletrônica de transmissão Transmission electronic microscopy
Mg : Miligrama Milligram
MgCl2 : Cloreto de magnésio Magnesium chloride
min : Minuto Minute
MIV : Maturação in vitro In vitro maturation
mL : Mililitro Millilitre
mm : Milímetro Millimeter
mM : Milimolar Millimolar
mRNA : RNA mensageiro Messenger RNA
N : Núcleo Nucleus
NaCl Cloreto de Sódio Sodium chloride
Ng : Nanograma Nanogram
nL : Nanolitro Nanoliter
nm : Nanômetro Nanometer
O : Oócito Oocyte
P4 : Progesterona Progesterone
P53 : Proteína tumoral 53 Tumor protein p53
PDF : Fator derivado da próstata Prostate-derived fator
PF : Folículo primordial Primordial follicle
PGC : Célula germinativa primordial Primordial germ cell
PI3K : Fostado de inositol 3-kinase phosphatidylinositol-3-kinases
PKC : Proteína quinase C Protein kinase C
RNA : Ácido ribonucleico Ribonucleic acid
RNAm : RNA Mensageiro Messenger RNA
RNAse : Ribonuclease Ribonuclease
S : Senso Sense
SD : Desvio-padrão Standard deviation
SF : Folículo secundário Secondary follicle
StAR : Proteína reguladora aguda esteroidogênica Steroidogenic acute regulatory protein
TE : Transferência de embriões Embryo transfer
TEM : Microscopia eletrônica de transmissão Transmission electron microscopy
TGF-β : Superfamília de fatores de crescimento
transformante beta Transforming growth fator beta superfamily
U : Unidade internacional International unit
V : Vacúolo Vacuole
VEGF : Fator de crescimento do endotélio vascular Vascular endothelial growth fator VIP : Peptídeo intestinal vasoativo Vasoactive intestinal peptide
Zp : Zona pelúcida Pellucid zona
α-MEM : Meio essencial mínimo modificado de Eagle alfa
Minimum Essential Medium Eagle Alpha Modification
28
LISTA DE SÍMBOLOS
Português Inglês
% : Percentagem Percentage
~ : Aproximadamente Nearly
< : Menor que Less than
> : Maior que Higher than
± S.E.M : Erro padrão da média Satndard eror mean
≥ : Maior igual a Greater-than ore qual to
°C : Graus Celsius Celsius degrees
µg : Micrograma Microgram
µ L : Microlitro Microliter
µm : Micrômetro Micrometer
µM : Micromolar Micromolar
p<0,05 : Probabilidade menor do que 5% Probability less than 5% p>0,05 : Probabilidade maior do que 5% Probability higher than 5%
SUMÁRIO
1. INTRODUÇÃO ... 30 2. REVISÃO DE LITERATURA ... 31 2.1 Oogênese ... 31 2.2 Foliculogênese ovariana e caracterização folicular ... 34 2.3 População e atresia folicular ... 36 2.4 Ativação de folículos primordiais ... 37 2.5 Crescimento de folículos pré-antrais pós-ativação ... 42 2.6 Crescimento folicular na fase antral ... 44 2.7 Maturação de oócitos bovinos ... 47 2.8 Ovulação ... 50 2.9 Importância do Sistema TNF-α no ovário e seus efeitos na foliculogênese e ovulação ... 52 2.10 Caracterização do Sistema Interleucina-1 (IL-1) na foliculogênese ovariana e ovulação ... 54 3. PROBLEMA ... 57 4. HIPÓTESE CIENTÍFICA ... 58 5. JUSTIFICATIVA ... 59 6. OBJETIVOS ... 61 6.1 Objetivos gerais ... 61 6.2 Objetivos específicos ... 61 7. CAPÍTULO 1
8. CAPÍTULO 2
Expression profile of mRNA for TNF-α system in LH-induced bovine preovulatory follicles and effects of TNF-α on gene expression, ultrastructure and expansion of cumulus-oocyte complexes cultured in vitro ………... 96 9. CAPÍTULO 3
Protein and mensseger RNA expression of interleukin 1 system members in bovine ovarian follicles and effects os interleukin ńβ on primordial follicle activation and
survival in vitro ... 125 10. CAPÍTULO 4
1. INTRODUÇÃO
As biotecnologias reprodutivas vêm se destacando no cenário nacional e internacional, criando oportunidades extraordinárias para a reprodução animal, especialmente no que se refere ao aumento da eficiência reprodutiva dos rebanhos de elevado potencial econômico. A bovinocultura é um dos principais destaques do agronegócio brasileiro no cenário mundial. O Brasil lidera o ranking de maior exportador de carne bovina do mundo desde 2008 e hoje é o segundo maior produtor, com mais de 212,34 milhões de cabeças, superado apenas pelos Estados Unidos, responsável por 17% da produção total (IBGE, 2015). A criação de rebanho bovino apresenta um impacto significativo no cenário socioeconômico mundial, atuando como fonte de renda para criadores, além de produzir alimento de alto valor nutricional e contribuir com valioso material genético voltado às pesquisas para reprodução animal.
fisiologia ovariana em bovinos e o desenvolvimento de métodos eficientes que possibilitem avaliar os efeitos de substâncias que estão envolvidas no controle da foliculogênese.
Os estudos in vivo e in vitro são de grande importância, pois apesar da enorme quantidade de informações produzidas durante as duas últimas décadas, o entendimento completo dos mecanismos que controlam o desenvolvimento folicular, ovulação e maturação oocitária ainda não foram alcançados. Desta forma, o modelo bovino vem sendo utilizado na identificação de fatores envolvidos na ativação e desenvolvimento e seleção folicular, maturação oocitária, ovulação e luteólise (FERREIRA et al., 2007; FERREIRA et al., 2011;; GASPERIN et al., 2012; TONELLOTTO DOS SANTOS et al., 2012; BARRETA et al., 2013; GASPERIN et al., 2014; PASSOS et al., 2016; BEZERRA et al., 2016). Dentre estes fatores, pode-se destacar as citocinas inflamatórias, tais como o fator de necrose tumoral alfa (TNF-α) e a interleucina ńβ (IL-ńβ) que desempenham importante papel tanto na ovulação como na função folicular (MORRISON et al., 2002; VAN DER HOEK, 1998). Um conceito emergente é que as citocinas são importantes reguladores intraovarianos, agindo modulando ações relativas à foliculogênese, ovulação, e função do corpo lúteo, revelando a importância dos sistemas TNF-α e IL-1 nas alterações funcionais e estruturais no ovário em todas as fases do ciclo ovariano.
Visando uma melhor compreensão do assunto, a revisão de literatura a seguir abordará inicialmente os aspectos gerais relacionados à oogênese e foliculogênese. Além disso, será discutida a importância das gonadotrofinas para a foliculogênese, bem como aspectos relacionados à ovulação; cultivo in vitro de folículos ovarianos pré-antrais e maturação in vitro. Ademais, será feita uma abordagem da importância das citocinas para a foliculogênese e ovulação.
2. REVISÃO DE LITERATURA
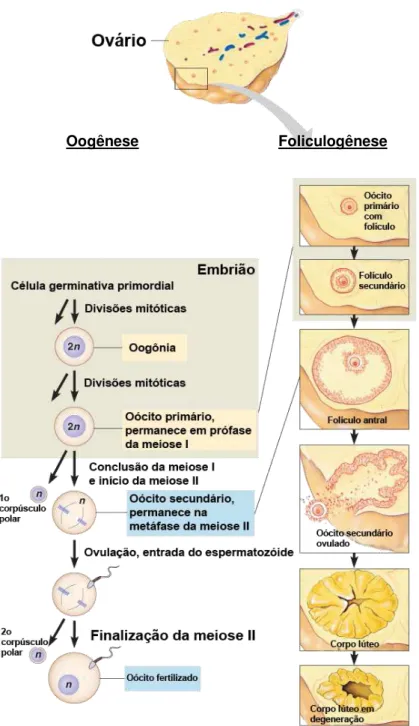
2.1 Oogênese
completar este processo meses ou anos mais tarde no animal adulto, após a fecundação (WASSARMAN, 1988). Em animais de laboratório, as proteínas morfogenéticas ósseas BMP-4 e BMP-8b induzem a formação de CGPs na região do epiblasto do disco embrionário (YING & ZHAO, 2001).
Figura 1. Oogênese e foliculogênese. Representação esquemática da oogênese e foliculogênese em fêmeas mamíferas. Fonte: adaptado de Milewski (2013).
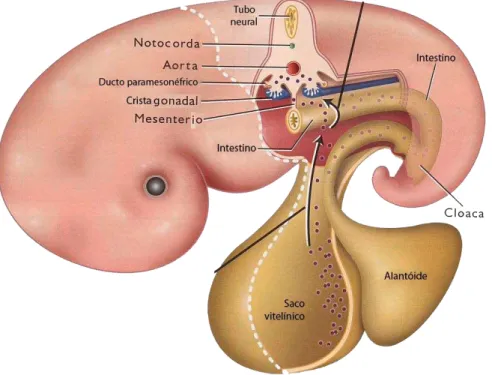
Em bovinos, as CGPs são oriundas da porção caudal do saco vitelínico do embrião (WASSARMAN & ALBERTINI, 1994). As CGPs expressam várias proteínas, como por exemplo, OCT4, SOX2, Stella, Fragilis, E-Caderina e Blimp1 e iniciam o processo de migração para o alantoide e mesoderma extra-embrionário (HAYASHI et al., 2007). Após perderem suas características de motilidade e sofrerem extensiva proliferação celular e redistribuição das organelas citoplasmáticas, as CGPs passam a se chamar oogônias (SADEU et al., 2006), as quais possuem alta atividade mitótica e transcricional (EPPIG et al., 2004). Essas divisões mitóticas que ocorrem no período pré-natal asseguram que a fêmea nascerá com um completo suprimento de células germinativas, as quais irão compor o futuro reservatório folicular.
Acredita-se que a migração das CGPs (Figura 2) é orientada pelo contato entre o receptor c-kit, expresso na superfície destas células, e o seu ligante, o Kit ligante expresso nas células somáticas que formam o substrato para a migração das CGPs para a crista gonadal (BUEHR et al., 1993). Ao entrarem na primeira divisão meiótica, as oogônias dão origem aos oócitos primários ou gametas femininos (PICTON et al., 1998). Esses oócitos ficam bloqueados na prófase I da meiose (em estágio de vesícula germinativa) até a puberdade (SUH et al., 2002).
Com o desenvolvimento das gônadas, uma camada de células somáticas achatadas, conhecidas como células da pré-granulosa, circundam os oócitos formando assim os folículos primordiais (PICTON, 2001), dando início à foliculogênese. As células da pré-granulosa são originárias do mesonéfron ou de células mesoteliais oriundas do epitélio da superfície ovariana. Um estudo recente concluiu que as células da granulosa e as células epiteliais da superfície do ovário surgem a partir de um precursor comum, que seriam células do ápice gonadal semelhantes a células epiteliais (Gonadal Ridge Epithelial-Like – GREL) (HUMMITZSCH et al., 2013).
2.2 Foliculogênese ovariana e caracterização folicular
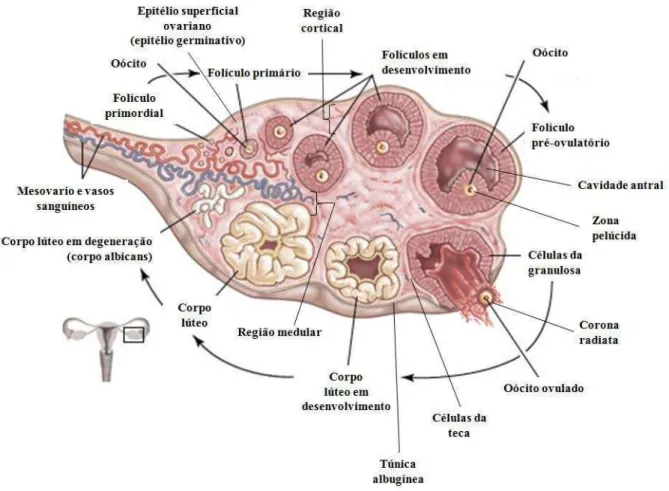
A foliculogênese bovina é um processo contínuo de crescimento e atresia dos folículos ovarianos (MATTON et al., 1981; WOOLUMS; PETER, 1994) que se inicia na vida fetal, passa pela puberdade (EVANS; ADAMS; RAWLINGS, 1994) e continua na vida reprodutiva até a senilidade (HAFEZ; HAFEZ, 2004). Este processo está presente inclusive durante a prenhez (TAYLOR; RAJAMAHENDRAM, 1991) e no período pós-parto que precede a ciclicidade (ROCHE; CROWE; BOLAND, 1992; MCDOUGAL et al., 1995), e caracteriza-se por alterações morfológicas acompanhadas pelo desenvolvimento funcional do folículo (HUSSEIN, 2005).
Figura 3. Esquema ilustrando o ovário mamífero com suas principais estruturas. (Adaptado de <http://www.britannica.com/EBchecked/media/99761/The-steps-of-ovulation-beginning-with-a-dormant-primordial-follicle>.)
Os FOPAs possuem um oócito circundado por uma ou mais camadas de células somáticas, sem a formação do antro. O desenvolvimento folicular pré-antral inicia-se em torno de 90 a 140 dias de vida com a colonização do ovário fetal por células mesonéfricas, precursoras das células foliculares, estas células somáticas achatadas circundam o oócito e formam uma camada de células da pré-granulosa originando os folículos primordiais. A ativação de folículos primordiais é um processo irreversível e contínuo que culminará no crescimento folicular ininterrupto até a ovulação ou atresia (PICTON, 2001). Os folículos pré-antrais representam cerca de 90 a 95% de toda a população folicular (WOOLUMS; PETER, 1994; FIGUEIREDO et al., 2008).
folículo selecionado passa a exercer dominância sobre os demais folículos, suprimindo o crescimento dos mesmos e inibindo o recrutamento de um novo grupo de folículos (fase de dominância) (HODGEN, 1982; GINTHER; KNOPF; KASTELIC, 1989; SIROIS; FORTUNE, 1990; GINTHER et al., 1996).
2.3. População e atresia folicular
A população folicular é bastante variável entre as espécies, sendo população estimada em 235.000 folículos em vacas, 160.000 em ovelhas, 37.000 em cabras e 2.000.000 em mulheres (BETTERIDGE et al., 1989; AMORIM et al., 2000; LUCCI et al., 1999; ERICKSON et al., 1986).
O “pool” de folículos pré-antrais existente nos ovários de mamíferos representa uma significativa reserva de material para estudos de manipulação genética em espécies domésticas, bem como para a preservação de espécies em extinção e preservação da fertilidade (PICTON, 2001). Entretanto, o número e a distribuição dos diferentes tipos foliculares nos ovários de animais são marcados por uma grande variação individual, além de ser afetado pela raça, idade, níveis hormonais, genética, bem como o status reprodutivo e nutricional do animal (IRELAND et al., 2007).
A fertilidade das fêmeas é determinada em grande parte pela capacidade de desenvolvimento dos oócitos, refletindo assim, na sua capacidade de sofrer meiose, ser fertilizado e originar um embrião saudável (KIDDER, 2010). Entretanto, ao longo da vida das fêmeas há uma significativa redução na população de folículos pré-antrais (SHAW et al., 2000), devido ao processo fisiológico degenerativo irreversível denominado atresia, que acomete cerca de 99,9% dos folículos ovarianos (FIGUEIREDO et al., 2008). Este processo pode ocorrer pelas vias degenerativa (SAUMANDE, 1981) e/ou apoptótica (FIGUEIREDO et al., 1995), quando o ambiente parácrino ou endócrino não é apropriado para suportar o crescimento e/ou diferenciação das células foliculares (SILVA et al., 2002).
Dessa forma, para se obter o sucesso no crescimento e desenvolvimento folicular, se faz necessário uma complexa interação entre oócito e células somáticas do estroma ovariano, envolvendo diversos mensageiros, fatores de crescimento, citocinas e hormônios (ARAÚJO et al., 2014; PASSOS et al., 2016; SILVA et al., 2016). A interação harmônica entre estas substâncias é responsável pela saída dos folículos primordiais do estágio de quiescência e posterior crescimento dos folículos até o estágio pré-ovulatório.
2.4 Ativação de folículos primordiais
O desenvolvimento de folículos pré-antrais pode ser dividido em três estágios: ativação de folículos primordiais, transição de folículo primário para secundário e desenvolvimento de folículos secundários até o estágio antral (FORTUNE, 2003). A maioria dos folículos em desenvolvimento sofrerão atresia, porém alguns irão amadurecer até o estágio de folículos pré-ovulatórios.
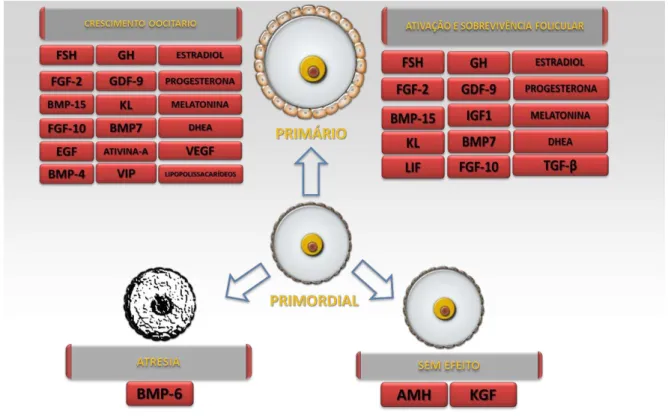
A ativação dos folículos primordiais caracteriza-se pela saída destes folículos do estágio de quiescência e entrada destes para o “pool” de folículos em crescimento. A ativação folicular resulta em alterações bioquímicas e funcionais nas células foliculares que levam ao aumento da atividade metabólica e transcricional destas células levando à mudanças na morfologia das células da granulosa o que pode acontecer dias, meses ou anos após a sua formação. Uma vez ativados, os folículos entram em um curso pré-programado de desenvolvimento e maturação, processos que são necessários para o sucesso da ovulação e fertilização, ou, alternativamente, são perdidos por atresia (MCGEE et al., 2000). Em adição, um grande número de fatores de crescimento e hormônios estão envolvidos na ativação de folículos primordiais (Figura 4).
Figura 4. Fatores que controlam a ativação, sobrevivência e o crescimento de folículos primordiais testados no cultivo folicular in vitro. Adaptado de Silva et al. (2016).
No que diz respeito às substâncias inibitórias, podem ser citadas a fosfatase e tensina homóloga com deleção no cromossomo 10 (PTEN), a proteína p27 (p27), ou o Fator de Transcrição Forkhead 3 (Foxo3) podem ser destacadas (JOHN et al., 2008).Como substâncias estimulatórias, pode-se destacar o kit ligante (KL) (JOHN et al., 2009), a insulina (ENGELMAN; LUO; CANTLEY, 2006), o fator de crescimento derivado de plaqueta (PDGF) (NAGAO et al., 2006), o fator de crescimento de queratinócito (KGF) (CHANG et al., 2005; BAO et al., 2005), o fator de crescimento neural (NGF) (RAHBEK et al., 2005), o fator neurotrófico derivado da linhagem celular glial (GDNF) (SRINIVASAN et al., 2005), o fator de crescimento do endotélio vascular (VEGF) (ABID et al., 2004) e o fator de crescimento do hepatócito (HGF) (TAHER et al., 2002).
FOXO3, FOXO1 e FOXO4, todos efetores negativos do padrão PI3K/AKT/PTEN (Tran et al., 2003). Além disso, o FOXO3, substrato da AKT, é um fator transcricional que leva à apoptose e à parada do ciclo celular. Portanto, tem sido sugerido que a AKT estimula o desenvolvimento do oócito, enquanto o FOXO3 o inibe. Vale ressaltar que, além do FOXO3, o FOXO1 e o FOXO4 também podem ser fosforilados pela via PI3K, resultando na inibição da apoptose e na ativação do ciclo celular (ACCILI E ARDEN, 2004).
Com o objetivo de compreender melhor os mecanismos de ativação em bovinos, o cultivo in vitro de tecido cortical ovariano vem sendo utilizado e no qual foi observado que a maioria dos folículos iniciam o seu crescimento espontaneamente após o cultivo (WANDJI et al., 1996; BRAW-TAL et al., 1997). Inicialmente, foi sugerido que um inibidor de origem medular regulava a ativação in vivo e que a separação do córtex da medula provocaria a ativação dos folículos primordiais bovinos in vitro. Atualmente, foi identificado que uma nova rota de sinalização pode está envolvida no controle da ativação e crescimento folicular. A via de sinalização Hippo é essencial para o controle do tamanho de órgãos e componentes desta via são conservados em todos os animais metazoários (PAN, 2007). Esta via consiste em vários fatores que atuam como inibidores do crescimento, a partir de uma cascata de quinases que fosforilam e inativam as principais vias efetoras da sinalização: Yes-associated protein (YAP) e transcricional coactivator with PDZ-binding motif (TAZ). Quando a via de sinalização Hippo é interrompida, ocorre a desfosforilação de YAP e um aumento dos níveis nucleares de YAP é observado. A proteína YAP atua em conjunto com fatores de transcrição TEAD que aumentam os níveis de expressão de fatores de crescimento da família CCN, bem como de fatores inibidores de apoptose – BIRC (baculoviral inhibitors of apoptosis repeat containing), estimulando o crescimento celular, sobrevivência e proliferação (PAN, 2007; HOLBOURN et al., 2008) (Figura 5).
pela proliferação celular e o crescimento folicular. A sigla CCN é derivado a partir de grandes membros da família, CCN1 (cysteine-rich angiogenic protein), CNN2 (connective tissue growth factor), e CCN3 (nephroblastoma overexpressed) (HOLBOURN et al., 2008).
Estudos in vitro com folículos primordiais caprinos têm demonstrado que o controle do início do crescimento folicular é regulado por diversos fatores, como o KL (CELESTINO et al., 2010), o estradiol (LIMA-VERDE et al., 2010), a proteína morfogenética óssea 7 (BMP-7) (ARAÚJO et al., 2010), o peptídeo intestinal vasoativo (VIP) (BRUNO et al., 2010), o fator de crescimento semelhante à insulina (IGF-1) (MARTINS et al., 2010), o VEGF (BRUNO et al., 2009), o fator de crescimento e diferenciação 9 (GDF-9) (MARTINS et al., 2008), a Ativina-A (SILVA et al., 2006a), o fator de crescimento fibroblástico básico (FGF-2) (MATOS et al., 2007), o fator de crescimento epidermal (EGF) (SILVA et al., 2004b), que atuam na promoção da ativação de folículos primordiais e no crescimento oocitário. A esfingosina 1-fosfato (S1P), após 7 dias de cultivo na concentração de 1ng/mL, promoveu a ativação e o desenvolvimento de folículos primordiais caprinos (NÓBREGA Jr. et al., 2014). Além disso, o FGF-10 (FSH/FGF-10 e FSH/FSH) mantêm a viabilidade e a ultraestrutura folicular, promovendo a ativação e o crescimento de folículos pré-antrais caprinos cultivados in vitro por 16 dias (ALMEIDA et al., 2015). Em ovinos, o EGF associado ao ácido indolacético (IAA) ou ao FSH foi capaz de promover a ativação de folículos primordiais e manter a viabilidade folicular por até seis dias de cultivo (ANDRADE et al., 2005). Ademais, o KL promoveu a ativação de folículos primordiais inclusos em tecido ovariano de ovelhas após 7 dias de cultivo in vitro (CAVALCANTE et al., 2014).
Desta forma, acumulam-se evidências de que a ativação e o crescimento dos folículos primordiais requerem a expressão de vários fatores e receptores. Em particular, a família dos fatores de crescimento transformante beta (TGF-β) tem-se mostrado potente regulador da proliferação e diferenciação celular, nas diferentes espécies (ELVIN et al., 2000). Além desses fatores, existem também comprovações sobre a importância das gonadotrofinas, hormônio do crescimento (GH), esteroides e andrógenos no desenvolvimento de folículos pré-antrais (HARTSHORNE et al., 1994; VENDOLA et al.; 1998; BACHELOT et al., 2002; ZACZEK et al., 2002).
2.5 Crescimento de folículos pré-antrais pós-ativação
Após a ativação, quando uma camada completa de células da granulosa de formato cuboide circunda o oócito, são formados os folículos primários. Por mecanismos independentes de gonadotrofinas, os folículos primários se desenvolvem até chegar ao estágio de folículos secundários pelo crescimento do oócito e pela atividade mitótica das células da granulosa. Durante a multiplicação destas células evidencia-se a expressão do antígeno nuclear de proliferação celular (PCNA), que pode ser usado como um marcador confiável de crescimento folicular (SILVA et al., 2014).
Tabela 1. Expressão de hormônios, receptores hormonais; fatores de crescimento e receptores que controlam a foliculogênese pré-antral em bovinos.
Ligante/Receptor Folículo Primordial
Folículo Primário
Folículo
Secundário Referência
FSHR (-) (+) RNAm (+) RNAm Wandji et al., 1992
GHR (+) RNAm
(+) Proteína
(+) RNAm (+) Proteína
(+) RNAm
(+) Proteína Kolle et al., 1998
GDF9 (+) RNAm (+) RNAm (+) RNAm Bodensteiner et al.,
1999 InibinaβA
(Ativina-A) (+) Proteína (+) Proteína (+) Proteína
Hulshof et al., 1997
IGF1 (-) (-) (+) RNAm Wandji et al., 1992
IGFR1 (-) (+) RNAm (+) RNAm Armstrong et al.,
2000
IGFBP 1- 6 (-) (-) (+) RNAm Rebolças et al.,
2013
VEGF (-) (-) (+) Proteína Yang et al., 2007
FGF2 (+) Proteína (-) (+) Proteína Van Wezel et al.,
1995
Abreviações: FSHR- receptor do hormônio folículo estimulante; GHR- receptor do hormônio do crescimento; GDF9- Fator de crescimento e diferenciação 9; BMPR- receptor de proteína morfogenética; ACVR- receptor de ativina; IGF- fator de crescimento semelhante à insulina; IGFBP- proteína ligante ao IGF; VEGF – fator de crescimento do endotélio vascular; FGF- fator de crescimento do fibroblasto. (+) presente; (-) ausente.
Estudos in vitro demonstraram que o FSH (HULSHOF et al., 1995), a Ativina-A (McLAUGHLIN et al., 2010), e a testosterona (YANG et al., 2006) estimulam o crescimento oocitário e a transição de folículos primários para secundários na espécie bovina.
Em murinos, Cheng et al. (2013) demonstraram que o R-spondin2, um gene expresso-oócito, por meio da estimulação de proteínas sinalizadoras Wingless (WNT), promove a proliferação de células da granulosa e o desenvolvimento de folículos primários para o estágio secundário.Em caprinos, durante a transição de folículo primário para secundário, observou-se um aumento nos níveis de RNAm para Kit Ligante (KL) (CELESTINO et al., 2010), EGF (CELESTINO et al., 2011), BMP15 (CELESTINO et al., 2011) e GDF9 (ALMEIDA et al., 2011).
desenvolvimento dos folículos, o espessamento da zona pelúcida torna-a visível (LUCCI et al., 2001), e as células da teca começam a surgir, formando uma camada circundante, provavelmente a partir de fibroblastos presentes no estroma ovariano (HONDA et al., 2007).
As células da teca indiferenciadas, não expressam receptores para LH (LHRs) ou enzimas esteroidogênicas e, portanto, não são responsivas ao LH, mostrando que o início da diferenciação das células da teca independe de gonadotrofinas (MAGOFFIN; WEITSMAN, 1994). Com o desenvolvimento folicular, as células da teca se estratificam em duas camadas: uma externa, denominada teca externa, composta por células indiferenciadas; e outra interna, conhecida como teca interna, na qual algumas células diferenciam-se e passam a secretar esteróides (GOUGEON et al., 2010). O crescimento folicular é progressivo, e como resultado do aumento do tamanho, aumenta-se também a demanda por nutrientes.
Com relação aos estudos in vitro, o cultivo de folículos secundários bovinos in vitro, resulta apenas na formação de cavidade antral, não tendo relatos de sucesso na produção de oócitos meioticamente competentes (ITOH et al., 2002; VASCONCELOS et al., 2013; PASSOS et al., 2013; SILVA et al., 2014; ROSSETTO et al., 2016; JIMENEZ et al., 2016; ROSSI et al., 2016).
2.6 Crescimento folicular na fase antral
Com o crescimento dos folículos secundários e a proliferação das células da granulosa originando várias camadas, ocorre entre estas a formação de uma cavidade repleta de líquido denominada antro. A partir desse estágio, os folículos passam a ser denominados terciários ou antrais e são caracterizados pelo aumento acentuado do diâmetro folicular ocasionado pelo crescimento do oócito, multiplicação das células da granulosa, da teca e acúmulo do fluido folicular (DRIANCOURT, 2001). Este fluido está presente no interior do antro sendo constituído por água, proteínas séricas, eletrólitos e altas concentrações de estradiol e inibina, ambos produzidos pelas células da granulosa (MARTINS et al., 2008). Em adição, o fluido folicular fornece inúmeros fatores que suportam as funções foliculares apropriadas, incluindo a qualidade dos oócitos, tais como a interleucina-6 (IL-6), BMP2, AREG (anfiregulina) e GDF-9 (DUMESIC et al., 2015).
transportadores e enzimas metabólicas necessárias para a manutenção do metabolismo oocitário (SU, SUGIURA & EPPIG, 2009). Além dessas substâncias, estão presentes no oócito, gonadotrofinas, esteróides, fatores de crescimento, enzimas, proteoglicanas e lipoproteínas, consideradas fundamentais para a determinação da qualidade oocitária (WU et al., 2007). A formação do antro divide as células da granulosa em duas populações diferentes: as células da granulosa que ficam próximas ao oócito sofrem diferenciação para formar as células do cumulus, enquanto que as demais se diferenciam em células da granulosa murais.
Em várias espécies domésticas, os folículos antrais são recrutados e crescem simultaneamente em uma onda folicular sob o controle das gonadotrofinas (FORTUNE et al., 2001). Em bovinos, já foi demonstrado que a dinâmica folicular acontece observando um padrão de uma, duas, três ou até quatro ondas de desenvolvimento folicular por ciclo estral (BARUSELLI et al., 2007). Uma elevação nas concentrações plasmáticas de FSH estimula o recrutamento folicular e a emergência da onda folicular (FORTUNE, 1994).
Ao iniciar uma nova onda folicular, um determinado grupo de folículos é recrutado, apresentando crescimento simultâneo, sobre estímulo do FSH, mas somente um deles será selecionado (GINTHER et al., 2003). Esta etapa estende-se por dois a três dias e os folículos apresentam uma taxa de crescimento constante (MIHM & BLEACH, 2003; PETER et al., 2009). A partir de então, este folículo passará a exercer dominância sobre os demais folículos, suprimindo assim o desenvolvimento e levando à inibição do recrutamento de um novo grupo de folículos. Na presença de níveis elevados de progesterona, o folículo dominante tornar-se-á anovulatório, em virtude da frequência na pulsatilidade do hormônio luteinizante (LH) ser baixa (GINTHER; KNOPF & KASTELIC, 1989; GINTHER et al., 1996).
Na espécie bovina, foi observada a formação dos folículos antrais aos 230 dias de gestação (RÜSSE, 1983). A partir deste estágio, o diâmetro do folículo aumentará notavelmente em virtude do crescimento oocitário, proliferação das células da granulosa, das células da teca e pela expansão da cavidade antral (DRIANCOURT, 2001).
Os folículos antrais podem ser classificados como pequenos ou grandes folículos antrais. Os pequenos folículos antrais crescem até alcançarem um diâmetro de 3 mm, independente da ação de gonodotrofinas. A partir deste estágio, os folículos tornam-se dependentes destes hormônios até o estágio de folículos pré-ovulatórios, que tem um diâmetro em torno dede 10 a 12 mm em Bos indicus e 12 a 15mm em Bos taurus (GINTHER, 2003).
fundamentais na regulação do desenvolvimento folicular. Em bovinos, os folículos podem atingir o diâmetro de 8 mm independente do suporte do LH, mas o crescimento além de 9 mm requer LH endógeno ou FSH exógeno. O FSH e o LH são reguladores primários da foliculogênese durante a fase dependente de gonadotrofinas (DRIANCOURT, 2001).
Durante o desenvolvimento folicular, ocorrem três eventos principais, o recrutamento, a seleção e a dominância (VAN DEN HURK & ZHAO, 2005). Em algumas espécies a dependência de gonadotrofinas e o recrutamento ocorrem quando os folículos atingem 0,2 mm em camundongos, 2 mm em ovinos e primatas e 3 mm em caprinos e 4 mm em bovinos (RUBIANES; MENCHACA, 2003). Os receptores de LH (LHR) das células da granulosa parecem estar relacionados à dominância folicular. A comparação dos padrões de expressão gênica observados por hibridização in situ em folículos antrais bovinos recrutados e selecionados indicou que a seleção está associada ao início da expressão do gene LHR em células da granulosa de bovinos (BAO & GARVERICK, 1998). Recentemente, tornou-se evidente que outros fatores produzidos localmente atuam em um controle autócrino/parácrino da foliculogênese, desempenhando um papel essencial na modulação do crescimento de folículos e potencialização do efeito das gonadotrofinas (MIHM et al., 2000; MIYOSHI et al., 2007; GASPERIN et al., 2008; JUENGEL et al., 2009; FORTUNE et al., 2004).
Em espécies monovolatórias, como na espécie bovina, o período de seleção folicular resulta na diminuição do número de folículos em crescimento até o completo estabelecimento da dominância, em que geralmente é observado o crescimento de somente um folículo. Esta redução do número de folículos em crescimento se deve ao aumento da capacidade secretória de estradiol pelos folículos em desenvolvimento e com isso uma regulação na secreção de FSH (PRICE & WEBB, 1988; MIHM et al., 2000). O estrógeno atua sobre o receptor β (ER -β) inibindo a expressão de PDEńC (fosfodiesterase ń C), levando ao aumento da produção de AMPc, que facilita a ação do FSH (DEROO et al., 2009)
FSH interrompe o desenvolvimento dos folículos subordinados, mas ainda é suficiente para promover o crescimento do folículo dominante (ALVES et al., 2002). Durante o recrutamento folicular, um grupo de folículos torna-se dependente das gonodrotrofinas e inicia seu desenvolvimento (BARROS; FIGUEIREDO; PINHEIRO, 1995).
O oócito de mamíferos sofre mudanças significativas durante o desenvolvimento folicular, principalmente no período em que o folículo se torna dominante, evento que antecede ao pico pré-ovulatório de LH. Essas mudanças são chamadas de capacitação, e tem papel fundamental na aquisição da competência meiótica oocitária (DIELEMAN et al., 2002).
2.7 Maturação de oócitos bovinos
Na fase de maturação, o oócito torna-se competente para o reinício da meiose, fecundação e, subsequente, desenvolvimento embrionário até a ativação do seu genoma (SIRARD et al., 2007). A maturação ocorre de maneira gradual e sincronizada com os eventos foliculares, visto que o desenvolvimento do folículo e seu oócito são eventos paralelos e relacionados funcionalmente (SILVA et al., 2016).
Na maioria dos mamíferos, o oócito entra nos estágios iniciais da meiose durante a vida fetal e torna-se quiescente na fase de diplóteno da prófase I até que se tornem aptos a ovulação ou atresia (LONERGAN & FAIR, 2015) (Figura 6). Em vacas, por volta de 72-82 dias de gestação, alguns oócitos do feto já iniciam a primeira prófase meiótica, passando pelos estágios de leptóteno, zigóteno, paquíteno e diplóteno, no qual ocorre a primeira parada da meiose, também denominado estágio de dictióteno ou de vesícula germinativa (VG) (RICHARDS, 1980).
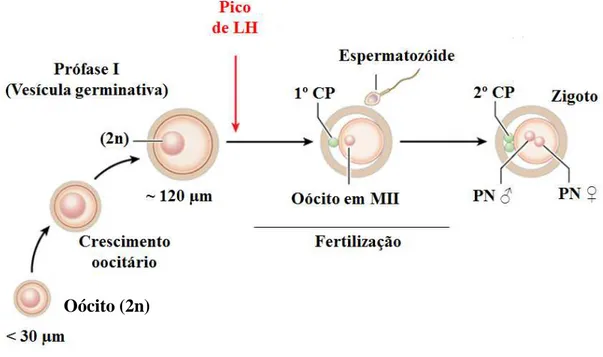
Figura 6. Representação esquemática do desenvolvimento oocitário em ovário de mamíferos. Oócitos imaturos permanecem quiescentes no estágio de VG (diplóteno-Prófase I). A retomada da meiose in vivo é marcada pelo pico pré-ovulatório de LH, que desencadeia a progressão da meiose até o estágio de metáfase II onde ocorre a extrusão do primeiro corpúsculo polar (CP). A meiose é então bloqueada novamente, e somente será retomada após fertilização, seguindo da expulsão do segundo corpúsculo polar e formação do oócito haploide fecundado. PN♂: pronucleo masculino; PN♀: pronúcleo feminino (adaptado de LONERGAN & FAIR, 2015).
In vivo, com o objetivo de produzir um oócito haploide, o reinício da divisão meiótica ocorre simultaneamente ao pico de LH em oócitos que completaram o crescimento através da completa competência meiótica (AYALON et al., 1972). Esta competência está correlacionada com o tamanho do oócito e o diâmetro do folículo. Na espécie bovina, oócitos com diâmetro em torno de 110-120 μm, inclusos em folículos de 2 a 3 mm de diâmetro, são considerados competentes para retomada da meiose (LEQUARE et al., 2005). No entanto, somente folículos dominantes com diâmetro maior que 12 mm são responsivos ao estímulo do LH nas células da granulosa bovinas (SARTORI et al., 2001). Alguns estudos têm demonstrado que a angiotensina II (Ang II) é um dos fatores que faz a intermediação da retomada da meiose induzida pelo pico de LH em oócitos bovinos e que este evento é dependente prostaglandinas (BARRETA et al., 2008). PORTELA et al. (2011) relataram que
a Ang II aumenta a expressão de RNAm para anfiregulina e epiregulina e desencadeia a cascata ovulatória. SIQUEIRA et al. (2012) mostrou que, semelhante a AngII e prostaglandinas, a progesterona (P4) também faz a intermediação da retomada da meiose após o estímulo das gonadotrofinas. NUTTINCK et al., (2011) reportaram que a produção de prostaglandina E2 pelas células do cúmulus aumenta a atividade de proteínas quinases ativadas por mitógenos (MAPK) no oócito durante o reinício da meiose em bovinos.
Em estudos in vitro, a completa remoção do oócito do ambiente folicular desencadeia espontaneamente o reinício da divisão meiótica (BEZERRA et al., 2016). Segundo LEIBFRIED & FIRST (1979), as células foliculares expressam fatores inibidores da progressão meiótica.
O bloqueio meiótico no estágio de VG é mantido por elevadas concentrações de monofostato cíclico de adenosina (AMPc) que é produzido pelas células da granulosa e transferido para o oócito via junções comunicantes do tipo GAP. O pico pré-ovulatório de LH, leva a uma redução nos níveis de AMPc, em função da ruptura das junções GAP (entre oócito e células do cumulus) e posteriormente pela redução da sua produção pelas células da granulosa (KAWAMURA et al., 2004). A redução nas concentrações de AMPc provoca a desfosforilação e consequente ativação do complexo fator promotor da meiose, que, por sua vez, está envolvido com a ruptura do envelope nuclear, condensação de cromatina, reorganização do citoesqueleto e bloqueio da atividade transcricional (MILLER; RUSSELL, 1992).
Já na maturação citoplasmática, são observadas modificações citoesqueléticas e moleculares no oócito que os tornam fertilizáveis e aptos a suportarem o desenvolvimento embrionário inicial (TOSTI, 2006). Gonadotrofinas hipofisárias e a comunicação local bidirecional entre as células do cumulus adjacentes e o oócito são importantes para maturação nuclear e citoplasmática (LONERGAN & FAIR, 2015).
Estes processos são essenciais para que ocorra a correta redistribuição das organelas citoplasmáticas e reorganização do citoesqueleto, bem como a estocagem de RNAm, proteínas e energia, dentre outros fatores necessários para o processo de maturação, fertilização e desenvolvimento embrionário (ANGUITA et al., 2007).
2.8 Ovulação
desencadeia a clivagem de proteínas da membrana celular, envolvendo proteases, colagenases e fatores vasoativos (ESPEY, 1980).
Após a ligação do LH ao seu receptor (LHR), presente em células da granulosa e da teca de folículos dominantes (PENG et al., 1991), a clássica via da adenosina monofosfato cíclica (AMPc) e da proteína quinase dependente de AMPc (PKA) são ativadas e induzem a expressão de fatores parácrinos e autócrinos que iniciam a cascata ovulatória (MARSH, 1976; RICHARDS, 2001; CONTI, 2002). A partir do pico de LH, o oócito retoma sua capacidade de reiniciar a meiose, o complexo cumulus oócito inicia o processo de expansão e os andrógenos sintetizados nas células da teca são transportados para as células da granulosa, sofrem a ação da aromatase e são convertidos em ń7β-estradiol (ESPEY, 1980).
O aumento na concentração de AMPc nas células da granulosa ativa a via da PKA que por sua vez, catalisa a fosforilação de proteína ligante do elemento de resposta ao AMPc (CREB – AMPc response element binding), um fator de transcrição nuclear que aumenta a transcrição de genes envolvidos no processo de ovulação (RICHARDS, 2001). Os fatores de crescimento semelhantes ao EGF como a ampirregulina (Areg), epirregulina (Ereg) e β -celulina (BTC) que se ligam aos receptores de EGF nas células da granulosa, induzem a expressão dos genes da cascata de produção de prostaglandinas em reposta ao LH, via AMPc (SHIMADA et al., 2006). As prostaglandinas parecem aumentar a atividade colagenolítica de tecido folicular, bem como a expressão de enzimas proteolíticas, tais como o fator ativador do plasminogénio tecidual (tPA- tissue pla sminogen activator) e plasmina (LI et al., 2006; FORTUNE et al., 2009). As prostaglandinas induzem a vasodilatação tecidual e alteração na região apical do folículo pré-ovulatório (SIROIS et al., 2004). Elas são produzidas a partir do ácido araquidônico pela via da cicloxigenase (COX). A COX possui duas principais isoformas: COX-1 e COX-2. A COX-1 é expressa em muitos tecidos de forma constitutiva (DEWITT & SMITH, 1995), enquanto a COX-2 é uma enzima induzível relacionada a processos fisiopatológicos (HINZ & BRUNE, 2002). Em vacas, a expressão de RNAm e proteína para COX 2 foi demonstrada em células da granulosa de folículos pré-ovulatórios (LIU et al., 1997; LIU & SIROIS, 1998).