CENTRO DE CIÊNCIAS
PROGRAMA DE PÓS-GRADUAÇÃO EM QUÍMICA
LABORATÓRIO DE PRODUTOS E TECNOLOGIA EM PROCESSSOS
Túlio Ítalo da Silva Oliveira
DESENVOLVIMENTO DE SENSORES ELETROQUÍMICOS
PARA DETECÇÃO DE MOLINATO E ÓXIDO NÍTRICO
Dissertação de Mestrado submetida à Comissão Julgadora do Curso de Pós- Graduação em Química da Universidade Federal do Ceará, como um dos requisitos para a obtenção do título de Mestre em Química.
Orientadora: Prof. Dra. Selma Elaine Mazzetto
DESENVOLVIMENTO DE SENSORES ELETROQUÍMICOS
PARA DETECÇÃO DE MOLINATO E ÓXIDO NÍTRICO
Dissertação de Mestrado submetida à Comissão Julgadora do Curso de Pós- Graduação em Química da Universidade Federal do Ceará, como um dos requisitos para a obtenção do título de Mestre em Química.
Orientadora: Prof. Dra. Selma Elaine Mazzetto
Dedico este trabalho aos meu pais,
Maria Elizeth da Silva Oliveira e
João José Ribeiro Oliveira,
Bênçãos que o Senhor escolheu para a minha acolhida ao mundo
Com muito amor, carinho, superação e trabalho digno como
Virtudes que tento seguir como exemplo.
Ao DEUS todo poderoso, fiel por toda vida e que nunca me deixou abandonar o barco, pois ele sempre esteve comigo pelejando, guerreando e decretando a minha vitoria, em nome do Senhor Jesus.
Aos meus pais, Elizeth e João José, por todo amor, carinho e dedicação durante essa minha caminhada de lutas e vitorias em meio à saudade de casa, sempre estiveram comigo sendo guiados por Deus para me ajudar em todos os momentos e sei que todos os ensinamentos que me transmitiram poderei levar pela vida inteira.
A minha irmã, Thaysmênia, que sempre será a minha menina Nena, pelo companheirismo em uma caminhada de muitas histórias de perseverança, amor e confiança onde em meio a todos os momentos, sempre estaremos unidos pela aliança fraternal feita pelo nosso Deus digno de toda honra e toda glória,
A minha noiva e futura esposa, Carolina, um presente de Deus em minha vida, uma benção mais que especial, onde na presença do Senhor somos mais que vencedores e unidos sendo capacitado para sermos uma só carne em uma aliança para toda vida, como diz a palavra viva do Senhor e eu vou até o fim por causa deste amor...
A Maria das Graças Bessa (Dona Graça), uma vida abençoada pelo Senhor para me ajudar em todas as horas, desde o momento em que a conheci no cursinho do colégio São José.
A minha tia Socorro, uma benção do Senhor em minha vida, muito especial, que sempre me ajudou, desde o dia em que decidi enfrentar a vida na capital.
A minha prima, Xeila Freitas, pelo amor de irmã e por todo o apoio em momentos muito importantes da minha vida estando sempre disposta a ajudar toda a família.
A professora Dra. Selma Elaine Mazzetto, pela orientação, oportunidade, ajuda e confiança a mim concedida. Sempre serei grato, pois viu meus passos, conhece um pouco da minha história, da minha luta e pelos bons conselhos dados e por ser uma pessoa especial na minha vida.
Aos professores Dr. Pedro de Lima Neto e Dra. Adriana Nunes Correia, pela oportunidade e confiança de realizar uma parte do trabalho no GELCORR onde aprendi com seus ensinamentos e sendo um agregado ao grupo sempre com o apoio para as discussões a cerca do trabalho.
dedicação para a realização de um excelente trabalho.
Aos professores e pesquisadores da EMBRAPA, Dr. Men de sá Moreira de Souza Filho e Dra. Morsyleide de Freitas Rosa, que me ajudaram com muito empenho durante meu estágio supervisionado proporcionando um crescimento científico e pessoal e fazendo com que se firmem excelentes parcerias para um melhor desenvolvimento profissional.
A todos os integrantes do Laboratório de Produtos e Tecnologia em Processos (LPT) que durante esses 6 anos tive a oportunidade de conviver e crescer com a experiência adquirida: Mayara Oliveira, Milena Esmeraldo, André Leandro, Norberto Bezerra, César Barreto,Tatiane Mota, Joyce Ellen, Luan Silva, Santiago Brito, Vivian Romero, Ana Angélica, Diego Lomonaco, Antônio Eufrázio, Janaina Leitinho, Pérsio Veloso, Fernando Luiz, Renata Paiva, Viviane Gomes, Claudenilson Clemente, Jonas Maia e João Paulo.
A todos os integrantes do grupo de pesquisa, GELCORR, que me acolheram durante o período de testes no laboratório com apoio e atenção para que tudo fosse desenvolvido de forma satisfatória.
Á Vanessa pelos ensinanentos com paciência e pela dedicação e força ao trabalho desenvolvido no GELCORR.
Aos integrantes do Grupo de Reações e Análises Químicas –GRAQ- e do ISEP que foram bastante receptivos e atenciosos ajudando-me a desenvolver a pesquisa em um intervalo de tempo muito pequeno, porém com muito incentivo para obter excelentes resultados. Em especial, aos pesquisadores Dra. Fátima Barroso e Dr. Subramanian Viswanathan que acompanharam o meu estágio no laboratório sempre dispostos a ajudar com capacidades incríveis em investigação científica para que tudo desse certo.
Aos integrantes do Laboratório de Valorização da Biomassa, na EMBRAPA, que sempre me apoiaram e estão prontos a ajudar para o meu crescimento.
Aos colegas de graduação e de pós-graduação que durante esses 6 anos de convivência foram bastante produtivos e promissor para que possamos futuramente firmar parcerias para um avanço maior em nosso meio: Silmara, Thalita, Pontes Filho, Josy,Helen, Patrícia,Wellington, Lair, Gisele, Willian,Estefânia, André, Artemízia, Milena Renato e Renata.
vida onde tivemos a oportunidade de conviver em outro país, mesmo distante dos nossos familiares, em um companheirismo e fraternidade que só Deus nos proporciona.
A minha tia Gorete Ribeiro, que está na gloria do Senhor Jesus, um exemplo de vida, uma educadora de respaldo e com uma grande contribuição para a cidade de Aracati, que desde cedo lutou pelos seus ideiais enfrentando lutas diante de toda a humildade, mas não desistiu e conseguiu muita vitorias para nossa família sendo um braço forte para cada um de nós e hoje só as boas lembranças são guardadas , como diz a palavra do Senhor, de uma pessoa tão abençoada.
A todos os meus irmãos na fé do Ministério Guerreiros de Oração (M.G.O.), em nome da minha Pastora Presidente, Miramar Estevam Sampaio, e a do seu esposo, Pr. Hélio Rodrigues, bênçãos mais que especiais que Deus colocou na minha vida, uma família que o Senhor me presenteou em um momento tão especial com um chamado para serví-lo em espírito e em verdade, como meu único Senhor e Salvador.
A Pra. Cleana Vanderley, uma mulher de Deus, guerreira de oração sempre disposta a ajudar orando, intercedendo e guerreando pela nossa vida.
Aos pastores Sérgio Santos (Portugal), Roberto Pontes e Maria de Jesus pelo apoio, carinho e oração como intercessores pela minha vida.
Aos meus irmãos guerreiros de oração e do Ministério de Louvor, instrumentos usados para louvar e exaltar o nome do Senhor: Sônia, Regina, Jerusa, Eduardo, Camila, Edna, Andréa, Fátima Lucena, Mirélia, John Victor, Conceição, Joel, Renan, Reinaldo, Daniel, Danielle, Levi, Suellen, Cileda, Jamille, Rejane, Rayssa, Anselmo, Norma, Cacilda, Glaydson, Renata, Mirian, Nágila e a todos que fazem parte do Exército do Senhor.
A todos os meus familiares (tios, primos e avós) que contribuíram para o meu crescimento com apoio, força e incentivo para vencer todos os obstáculos.
Á Família Paulino: Rosa, Jarbas, Nilzete, Isadora, Ana Rébem, Gabriel, Ana Luisa, Edna, Francisca, Darcy, Renata e Sofia, pessoas especiais que Deus colocou na minha vida.
“Por isso não temas, porque eu sou contigo; não te assombres, porque eu sou o teu
Deus. Eu te esforço e te ajudo, e te sustento com a destra da minha justiça. Eis que
envergonhados e confundidos serão todos os que se irritaram contra ti; tornar-se-ão
nada e os que contenderem contigo perecerão. Buscá-los-ás, mas não acharás, e os
que pelejarem contigo tornar-se-ão nada, e como coisa que não é nada os que
guerrearem contigo. Pois eu sou o Senhor teu Deus, te tomo pela tua mão direita e te
digo: Não temas, que eu te ajudo.”
E o que me faz crescer; Eu vivo pela fé, e não vacilo;
Eu não paro, eu não desisto,
Eu sou de Deus, eu sou de Cristo. Você mudou a minha história
E fez o que ninguém podia imaginar Você acreditou e isso é tudo Só vivo pra você
Não sou do mundo,não. A honra, a glória, a força
O louvor a Deus E o levantar das minhas mãos
É pra dizer que te pertenço, Deus. Eu te agradeço, Deus
Que no deserto não me deixou morrer
E nem desanimar E como aquela mãe, que não desiste
você não se esqueceu, você insiste...
1. INTRODUÇÃO...16
1.1. LCC e seus constituintes...17
1.1.1. Cardanol e suas Aplicações...19
1.2. meso-Porfirinas...21
1.3. Sensores...22
1.4. Biossensores: Funcionamento e suas Aplicações...23
1.5. Os pesticidas e suas aplicações...25
1.5.1. Atuação ambiental no Brasil...26
1.5.2. Atuação dos pesticidas em Portugal...28
1.5.3. Molinato...29
1.5.4.Técnicas analíticas para a detecção de pesticidas...33
2. OBJETIVOS...34
2.1. Objetivo geral...34
2.2. Objetivos específicos ...34
3. PROCEDIMENTO EXPERIMENTAL....35
3.1. Obtenção da meso-porfirina base livre...35
3.1.1. 1-(2-bromo-etoxi)-3-pentadecilbenzeno...35
3.1.2. 4-[2-(3-pentadecilfenoxi)-etoxi]-benzaldeído...36
3.1.3. 5, 10, 15, 20-tetra-[4-(2-(3-pentadecilfenoxi)-etoxi)-fenil]-porfirina...37
3.1.4. Cu(II)5,10,15,20-tetra-[4-(2-(3-pentadecilfenoxi)-etoxi)-fenil]-porfirina...38
3.1.5. Caracterização dos compostos...39
3.2. Modificação da Superfície do Eletrodo de Ouro...40
3.3. Construção do Biossensor...42
3.3.1. Metodologia Empregada na Construção do Biossensor...43
3.3.4. Medidas Eletroquímicas...45
3.3.5. Análise das Amostras de Águas Contaminadas de Arrozais...46
4. RESULTADOS E DISCUSSÃO....48
4.1. Caracterização dos Precursores...48
4.1.1. Cardanol (3-n-PDF)...48
4.1.2. 1-(2-bromo-etoxi)-3-pentadecilbenzeno (Composto 1)...51
4.1.3. 4-[2-(3-pentadecil-fenoxi)-etoxi]-benzaldeido (Composto 2)...52
4.1.4. Meso-porfirina base livre (H2Pp)...54
4.1.5. CuII – meso – porfirina (CuPp). ...58
4.2. Modificação da Superfície do Eletrodo de Ouro pela CuII-meso-porfirina e aplicação como sensor para NO...61
4.3. Obtenção do biossensor...74
4.3.1. Avaliação da atividade da GST e Caracterização eletroquímica do GCE/APTES/GDA/GST...74
4.3.2. Quantificação de Molinato em amostra de água contaminada de arrozais...77
5. CONSIDERAÇÕES FINAIS....83
REFERÊNCIAS BIBLIOGRÁFICAS...84
obtenção de uma meso-metaloporfirina, a partir de uma meso-porfirina base livre, macromolécula derivada do Líquido da Casca da Castanha de Caju (LCC), subproduto do agronegócio do caju. A obtenção dessas espécies seguida de estudos preliminares da modificação da superfície do eletrodo de ouro com a meso-metaloporfirina de cobre com aplicação para sensor de NO (Óxido Nítrico) também compõe os objetivos desse trabalho. A partir do processo de metalação,foi sintetizada uma meso-metaloporfirina utilizando Cu (II) como centro metálico, a partir da macromolécula base livre, e testes voltamétricos foram realizados utilizando o eletrodo de ouro, em meio de diclorometano e PTBA 0,1 mol L-1, obtido a 100 mV s-1.Estudos foram realizados a cerca do comportamento eletroquímico dos filmes formados em presença de NO em meio aquoso de Na2SO4 0,5 mol L-1 obtendo o voltamograma cíclico para o eletrodo de ouro
modificado com a porfirina de cobre(II) na detecção de NO e foi observado no voltamograma para NO sobre uma intensidade de corrente 7,6 vezes maior comparada à do pico observado para o mesmo processo do NO na superfície de ouro não modificado demonstrando elevado potencial para aplicação como sensor eletroquímico. Outra metodologia eletroanalítica foi desenvolvida para a obtenção de um biossensor, baseado em uma enzima, glutationa-S-transferase (GST), para determinação do pesticida molinato, um herbicida pré-emergente, em amostras reais de água de campos de arrozais da cidade do Porto, em Portugal. A construção deste biossensor baseou-se a imobilização de GST em um eletrodo de carbono vítreo (GCE), através da ligação covalente glutaraldeído-amino-silano (APTES/GA). O princípio deste biossensor consistiu no processo de inibição da GST promovida pelo molinato. A curva de calibração foi obtida por meio da técnica de voltametria de pulso diferencial (VPD) variando a concentração do pesticida entre 1,01x10-6 – 4,20x10-5 mol L-1 apresentando um limite de detecção (LD) de 0,064 mg L-1. O biossensor baseado na GST foi aplicado para quantificar o molinato nas amostras de água das lavouras de arrozais. Os resultados obtidos com este biossensor foram comparados com aqueles obtidos por HPLC e não houve diferenças estatisticamente significativas comprovando, então, que a metodologia desenvolvida foi precisa no nível de concentração estudada.
This study illustrates the development of synthetic route will be obtaining meso-metalloporphyrin, from porphyrin meso-free base macromolecule derived from Shell Liquid Cashew Nut (CNSL), byproduct of cashew agribusiness. Obtaining these species followed by preliminary studies of surface modification of gold electrode with copper meso-metalloporphyrin with application to sensor of NO (Nitric Oxide) also composed the objectives of this work. From metalation process, was synthesized by meso-metalloporphyrin using Cu (II) the a metal to center, from the macromolecule free base, and voltametric tests were carried out using the gold electrode in the middle of dichloromethane and TBAP 0,1 mol L-1, obtained at 100 mV s-1. Studies have been conducted about the electrochemical behavior of the films formed in the presence of NO in aqueous Na2SO4 0,5 mol L-1 the cyclic voltammogram obtained will be the gold
electrode modified with porphyrin to copper (II) the detection of NO and voltammogram was observed in about one NO to current intensity 7,6 times larger compared to the peak observed for the same process of NO in unmodified gold surface showing high potential for application as an electrochemical sensor. Electroanalytical another methodology was developed will be obtaining the biosensor, based on an enzyme, glutathione-S-transferase (GST), will be determining the pesticide molinate, the real daily pre-emergent herbicide in samples of to water of paddy fields City Porto, in Portugal. The construction of this biosensor was based on the immobilization of GST in glassy carbon electrode (GCE) by covalent glutaraldehyde-amino-silane (APTES/GA). The principle of this biosensor consisted of the process promoted by inhibition of GST molinate. The calibration curve was obtained by the technique of differential pulse voltammetry (DPV) varying the concentration of the pesticide
between 1,01 x10-6 to 4,20 x10-5 mol L-1 having a limit of detection (DL) of 0,064 mg L-1. The biosensor based on GST was applied to quantify the molinate in
water samples of paddy crop. The results obtained with this biosensor were compared with those obtained by HPLC and no statistically significant differences proving therefore that the developed methodology has been studied in terms of concentration.
Figura 2: Estruturas dos constituintes do LCC ... 19
Figura 3: Cardanol Hidrogenado (ou 3-n-Pentadecilfenol)... 20
Figura 4: Estrutura base de uma porfirina do tipo meso ou 5,10,15,20: (A) Base livre; (B) Metalada. ... 21
Figura 5: Representação esquemática de um biossensor ... 24
Figura 6: Estrutura química do molinato. ... 29
Figura 7: Transferência do molinato para o meio ambiente ... 30
Figura 8: Mecanismos da degradação do molinato nas plantas e solos ... 32
Figura 9: Processo sintético para obtenção do derivado bromado (composto1) ... 36
Figura 10: Processo sintético para obtenção do derivado aldeídico (Composto 2)... 37
Figura 11: Processo sintético de obtenção da meso-porfirina (Composto 3 = H2Pp) .. 38
Figura 12: Processo sintético para a obtenção da CuII-meso-porfirina. ... 39
Figura 13: Células eletroquímicas: (a) eletropolimerização e (b) análise dos interferentes (NO2-, dopamina e serotonina) ... 41
Figura 14: Potenciostato utilizado nas determinações voltamétricas... ... 42
Figura 15: Ilustração esquemática do conjunto de três eletrodos... 43
Figura 16: Representação da preparação do biossensor usado nesse trabalho. ... 45
Figura 17: Espectro CG-EM do 3-n-PDF. ... 48
Figura 18: Espectro de RMN –1H para o 3-n-PDF. ... 49
Figura 19: Espectro de expansão 1 de RMN –1H para o 3-n-PDF ... 50
Figura 20: Espectro de expansão 2 de RMN –1H para o 3-n-PDF . ... 50
Figura 23: Espectro de CG-EM do Composto 2. ... 53 Figura 24: Espectros de RMN –1H para o composto 2 ... 54
Figura 25: Espectro ESI-MS para a H2Pp. ... 55
Figura 26. Espectros de RMN –1H para a H
2Pp.. ...56
Figura 27: Espectros na região do UV-Visível para H2Pp em diclorometano. ... 57
Figura 28: Espectro na região do UV-Vísivel da CuII-meso-porfirina, 2,5x10-6molL-1 em diclorometano (A) e (B) expansão do espectro. ... 59 Figura 29: Espectro APCI-MS para a CuII-meso-porfirina em diclorometano ... 60 Figura 30: Perfil voltamétrico da meso-porfirina base livre (0,05mg.mL-1) em diclorometano e PTBA 0,1mol L-1 obtidos a 100 mV.s-1. ... 62
Figura 31: Perfil voltamétrico da CuPp (0,05mg.mL-1) em diclorometano e PTBA 0,1mol L-1 obtidos a 100 mV.s-1. ... 62
Figura 32: Perfis voltamétricos do eletrodo de ouro: ( ) não modificado e ( ) modificado na presença de uma solução de 2,85x10-5 mol L-1 NO em meio de Na2SO4
0,5 mol L-1. ... 63
Figura 33: Curvas analíticas para os eletrodos de Au e Au/CuPp obtidos em solução de
0,2 mol L-1 Na2SO4 contendo NO no intervalo de concentração
de 2,85 x 10-6 mol L-1 - 2,82 x 10-5 mol L-1 e usando com os seguintes parâmetros: f = 100s-1, a = 50 mV e ΔEs = 2 mV, na Voltametria de Onda Quadrada (VOQ) ... 64 Figura 34: (A) Voltamogramas de onda quadrada para o NO em Na2SO4 em função da
concentração de NO usando como sensor o eletrodo de ouro modificado com a CuPp. A expansão (B) ilustra a curva analítica média da intensidade de corrente de pico versus a concentração de NO. ... 67
Figura 35: Voltamogramas de onda quadrada para o NO em Na2SO4 em função da
como sensor o eletrodo modificado com CuII-meso-porfirina. (A concentração de NO de cada voltamograma está identificada pelos algarismos de I a X, ao lado da Figura). .... 72
Figura 38: Curvas analíticas dos interferentes NO2- + NO e dopamina + serotonina +
NO comparando-as com a curva do NO ... 73
Figura 39: Gráfico da absorvância em função do tempo a 340nm. Representa a reação entre diferentes volumes da enzima GST na presença do seu substrato [1,0x10-3 mol.L-1 CDNB, 1,0x10-3 mol.L-1 glutationa reduzida e 0,1 mol.L-1 PBS ( pH 6,0)] ... 74
Figura 40: Comportamento eletroquímico do eletrodo enzimático modificado em 1x10-3 mol L-1 de GSH, 1x10-3 mol L-1 CDNB e 1x10-3 mol L-1 [Fe (CN) 6]4- como
mediador de elétrons ... 76
Figura 41: Voltamogramas de pulso diferencial obtido com concentrações crescentes de molinato em 1x10-3 mol. L-1 GSH, 1x10-3 mol. L-1 CDNB e 1x10-3 mol. L-1 [Fe (CN)6]4- como mediador de elétrons.. ... 78
Figura 42: . Relação entre a Intensidade de corrente de pico (Ip) e a concentração de molinato ... 79
Figura 43: Curva de calibração de percentagem de inibição (IR, %) da atividade da GST versus o logaritmo da concentração de molinato. ... 80
Tabela 1: Classificação dos Pesticidas quanto ao organismo alvo ... 26 Tabela 2: Comparação entre os VMP de alguns agrotóxicos regulamentados pela Portaria εS nº 518/2004 e a normatização internacional (OεS), em g δ-1 ... 27
Tabela 3: Vendas de produtos fitofarmacêuticos em 2010. ... 29 Tabela 4: Propriedades Físicas e Químicas do Molinato ... 31
Tabela 5: Condições experimentais para a realização dos ensaios voltamétricos no eletrodo de carbono vítreo. ... 46
Tabela 6.Os valores de e log para a meso-porfirina base livre ... 57 Tabela 7: Bandas de absorção B e Q para as macromoléculas obtidas ... 59 Tabela 8: Valores de razões m/z para a meso-porfirina base livre e metalada com Cu (II) com suas respectivas abundâncias relativas ... 61
Tabela 9: Parâmetros analíticos obtidos das curvas analíticas para a determinação de NO sobre os eletrodos de Au e Au / CuPp utilizando a VOQ ... 65
Tabela 10: Figuras de mérito para a determinação eletroanalítica de NO na presença de dopamina e serotonina em excesso ... 70
Tabela 11.Figuras de mérito para a determinação eletroanalítica de NO na presença de NO2- em excesso ... 72
Tabela 12. Determinação de molinato em amostra de água de campos arrozais usando o biossensor e o método do HPLC- UV ... 81
1. INTRODUÇÃO
A Química tem evoluído a níveis inquestionáveis em todas as suas áreas de atuação, colaborando principalmente para os avanços tecnológicos atuais, com diversos produtos fundamentais à sociedade. O aperfeiçoamento de processos mais inofensivos ao meio ambiente pode ser observado constantemente devido à grande preocupação que a sociedade e autoridades governamentais vêm demonstrando no assunto.
Todavia, essa evolução também acarreta em preocupações. O aumento das atividades produtivas na área de Química é um exemplo, tornando-se um dos potenciais causadores da poluição,uma vez que manipula substâncias muitas vezes tóxicas e inflamáveis que, após processos químicos, frequentemente, geram um “lixo
tóxico”(resíduo) que precisa ser tratado.[1]
Neste sentido, a busca por produtos e processos menos impactantes ao meio ambiente tem se tornado o objeto de muitas pesquisas. [2] É dentro deste contexto que se insere a Química Verde, definida como a invenção, o desenvolvimento e a aplicação de produtos e processos químicos para redução e/ou eliminação do uso e/ou a geração de substâncias perigosas. [3]
No Brasil, essa temática ainda é incipiente, entretanto, a comunidade científica já começa a reconhecer a filosofia da Química Verde como uma estratégia importante no que se refere ao problema do meio ambiente, não só nas pesquisas, como também na inserção deste conceito nos cursos de graduação.[3] Essa conscientização também vem crescendo no sentido da utilização de rejeitos e subprodutos obtidos dos mais diversos processos industriais.
De acordo com as novas diretrizes que regem as legislações ambientais a utilização de novos produtos/processos capazes de aproveitar ou minimizar os impactos provocados por esses materiais é vista como uma contribuição muito positiva sob todos os aspectos, econômico, social e ambiental.
matéria-prima regional, renovável e abundante, do semiárido nordestino. A referida molécula será sintetizada, caracterizada e aplicada como um sensor eletroquímico para detecção de óxido nítrico (NO).
A partir dos fundamentos estabelecidos na vertente de Química Verde, o trabalho também contemplou o desenvolvimento de uma metodologia eletroanalítica, a construção de um biossensor eletroquímico enzimático (Glutationa-S-transferase – GST) e sua aplicação na determinação do pesticida Molinato em águas de arrozais da cidade do Porto, em Portugal.
1.1. O LCC e seus Constituintes
O fruto do cajueiro, popularmente conhecido como castanha de caju, é um aquênio de comprimento e largura variável, casca coriácea lisa, mesocarpo alveolado, repleto de um líquido escuro quase preto, cáustico e inflamável, chamado de Líquido da Casca da Castanha do Caju (LCC) ou Cashew Nut Shell Liquid (CNSL) como é conhecido internacionalmente. Na parte mais interna da castanha está localizada a amêndoa, constituída de dois cotilédones carnosos e oleosos, que compõem a parte comestível do fruto, revestida por uma película em tons avermelhados.[5] A amêndoa representa cerca de 28-30% do peso do fruto enquanto a casca fica responsável pelo restante. Já o LCC constitui cerca de 30-35% da casca da castanha, o que significa aproximadamente 67% do peso bruto da mesma (Figura 1).[4]
Figura 1. Corte longitudinal da amêndoa de castanha de caju e sua estrutura.[5]
O LCC é um subproduto da agroindústria do caju e uma importante fonte vegetal de compostos fenólicos, cujo anel aromático possui uma cadeia lateral na posição 3, com grau de insaturação variável, podendo ser extraído por vários métodos.[6] O LCC é constituído por uma mistura de compostos fenólicos com cadeia alquílica de 15 átomos de carbono na posição meta do anel aromático, podendo ter de 0 a 3 insaturações, nas posições 8, 11 e 14 respectivamente (Figura 2).
Figura 2. Estruturas dos constituintes do LCC.
Fonte: O Autor
1.1.1. Cardanol e suas Aplicações
O LCC tem como seu principal constituinte o cardanol, uma mistura de 3-alquilfenois produzidos pela reação de descarboxilação do ácido anacárdico a altas temperaturas, conseqüência do tratamento industrial durante a eclosão das Amêndoas de Castanha de Caju (ACC). O LCC quando destilado gera compostos com duplas ligações entre os átomos de carbono de cadeia lateral, localizada na posição meta do anel aromático.[4]
A presença de insaturações na cadeia alifática do cardanol possibilita a obtenção de reações indesejáveis na funcionalização do produto acarretando uma redução no
O H
C15H(31 -2n) O H
C15H(31-2n) O
O H
O H
C15H(31 -2n) O
H
O H
C15H(31 -2n) C
H 3
O H
Ácido Anacárdico Cardanol
Cardol 2- m etilcardol
n = 0
n = 1
n = 2
n = 3
rendimento do processo. Como otimização do procedimento a utilização do cardanol hidrogenado, onde o produto é submetido ao processo de hidrogenação (onde o hidrogênio é introduzido ao meio reacional) utilizando um catalisador como, por exemplo, o óxido de paládio, cobre, níquel ou ainda a mistura destes (Figura 3) aumenta a eficiência do processo com uma maior superfície de contato para que as reações possam ocorrer evitando a formação de outros produtos, isto porque neste trabalho utiliza-se o cardanol para posteriores sínteses de obtenção de porfirina.[7]
Figura 3. Cardanol Hidrogenado (ou 3-n-Pentadecilfenol).
Fonte: O Autor
O uso industrial do cardanol e seus derivados vêm sendo bastante divulgado.[8,9] Recentes pesquisas envolvendo sínteses de glocolipídeos vêm sendo explorada em um esforço combinando a Química Verde e Supramolecular, fazendo uso de recursos renováveis como material de partida para a obtenção de nanotubos orgânicos não covalentes, como potencial aplicação em nanofabricação, catálise, medicina, eletrônica molecular, armazenamento de hidrogênio e separação molecular.[8-10]
1.2. meso-Porfirinas
A palavra porfirina tem origem do grego “porphura” que significa “da cor púrpura” (Figura 4A). Sua estrutura macrocíclica foi proposta pela primeira vez por Küster em 1912, mas só em 1929 Fischer teve sucesso na sua obtenção, a partir de pirrol.[13,14]
Seus análogos metalados, as metaloporfirinas, são o resultado da troca de dois átomos de hidrogênio centrais do anel, por um cátion metálico (Figura 4B). Durante o processo de metalação ocorre uma mudança na simetria do anel porfirínico, diretamente proporcional ao tamanho do cátion, influenciando a conformação do anel e,
conseqüentemente, a estabilidade da porfirina. Íons como o vanadilo (V2+) e férrico
(Fe3+), por exemplo, que possuem raios de 60 e 65 pm respectivamente, são considerados os de tamanho ideal para a coordenação ao centro da porfirina, cujo raio é em torno de 62 pm.[15]
Figura 4. Estrutura base de uma porfirina do tipo meso ou 5,10,15,20: (A) Base livre; (B) Metalada.
1.3. Sensores
Nas últimas décadas, a obtenção de novos materiais tem despertado grande interesse e muito destaque devido à possibilidade de formação de interfaces para sensores analíticos.
Como definição, sensor é um dispositivo que transforma a informação química como característica inerente á concentração molecular de um determinado composto em um sinal analiticamente utilizável. Sensores eletroquímicos possuem alta sensibilidade, resposta rápida e requerem pequenas quantidades de material para sua fabricação. [12]
A aplicabilidade destes novos materiais vem crescendo a partir de estudos científicos visando novas descobertas, como na área de macromoléculas associada à utilização de porfirinas e metaloporfirinas, com ênfase em estudos eletroquímicos na determinação de moléculas biológicas.[10] As porfirinas e metaloporfirinas formam filmes estáveis e bastante homogêneos sobre a superfície de vários substratos, como o óxido de estanho dopado com flúor (FTO), o óxido de estanho dopado com fluor e índio (ITO), carbono vítreo e outros. [16-19]
A eletrodeposição desses compostos sobre as superfícies metálicas como a de ouro (Au), platina (Pt) ou carbono vítreo (GCE) fazem com que suas propriedades sejam transferidas para a superfície do eletrodo tornando-os passíveis de serem usado como sensores analíticos na detecção de moléculas biológicas, em especial o óxido nítrico (NO).
O NO é uma molécula que possui a capacidade de ser benéfica ou potencialmente tóxica, dependendo da concentração empregada. Entretanto, monitorar a concentração de NO é difícil devido ao seu curto tempo de vida, baixas concentrações para detecção e alta reatividade com outros componentes biológicos, gerando
rapidamente as formas nitrito (
2
NO ) e nitrato (NO3).[20]
de NO: ele deve ser capaz de determinar NO na presença de íons interferentes como
2
NO e neurotransmissores.[21]
1.4. Biossensores: Funcionamento e Aplicações
O uso de enzimas para fins analíticos vem crescendo desde a década de 60, quando Clark e Lyons (1962) vislumbraram a idéia de usar uma enzima aliada a um eletrodo para determinação de glicose no controle de diabetes.[22] Neste caso, um sensor foi desenvolvido baseado na oxidação de glicose em ácido glicônico, envolvendo consumo de oxigênio e formação de peróxido de hidrogênio, por ação da enzima glicose oxidase, de forma que o oxigênio ou peróxido consumido poderiam ser detectados.
Posteriormente, os dispositivos criados a partir da junção de uma enzima com um eletrodo receberam o nome de “Eletrodos Enzimáticos”. Contudo, com o desenvolvimento pela busca de novos sensores físico-químicos, em especial utilizando reações enzimáticas variadas, foi introduzido um termo mais genérico e abrangente, “Biossensor”.[23]
A ciência dos biossensores é uma área multidisciplinar que justifica as várias formas de definição de um biossensor, mas de forma geral, trata-se de uma ferramenta analítica que combina biomoléculas imobilizadas com transdutores químicos ou físicos para criar uma superfície que permita a medição direta, possivelmente contínua, de um analito específico.
Assim, um biossensor combina a especificidade de um componente biológico ativo para o analito de interesse com a sensibilidade de um transdutor para conversão do sinal biológico em elétrico, proporcional à concentração do analito.[24] Um biossensor deve ser claramente diferenciado de um sistema bioanalitico, o qual requer etapas adicionais de processamento, como a adição de reagentes e o componente biológico não estar necessariamente ligado diretamente ao detector.
fornecer informação analítica ”especifica”, quantitativa ou semi-quantitativa usando um elemento de reconhecimento biológico (receptor bioquímico) o qual está em contato espacial direto com um elemento de transdução”.[25]Então, de um modo geral, um biossensor é formado de duas partes: o componente biológico e o transdutor. O componente biológico faz o reconhecimento da substância de interesse por meio de uma reação química, gerando um sinal que pode resultar de uma variação na concentração de prótons, liberação de gases, emissão ou absorção de luz, emissão de calor, variação de massa, mudança de estado de oxidação, etc. O transdutor converte este sinal em uma resposta mensurável, como corrente, potencial, variação de temperatura etc. [24]
O funcionamento de um biossensor, de uma forma geral, envolve a especificidade e alta sensibilidade do componente biológico com o substrato de interesse. Em seguida, como produto desta interação, variações de um ou mais parâmetros físico-químicos são convertidos em um sinal elétrico quantificável e processável pelo uso de um transdutor adequado (Figura 5).[26]
Figura 5. Representação esquemática de um biossensor.[26]
Fonte: ARYA, S.K.; DATTA, M.; MALHOTRA, B.D.; Biosensors and Bioelectronics, 23 (2008) 1083.
um determinado produto. Algumas enzimas mostram uma sensibilidade específica para uma molécula em particular (substrato).
Os sensores eletroquímicos podem ainda ser classificados como sendo voltamétricos [27-30], potenciométricos[29-30], impedimétricos[31] e biossensores eletroquímicos (baseados em enzimas).[32-33]
As vantagens dos biossensores em relação às técnicas convencionais não se limitam à sensibilidade e seletividade, mas ao fato da rapidez nas análises e dos gastos mínimos de reagentes adequando-se aos princípios da Química Verde e, assim, proporcionando agilidade na obtenção dos resultados e redução no custo.
Os biossensores são aplicados no meio ambiente, como no monitoramento de pesticidas onde geralmente empregam a acetilcolinesterase como enzima imobilizadora e monitoram a ocorrência de inibição da enzima por organofosforados e carbamatos, pois tais substâncias ligam-se ao centro ativo da enzima, impedindo a reação de hidrólise da acetilcolina em colina e acetato. [23]
1.5. Os pesticidas e suas aplicações
Tabela 1. Classificação dos Pesticidas quanto ao organismo alvo. [35]
Fonte: TOMLIN, C.D.S.; The Pesticide Manual, 11 ed. Surrey, UK, British Crop Protection Council, 1997.
1.5.1. Atuação ambiental no Brasil
No Brasil, a demanda por pesticidas vem se acentuando anualmente, destacando-se como um dos maiores consumidores mundiais. Recentemente, o estado do Rio Grande do Sul (RS) foi responsável por 10,4% do consumo Nacional de pesticidas, devido à intensa atividade agrícola, com destaque ao molinato para o cultivo de arroz irrigado.[36]
A atual legislação brasileira de potabilidade de água, portaria do Ministério da Saúde (MS) nº 518/2004, regulamenta 54 substâncias químicas que representam riscos à saúde humana, dentre as quais 22 são agrotóxicos.Na Tabela 2 estão relacionados os agrotóxicos regulamentados e os valores médios permitidos (VMP) correspondentes, estabelecidos pela Organização Mundial da Saúde (OMS) como por exemplo, o molinato onde os VMP são de 6 g δ-1 (em destaque na Tabela 2).
Tipos de pesticida Organismo alvo Tipos de pesticida Organismo alvo
Acaricida Ácaros Larvicida Larvas de insetos
Algicida Algas Bactericida Bactérias
Avicida Pássaros Nematicida Nematóide
Herbicida Plantas Piscicida Peixes
Fungicida Fungos Raticida Roedores
Tabela 2. Comparação entre os VMP de alguns agrotóxicos regulamentados pela Portaria MS nº 518/2004 e a normatização internacional (OεS), em g L-1. [37]
Fonte: BRASIL, Ministério da Saúde: Portaria MS nº 518, de 25 de março de 2004. Brasília: Ministério da Saúde, p.455, 2005.
No Ceará, por busca por maiores produtividades, o uso de fertilizantes e agrotóxicos na agricultura tem se intensificado consideravelmente. Considerado o maior do Nordeste e quarto do Brasil, em 2011, por quantidade de estabelecimentos que usam agrotóxicos, o Ceará dobrou, em cinco anos, a venda de veneno e ampliou em 963,3% a venda de ingredientes ativos para os venenos. O dado faz parte de estudo coordenado pela Universidade Federal do Ceará (UFC), consta de pesquisa de doutorado na Universidade de São Paulo (USP) e foi extraído do Censo Agropecuário do Instituto Brasileiro de Geografia e Estatística (IBGE).[38]
Diante desse quadro, a identificação e a avaliação de perigos ambientais e riscos à saúde se tornam importantes ferramentas para contribuir para o controle e a prevenção da exposição da população à esses resíduos tóxicos, com uma estatística preocupante onde mais de um bilhão de litros de venenos foram jogados nas lavouras em 2010, de
Parâmetro/ Pesticidas
Portaria MS nº 518 ( g L-1)
Guias OMS ( g L-1)
Alacor 20 20
Aldrin\ Dieldrin 0,03 0,03
Atrazina 2 2
Clordano (isômeros) 0,2 0,2
DDT (isômeros) 2 1
Glifosato 500 -
Metalacloro 10 10
Molinato 6 6
Pendimetalina 20 20
Pentaclorofenol 9 9
Simazina 2 2
acordo com dados do Sindicato Nacional da Indústria de Produtos para Defesa Agrícola (SINDAG).[39] O consumo de agrotóxicos cresce de forma correspondente ao avanço do modelo do agronegócio, que concentra a terra e utiliza grande quantidade de venenos para para garantir a produção em escala industrial.[38,39]
1.5.2. Atuação dos pesticidas em Portugal
De acordo com a Direção Geral da Proteção das Culturas (DGPC), o consumo de Pesticidas em Portugal no ano de 2010 foi de aproximadamente 14 000 toneladas.[40]A Tabela 3 apresenta o volume de vendas de produtos fitofarmacêuticos relativamente ao ano de 2010. O grupo “Outros” inclui além de outros produtos fitofarmacêuticos, o óleo vegetal e dazomete (3,5-dimetil-1,3,5-tiadiazina-2-tiona).[41]
Os riscos para o meio ambiente resultantes da aplicação de pesticidas são dependentes das suas propriedades físicas e químicas, dos processos de dissipação e degradação, e ainda, de outros fatores como grau de toxicidade, quantidade de pesticida aplicada, formulação utilizada, método e tempo de aplicação e a extensão do seu uso.[42]
Tabela 3. Vendas de produtos fitofarmacêuticos em 2010. [41]
Função Quantitativo Vendido (Kg)
Fungicidas 9 475 374
Herbicidas 2 042 283
Insecticidas e Acaricidas 370 935
Moluscicidas 18 375
Reguladores de Crescimento 7 987
Rodenticidas 530
Óleo Mineral 542 247
Fumigantes de Solo 1 316 414
Outros 21 104
Total 13 795 249
Fonte:Diagnóstico ambiental sobre os pesticidas. Disponível em: < http://www.drapc.minagricultura.pt/base/documentos/vendafitofarm2010.pdf>. Acesso
em: 31 jan. 2013.
1.5.3. Molinato
O molinato, nome cientifico S-etilo-N,N-hexametileno-tiocarbanato, é um exemplo de herbicida seletivo sistêmico, pertencente à família dos tiocarbamatos, o qual é adsorvido pelas raízes dos infestantes inibindo o crescimento das pragas emergentes, através da sua rápida absorção radicular e transporte até às folhas.[43] A fórmula química do molinato é C9H17NOS e a sua estrutura encontra-se representada a seguir (Figura 6). Figura 6. Estrutura química do molinato.
Não há indícios da propagação do molinato no Brasil como causador de poluição ambiental. Em Portugal, ele é um dos pesticidas mais estudados, isolado ou associado a outros pesticidas, em formulações líquidas ou granulares, nos vales dos rios Guadiana, Mondego, Tejo e Vouga. Após ser aplicado no campo de cultivo, o molinato é dissipado sob evaporação. Este fenômeno ocorre em grande escala devido aos extensos lençóis freáticos que cobrem os arrozais associado [44] Uma pequena fração do molinato é ainda adsorvida pelas plantas e o restante eliminado por fotodegradação (Figura 7).
Figura 7. Transferência do molinato para o meio ambiente.
Fonte: O Autor
Na Tabela 4 encontram-se algumas das características do molinato quanto as suas propriedades físicas e químicas.
Volatilização
Fotodegradação
Degradação Química
Absorção
Adsorção
Colheita
Escoamento
Degradação Microbiana
Tabela 4. Propriedades Físicas e Químicas do Molinato.[45]
Propriedade
Valor
Pressão de Vapor (mPa) 746 (a 25ºC)
Constante de Henry (atm mol-1 m3) 1,6x10-5
Adsorção (Koc) 190 (25ºC)
Bioacumulação (Kow) 2,88
Massa Molecular (g mol-1) 187,32
Massa Específica (g cm-3) 1,065
Ponto de Ebulição (ºC) 202
Solubilidade em Água (mg L-1) 800 (a 20ºC)
Fonte: HOLDEN, L.R.; GRAHAM, J.A.; WHITMAN, R.W.; ALEXANDER, W.J.; PRATT,R.W.; et al. Environmental Science and Technology, 26 (1992) 935.
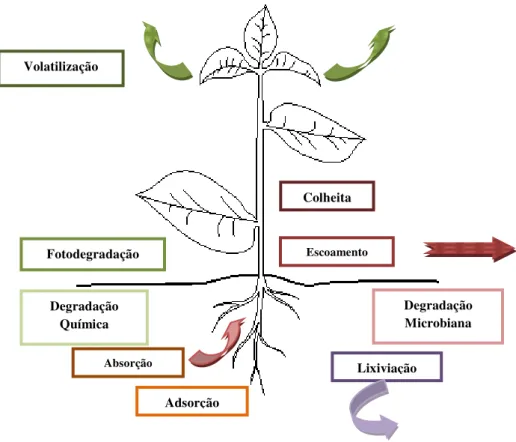
Os mecanismos propostos [46-48] para a degradação do molinato no solo e nas plantas podem ser obtidos por três rotas (Figura 8) descritas a seguir.
Rota 1: O átomo de enxofre é oxidado a sulfóxido de molinato e, posteriormente, a sulfona de molinato; o primeiro pode ser convertido em compostos conjugados e o segundo em hexametilenoimina (hexahidroazepina);
Rota 2: Os carbonos C2 do anel são oxidados a derivados hidroxila
(2-hidroximolinato ou 4-(2-hidroximolinato), posteriormente transformados em oxo derivados (2-oxo-molinato ou 4-oxo-molinato);
Figura 8. Mecanismos da degradação do molinato nas plantas e solos.[48]
Fonte: Adaptado de CAMPBELL, A.; Regulatory Toxicology and Pharmacology, 53 (2009) 200.
Segundo vários autores, a última rota descrita (Rota 3) corresponde ao mecanismo preferencial da degradação do molinato. [40,46,48] Estudo recente mostra ainda que a Glutationa–S–Transferase é a principal responsável pelas reações de destoxificação do sulfóxido de molinato (Figura 8).[49] Tendo em vista que o molinato é um potencial contaminante das águas superficiais, aquíferos e solos, com a agravante de ser tóxico formando metabólitos por rotas químicas, físicas e biológicas com grau de toxicidade ainda maior[44], várias metodologias têm sido desenvolvidas de modo a quantificar e detectar molinato ou seus metabolitos em amostras ambientais.
Sulfonato de Molinato
Hexahidroazepina Glutationa-S- Transferase
Glutationa - Molinato
Mercapturato de Molinato Sulfóxido de Molinato
Rota 1
Molinato Molinatol
C2
(2) – 4- oxo - Molinato
Rota 2
(2) – 4-OH - Molinato
Rota 3
1.5.4. Técnicas analíticas para a detecção de pesticidas
Nos últimos anos, um grande número de publicações voltadas à análise de pesticidas e dos seus produtos de degradação vem sendo publicadas.[40,46,48] Como conseqüência, se verifica um avanço considerável no desenvolvimento de metodologias capazes de dosar estes compostos nas mais diversas matrizes.
2. OBJETIVOS
2.1. Geral
Desenvolver uma metodologia eletroanalítica para determinação de NO a partir da modificação de um eletrodo de ouro utilizando CuII-meso- porfirina, visando sua potencialidade de aplicação como sensor na presença de moléculas biológicas que interagem com o NO. Outro objetivo deste trabalho é obter um biossensor eletroquímico enzimático (Glutationa-S-Transferase) capaz de determinar o pesticida molinato em amostras ambientais.
2.2. Específicos
Desenvolver uma rota sintética para a obtenção de uma CuII-meso- porfirina, a partir da meso-porfirina base livre;
Modificar a superfície do eletrodo de ouro pela CuII-meso-porfirina para obtenção de um sensor capaz de determinar NO;
Verificar a influência de interferentes como NO2-, dopamina e serotonina na
detecção de NO em meio de Na2SO4;
Desenvolver uma metodologia para a obtenção de um biossensor eletroquímico enzimático, baseado na Glutationa-S-Transferase (GST);
3. PROCEDIMENTO EXPERIMENTAL
O Cardanol hidrogenado foi obtido através de destilação sob pressão reduzida e, posteriormente, submetido a um processo de hidrogenação catalítica em presença de paládio como catalisador, obtendo-se o derivado 3-n-pentadecilfenol (3-n-PDF), material de partida para os procedimentos sintéticos, de acordo com mostra a rota sintética a seguir.
3.1. Obtenção da meso-porfirina base livre
3.1.1. 1-(2-bromo-etoxi)-3-pentadecilbenzeno[54]
Em um balão de fundo redondo adicionou-se 4,0 g de cardanol (13,16 mmol) em 15 mL de dibromoetano. A mistura foi mantida sob agitação constante e refluxo e, após completa dissolução, adicionou se 2,2 g de hidróxido de potássio a solução (39,21 mmol). A seguir, deixou-se a mistura reagir por cerca de 8 horas e a partir daí não mais se observou mudança significativa na intensidade da mancha característica do produto ou material de partida (cardanol hidrogenado). O produto foi submetido à extração por solvente através de 3 sucessivas lavagens de 100mL cada, em funil de separação, utilizando solução de HCl 5%. O composto foi seco com Na2SO4 anidro,
Figura 09. Processo sintético para obtenção do derivado bromado (composto 1).
Fonte: O Autor
3.1.2 4-[2-(3-pentadecilfenoxi)-etoxi]-benzaldeído[54]
Em um balão de fundo redondo, sob agitação constante, adicionou-se 3,0 g (8,2 mmol) do composto (1); 1,33g (10,9 mmol) do 4-hidroxibenzaldeído em 15 mL de acetona. Após 40 minutos de reação adicionou-se lentamente 3,03 g (21,9 mmol) de carbonato de potássio e a reação foi realizada por cerca de 48 horas; a partir daí não mais se observou mudança significativa na intensidade da mancha característica do material de partida (composto 1) e o surgimento de uma nova mancha correspondendo ao composto (2). O produto reacional foi filtrado para remoção do precipitado formado, rotaevaporado e purificado em coluna cromatográfica (diâmetro 40mm), utilizando-se uma mistura éter etílico e éter de petróleo 3:7 como fase móvel. Obteve-se um sólido branco, eluído na Obteve-segunda fração da coluna. O composto apreObteve-sentou uma massa molar de 452,67 g mol-1 e um rendimento de 50% (Figura 10).
Composto 1
C23H39BrO
Massa molar: 411,46 gmol-1
Rendimento: 70,0%
Cardanol Hidrogenado (3-n-PDF)
C21H36O
Massa molar: 304,51gmol-1
O H
C15H31
B r
B r
KOH
70ºC
6h
O
H31C15
Figura 10. Processo sintético para obtenção do derivado aldeídico (Composto 2).
Fonte: O Autor
3.1.3 5, 10, 15, 20-tetra-[4-(2-(3-pentadecilfenoxi)-etoxi)-fenil]-porfirina.[54]
Em um balão de fundo redondo adicionou-se 1,0 g do composto 2 (2,22 mmol) em 50 mL do solvente (0,8% de etanol e 99,2% de clorofórmio). Após dissolução adicionou-se o pirrol (2,22 mmol) e o NaCl (55,5 mmol), iniciando o fluxo de gás inerte na reação. Esperou-se 10 minutos para a seguir adicionar o trifluoreto de dietil - eterato de boro (0,73 mmol) e, em seguida DDQ (2,3,5,6-tetraclorobenzoquinona) (1,66 mmol). Deixou-se a mistura reagir por cerca de 1 hora e,
a partir daí, não mais se observou mudança significativa na intensidade da mancha característica do material de partida (composto 2). Para purificação, foi realizado um pré-tratamento utilizando uma mistura de N, N-Dimetilformamida (DMF) e etanol na proporção de 7:3. A mistura foi submetida á agitação constante por aproximadamente 3 horas e fez-se uma filtração a vácuo obtendo um composto violeta no fundo do funil de placa sinterizada. Após este procedimento foi realizada uma separação em coluna cromatográfica (diâmetro de 40 mm) do material, utilizando-se uma mistura de diclorometano e hexano (1:1; 6:4; 7:3; 8:2; 9:1), respectivamente, ao longo da separação. O composto obtido apresentou massa molar 2000,92 g mol-1 com o rendimento de 26% (Figura 11).
Composto 2
C30H44O3
Massa molar: 452,67 gmol-1
Rendimento: 50,0%
Composto 1
O
H31C15
B r CHO
O H
K2CO3 acetona
24h refluxo
O
H31C15
O O H31C15
N N H N NH O O
H31C15
O O
C15H31
O O
C15H31
N H
O
H31C15
CHO O
I) BF3.OEt2
CHCl3
10 min
II) DDQ
60 min CHCl3
Figura 11. Processo sintético de obtenção da meso-porfirina (Composto 3 = H2Pp).
Fonte: O Autor
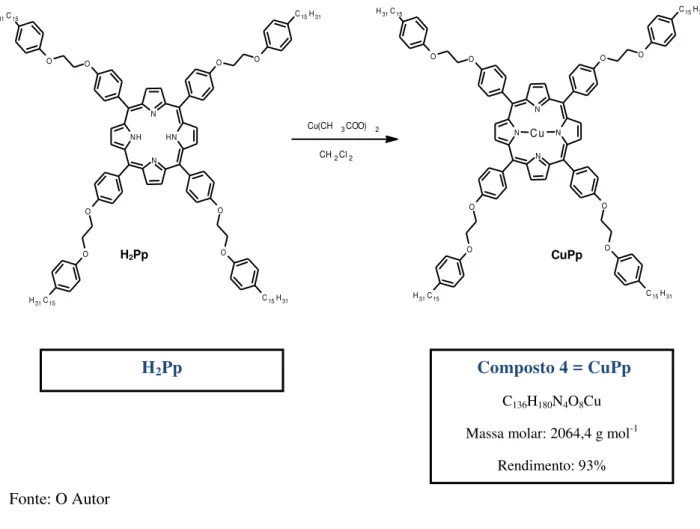
3.1.4. Cu(II) 5, 10, 15, 20-tetra-[4-(2-(3-pentadecilfenoxi)-etoxi)-fenil]-porfirina.[54] Em um balão de fundo redondo adicionou-se 100 mg (0,05mmol) de H2Pp em
50 mL de diclorometano e 910 mg (5mmol) de acetato de cobre em 50 mL de N, N-dimetilformamida (DMF). A mistura permaneceu à temperatura de 70 ºC, sob agitação magnética constante e atmosfera de N2 por um período de três horas. O produto foi
então concentrado por rotaevaporação, filtrado em funil de placa sinterizada para separação do excesso de sal de cobre em solução. O filtrado foi transferido para um funil de separação onde fez-se 3 sucessivas lavagens com 100 mL de água destilada para a remoção do acetato de cobre. A seguir, o composto foi rotaevaporado para redução do conteúdo reacional de solvente e submetido a purificação em coluna cromatográfica de sílica gel (fase estacionária), empregando como fase móvel uma mistura de diclorometano e hexano em diferentes proporções ao longo da separação (7:3 9:1). O composto foi obtido na primeira fração eluída da coluna, de cor avermelhada, massa molar 2064,4 g mol-1 e rendimento de 93% (Figura 12).
Composto 2
Composto 3 = H2Pp
C136H182N4O8
Massa molar: 2000,92 gmol-1
Figura 12. Processo sintético para a obtenção da CuII-meso-porfirina (Composto 4 = CuPp).
Fonte: O Autor
3.1.5. Caracterização dos compostos
Após as sínteses, os compostos foram purificados e caracterizados com as técnicas de Cromatografia Gasosa acoplada ao Espectrômetro de Massa (CG-EM), Espectrometria de absorção na região do UV-Visível (UV-Vis), Ressonância Magnética Nuclear de prótio (RMN-1H), Ionização por Electrospray acoplada ao Espectrômetro de Massa (ESI-MS) e Pressurização Atmosférica por Ionização Química (APCI-MS) desde o precursor das etapas sintéticas, 3-n-PDF (3-n-Pentadecilfenol) até as macromoléculas obtidas.
Cu(CH 3COO) 2
CH2Cl2
O O
H31C15
N N N N O O
H31C15
O O
C15H31 O O
C15H31
C u
O O
H31C15
N N H N NH O O
H31C15
O O
C15H31 O O
C15H31
H2Pp CuPp
H2Pp Composto 4 = CuPp
C136H180N4O8Cu
Massa molar: 2064,4 g mol-1
3.2. Modificação da Superfície do Eletrodo de Ouro
Foram estudados vários eletrólitos para a modificação da superfície do eletrodo de ouro (Au), com destaque para o Perclorato de Tetrabutilamônio (PTBA), um sal de amônio, que apresentou o melhor resultado para os estudos posteriores.
A modificação da superfície do eletrodo de ouro pela CuII-meso-porfirina foi realizada através da técnica de voltametria cíclica (VC). Os filmes foram formados em 25 ciclos utilizando um intervalo de potencial de 0,00 a 1,45V, a uma velocidade de varredura de 100 mV s-1, na presença de um eletrólito de suporte de solução 0,1 mol L-1 PTBA (perclorato de tetrabutilamônio) contendo uma solução 0,05 mg mL-1 de porfirina. O eletrodo de referência foi o Ag/AgCl em CH2Cl2 + 0,1 mol L-1 PTBA e
contra-eletrodo de Pt com 1 cm2 . Os perfis voltamétricos foram obtidos a partir de um potenciostato/galvanostato da AUTOLAB PGSTAT 30 interfaceado a um computador com o programa GPES 4.0.
A solução de NO utilizada para a detecção pelo sensor foi preparada de acordo com procedimentos da literatura[55,56], pelo gotejamento de H2SO4 de um funil de
separação para um kitassato contendo NaNO2. O NO provém da reação entre H2SO4 e
NaNO2, que fornece espécies NOx gasosas como produto. Esse gás passa por uma
solução saturada de NaOH que permite que apenas o gás NO seja obtido e, finalmente, é lavado em água Milli-Q (Millipore, Inc.). O NO obtido é coletado em um recipiente selado contendo eletrólito suporte previamente desaerado por 30 minutos com argônio de alta pureza. A saturação da solução ocorre em 30 minutos. Essa solução saturada mantida sob atmosfera de NO apresenta uma concentração de 2,0x10-3 mol L-1, como recomendado pela literatura.[57-59]
Para a preparação das soluções de NO diluídas, utilizou-se uma seringa Hamilton de 100 µL (Aldrich) para adicionar as alíquotas de 10 µL de solução estoque de NO á célula eletroquímica. O volume dessa célula foi de 7 mL, aferido com a adição de eletrólito suporte Na2SO4 0,2 mol L-1 previamente desoxigenado com N2 por 1
minuto.
1,0x10-4 mol L-1. Elas foram preparadas em eletrólito suporte Na2SO4 0,2 mol L-1 e
foram mantidas sob refrigeração em torno de 5 ºC.
A solução estoque de nitrito (NO2- ) 1,0x10-2 mol L-1, também utilizada no
estudo de interferentes, foi preparada em eletrólito suporte Na2SO4 0,2 mol L-1. Desta
solução foi retirada uma alíquota de 70 µL, que foi eluida em 6,30 mL de eletrólito suporte, obtendo, assim, a concentração final de 1,0x10-4 mol L-1. Essa solução também foi mantida sob refrigeração em torno de 5 ºC.
A detecção de NO foi realizada utilizando o eletrólito contendo uma solução de Na2SO4 (0,5 mol L-1), com 6 replicatas. A aplicabilidade deste eletrodo modificado
como sensor de NO foi avaliada pela técnica de voltametria de onda quadrada (VOQ) utilizando os seguintes parâmetros: freqüência de pulso de potencial (f) de 100 s-1, amplitude do pulso (a) de 50 mV e incremento de varredura (Es) de 2 mV. Utilizou-se o eletrodo de ouro como o de trabalho, eletrodo de referência Ag/AgCl saturado em KCl (3,0 mol L-1) e contra-eletrodo de Pt com 1cm2 em solução de Na2SO4 (0,2 mol L-1)
como eletrólito (Figura 13).
Figura 13. Células eletroquímicas: (a) eletropolimerização e (b) análise dos interferentes (NO2-, dopamina e serotonina).
Fonte: O Autor
ELETROPOLIMERIZAÇÃO ÁNALISE DOS INTERFERENTES
3.3. Construção do Biossensor
A escolha da enzima foi realizada através de estudos exploratórios em trabalhos publicados na literatura a cerca dos biossensores aplicados ao meio ambiente.[36,43,50]A enzima escolhida foi a Glutationa-S-Transferase (GST) que desempenha um papel importante na resposta do estresse causado pelos herbicidas nas plantas. Ela é considerada uma enzima de desintoxicação por metabolizar grande variedade de compostos xenobióticos, por meio da conjugação destes com glutationa reduzida (GSH), formando substâncias de baixa toxicidade. [44]
A determinação da atividade da enzima estudada (GST) foi verificada por meio do espectrofotômetro Shimadzu 160-A a 220nm com célula de quartzo e percurso óptico de 1,0 cm. A GST (ref. n º G6511, fígado equino) e os substratos 1-cloro-2,4-dinitrobenzeno (CDNB) e glutationa-S-reduzida (GSH) (ref. nº G4251), molinato (pureza>99,6%), 3-aminopropiltrietoxissilano (APTES), (ref. nº A3648), K4[Fe (CN)6] (hexacianoferrato de potássio) e glutaraldeído (GA) foram adquiridos da
Sigma-Aldrich Company. Outros produtos químicos (Merck) pró-análise, foram utilizados sem purificação prévia.
As soluções de enzima GST (0,5 mg mL-1) e do substrato GSH (0,1 mol L-1) foram preparadas diariamente e armazenadas a 4 ºC. O substrato CDNB (0,1 mol L-1) foi preparado em etanol absoluto e congelado. A solução de GA (grau I, 2 % de solução aquosa) foi preparada no momento da realização das análises.
As determinações voltamétricas foram realizadas em um equipamento semelhante ao utilizado para a obtenção do sensor para NO (Figura 14). Os ensaios voltamétricos foram realizados em uma célula de vidro constituída por eletrodos (Metrohm) (Figura 15).
Figura 14. Potenciostato utilizado nas determinações voltamétricas.
Conjunto de três
eletrodos
Eletrodo de trabalho
Eletrodo de carbono vítreo de 3mm de
diâmetro (GCE)
Eletrodo de referência Ag/AgCl/KCl
(3mol dm-3)
Eletrodo auxiliar
Platina (2mm de diâmetro) Figura 15. Ilustração esquemática do conjunto de três eletrodos.
Fonte: O Autor
As medidas foram utilizadas empregando 0,1 mol L-1 de fosfato de L-1 salino tamponado (PBS) (pH 7,0), à temperatura ambiente (25 ºC). Todas as soluções foram preparadas com água deionizada (18,0 MΩ cm) Tipo I, obtida a partir de um sistema de purificação de água Simplicity 185 (Millipore) .
Todas as medidas eletroquímicas foram realizadas com a utilização de solventes menos tóxicos tornando-se uma das grandes vantagens em termos de sustentabilidade, comparada á técnica de HPLC.
3.3.1. Metodologia Empregada na Construção do Biossensor
O GCE foi limpo mecanicamente por meio de polimento com γ-Al2O3 (0,3 pm e
0,05 uM) até a obtenção de uma superfície espelhada, e lavado com água. Posteriormente, o GCE foi imerso em uma solução piranha (H2O2: H2SO4, 1:3, v/v)
durante 10 min. Para a ativação eletroquímica da superfície (criar os grupos funcionais - COOH e-OH sobre o eletrodo) o GCE foi varrido entre - 0,2 a 1,6 V em solução de H2SO4 0,5 mol L-1 a 50 mV s-1.
A quantificação de molinato foi verificada pelo método comparativo em cromatógrafo em fase líquida de alta eficiência (Knauer), equipado com um detector de
100 RP-18 (5 m coluna) (Merck), protegido por uma coluna de guarda LiChroCART 4-4 (Merck). A fase móvel foi uma mistura de metanol:água (80:20 v/v) a um fluxo de 0,8 mL min-1.[60]
3.3.2. Ensaios Enzimáticos
Considera-se que uma unidade da enzima GST é definida como a quantidade de material que irá conjugar 1,0 µmol de CDNB com GSH reduzida por minuto, a pH 6,5 e 25 ° C. A atividade de GST foi medida espectrofotometricamente de acordo com o procedimento descrito na literatura.[49] Em uma cubeta de quartzo foram misturados, 1500 µL de concentração 0,1 mol L-1 de uma solução de PBS (pH 6,5), 15 µL de solução de GSH (1 mmol L-1) e 15 uL de solução etanólica CDNB (1 mmol L-1). Em seguida, a reação foi iniciada pela adição de 20 µL de solução GST. A atividade de GST foi monitorada a 340 nm com um tempo de varredura de 10 s durante 3 min.
3.3.3. Preparação do Biossensor empregado na GST
Para realizar a modificação química da superfície do GCE, este foi primeiramente lavado com diclorometano (CH2Cl2) e seco sob uma corrente de gás
nitrogênio (N2) . Em seguida, o GCE foi imerso em uma solução de APTES (10 % em
CH2Cl2) durante 12h. O aminosilano-GCE foi enxaguado com diclorometano e o
eletrodo modificado foi imerso em uma solução de GA (2 % solução aquosa) durante 30 min. A seguir, o eletrodo quimicamente modificado foi lavado com PBS (pH 7,0) e imerso em PBS (pH 8,0) por 5 minutos (tempo estimado) para bloquear todo o GA que não reagiu. Finalmente, o material foi seco sob uma corrente de N2.
2% GDA Tratamento efetuado em 30min Oxidação
Eletroquímica
Figura 16. Representação da preparação do biossensor usado nesse trabalho.
Fonte: O Autor
3.3.4. Medidas Eletroquímicas
Todas as medidas de Voltametria Cíclica (VC) e Voltametria de Pulso Diferencial (VPD) foram realizadas à temperatura ambiente em uma célula eletroquímica de vidro contendo 0,1 mol L-1 de PBS (pH 7,0). Os voltamogramas cíclicos foram registrados pela varredura do potencial entre - 0,2 a 0,6 V com uma velocidade de varredura de 50 mV s-1. Medições de VPD foram realizadas aplicando um intervalo de potencial estudado entre - 0,2 a 0,6 V e pulso de 10 s (Tabela 5). Todos os ensaios foram realizados usando [Fe(CN)6]4- como indicador eletroativo. Após cada
adição, as medições foram registradas a partir de VPD, em uma faixa de potencial de - 0,2 a 0,6 V.
voltametria de pulso diferencial. O objetivo foi controlar o potencial ao longo do tempo e obter uma resposta proporcional à concentração na solução.
Tabela 5. Condições experimentais para a realização dos ensaios voltamétricos no eletrodo de carbono vítreo.
Fonte: O Autor
3.3.5. Análise das Amostras de Águas Contaminadas de Arrozais
Amostras de água contaminadas foram coletadas em uma lavoura de arroz irrigada, na fazenda experimental "Bico da Barca", de Direção Regional de Pescas Agrícolas eletrônicos do Centro (DRAP - Centro), localizado no vale do rio Mondego, Montemor-o-Velho, centro de Portugal. Este arroz de campo é utilizado em agricultura convencional e, no momento da recolha da amostra, continha resíduos de molinato, resultado da aplicação de seis anos consecutivos de aplicação do produto. As amostras foram recolhidas 5 horas após a aplicação do Ordram (formulação comercial do molinato) e armazenadas a – 20 °C até a análise. [61]
Técnica Ensaios Faixa de Potencial/V
Eletrólito usado Velocidade varredura / V.s-1
Voltametria Cíclica (VC)
Limpeza eletroquímica/
Oxidação [- 2,0 a 1,6] H2SO4 0,5mol L
-1 0,100
Estudos Molinato
[- 0,2 a 0,6] Tampão fosfato 0,1 mol L-1
0,050 Voltametria de Pulso Diferencial (VPD) Estudos Molinato
[- 0,2 a 0,6]
Tampão fosfato 0,1 mol L-1 com K4[Fe(CN)6] 0,1 mol L-1
e GSH 0,1 mol L-1
Para a quantificação de molinato (HPLC-UV), alíquotas de 20 mL da amostra contaminada foram extraídas duas vezes com um volume de n-hexano usando cicloato (ciclohexiletiltiocarbamato de etila) 5 mg L-1 (Riedel-de Haen, Seelze, Alemanha) como padrão interno. Os extratos de hexano foram secos sob vácuo, dissolvidos em 1mL de metanol e analisadas por HPLC-UV.[61,62]
A determinação eletroanalítica do molinato em água contaminada de arrozal por meio do biossensor com base na GST foi realizada utilizando o método de adição de padrão. Um volume de amostra de água do ambiente foi transferido para a célula eletroquímica que contém o eletrólito de suporte (0,1 mol L-1 de PBS pH 7,0), o
substrato (1 mmol L-1 de GSH e 1 mmol L-1 de CDNB), o mediador de elétrons 1 mmol L-1 [Fe(CN)6]4- e quantificado após três adições sucessivas de solução padrão
4. RESULTADOS E DISCUSSÃO
4.1. Caracterização dos Precursores 4.1.1. Cardanol (3-n-PDF):
O espectro de massas revelou o sinal do íon molecular de razão massa/carga (m/z) igual a 304,3 g mol-1, condizente com a fórmula molecular esperada para o precursor da macromolécula sintetizada (Figura 17).
Figura 17. Espectro CG do 3-n-PDF.
Fonte: O Autor
O espectro de ressonância magnética nuclear (Figura 18) para o 3-n-PDF mostra seis sinais na região de desproteção, um em H 7,16 (H-5, tripleto) referente aos
dubleto) e um multipleto entre H (deslocamento químico) 6,67 – 6,64 referente aos
prótons de um sistema aromático meta substituído
.
Observou-se também uma absorçãoem H 2,56 referente ao CH2-Ar (2-H1’, tripleto), um multipleto em H 1,60 (2- H2’), H 1,28 (sinal intenso com integração para 24 hidrogênios caracterizando a presença de
uma extensa cadeia alquílica), além de outro sinal em H 0,90 (3-H15’, tripleto)
associado aos prótons da metila terminal (Figuras 19 e 20 - Expansão).
Figura 18. Espectro de RMN –1H para o 3-n-PDF.
Fonte: O Autor
O H
H2 H6
H5
H4
CH2 -CH 2 -(CH 2)12 -CH 3
Figura 19. Espectro de expansão 1 de RMN –1H para o 3-n-PDF.
Fonte: O Autor
Figura 20. Espectro de expansão 2 de RMN –1H para o 3-n-PDF.
![Figura 1. Corte longitudinal da amêndoa de castanha de caju e sua estrutura. [5]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15336889.558115/20.892.224.594.843.1111/figura-corte-longitudinal-amêndoa-castanha-caju-sua-estrutura.webp)
![Figura 5. Representação esquemática de um biossensor. [26]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15336889.558115/26.892.116.786.701.944/figura-representação-esquemática-de-um-biossensor.webp)

![Figura 8. Mecanismos da degradação do molinato nas plantas e solos. [48]](https://thumb-eu.123doks.com/thumbv2/123dok_br/15336889.558115/34.892.94.828.153.743/figura-mecanismos-da-degradação-molinato-nas-plantas-solos.webp)