Vinhos de Talha
Caracterização Química
Ana Rita Jerónimo dos Santos
Dissertação para a obtenção do Grau de Mestre em
Viticultura e Enologia
Orientadores: Prof. Doutora Maria João Pires Bastos Cabrita, Universidade de Évora
Prof. Doutor Jorge Manuel Rodrigues Ricardo da Silva, Instituto
Superior de Agronomia
Júri:
Presidente: Doutor Carlos Manuel Antunes Lopes, Professor Associado com Agregação do(a) Instituto Superior de Agronomia da Universidade de Lisboa.
Vogais:
Doutora Maria João Pires Bastos Cabrita, Professora Auxiliar com Agregação do(a) Universidade de Évora, orientadora;
Doutor Manuel José de Carvalho Pimenta Malfeito Ferreira, Professor Auxiliar com Agregação do(a) Instituto Superior de Agronomia da Universidade de Lisboa.
I
A
GRADECIMENTOSComeço por agradecer à principal responsável da escolha do tema da minha tese mostrando uma nova realidade no mundo da enologia, os vinhos de talha, Professora Maria João Cabrita, orientadora de todo este trabalho, muito lhe agradeço por todo o tempo dedicado a este projeto, peço desculpa pelo tempo que deixei passar até a entrega deste trabalho (espero que consiga compensar com o resultado final).
De seguida a todos os colaboradores do laboratório de enologia do ICAAM da Universidade de Évora que diretamente me ajudaram no trabalho experimental, pelo acolhimento, disponibilidade e paciência, à D. Antónia, ao Rui, à D. Albina, à Professora Raquel pelas explicações sobre diluições e concentrações das soluções padrão. Ao Nuno pela ajuda no final das injeções da cromatografia em fase líquida, pela companhia e ajuda na identificação e quantificação das aminas e na identificação dos voláteis. Ao professor Marco da Silva da Faculdade de Ciências da Universidade Nova de Lisboa, pela disponibilidade do GC/MS e nas explicações sobre as identificações dos picos nos cromatogramas.
Ao Professor Jorge Ricardo da Silva pela disponibilidade mostrada para ser meu orientador, pelos conhecimentos transmitidos ao longo de todas as unidades curriculares do mestrado e nas visitas às adegas, sem dúvida essenciais para esta tese e para a vida profissional que está oficialmente iniciada. Agradeço também a todos os outros docentes do mestrado de viticultura e enologia que acompanharam durante ano e meio a minha carreira, uns mais de perto que outros. Apesar de não estar diretamente ligado a esta tese agradeço ao Professor Manuel Malfeito Ferreira pela sua enorme disponibilidade fazer dos seus alunos especialista em provas de vinho descontraídas, com direito a experiências gastronómicas.
Por último, mas não menos importante agradeço a toda a minha família, aos meus pais por não me terem deixado desistir de terminar esta tese, dedico-lhes este trabalho. Por eles apostei e continuarei a apostar no meu currículo académico, como tantas vezes oiço deles, o saber não ocupa lugar.
II
R
ESUMOOs vinhos de talha são produzidos na região do Alentejo desde os tempos da ocupação dos romanos. Apesar não serem os vinhos mais consumidos no país devido às suas características peculiares que advêm do facto da vinificação ser efetuada em recipientes de barro revestidos com pês, vulgarmente designados por talhas ou ainda por serem fundamentalmente de produção familiar e por isso existirem em pequena quantidade. A vinificação é baseada nos princípios de produção de vinho na época dos romanos e ainda hoje poucas alterações sofreram.
A necessidade de conhecer estes vinhos com maior detalhe levou à caraterização química feita com base na análise sumária, no estudo da cor através do CIELab, na quantificação das aminas biogénicas, por cromatografia de fase líquida com deteção por fluorescência (HPLC-FLD), e na identificação de compostos voláteis, utilizando cromatografia de fase gasosa acoplada a espectrometria de massa (GC/MS). Os resultados obtidos são confrontados com resultados obtidos por vinhos comerciais da mesma região. Os vinhos de talha escolhidos para este trabalho foram produzidos na região da Vidigueira, Cuba e Vila de Frades, sendo que todos participaram no concurso da Vitifrades 2015.
Alguns resultados podem ser destacados como: a quantidade de dióxido de enxofre livre e total quantificada nos vinhos de talha, que é menor ou quase inexistente em alguns destes vinhos, e o oposto verificou-se nos vinhos comerciais utilizados como testemunha; e a quantidade de aminas biogénicas, nos vinhos de talha é superior em praticamente o dobro em relação aos vinhos testemunha do mesmo tipo.
III
A
BSTRACTAmphora wines are produced in Alentejo region since Romans time. Despite not being the most consumed wines in the country due to its peculiar characteristics arising from the fact that wine has been made in containers of clay coating with pitch, usually denominated amphoras, or because they are fundamentally of familiar production and exist in small quantities. The vinification still it is in some cases sufficiently simplified, based in the principles of production of wine at the time of the Romans.
The lack of knowledge in this wine in greater detail, led to the chemical characterization based on the elementary analysis, the colour using the CIELab, the quantification of the biogenic amines, by liquid chromatography with fluorescence detection (HPLC-FLD), and finally identification of volatile compounds by gas chromatography coupled with mass spectrometry (GC/MS). The results obtained were compared with results obtained by commercial wines from the same region. For this work, amphora wines were produced in the region of Vidigueira, Cuba and Vila de Frades, all of which participated in the contest of Vitifrades 2015.
Some results can be highlighted as: the amount of free and total sulfur dioxide quantified in amphora wines, which is less or almost nonexistent in some of these wines, and the opposite occurred in commercial wines used as a control; and the amount of biogenic amines in amphora wines is almost double that of control wines of the same type.
IV
Í
NDICE Agradecimentos I Resumo/Palavra-Chave II Abstract/Keywords III Abreviaturas VÍndice de Figuras e Quadros VII
1.Introdução 9
1.1 Breve Referência sobre Vinificação em Talha 10
1.2 Principais compostos químicos e parâmetros considerados na Vinificação em Talha 13
1.2.1 Caraterísticas Cromáticas – CIELab 13
1.2.2 Aminas Biogénicas 14 1.2.3 Composição Volátil 16 1.3 Objetivo do Trabalho 19 2.Materiais e Métodos 20 2.1 Materiais: 21 2.1.1 Amostras 21 2.1.2 Reagentes e Padrões 22 2.1.3 Equipamentos 22 2.2 Procedimento analíticos: 23
2.2.1 Análise Sumária - Métodos analíticos 23
2.2.2 Caraterísticas Cromáticas - Método de espetrofotometria CIELab 24 2.2.3 Aminas Biogénicas - Métodos de derivatização e HPLC-FLD 25
2.2.4 Aminas Biogénicas - Rectas de Calibração 26
2.2.5 Composição Volátil - Métodos de HS-SPME e GC/MS 26
2.3 Análise estatística dos dados 27
3. Resultados 28
3.1 Análises Sumárias – Boletim Analítico 29
3.2 Caraterísticas Cromáticas 35
3.3 Aminas Biogénicas 38
3.3.1 Teores de Aminas Biogénicas vs. Tipo de Vinho 39 3.3.2 Teores de Aminas Biogénicas vs. Origem do Vinho de Talha 40
3.4 Composição Volátil 42
4. Conclusão 48
5. Revisão Bibliográfica 50
V
A
BREVIATURASAA – Aminoácidos AB- Aminas Biogénicas Abs - Absorvância
Bnz-Cl – Cloreto de Benzoico C* - Croma
CAR-PDMS – Carboxeno – Polidimetilsiloxano CH3CN - Acetonitrilo
CIE – Comissão Internacional da Iluminação CO2 – Dióxido de Carbono
DAO – Diamina Oxidase Dbs – Cl – Cloreto de Dabsilo Dns-Cl – Cloreto de Dansilo FLD – Detetor de Fluorescência FML – Fermentação Malolática GC – Cromatografia de fase gasosa
GC/MS – Cromatografia de fase gasosa acoplada a Espectrometria de Massa H* - Matiz ou Tonalidade
HPLC – Cromatografia Liquida de Alta Eficiência
HPLC-FLD – Cromatografia Liquida de Alta Eficiencia com Detector de Fluorescência HS-SPME – Microextração em Fase Sólida no Espaço de Cabeça
IC – Intensidade da cor
IVV – Instituto da Vinha e do Vinho L* - Luminosidade
LLE – Extração Líquido-Líquido MAO – Monoamina Oxidase MS – Espectrometria de Massa
MSWS – Mass Spectrometry Workstation m/z – Razão massa carga
NaCl – Cloreto de Sódio
NIST – National Institute of Standards and Tecnology OIV – Organização Internacional da Vinha e do Vinho OPA – O-Ftalaldeido
PI – Padrão Interno
PTFE – Politetrafluoretileno SO2 – Dióxido de Enxofre
VI TC – Tonalidade da cor
tR - Tempo de Retenção
UNESCO – Organização das Nações Unidas para a Educação, Ciência e Cultura λEx – Comprimento de Onda de Excitação
VII
Í
NDICE DE FIGURAS EQ
UADROSF
IGURAS:
Figura 1 - Talhas de Barro
Fonte: http://vinhodetalha.vinhosdoalentejo.pt/ Figura 2 - Duas Realidades na Herdade do Peso.
Fonte: http://www.sograpevinhos.com/blog/2015/08/01/tecnologia-com-2000-anos/ Figura 3 - CIELab colourspace, based on a sequential or 3 orthogonal axis continual Cartesian representation L*, a* y b*.
Fonte: Compendium of international methods of wine and must analysis Vol.1.
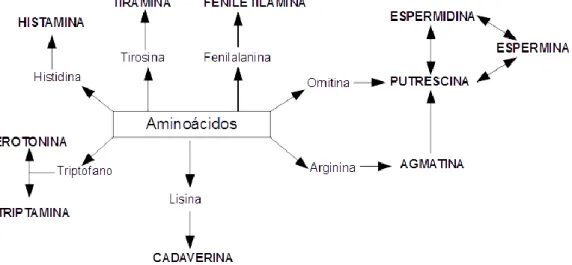
Figura 4 - Aminoácidos percursores de aminas biogénicas. Adaptado de Ancín-Azpilicueta et al.,(2008).
Figura 5 - Esquema ilustrativo da preparação da amostra para análise em HPLC-FLD. (Adaptado de Ramos et al.2014).
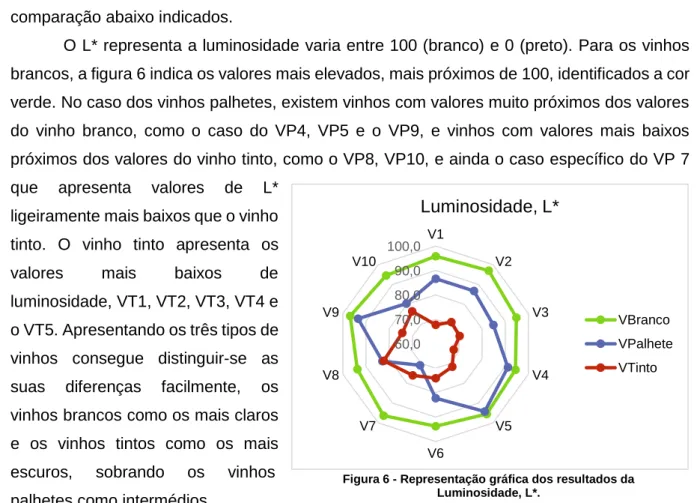
Figura 6 - Representação gráfica dos resultados da luminosidade dos vinhos.
Figura 7 - Representação gráfica dos valores referente à variação entre o verde (-a*) e o vermelho (+a*) dos vinhos.
Figura 8 - Representação gráfica dos valores referente à variação entre o azul (-b*) e o amarelo (+b*) dos vinhos.
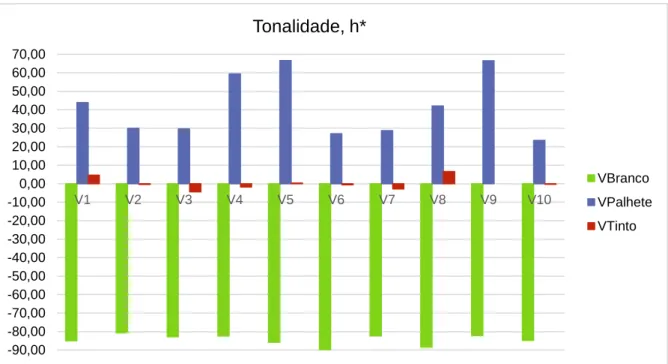
Figura 9 - Representação gráfica da Tonalidade, h*, referente aos vinhos de talha. Figura 10 - Representação gráfica do Croma, C* referente aos vinhos de talha.
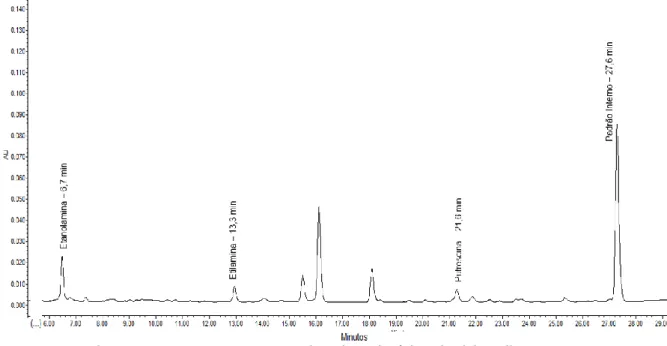
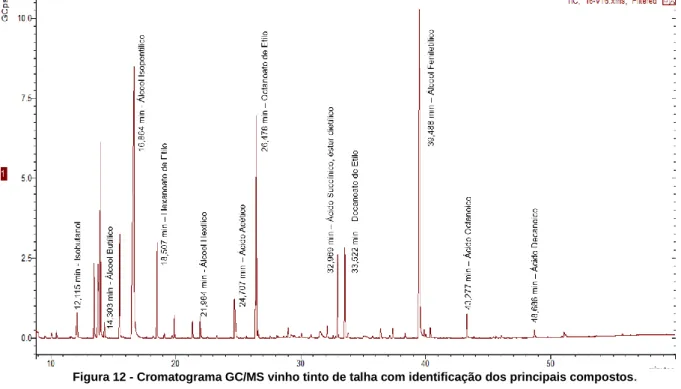
Figura 11 - Cromatograma HPLC-FLD de Aminas Biogénicas do vinho de talha palhete. Figura 12 - Cromatograma GC/MS vinho tinto de talha com identificação dos principais compostos.
Q
UADROS:
Quadro 1 – Classificação das Aminas Biogénicas segundo Ramos et al.,2014.
Quadro 2 - Identificação das amostras dos vinhos de talha e seus locais de produção. Quadro 3 - Identificação das amostras dos vinhos comerciais e seus locais de produção. Quadro 4 - Rectas de calibração para as Aminas Biogénicas.
Quadro 5 - Resultados obtidos dos vinhos comerciais brancos e tintos na análise sumaria. Quadro 6 - Resultados obtidos nas determinações acidimétricas (g/L) nos vinhos tintos e brancos de talha.
Quadro 6.1 - Resultados obtidos nas determinações acidimétricas (g/L) nos vinhos palhetes.
Quadro 7 - Resultados do dióxido de enxofre (mg/L) nos vinhos de talha.
VIII Quadro 9 - Resultados de massa volúmica (g/mL) extrato seco (g/L) e extrato seco não redutor (g/L) obtidos nos Vinhos de Talha.
Quadro 9.1 - Resultados obtidos de massa volúmica (g/mL), extrato seco (g/L) e extrato seco não redutor (g/L) dos vinhos palhetes.
Quadro 10 - Resultados obtidos nos açúcares redutores (g/L) nos vinhos de talha.
Quadro 11 - Análise estatística da quantidade de aminas biogénicas por tipo de vinho. Letras diferentes na mesma coluna significam diferenças significativas a p <0,05%.
Quadro 12 - Análise estatística da quantidade de aminas biogénicas por origem dos vinhos. Letras diferentes na mesma coluna significam diferenças significativas a p <0,05%.
Quadro 13 - Compostos identificados da família dos ácidos carboxílicos em vinhos de talha. Quadro 14 - Compostos identificados da família dos álcoois em vinhos de talha.
Quadro 15 - Compostos identificados da família dos compostos carbonilicos, aldeídos e cetonas em vinhos de talha.
Quadro 16 - Compostos identificados da família dos esteres em vinhos de talha.
Quadro 17 - Compostos identificados da família das lactonas, compostos sulfúricos e benzenoídes em vinhos de talha.
Quadro 18 - Compostos identificados da família dos norisoprenoides em vinhos de talha. Quadro 19 - Compostos identificados da família dos sesquiterpenos em vinhos de talha. Quadro 20 - Compostos identificados da família dos terpenoides em vinhos de talha.
10
1.1
B
REVER
EFERÊNCIA SOBRE AV
INIFICAÇÃO EMT
ALHAOs vinhos de talha tiveram as suas primeiras feitorias aquando da ocupação romana devido à necessidade de exportar vinho para Roma. Os artefactos encontrados por arqueólogos ao longo de toda a região do Alentejo mostram que a vinha já existia muitos antes dos Romanos desde a época dos Tartessos, Fenícios e os Gregos. Mas foi com os Romanos que a vitivinicultura deu um grande salto, devido aos seus conhecimentos na área da agricultura, trazendo também o processo de vinificação de uvas em talhas. (CVRA: http://vinhodetalha.vinhosdoalentejo.pt/)
A talha é um vaso de barro em forma de ânfora, como mostra a fig. 1, podem ter várias capacidades e formas mais redondas ou mais alongadas. As talhas precisam de ser impermeabilizadas como conta Antonio Augusto de Aguiar nas Conferências sobre Vinhos de 1876, ‘Tradicionalmente, este processo chamado de pêsga, era feito com a talha de boca para baixo assente em quatro pedras no chão e entre estas era feita uma fogueira, ficando a talha em aquecimento enquanto se derretia o pês para barrar. Quando tudo estava pronto a talha era endireitada e colocado dentro dela o pês, logo de seguida a talha era posta de lado e rolada no chão para homogeneizar todo o revestimento, impermeabilizando a talha’. Atualmente, este processo já está praticamente extinto devido ao aparecimento de novos compostos que têm a mesma função do pês, como a cera de abelha sendo maior a eficácia e maior facilidade de aplicação, e ainda a aplicação de resinas epóxi.
A vinificação inicia-se com a colheita das uvas quando chega aos parâmetros de maturação ideais, chegada a uva à adega é desengaçada, separando os bagos dos engaços, os primeiros seguem para a talha com o esmagamento incompleto feito, por vezes bastante ténue, sendo os segundos subprodutos do processo. É também prática corrente que alguns engaços, numa proporção variável, sejam introduzidos dentro das talhas. Iniciando-se a fermentação a manta é mergulhada no mosto, inicialmente com alguma frequência, mas à medida que a fermentação decorre a frequência deste processo é menor, até que a manta baixa e fica no fundo, durante este período a talha é coberta para evitar que o mosto oxide, a camada de CO2 resultante da fermentação inibe o crescimento de microrganismos, deixando
11 mosto/vinho duplamente protegido. O mosto/vinho é mantido durante mês e meio a dois meses na talha em contato com as massas (peliculas, grainhas e engaços). Quando chega a altura de retirar o vinho da talha, as próprias massas que estão no fundo da talha servem como filtro quando é colocada a torneira. Este processo é feito por tradição no dia de S. Martinho, 11 de novembro, seguindo o proverbio “Dia de S. Martinho vai-se à adega e
prova-se o vinho novo”, não fosse o Alentejo rico em tradições.
A vinificação em talha é exclusiva da região vitivinícola do Alentejo, caraterizando-se por ser bastante distinta das outras regiões vitivinícolas. A existência das talhas é maioritária no baixo Alentejo, em locais como a Vidigueira, Alvito, Vila de Frades e Vila Alva onde o vinho de talha tem uma elevada expressão quer em consumo quer em fabrico. Existindo em outros locais no Alto e Centro Alentejo, como Estremoz, Cabeção, Reguengos de Monsaraz, onde são feitos este tipo de vinhos, sendo que a expressão não é tao notória. Tem sido contínua ao longo do tempo em dois locais do Mundo: em Portugal, no Alentejo, aqui o vinho de talha perdeu consumidores pelo aparecimento de vinhos de maior qualidade, melhores aromas e sabores, e com maior tempo de conservação; o outro local é a Geórgia onde as talhas são chamadas de ‘Qvrevi’. Os ‘Qvrevi’ podem ser de diferentes tamanhos e formas, as adegas são feitas de acordo com o sistema de controlo de temperatura, podendo as ânforas serem totalmente enterradas no solo, ou não, segundo Baiano et al. (2014). A vinificação destes é muito idêntica à utilizada em Portugal, à exceção do tempo de armazenamento, depende das caraterísticas pretendidas pelo enólogo, (Díaz et al. 2013). Capece et al. (2013) explica o método ancestral de
vinificação Kakhetian, região da Geórgia onde são produzidos os vinhos considerados de maior qualidade, onde as massas ou a ‘Chacha’ ficam em contacto com o vinho durante três a quatro meses, estes vinhos
brancos são
caraterizados por
apresentarem uma cor alaranjada, escura, com elevada riqueza em compostos de voláteis e fenólicos, também Baiano et al (2015) concluiu a presença destas caraterísticas nos vinhos.
De acordo com a bibliografia, este tipo de vinificação tradicional ou de baixa intervenção é cada vez mais apreciada pelos consumidores, e uma forma de produzir vinhos
Figura 2 – Duas Realidades na Herdade do Peso. Fonte:
12 com caraterísticas bastante distintas, considerando a fermentação espontânea, ou seja, a não adição de qualquer levedura, beneficiando as leveduras indígenas, e o contato prolongado com as massas. Este processo torna-se bastante complexo pois depende de muitos fatores como a flora microbiana presente nas uvas, as castas utilizadas, os fatores climáticos e a presença de leveduras nos processos da adega ou mesmo nos recipientes de fermentação, (Díaz et al. 2013). A correção da acidez é feita com ácido tartárico, e não são feitas adições de SO2 durante o processo de vinificação, facto visível nos resultados das análises sumárias. O período de conservação destes vinhos não é muito elevado, nem servem para envelhecer, o seu consumo deve ser imediato após a saída das talhas, consequência da não adição de qualquer conservante ao vinho.
Segundo a Portaria nº 296/2010 de 1 junho de 2010, no artigo 8º, nº3 foi reconhecida a vinificação em talha como método tradicional para elaboração de vinho com direito ao uso da denominação de origem (DO) Alentejo desde que produzido segundo o regulamento próprio da entidade certificadora. Neste regulamento são descritas, como obrigatórias, as principais praticas de vinificação expostas no parágrafo anterior: o desengace das uvas, a fermentação em talhas ou potes devidamente impermeabilizados e as massas vínicas têm de ser mantidas dentro da talha, pelo menos até 11 de novembro do próprio ano. (CVRA: http://siva.vinhosdoalentejo.pt/site_media/documentos/reg_talha.pdf).
13
1.2
P
RINCIPAIS COMPOSTOS QUÍMICOS E PARÂMETROS CONSIDERADO NAV
INIFICAÇÃO EMT
ALHA1.2.1CARATERÍSTICAS CROMÁTICAS Os compostos fenólicos, responsáveis pela cor dos vinhos, são transferidos para o vinho através das peliculas e grainhas das uvas sendo difundidas pelo mosto durante a curtimenta (García-Marino, et al, 2013). Este tipo de compostos assume especial importância nos vinhos tintos devido á presença de antocianinas e taninos. Beneficia a qualidade final do vinho, porque a cor e o corpo do vinho são definidos pela maior presença destes compostos. Os vinhos brancos não
contêm as antocianinas nas peliculas, facilmente observável pela ausência da cor avermelhada ou azulada, a cor amarela escura presente em alguns vinhos esta diretamente relacionada com reações de oxidação e redução dos compostos fenólicos. O contacto com as grainhas nos vinhos brancos, tende a não ser benéfica para as características sensoriais do vinho, isto porque os taninos deixam aroma herbáceo e existe o aumento da adstringência.
A intensidade da cor está relacionada diretamente relacionada com o tempo de contato das peliculas com o mosto/vinho, fazendo variar a concentração final de antocianinas nos vinhos tintos e em alguns casos nos vinhos rosados.
No caso dos vinhos de talha, o mosto/vinho é deixado em contato com as massas (peliculas e grainhas) durante toda a fermentação até a abertura das talhas durante cerca de duas meses, concluindo que existe algumas diferenças de cor entre os vinhos de talha e os vinhos não fermentados em talha. No final da fermentação alcoólica, estas caem para o fundo e devido à forma das talhas só uma pequena parte do líquido está em contato direto com as grainhas prevenindo a libertação excessiva dos taninos amargos, segundo Capece et al., (2013).
A cor dos vinhos é facilmente definida visualmente quando comparando diferentes tipos de vinho, mas a fim de perceber as diferenças das caraterísticas cromáticas entre os vinhos do mesmo tipo, recorreu-se ao estudo dos parâmetros do CIELab.
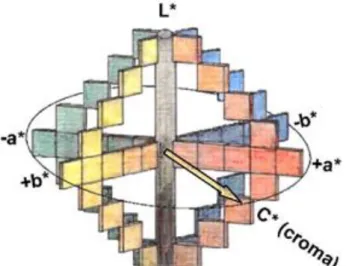
Figura 3 – CIELab colourspace, based on a sequential or 3 orthogonal axis continual Cartesian representation L*, a* y b*
Fonte: Compendium of international methods of wine and must analysis Vol.1
14 1.2.2AMINAS BIOGÉNICAS
As Aminas Biogénicas são consideradas marcadores de qualidade e autenticidade associados a outros compostos químicos como os polifenóis, são utilizados para referência do grau de degradação e de fermentação nos alimentos, daí a sua importância em alguns alimentos como o vinho, cerveja, queijo, produtos de pescado e carne, (Manetta et al. 2016; Ramos et al. 2014).
São compostos orgânicos azotados de baixo peso molecular, sendo formadas ou metabolizadas nas células de organismos vivos pela descarboxilação de aminoácidos ou por aminação/transaminação de aldeídos e cetonas. Estão agrupadas por grupos, como mostra o quadro 1. Estes compostos em baixas concentrações podem ser facilmente toleráveis e podem ajudar na regulação de algumas funções fisiológicas, mas em elevadas concentrações podem induzir distúrbios neurológicos, como dor de cabeça, hipo ou hipertensão, náuseas, palpitações cardíacas, intoxicações renais, etc., (Ramos et al.,2014; Tuberoso et al. 2015).
Quadro 1 – Classificação das Aminas Biogénicas segundo Ramos et al.,(2014)
Aminas Aromáticas Aminas Alifáticas Aminas Heterocíclicas
Tiramina Putrescina Histamina
2-Feniletilamina Cadaverina Triptamina
Espermina Espermidina
Devido aos efeitos secundários acima descritos, as concentrações de aminas biogénicas nos vinhos têm recebido muita atenção, isto porque o etanol e o acetaldeído podem aumentar o risco dos efeitos na saúde humana direta ou indiretamente, devido aos seus efeitos inibidores sobre as enzimas monoamina oxidase (MAO) e a diamina oxidase (DAO) presentes no fígado e no intestino, responsáveis pela destoxificação, (Ancín-Azpilicueta et al. 2008). Segundo Piasta et al. (2014) a dose tóxica em bebidas alcoólicas varia entre 8 a 20 mg/L para a histamina; 25-40 mg/L para a tiramina e apenas 3 mg/L para a feniletilamina.
Segundo Ancin-Azpilicueta et al. (2008), a concentração de aminas no vinho é muito variável, pois existem inúmeros fatores que influenciam a sua concentração, quer direta ou indiretamente, pela presença e quantidade do seu percursor e condições de transformação do AA em AB:
As matérias-primas uvas e mosto apresentam geralmente baixas concentrações em AB. Contudo foram encontradas diferentes concentrações destes compostos nestas mesmas matrizes, isto porque as aminas, especialmente as poliaminas, são compostos indispensáveis em células vivas, podendo ser considerados a chave para a proteção da planta contra o stress.
15 Algumas aminas como a putrescina, espermidina e histamina são normais de encontrar nas matérias-primas em baixas concentrações. No caso da ocorrência de Botritys cinerea, a composição das uvas é alterada, aumentando a concentração de AB.
A concentração de aminoácidos nas uvas constitui a principal fonte de energia das leveduras, e são compostos azotados para a fermentação alcoólica. Esta fonte de energia é contabilizada pela determinação do Azoto Assimilável, para o qual também contribui o azoto na forma amoniacal. Na figura 4 estão apresentados os AA percursores das AB respetivas.
Pelo processo de vinificação foi observado que um período longo de curtimenta aumenta a possibilidade de formação de histamina, tiramina e putrescina, bem como o envelhecimento do vinho nas borras pode aumentar a concentração de putrescina e metilamina. Também mostrou que o ataque de fungos nas uvas em alguns anos de vindimas pode influenciar a concentração de AA no vinho, Kiss et al., (2005), estudaram a influência da presença do fungo Botrytis, sobre a quantidade de AB nos vinhos.
As condições de vinificação: Valores elevados de pH favorecem a proliferação de algumas estirpes de baterias responsáveis pela formação de AB. A adição de SO2, mesmo em pequenas quantidades, depois da fermentação alcoólica atrasa a FML e favorece o desenvolvimento de Pediococcus, bactéria que apresenta maior capacidade aminobiogénica. As borras e os bagaços deixados no vinho para facilitar a FML podem dar origem uma elevada concentração de AB, devendo este processo ser evitado. A utilização de SO2 como estabilizador antes do engarrafamento é insuficiente para prevenir a formação de AB.
Pode concluir-se que provavelmente existe maior concentração de AB em vinhos tintos, devido à influência de diferentes fatores, como o processo de vinificação tradicional, a fermentação a temperaturas mais elevadas, curtimenta, pH pouco ácido, elevada biomassa de leveduras, desenvolvimento da FML e níveis baixos de SO2, sendo também estas condições propícias ao desenvolvimento de microrganismos com elevada capacidade aminobiogenica. A maioria das condições acima referidas estão presentes na vinificação de
16 talha, logo é expectável a existência de maior quantidade de AB em relação aos vinhos comerciais. A eliminação de AB do vinho é bastante difícil, pois implica a alteração da composição do vinho.
Têm sido desenvolvidos vários métodos analíticos para quantificação destes compostos azotados no vinho: cromatografia em fase gasosa, eletroforese capilar, métodos enzimáticos e imunoensaios. Mas devido à sua elevada sensibilidade, resolução e versatilidade, o método predileto é a cromatografia em fase líquida, HPLC, com deteção por fluorescência (FLD). (Manetta et al. 2016). A derivatização é importante pois permite a transformação das AB em compostos derivados capazes de serem detetados através de um detetor de fluorescência. Neste caso o agente de derivatização utilizado foi o cloreto de dansilo que reage com as aminas para formar sulfonamidas estáveis por ligações covalentes com propriedades fluorescentes, para que seja possível a sua deteção após cromatografia. O método de extração por salting-out e líquido-líquido permitiu uma diminuição de gastos de solventes comparativamente a outras referências bibliográficas, segundo Valente et al. (2014).
1.2.3COMPOSIÇÃO VOLÁTIL
O vinho é constituído maioritariamente por água, etanol, compostos fenólicos (taninos, antocianinas, ácidos fenólicos) e os compostos voláteis como terpenos, esteres, ácidos carboxílicos, e outros. Os compostos voláteis do vinho representam uma das maiores frações químicas do vinho e estão intimamente ligados ao aroma do vinho, uma das caraterísticas que define a sua qualidade e aceitação dos consumidores.
O perfil aromático do vinho é o resultado de importantes modificações derivadas de reações de esterificações, hidrólises, redução-oxidação, da difusão de oxigénio, clarificação espontânea e da eliminação do dióxido de carbono (Baiano et al, 2015). Este perfil está diretamente relacionado com a composição volátil que está amplamente estudada e documentada cientificamente por muitos investigadores, cerca de 1000 compostos estão identificados com uma vasta gama de polaridades e volatilidades (Barros, et al.,2012). Estes compostos pertencem a diferentes famílias, apresentam estruturas químicas diferentes, logo diferentes propriedades físico-químicas, concentrações que podem ir do mg/L até abaixo dos ng/L, polaridade, volatilidade e impacto no aroma bastante distintos entre vinhos (Mendes, et al., 2012). Esta diversidade de compostos é devida a diversos fatores como a casta, que condiciona a existência de diferentes aromas varietais nas uvas; a maturação da uva, o grau de maturação está diretamente relacionado com o aparecimento de aromas herbáceos no vinho, clima, solo, condições de fermentação, estirpe da levedura e bactéria utilizadas e os processos de produção e envelhecimento.
Os compostos do aroma existem na polpa e pelicula da uva e podem estar em duas formas a volátil (a forma livre) e/ou na forma não volátil (sob a forma de ligações glicosidicas).
17 Ambas contribuem para o aroma do vinho, sendo que a forma volátil contribui diretamente, e a forma não volátil (não tem cheiro, nem sabor) contribui atuando nas reações de hidrólises ácidas e enzimáticas que ocorrem durante os processos de vinificação e de armazenamento do vinho, podendo desempenhar um papel de percursores dos aromas (Panighel et al.,2014). Perante a existência de muitos compostos houve necessidade de dividir por famílias: Álcoois Superiores; Ésteres; Compostos carbonilos: Aldeídos e Cetonas; Ácidos Carboxílicos; Benzenoídes; C13-Norisoprenóides; Monoterpenos; Sesquiterpenóides, entre outras famílias. Podem ser divididas entre aromas primários, presentes naturalmente nas uvas sem qualquer intervenção, aromas secundários, resultantes da fermentação alcoólica e malolática, e por fim os aromas terciários formados durante o envelhecimento/ armazenamento do vinho, ligados ao “Bouquet”.
Os Álcoois Superiores são caraterizados por terem mais de dois átomos de carbono na estrutura química, são na maioria dos casos produzidos na fermentação alcoólica. Os compostos que fazem parte desta família são o Propanol (Propan-1-ol), Butanol (Butan-1-ol), 2-Fenil-etanol, entre outros compostos. Benéficos para o aroma do vinho, em especial o último que confere ao vinho aroma floral, nomeadamente rosas. Existem outros compostos que acima do limiar de perceção podem tornar o aroma menos atrativo para o apreciador/consumidor, em especial o Hexanol (Hexan-1-ol), responsável pelo aroma herbáceo/verde, estando intimamente relacionado com o grau de maturação das uvas aquando a sua colheita.
Os Ésteres são os compostos mais abundantes no vinho, a par com os álcoois superiores, são formados quando uma função álcool reage com uma função ácida, com eliminação de uma molécula de água, importantes no aroma dos vinhos jovens contribuindo para o aroma frutado e floral, divididos em três grupos: ésteres etílicos de ácidos orgânicos; ésteres etílicos de ácidos gordos e acetatos de álcoois superiores (mais abundantes nos vinhos com vinificação por maceração carbónica, originando vinhos mais frutados). Os ésteres etílicos provêm de metabolismos secundários das leveduras durante a fermentação alcoólica. Existem vários ácidos carboxílicos presentes no vinho, sendo os mais importantes para o aroma os ácidos orgânicos de cadeia alifática. Neste grupo existem um ácido de extrema importância em enologia, Ácido Acético responsável diretamente pela acidez volátil, a quantidade deste no vinho não deve ultrapassar os 0,5g/L, é um subproduto da fermentação alcoólica produzido pelas leveduras e resultado da atividade bacteriana (bactérias acéticas e/ou lácticas), é responsável pelo aroma vinagre. Além do ácido acético existem outros igualmente importantes como o butanoico, hexanoico, valérico, octanoico e o ácido decanoico, têm limites de perceção olfativa baixos, a concentração ronda os 20mg/L, acima deste valor a sua presença pode ser negativa para o aroma dos vinhos, (Curvelo-Garcia e Barros, 2015).
18 Os Compostos Carbonilos, Aldeídos e Cetonas, estão presentes em menor concentração vestigiais nos vinhos relativamente às famílias anteriormente descritas, à exceção do Etanal e da Acetoína (3-Hidroxi-2-Butanona) que pode ser produzida pelas leveduras através da degradação dos açúcares, ou durante o envelhecimento. Estes compostos podem induzir no vinho aroma a leite, ou aumentar adstringência. Outros compostos desta família, como os furfurais produzidos pela degradação térmica dos açúcares, podem conferir aos vinhos aromas de papel (2-Furfural), aroma a caramelo (5-Hidroximetil-2-Furfural), e aromas a baunilha/amêndoa (5-Metil-2-Furfural). A acetoína e outras cetonas derivam da degradação dos carotenoides e de alguns norisoprenoides não voláteis do vinho, exemplo a β-Damascenona, β-Ionona, conferindo ao vinho aromas florais, como por exemplo a rosas.
As Lactonas são formadas por esterificação intramolecular entre uma função ácida e uma função álcool. A Butirolactona, pertencente a família das ɣ-Lactonas, deve o prefixo ao número de carbonos tem 4 carbonos, resulta da esterificação do ácido hidroxibutirico, pode estar presente nos vinhos na ordem dos miligramas por litro. Conferem ao vinho aromas frutados, como por exemplo cocô e pêssego. Existem outras lactonas que aparecem nos vinhos quando estes são envelhecidos em barricas de madeira.
Os Terpenos são compostos químicos da família dos álcoois, existem nas uvas ou em vinhos aromáticos na forma livre ou ligados a açúcares. A casta Moscatel é um exemplo da presença destes compostos em elevadas concentrações que podem ir dos 100 a 1000µg/L são responsáveis pelos aromas florais. Os compostos mais importantes são o Geraniol, Linalol, Nerol, Citronelol e o α-Terpeniol.
Existem inúmeros estudos sobre a composição volátil, mas poucos específicos sobre a vinificação em talha. Dentro dos estudos que envolvem ânforas de barro, a maioria, são de comparação da evolução dos compostos voláteis durante o envelhecimento em diferentes tipos de depósitos (barricas, depósitos em inox e as ânforas de barro com diferentes tipos de revestimentos) como mostra Baiano et al., (2015), as ânforas sem revestimento apresentam uma composição volátil rica em terpenos e compostos carbonilos positivos para o aroma, enquanto que as ânforas com revestimento inerte, originam vinhos menos ricos em compostos voláteis aromáticos como derivados de terpenos e os compostos carbonilos, são os hidrocarbonetos que se destacam.
A análise de compostos voláteis é feita com preparação da amostra que consiste no isolamento e concentração dos voláteis antes da realização da cromatografia. Existem muitos métodos para preparar as amostras, como a destilação, extração líquido-líquido (LLE), extração em fase sólida (SPE) e a micro-extração em fase sólida no espaço de cabeça, (HS-SPME), sendo esta última a escolhida neste caso. A cromatografia de gás com espectrometria
19 de massa, GC/MS, é a mais utilizada para separação, identificação e quantificação da componente volátil no vinho.
1.3
O
BJETIVO DOE
STUDO DAV
INIFICAÇÃO EMT
ALHAO estudo da vinificação de talha em Portugal está pouco desenvolvido na química enológica, na análise sensorial, nos métodos de vinificação ou até mesmo na viticultura.
Os vinhos de talha têm origem na fermentação espontânea e apresentam características que diferem e tornam únicos estes vinhos em relação a todos os outros, dai a necessidade da realização de um estudo sobre a sua caraterização química, cujo objetivo será perceber as diferenças e as mais-valias em relação aos outros vinhos existentes no mercado. As principais características estudadas neste caso são a análise sumaria, a quantidade de aminas de biogénicas e a identificação dos compostos voláteis.
2.MATERIAIS E
MÉTODOS
21
2.1
M
ATERIAISU
TILIZADOS2.1.1AMOSTRAS:
Na realização do trabalho prático desta dissertação foram utilizadas trinta amostras de vinho de talha de Cuba, Vidigueira e Vila de Frades, sendo divididos em dez amostras de vinho de talha Branco, dez amostras de vinho de talha Tinto e dez amostras de vinho de Palhetes, participantes no concurso de Vitifrades 2015. De modo a confrontar os resultados foram também usados vinhos comerciais, feitos pela vinificação normal de tintos e brancos, da mesma região dos vinhos de talha, Vidigueira e Marmelar, utilizou-se três amostras de vinho Branco e três de vinho Tinto, não sendo considerado o vinho rosado como comparação para os vinhos Palhetes, por estes nada terem a ver na maneira de vinificação, pois este último resulta da junção de uma porção de uva branca com uva tinta.
As amostras foram identificadas por tipo e origem do vinho segundo o quadro 2 e 3.
Quadro 2 - Identificação das amostras dos vinhos de talha e seus locais de produção.
Quadro 3 - Identificação das amostras dos vinhos comerciais e seus locais de produção. Código de
Identificação Vinho Comercial Branco
VCB1 VCB2 VCB3
Local de produção Marmelar Vidigueira Vidigueira
Código de
Identificação Vinho Comercial Tinto
VCT1 VCT2 VCT3
Local de produção Marmelar Vidigueira Vidigueira
Código de Identificação Local de Produção Código de Identificação Local de Produção Código de Identificação Local de Produção
Vinho Tinto 1 Vidigueira Vinho Palhete 1 Vila de Frades Vinho Branco 1 Vila de
Frades
VT 2 Vila de Frades VP 2 Vila de Frades VB 2 Vidigueira
VT 3 Vila de Frades VP 3 Vila de Frades VB 3 Vila de
Frades
VT 4 Vidigueira VP 4 Vila de Frades VB 4 Vila de
Frades
VT 5 Vila de Frades VP 5 Vila de Frades VB 5 Vila de
Frades
VT 6 Cuba VP 6 Vila de Frades VB 6 Vila Alva
VT 7 Cuba Capela VP 7 Cuba VB 7 Vila de
Frades
VT 8 Vidigueira VP 8 Vila de Frades VB 8 Vila de
Frades
VT 9 Vidigueira VP 9 Vila de Frades VB 9 Cuba
22 2.1.2 REAGENTES E PADRÕES:
Todos os reagentes, solventes e padrões utilizados nos procedimentos analíticos são analiticamente certificados. Os reagentes utilizados nas análises sumariais foram adquiridos na Merck. Todos os padrões de aminas biogénicas (Etanolamina, Metilamina, Etilamina, Feniletilamina, Isoamilamina, Putrescina, Cadaverina, Histamina) bem como o agente de derivatização e o padrão interno (1,8 – Diaminoctano) foram adquiridos à Sigma-Aldrich (St Louis, MO, USA). Em todos os processos analíticos foi utilizada água pura através de um sistema de purificação de água Millipore.
2.1.3 EQUIPAMENTOS
Além do uso do material corrente de laboratório (pipetas, materiais de vidro, micropipetas, viais para HPLC e GC), foram feitas determinações de pH, acidez total e dióxido de enxofre livre e total num titulador potenciométrico automática, Crison modelo Compact
Tritator. As medições de absorvância para determinação dos parâmetros de cor foram
realizadas num espectrofotómetro de modelo HACH Lange DR5000. A cromatografia de alta eficiência foi realizada no equipamento de modelo Waters e2695, com detetor de fluorescência modelo Waters 2495, a coluna escolhida para a separação dos compostos das aminas biogenicas foi uma Phenomenex 18, 250*4,6mm, 4µm. Nas análises dos compostos volatéis, na preparação da amostra por HS-SPME foi utilizada uma fibra tripla CAR/DVB/PDMS, 1cm, 50/30 µm espessura de filme (df) da Supelco (Bellefonte, PA, USA), e viais de capacidade de 22 mL fechados com tampa de rosca magnética e septo de borracha forrado com teflon. Foi usado um cromatógrafo de modelo Bruker GC 456 com detetor seletivo de massa Bruker Scion TQ, com injetor automático CTC Analysis autosampler CombiPAL. As colunas utilizadas na separação dos compostos voláteis foram: duas colunas capilares ligadas em série, ZB-WAX PLUS (30 m x 0.25 mm i.d., 0.25 μm df) e ZB-5 MS (30 m x 0.25 mm i.d., 0.25 μm film df)), ambas Phenomenex, Torrance CA, USA.
23
2.2
P
ROCEDIMENTOSA
NALÍTICOS2.2.1 ANÁLISE SUMÁRIA -MÉTODOS ANALÍTICOS
Determinação da Massa Volúmica e Densidade Relativa de um vinho a 20ºC – Norma Portuguesa – NP 2142 - Método OIV-MA-AS2-01B (IV)
Princípio do Método: Determinação da massa volúmica por aerometria e correção em função da temperatura.
Determinação do teor alcoólico de um vinho – Método de Ebuliometria
Princípio do Método: baseia-se na determinação da temperatura de ebulição do vinho, intermédia entre a da água (100ºC sob uma pressão de 760 mm de mercúrio) e do etanol (78,4ºC, à mesma pressão da água) e diretamente relacionada e dependente do respetivo teor alcoólico em volume. Uma das ações interferentes neste método prende-se com a influência da pressão atmosférica na temperatura de ebulição da água, cujo valor se realiza a aferição da régua do aparelho.
Determinação dos açúcares redutores pelo método de Luff-Schoorl – NP 2223 - Método OIV-MA-AS311-01A (IV)
Princípio do Método: os açúcares redutores são o conjunto de açúcares com função aldeídica e cetónica que lhes confere poder redutor sob uma solução cupra-alcalina. Defecação da amostra, oxidação por uma solução cupra-alcalina em excesso e titulação por iodometria dos iões cúpricos não reduzidos.
Determinação da Acidez Volátil com prévio bloqueamento da fração do SO2 – Método Oficial por arrastamento de vapor - Aparelho Cazenave
Princípio do Método: Separação dos ácidos voláteis presentes no vinho por arrastamento numa corrente de vapor seguida de retificação, condensação e titulação.
Determinação de extrato seco dos vinhos – Através dos valores de Massa Volúmica; Acidez Volátil; Teor alcoólico a 20ºC
Princípio do Método: Cálculo do extrato seco dos vinhos em função da densidade do seu “resíduo sem álcool”, determinada indiretamente a partir da massa volúmica do vinho e de uma mistura hidroalcoólica com igual teor alcoólico.
Determinação do extrato seco não redutor dos vinhos – Através do extrato seco e dos açúcares totais
Princípio do Método: Determinação do teor de extrato seco total e do teor em açúcares totais e cálculo, por diferença, do teor de extrato seco não redutor.
Determinação de dióxido de enxofre SO2 livre e total – titulação com Iodo 0,02 N – Método titulação por potenciometria
24 Princípio do Método: SO2 Livre – titulação iodométrica, após adição de iodeto de potássio na amostra, cuja finalidade é eliminar substâncias interferentes. SO2 Total – titulação iodométrica, após hidrólise alcalina da amostra (para que o SO2 combinado se liberte).
Determinação da Acidez Total – titulação com Hidróxido de Sódio 0,5 N – Método de titulação por potenciometria
Princípio do método: Titulação básica, hidróxido de sódio até pH 7. A partir do volume gasto de NaOH é definida a quantidade de ácido tartárico, em g/L de ácido tartárico.
Determinação de pH – Potenciometria
Princípio do método: determinação da atividade iónica do hidrogénio utilizando o elétrodo padrão de hidrogénio.
2.2.2CARATERÍSTICAS CROMÁTICAS -MÉTODO DE ESPETROFOTOMETRIA CIELAB
A CIE (Comission Internationale de l’Éclairage) criada em 1931 cujo objetivo é a informação aos países membros da comissão sobre a arte e a ciência da iluminação. Em 1976 foi definido o espaço CIELab com coordenadas colorimétricas são definidas pela luminosidade, L*, propriedade com a qual cada cor é relacionada com a escala de cinzentos, varia entre o preto e o branco, e é definida entre 0 e 100, respetivamente. Outra coordenada é o a*, que quantifica os tons avermelhados com valores positivos, e com valores negativos os tons esverdeados. A última, das coordenadas principais, é o b* que está relacionado com os tons de amarelo corresponde aos valores positivos, e os tons de azul definidos pelos valores negativos da coordenada.
Além das coordenadas Lab, foram ainda determinados o Croma, C*, atributo que permite determinar para cada tonalidade o grau de diferença quando comparados com a escala de cinzentos com a mesma luminosidade, e por fim a Matiz ou Tonalidade, H*, é definido como o atributo que define as cores como avermelhado, esverdeado, etc., permite distinguir uma cor utilizando a referência do cinzento com o mesmo brilho. A Matiz está relacionada com as diferentes absorvâncias e comprimentos de onda, é considerado o atributo de qualidade da cor (Gómez-Míguez et al.,2007).
O estudo da cor foi realizado com base no Método OIV-MA-AS2-11, tipo I, as leituras de absorvâncias, Abs, foram efetuadas entre os comprimentos de onda 380 a 750 nm, de 5 em 5 nm duplicadas por vinho. As células utilizadas foram de quartzo com dimensões diferentes para cada tipo de vinho: para vinhos brancos célula de 1 cm, vinhos palhetes 0,5 cm; e para os vinhos tintos foi utilizada uma célula de 0,1 cm. Os dados foram calculados através de uma folha de cálculo formatada para o efeito permitindo observar se existe diferenças entre os vinhos.
25 2.2.3AMINAS BIOGÉNICAS - MÉTODO DE DERIVATIZAÇÃO E HPLC–FLR
Condições de Derivatização:
Tampão Fosfato 0,2 mol/L pH12 – Hidrogeno Fosfato Sódico Anidro (Na4HPO4) dissolvido em H2O, para 500 mL pesa-se 14,196g de Na4HPO4, ajustando-se o pH para 12 com Hidróxido de Sódio (NaOH) 4 mol/L.
Cloreto de Dansilo (Dns-CL) – Solução de Dns-Cl 3,5 mg/mL dissolve-se 80 mg de Dns-CL em 25 mL de Acetonitrilo (CH3CN).
Padrão Interno (PI) – 1,8 Diaminoctano (1g/L)
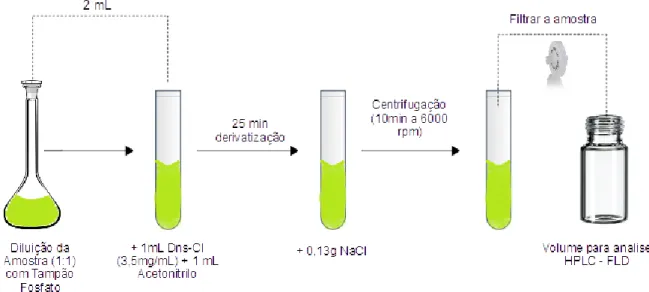
A preparação das amostras foi feita segundo (Ramos, et al., 2014) com algumas alterações. A amostra de padrão ou vinho foi diluída com o tampão de fosfato 0,2 mol/L pH12, na razão de 1:1 (v/v). De seguida, transferiu-se para um tubo de ensaio, 2 mL desta diluição, onde foram adicionados 20 µL de PI, de seguida adicionou-se 1 mL de CH3CN e 1 mL DNS-Cl, adição feita segundo a razão 1:1 (v/v), aguarda-se 25 minutos, pesa-se 0,13g de NaDNS-Cl, adiciona-se à solução de derivatização finalizados os 25 minutos, centrifuga-se a 6000 rpm durante 10 minutos. No final agita-se o tubo de ensaio, e recolhe-se o sobrenadante (Fase Orgânica), filtra-se a amostra com filtro de membrana PTFE, 0,45mm de poro e Ø=13 mm, para o vial de HPLC, procedendo à separação, ilustrado na figura 5. Neste método foi utilizada a técnica de Salting-Out, ou seja a adição de um sal para separar a fases orgânica e aquosa.
Figura 5 – Esquema ilustrativo da preparação da amostra para análise em HPLC-FLD. (Adaptado de Ramos et al.2014)
Método Cromatográfico:
A quantificação das aminas biogénicas foi realizada por HPLC-FLR, os solventes escolhidos para a separação foram Água pura Millipore e Acetonitrilo. O detetor de fluorescência foi programado com os comprimentos de onda de excitação, λex=320 nm e de emissão, λem=523 nm, segundo Preti, et al. 2015. A fase móvel da separação carateriza-se por: 0-25 minutos 60 % de água e 40% de acetonitrilo; 25-30 minutos 20% de água e 80% de
26 acetonitrilo; dos 30-35 minutos 60% água e 40% de acetonitrilo com o fluxo de 1 ml/min, com volume de amostra de 10L, método adaptado de Manneta et al, 2016. Foram efectuados peridicamente, injeções de branco com acetonitrilo para garantir a limpeza de compostos, entre corridas, na coluna.
A identificação das aminas biogénicas foi feita recorrendo à injeção da solução padrão com as 8 aminas e o padrão interno (Etanolamina, Metilamina, Etilamina, Feniletilamina, Isoamilamina, Putrescina, Cadaverina, Histamina e 1,8-diaminoctano (PI)), em cromatografia líquida de alta precisão com detetor de fluorescência, e posterior análise dos espectros e dos tempos de retenção, como indica Manetta, et al. (2016).
2.2.4AMINAS BIOGÉNICAS -RETAS DE CALIBRAÇÃO
Para a quantificação das aminas biogénicas procedeu-se à injeção de soluções padrão (consideradas as mesmas AB presentes na identificação), em concentrações que variaram entre 0,0095 a 9,766 mg/L. As diferentes soluções padrão foram derivatizadas segundo o mesmo protocolo utilizado para as amostras. Os padrões foram preparados e injetados em triplicados
O coeficiente de determinação variou entre 0,9995 a 0,9973 considerando a existência de uma correlação muito boa entre as variáveis. O comprimento de onda do detetor de fluorescência utilizado foi de 320nm para excitação e 523nm para a emissão.
A partir das rectas apresentadas no quadro 4, foi calculado as quantidades de cada amina biogénica presente nos vinhos.
Quadro 4 – Rectas de calibração para as Aminas Biogénicas. Amina Tempo Retenção
(min) λ (nm) Equação de Calibração R2 Gama de Linearidade mg/L Ex Em Mínimo Máximo Etanolamina 6,51 320 523 y = 87,37x + 0,0101 0,9956 0,009538 9,765625 Metilamina 10,80 320 523 y = 38,824x + 0,00001 0,9995 0,009538 9,765625 Etilamina 13,02 320 523 y = 32.321x + 0,0011 0,9981 0,009538 9,765625 Feniletilamina 20,01 320 523 y = 23,308x − 0,0004 0,9998 0,009538 9,765625 Isoamilamina 20,65 320 523 y = 228,82x + 0,0024 0,9998 0,009538 9,765625 Putrescina 21,36 320 523 y = 34,36x − 0,0018 0,9996 0,008583 8,878906 Cadaverina 22,60 320 523 y = 46,618x − 0,0019 0,9973 0,009489 9,716797
2.2.5COMPOSIÇÃO VOLÁTIL - MÉTODO DE HS-SPME E GC/MS Microextração em fase solida no espaço cabeça (HS – SPME)
Para a extração dos compostos por HS-SPME (Head Space – Solid Phase
MicroExtration) foi utilizada uma fibra tripla, CAR/DVB/PDMS, 1cm, 50/30 µm espessura de
27 fabricante antes da sua utilização, e periodicamente foram efetuados vários brancos da fibra a fim de confirmar a ausência de contaminantes e/ou presença de compostos de aroma das amostras anteriores.
5 mL de amostra de vinho e 0,6g de NaCl, foram colocadas em viais de 22 mL, posteriormente fechados com tampas de rosca magnética e septos de borracha forrada com teflon. Os viais foram equilibrados durante 5 minutos a 30ºC e a extração decorreu durante 30 minutos à mesma temperatura.
A desorção térmica dos analitos foi feita expondo a fibra no injetor do GC a 260ºC durante 3 minutos, sem partição de fluxo, em modo splitless, durante 3 minutos. Todas as amostras foram analisadas em triplicado. Esta técnica de preparação de amostra foi efetuada segundo Carlin et al, (2016), com algumas modificações.
Método Cromatográfico:
Para a separação por GC as condições cromatográficas foram: a temperatura do forno a 40ºC durante 1minuto, aumento de 7ºC/min até aos 210ºC, 10ºC/min até atingir os 250ºC, mantendo esta temperatura durante 15 minutos. A fase móvel, ou seja, o gás de arraste utilizado foi Hélio, a pressões constantes de 35,0 psi e 23,0 psi, nos dois controlos eletrónicos de fluxo (EFC 21, EFC 24). A temperatura da linha de transferência e da fonte foram de 240ºC e 220ºC, respetivamente. Os tempos de retenção e os fragmentos característicos foram obtidos por impacto eletrónico a 70 eV e os espectros de massa dos analitos foram registados em modo varrimento entre 40 a 450Da.
Os dados foram adquiridos com o programa MSWS 8.2 Bruker e analisados com o programa Bruker MS Data Rewie 8.0, e os espectros obtidos foram comparados com os presentes na biblioteca NIST MS Search Program Version 2.0.
2.3
A
NÁLISE ESTATÍSTICA DOS DADOSPara a análise estatística dos dados obtidos no estudo das aminas biogénicas foi utilizado o software SPSS Statistcs 2.0. Foram feitas duas análises de variâncias, ANOVA a um fator, o tipo de vinho e a sua origem, o teste de comparação das médias utilizado foi LSD, diferenças mínimas significativas, considerando o intervalo de confiança a 95% (valor de p <0,05). O teste de Levene foi utilizado para testar a homogeneidade de variâncias.
No anexo A estão apresentados os resultados obtidos nas duas ANOVA a um fator: Quantidade de aminas biogénicas vs. Tipo de vinho; e para a Quantidade de aminas biogénicas vs. Origem do vinho, e respetivos testes de homogeneidade de variâncias.
29
3.1
A
NÁLISES
UMÁRIA DOSV
INHOS–
B
OLETINS ANALÍTICOSVINHOS COMERCIAIS
No quadro 5 estão apresentados os resultados obtidos da análise de três vinhos comerciais, brancos (VCB) e tintos (VCT) de anos de colheita diferentes 2013, 2015 e 2014, com a mesma região demarcada dos vinhos de talha, Vidigueira. Os parâmetros analíticos estão de acordo com o esperado tendo em consideração as caraterísticas próprias da região vitivinícola Alentejo, obtendo vinhos com elevado teor alcoólico, nomeadamente os vinhos brancos e com baixa acidez. Os outros parâmetros apresentam valores dentro do que é expectável dos limites impostos pelo Reg. (CE) nº606/2009.
Quadro 5 – Resultados obtidos dos vinhos comerciais brancos e tintos na análise sumária.
Código ID SO2 Livre SO2 Total Massa Volúmic a Teor Alcoólic o Açucares redutores Extrato Seco Total Extrato Seco N/Red. Acidez Total Acidez Volátil pH mg/L mg/L g/mL % vol g/L g/L g/L g/L g/L VCB1 32 112 0,9912 12,9 1,7 25,3 23,6 5,67 0,36 3,33 VCB2 77 217 0,9903 12,8 1,4 22,7 21,3 4,31 0,51 3,66 VCB3 54 143 0,9902 12,7 2,2 22,2 20,0 5,35 0,39 3,30 VCT4 14 78 0,9929 13,3 3,1 30,7 27,6 5,21 0,60 3,49 VCT5 36 77 0,9929 13,4 2,5 31,3 28,8 4,99 0,51 3,67 VCT6 28 93 0,9934 13,6 3,1 33,1 30,0 5,24 0,57 3,62
ACIDEZ TOTAL,ACIDEZ VOLÁTIL E PH
No quadro 6 apresentam-se os valores obtidos para a acidez total, volátil e pH dos vinhos de talha brancos e tintos. Os resultados obtidos na acidez volátil, mostram alguns vinhos com acidez muito elevada. Escrutinando os resultados: nos vinhos tintos de talha os valores obtidos estão entre os 0,6 g/L e os 0,84 g/L de ácido acético, valores aceitáveis para este tipo de vinho pois a realização da fermentação malolática aumenta o parâmetro em questão.
Nos vinhos brancos existe uma maior variação dos valores de acidez volátil, variando entre 0,24 g/L, um valor ótimo, e 0,84 g/L. porem, quer para os vinhos tintos quer para os vinhos brancos, todos os valores são inferiores ao limite legal de 1,2 g/L expresso em ácido acético.
Quadro 6 – Resultados obtidos nas determinações acidimétricas (g/L) nos vinhos tintos e brancos de talha.
Código ID Acidez Total (g/L) Acidez Volátil (g/L) pH Código ID Acidez Total (g/L) Acidez Volátil (g/L) pH VT 1 3,81 0,78 4,16 VB 1 5,23 0,57 3,66 VT 2 5,34 0,72 3,49 VB 2 5,04 0,24 3,32 VT 3 5,07 0,66 3,51 VB 3 4,79 0,60 3,56 VT 4 5,71 0,72 3,45 VB 4 4,41 0,72 3,90 VT 5 5,85 0,60 3,44 VB 5 5,27 0,54 3,54 VT 6 4,20 0,72 3,75 VB 6 4,99 0,84 3,65
30
VT 7 4,68 0,69 3,66 VB 7 5,36 0,54 3,63
VT 8 5,30 0,66 3,77 VB 8 4,93 0,45 3,52
VT 9 4,52 0,84 4,20 VB 9 5,65 0,48 3,37
VT 10 5,60 0,78 3,43 VB 10 5,66 0,69 3,79
Por último, em relação aos vinhos palhetes, quadro 6.1 os valores da acidez volátil variam entre os 0,42 g/L e os 1,05g/L, existem quatro vinhos palhetes com valores de acidez volátil elevados, dois superiores a 1g/L (VP6 e VP7) e outros dois superiores a 0,9 g/L ácido acético (VP8 e VP10), segundo a bibliografia, estes valores estão no limiar de perceção do gosto e aroma a vinagre nos vinhos, sendo depreciativo para os consumidores.
Os elevados valores de acidez volátil podem estar relacionados com a dificuldade na higienização das talhas devido ao material poroso, com a utilização contínua destes recipientes e da pouca ou nenhuma adição de conservantes nos vinhos, a microxigenação através dos poros de barro, quando a talha está mal impermeabilizada, também pode estar.
Quadro 6.1 – Resultados obtidos nas determinações acidimétricas (g/L) nos vinhos palhetes.
Código ID Acidez Total
(g/L) Acidez Volátil (g/L) pH VP 1 5,01 0,72 3,67 VP 2 4,57 0,42 3,63 VP 3 4,97 0,78 3,54 VP 4 5,07 0,69 3,61 VP 5 5,26 0,48 3,56 VP 6 5,20 1,05 3,74 VP 7 4,82 1,02 3,92 VP 8 5,77 0,93 3,66 VP 9 5,44 0,60 3,51 VP 10 5,08 0,99 3,78
A acidez total indica, em muitos casos a região de produção dos vinhos, isto porque regiões mais quentes tendencialmente produzem vinhos com baixa acidez, como no Alentejo, enquanto regiões mais frias, vinhos com acidez mais elevada, tais como os vinhos verdes.
Nos resultados obtidos facilmente se deteta as caraterísticas da região quente pois os vinhos apresentam acidez baixa: nos vinhos tintos variam entre os 3,81 g/L e os 5,85 g/L ácido tartárico; os vinhos brancos 4,41 g/L e os 5,66 g/L ácido tartárico; os vinhos palhetes têm valores entre os 4,57 g/L a 5,77 g/L ácido tartárico. Estes valores estão de acordo com os vinhos comerciais estudados, e cumprem o estipulado na leio apresentado valores de acidez total superior a 3,5g/L, expresso em ácido tartárico. Os valores de pH estão de acordo com os valores de acidez, são dois parâmetros que não podem ser separados, sendo inversamente proporcional (não sendo na mesma proporção), quando um é baixo o outro é elevado, valores mais elevados de pH, podem estar relacionados com alguns fenómenos de casse nos vinhos.
31 DIÓXIDO DE ENXOFRE (SO2)
As quantidades de SO2 Livre e Total nos vinhos estão presentes no quadro 7. Observa-se que nos identificados por VT2, VT10, VP1 e o VP8, provavelmente não foi adicionado SO2, porque os valores de dióxido de enxofre total são muito próximos dos valores de dióxido de enxofre livre, podendo estar associados ao erro do método analítico utilizado.
Na maioria dos vinhos, à exceção dos referidos anteriormente, foi utilizado dióxido de enxofre, como mostra os valores referentes ao SO2 Total, vinhos com valores mais baixos em menor quantidade, noutros mostra que houve adições em maior quantidade, valores mais elevados, como o exemplo VB2, VB5, VB10 e o VP5. A utilização de dióxido de enxofre pode ser justificada pela existência de uvas em mau estado sanitário, pretender aumentar o tempo de armazenamento do vinho, visto estes serem considerados vinhos de consumo rápido, e por ultimo, as elevadas quantidades de SO2 podem dever-se à sua adição aquando do engarrafamento. Normalmente considera-se um vinho protegido quando tem um teor de SO2 livre de 30 mg/L, e verifica-se que estes vinhos têm valores de dióxido de enxofre livre muito baixos, mesmo aqueles que têm teores elevados de dióxido de enxofre total. Este facto parece indicar que a aplicação de SO2 foi efetuada aquando do engarrafamento. Este parâmetro torna-se muito importante, pois a saúde do vinho durante a conservação depende da existência deste adjuvante, devido a todas as suas caraterísticas antioxidantes, antissépticas e antilevurianas, dai estes vinhos serem considerados de consumo rápido.
Quadro 7 – Resultados do SO2 (mg/L) nos vinhos de talha.
Código ID SO2 Livre (mg/L) SO2 Total (mg/L) Código ID SO2 Livre (mg/L) SO2 Total (mg/L) Código ID SO2 Livre (mg/L) SO2 Total (mg/L) VT 1 20 40 VB 1 7 36 VP 1 5 6 VT 2 4 8 VB 2 27 126 VP 2 11 46 VT 3 11 70 VB 3 9 57 VP 3 7 55 VT 4 11 79 VB 4 12 75 VP 4 5 11 VT 5 7 24 VB 5 7 115 VP 5 8 134 VT 6 16 46 VB 6 4 11 VP 6 9 22 VT 7 15 68 VB 7 10 70 VP 7 6 14 VT 8 21 67 VB 8 4 42 VP 8 6 6 VT 9 6 11 VB 9 4 61 VP 9 6 18 VT 10 4 6 VB 10 5 113 VP 10 8 11
TITULO ALCOOMÉTRICO VOLÚMICO -% VOL.
Os vinhos do Alentejo têm como caraterística o elevado teor alcoólico, devido ao microclima mais quente e ao terroir das vinhas. Os valores dos vinhos de talha estão apresentados no quadro 8, indicam valores elevados de teor alcoólico nos vinhos brancos 11,1% vol. a 14,1% vol.. Os vinhos tintos apresentam valores entre os 12,2% vol. e os 16,3% vol., este último apresenta elevado teor alcoólico podendo apresentar condições menos
32 positivas para o consumidor. Os vinhos palhetes têm o título alcoométrico entre os 11,8% vol. e os 13,8% vol..
Quadro 8 – Resultados obtidos no teor alcoólico volumétrico (% vol.) dos vinhos de talha.
Código ID Titulo Alcoométrico (% vol.) Código ID Titulo Alcoométrico (% vol.) Código ID Titulo Alcoométrico (% vol.) VT 1 14,9 VB 1 13,6 VP 1 13,8 VT 2 13,5 VB 2 11,4 VP 2 13,3 VT 3 12,2 VB 3 11,1 VP 3 13,7 VT 4 13,1 VB 4 14,1 VP 4 12,4 VT 5 14,5 VB 5 14,0 VP 5 13,6 VT 6 13,7 VB 6 12,2 VP 6 11,8 VT 7 13,2 VB 7 14,1 VP 7 13,0 VT 8 14,5 VB 8 13,5 VP 8 11,9 VT 9 16,3 VB 9 12,4 VP 9 12,4 VT 10 13,1 VB 10 12,2 VP 10 12,6
MASSA VOLÚMICA E EXTRATO SECO
O quadro 9 apresenta os resultados de massa volúmica, extrato seco total e extrato seco não redutor dos vinhos tintos e brancos. A massa volúmica para os vinhos de talha tintos varia entre os 0,9919 g/mL e os 0,9947g/mL. Os vinhos de talha brancos têm valores entre os 0,9917 g/mL e os 0,9951g/mL. No quadro 9.1 estão os valores referentes aos vinhos palhetes, estes variam entre 0,9916 g/mL e os 0,9945 g/mL. Todos os valores estão de acordo com o expectável, pode ser considerado um ligeiro aumento nos vinhos de talha brancos quando comparados com os vinhos brancos comerciais, pois são vinificados com curtimenta.
Os resultados obtidos para o extrato seco não redutor estão acima dos limites estipulados pelo regulamento (Vinhos brancos >16g/L; Vinhos tintos e palhetes ≥ 18g/L), logo estão todos dentro dos limites legais. Para os vinhos tintos a variação é entre 27,2 g/L a 38,2 g/L, no caso dos vinhos brancos varia entre 23,0 g/L e 30,9 g/L. nos vinhos palhetes os valores variam entre 26,0g/L e os 31,2 g/L.
A variação dos valores dos extrato seco total nos vinhos tintos fica entre 29,7 g/L e 41,3 g/L, nos vinhos brancos entre 25,3 g/L e os 32,3 g/L, por fim os valores referentes aos vinhos palhetes está compreendida entre os 27,9 g/L e os 33,1 g/L. Tendo em consideração a ocorrência de curtimenta nos vinhos de talha é expectável que os valores de extrato seco total sejam um pouco mais elevados em comparação aos valores obtidos nos vinhos comerciais, concretamente na comparação entre vinhos brancos.
33 Quadro 9 – Resultados de Massa Volúmica (g/mL) extrato seco (g/L) e extrato seco não redutor (g/L) obtidos nos
Vinhos de Talha. Código ID Massa Volúmica (g/mL) Extrato Seco Total (g/L) Extrato Seco N/Redut. (g/L) Código ID Massa Volúmica (g/mL) Extrato Seco Total (g/L) Extrato Seco N/Redut. (g/L) VT 1 0,9930 35,7 32,2 VB 1 0,9931 32,3 30,0 VT 2 0,9926 30,7 28,3 VB 2 0,9929 25,3 23,0 VT 3 0,9947 32,3 29,9 VB 3 0,9951 30,0 27,6 VT 4 0,9933 31,3 28,3 VB 4 0,9917 30,0 28,1 VT 5 0,9919 31,5 29,2 VB 5 0,9925 32,0 29,6 VT 6 0,9927 31,3 29,5 VB 6 0,9931 28,1 25,7 VT 7 0,9930 30,7 28,6 VB 7 0,9923 31,3 28,6 VT 8 0,9946 38,5 35,3 VB 8 0,9923 30,0 27,3 VT 9 0,9937 41,3 38,2 VB 9 0,9923 26,6 24,9 VT 10 0,9927 29,7 27,8 VB 10 0,9951 33,1 30,9
Quadro 9.1 - Resultados obtidos nos Massa Volúmica (g/mL), extrato seco (g/L) e extrato seco não redutor (g/L) dos vinhos palhetes.
Código ID Massa Volúmica
(g/mL)
Extrato Seco Total (g/L)
Extrato Seco N/Redut. (g/L) VP 1 0,9916 28,9 26,8 VP 2 0,9930 31,3 29,0 VP 3 0,9919 29,2 26,7 VP 4 0,9931 28,7 26,5 VP 5 0,9928 31,5 29,3 VP 6 0,9945 30,2 28,4 VP 7 0,9941 33,1 31,2 VP 8 0,9941 29,4 27,7 VP 9 0,9928 27,9 26,0 VP 10 0,9938 31,0 29,5 AÇUCARES REDUTORES
Os açucares redutores estão apresentados no quadro 10, valores acima do limite técnico < 2g/L, mas aceitáveis como final de fermentação alcoólica. Os vinhos tintos apresentam maior conteúdo em açucares redutores, comparando com os vinhos tintos comerciais os valores não se tornam muito diferentes. Considerando a elevada quantidade de açucares redutores é de esperar a ocorrência de fenómenos de alteração no vinho, assim considera-se que estes vinhos têm pouco tempo de vida útil sem que sejam alterados microbiologicamente.
Quadro 10 – Resultados obtidos nos açúcares redutores (g/L) nos vinhos de talha.
Código ID Açucares Redutores (g/L) Código ID Açucares Redutores (g/L) Código ID Açucares Redutores (g/L) VT 1 3,5 VB 1 2,3 VP 1 2,1 VT 2 2,4 VB 2 2,3 VP 2 2,3