Cromossomas
Cromossomas
em Mulheres c
Suspeita Clínic
C
Cromossomop
Cristina Isabel Fernandes Cand
Biologia
Biologia 2012Orientador
Natália Oliva Teles, Assessor Superior, CGM-I
s Sexuais
s Sexuais
com
ca de
patia
deias
NSA,I.P.
O Presidente do Júri,
Agradecimentos
À Prof.ª Doutora Natália Oliva Teles pela orientação persistente e dedicada deste trabalho, sempre salpicada com apontamentos do seu humor acutilante, decisivo e estimulante nos momentos mais difíceis. As suas contribuições técnico-científicas bem como as partilhas pessoais foram fundamentais.
Ao Prof. Doutor Vasco Almeida pela sua constante disponibilidade e simpatia sempre que a ele recorri.
À Dr.ª Maria da Luz Fonseca e Silva, que sempre incentivou a elaboração deste trabalho, mesmo nos momentos mais difíceis, contribuindo também para ele com o seu espirito crítico e experiência. Sem o seu apoio incondicional, este mestrado não teria chegado a bom porto.
À minha amiga Manuela Mota Freitas pelo “empurrão” inicial e pela ajuda constante ao longo de toda a elaboração deste trabalho.
A todos os colegas da Unidade de Citogenética a amizade e o apoio que sempre me deram.
À Dr.ª Maria José Ortigão pela preciosa ajuda na recolha dos dados informáticos que permitiram a realização deste trabalho.
À Paula Machado pela ajuda na formatação informática de todo o texto. Ao Marco, Pedro e Beatriz por existirem na minha vida.
Aos meus pais por todos os valores que me transmitiram e que fizeram de mim aquilo que sou hoje. Vocês são, e serão sempre, os meus pilares.
Resumo
As anomalias dos cromossomas sexuais são as mais comuns de todas as alterações citogenéticas em diagnóstico pré-natal, nas crianças e nos adultos. As patologias associadas a estes cromossomas apresentam uma extensa variabilidade genética e clínica englobando uma vasta gama de anomalias citogenéticas. No entanto, os fenótipos associados a estas alterações são, geralmente, menos severos do que os provocados pelas mesmas alterações nos autossomas, sendo a infertilidade a sua única manifestação clínica em muitos destes casos.
Para a realização deste estudo, de entre os 27422 cariótipos realizados entre 1981 e 2011 na Unidade de Citogenética do CGMJM, INSA, I.P., foram selecionados 8730 cariótipos de mulheres. As indicações clínicas para a execução da análise citogenética foram várias sendo de destacar a presença de anomalias múltiplas, o atraso psicomotor, os abortamentos de repetição e a suspeita clínica de Síndrome de Turner. Entre as 8730 amostras selecionadas 282 apresentavam alterações do cromossoma X (3,2%). Foram efetuadas duas abordagens dos resultados anormais: a primeira foi a classificação dos cariótipos por grupo de anomalia; e a segunda a distribuição dos cariótipos por indicação clínica. Os resultados obtidos foram comparados com o descrito na literatura.
Com este trabalho pretendeu-se um melhor conhecimento e divulgação junto da comunidade científica das anomalias do cromossoma X na mulher portuguesa e a identificação dentro de cada grupo clínico do tipo de anomalia mais frequente.
Abstract
Sex chromosome abnormalities are the most frequent cytogenetic alterations in prenatal diagnosis, in children and in adults. The pathologies associated with these chromosomes show a wide range of genetic and clinical variability and encompass many cytogenetic anomalies. However the phenotypes associated with these alterations are generally less severe than those which are caused by the same alterations in the autosomes. Infertility is often the only clinical manifestation in many of these cases.
From the 27422 karyotypes analyzed between 1981 and 2011, in the Cytogenetics Unit of CGMJM, INSA, I.P. , 8730 karyotypes from women were selected for this study. Clinical indications for cytogenetic analysis were varied. Particularly important indications were; the presence of multiple anomalies, psicomotor delay, recurrent miscarriage and clinical suspicion of Turner’s Syndrome. Among the 8730 selected samples 282 showed alterations of the X chromosome (3,2%). The abnormal results have been presented in two ways, firstly classification of the karyotype by abnormality and secondly distribution of the karyotypes according to the clinical indication. The results obtained were compared with those described in the literature.
The aims of this work are the better understanding of the X chromosome anomalies in Portuguese women, the identification within each clinical group of the most frequent abnormality, and the distribution of this information to the scientific community.
INDICE
I. Introdução ... 1
1. A Citogenética ... 1
1.1. Historial da Citogenética Humana ... 1
2. Estudos Cromossómicos Convencionais ... 8
2.1. Os Cromossomas Humanos e a sua Estrutura ... 8
2.2. Cultura de Tecidos e Obtenção de Metafases... 10
2.3. Técnicas de Bandeamento e de Coloração ... 13
2.3.1. Bandas GTG/GTL (bandas G, usando Tripsina e corante Giemsa ou Leishman, respetivamente) ... 13
2.3.2. Bandas QFQ (bandas Q, por Fluorescência e coloração Quinacrina) ... 14
2.3.3. Bandas RHG (Bandas R usando calor e corante Giemsa) ... 14
2.3.4. Bandas CBG (bandas C usando hidróxido de Bário e corante Giemsa)... 15
2.3.5. Coloração AgNOR (Coloração com nitrato de prata das regiões organizadoras dos nucléolos) ... 15
2.4. Nomenclatura Cromossómica ... 15
2.5. Anomalias Cromossómicas ... 16
2.5.1. Alterações Cromossómicas Numéricas ... 17
2.5.1.1. Poliploidias ... 17
2.5.1.2. Aneuploidias... 17
2.5.2. Anomalias Cromossómicas Estruturais ... 18
2.5.2.1. Deleções ... 19 2.5.2.2. Duplicações... 19 2.5.2.3. Inversões ... 20 2.5.2.4. Translocações ... 20 2.5.2.5. Inserções ... 21 2.5.2.6. Isocromossomas ... 21 2.5.2.7. Cromossomas Marcadores ... 22 2.5.2.8. Cromossomas Dicêntricos ... 22 2.5.2.9. Cromossomas em Anel ... 23 2.6. Cromossomas Sexuais ... 23 2.6.1. Cromossoma X ... 24 2.6.1.1. Inativação do Cromossoma X ... 25 2.6.2. Cromossoma Y ... 26
2.6.3. Patologias dos Cromossomas Sexuais ... 27
3. Alterações Dos Cromossomas Sexuais Em Mulheres ... 29
3.1. Alterações Cromossómicas Numéricas ... 29
3.1.1. 45,X (Síndrome de Turner) ... 29
3.1.2. 47,XXX (Trissomia X) ... 31
3.1.3. 48,XXXX (Tetrassomia X) ... 32
3.2. Anomalias Cromossómicas Estruturais ... 32
3.2.1. Isocromossoma X ... 32 3.2.2. Anel do cromossoma X ... 33 3.2.3. Deleções em Xp ... 34 3.2.4. Deleções em Xq ... 34 3.2.5. Duplicações em Xp ... 34 3.2.6. Duplicações em Xq ... 35 3.2.7. Inversões do X ... 35 3.2.8. Cromossoma X Isodicêntrico ... 36
3.3. Alterações da Diferenciação Sexual ... 36
3.4. Aconselhamento Genético ... 38
II. Objetivo do Trabalho ... 40
III. Material e Métodos ... 41
1. Material ... 41
1.1. Recolha Informática dos Dados ... 41
2. Metodologia Utilizada para a Obtenção de Cariótipo ... 43
2.1. Controlo de Qualidade ... 44
2.2. Sistema de Gestão da Qualidade ... 44
IV. Resultados ... 45
V. Discussão ... 53
1. Anomalias Numéricas ... 54
1.1. 45,X e Mosaicos 45,X com uma Linha Celular Normal (46,XX) ... 54
1.2. 47,XXX e Mosaicos com uma Linha Celular 47,XXX ... 58
1.3. 48,XXXX e Mosaicos com uma Linha Celular 48,XXXX ... 60
2. Anomalias Estruturais ... 60
2.1. Isocromossoma X(q) e Mosaicos com uma Linha Celular i(Xq) ... 61
2.2. Anéis do Cromossoma X ... 62
2.3. Deleções em Xp e em Xq ... 63
2.4. Duplicações em Xq ... 64
2.5. Translocações Equilibradas X;autossoma ... 65
2.6. Inversões Pericêntricas do X ... 66
2.7. Isodicêntricos do X ... 66
3. Anomalias da Diferenciação Sexual ... 67
4. Indicações Clínicas ... 68
VI. Considerações Finais ... 73
LISTA DE TABELAS
Página
Tabela 1 - Características clínicas das patologias mais frequentes dos
cromossomas sexuais. ... 28
Tabela 2 - Achados cromossómicos no Síndrome de Turner ... 30 Tabela 3 - Distribuição dos casos com resultados anormais por tipo de
anomalia. ... 46
Tabela 4 - Cariótipos com Anomalias Numéricas especificando o número de
casos e a percentagem. ... 46
Tabela 5 - Cariótipos com Anomalias Estruturais especificando o número de
casos e a percentagem. ... 47
Tabela 6 - Cariótipos com Anomalias da Diferenciação Sexual especificando
o número de casos e a percentagem. ... 47
Tabela 7 - Indicações clínicas para a realização de cariótipo com respetivo
número total de casos, número de casos com anomalia e percentagem de
anomalias por indicação clínica. ... 48
Tabela 8 - Resultados anormais de cariótipos efetuados em mulheres com
suspeita clínica de Intersexo. ... 49
Tabela 9 - Resultados anormais de cariótipos efetuados em mulheres com
Amenorreia Primária/ Secundária. ... 49
Tabela 10 - Resultados anormais de cariótipos efetuados em mulheres com
suspeita clínica de Síndrome de Turner. ... 50
Tabela 11- Resultados anormais de cariótipos efetuados em mulheres com
Abortamentos de Repetição. ... 51
Tabela 12 - Resultados anormais de cariótipos efetuados em mulheres com
Familiares com Anomalia Cromossómica. ... 51
Tabela 13 - Resultados anormais de cariótipos efetuados em mulheres com
Anomalias Múltiplas. ... 51
Tabela 14 - Resultados anormais de cariótipos efetuados em mulheres com
LISTA DE FIGURAS
Página
Figura 1 - Texto em que Wilhelm Waldeyer propôs a designação de
cromossoma ... 1
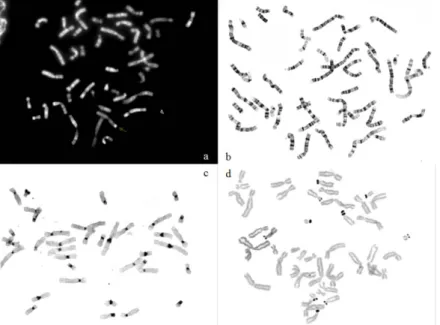
Figura 2 - a) Imagem que estabeleceu 46 como o número de cromossomas da espécie humana; b) Cariograma após coloração com corante giemsa ... 3
Figura 3 - Exemplos de várias técnicas utilizadas em citogenética convencional (a) Bandas QFQ, (b) bandas GTL, (c) bandas CBG, (d) coloração AgNor ... 4
Figura 4 - Cariograma com bandas GTL de alta resolução ... 5
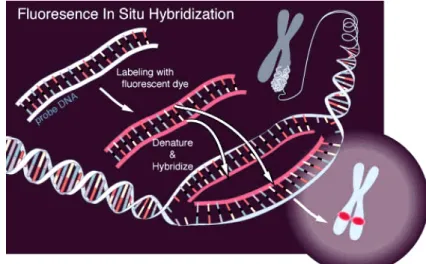
Figura 5 - Esquema da técnica de FISH ... 5
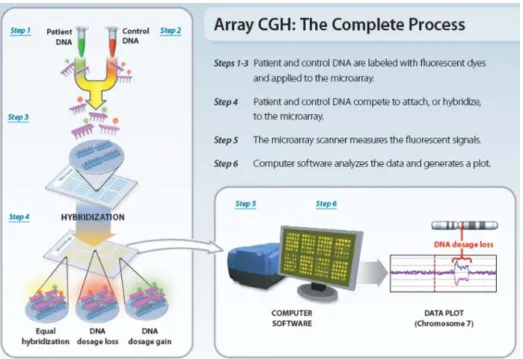
Figura 6 - Diagrama elucidativo da técnica microarrays baseados na hibridação genómica comparativa (aCGH) ... 6
Figura 7 - Componentes estruturais e funcionais dos cromossomas metafásicos ... 9
Figura 8 - Representação esquemática de um cromossoma ... 16
Figura 9 - Esquema ilustrativo da formação de uma deleção intersticial e terminal ... 19
Figura 10 - Esquema ilustrativo da formação de uma duplicação intracromossómica ... 19
Figura 11 - Esquema ilustrativo da formação de uma inversão ... 20
Figura 12 - a) Esquema ilustrativo da formação de uma translocação equilibrada; b) Esquema ilustrativo da formação de uma translocação robertsonianas ... 21
Figura 13 - Esquema ilustrativo da formação de uma inserção ... 21
Figura 14 - Esquema ilustrativo da formação de um isocromossoma ... 22
Figura 15 - Esquema ilustrativo da formação de um cromossoma dicêntrico ... 22
Figura 16 - Esquema ilustrativo da formação de um cromossoma em anel ... 23
Figura 17 - Ideogramas do cromossoma X e do cromossoma Y. PAR1 e PAR2; a localização do gene X-inactive-specific transcript (XIST) no cromossoma X, dos genes SRY e AZF e das regiões específica do homem e hetrocromática no cromossoma Y ... 24
LISTA DE GRÁFICOS
Página
Gráfico 1 - Distribuição do número total de amostras selecionadas para o
estudo com evidência do número (preto) e percentagem (azul) de resultados
normais e anormais ... 45
Gráfico 2 - Distribuição do número total de casos desde 1981 a 2011 e a
respetiva percentagem de casos anormais. ... 45
Gráfico 3 - Distribuição do número de amostras com resultados anormais por
SIGLAS E ABREVIATURAS µg – microgramas 2n – diploide 2n+1 – trissomia 2n-1 – monossomia 3n – triploide 4n – tetraploide
aCGH – “arrays” de hibridação genómica comparativa adapt – adaptado
add – material extra
AgNor – região organizadora do nucléolo com nitrato de prata AT – Adenina Timina
BAR – Bandas de Alta Resolução
CBG – Bandas C, por Hidróxido de bário usando Giemsa
CEQA – programa europeu de controlo de qualidade citogenética, Cytogenetic European Quality Assessment
CGH – hibridação genómica comparativa
CGMJM – Centro de Genética Médica Doutor Jacinto de Magalhães cm – centímetros
Coord. – coordenação
DA/DAPI – Distamicina A e 4,6-diamino-2-fenilindol del – deleção
DNA – Ácido desoxirribonucleico DPN – diagnóstico pré-natal
DSS – região sensível à dosagem para reversão de sexo dup – duplicação
Ed/ed – edição
EN – Norma europeia
et al. – et alii
Fig – figura
FISH – Hibridização in situ com fluorescência, Fluorescense in situ Hibridisation FIV – fertilização in vitro
FSH – hormona folículo estimulante GAP 1 – fase G1
GAP 2 – fase G2
GTL – Bandas G, usando tripsina e corante Leishman i – isocromossoma
i.e. – id est
idic – isocicêntrico
INSA – Instituto Nacional de Saúde Doutor Ricardo Jorge inv – inversão
IP – instituto público
ISCN – Sistema internacional da nomenclatura citogenética humana ISH – Hibridização in situ
KCl – Cloreto de potássio mar – marcador Mb – Megabases mL – mililitro mos – mosaico n – haploide n.º/N.º – número/Número
NGS – sequenciação de próxima geração, next-generation sequencing NOR – Região organizadora do nucléolo
NP – norma portuguesa ºC – graus Celsius p – braço curto
PAR – região pseudoautossómica
PAR1 – região pseudoautossómica do braço curto PAR2 – região pseudoautossómica do braço longo PMA – procriação medicamente assistida
pp. – páginas q – braço longo
QI – Quociente de inteligência r – anel
RHG – Bandas R usando calor e corante Giemsa RNA – Ácido ribonucleico
S – fase de síntese t – translocação
THS – tratamento hormonal de substituição U – unidades
UK NEQAS – programa externo de controlo de qualidade de serviços do Reino Unido, United Kingdom National External Quality Assessment Service
UV – ultavioleta Vol. – volume
WCP – sonda de pintura cromossómica total
WHO – Organização Mundial de Saúde, World Health Organization Xp – braço curto do cromossoma X
I. Introdução
1. A Citogenética
A citogenética é o ramo da Biologia que estuda o material genético a nível celular, analisando o número, a estrutura, as alterações e as patologias associadas aos cromossomas (Lawce e Brown, 1997). A palavra “cromossoma” é de origem grega, resultando da junção das palavras “khroma”, que significa cor e “soma”, que significa corpo. São assim denominados porque, nas primeiras experiências laboratoriais nos finais do século XIX, os cientistas verificaram que estas estruturas podiam ser facilmente coradas permitindo a sua visualização.
1.1. Historial da Citogenética Humana
Os cromossomas humanos foram observados pela primeira vez em 1882 pelo citologista austríaco Walther Flemmig (Gersen, 2005) e, em 1888, o alemão Wilhelm Waldeyer propôs a utilização do termo “cromossoma” (Fig. 1) (Zacharias, 2001).
Fig. 1 - Texto em que Wilhelm Waldeyer propôs a designação de cromossoma (Zacharias, 2001, adapt.)
Nessa altura ainda não era possível a cultura de células de mamíferos, nem tão pouco a obtenção de preparações com qualidade que permitisse uma contagem reprodutível do número de cromossomas. O material de estudo era proveniente de biópsias (i.e. testiculares), tecidos ou amostras maceradas de células tumorais e, por este motivo, não era de estranhar que o número de cromossomas humanos descritos em diversas publicações fosse contraditório. A título de exemplo, em 1912, Von Winiwarter
descreveu um número diferente de cromossomas no homem (n=47) e na mulher (n=48) (Ferguson-Smith, 2008) e, em 1923, Painter publicou vários artigos que descreviam como sendo 48 o número de cromossomas da espécie humana e propondo a existência dos cromossomas sexuais X e Y (Gersen, 2005). Este número foi aceite durante as três décadas seguintes, visto não haver à época tecnologia capaz de refutar esta teoria (Smeets, 2004).
No início da década de 50 do século XX, foram feitas importantes melhorias no âmbito das culturas celulares, que culminaram com a determinação do número correto de cromossomas para a nossa espécie. O problema da obtenção de lâminas com um bom espalhamento cromossómico, que permitisse uma fácil contagem, foi resolvido por Hsu em 1952, quando descreveu o chamado “choque hipotónico” (Ferguson-Smith, 2008). Outra importante descoberta foi a adição de colchicina às culturas celulares, com o objetivo de destruir o fuso acromático, parando a divisão celular em metafase e, assim, aumentar o número de células para análise. Combinando estas últimas descobertas, Tjio e Levan, em 1956, conseguiram obter preparações de células embrionárias com boa qualidade, o que lhes permitiu observar claramente os cromossomas humanos e esclarecer que estes eram apenas 46 e não 48, como se pensava até então (Fig. 2a). Também nesse ano, Ford e Hamerton confirmaram a presença constante de 46 cromossomas nas células somáticas testiculares (Gilgenkrantz e Rivera, 2003), permitindo que, três anos mais tarde, surgisse a primeira possibilidade de aplicação médica deste tipo de conhecimento. Em janeiro de 1959, Jérôme Lejeune publicou um artigo que descreve a presença de um cromossoma 21 extra no Síndrome de Down (Lejeune, Gautier e Turpin, 1959). Nesse ano e no seguinte, outras anomalias cromossómicas numéricas foram relatadas, nomeadamente: 45,X no Síndrome de Turner; 47,XXY no Síndrome de Klinefelter; trissomia 13 no Síndrome de Patau; e trissomia 18 no Síndrome de Edwards (Gilgenkrantz e Rivera 2003).
Em 1960, Moorehead e colaboradores descreveram um método de cultura e manipulação de linfócitos de sangue periférico usando a fitohemaglutinina (descoberta nesse ano por Nowell, que a usou para estimular a divisão destas células), a colchicina, o choque hipotónico, a solução fixadora de 3:1 (metanol:ácido acético) e, por fim, a coloração com giemsa, que possibilitou a análise dos cromossomas humanos com muito menos artefactos do que até então (Rooney, 2001).
Em 1966, Steele e Breg publicaram um artigo no qual explicaram que células de líquido amniótico cultivadas podiam ser utilizadas para determinar a constituição cromossómica do feto (Smeets, 2004), mas só em 1969 é que a amniocentese (colheita de líquido amniótico, habitualmente entre as 15 e as 17 semanas de gestação) passou a ser utilizada clinicamente para este tipo de diagnóstico (Wieacker e Steinhard, 2010; Trask, 2002). Iniciou-se assim a citogenética em diagnóstico pré-natal.
Fig. 2 - a) Imagem que estabeleceu 46 como o número de cromossomas da espécie humana (Trask, 2002, adapt.); b) Cariograma após coloração com corante giemsa (sg Smeets, 2004, adapt.)
Nesta altura, todos os estudos citogenéticos eram realizados em cromossomas apenas fortemente corados que, apesar de apresentarem poucos detalhes, podiam já ser agrupados em 7 grupos diferentes (A, B, C, D, E, F, G), com base no seu tamanho e localização do centrómero (Fig. 2b). Este agrupamento possibilitou uma contagem mais fácil dos cromossomas, embora não permitisse uma identificação individual inequívoca nem a deteção da maioria das alterações estruturais até que, em 1968, Torbjorn Casperson et al. publicaram as primeiras imagens de cromossomas de plantas com bandas coradas com mostarda de quinacrina (bandas QFQ). Esta técnica de coloração fluorescente permitia a diferenciação dos cromossomas recorrendo a um microscópio de fluorescência. Estes estudos foram rapidamente alargados aos cromossomas humanos e, em 1970, estes mesmos investigadores publicaram a imagem do primeiro cariótipo humano bandeado, permitindo o reconhecimento individual de cada cromossoma e uma clara distinção entre os vários pares de cromossomas (Trask 2002). Contudo, esta técnica tinha como limitação o facto de a fluorescência diminuir rapidamente de intensidade, o que a tornava pouco apropriada para estudos de rotina em pacientes nos quais se punha a hipótese de existirem alterações estruturais.
Desde então várias outras técnicas de bandeamento foram sendo desenvolvidas, como o tratamento com tripsina seguido de coloração com o corante Giemsa ou Leishman (bandas GTG e GTL, respetivamente), o bandeamento reverso (bandas RHG), a coloração da heterocromatina constitutiva (bandas CBG) e a coloração das regiões organizadoras do nucléolo (coloração AgNor), tendo cada uma delas propriedades e aplicações específicas (Fig. 3). Para estudos de rotina, as técnicas de bandeamento GTG ou GTL tornaram-se as mais usadas nos laboratórios de citogenética de todo o mundo.
Fig. 3 - Exemplos de várias técnicas utilizadas em citogenética convencional. (a) Bandas QFQ, (b) bandas GTL, (c) bandas CBG, (d) coloração AgNor.
A implementação destas técnicas, juntamente com a facilidade de cultura de linfócitos a partir de uma amostra de poucos mililitros de sangue periférico, levou a um aumento significativo no número de estudos citogenéticos realizados por rotina e permitiu a deteção e caracterização de muitas mais anomalias citogenéticas, embora os cromossomas apresentassem ainda um padrão com um número reduzido de bandas (aproximadamente 500 por conjunto haploide).
Em 1979, esta situação foi melhorada por Yunis, que desenvolveu as chamadas bandas G de alta resolução (BAR); com a sincronização das culturas de linfócitos obteve também um maior número de células em profase e prometafase, conseguindo cromossomas mais distendidos e, consequentemente, um padrão de bandeamento mais detalhado, o que permitiu aumentar a resolução de 500 para mais de 850 bandas (Fig. 4) (Smeets, 2004). Com a aplicação desta metodologia, vários síndromes clínicos
já conhecidos (i.e. Síndrome de Williams e Síndrome de Smith-Magenis) puderam ser relacionados com pequenas alterações cromossómicas, surgindo então a designação de “Síndrome de Microdeleção”.
Fig. 4 - Cariograma com bandas GTL de alta resolução
Apesar do desenvolvimento das técnicas de bandas G e BAR, em vários pacientes com claros sinais clínicos de um dos síndromes acima mencionados, não se conseguia visualizar, a nível citogenético, nenhuma alteração cromossómica. Foi por isso importante a introdução de uma técnica completamente nova no campo da citogenética clínica, que inicialmente utilizava sondas marcadas com isótopos radioactivos denominada ISH (In Situ Hybridization) (Rudkin e Stollar, 1977). Em 1977 esta técnica foi descrita pela primeira vez utilizando sondas marcadas com fluorocromos – Fluorescense In Situ Hybridization (FISH)(Fig. 5), tendo no início aplicação apenas em laboratórios de investigação (Speicher e Carter, 2005).
No início da década de 90 do século XX a FISH tornou-se disponível para a aplicação clínica em análises citogenéticas de rotina, sendo de grande utilidade em várias situações, como: o esclarecimento de alterações complexas; a deteção de rearranjos ou alterações crípticas (visíveis apenas a nível submicroscópico); em estudos de células cultivadas em interfase, ou mesmo sem necessidade de haver cultura prévia, tornando-se assim um importante complemento da citogenética convencional. Os novos métodos de FISH incluem sondas de pintura cromossómica total, de sequência única, e específicas para as regiões centroméricas. Uma vez que para a realização desta técnica é necessário um longo período de hibridação da sonda com o DNA alvo, à qual se segue a observação ao microscópio de fluorescência, estes estudos foram sempre demorados e difíceis de automatizar. Por este motivo, com frequência, era apenas aplicado um número limitado de sondas por paciente, o que mostrava ser necessário o desenvolvimento de novas tecnologias que colmatassem esta lacuna. Assim, foi desenvolvido um array baseado na hibridização genómica comparativa (CGH). Na CGH, DNA do doente e DNA controlo, marcados com diferentes fluorocromos, são hibridados em simultâneo com cromossomas metafásicos normais e regiões de perda ou de ganho de sequências de DNA (deleções ou duplicações) são visualizadas como alterações no rácio de intensidades dos dois fluorocromos, ao longo do cromossoma em que existem essas alterações (Kallioniemi et al,1992).
Fig. 6 - Diagrama esquematizando a técnica de microarrays baseados na hibridação genómica comparativa (aCGH) (Gardner e Sutherland, 2012, adapt.)
Como esquematizado na Fig. 6, a técnica de arrayCGH (aCGH) pode ser encarada como uma FISH reversa em larga escala. Em vez de hibridar uma sonda marcada com o respetivo cromossoma numa lâmina, podemos agora colocar milhares de sondas diferentes, e bem caracterizadas, numa única lâmina de vidro. Em seguida, o DNA do paciente em estudo, isolado e fragmentado, é marcado com um determinado fluorocromo (i.e. verde) e misturado com exatamente a mesma quantidade de DNA de um controlo normal marcado com um fluorocromo diferente (i.e. vermelho). Esta mistura é então hibridada com as sondas desnaturadas da lâmina. Após vários passos de lavagens, o padrão fluorescente de cada ponto pode ser analisado, sendo medido o rácio de intensidades do DNA a analisar (paciente) e do de referência (controlo) (Pinkel, Segraves e Sudar, 1998). Uma das grandes vantagens desta nova técnica reside na possibilidade de automatização de grande parte dos procedimentos e do aumento significativo de sondas que se podem utilizar por análise. Recomenda-se que nos casos anormais se realizem os mesmos estudos nos pais, já que muitas das deleções e duplicações encontradas podem ser polimorfismos, ou seja, alterações sem significado clínico. Estas tecnologias vão permitir também perceber muito mais sobre as alterações dentro do genoma humano (Smeets, 2004). Atualmente, o aCGH já está disponível em diversos estudos de rotina, permitindo diagnósticos clínicos cada vez mais precisos, inclusivamente em diagnósticos genéticos pré-implantacionais (Oliva Teles, 2011; Belengeanu et al, 2012; Ledig et al, 2012; Lott, Gabriel e Gencik, 2012).
2. Estudos Cromossómicos Convencionais
2.1. Os Cromossomas Humanos e a sua Estrutura
Os cromossomas podem ser definidos como estruturas filamentosas compostas pelo ácido desoxirribonucleico (DNA), com proteínas associadas (na sua maioria histonas) que estão localizados no núcleo das células eucariotas. A molécula de DNA é a base da hereditariedade e, em última análise, influencia todos os aspetos da estrutura e do funcionamento do corpo humano (Keagle, 2005). Os genes são as unidades funcionais da informação genética e estão localizados em cada um dos 23 pares de cromossomas da espécie humana. Estas unidades são sequências lineares de bases azotadas (adenina, timina, citosina e guanina) que codificam as proteínas necessárias ao correto funcionamento celular. A informação genética contida nos cromossomas é copiada e distribuída às novas células originadas durante a divisão celular (Turnpenny e Ellard, 2012).
Durante a divisão celular (mitose ou meiose) e na interfase que, em conjunto, formam o ciclo celular, verifica-se uma grande variabilidade na conformação e no grau de compactação dos cromossomas. Durante a interfase, que constitui a maior parte do ciclo e que é formada pelos períodos denominados por gap1 (G1), síntese (S) e gap 2 (G2), os cromossomas não são visíveis ao microscópio ótico, uma vez que estão extremamente finos e descondensados. Nesta fase as células sintetizam proteínas (em G1) e DNA (em S) preparando-se (em G2) para o processo de divisão subsequente. A mitose é o processo de divisão das células somáticas e origina duas células filhas idênticas, cada uma das quais com uma constituição cromossómica igual à célula que lhe deu origem. É durante a metafase, uma das cinco fases da mitose, que inclui também profase, anafase, telofase e citocinese, que os cromossomas apresentam o grau de compactação necessário à sua visualização e identificação ao microscópio, possibilitando o estudo citogenético.
Os 46 cromossomas de uma célula somática humana normal são agrupados em 23 pares, sendo que 44 são denominados por autossomas e dois por cromossomas sexuais (heterossomas). Para cada indivíduo, um conjunto de 23 cromossomas é herdado da mãe e o outro é herdado do pai (Regateiro, 2004). Os autossomas são os pares 1 a 22 e têm a mesma morfologia em ambos os sexos, enquanto os
heterossomas são diferentes de acordo com o sexo: no sexo feminino as células possuem um par de cromossomas X, enquanto no sexo masculino possuem um cromossoma X e um cromossoma Y. Um conjunto de cromossomas homólogos (um de cada autossoma e um sexual) é denominado de haploide. O número haploide (n) é 23 e apenas está presente nas células gaméticas (oocito e espermatozoide). As restantes células do corpo humano são constituídas por dois conjuntos haploides (2n) e, por isso denominadas células diploides, com 46 cromossomas (Wilson, 2000; Pierce, 2005).
Um cromossoma é composto por dois cromatídeos irmãos, cada um dos quais formado por uma dupla hélix de DNA compactada; tem como áreas funcionalmente distintas o centrómero, os telómeros e as regiões organizadoras do nucléolo (NOR), contidas nos stalks dos acrocêntricos (Fig. 7).
Fig. 7 - Componentes estruturais e funcionais dos cromossomas metafásicos (Keagle, 2005, adapt.)
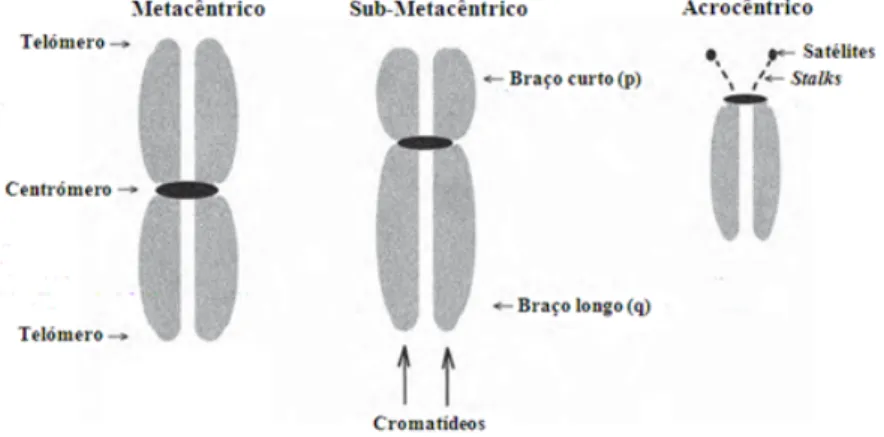
O centrómero é uma constrição que une os dois cromatídeos e é visível nos cromossomas em metafase. Esta estrutura é essencial à sobrevivência dos cromossomas durante a divisão celular, uma vez que é através dele que os cromossomas se ligam ao fuso acromático. Por convenção e para facilitar a sua identificação, os cromossomas humanos são agrupados com base na localização do centrómero: metacêntricos, em que o centrómero está localizado no meio do cromossoma ou muito perto; submetacêntricos, em que o centrómero está localizado entre o meio e a extremidade; e acrocêntricos, em que o centrómero está localizado na extremidade (Fig. 7).
Os telómeros são as regiões terminais dos cromossomas. Proteínas não histonas ligam-se ao DNA telomérico de modo a proteger essas extremidades da ação das nucleases (enzimas que degradam as ligações entre os nucleotídeos) (Regateiro,
2004). As regiões teloméricas desempenham também um importante papel nas sinapses durante a meiose e o emparelhamento cromossómico parece iniciar-se nestas regiões. O tamanho dos telómeros diminui gradualmente com o envelhecimento e com o aumento do número de divisões celulares em cultura (Keagle, 2005).
Os stalks dos satélites existentes nos braços curtos dos cromossomas acrocêntricos contêm as regiões NOR, uma vez que é aqui que se formam os nucléolos quando as células se encontram em interfase. Nestas regiões localizam-se os genes responsáveis pela produção do RNA ribossomal (Keagle, 2005).
2.2. Cultura de Tecidos e Obtenção de Metafases
As indicações clínicas para o estudo do cariótipo nos seres humanos podem ser várias, nomeadamente: atraso mental, alterações do desenvolvimento, infertilidade de etiologia desconhecida e anomalias múltiplas (Bricarelli et al, 2006). O pedido de um cariótipo deve especificar a razão que o determinou e ser sempre acompanhado por uma história clínica detalhada (Regateiro, 2004).
É possível realizar o estudo citogenético em células provenientes de diversos tecidos; a escolha destes depende da altura em que se faz o diagnóstico (pré ou pós-natal), do tipo de doença a investigar (constitucional ou adquirida) e das suspeitas clínicas. Para diagnóstico pré-natal podem utilizar-se os fibroblastos das vilosidades coriónicas, as células do líquido amniótico ou os linfócitos do sangue fetal, enquanto que para o diagnóstico pós-natal as células mais utilizadas são os linfócitos de sangue periférico ou os fibroblastos obtidos por biópsia da pele (Regateiro, 2004). Para este estudo são necessárias células em divisão, mais concretamente em metafase; os cromossomas metafásicos podem ser estudados em células em divisão espontânea ou estimulada. No primeiro caso, as células podem ser encontradas em tecidos como a medula óssea, as gónadas e as vilosidades coriónicas. As células cuja divisão necessita de ser estimulada antes do estudo citogenético encontram-se, por exemplo, no sangue periférico. Assim, é necessário proceder a uma cultura celular de modo a obter um número suficiente de células em mitose para analisar (Lawce e Brown, 1997). O procedimento geral para a obtenção de um cariótipo pode ser subdividido em várias
etapas, nomeadamente: sementeira, manipulação, espalhamento, bandeamento, coloração e visualização ao microscópio.
O sangue periférico é o tecido mais utilizado em diagnóstico pós-natal constitucional, visto ser de fácil colheita e envio para o laboratório, podendo obter-se ao fim de pouco tempo de cultura a quantidade suficiente de metafases necessária à realização da análise (48 horas, num caso de extrema urgência). Os leucócitos são as células alvo para os estudos citogenéticos (uma vez que são as únicas células nucleadas presentes no sangue periférico) e, dentro destes, os linfócitos T, responsáveis pela imunidade celular, são os que mais facilmente se dividem após estimulação (Freshney, 1987; Rooney, 2001).
A partir de cada amostra de sangue devem-se estabelecer pelo menos duas culturas utilizando distintos meios de cultura celular altamente enriquecidos nutricionalmente, aos quais se adiciona um agente mitogénico (fitohemaglutinina) que vai induzir a divisão dos linfócitos T, numa reação tipo antigénio/anticorpo. Se o meio não tiver antibióticos na sua constituição, estes devem ser adicionados de forma a evitar a proliferação microbiana (Penicilina/Estreptomicina 10000U/10000µg/mL, Kanamicina 1%). Assim, a cada um dos tubos devidamente identificados e contendo este meio de cultura adiciona-se a quantidade adequada da amostra. A cultura decorre numa estufa a 37ºC, durante 48 ou 72 horas.
Para se obter um maior número de metafases com cromossomas mais longos e de melhor morfologia procede-se à sincronização das culturas, recorrendo a um agente químico (metotrexato), que pára a divisão celular na transição G1/S. O metotrexato adicionado ao fim de 48 ou 72 horas de incubação interfere com a síntese do DNA, atuando por inibição competitiva com a dihidrolato redutase (enzima redutora do ácido dihidrofólico a ácido tetrahidrofólico, necessário para a síntese da timidina), inibindo a replicação celular. Ao fim de 17 horas o bloqueio é removido por lavagem e adição de timidina à cultura. A paragem da divisão celular em metafase é efetuada recorrendo à colchicina ou à colcemida, pois ambas interferem com a formação do fuso acromático: a colcemida despolimeriza os microtúbulos (Forry-Schaudiess et al, 1986) e a colchicina liga-se à tubulina, inibindo a polimerização dos microtúbulos (Cuthbert e Shay, 1983).
O passo seguinte consiste na adição de uma solução hipotónica, constituída por uma solução salina com uma concentração inferior à do citoplasma. Por osmose, a entrada de água através da membrana celular para o interior das células provoca um aumento
do volume celular, o que posteriormente vai facilitar a dispersão dos cromossomas por rebentamento das células quando se efetuar o espalhamento em lâmina. A solução hipotónica mais utilizada na rotina citogenética é de KCl, visto ser a que provoca menos danos na estrutura cromossómica.
Em seguida promove-se a fixação das células, com o objetivo de remover a água e fragilizar as membranas celulares, bem como de preservar a morfologia dos cromossomas. Para a fixação usa-se uma mistura extemporânea de metanol/ácido acético na proporção 3:1. Depois de fixadas, as células podem ser armazenadas durante meses à temperatura de 4ºC.
O espalhamento é um passo fundamental na obtenção de um bom material de estudo citogenético, sendo a sua qualidade influenciada por fatores como a porosidade e lavagem das lâminas (limpas e isentas de gordura), a concentração da suspensão celular e o tempo de secagem das gotas na lâmina em função da temperatura e da humidade no ambiente. Este passo consiste na aplicação de uma gota da suspensão de linfócitos fixados sobre uma lâmina, de modo que as células rebentem e os cromossomas dispersem o suficiente para permitir a sua individualização, identificação e análise. As lâminas assim preparadas são colocadas numa estufa a 60ºC ou a 90ºC para desidratar os cromossomas, o que vai favorecer a obtenção de um padrão de bandas mais nítido e contrastado, após a aplicação das técnicas de bandeamento e de coloração e, consequentemente, facilitar a análise microscópica das metafases obtidas. Segundo critérios internacionalmente aceites, em citogenética pós-natal são analisadas pelo menos 5 metafases de duas culturas independentes e contados os cromossomas em outras 15, perfazendo um total de pelo menos 20 metafases vistas. Quando se suspeita de uma anomalia numérica o estudo deve ser alargado até às 30 ou 50 metafases, de modo a excluir um possível mosaicismo nesse tecido. Este estudo alargado é também efetuado se, durante uma análise de rotina, se encontra uma anomalia numérica ou estrutural numa das metafases analisadas (Verma e Babu, 1995; Hastings et al, 2012).
2.3. Técnicas de Bandeamento e de Coloração
Os métodos citogenéticos convencionais permitem detetar alterações cromossómicas numéricas e estruturais quando estas estão acima do limiar de resolução da microscopia ótica e impliquem modificações visíveis nos cromossomas (Regateiro, 2004). Define-se como banda um segmento cromossómico que se visualiza de escuro ou de claro de acordo com a técnica de coloração utilizada (ISCN, 2009). Assim, as bandas permitem visualizar os cromossomas metafásicos de acordo com uma sequência específica de segmentos de diferente coloração, conduzindo à sua identificação precisa. O número de bandas observadas depende do estado de condensação dos cromossomas, podendo este número variar entre as 450-550 bandas em cromossomas metafásicos e as 800-850 bandas nos cromossomas prometafásicos. Estes últimos, devido à sua menor condensação com consequente aumento do número de bandas, permitem a obtenção de cariótipos com bandas G e BAR.
As técnicas de bandeamento e de coloração têm como objetivo a revelação destes segmentos nos cromossomas e podem ser divididas em dois grandes grupos:
¾ Técnicas básicas – permitem a obtenção de um padrão de bandas ao longo do cromossoma. Neste tipo de técnicas estão incluídas as bandas GTG ou GTL, as bandas QFQ e as bandas RHG.
¾ Técnicas seletivas – coram apenas regiões específicas de alguns ou da totalidade dos cromossomas, originando um número restrito de bandas. Neste tipo de técnicas estão incluídas as bandas CBG, a coloração das regiões organizadoras dos nucléolos com nitrato de prata (AgNOR) e a coloração com distamicina e 4,6-diamino-2-fenilindol (DA/DAPI).
2.3.1. Bandas GTG/GTL (bandas G, usando Tripsina e corante
Giemsa ou Leishman, respetivamente)
Atualmente esta técnica de bandeamento é a mais utilizada nos laboratórios de citogenética; baseia-se na utilização de uma enzima proteolítica – tripsina – que degrada certas histonas (ricas em arginina) localizadas em regiões específicas, de que resulta, após coloração, um conjunto de bandas alternadamente escuras e claras ao longo dos cromossomas. As bandas escuras, que coram intensamente com o corante Giemsa ou Leishman (G positivas), são mais ricas em adenina-timina, replicam mais tarde e aparentemente contêm poucos genes, enquanto as bandas claras (G
negativas) são ricas em citosina-guanina, replicam mais cedo e contêm a maioria dos genes (ISCN, 2009). Cada cromossoma tem um padrão de bandas específico que permite a sua identificação (Rooney, 2001; Regateiro, 2004). As bandas GTG/GTL atingem uma resolução máxima de cerca de 850 bandas em cromossomas prometafásicos. Os corantes utilizados têm um cariz permanente, o que facilita a análise microscópia das metafases em qualquer momento – por exemplo, caso seja necessária uma reavaliação do caso, constituindo uma vantagem relativamente às bandas QFQ.
2.3.2. Bandas QFQ (bandas Q, por Fluorescência e coloração
Quinacrina)
Esta técnica de bandeamento foi a primeira a ser utilizada nos laboratórios de citogenética e permite a caracterização dos cromossomas através da microscopia de fluorescência, após coloração com mostarda de quinacrina. À semelhança do que acontece nas bandas G, o padrão de bandas obtido é também característico de cada cromossoma e a intensidade de fluorescência corresponde à riqueza em ligações adenina-timina (AT) (Regateiro, 2004). A região distal do braço longo do cromossoma Y é extremamente fluorescente, sendo a mais intensa de todos os cromossomas. As regiões pericêntricas dos cromossomas 3 e 4 e os satélites dos acrocêntricos podem apresentar variações de intensidade, quer entre os homólogos, quer entre diferentes indivíduos (Verma e Babu, 1995). Atualmente esta técnica de bandeamento é utilizada para o esclarecimento de situações duvidosas relacionadas com o braço longo do cromossoma Y e em situações de existência de cromossomas supranumerários não identificados (marcadores), para despistar a possibilidade de terem origem no cromossoma 15. Uma vez que a fluorescência associada a esta técnica se perde rapidamente com a exposição à luz UV, a análise deve ser efetuada de imediato e deve recorrer-se à fotografia para registo das imagens observadas ao microscópio de fluorescência (Rooney, 2001).
2.3.3. Bandas RHG (Bandas R usando calor e corante Giemsa)
Estas bandas são obtidas por desnaturação a altas temperaturas em diferentes tampões, seguida de coloração com Giemsa (Rooney, 2001). As bandas resultantes são inversas das obtidas pelas duas técnicas anteriores e, de acordo com as publicações existentes, são utilizadas principalmente em laboratórios de citogenética
da escola francófona; têm como principal vantagem o facto das regiões teloméricas da maioria dos cromossomas corarem de escuro, tornando-se assim mais visíveis.
2.3.4. Bandas CBG (bandas C usando hidróxido de Bário e
corante Giemsa)
Este tipo de bandeamento consiste na degradação do DNA com ácido clorídrico seguida de desnaturação com uma solução alcalina de hidróxido de bário. O tratamento subsequente com uma solução salina de citrato de sódio a 60ºC tem como objetivo a remoção de toda a eucromatina, ficando apenas na lâmina as regiões de DNA altamente repetitivo: o DNA centromérico dos diferentes cromossomas e a heterocromatina pericentromérica dos cromossomas 1, 9, 16 e a região distal do braço longo do cromossoma Y (Rooney, 2001; Regateiro, 2004), que posteriormente é corado com Giemsa.
2.3.5. Coloração AgNOR (Coloração com nitrato de prata das
regiões organizadoras dos nucléolos)
Com esta técnica é possível identificar as regiões organizadoras do nucléolo. Estas regiões cromossómicas específicas são responsáveis pela formação e manutenção do nucléolo nos núcleos interfásicos, estão localizadas nos stalks dos cinco pares de cromossomas acrocêntricos e contêm os genes que codificam para o RNA ribossomal (Rooney, 2001). Quando a síntese desse RNA está ativa, estas regiões podem ser diferencialmente coradas recorrendo-se à impregnação das lâminas com nitrato de prata, devido à natureza argentafim das proteínas presentes (Regateiro, 2004). Esta coloração é aplicada quando se pretende esclarecer a presença de stalks, sendo de grande utilidade para a marcação de pequenos cromossomas marcadores com satélites com origem nos acrocêntricos (Gardner e Sutherland, 2004).
2.4. Nomenclatura Cromossómica
A nomenclatura cromossómica humana baseia-se numa série de pressupostos redigidos em várias conferências internacionais – Denver 1960, Londres 1963, Chicago 1966, Paris 1971, Paris 1975, Estocolmo 1977, Paris 1980, Memphis 1994 (ISCN, 2009). Os cromossomas são constituídos por dois braços, que se unem no
centrómero; o braço mais pequeno é designado por p (de petit) e está localizado para cima do centrómero, e o mais longo por q (por ser a letra seguinte do alfabeto) e está localizado para baixo do centrómero (Fig. 8).
Fig. 8 - Representação esquemática de um cromossoma
De acordo com as convenções internacionais (ISCN, 2009), os cromossomas são identificáveis com base no tamanho, posição do centrómero e padrão de bandas (Wilson, 2000). Os autossomas são numerados do par de maiores dimensões para o par mais pequeno, ou seja, do número 1 até ao 22 (apesar de os cromossomas 10 e 11 serem mais pequenos do que o 12 e de o cromossoma 22 ser maior do que o 21). Os braços são divididos em regiões tomando como referência o centrómero, os telómeros e as bandas caraterísticas, sendo a numeração das bandas feita sequencialmente do centrómero para o telómero, em cada um dos braços (Regateiro, 2004).
À organização dos cromossomas em pares de homólogos mediante as características anteriormente descritas dá-se o nome de cariograma, sendo a palavra cariótipo utilizada para designar a constituição cromossómica do indivíduo.
2.5. Anomalias Cromossómicas
As anomalias cromossómicas atingem cerca de 20% das gestações e a maioria destas termina em abortamentos espontâneos, o que baixa a sua frequência ao nascimento para 0,6% (Gardner e Sutherland, 2004). A frequência de alterações cromossómicas em abortamentos tardios, associada à frequência de alterações cromossómicas observadas ao nascimento representa, no seu conjunto, apenas 5% dos casos, sendo os restantes 95% resultantes de abortamentos precoces (Gardner e Sutherland, 2004).
As alterações cromossómicas podem classificar-se como constitucionais ou adquiridas, quanto à altura do seu aparecimento. Assim, as alterações cromossómicas constitucionais são as que existem já no embrião e podem ocorrer antes da fecundação, num dos gâmetas de um dos progenitores, ou pouco depois da fecundação, numa das células do embrião. No último caso, a alteração observa-se sob a forma de mosaico, ou seja, não está presente em todas as linhas celulares do indivíduo mas apenas naquelas que tiveram origem na célula onde se deu a alteração, dependendo a sua expressão (mosaico de alta ou baixa expressão) da fase do desenvolvimento embrionário em que ocorre. As alterações cromossómicas adquiridas resultam de um processo carcinogéneo, podem afetar um ou vários órgãos e ocorrem ao longo da vida do indivíduo (Gardner e Sutherland, 2004).
As alterações cromossómicas, independentemente da altura do seu surgimento, podem classificar-se como numéricas ou estruturais.
2.5.1. Alterações Cromossómicas Numéricas
Neste tipo de anomalia citogenética observa-se aumento ou diminuição do número normal de cromossomas (46 = dois conjuntos haploides) resultante da não-disjunção cromossómica ou cromatídica na meiose ou na mitose. As consequências no fenótipo vão depender do tamanho do cromossoma envolvido e do facto de ser um autossoma ou um heterossoma.
Estas alterações podem ser divididas entre poliploidias ou aneuploidias.
2.5.1.1. Poliploidias
Nas poliploidias a alteração do conjunto normal de cromossomas (2n) é um múltiplo exato do número haploide (n) (ex.: 3n–triploidia; 4n–tetraploidia). Os zigotos poliploides dão origem a situações de anasarca com placentas volumosas e são letais precocemente, na fase embrionária ou fetal. Excecionalmente, o feto pode desenvolver-se até ao período perinatal, ocorrendo a morte após alguns dias de sobrevivência (Regateiro, 2004).
2.5.1.2. Aneuploidias
Nestas anomalias há perda ou ganho de um ou mais cromossomas, mas não da totalidade do conjunto haploide (ex.: 2n-1/monossomia, 2n+1/trissomia). Cerca de 50%
dos abortamentos espontâneos são causados por aneuploidias. A aneuploidia pode resultar de não-disjunção meiótica ou mitótica, ou de anomalias na mitose, como o atraso de migração de um cromossoma para o pólo do fuso (Regateiro, 2004). As monossomias provocam alterações muito graves no desenvolvimento embrionário. Embora haja casos descritos de sobrevivência de indivíduos com monossomia 21 (apenas em mosaico), a monossomia 45,X é a única compatível com a vida, sendo responsável pelo Síndrome de Turner (Regateiro, 2004).
Estas anomalias podem envolver os autossomas – autossomopatias – ou os cromossomas sexuais – heterossomopatias. As primeiras estão geralmente associadas a alterações fenotípicas mais graves do que as segundas, sendo as mais frequentes o atraso do desenvolvimento psicomotor, as malformações congénitas múltiplas, as dismorfias várias e o atraso de crescimento pré e pós-natal. As trissomias são as aneuploidias autossómicas mais frequentes prevalecendo, por ordem decrescente de frequência, as trissomias dos cromossomas 21, 18 e 13, que originam os Síndromes de Down, Edwards e Patau, respetivamente. As heterossomopatias apresentam fenótipos menos severos do que as autossomopatias e os exemplos mais comuns são o Síndrome de Turner (45,X) e o Síndrome de Klinefelter (47,XXY); porém, podem também surgir polissomias do cromossoma X e/ou do Y, tais como 47,XXX e 47,XYY.
2.5.2. Anomalias Cromossómicas Estruturais
As alterações cromossómicas estruturais resultam da quebra ou quebras em um ou mais cromossomas, seguidas da sua reconstituição de forma anómala. Estas alterações podem ser equilibradas, se o conjunto de cromossomas possuir toda a informação genética normal mas acondicionada de modo diferente, ou desequilibradas, se o conjunto de cromossomas tiver informação genética deficitária ou excedentária. Podem também ser estáveis, se a alteração se mantiver imutável durante a divisão celular (deleções, duplicações, inversões, translocações, inserções e isocromossomas), ou instáveis (cromossomas marcadores, cromossomas dicêntricos e cromossomas em anel), se a anomalia puder sofrer alterações durante a divisão celular. Nos indivíduos fenotipicamente normais portadores de alterações estruturais equilibradas é muito importante o estudo familiar, dada a possibilidade de outros
mem motiv
2.5.
Uma se oc queb que são micro (Reg Fig. 9 adapt.2.5.
Uma mesm tipo depe Fig.10 (http:// mbros da fa vo, estarem.2.1. Dele
a deleção é correr na ex bra; ou inte ocorram do pequenas oscópio ót gateiro, 2004 - Esquema ilus ); b) terminal.2.2. Dup
a duplicação mo cromos de anoma endendo, no 0 - Esquema ilus /ghr.nlm.nih.gova
amília pode m em risco deções
a perda de xtremidade ersticial, se ois pontos d perdas c tico e dete 4). trativo da formaplicações
o é o result soma e im alia tem e o entanto, d strativo da forma v/handbook/illus erem ser ta de vir a ter d e um segm de um braç o segment de quebra ( cromossóm etáveis ap ação de uma des
tado da pre plica a exis efeitos fen da extensão ação de uma du strations/, adapt ambém por descendênc mento cromo ço, necessi to perdido (Fig. 9). Ex micas, infer penas poreleção. a) interst esença de stência de otípicos m o de materia uplicação intrac t.)
b
rtadores de cia anormal ossómico a tando apen for intermé xistem tamb riores a 4 técnicas d ticial (http://ghr. uma cópia dois ou ma menos grav al cromossó cromossómica essa anom . cêntrico. Po nas que oco édio, necess bém as mic 4x106bp, n de citogen nlm.nih.gov/han extra de u ais pontos ves do qu ómico envol alia e, porode ser ter orra um pon sitando por crodeleções não visíveis nética mole ndbook/illustrati m fragmen de quebra. ue as dele lvido (Fig. 1 r este rminal nto de r isso s, que s ao ecular ions/, to do Este eções 0).
2.5.2.3. Inversões
As inversões são anomalias cromossómicas resultantes da rutura do cromossoma por duas quebras, seguida da reintrodução nesse cromossoma, do segmento que se encontra entre elas, com rotação de 180º. Designam-se por paracêntricas, se envolverem um único braço do cromossoma e não envolverem o centrómero, ou pericêntricas, se envolverem os dois braços do cromossoma e, consequentemente, o centrómero, sendo estas últimas mais frequentes (Fig. 11). Estas anomalias provocam uma alteração na localização sequencial dos genes ao longo do cromossoma, não conduzindo geralmente a um fenótipo anormal, a não ser que ocorra, por exemplo, disrupção génica. A sua importância clínica está ligada a possíveis dificuldades de obtenção de descendência normal, uma vez que na gametogénese se podem formar três tipos de gâmetas: gâmetas normais, gâmetas com a inversão e gâmetas recombinantes com duplicações ou deleções.
Fig.11- Esquema ilustrativo da formação de uma inversão. a) paracêntrica; b) pericêntrica (http://ghr.nlm.nih.gov/handbook/illustrations/, adapt.)
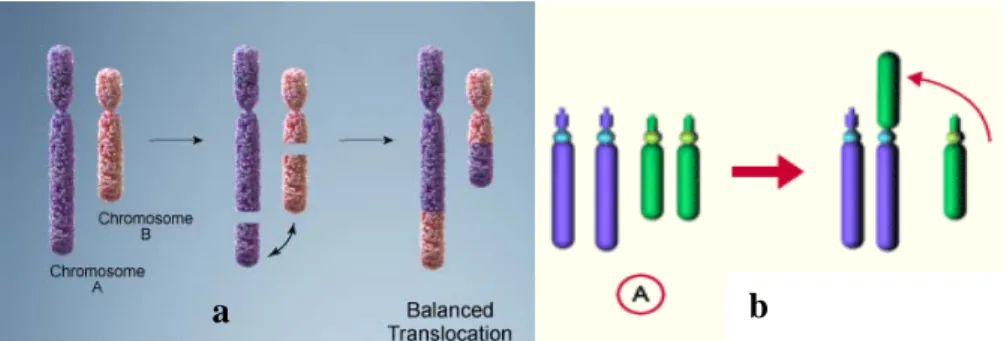
2.5.2.4. Translocações
Uma translocação pode ser definida como a transferência de parte de um cromossoma para um outro cromossoma. As translocações podem designar-se por recíprocas ou por robertsonianas. As primeiras resultam da quebra de dois cromossomas, com troca mútua de segmentos; as robertsonianas envolvem dois cromossomas acrocêntricos que se fundem na região do centrómero, com perda dos respetivos braços curtos (Fig.12).
Estas alterações cromossómicas são das mais frequentes na espécie humana e, se forem equilibradas, não provocam habitualmente um fenótipo anormal mas, à semelhança do que acontece com as inversões, podem levar à formação de gâmetas desequilibrados e, consequentemente, implicar um risco elevado de descendência anormal.
Fig. 12 - a) Esquema ilustrativo da formação de uma translocação equilibrada
(http://ghr.nlm.nih.gov/handbook/illustrations/, adapt); b) Esquema ilustrativo da formação de uma translocação robertsoniana (http://embryology.ch, adapt.)
2.5.2.5. Inserções
Uma inserção é essencialmente uma translocação não-recíproca, envolvendo três quebras cromossómicas. Um cromossoma apresenta uma deleção intersticial e o segmento deletado insere-se num local onde ocorreu uma quebra cromossómica num outro cromossoma. Estas anomalias designam-se por diretas, se o fragmento inserido mantiver a mesma orientação relativamente ao centrómero que tinha no cromossoma original, ou por invertidas, se o fragmento inserido se colocar no cromossoma que o recebe com uma orientação inversa à que tinha no cromossoma original (Fig.13).
Fig.13- Esquema ilustrativo da formação de uma inserção (http://embryology.ch, adapt.)
2.5.2.6. Isocromossomas
Os isocromossomas são cromossomas com um plano de simetria horizontal que origina uma imagem em espelho, ou seja, possuem dois braços com a mesma constituição (dois braços curto ou dois braços longos). Têm origem numa divisão celular defeituosa em que o centrómero se divide de modo errado, separando os dois braços em vez dos dois cromatídeos (Fig.14).
Fig. 14- Esquema ilustrativo da formação de um isocromossoma (http://ghr.nlm.nih.gov/handbook/illustrations/, adapt.)
2.5.2.7. Cromossomas Marcadores
A definição de cromossoma marcador tem sofrido diversas alterações ao longo da história da citogenética, sendo atualmente mais aceite a que Thomas Liehr propôs em 2006. Segundo este autor, os marcadores são “cromossomas estruturalmente anormais, com centrómero, pequenos demais para serem identificados ou caracterizados inequivocamente apenas por citogenética convencional e que, geralmente, são de tamanho igual ou inferior ao cromossoma 20 da mesma metafase” (Liehr et al, 2006). Na maioria das situações estes cromossomas observam-se sob a forma de mosaicismo, em proporções muito variáveis, por vezes consoante as amostras (i.e. sangue periférico e/ou pele).
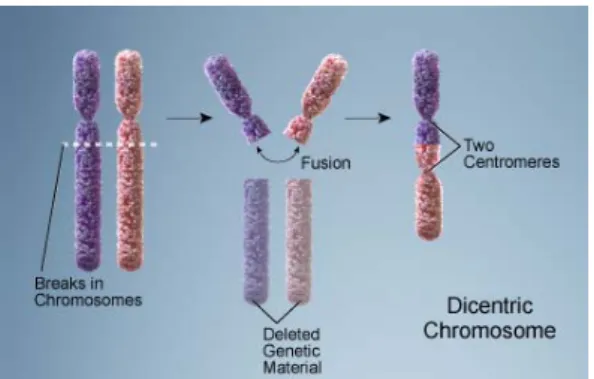
2.5.2.8. Cromossomas Dicêntricos
Os cromossomas dicêntricos apresentam, como o próprio nome indica, dois centrómeros. Resultam da fusão de dois segmentos cromossómicos, ambos com centrómero. São estruturas instáveis porque, se os dois centrómeros estiverem próximos, têm tendência a quebrar-se durante a anafase. No entanto, se um dos centrómeros estiver inativo estes cromossomas são estáveis (Fig. 15).
Fig. 15 - Esquema ilustrativo da formação de um cromossoma dicêntrico http://ghr.nlm.nih.gov/handbook/illustrations/, adapt.)
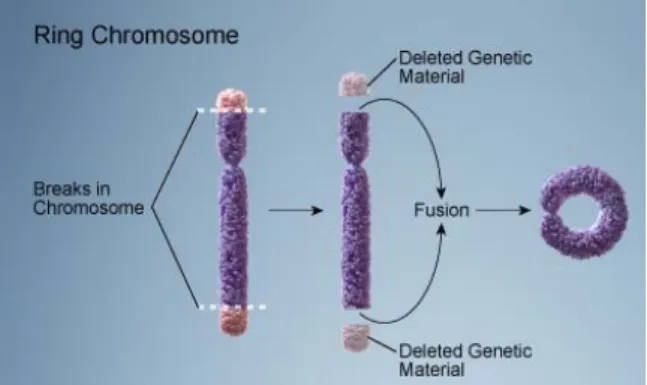
2.5.2.9. Cromossomas em Anel
Os cromossomas em anel resultam da quebra de ambas as extremidades dos braços dos cromossomas e fusão posterior dos dois topos, formando um cromossoma com forma circular (Fig. 16). O cromossoma que mantém o centrómero pode replicar-se, apesar de poder sofrer alterações na sua estrutura, como o aparecimento de anéis duplos e o desaparecimento do anel em algumas células. Se não tiver centrómero perde-se, visto os fragmentos acêntricos não serem viáveis.
Fig. 16- Esquema ilustrativo da formação de um cromossoma em anel http://ghr.nlm.nih.gov/handbook/illustrations/, adapt.)
2.6. Cromossomas Sexuais
Segundo alguns autores, o cromossoma X e o cromossoma Y constituem o par cromossómico mais importante em cada célula, dado o seu papel na determinação do género (feminino ou masculino), permitindo assim a reprodução e a procriação (Powell C 2005).
Na espécie humana, o dimorfismo sexual está associado à presença de dois cromossomas X nas mulheres e de um cromossoma X e um cromossoma Y nos homens (Morey e Avner, 2010). Os cromossomas sexuais evoluíram a partir de um autossoma ancestral nos últimos 240-320 milhões de anos (Zinn, 2005) e, durante este processo, os elementos funcionais originais foram conservados no cromossoma X, enquanto o cromossoma Y perdeu quase todas estas características, incluindo os genes que já foram outrora partilhados com o cromossoma X (Zinn, 2005; Ross et al, 2005).
Normalmente os cromossomas X e Y só recombinam entre si nas extremidades, por onde emparelham durante a meiose masculina; este emparelhamento e recombinação
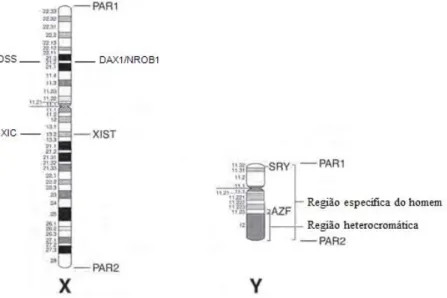
parecem ser necessários à normal segregação cromossómica. Diversos estudos realizados demonstraram que estas regiões não têm genes ligados ao sexo, daí terem sido denominadas regiões pseudoautossómicas (PAR) (Fig. 17).
Fig. 17 - Ideogramas do cromossoma X e do cromossoma Y evidenciando a localização de: regiões PAR1 e PAR2;
Centro de inativação do X (XIC), gene SHOX, gene X-inactive-specific transcript (XIST), região sensível à dosagem para reversão sexual (DSS) e genes DAX1 e NROB1 no cromossoma X, genes SHOX, SRY e AZF, regiões específica do homem e heterocromática no cromossoma Y (Powell C 2005, adapt.).
A região pseudoautossómica do braço curto expande-se por aproximadamente 2,6Mb e contém 13 genes conhecidos (Zinn, 2005). Esta região (PAR1) é reconhecida pela sua elevada taxa de crossing-over meiótica, bem como por lá estar localizado pelo menos um gene (SHOX), cuja haploinsuficiência leva à baixa estatura característica do fenótipo do Síndrome de Turner (45,X) (Ballabio, Nelson e Rozen, 2006). A região pseudoautossómica do braço longo (PAR2) tem apenas 0,4Mb e 4 genes (Zinn, 2005). Nestas regiões estão presentes genes essenciais a um desenvolvimento normal, existindo duas cópias funcionais destes genes em ambos os sexos (Pontier e Gribnau, 2011).
2.6.1. Cromossoma X
O cromossoma X tem 155 Mb de tamanho e na forma e no conteúdo é semelhante a um autossoma (Ross et al, 2005; Ross, Bentley e Tyler-Smith, 2006). Representa cerca de 5% do DNA total presente nas células
(http:///ghr.nlm.nih.gov/chromosome/X). Uma vez que diferentes investigadores
dos cromossomas, este valor pode apresentar variações. Assim, o número estimado de genes presentes no cromossoma X, que codificam uma grande variedade de proteínas e que desempenham as mais diferentes funções (catalíticas, estruturais e regulatórias) no organismo humano, é de 900 a 1.400.
O cromossoma X, único heterossoma existente nas mulheres citogeneticamente normais, tem características singulares no genoma humano, que são consequência da evolução dos cromossomas sexuais dos mamíferos. A existência de duas cópias do cromossoma X nas mulheres e apenas uma nos homens é compensada na espécie humana por um processo denominado por inativação do X.
2.6.1.1. Inativação do Cromossoma X
A inativação do X foi descrita pela primeira vez em 1961 por Mary Lyon que sugeriu que o X heterocromático poderia corresponder, em diferentes células somáticas do mesmo mamífero fêmea, quer ao cromossoma X herdado do pai, quer ao herdado da mãe, e propôs a existência de um processo que, logo no início do desenvolvimento embrionário, levaria ao completo silenciamento dos genes de um dos dois cromossomas X existentes numa constituição normal do sexo feminino (Morey e Avner, 2011). Este mecanismo permite explicar que, na prática, as mulheres tenham apenas um cromossoma X funcional por célula e, por este motivo, haja compensação da dosagem génica deste cromossoma.
Pressupondo-se que em mulheres normais a inativação do X (também designada por lyonização) acontece ao acaso, estará explicado porque, no mesmo indivíduo, o X herdado da mãe está ativo numas células e o X herdado do pai noutras. A partir daí, todas as células descendentes de uma determinada célula apresentam o mesmo cromossoma X inativo. Pensa-se que este padrão de inativação seja definido no início do desenvolvimento embrionário, iniciando-se cerca de três dias após a fertilização e esteja completo no fim da primeira semana de desenvolvimento (Powell, 2005); verifica-se ainda que é permanente nas células somáticas, sendo apenas desfeito na oogénese, onde o X inativo é reativado quando as células entram em meiose (Zinn, 2005). Os cromossomas X ativos e inativos são distinguíveis utilizando técnicas adequadas, através de uma série de características que permitem a sua identificação. O X inativo replica mais tarde (formando o corpo de Barr nos núcleos interfásicos), é mais metilado nas regiões controladoras dos genes e é reprimido transcripcionalmente (Scriver et al, 1995). Cerca de 15% dos genes do cromossoma X escapam à inativação e permanecem ativos nos dois X das mulheres, estando a sua maioria
localizada nas regiões PAR (Powell, 2005). Comparativamente, muitos mais genes escapam à inativação em Xp do que em Xq e, nos indivíduos com um cromossoma X extra, apenas um se mantém ativo. Porém, nos triplóides, encontram-se dois cromossomas X ativos, o que sugere a existência de um mecanismo de contagem levando à ativação de um X por cada conjunto de dois autossomas (Powell, 2005). Para ocorrer inativação é necessária a existência do gene XIST (X-inactive-specific transcript), localizado na banda q13 do cromossoma X, no seu centro de inativação (Fig. 17) (Pontier e Gribnau, 2011). O XIST é apenas expresso pelo cromossoma X inativo e produz uma molécula de RNA que se mantém associada a este cromossoma. Quando existe uma anomalia cromossómica num dos cromossomas X de uma mulher, tem-se verificado que o cromossoma onde a anomalia está presente tende a estar inativo. As únicas exceções são os cromossomas marcadores ou os anéis do X que não possuam o centro de inativação do X; normalmente estes doentes têm atraso mental e várias anomalias fenotípicas, que se pensa poderem representar as consequências clínicas da dissomia funcional dos genes habitualmente inativos num dos X (Scriver et al, 1995).
2.6.2. Cromossoma Y
O cromossoma Y é um dos cromossomas humanos mais pequenos, com aproximadamente 60Mb de tamanho e apenas 45 genes (www.ensemble.org). Este cromossoma divide-se em duas partes: a porção eucromática, com aproximadamente 40Mb, que codifica todos os genes do Y, e a porção heterocromática, com cerca de 20Mb, constituída apenas por sequências repetitivas, cujo tamanho pode variar substancialmente entre os homens (Zinn, 2005). Os genes que possui estão, na sua maioria, apenas presentes no sexo masculino, exprimem-se especificamente nos testículos e têm um importante papel na diferenciação sexual primária, codificando aproximadamente 60 proteínas (Ross, Bentley e Tyler-Smith, 2006). Porém, alguns dos genes do Y, localizados nas regiões PAR, são expressos noutros tecidos e são importantes em processos comuns a ambos os sexos, incluindo viabilidade, crescimento e morfogénese tecidular (Zinn, 2005).
2.6.3. Patologias dos Cromossomas Sexuais
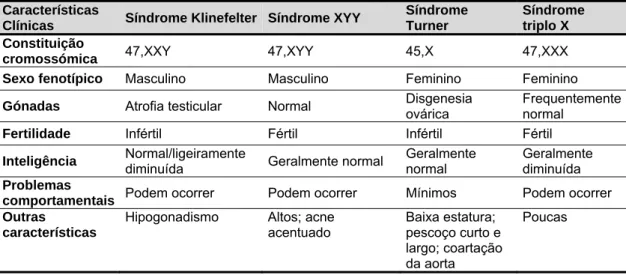
As manifestações clínicas das anomalias dos cromossomas sexuais são melhor compreendidas enfatizando alguns princípios já referidos anteriormente neste trabalho. Primeiro, os cromossomas sexuais têm funções biológicas únicas durante a gametogénese, sendo a infertilidade uma consequência frequente de anomalias nos cromossomas sexuais. Segundo, uma vez que homens e mulheres têm diferentes constituições cromossómicas sexuais, os dois géneros possuem um diferente número de cópias ou dosagem dos genes do cromossoma X; como uma diferença na expressão dos genes é, em muitos casos, suficiente para perturbar o crescimento e o desenvolvimento dos mamíferos, houve mecanismos que evoluíram para equilibrar a expressão dos genes do cromossoma X entre os dois sexos. Terceiro, o facto do cromossoma Y possuir relativamente poucos genes, a maioria dos quais específicos de funções do sexo masculino. Por fim, as patologias dos cromossomas sexuais apresentam uma extensa variabilidade genética e clínica e as entidades comuns de diagnóstico englobam uma vasta gama de anomalias cromossómicas (Zinn, 2005). Consideradas como um todo, as anomalias numéricas e estruturais dos cromossomas sexuais são as mais comuns de entre todas as alterações citogenéticas em diagnóstico pré-natal, nos recém-nascidos (Linden, Bender e Robinson, 2002), nas crianças e nos adultos (Powell, 2005). Estas patologias apresentam uma incidência aproximada de 1:250 a 1:300 em diagnóstico pré-natal, e de 1:400 em recém-nascidos (Linden, Bender e Robinson, 2002); a sua incidência é de 1:400 nos homens e de 1:650 nas mulheres (Scriver et al, 1995). As aneuploidias dos cromossomas sexuais representam aproximadamente metade de todas as anomalias cromossómicas nos humanos, com uma frequência de 1:400 recém-nascidos (WHO, 2012). De todas as anomalias dos heterossomas, as mais comuns nos recém-nascidos e nos fetos (mas raras nos abortamentos espontâneos) são os 47,XXY, 47,XXX e 47,XYY (Scriver et al, 1995). As anomalias estruturais do X são menos frequentes, sendo a mais frequente destas o isocromossoma do braço longo do X, detetado em aproximadamente 15% das mulheres com Síndrome de Turner (Scriver et al, 1995; Turnpenny e Ellard, 2012). Os fenótipos associados a alterações dos cromossomas sexuais são, em geral, menos severos do que as mesmas alterações nos autossomas (Tabela 1), devido à existência do mecanismo de inativação do X e ao baixo conteúdo em genes do Y (Powell, 2005).
Tabela 1 - Características clínicas das patologias mais frequentes dos cromossomas sexuais (Harper, 2010, adapt.) Características
Clínicas Síndrome Klinefelter Síndrome XYY
Síndrome Turner
Síndrome triplo X Constituição
cromossómica 47,XXY 47,XYY 45,X 47,XXX
Sexo fenotípico Masculino Masculino Feminino Feminino
Gónadas Atrofia testicular Normal Disgenesia ovárica Frequentemente normal
Fertilidade Infértil Fértil Infértil Fértil
Inteligência Normal/ligeiramente diminuída Geralmente normal Geralmente normal Geralmente diminuída
Problemas
comportamentais Podem ocorrer Podem ocorrer Mínimos Podem ocorrer
Outras
características
Hipogonadismo Altos; acne acentuado Baixa estatura; pescoço curto e largo; coartação da aorta Poucas