Operações Unitárias na Engenharia Química
-4.9 MECANISMO DE TRANSFERÊNCIA DE MASSA POR DIFUSÃO MOLECULAR
A transferência de um componente de uma fase para outra se dará por difusão molecular, que consiste no movimento individual das moléculas, sob a ação de um estímulo físico ("driving force"), que no caso mais comum é o gradiente de concentração deste componente nas duas fases. Ou seja o movimento do componente ocorre em uma direção de forma a equalizar as concentrações deste componente em todas as regiões. Em um processo contínuo, havendo sempre a existência deste gradiente, remove-se continuamente o componente da fase em que ocorre em maior concentração para a fase em que sua concentração é baixa.
Isto é realizado em diversos processos como a remoção de cristais de um sal por água ou em todas as operações de transferência de massa. Por exemplo na absorção gasosa onde o soluto se difunde do interior da fase gasosa para a interface com fase líquida e daí para o interior da fase líquida.
Similarmente à transferência de calor onde o fluxo de calor se dá em função de um gradiente de temperatura, na transferência de massa a difusão ocorre em função do gradiente de concentração em uma direção perpendicular a interface entre as fases. Esta transferência pode se dar para apenas um dos componentes ou para mais de um em direções opostas, em quantidades iguais ou não.
Definindo-se como N o fluxo molar total de uma fase, que se move a uma vazão Q em uma superfície S, pode-se escrever que:
N = Q / S (4.8)
Para o componente A, difundindo-se através de uma fase, por um plano estacionário de área S , tem-se:
NA = CA (Q / S) (4.9a)
Para o componente B, vem:
NB = CB (Q / S) (4.9b)
N = NA + NB (4.9c)
Considerando-se o fluxo por difusão molecular de A, movimento individual das moléculas, cuja força motriz é o gradiente de concntração do componente A nas fases, tem-se:
N
A D= −
D
dCA
dZ
AB (4.10a)
Ou seja, o fluxo por difusão molecular é proporcional ao gradiente de concentração no espaço considerado. Na equação 4.15 DAB, é o coeficiente de difusividade, do componente A em uma
mistura com B. Para o componente B pode-se escrever:
N
B D= −
D
dCB
dZ
BA (4.10b)
Nas equações acima, pode-se usar como unidade de concentração a fração molar ou no caso de gases, a pressão parcial.
C
A=
nA
=
V
PA
Operações Unitárias na Engenharia Química
-N
AD
= −
DAB
RT
dPA
dZ
(4.12)Estudando-se o caso de difusão molecular equimolar binária e considerando-se os mesmos volumes molares, os fluxos difusionais de cada componente são iguais entre si e de sentido contrário:
N
AN
D
B D
=−
∴
D
dPA
=
dZ
D
dPB
dZ
AB BA (4.13)
pa + pb = p (4.13)
dPA
dZ
dPB
dZ
= −
(4.15)D
AB=
D
BA (4.16)
Para os processos de transferência por difusão mais convecção molecular tem-se:
Na =
N
AN
DA C
+
N
A C = cA vA = cA (NA + NB / c) (4.17)
NA =
−
DAB
RT
dPA
dZ
+ ca [(NA + NB) / c] (4.18)Se a transferência for equimolar:
NA = - NB
NA =
−
DAB
RT
dPA
dZ
=−
−
DAB
RT
PA PAi
Z
(
)
(4. 19)Para transferência de um único componente: NB = 0
NA =
−
DAB
RT
dPA
dZ
+ ca [(NA ) / c] =−
−
−
DAB
RTZ
PA
PAI
ln
(
)
(
)
1
1
(4.19b)Para o caso de difusão turbulenta:
N
AD= −
ε
AB
RT
dPA
dZ
(4.20)fluxo total: na =
−
−
−
+
=
DAB
RT
dPA
dZ
AB
RT
dPA
dZ
AB
AB
RT
dPA
dZ
ε
(
ε
ε
)
Operações Unitárias na Engenharia Química
-na =
−
+
+
−
−
=
(
)
(
) (
)
(
)
ε
AB
ε
AB
ε
ε
RT
dPA
dZ
AB
AB
RTZ
PAi PA
P ml
1
(4.22)k =
(
ε
AB
ε
AB
)
RTZ
+
(1 - p)ml = (pi - pa) /ln [(1 - p) / (1 - pi)]
(4.23)
(4.24)
No caso de soluções diluídas: (1-pa) =1
Na = k (pai - pa) (4.25)
A equação 4.25 expressa a transferência de NA mols do constituinte A por unidade de
tempo, em um sistema cujas concentrações de A no gás através da área S, sejam y1 e y2 .
4.10 CÁLCULO DA ALTURA DA TORRE
O cálculo da altura de recheio de uma coluna depende da separação desejada e da taxa de transferência de massa através do recheio, envolvendo balanço material, coeficientes de transferência de massa e estimativa dos gradientes de concentração para esta transferência.
Analogamente à transferência de calor, o coeficiente de transferência de massa é expresso como um coeficiente (K), podendo-se também usar coeficientes globais ou locais.
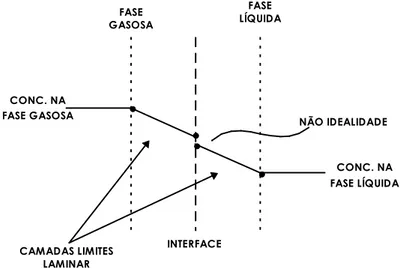
Em muitos processos de separação, a taxa de difusão do componente que se move de uma fase para outra afeta a taxa global de transferência de massa. É importante conhecer o que se passa na interface das fases para que se possa avaliar o processo de modo global. Considerando-se que na interface, devido à não idealidade do processo, esteja-se quase no equilíbrio, as concentrações aí seriam iguais quando referidas às duas fases, como pode ser visto na Figura 4.13. Na teoria proposta por Whitman, as resistências a transferência de massa nas duas fases são somadas para dar a resistência global, tal como na transferência de calor.
••••
•••• ••••••••
Figura 4.13 - Gradientes de concentrações na interface das fases.
Operações Unitárias na Engenharia Química
-transferência do soluto A na interface deve ser a mesma independente do modo de expressar a concentração, podemos considerar idealmente que os fluxos seriam os mesmos.
Assim, admite-se que haja equilíbrio na interface e as taxas de difusão de um componente do interior de uma fase para a interface é igual a taxa de difusão deste mesmo componente da interface para o interior da outra fase. Considerando-se apenas o componente A se difundindo e por isto abolindo-se o subscrito A:
Para a fase gasosa, pode-se escrever:
= ky (y - yi)
(4.28)
Para a fase líquida:
= k x(xi-x)
(4.30)
Usualmente, é possível determinar-se as concentrações do soluto A no interior das duas fases através de amostragens e análises. No entanto, a amostragem de fluidos na interface é ordinariamente impossível, pois grande parte da diferença (y - yi) se passa através de distâncias
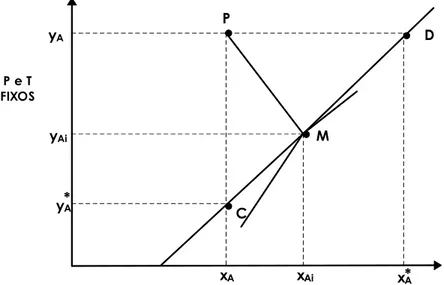
extremamente pequenas. Nestas circunstân-cias, só um efeito global, em termos de concentrações no interior das duas fases pode ser determinado. Assim, expressa-se estas concentrações através de valores fictícios, y* e x*, correspondentes àquelas que seriam obtidas se o equilíbrio fosse atingido tal como mostrado na Figura 4.14.
!
••••
" " "!
••••
••••
••••
FIGURA 4.14 - CONCENTRAÇÕES DAS FASES NA INTERFACE E NO INTERIOR DAS FASES.
Considerando-se estas concentrações fictícias, a taxa de transferência de massa será expressa em termos de coeficiente global de transferência Ky ou Kx, caso seja referido à fase gasosa
ou à líquida.
Assim, para a fase gasosa:
= Ky
(
−
)
Operações Unitárias na Engenharia Química
-onde:
Ky - coeficiente global de transferência de massa, referido à fase gasosa.
Da Figura 4.15, tira-se
(
−
)
=(
−
)
+(
−
)
=(
−
)
+ m(
−
)
(4.32)onde m é a inclinação da reta .
Pelas equações 4.29, 4.30, 4.31 e 4.32, tem-se:
= + m ∴
= +
(4.33)
(4.34)
Tal como proposto pela teoria de Whitman, a relação entre os coeficientes globais e locais se apresenta como adição de resistências.
Analogamente para a fase líquida:
= Kx
(
−
)
(4.35)
onde Kx = coeficiente global de transferência de massa, referido à fase líquida.
De onde se deduz que:
=
′
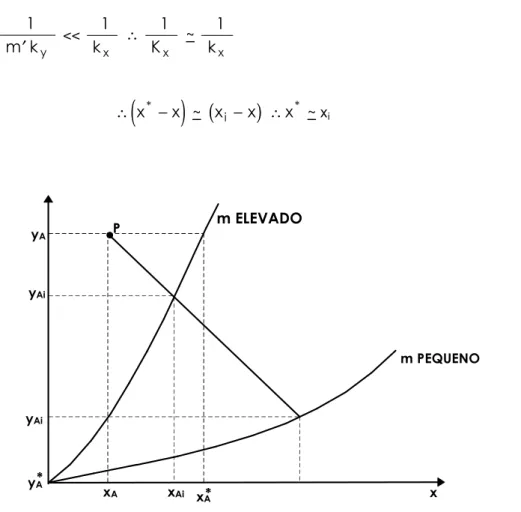
+ , m' = inclinação da reta (4.36)Analisando-se a equação 4.36 em função da solubilidade do soluto, tem-se duas situações:
• se m é pequeno, A muito solúvel no líquido, a fase gasosa é a controladora, tem-se:
<< ∴ = (4.37)
ou seja a fase controladora dp processo é a fase gasosa:
∴
(
−
)
~(
−
)
∴ ~ yi (4.38)Operações Unitárias na Engenharia Química -
#
′
<< ∴ ~ (4.39)∴
(
−
)
~(
−
)
∴ ~ xi (4.40)••••
!
" " "! "
$ %
$
FIGURA 4.15 - FASES CONTROLADORAS DO PROCESSO DE ABSORÇÃO.
Operações Unitárias na Engenharia Química
-&
'&
"
"
(
Seja:
• S a área de transferência de massa na torre;
• dz a altura da seção da torre distante do topo de um comprimento dz;
• V e L as vazões molares de gás e de líquido na seção considerada.
• dv o volume elementar da seção da torre.
dv = S dZ (4.41)
A transferência do soluto A, dentro deste volume diferencial da fase gasosa para a fase líquida pode ser descrita pela equação de balanço
FIGURA 4.16 - CÁLCULO DA
ALTURA DE
RECHEIO.
material.
d(Vy) = d(Lx)
(V e L em mol/h) (4.42)
Como taxa de redução da concentração do componente A na fase gasosa deve ser igual a taxa de aumento da concentração do componente A na fase líquida, podemos escrever:
dN . ds = d(Vy) = d(Lx) (4.43)
Vamos tratar separadamente as fases gasosa e liquida. Para a fase gasosa, considerando o coeficiente local de transferência de massa (ky):
dN . ds = d(Vy) = ky dS (y - yi) (4.44)
Como apenas A é absorvido: Vs = V(1-y) ou V = Vs/(1-y)
Considerando o termo d(Vy) da equação 4.44:
Vy = Vs
−
∴ d(Vy) = Vs d−
(4.45)d(Vy) = Vs
(
)
( )
(
)
−
−
−
=(
)
⋅
Operações Unitárias na Engenharia Química -
##
A área real de transferência na torre recheada não é de fácil medida, sendo necessário substituí-la por grandezas de mais fácil determinação. Assim ela é substituída pelo produto do volume (dv=A dz) da seção recheada pela área superficial do recheio por unidade de volume (a). Assim:
dS = adV = a A dZ (4.47)
Manipulando as equações acima, tem-se:
dN = V
−
= ky a A dZ (y - yi) (4.48)∴ dZ = .
(
−
)
(
−
)
(4.49)
∫
dZ =∫
.(
−
)
(
−
)
(4.50)A equação 4.50 representa o modelo matemático que permite a determinação da altura de recheio, levando em conta todos os princípios da transferência de massa e considerando a concentração na interface, o que já vimos não é de fácil medida.
Se multiplicar-se e dividir-se o integrando por (1-yi) ML, onde:
(1-yi)ML =
(
)
(
)
−
− −
−
−
(4.51)
Chega-se a uma expressão que pode ser manipulada, para se efetuar simplificações considerando-se casos particulares. Assim:
h =
(
)
∫
−
.(
)
(
)
(
)
−
−
−
dy (4.52)O termo V/(ky a S (1-y)ML ) é aproximadamente constante, ou seja, varia muito pouco com
y, dentro da precisão dos dados experimentais, podendo sair de dentro do sinal da integração. Então:
h =
(
−
)
.(
)
(
)
(
)
∫
−
−
−
dy (4.53)Definindo-se:
HG =
Operações Unitárias na Engenharia Química
-Altura da unidade de transferência = HTU da fase vapor
NG =
(
)
(
)
(
)
∫
−
−
−
dy = (4.55)Número de unidades de transparência da fase vapor = NTU da fase vapor
h = HG . NG (4.56)
Ou seja, expressa-se a altura em função do coeficiente local de transferência de massa referido a fase vapor, levando-se em conta a difusão nesta fase e a concentração na interface.
Equações semelhantes podem ser obtidas para a fase líquida:
h = HL . NL (4.57)
onde:
HL =
(
−
)
= altura da unidade de transferência fase líquida (4.58)NL =
(
)
(
)
(
)
∫
−
−
−
dx = número de unidade de transferência fase líquida (4.59Como já foi dito a determinação da concentração na interface é praticamente impossível, Assim, utiliza-se os coeficientes globais de transferência de massa e os gradientes de concentração são obtidos diretamente em função do interior das fases e das concentrações fictícias de equilíbrio y* ou x*. Por raciocínio análogo ao caso dos coeficientes locais, pode-se obter a expressão da altura referida aos coeficientes globais de troca de massa Ky e Kx:
h = HOG . NOG (4.60)
onde:
(
)
(
)
(
)
(
)
=
−
=
−
−
−
∫
(4.61)
(4.62)
Para a fase líquida:
h = HOL . NOL (4.63)
Operações Unitárias na Engenharia Química -
#)
HOL =
(
−
)
(4.64NOL =
(
)
(
)
(
)
∫
−
−
−
dx (4.65)Permanece ainda a restrição da determinação da integral através de métodos numéricos, uma vez que sua solução analítica ainda não é possível.
4.10.1 DETERMINAÇÃO DE NOG OU DE NOL
• Integração Gráfica
Usando as linhas de operação e de equilíbrio, escolhem-se valores arbitrários de x entre a entrada e saída, e lê-se os correspondentes valores de y da linha de operação e de y* da linha de equilíbrio e constrói-se a seguinte tabela:
x y y* (1-y) (1-y*) (1-y)ML (y-y*)
(
)
(
−
−
)
(
−
)
Plota-se o último termo na tabela versus y e calcula-se graficamente a integral.
• Simplificação da Integral
Para a maioria das situações práticas, pode-se assumir que a média aritmética pode ser usada para aproximar a média logarítmica. Assim:
(1-y)ML =
(
−
)
+ −
(
)
∴ NOG =
(
) (
)
(
)(
)
y
y
y
y
y y y
21
1
1
2 1
∫
−
−
+ −
−
*
*
dy =(
) (
)
(
)(
)
y y
y y
y
y
y y y
21
1
1
1
2 1
∫
−
+
−
+ −
−
−
*
*
*
dy ==
(
)
(
)(
)
(
(
)(
)
)
y yy y
y
y y y
y y
y y y
21
1
1
1
1
∫
−
+
−
−
−
+
−
−
−
*
*
*
*
dy ==
∫
−
+
−
=∫
−
+
−
−
(4.66)Operações Unitárias na Engenharia Química
-NOG =
∫
−
+
+
+
(4.67)Da mesma forma para a fase líquida:
NOL =
∫
−
−
−
−
(4.68)ou
NOL =
∫
−
−
+
+
(4.69)• Sistemas com Soluções Diluídas
Se a solução gasosa é diluída, o fator (1-y1)/(1-y2) tende a 1 e o 2o termo da equação tende
a zero. Ou seja:
NOG =
∫
−
+
−
−
(4.70)Considere agora que na faixa de concentrações envolvidas, ambas linhas de operação e de equilíbrio são lineares. Esta hipótese é análoga a hipótese de Cp constante em projeto de trocadores de calor.
Assim:
linha de operação: y = (x - x2) + y2 (reta)
(4.71)
linha de equilíbrio: y* = mx + n (reta)
(4.72)
y - y* =
−
x +
−
−
= qx + S (4.73)dy = dx (4.74)
Conseqüentemente:
NOG =
∫
Operações Unitárias na Engenharia Química -
#
=
⋅
+
+
=⋅
.−
−
(4.76)(
−
)
−
(
−
)
= q(
−
)
(4.77)mas
(
−
)
=(
−
)
∴
(
−
)
−
(
−
)
=⋅
(
−
)
∴
⋅
=(
)
(
)
−
−
−
−
(4.78)
NOG =
(
−
)
−
(
−
)
−
−
(4.79)
(y - y*)m.l. =
( ) (
)
−
−
−
NOG =
(
−
−
)
(4.80)Esta equação é restrita à soluções diluídas e linhas retas para linhas de operação e de equilíbrio.
4.10.2 FORMAS ALTERNATIVAS DOS COEFICIENTES DA TRANSFERÊNCIA DE MASSA
Existem diversas alternativas para se expressar os coeficientes de transferência de matéria, em função das unidades de vazão e de concentração utilizadas. Assim, s seguintes relações são válidas:
kG = ky/ P e kG = ky/ P (4.81)
kL = kx/ ρM e kG = ky/ ρm (4.82)
As unidades destes coeficientes seriam, por exemplo:
[kG] e ]kG] : mol/ft3 . h . atm (4.81)
[kL] e [kL] : mol/ft3 . h . (mol/ft3) ou h-1 (4.82)
Operações Unitárias na Engenharia Química
-HOG =
(
)
⋅ ⋅ ⋅
(4.83)
HOG =
ρ
⋅ ⋅
(4.84
Exercícios de Absorção
4.1 Quais são as vantagens e desvantagens de se utilizar recheios randômicos ou estruturados? Qual é o tipo mais comum de recheios? Exemplifique.
4.2 Porque são utilizados os suportes e distribuidores de líquido? Como reduzir o fenômeno da canalização?
4.3 Porque é desejável operar-se uma torre de absorção abaixo do ponto de carga ("loading point")? O que é inundação?
4.4 Explique os casos em que a fase controladora do processo e: a) a fase líquida;
b) a fase gasosa.
4.5 Deseja-se remover 95% do amoníaco presente em um mistura ar-amoníaco contendo 40% em volume de amoníaco, utilizando-se água como líquido absorvente. A pressão é de 1 atmosfera e temperatura de 20oC.
Operações Unitárias na Engenharia Química -
#
a) a quantidade mínima de água;
b) o número de estágios teóricas necessários se a quantidade de água emprega é 60% superior a mínima;
c) a concentração da solução líquida na saída expressa em % em peso.
Considerar a mistura gasosa como gás ideal.
4.6 Deseja-se recuperar amônia presente em uma mistura com o ar contendo 22% em volume de amônia e vazão de 250 m 3 / h, utilizando água contendo 0,01% em mol de amônia como líquido absorvente na pressão de 790 mm de HG e temperatura de 20oC.
Deseja-se absorver 96% da amônia da mistura, e a fração molar do líquido na saída será de 0,1 (amônia).
Calcular as quantidades de solvente, água, amônia absorvida e concentrações na saída.
Considerar a mistura gasosa como gás ideal.
4.7 Deseja-se purificar uma mistura que contém 99% de ar e 1% de CO 2 , com água pura a 20 oC e a
uma atmosfera, em uma torre recheada com selas tipo Berl de cerâmica de 1,5 polegadas. A velocidade de gás é de 566 m/h e a razão da velocidade de gás para a de líquido é de 0,2 em massa.
Calcular:
a) a velocidade de inundação;
b) o diâmetro da torre, para uma velocidade operacional igual a metade daquela de inundação;
c) verificar a possibilidade de ocorrer canalização;
d) o mesmo para o molhamento do recheio;
e) a perda de carga da torre se a altura de recheio é de 7,5 m.
Operações Unitárias na Engenharia Química -)*+
, %
-*+ .
%
/ %
%
/ , &
% 0/
1 )*+
-*+
/
Absorvedor : − P = 800 mmHg , T = 80oF
− Vazão do gás = 30.000 ft3/h, comp. soluto = 2% volume
− Soluto: praticamente benzeno, remoção desejada: 95%
− Solvente: óleo de lavagem contendo 0,5% mol de benzeno e PM média de 260
− Vazão de solvente: 1.5 vezes a mínima
− Solução solvente - benzeno ~ ideal
Retificador: − P = 1 atm , T = 250oF
− Vazão de vapor d'água: 1.5 vezes a mínima
Calcular a vazão do óleo de lavagem e do vapor d'água. Considerar que o gás se comporte idealmente.
Considerar que relação de equilíbrio seja dada por:
y* = 0,125 x (y e x fração molar) ou por
+
= 0,125+
(y, x razão molar)Sugestão: Calcular primeiramente a vazão mínima de óleo de lavagem no absorvedor, em seguida a vazão operacional, passar para o retificador calculando sua vazão mínima.
Observação: Lembrar que no retificador o óleo de lavagem sairá com 0,5 mol% de benzeno (condição de entrada do absorvedor).
4.9 Determinar a altura da torre para o exercício 4.6.
Operações Unitárias na Engenharia Química
-2 -* 3+
2 - $$45 !"!#$#### ! %! & %!
!"!#$###' #! %! & %! ( )
( ) *
*
!"!#$###+&,! %! & %!
-!"!#$##,&.#! %! & %!
-O coeficiente global de transferência de massa para a fase vapor par este sistema, nas condições da experiência foi de:
KG x a = 2,15 b mol/h . ft3 . atm
A relação de equilíbrio par o sistema amônia-ar-água é dada pela seguinte equação:
/
=&
0
1
+ 10,82p − pressão parcial em NH3, em atmosferas
x − fração molar do NH3
T − temperatura em oK
Calcular a altura do recheio e a perda de carga através dele, se são usadas 5.310 b/h (base isenta de NH3) de água em uma torre de 1,5 ft de diâmetro, recheada com anéis de Raschig de
cerâmica de 1".
Considerar que a temperatura, pressão, composições e o coeficiente global sejam os mesmos das condições operacionais.
Para o cálculo da perda de carga utilizar as condições de fundo.
4.11 Em uma coluna de absorção recheada de anéis cerâmicos de Raschig de ½" deseja-se recuperar 99% do amoníaco contido em uma mistura gasosa ar-amoníaco de concentração em amoníaco igual a 2% em mol. A absorção se passa à 20oC e 760 mmHg e se deseja tratar 1.000 kg/h de
ar, que é considerado como inerte.
Calcular:
a) a quantidade mínima de solvente necessário. O solvente é constituído por água pura;
b) a concentração da solução líquida na saída da coluna, se a quantidade de água, empregada como solvente corresponde a 10 vezes o valor
mínimo. Para resolução dos itens ( ) e (b) seguir em linhas gerais o método dado no exercício sobre o gás de carvão, sendo que na prova, foi dada a vazão de gás em b/h e já foi dada a equação da reta do equilíbrio (ver obs. (b));
c) a área da seção normal da torre se o fluxo mássico corresponde à metade do fluxo de inundação;
d) a altura necessária de recheio, se a altura da umidade de transferência HOG é igual a 1,3 ft.
Utilizar as condições de fundo.
Operações Unitárias na Engenharia Química
-a) Para as condições de operação, considerar a relação de equilíbrio entre as fases é um reta expressa pela equação:
y* = 0,185x ,
+
= 0,185+
b) Considerar para efeito de cálculos solução diluída.
c) Sugestão: trabalhar em razão molar, não esquecendo de transformar a vazão mássica de ar em vazão molar.
d) ρH2O = 1g/cm
3 = 62,4 b/ft3 µ
H2O = 1cp ψ = 1
e) R = 1,987 cal/(gmol)oK =1,987 BTU/ bmol x (oR) = 82,06 atm x cm3/gmol(oK) R = 0,7302 ft3 x atm/ bmol(oR)
4.12 Os dados abaixo foram obtidos experimentalmente para absorção de amônia do ar, utilizando água como solvente, em uma torre recheada com anéis de Raschig de cerâmica de 1".
% % 2 2
&
2 +
2 6 $$45 %
% 2 2
&
( )
( ) *
*
% % 2 2
&
% % 2 2
&
!"!#$###' 3
!"!#$#### !"!#$###+&,
!"!#$##,&#
O coeficiente global de transferência de massa para a fase vapor par este sistema, nas condições da experiência foi de:
KG a = 1634 b mol/h . ft3 . mm Hg
A relação de equilíbrio para o sistema amônia-ar-água é dada pela seguinte equação:
y = 0,957 x
Calcular a altura do recheio e a perda de carga através dele, se são usadas 127.440 b/d (base isenta de NH3) de água em uma torre de 1,5 ft de diâmetro,
recheada com anéis de Raschig de cerâmica de 1".
Considerar que a temperatura, pressão, composições e o coeficiente global sejam os mesmos das condições operacionais.
Para o cálculo da perda de carga utilizar as condições de fundo.
4.13 Deseja-se recuperar amônia de um fluxo de ar por absorção com água no solvente.
Sabe-se que:
a concentração de amônia no gás de alimentação é de 0.099 (moles de NH3/moles de ar) e no
gás de saída é de 0.001 (moles de NH3/moles de ar). A vazão de gás total de alimentação é de
Operações Unitárias na Engenharia Química -
#
o solvente, água, utilizado não contém NH3 e trabalha-se com uma quantidade de solvente 2,1
vezes maior que a mínima.
Calcular:
a) o número de pratos teóricos necessários para efetuar a separação no caso de se utilizar torre de pratos;
b) o diâmetro de um torre recheada, calculado para as condições de fundo, no caso de se utilizar recheios de anéis de Raschig de cerâmica de 1";
c) a altura da torre recheada considerando-se as condições do fundo e que o número de unidades de transferência (NOG) baseado na fase gasosa seja igual a 6,75
KOG a = 23,78 bmol/(h ft3 x fração molar) = 3,80 kg mol/(h m3)
(ρL)fundo = (ρL)topo = 62,4 .
%
42
& = 15
6
& = 12
&
(µL)fundo = (µL)topo = 1 cp