UNIVERSIDADE FEDERAL DO CEARÁ CENTRO DE TECNOLOGIA
DEPARTAMENTO DE ENGENHARIA QUÍMICA
PROGRAMA DE PÓS-GRADUAÇÃO EM ENGENHARIA QUÍMICA
ANA CRISTINA DE ABREU SIQUEIRA
PARTIÇÃO DE ANTOCIANINAS DO AÇAÍ POR MEIO DE SISTEMAS AQUOSOS BIFÁSICOS
ANA CRISTINA DE ABREU SIQUEIRA
PARTIÇÃO DE ANTOCIANINAS DO AÇAÍ POR MEIO DE SISTEMAS AQUOSOS BIFÁSICOS
Tese apresentada ao Curso de Doutorado em Engenharia Química da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Doutor em Engenharia Química. Área de concentração: Processos Químicos e Bioquímicos.
Orientador: Hosiberto Batista de Sant’Ana
Coorientador: Ivanildo José da Silva Júnior
ANA CRISTINA DE ABREU SIQUEIRA
PARTIÇÃO DE ANTOCIANINAS DO AÇAÍ POR MEIO DE SISTEMAS AQUOSOS BIFÁSICOS
Tese apresentada ao Curso de Doutorado em Engenharia Química da Universidade Federal do Ceará, como parte dos requisitos para obtenção do título de Doutor em Engenharia Química. Área de concentração: Processos Químicos e Bioquímicos.
Aprovada em: 23/03/2018.
BANCA EXAMINADORA
________________________________________ Prof. Dr. Hosiberto Batista de Sant’Ana (Orientador)
Universidade Federal do Ceará (UFC) _________________________________________
Profa. Dra. Rílvia Saraiva de Santiago-Aguiar Universidade Federal do Ceará (UFC) _________________________________________
Profa. Dra. Diana Cristina Silva de Azevedo Universidade Federal do Ceará (UFC) _________________________________________
Profa. Dra. Sueli Rodrigues
Universidade Federal do Ceará (UFC) _________________________________________
AGRADECIMENTOS
A Deus e Nossa Senhora de Fátima, por me permitirem ter fé de que iria dar certo mesmo quando tudo parecia estar errado e terem me dado forças para seguir em frente apesar de tantas dificuldades.
Ao meu orientador professor Dr. Hosiberto Sant’Ana, por ter me recebido tão bem em seu grupo de pesquisa, pela orientação e por todo seu apoio, não só pra crescer no meio acadêmico, mas em todos os aspectos da vida. Tenho muito orgulho de ter feito parte de sua equipe. Meus sinceros agradecimentos.
Ao meu coorientador professor Dr. Ivanildo Júnior, por ter se prontificado a fazer parte deste trabalho, pela paciência e por tudo que me ensinou durante todos esses anos. Levarei este aprendizado pelo resto da minha vida. Tenho imensa gratidão pela sua participação nisso tudo.
Ao Dr. Edy Brito, pela enorme contribuição nessa pesquisa, pela grande importância que tem em minha caminhada acadêmica e por sempre ter sido um profissional tão solícito e disposto a tirar as muitas dúvidas que surgiram nesse caminho. Agradeço imensamente por tudo.
Às professoras Dras. Diana Azevedo e Sueli Rodrigues pela participação e pelas valiosas contribuições na banca examinadora de meu Exame Geral de Conhecimento e pela participação da banca de defesa.
À professora Dra. Rílvia Santiago-Aguiar, pelo apoio durante o doutorado e pela participação na banca examinadora.
Ao Dr. Guilherme Zocollo, pela participação e enormes contribuições na banca examinadora e pela disponibilidade em ajudar durante as correções desta tese.
Ao professor Dr. Álvaro Lima, da UNIT (Universidade Tiradentes/Sergipe) pela disposição em tirar algumas dúvidas tanto no começo deste trabalho, como na reta final.
Aos meus pais Maria Eddy e Leledo, pelo apoio, pelo amor incondicional e por serem meu porto seguro. Eu amo vocês.
Às minhas irmãs Ana Maria, Ana Cláudia e Ana Carla, que são uma parte de mim e que sem elas eu jamais poderia viver. Amo vocês.
À minha sobrinha e afilhada Lia, que chegou a minha vida num momento difícil trazendo luz e alegria a minha família, mostrando que a vida é maravilhosa, mesmo nas adversidades. Mamá ama você.
Ao meu cunhado Marcelo, por ser um irmão e por todas as vezes que ficou ao meu lado tirando algumas dúvidas.
Aos meus tios, tias, primos e primas que tanto me apoiam e torcem por mim.
Ao Grupo de Pesquisa em Termofluidodinâmica Aplicada (GPTA) sem o qual não teria sido possível desenvolver essa pesquisa. Muito obrigada pela companhia e apoio durante esses anos.
Aos queridos amigos que o Departamento de Engenharia Química da UFC me deu: Alaídes, Amanda, Ana Alice, Ariane, Arthur, Brenda, Edvan, Jansen, Jouciane, Kennedy, Luiz Bruno e Talita. Sou muito grata pela amizade, apoio e companhia de vocês.
Aos amigos e colegas da pós-graduação.
À Embrapa Agroindústria Tropical, especialmente a todos do Laboratório Multiusuário de Química de Produtos Naturais, no qual eu realizei uma parte dos experimentos.
Aos meus queridos amigos Agnaldo, Clécia, Diones, Gabriele, Joni e Luciana pela sincera amizade. Tenho muita sorte de tê-los como amigos.
À minha amiga Gardênia, por tudo o que fez e faz por mim. Tenho uma imensa gratidão a Deus por ter uma amiga como você.
À minha professora de yoga Andréa Benício, por me ensinar que na vida devemos aceitar e deixar ir tudo o que acontece. Namastê.
A todos os amigos que o jiu-jitsu me trouxe, principalmente ao mestre Abraão Amorim e aos amigos Rayana, Marcela, Afonso, Edson, Lorena, André, Lessandro, João Igor, Sílvio.
Ao Seu Luiz por toda sua preocupação com minha segurança no DEQ nos dias em que precisei ficar até a noite e finais de semana e feriados em que eu fui ao laboratório e que sempre ajudou não só a mim, mas a todos no DEQ.
A todos os professores e funcionários do Departamento de Engenharia Química da UFC.
À Universidade Federal do Ceará.
À FUNCAP pela bolsa a mim concedida.
RESUMO
O açaí é bastante consumido pelo Brasil por apresentar, entre tantos benefícios, atividade antioxidante, uma vez que é rico em antocianinas, que é um grupo de pigmentos naturais de maior distribuição no reino vegetal. Sistemas Aquosos Bifásicos (SABs) são utilizados para a partição de biomoléculas, como antocianinas. SABs são formados quando os componentes de um sistema são imiscíveis e formam duas fases líquidas a determinadas concentrações. O objetivo deste trabalho é particionar antocianinas de açaí por meio de SABs. SABs formados por PEG e sulfato de amônio, sulfato de magnésio e sulfato de sódio foram avaliados para escolher o melhor sal para a partição de antocianinas e o sulfato de amônio foi o mais apropriado devido a este ter apresentado o maior rendimento de açúcares na fase rica em sal (fundo), que foi 44,56% m/m, sendo este então escolhido para estudar o efeito da massa molecuar do PEG na partição. PEG 8000 foi escolhido entre PEG 4000, 6000, 8000 e 10000 por apresentar maior rendimento de açúcares na fase fundo. Todos os SABs formados por PEG e sal apresentaram rendimento de 100% m/m de antocianinas na fase rica em PEG (topo). Dentre os SABs formados por álcoois (etanol, 1-propanol e 2-propanol) e sulfato de amônio, o sistema etanol e sulfato de amônio apresentou um rendimento de 64,83% m/m de antocianinas na fase rica em etanol (topo) e 66,17% m/m de açúcares na fase rica em sulfato de amônio (fundo) contra SABs formados por 1-propanol e 2-propanol, os quais as antocianinas e os açúcares particionaram para a fase fundo. Para avaliar o efeito da concentração dos componentes formadores de fases, foi realizado um planejamento estatístico do tipo DCCR (Delineamento Composto Central Rotacional) cujas variáveis independentes foram concentração de etanol e de sulfato de amônio. O melhor resultado apresentado foi com SAB formado com 17,5% m/m de sulfato de amônio e 28% m/m de etanol. A extração multiestágios mostrou que um estágio para o SAB PEG/sulfato de amônio e dois estágios para o SAB etanol/sulfato de amônio são suficientes para remover mais de 97% dos açúcares. O aumento de escala foi considerado viável para os dois sistemas, uma vez que seus rendimentos de açúcares mantiveram-se similares aos encontrados na partição realizada em célula de equilíbrio. As antocianinas foram identificadas por meio de UPLC-QToF.
ABSTRACT
Acai is widely consumed in Brazil because it has antioxidant activity, as it is rich in anthocyanins, which is a group of natural pigments of greater distribution in the vegetable kingdom. Aqueous Two-phase Systems (ATPS) are used for the partitioning of biomolecules, such as anthocyanins. ATPS are formed when the components of a system are immiscible and form two liquid phases at certain concentrations. The aim of this work is to partition anthocyanins of açai by ATPS. ATPS formed by PEG and ammonium sulfate, magnesium sulfate and sodium sulfate were evaluated to select the best salt for partition of anthocyanins and ammonium sulfate was the most appropriate because it had the highest yield of sugar in the salt rich phase (bottom), which was 44.56% w/w, which was then chosen to study the effect of the molar mass of PEG on the partition. PEG 8000 was chosen from PEG 4000, 6000, 8000 and 10000 because it showed higher yield of sugars in the bottom phase. All ATPS formed by PEG and salt showed 100% w/w of anthocyanins in the PEG rich phase (top phase). Among the ATPS formed by alcohols (ethanol, 1-propanol and 2-propanol) and ammonium sulfate, ethanol and ammonium sulphate showed a yield of 64.83% w/w of anthocyanins in the ethanol rich phase (top phase) and 66.17% w/w yield of sugars in the ammonium sulfate rich phase (bottom phase) against ATPS formed by 1-propanol and 2-propanol, which the anthocyanins and sugars partitioned into the bottom phase. In order to evaluate the effect of the concentration of the phase-forming components, a DCCR (Compound Rotational Central Compound Design) statistical design was carried out, whose independent variables were ethanol and ammonium sulfate concentration. The best result was with ATPS formed with 17.5% w/w of ammonium sulphate and 28% w/w of ethanol. Multistage extraction showed that one stage for ATPS PEG/ammonium sulfate and two stages for ATPS ethanol/ammonium sulfate are sufficient to remove more than 97% of the sugars for both systems. Scale-up was considered feasible for both systems, since their yields of sugars remained similar to those found in the partition realized in equilibrium cell. Anthocyanins were identified by means of UPLC-QToF.
LISTA DE FIGURAS
Figura 1 Estrutura da forma mais frequente de antocianidina ... 27
Figura 2 Estrutura das antocianinas dependendo do pH ... 29
Figura 3 Estrutura molecular da cianidina-3-rutinosídeo ... 30
Figura 4 Estrutura molecular da cianidina-3-glicosídeo ... 31
Figura 5 Diagrama de fases para sistema aquoso bifásico expresso em coordenadas retangulares ... 39
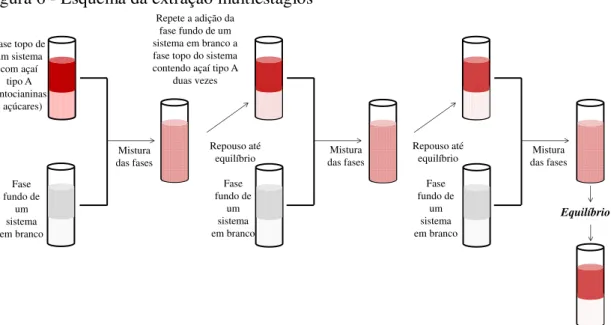
Figura 6 Esquema da extração multiestágios ... 56
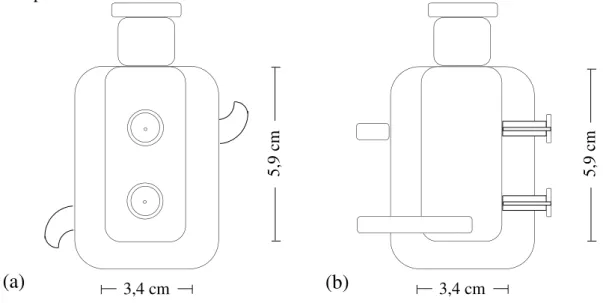
Figura 7 Esquema de uma célula de equilíbrio: (a) vista frontal e (b) vista lateral com seus respectivos diâmetro e altura ... 57
Figura 8 Esquema do reator de vidro utilizado para o aumento de escala com seus respectivos valores de diâmetro e altura ... 59
Figura 9 Partição de antocianinas do açaí tipo A em SAB PEG 8000/sulfato de amônio após equilíbrio ... 64
Figura 10 Partição de antocianinas do açaí tipo A em SAB etanol/sulfato de amônio após equilíbrio ... 73
Figura 11 Diagrama de fases para o sistema etanol/sulfato de amônio a 25°C ... 74
Figura 12 Superfícies de resposta que descrevem o efeito da concentração de etanol e sulfato de amônio no (a) coeficiente de partição de antocianinas, (b) rendimento de antocianinas na fase topo, (c) rendimento de açúcares na fase fundo e (d) seletividade... 83
Figura 13 Cromatograma do UPLC-QToF do açaí tipo A ... 94
Figura 14 Cromatograma do UPLC-ToF do açaí tipo A em SAB PEG 8000/sulfato de amônio (fase topo)... 97
Figura 15 Cromatograma do UPLC-ToF do açaí tipo A em SAB etanol/sulfato de amônio (fase topo) ... 100
Figura 17 Epectro do RMN do açaí tipo A após partição em SAB PEG 8000/sulfato de amônio ... 103 Figura 18 Epectro do RMN do açaí tipo A após partição em SAB etanol/sulfato de
LISTA DE TABELAS
Tabela 1 Principais antocianinas encontradas na natureza e suas substituições na
antocianidina ... 27
Tabela 2 Propriedades benéficas das antocianinas ... 32
Tabela 3 Valores em reis (R$) dos componentes formadores de fases ... 37
Tabela 4 Sistemas aquosos bifásicos aplicados para a partição de antocianinas ... 47
Tabela 5 Planejamento experimental feito no software Statistica 7 para obtenção de dados de partição de antocianinas ... 53
Tabela 6 Escolha do sal formador de fase para formado por PEG 8000 e sais ... 65
Tabela 7 Escolha da massa molar do PEG para SAB formado por PEG 8000/sulfato de amônio ... 67
Tabela 8 Resultados da extração multiestágios na partição de antocianinas do açaí tipo A para SAB formado por PEG 8000/sulfato de amônio ... 70
Tabela 9 Escolha do álcool formador de fase para SAB formado por álcool/sulfato de amônio ... 72
Tabela 10 Dados de fração mássica de etanol e sulfato de amônio para composição global, fase topo e fase fundo dos pontos do planejamento estatístico ... 75
Tabela 11 Valores de composição das fases, coeficiente de partição de antocianinas (K1), concentração de antocianinas (C1), rendimento de antocianinas (R1), coeficiente de partição de açúcares (K2), concentração de açúcares (C2), rendimento de açúcares (R2) e seletividade () do planejamento experimental DCCR para a partição de antocianinas do açaí tipo A ... 78
Tabela 12 Análise de variância (ANOVA) do coeficiente de partição das antocianinas ... 80
Tabela 13 Análise de variância (ANOVA) do rendimento de antocianinas na fase topo ... 80
Tabela 15 Análise de variância (ANOVA) da seletividade ... 82 Tabela 16 Efeito da extração multiestágios na partição de antocianinas do açaí tipo A
em SAB etanol/sulfato de amônio ... 86 Tabela 17 Efeito do aumento de escala na partição das antocianinas do açaí tipo A
em SAB PEG 8000/sulfato de amônio ... 89 Tabela 18 Efeito do aumento de escala na partição das antocianinas do açaí tipo A
em SAB etanol/sulfato de amônio ... 91 Tabela 19 Dados de espectrometria de massas para identificação dos compostos
fenólicos do açaí tipo A ... 95 Tabela 20 Dados de espectrometria de massas dos compostos fenólicos da fase topo
da partição do açaí tipo A em SAB PEG 8000/sulfato de amônio ... 98 Tabela 21 Dados de espectrometria de massas dos compostos fenólicos da fase topo
LISTA DE ABREVIATURAS E SIGLAS
C1 Concentração de antocianinas
C2 Concentração de açúcares
Da Dalton
DCCR Delineamento Composto Central Rotacional ESI + Ionização por electrospray em modo positivo
g Gravidade
K1 Coeficiente de partição das antocianinas K2 Coeficiente de partição dos açúcares
UPLC-QToF Cromatografia líquida de ultra performance acoplada a um sistema quadrupolo/tempo de voo
MHz Mega hertz
MM Massa molar
MSE Método de aquisição de dados para obter a massa acurada do íon precursor
m/z Massa do íon
PEG Polietilenoglicol
R1 Rendimento das antocianinas
R2 Rendimento dos açúcares
RMN Ressonância Magnética Nuclear
RV Razão volumétrica
VT Volume da fase topo
VF Volume da fase fundo
SUMÁRIO
1 INTRODUÇÃO E OBJETIVOS ... 20
1.1 Introdução ... 20
1.2 Obejtivo geral ... 23
1.3 Objetivos específicos ... 23
2 REVISÃO BIBLIOGRÁFICA ... 24
2.1 Açaí ... 24
2.2 Antocianinas ... 26
2.2.1 Estrutura das antocianinas ... 26
2.2.1.1 Cor e estabilidade das antocianinas ... 28
2.2.1.2 Influência do pH ...... 28
2.2.1.3 Cianidina-3-rutinosídeo ...... 29
2.2.1.4 Cianidina-3-glicosídeo ...... 30
2.2.2 Benefícios e aplicação das antocianinas ... 31
2.2.3 Técnicas de extração de antocianinas ... 32
2.3 Extração líquido-líquido ... 34
2.3.1 Escolha de solvente ... 35
2.4 Sistemas aquosos bifásicos ... 37
2.4.1 Sistemas aquosos bifásicos (SABs) ... 37
2.4.2 Fundamentos termodinâmicos sobre a formação dos SABs ... 40
2.4.3 Parâmetros que afetam a partição de solutos em SABs ... 42
2.4.3.1 Influência da massa molar do polímero ... 42
2.4.3.2 Influência do tipo de sal ... 43
2.4.3.3 Influência da temperatura... 43
2.4.3.4 Influência do pH ... 43
2.4.4 Sistemas aquosos bifásicos polímero/sal ou álcool/sal ... 44
2.4.4.1 Sistemas aquosos bifásicos polímero/sal ... 44
2.4.4.2 Sistemas aquosos bifásicos álcool/sal ... 45
2.4.5 Sistemas aquosos bifásicos e antocianinas ... 46
2.5 Função D (Função desejabilidade) ... 48
3 MATERIAIS E MÉTODOS ... 50
3.2 Métodos ... 50
3.2.1 Preparo da amostra ... 50
3.2.2 Diagrama de fases ... 51
3.2.3 Ensaios de partição ... 52
3.2.4 Planejamento estatístico ... 52
3.2.5 Teor de antocianinas monoméricas totais ... 53
3.2.6 Teor de açúcares totais ... 54
3.2.7 Coeficiente de partição ... 54
3.2.8 Razão volumétrica ... 54
3.2.9 Rendimento de antocianinas e açúcares ... 55
3.2.10 Seletividade ... 55
3.2.11 Extração multiestágios ... 55
3.2.12 Ampliação de escala ... 56
3.2.12.1 Partição em célula de equilírio ... 57
3.2.12.2 Partição em reator ... 58
3.2.12.3 Relação H/D ... 59
3.2.13 Identificação das antocianinas através de UPLC-QToF-MSE... 60
3.2.13.1 Preparo da amostra ... 60
3.2.13.2 Análise cromatográfica ... 61
3.2.13.3 Condições do Massa de Alta Resolução – XEVO - QToF... 61
3.2.14 Ressonância Magnética Nuclear (RMN)... 61
3.2.14.1 Preparo da amostra ... 61
3.2.14.2 Obtenção dos espectros de RMN ... 62
4 RESULTADOS ... 63
4.1 Sistema PEG/sais ... 63
4.1.1 Escolha do sal formador de fase... 63
4.1.2 Escolha da massa molar do PEG... 66
4.1.3 Extração multiestágios ...... 67
4.2 Sistema álcool/sal ... 71
4.2.1 Seleção do álcool formador de fase... 71
4.2.2 Diagrama de fases e efeito da composição do sistema na partição de antocianinas do açaí tipo A... 73
4.2.3.1 Análise de variância (ANOVA) do coeficiente de partição das antocianinas... 79
4.2.3.2 Análise de variância (ANOVA) do rendimento das antocianinas na fase topo ... 80
4.2.3.3 Análise de variância (ANOVA) do rendimento de açúcares na fase fundo ... 81
4.2.3.4 Análise de variância (ANOVA) da seletividade ... 81
4.2.3.5 Análise de superfícide de resposta ... 82
4.2.4 Função D (Desejabilidade)... 84
4.2.5 Extração multiestágios... 84
4.3 Ampliação de escala ... 87
4.3.1 Ampliação de escala do sistema PEG 8000/sulfato de amônio ... 87
4.3.2 Ampliação de escala do sistema etanol/sulfato de amônio ... 90
4.4 Identificação das antocianinas através de UPLC-QToF-MSE... 92
4.4.1 Identificação das antocianinas do açaí tipo A ... 92
4.4.2 Identificação das antocianinas da fase topo da partição do açaí tipo A em SAB PEG 8000/sulfato de amônio ... 96
4.4.3 Identificação das antocianinas da fase topo da partição do açaí tipo A em etanol/sulfato de amônio ... 99
4.5 Ressonância Magnética Nuclear (RMN) ... 102
5 CONCLUSÕES ... 104
REFERÊNCIAS ... 105
ANEXO A – ESQUEMA DO PREPARO DA AMOSTRA ATÉ AS ANÁLISES DE ANTOCIANINAS MONOMÉRICAS TOTAIS E AÇÚCARES TOTAIS APÓS PARTIÇÃO POR MEIO DE SISTEMA AQUOSO BIFÁSICO ... 119
ANEXO B – ESQUEMA DO PREPARO DAS AMOSTRAS PARA ANÁLISES DE RESSONÂNCIA MAGNÉTICA NUCLEAR (RMN) E CROMATOGRAFIA LÍQUIDA DE ALTA PERFORMANCE QUADRUPOLO TEMPO DE VOO (UPLC-QToF) ... 120
ANEXO C – COEFICIENTES DE REGRESSÃO PARA A RESPOSTA COEFICIENTE DE PARTIÇÃO DAS ANTOCIANINAS ... 121
ANEXO D – COEFICIENTES DE REGRESSÃO PARA A RESPOSTA RENDIMENTO DE ANTOCIANINAS NA FASE TOPO ... 122
ANEXO F – COEFICIENTES DE REGRESSÃO PARA A RESPOSTA
1 INTRODUÇÃO E OBJETIVOS
1.1 Introdução
Com o aumento do consumo de produtos saudáveis devido à preocupação dos consumidores com a saúde e bem-estar, a indústria de alimentos, cosméticos, farmacêutica e química tem procurado utilizar-se de insumos naturais para gerar estes produtos. Um desses insumos são as antocianinas devido à sua cor atrativa e por agir contra a diabetes, além de possuírem capacidade antioxidante, atividade anti-inflamatória e anticarcinogênica (HE; GIUSTI, 2010).
As antocianinas são consideradas o maior e mais importante grupo de pigmentos naturais hidrossolúveis encontrados em frutos, folhas e flores e pertencem à classe dos flavonoides, que são metabólitos secundários sintetizados pelas plantas superiores (HE; GIUSTI, 2010; WU et al., 2011).
O açaizeiro é uma planta nativa da região amazônica e produz um alimento de grande importância para a população local, além de seu impacto na produção de palmito (EMBRAPA, 2006). Sua importância se dá devido aos seus benefícios à saúde. Esses benefícios se devem a sua composição fitoquímica e sua capacidade antioxidante. A polpa do açaí é rica em carboidratos, fibras, vitaminas E, proteínas e minerais (Mn, Fe, Zn Cu, Cr), além de apresentar elevado valor energético, devido ao seu alto teor de lipídios, como os ácidos graxos essenciais Ômega 6 e Ômega 9 (PORTINHO et al., 2012).
Quando o açaí é extraído sem adição de água, o produto obtido denomina-se polpa de açaí e quando a extração é realizada com adição de água seguida de uma etapa de filtração, os produtos obtidos são chamados de açaí especial ou grosso ou tipo A, açaí regular, médio ou tipo B e açaí popular ou fino ou tipo C (BRASIL, 2000).
As principais antocianinas presentes no açaí são cianidina-3-rutinosídeo e cianidina-3-glicosídeo, cuja concentração no fruto é de 311 mg/L e 208 mg/L, respectivamente (PACHECO-PALLENCIA; TALCOTT, 2010) e estas são responsáveis pela coloração roxa do açaí (GALLORI et al., 2004; LICHTENTHÄLER et al., 2005; SCHAUSS et al., 2006, ROSSO et al., 2008).
alimentos é de uso ilimitado, de acordo com a Resolução RDC nº 34, de 9 de março de 2001 (BRASIL, 2001) e permite o uso de até 0,05 g/100g ou g/100mL como corante em produtos de frutas e de vegetais e geleia de mocotó, de acordo com a Resolução RDC nº 8, de 6 de março de 2013 (BRASIL, 2013). A ANVISA aprova também a aplicação de antocianinas na indústria de cosméticos em produtos de higiene pessoal, cosméticos e perfumes, de acordo com a Resolução RDC nº 79, de 28 de agosto de 2000 (BRASIL, 2000).
As antocianinas também podem ser utilizadas na produção de padrões cromatográficos. Para garantir ao consumidor que o produto que está adquirindo é de qualidade e assim, evitar fraudes, torna-se necessário a realização de análises. Porém, análises cromatográficas podem ser caras e a confiabilidade dos resultados depende do quão preciso é a padronização (KIMURA; RODRIGUEZ-AMAYA, 2002). Os altos custos dos padrões cromatográficos, bem como a falta de vários padrões, fazem com que essas análises apresentem dificuldades para serem realizadas. Como exemplo, 5 mg de padrão analítico de cianidina-3-rutinosídeo custa R$ 1293,00, 15 mg de padrão de cianidina-3-glicosídeo custa R$ 5.515,00 e 1 mg de padrão de peonidina-3-glicosídeo custa R$ 3.079,00 (SIGMA-ALDRICH, 2017). Portanto, há a necessidade de se produzir os próprios padrões para reduzir custos.
Para a aplicação das antocianinas nas indústrias de alimentos, cosméticos e química, é necessário obtê-las a partir de técnicas que não sejam tóxicas, de baixo custo e alto rendimento, como por exemplo, por meio de sistemas aquosos bifásicos.
sido utilizados para separar e purificar antocianinas de jambolão (CHANDRASEKHAR; RAGHAVARAO, 2015) e repolho roxo (JAMPANI; RAGHAVARAO, 2015a e JAMPANI; RAGHAVARAO, 2015b). Sistemas formados por álcoois e sais também foram utilizados para a partição de antocianinas de suco de uva (WU et al., 2014), batata doce (LIU et al., 2013), Vaccinium uliginosium (HUA et al., 2013) e amora (WU et al., 2011; LIANG et al., 2012).
1.2 Objetivo geral
Essa tese tem como objetivo geral, particionar antocianinas do açaí tipo A por meio de sistemas aquosos bifásicos para posterior uso na indústria de alimentos, química e/ou farmacêutica.
1.3 Objetivos Específicos
Avaliar diferentes sistemas aquosos bifásicos formados por PEG e sais e formados por álcoois e sulfato de amônio para a partição de antocianinas do açaí Tipo A;
Averiguar o efeito de álcoois como etanol, 1-propanol e 2-propnol na partição de antocianinas do açaí tipo A;
Determinar o efeito de diferentes sais de sulfato de amônio, sulfato de magnésio e sulfato de sódio na partição de antocianinas do açaí tipo A;
Estudar o efeito da variação concentração de etanol e sulfato de amônio na partição das antocianinas;
Avaliar o efeito de PEG de diferentes massas molares no processo de partição de antocianinas do açaí tipo A;
Identificar as antocianinas presentes após partição em SAB através de cromatografia líquida de ultra performance acoplada a um sistema quadrupolo/tempo de voo (UPLC-QToF);
Realizar extrações multiestágios a fim de reduzir a concentração de açúcares na fase topo do sistema;
2 REVISÃO BIBLIOGRÁFICA
2.1 Açaí
O açaizeiro é uma palmeira bastante comum nas várzeas e margens dos rios na região amazônica. Seu fruto, o açaí (Euterpe oleracea M.), é apresentado em forma de cachos, de coloração violeta, quase negra, de forma ovóide ou arredondada, de caniço duro e polpa comestível (ROGEZ, 2000 apud. PORTINHO et al., 2012).
Devido à expansão comercial do açaí como bebida, a comercialização de açaí nas capitais brasileiras ocorre das mais diferentes formas e muitos produtores brasileiros tem realizado seu cultivo em escala comercial, principalmente nas regiões Norte e Nordeste (SANTOS et al., 2008).
No ano de 2015, uma área extrativista e cultivada de 154.486 hectares, no estado do Pará colheu mais de 1 milhão de toneladas de açaí. A estimativa de consumo de açaí na região metropolitana de Belém é de 300 mil toneladas por ano. Segundo a Embrapa Amazônia Ocidental, a procura pelo suco de açaí aumenta 15% a cada ano. O governo paraense espera que até 2020, a área cultivada do fruto aumente em 50 mil hectares (BRASIL, 2016).
De acordo com o Instituto Brasileiro de Geografia e Estatística (IBGE), do ano de 2015 para 2016, a safra de açaí aumentou de 1 milhão para 1,1 milhão de toneladas, sendo o estado do Pará responsável por 98,3% desta produção (IBGE, 2017).
A colheita do açaí ajuda a população ribeirinha no baixo Rio Tocantins no período de safra, rendendo a esta, até 2 salários mínimos, além da venda do palmito do açaizeiro no final da safra e do caroço do açaí, do qual se extrai o óleo de açaí e assim, pode ser utilizado na produção de fitoterápicos, ração animal e adubo orgânico (BRASIL, 2016).
Por ser umas das frutas mais nutritivas da Região Amazônica, o açaí é consumido na forma de bebida, sendo um alimento altamente energético e de alto valor nutricional (SANABRIA; SANGRONIS, 2007).
O açaí possui grande importância devido aos benefícios à saúde. Esses benefícios se devem a sua composição fitoquímica e sua capacidade antioxidante. Possui substâncias bioativas, como por exemplo, 31% de flavonoides, seguido de 23% de compostos fenólicos, 11% de lignoides e 9% de antocianinas (YAMAGUCHI et al., 2015). A polpa do açaí também é rica em carboidratos, fibras, vitaminas E, proteínas e minerais (Mn, Fe, Zn Cu, Cr), além de apresentar elevado valor energético, devido ao seu alto teor de lipídios, como os ácidos graxos essenciais Ômega 6 e Ômega 9 (PORTINHO et al., 2012). Fatores ambientais como sazonalidade, estádios de maturação, tipo de cultivar e a procedência dos frutos fazem com que haja algumas divergências em sua composição centesimal de macro e microelementos (SANABRIA; SANGRONIS, 2007; DE ROSSO et al., 2008).
Estudos identificaram as principais antocianinas presentes no açaí como cianidina-3-glicosídeo e cianidina-3-rutinosídeo (BOBBIO et al., 2000; GALLORI et al., 2004; LICHTENTHÄLER et al., 2005; SCHAUSS et al., 2006, ROSSO et al., 2008).
Schauss e colaboradores (2006) identificaram a cianidina-3-rutinosídeo e cianidina-3-glicosídeo como antocianinas majoritárias e encontraram em quantidades menores, a cianidina-3-sambubiosídeo, rutinosídeo e peonidina-3-glicosídeo. Os autores também foram os primeiros a detectarem a cianidina-3-sambubiosídeo e peonidina-3-glicosídeo no açaí.
2.2 Antocianinas
2.2.1 Estrutura das antocianinas
As antocianinas constituem o maior e mais importante grupo dos pigmentos naturais hidrossolúveis. Pertencem ao grupo dos compostos fenólicos na classe dos flavonóides, que são os metabólitos secundários sintetizados pelas plantas superiores (HE; GIUSTI, et al., 2010). Encontram-se acumuladas nos vacúolos de células vegetais e protegem as plantas do sol contra a fotoxidação e apresentam atividade antioxidante através das espécies reativas de oxigênio geradas durante o metabolismo da planta (CELLI et al., 2018). Além disso, são responsáveis pela coloração vermelha, azul e roxa em frutas, legumes e plantas ornamentais e a excitação de uma molécula pela luz visível resulta em diferentes cores e como os grupos metoxi possuem uma grande capacidade de doar elétrons, eles causam uma maior mudança batocrômica do que os grupos hidroxi (BRITO et al., 2007; FENNEMA, 2010, p. 468; PASCUAL-TERESA et al., 2010).
As antocianinas são compostos bioativos com importante papel nas características sensoriais de alimentos além de suas propriedades estarem relacionadas com a saúde, na proteção de doenças cardiovasculares (CASTAÑEDA-OVANDO et al., 2009; PASCUAL-TERESA et al., 2010).
Quando a antocianina está em sua forma aglicona, ou seja, quando não está ligada a um açúcar, é denominada antocianidina e é também considerada a estrutura básica das antocianinas representada pelo esqueleto carbônico C6-C3-C6 (HE; GIUSTI, 2010; SRIVIVASAN; PARKIN; FENNEMA, 2010 p. 468). Essa estrutura é basicamente o cátion flavilium (íon 2-fenilbenzopirilium), com grupos hidroxila e metoxila presentes em diferentes posições na sua estrutura. Consistem em um anel aromático ligado a um anel heterocíclico contendo oxigênio, unido por uma ligação carbono-carbono a um segundo anel aromático (Figura 1) (CASTAÑEDA-OVANDO et al., 2009; PASCUAL-TERESA et al., 2010).
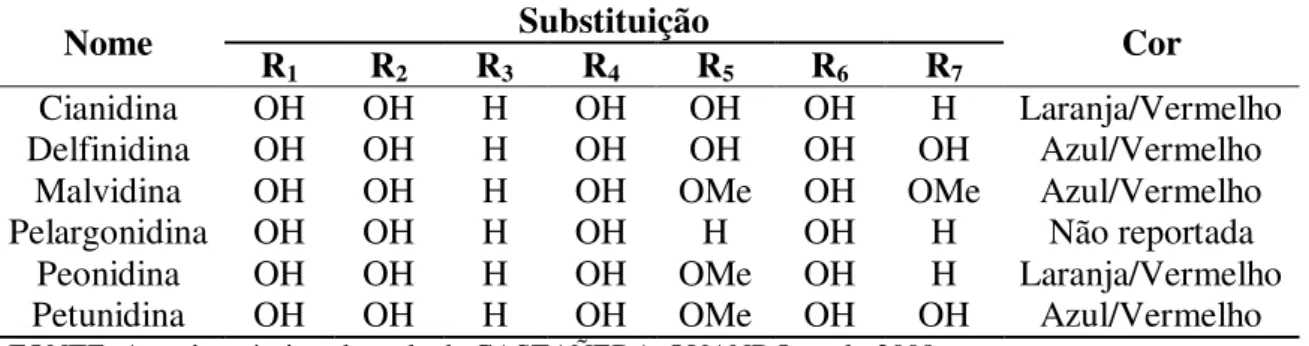
Açúcares podem estar ligados as antocianidinas como mono, di ou triglicosídeos. A glicose é o principal açúcar que está ligado as antocianidinas, além de raminose, xilose, galactose, arabinose e frutose. De acordo com o número e a posição dos grupos hidroxilas e o grau de metilação destes grupos, podemos encontrar diferentes tipos de antocianinas na natureza e as seis mais comumente encontradas em frutos e vegetais são: pelargonidina, cianidina, delfinidina, petunidina, peonidina e malvidina, como mostra a Tabela 1 (GALVANO et al., 2004).
Figura 1 - Estrutura da forma mais frequente de antocianidina
O+
R1 R2
R3 R4
R5
R6
R7
FONTE: Autoria própria, adaptado de CASTAÑEDA-OVANDO et al., 2009
Tabela 1 – Principais antocianinas encontradas na natureza e suas substituições na antocianidina
Nome Substituição Cor
R1 R2 R3 R4 R5 R6 R7
Cianidina OH OH H OH OH OH H Laranja/Vermelho
Delfinidina OH OH H OH OH OH OH Azul/Vermelho
Malvidina OH OH H OH OMe OH OMe Azul/Vermelho
Pelargonidina OH OH H OH H OH H Não reportada
Peonidina OH OH H OH OMe OH H Laranja/Vermelho
Petunidina OH OH H OH OMe OH OH Azul/Vermelho
FONTE: Autoria própria, adaptado de CASTAÑEDA-OVANDO et al., 2009.
As antocianinas mais comumente encontradas na natureza são a cianidina (50%), delfinidina (12%) e a pelargonidina (12%), sendo encontradas em folhas (80%), frutos (65%) e em flores (50%) (CASTAÑEDA-OVANDO et al., 2009).
2.2.1.1 Cor e estabilidade das antocianinas
As antocianinas são instáveis à luz e solúveis em água e não ocorrem em seu estado livre. Estão presentes nos vacúolos celulares e ligadas aos açúcares, de onde provém sua estabilidade e hidrossolubilidade (PASCUAL-TERESA et al., 2010). A estrutura fenilpropanóide e a presença de grupos hidroxílicos (OH-), metoxílicos (OCH3-), açúcares e açúcares acetilados possui efeito marcante na intensidade e estabilidade da cor, que pode ser azul, vermelha, roxa ou laranja (CHITARRA; CHITARRA, 2005). Além disso, o pH, altas temperaturas, a luz e a concentração de oxigênio são os principais fatores que afetam a estabilidade das antocianinas. Portanto, as antocianinas possuem maior estabilidade sob condições ácidas e são muito influenciadas pelos substituintes da aglicona (SRIVIVASAN; PARKIN; FENNEMA, 2010, p. 470).
Açúcares e seus produtos de degradação também podem afetar a estabilidade das antocianinas. A presença destes em extratos antociânicos podem levar à reação de Maillard e acabam por causar escurecimento, devido à formação de compostos marrons. Então torna-se necessário a remoção dos açúcares do extrato antociânico a fim de se obter maior estabilidade desses pigmentos para que possam ser aplicados na indústria de alimentos (HODGE, 1953; SRIVIVASAN; PARKIN; FENNEMA, 2010; JAMPANI; RAGHAVARAO, 2016).
2.2.1.2 Influência do pH
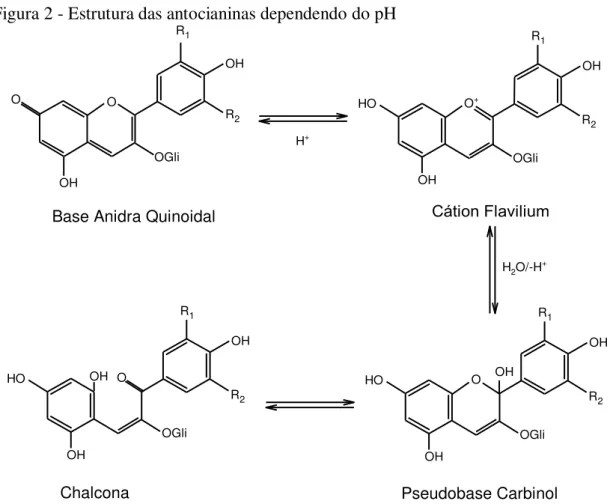
A Figura 2 apresenta a distribuição do equilíbrio dessas 4 formas em uma faxia de pH de 0 a 6. Em pH menor que 2,0, o cátion flavilium é a forma de antocianina predominante e se encontra intensamente colorida, contribuindo para as colorações roxa e vermelha. Em valores de pH entre 2 e 4, as antocianinas se encontram na forma base anidra quinoidal, de coloração azul. Se ocorrer uma hidratação do cátion flavilium na posição C-2, serão obtidas as formas descoloridas pseudobase carbinol e chalcona, na faixa de pH 5 a 6. As antocianinas degradam se expostas a pH acima de 7 (PASCUAL-THEREZA;SANCEZ-BALLESTA, 2008; CASTAÑEDA-OVANDO et al., 2009; HE; GIUSTI, 2010).
Figura 2 - Estrutura das antocianinas dependendo do pH
O O OGli OH R1 R2 OH OH OH HO R1 R2 OGli O+
Base Anidra Quinoidal
OH OH HO R1 R2 OGli O OH Cátion Flavilium Pseudobase Carbinol OH OH HO R1 R2 OGli OH O Chalcona
H2O/-H+
H+
FONTE: Autoria própria, adaptado de PASCUAL-THERESA; SANCHEZ-BALLESTA, 2008
2.2.1.3 Cianidina-3-rutinosídeo
tomate-de-árvore (HURTADO et al., 2009) e é uma das antocianinas majoritárias do açaí, juntamente com a cianidina-3-glicosídeo (BOBBIO et al., 2000; GALLORI et al., 2004; LICHTENTHÄLER et al., 2005; SCHAUSS et al., 2006, ROSSO et al., 2008). Representa cerca de 60 a 67% das antocianinas presentes no açaí (PORTINHO et al., 2012). Sua estrutura é apresentada na Figura 3, onde temos uma molécula de rutinose ou raminose ligada a cianidina.
Figura 3 – Estrutura molecular da cianidina-3-rutinosídeo
O+
OH OH
OH HO
O
O
OH HO
HO O O
OH
HO OH
CH3
FONTE: Autoria própria, adaptado de YAMAGUCHI et al., 2015.
2.2.1.4 Cianidina-3-glicosídeo
A cianidina-3-glicosídeo (C21H21O11), cuja massa molecular é 449,38 g∙moL-1, é uma das antocianinas encontrada em amora (CHEN et al., 2006; WU et al., 2011; YOU et al., 2017), é a antocianina majoritária da líchia (JIANG, 2000) e também é encontrada em cerejeira preta (ORDAZ-GALINDO et al., 1999). É a segunda principal antocianina do açaí, representando 26 a 30% (PORTINHO et al., 2012) e reduz a toxicidade de metais pesados (WENG et al., 2017). Sua estrutura é apresentada na Figura 4, onde temos uma molécula de glicose ligada a cianidina.
Figura 4 - Estrutura molecular da cianidina-3-glicosídeo
O+
OH HO
O
O
HO
OH
OH OH OH
OH
FONTE: Autoria própria, adaptado de YAMAGUCHI et al., 2015.
2.2.2 Benefícios e aplicação das antocianinas
As antocianinas são utilizadas pelas indústrias farmacêutica e alimentícia devido aos estudos que evidenciam algumas de suas características como sua capacidade anti-inflamatória e seu potente efeito como agente quimioprotetor (TENG et al., 2017)
As indústrias de alimentos utilizam com frequência os corantes que são obtidos a partir de extratos de urucum, carmim de cochonilha, curcumina, além de diferentes antocianinas e betalaínas. A comercialização de extratos de antocianinas geralmente se dá na forma de concentrado líquido ou em pó, muitas vezes obtidos da casca de uva, cenoura, repolho roxo, groselha, entre outros. Esses extratos são aplicados na indústria de alimentos em produtos como geleias, laticínios, doces, isotônicos, refrigerantes (HAMERSKI et al., 2011).
Uma limitação do uso de antocianinas como corantes em alimentos é sua baixa instabilidade quando são submetidas a altos valores de pH, altas temperaturas e ainda na preseça de luz (NONTASAN et al., 2012)
Tabela 2- Propriedades benéficas das antocianinas
Propriedades Autores
Anticarcinogênica
KATSUBE et al., 2003; GALVANO et al., 2004; ZHAO et al., 2004; MATSUBARA et al., 2005; WANG; STONER, 2006; NETO, 2007; MAZEWSKI et al., 2017 Antiinflamatória SHIN et al., 2006; BOWEN-FORBES et al., 2010;
MIGUEL, 2011; HUANG et al., 2014
Antioxidante
KÄHKÖEN; HEINONEN, 2003; MERTENS- TALCOTT et al., 2008; STINTIZING et al., 2002;
GALVANO et al., 2004; NETO, 2007; BOWEN-FORBES et al., 2010; DIACONEASA et al., 2015 Funções visuais MATSUMOTO et al., 2003; GHOSH; KONISHI, 2007
Cardiológicas PASCUAL-TERESA et al., 2010; WALLACE, 2011; KRUGER et al., 2014
Diabetes tipo 2 e obesidade GHOSH; KONISHI, 2007; SANCHO; PASTORE, 2012; GUO; LING, 2015
2.2.3 Técnicas de extração de antocianinas
Para utilizar antocianinas, as indústrias precisam primeiramente, isolar o corante. As antocianinas localizam-se nas células próximas a superfície das plantas, o que facilita sua obtenção. Esse corante é extraído com solventes orgânicos e essa extração geralmente é realizada com soluções acidificadas de metanol, etanol, acetona e água ou com misturas desses solventes (JU; HOWARD, 2003).
Para serem eficazes, os métodos de extração devem maximizar a recuperação de antocianina com uma quantidade mínima de adjuntos e degradação ou alteração de seu estado natural (CHANDRASEKHAR et al., 2012).
de antocianinas se compararmos com outras frutas vermelhas como morango e framboesa.
Wu et al. (2011) extraíram antocianinas de amora a partir de um SAB formado por etanol ou metanol e sulfato de amônio estudando a influência da composição das fases, concentração de amostra, pH e temperatura, a fim de otimizar o comportamento da partição de antocianina e açúcares. Segundo os autores, houve separação de fases quando se utilizou etanol no sistema, o que não ocorreu com o sistema formado por metanol devido à afinidade entre a água e o metanol. As condições ótimas foram de 20% m/m de sulfato de amônio, 30% m/m de etanol, 10% m/m de suco de amora, pH 4,5 e temperatura do sistema de 35 °C. Sob essas condições, 85,1% das antocianinas do suco de amora foram particionadas para a fase superior rica em etanol e 89,5% dos açúcares foram particionados para a fase inferior, rica em sulfato de amônia. Os autores compararam a extração por SAB com extração convencional com uma solução de etanol 80% e 0,01% de ácido clorídrico e que com SAB, foi necessário uma única etapa de extração, com maior recuperação de antocianinas (rendimento de 1,8% de antocianinas com extração convencional e 2,7% de antocianinas com SAB) e maior redução de açúcares (0,9 g de glicose/extrato seco com extração convencional e 0,3 g de glicose/extrato seco com SAB), além de tempo menor de extração.
Chandrasekhar et al. (2012) realizaram um estudo de extração e purificação de antocianinas de repolho roxo. A extração com uma mistura 50% v/v de etanol/água acidificada rendeu o maior conteúdo de antocianinas, de 390,6 mg.L-1. Adsorção foi utilizada para a purificação de metabólitos secundários. Para purificação de antocianinas, os autores realizaram adsorção com alguns adsorventes diferentes - Amberlite XAD7HP, Amberlite XAD4,Amberlite IRC 80, Amberlite IRC 120 e Dowex 50WX8. Amberlite XAD-7HP apresentou a maior capacidade de adsorção (0,84 mg.mL-1 de resina).
Truong et al. (2012) otimizaram as condições de extração de antocianinas da batata doce através da extração com líquido pressurizado. Os autores encontraram os maiores valores de rendimentos de antocianinas com uma mistura de ácido acético: metanol: água de 7:75:18% v/v, peso da amostra maior que 0,5 g e temperatura de 80 a 120 °C.
reduz o tempo de extração, possui boa reprodutibilidade, além da manipulação da amostra para a análise ser mínima. A utilização de MAE na extração de polifenóis exige otimização do processo em relação aos parâmetros operacionais como temperatura e tempo de irradiação. Para antocianinas, são exigidas temperaturas mais baixas e menor tempo de exposição às microondas. Em comparação com a extração convencional, MAE obteve maior concentração de antocianinas em menor tempo de extração.
Em estudo realizado por Alessandro et al. (2014) a respeito da influência do tempo de extração, temperatura, composição do solvente e energia de ultrassom sobre o rendimento de antocianinas e polifenóis e a capacidade antioxidante dos extratos, os autores verificaram que alta temperatura e alto teor de etanol melhoraram o rendimento da extração assitida por ultrassom. O extrato obtido da aronia através da extração assistida por ultrassom obteve um alto teor de atividade antioxidante e pode ser utilizado na indústria de alimentos e cosméticos.
Liu et al. (2013) extraíram antocianinas de batata doce através de um sistema aquoso bifásico composto por etanol e sulfato de amônio e utilizaram a metodologia de superfície de resposta para otimizar o processo. O rendimento foi de 90,02% m/m de antocianinas sob condições ótimas de processo. Essas condições foram: concentrações de etanol e sulfato de amônia a 25 e 22% m/m, respectivamente e pH 3,3.
Wu et al. (2014) utilizaram dois sistemas aquosos bifásicos para extração e purificação preliminar de antocianinas de suco de uva: um composto por etanol e sulfato de amônia e outro composto por etanol e fosfato monossódico. Os autores observaram que o SAB formado por etanol e fosfato monossódico foi mais adequado para a extração e purificação preliminar das antocianinas e que as condições ótimas para trabalharem foi com 28% m/m de NaH2PO4, 25% m/m de etanol, 1 mL de suco de uva, sem ajuste de pH, temperatura de 25° C durante 1 hora e que, sob essas condições, mais 90% das antocianinas do suco de uva permaneceram na fase superior rica em etanol e mais de 90% de açúcares totais foram removidos após uma segunda extração. Também realizaram um estudo de aumento de escala e foi verificado que o sistema é viável e eficiente para extração de antocianinas de suco de uva.
2.3 Extração líquido-líquido
dos componentes da mistura e miscível ou parcialmente miscível com o outro componente, ocorre pelo menos uma separação parcial dos componentes da alimentação, o que denominamos de extração líquido-líquido ou extração por solvente. Se os componentes da solução original se distribuírem entre as duas fases, vai resultar em um certo grau de separação e este pode ser melhorado aumentando-se o número de estágios (TREYBALL, 1980, p. 477 ; SEADER et al., 2011, p. 299).
Na extração líquido-líquido, a solução a ser extraída é denominada de alimentação e denominamos de solvente o líquido com o qual a alimentação entra em contato. Chamamos de extrato a fase rica em solvente ou no composto de interesse e de rafinado o líquido residual cujo soluto foi removido (TREYBALL, 1980, p. 477).
A extração líquido-líquido é utilizada quando outras operações de separação como destilação ou evaporação se tornam mais caras do que ela, para substituir métodos químicos com alto consumo de reagentes e quando outros métodos de separação não são possíveis. Por exemplo, quando os componentes possuem pesos moleculares aproximados e não é possível a separação por destilação, como no caso de hidrocarbonetos aromáticos e paraníficos, que possuem pressão de vapor muito parecida, mas que podem ser separados por uma vasta variedade de solventes (TREYBALL, 1980, p. 478).
2.3.1 Escolha do solvente
A base da extração líquido-líquido é a separação de um soluto específico de outros materiais através da transferência seletiva para o solvente de extração, por isso o mesmo deve ter afinidade seletiva pelo soluto (BLACKADDER; NEDDERMAN, 2004).
Apesar de existir uma grande variedade de líquidos que podem ser utilizados como solvente extrator, nem todos irão apresentar todas as características desejadas para a operação, porém algumas delas são consideradas desejáveis, o que acaba por tornar a escolha do solvente um fator de operação muito importante (TREYBALL, 1980, p. 488; SEADER et al., 2011, p. 309).
𝛽 = (𝑥𝐴)𝑇
(𝑥𝐴)𝐹
⁄
(𝑥𝐶)𝑇
(𝑥𝐶)𝐹
⁄ (1)
em que x1 é a fração molar do componente 1 e x2 é a fração molar do componente 2, T é a fase topo e F a fase fundo. A seletividade deve exceder a unidade, senão, a separação não será possível.
A relação entre as concentrações de soluto nas fases superior e inferior é denominada de coeficiente de partição ou de distribuição e é definido de acordo com a Equação 2. Quanto maior for o valor do coeficiente de partição, menor será a quantidade de solvente necessária para se realizar a extração.
F T
C C
K (2)
em que CT é a concentração de soluto na fase topo e CF é a concentração de soluto na fase fundo.
O solvente deve ser o mais solúvel possível no soluto, porque se a solubilidade for pequena, não terá uma boa capacidade de extração e será necessária uma maior quantidade de solvente, o que acaba por deixar a operação mais cara e deve ser possível de se recuperar para reutilizá-lo em outras operações e isso é feito a partir de outra operação de transferência de massa.
A densidade dos líquidos deve ser diferente para que ocorra a separação e quanto maior for essa diferença, melhor para que ocorra a separação das fases e a alta tensão interfacial facilita a coalescência, dificultando assim, a dispersão de um líquido no outro. Além disso, devem apresentar baixa viscosidade e baixa pressão de vapor para melhor manuseio e armazenamento.
O solvente deve ser quimicamente estável e inerte, para que não haja a formação de subprodutos indesejáveis entre o solvente e os outros componentes da mistura, ser atóxico e não inflamável, a fim de facilitar seu manuseio e estarem disponíveis a baixo custo se possível.
através do site da Sigma-Aldrich (acesso em 11 de novembro de 2016; www.sigmaaldrich.com).
Tabela 3- Valores em reais (R$) dos componentes formadores de fase Componente Unidade Custo (R$)
Etanol 1 L 125,00
1-Propanol 1 L 77,00
2-Propanol 1 L 242,00
PEG 4000 1 Kg 982,00
PEG 6000 1 Kg 531,00
PEG 8000 1 Kg 950,00
PEG 10000 1 Kg 410,00
Sulfato de amônio 1 Kg 439,00
Sulfato de magnésio 1 Kg 480,00
Sulfato de sódio 1 Kg 657,00
2.4 Sistemas aquosos bifásicos
2.4.1 Sistemas aquosos bifásicos
(CLÁUDIO et al., 2010; ZAFARANI-MOATAR; HAMZEHZADEH, 2011; ALMEIDA et al., 2014), acetonitrila e açúcares (CARDOSO et al., 2013) e acetonitrila e poliois (CARDOSO et al., 2014).
A base da separação em um sistema aquoso bifásico é a distribuição seletiva das substâncias entre as duas fases. Ao alterar a composição de um sistema de fases, as moléculas podem ser distribuídas mais em uma fase do que em outra. Moléculas menores são distribuídas uniformemente entre as fases, enquanto que moléculas maiores são particionadas em uma única fase (TJERNELD et al., 1984; HAITI-KAUL, 2000).
O alto conteúdo de água em cada fase faz com que os SABs sejam um ambiente favorável para a preservação de biomoléculas lábeis, e, além disso, possui baixa tensão interfacial, o que favorece a migração de biomoléculas através da interface o que possibilita um aumento de escala linearmente em até 104 vezes, facilitando suas aplicações industriais (PÉREZ et al., 2013).
SAB é uma técnica de separação e purificação de vários compostos e biomoléculas cujas principais vantagens são sua versatilidade, alta eficiência, alto rendimento, seletividade, simplicidade tecnológica e baixo custo, além de sua rápida transferência de massa (MALPIED et al., 2009; CLÁUDIO et al., 2010). Tem sido utilizado para extração e purificação de biomoléculas como antibióticos (BORA et al., 2005; MOKHTARANI et al., 2008), vanilina (CLÁUDIO et al., 2010; CARDOSO et al., 2013), aminoácidos (WYSOCZANSKA; MACEDO, 2016), proteínas (MERCHUCK et al., 1998; SARAVANAN et al., 2008), enzimas (VENTURA et al., 2012; RAMAKRISHNAN et al., 2016) e antocianinas (WU et al., 2011; LIANG et al., 2012; HUA et al., 2013; WU et al., 2014; CHANDRASEKHAR; RAGHAVARAO, 2015; JAMPANI; RAGHAVARAO, 2015a e JAMPANI; RAGHAVARAO, 2015b)
for a área acima da curva binodal, menor será a quantidade requerida dos componentes formadores do sistema para que ocorra a separação de fases. As linhas de amarração ou
tie-lines conectam dois pontos na curva binodal que representam uma determinada composição global do sistema e que fornece a composição das duas fases em equilíbrio. Todas as misturas cuja composição global seja representada por pontos, presentes na mesma linha de amarração, resultarão em duas fases, uma topo e uma fundo, cujas propriedades termodinâmicas intensivas são iguais (composição) e propriedades extensivas são diferentes (volume). O ponto crítico é o ponto no qual a composição e o volume das fases topo e fundo são iguais (ZASLAVSKY, 1995, p. 78; HAITI-KAUL, 2000, p. 11).
Figura 5 - Diagrama de fase para sistema aquoso bifásico expresso em coordenadas retangulares
FONTE: Autoria própria, adaptado de SILVA; LOH (2006).
Um parâmetro termodinâmico muito importante é o comprimento da linha de amarração (CLA). Nos processos de partição de solutos em SABs, o CLA geralmente é utilizado como variável determinante e é dado pela Equação 3:
𝐶𝐿𝐴 = [(𝐶𝑃𝑇− 𝐶𝑃𝐹0)
2
+ (𝐶𝑆𝑇− 𝐶𝑆𝐹0)
2
]1⁄2 (3)
Região monofásica
Linha de amarração
Ponto crítico
Curva binodal
Região bifásica
Com
po
nen
te
2 (%)
Componente 1 (%)
onde, CP e CPo são as concentrações final e inicial, respectivamente, do componente 1, CS e CSo são as concentrações final e inicial, respectivamente, do componente 2 e os sobrescritos S e I representam a fase superior e a fase inferior, respectivamente. O aumento do CLA torna maior a diferença na composição entre as fases, o que pode melhorar a eficiênica da extração e/ou partição do soluto de interesse no SAB (SILVA; LOH, 2006; MAGESTE et al., 2009).
A inclinação da linha de amarração (ILA) pode dar a medida de como a composição das fases pode variar alterando-se uma propriedade físico-química, como a temperatura e é calculada pela Equação 4:
𝐼𝐿𝐴 =(𝐶𝑃−𝐶𝑃0)
(𝐶𝑆−𝐶𝑆0) (4)
Num diagrama de fases, o ponto crítico (PC) é o ponto no qual as propriedades físico-químicas (composição e volume, dentre outras) das duas fases são iguais. Quanto mais próxima a composição do sistema está do ponto crítico, menor é a diferença entre as fases. Pequenas alterações na composição nas proximidades do ponto crítico provocarão mudanças, levando o sistema de uma fase para duas e vice-versa (ZASLAVSY, 1995, p. 81).
2.4.2 Fundamentos termodinâmicos sobre a formação dos SABs
Quando uma fase líquida homogênea se separa em duas fases líquidas parcialmente miscíveis ( e ), cada componente i poderá estar presente em cada uma das fases. A isso denominamos equilíbrio líquido-líquido. Um sistema está em equilíbrio quando possui uma energia mínima de Gibbs a temperatura e pressão constantes.
Ti = Ti = ... = Ti; Pi = Pi = ... = Pi; µi = µi = ... = µi;
em que o subescrito i representa os componentes das fases e os sobrescritos , e representam as fases do sistema em equilíbrio (PRAUSNITZ et al., 1986, p. 245; SMTIH et al., 2007, p. 434).
O equilíbrio de fases descreve como um determinado componente se distribui entre as fases de um sistema quando este possui mais de uma fase. Gibbs introduziu o conceito de potencial químico para o equilíbrio termodinâmico relacionando-o a propriedades mensuráveis como temperatura, pressão e composição (PRAUSNITZ et al., 1986, p. 17).
A energia de Gibbs (G) é uma combinação das primeira e segunda lei da termodinâmica e nos mostra a direção em que o processo irá ocorrer ou a quantidade de trabalho necessária para que ele ocorra. Determinando-se G para cada fase de um sistema, estabelecemos quando estas fases coexistem em equilíbrio. A energia de Gibbs é dada pela Equação 5 e de acordo com ela, a variação de energia a qualquer pressão constante, possui duas contribuições:
S T H
G
(5)
em que H é a entalpia, T é a temperatura e S é a entropia.
A combinação da primeira e da segunda lei da termodinâmica nos leva a Equação 6:
dGi T,P0 (6)
o que nos diz que para um processo espontâneo, a pressão e temperatura constantes, a energia de Gibbs sempre diminui, portanto, podemos dizer que quando uma mistura líquida se separa em duas fases líquidas sua energia de Gibbs foi minimizada (COOPER, 1999; KORETSKY, 2014, p. 228).
distribuição. Essa distribuição depende das caracteríticas da biomolécula que vai se distribuir (massa molar, carga, hidrofobicidade superficial) e das características do SAB utilizado para a partição, como os reagentes, massa molar, pH, concentração e força iônica. O coeficiente de partição do soluto depende principalmente, do sistema de fase escolhido (do seu diagrama de fases), da concentração do soluto, da temperatura e do pH (CHAIWUT et al., 2010).
Para que ocorra uma extração significativa, a biomolécula de interesse deve ser particionada, preferencialmente, em uma das fases enquanto que as biomoléculas interferentes ao processo devem migrar para a outra fase contida no sistema (OLIVEIRA et al., 2001).
A separação de fase depende do grau de polimerização dos componentes formadores de fases, da temperatura e da massa molecular do soluto. As contribuições entálpicas e entrópicas em Kp são explícitas de forma a permitir a interpretação direta das energias dominantes de partição num determinado sistema bifásico (JOHANSSON et al.,1998).
2.4.3 Parâmetros que afetam a partição de solutos em SAB
Alguns parâmetros como massa molar do polímero, tipo de sal, temperatura e pH afetam a partição de solutos em sistemas aquosos bifásicos.
2.4.3.1 Influênica da massa molar do polímero
fases. Por exemplo, o aumento da massa molar de proteínas faz com que ocorra uma diminuição no coeficiente de partição (PESSOA JR; KILIKIAM, 2005, p. 118).
2.4.3.2Influência do tipo de sal
Ânions com maior valência possuem maior capacidade de causar o efeito
salting-out do que ânions com menor valência devido ao fato deles se hidratarem melhor em água, diminuindo assim, a água disponível para hidratar o polímero (ANANTHAPADMANABHAN; GODDARD, 1987; ZAFFARANI-MOATTAR; SADEGHI, 2001).
Segundo Ananthapadmanabhan e Goddard (1987), a capacidade dos ânions em formar SAB com PEG ocorre na seguinte ordem PO4-3 > SO4-2 > OH-. A solubilidade de biomoléculas na fase rica em sal (fase fundo) diminui com o aumento da concentração de sal no sistema, aumentando a partição da biomolécula na fase topo devido ao efeito salting-out (BABU et al., 2008).
2.4.3.3Influência da temperatura
Um aumento da temperatura faz com que aumente a concentração de pelo menos um dos componentes do sistema para que se formem as duas fases. Isso ocorre porque o aumento da temperatura desfaz a estrutura da água (ZASLAVSKY, 1995, p. 99).
2.4.3.4 Influência do pH
2.4.4 Sistemas aquosos bifásicos polímero/sal ou álcool/sal
Sais são capazes de formar sistema aquoso bifásico com polímeros, líquidos iônicos e álcoois hidrofílicos devido ao efeito salting-out.
No efeito salting-out, substâncias solúveis em água são excluídas da fase aquosa pela adiçãode sal. Isso ocorre devido a interações entre eletrólitos e não-eletrólitos, onde os não-eletrólitos se tornam menos solúveis em água quando se aumenta a concentração de sais (ZASLAVSKY, 1995, p. 32).
O efeito salting-out faz os sais competirem com os outros componentes formadores de fase pelas moléculas de água, o que leva a separação do sistema em duas fases (WANG et al., 2010). E, além disso, a solubilidade das biomoléculas na fase rica em sal diminui com o aumento da concentração de sal (BABU et al., 2008).
2.4.4.1 Sistemas aquosos bifásicos polímero/sal
Sistemas aquosos bifásicos compostos por polímeros/polímeros, como PEG/dextrana são de alto custo, principalmente para realizar aumento de escala, por isso a utilização de polímeros/sais para formar SABs.
SABs formados por polímero/sal possuem a vantagem de apresentarem menor custo, maior diferença de densidade, o que facilita a separação de fases, maior seletividade e de mais fácil aumento de escala, devido à baixa viscosidade dos sais (MALPIED et al., 2008; OLIVEIRA et al., 2008).
Em cada monômero de uma molécula de PEG contém um átomo de oxigênio com pares de elétrons livres para a interação com os cátions presentes nos sais. A mistura de soluções de polímeros e cátions promove a interação entre estas espécies, fazendo com que os cátions liberem moléculas de água que antes estavam solvatando-os. Esse processo é dirigido pelo aumento da entropia. Quando este aumento cessa, o sistema se separa em duas fases.
Portanto, a fase rica em polimero contém cátion interagindo com o polímero, formando complexos entre os cátions e os pares de elétrons livres dos átomos de oxigênio, o que contribui para uma estabilização da biomolécula na fase rica em polímero (SILVA; LOH, 2000).
2.4.4.2 Sistemas aquosos bifásicos álcool/sal
Soluções aquosas de álcoois alifáticos e sais inorgânicos são imiscíveis em certas concentrações e irão formar duas fases líquidas. São de custo mais baixo do que os sistemas formados por polímeros/polímeros e polímeros/sais, possuem baixa viscosidade, ocorre rápida separação das fases, possuem baixa toxicidade, pouca interferências com os analitos, de simples operação, fáceis de remover dos extratos obtidos, possuem baixa tensão interfacial, apresentam alto rendimento e tem a vantagem da facilidade do aumento de escaladevido ao alto custo dos polímeros e pela dificuldade de separar a biomolécula da fase polimérica (TABATA et al., 1994; LIU et al., 2006; LIU et al., 2013).
Sais são utilizados em sistemas aquosos bifásicos devido ao seu efeito
salting-out, uma vez que a adição de eletrólitos faz com que ocorra a diminuição da solubilidade de solventes orgânicos como etanol, propanol e acetonitrila, nas moléculas de água (TABATA et al., 1994; LIU et al., 2006). Ou seja, a diferença nas forças de atuação entre os pares íons-água e álcool-água leva a exclusão do álcool ou a cristalização do sal (WANG et al., 2010).
Os álcoois de cadeia curta como etanol, metanol, 1-propanol e 2-propanol tem sido utilizados na formação de sistemas aquosos bifásicos com sais inorgânicos uma vez que suas estruturas são adequadas para compostos hidrofílicos e por formarem sistemas aquosos bifásicos estáveis devido ao efeito salting-out e a baixa solubildade desses sais nesses álcoois (LIU et al., 2013).
Etanol, 1-propanol e 2-propanol se dissolvem em água devido às interações das ligações de hidrogênio. Quando sais capazes de separar fases são adicionados a esses álcoois, as interações íon-dipolo vão fazer com que ocorra a hidratação dos íons e assim, os sais irão se dissolver nestes álcoois.
Sulfato de amônio tem sido utilizado para formar sistema aquoso bifásico com álcoois hidrofílicos por apresentar baixa acidez em soluções aquosas, o que torna apropriado para a separação de biomoléuclas (WANG et al., 2010).
2.4.5 Sistemas aquosos bifásicos e antocianinas
Os sistemas aquosos bifásicos têm sido utilizados na partição/extração de antocianinas devido às limitações que os métodos convencionais de extração apresentam.
Um desses métodos de extração é por meio de misturas aquosas de solventes orgânicos como etanol, metanol e acetona, que demandam uma grande quantidade destes solventes.
Outros métodos como extração por solventes pressurizados, extração a alta pressão hidrostática, extração assistida por microondas, extração por ultrassom e extração com fluido supercrítico possuem limitações devido aos equipamentos exigidos e condições de operações como alto gasto de energia e alto custo para a produção em larga escala (WU et al., 2011; LIU et al., 2013; WU et al., 2014).
Tabela 4 - Sistemas aquosos bifásicos aplicados para a partição de antocianinas
Matéria-prima SAB Antocianinas AUTORES
Uva
Acetato de 1-etil-3metilimidazoli + carbonato de potássio ou fosfato
tripotássico
Cianidina-3-O-glicosídeo, Malvidina-3-O-glicosídeo,
Peonidina-3-O-glicosídeo Lima et al.,2017
Inhame da Índia Etanol + sulfato de amônio - Yin et al., 2017
Jambolão PEG 6000 + sulfato de magnésio Cianidina-3-glicosídeo Chandrasekhar;
Raghavarao, 2015 Repolho roxo PEG 4000 + sulfato de magnésio Derivadas da cianidina-3-glicosídeo Raghavarao, 2015b Jampani; Repolho roxo PEG 4000 + sulfato de magnésio Derivadas da cianidina-3-glicosídeo Raghavarao, 2015a Jampani;
Suco de uva Etanol + fosfato monossódico Malvidina-3-O-glicosídeo Wu et al., 2014
Vaccinium
uliginosium Etanol + sulfato de amônio - HUA et al., 2013
Batata doce Etanol + sulfato de amônio Formas monoacetiladas e diacetiladas de cianidinas e
peonidinas Liu et al., 2013
Amora Etanol + sulfato de amônio - Liang et al., 2012
Amora Etanol + sulfato de amônio
Cianidina-3-glicosídeo; Cianidina-3-rutinosídeo; Delfinina-3-malonoiglicosídeo; Delfinina-3-rutinosídeo;
Peonidina-3-xiloseraminosídeo