CENTRO DE CIÊNCIAS
DEPARTAMENTO DE ORGÂNICA E INORGÂNICA CURSO DE PÓS-GRADUAÇÃO EM QUÍMICA
FRANCISCO CARLOS DE OLIVEIRA
ESTUDO DE INVESTIGAÇÃO QUÍMICA DA ESPÉCIE
Lippia rigida
Schauer (VERBENACEAE)
ESTUDO DE INVESTIGAÇÃO QUÍMICA DA ESPÉCIE
Lippia rigida
Schauer (VERBENACEAE)
Dissertação submetida à Coordenação do Programa de Pós-Graduação em Química, da Universidade Federal do Ceará, como requisito parcial para obtenção do Título de Mestre em
Química com Área de
Concentração em Química Orgânica.
Orientador: Prof. Dr. Francisco Geraldo Barbosa
A Deus, por me conceder disposição, força, saúde, amor, paz e fé para superar os obstáculos da vida.
À minha amada esposa Elieuda, que sempre com muito amor e carinho, me incentivou para a realização deste trabalho, simplesmente muito obrigado.
AGRADECIMENTOS
A Deus, por estar sempre comigo, me orientando e auxiliando em todos os momentos da minha vida.
Ao meu orientador Prof. Dr. Francisco Geraldo Barbosa, pela orientação, dedicação, atenção, sugestões e muitos conhecimentos que foram transmitidos, que foram fundamentais para a realização deste trabalho.
Aos colegas do LABFITO (Carol Luz, Diana Kelly, Roberta, Marlon, Keyline e Darlan), pela amizade.
Ao Prof. Jair Marfezoli, pela ajuda nas determinações estruturais.
Aos colegas e amigos de Pós-graduação: Felipe, Duvilardo, João Vitor, Max, Luciana, Irvila, Diego, Paula, Bruno, Carol, Daniele, Afonso, entre outros.
À Profa. Dra. Mary Ane pela disponibilidade do equipamento de CLAE e a Antonia pela ajuda na operação do mesmo.
Ao Prof. Dr. Edilberto pela coleta da planta e disponibilidade dos equipamentos de RMN do CENAUREMN.
Aos operadores dos equipamentos RMN: Elton, Regivaldo e Prof. Dr. Daniel, pela obtenção dos espectros de RMN.
Ao André pela obtenção dos espectros de massa.
À Profa. Dra. Jane Eire pela realização dos ensaios de atividade de inibição da enzima acetilcolineterase.
À Profa. Dra. Givandete pela realização dos ensaios de atividade larvicida.
À Profa. Dra. Telma e doutoranda Cleane pela realização dos ensaios de atividade antioxidante.
À Profa. Dra. Leticia pela realização dos ensaios de atividade anticâncer.
Aos funcionários da UFC (Raimunda – “Mundinha”, Aurilana – “Lana”, Sr. Paulo, Célia e Orlando).
À Doutoranda Renata e ao Mestrando Fábio pela realização dos ensaios de atividade antibacteriana.
SUMÁRIO
LISTA DE ABREVIATURAS, SÍMBOLOS E SIGLAS... 9
LISTA DE FIGURAS... 11
LISTA DE TABELAS... 16
LISTA DE FLUXOGRAMAS... 19I RESUMO... 20
ABSTRACT... 21
1INTRODUÇÃO... 22
2. COSIDERAÇÕES BOTANICAS... 24
2.1 Considerações botânicas sobre a família Verbenaceae... 24
2.2 Considerações sobre o gênero Lippia... 24
2.3 Considerações sobre a espécie Lippia rigida... 25
3 - LEVANTAMENTO BIBLIOGRAFICO... 27
3.1 - Levantamentos do potencial biológico do gênero Lippia...... 27
3.2 Flavonóides: no gênero Lippia dispersão e atividades biológicas... 35
3.3 Flavonóides e atividade anticâncer... 48
3.4 Flavonóides e inibição da enzima acetilcolinesterase... 53
3.5Flavonóides com atividade antioxidantes... 55
3.6Flavonóides com atividade antibacteriana... 61
3.7 Flavonóides com potencial antifúngicos... 65
3.8 Flavonóides com atividade de citotoxicidade... 68
3.9 Estruturas química dos flavonóides relatados na literatura com atividade anticâncer, inibição da enzima acetilcolinesterase, antioxidante, antibacteriana, antifúngica e citotoxicidade... 71
4.1Determinação estrutural dos metabólitos secundário isolados das folhas de L.
rigida... 88
4.1.1 Determinação estrutural de LEF-1... 88
4.1.2 Determinação estrutural de LEF-2... 97
4.1.3 Determinação estrutural de LEF-3……….... 104
4.1.4 Determinação estrutural de LEF-4……….... 111
4.1.5 Determinação estrutural de LEF-5……….... 119
4.1.7 Determinação estrutural de LDF-1………... 126
4.1.8 Determinação estrutural de LDF-2………... 133
4.1.9 Determinação estrutural de LDF-3………... 139
4.1.10 Determinação estrutural de LEC-1………... 145
4.2 Caracterização da composição química do óleo essencial das folhas de L. rigida... 152 5 PROCEDIMENTO EXPERIMENTAL………... 159
5.1 Material botânico………... 159
5.2 Métodos cromatográficos………... 159
5.2.1 Cromatografia de adsorção………...... 159
5.2.2 Cromatografia Líquida de Alta Eficiência (CLAE)... 160
5.3 Métodos físicos... 160
5.3.1 Ponto de fusão... 160
5.3.2 Rotação óptica [α]D... 160 5.4 Métodos espectrométricos e espectroscópicos... 161
5.4.1 Espectroscopia de ressonância magnética nuclear (RMN)... 161
5.4.2 Espectroscopia de absorção na região do infravermelho (IV)... 161
5.5 Estudo dos constituintes não voláteis de L. rigida... 162
5.5.2 Fracionamento cromatográfico do extrato etanólico das folhas de L. rigida
(LEF)... 162
5.5.3 Fracionamento cromatográfico do extrato etanólico das folhas de L. rigida (LEC)... 163 5.5.4 Fracionamento cromatográfico da fração LEFD e isolamento de LEF-1 e LEF-2... 163
5.5.5 Fracionamento cromatográfico da fração LEFA e isolamento de LEF-3, LEF-4 e LEF-5... 166
5.5.6 Obtenção do óleo essencial e decocto das folhas de Lippia rigida... 169
5.5.7 Análise química do óleo essencial por CG-EM e CG-DIC... 170
5.5.8 Fracionamento por extração líquido-líquido de LDF... 171
5.5.9 Fracionamento cromatográfico da fração LDFA e isolamento de LDF-1, LDF-2 e LDF-3... 171
5.5.10 Fracionamento Cromatográfico da fração LECA e isolamento de LEC-1... 174
6 ATIVIDADES BIOLÓGICAS... 178
6.1 Ensaio de atividade de citotoxicidade in vitro frente à linhagem de células cancerígenas... 178 6.2 Ensaio de atividade larvicida com o óleo essencial das folhas de L. rigida... 179
6.3 Ensaio de atividade inibitória da enzima acetilcolinesterase... 180
6.4 Ensaio de atividade toxicidade frente Artemia salina... 181
6.5 Ensaio de atividade antioxidante... 182
6.6 Ensaio de atividade nematicida... 183
6.7 Ensaio de atividade antibacteriana... 183
7 CONSIDERAÇÕES FINAIS... 185
LISTA DE ABREVIATURAS, SÍMBOLOS E SIGLAS
OMS Organização Mundial de Saúde
IV Inflavermelho
RMN 1H Ressonância Magnética Nuclear de Hidrogênio RMN 13C Ressonância Magnética Nuclear de Carbono-13 EM-IE Espectrometria de Massa por Impacto Eletrônico
p.f Ponto de fusão
LEF Extrato Etanolico das Folhas
[α]D Rotação óptica
KBr Brometo de Potássio
J Constante de Acoplamento
δ Deslocamento químico
d Dubleto
dd Duplo dubleto
Hz Hertz
s Singleto
COSY Correlated Spectroscopy
DEPT Distortionless Enhancement by Polazation Transfer HSQC Heteronuclear Single Quantum Coherence
HMQC Heteronuclear Multiple Quantum Coherence
BB Broad Band decoupling
1D Unidimensional
2D Bidimensional
m Multipleto
LEFD Fração Diclorometano do Extrato Etanolico das Folhas de Lippia rigida
LEFA Fração Acetato de Etila do Extrato Etanolico das Folhas de Lippia rigida
LDFA Fração Acetato de Etila do Decocto das Folhas de Lippia rigida
LECA Fração Acetato de Etila do Extrato Etanolico do Caule de Lippia rigida
IK Indice Kolvats
CG-DIC Cromatografia Gasosa acoplado a Detector por Ionização de Chama CG-MS Cromatografia Gasosa acoplado a Espectrometria de Massa
ALCA Herbário Alexandre Leal Costa
Rf Índice de Retenção
CLAE Cromatografia Líquida de Alta Eficiência
CENAUREMN Centro Nordestino de Aplicação e Uso da Ressonância Magnética Nuclear
Θ Ângulo de nutação
LHF Extrato Hexanico das Folhas de Lippia rigida
LHC Extrato Hexanico do Caule de Lippia rigida
LEF Extrato Etanolico das Folhas de Lippia rigida
LEC Extrato Etanolico do Caule de Lippia rigida
LEFH Fração Hexano do Extrato Etanolico das Folhas de Lippia rigida
LEFM Fração Metano do Extrato Etanolico das Folhas de Lippia rigida
LECH Fração Hexano do Extrato Etanolico do Caule de Lippia rigida
LECD Fração Diclorometano do Extrato Etanolico do Caule de Lippia rigida
LECM Fração Metano do Extrato Etanolico do Caule de Lippia rigida
LDF Decocto das Folhas de Lippia rigida
OEFLR Óleo Essencial das folhas de Lippia rigida
ºC/min Grau Celsius por Minuto
eV ElétronVolt
LDFD Fração Diclorometano do Decocto das Folhas de Lippia rigida
LDFB Fração Butanol do Decocto das Folhas de Lippia rigida
MTT 3-(4,5-dimetil-2-tiazolil)-2,5-difenil-2H-brometo tetrazolina DMSO Dimetilsulfóxido
AChE Acetilcolinesterase
DTNB Ácido 5,5’-ditiobis-(2-nitrobenzóico) DPPH 1,1-Difenil-2-picrilhidrazil
LISTA DE FIGURAS
Figura 1 – Fotos de L. rigida em seu local de coleta. Planta inteira – A; folhas – B; inflorescência – C... 26 Figura 2 - Estrutura básica de um flavonóides... 35 Figura 3 - Flavonóides isolados de plantas do gênero Lippia... 36 Figura 4 - Gráfico representando a distribuição de flavonóides com atividade anticâncer, registrado na literatura...
52
Figura 5 - Gráfico representando a distribuição de flavonóides com atividade inibição da enzima acetilcolinesterase, registrado na literatura...
55
Figura 6 – Gráfico representando a distribuição de flavonóides com atividade antioxidante, registrado na literatura...
61
Figura 7 - Gráfico representando a distribuição de flavonóides com atividade antibacteriana, registrados na literatura...
65
Figura 8 - Gráfico representando a distribuição de flavonóides com atividade antifúngica, registrados na literatura...
68
Figura 9 - Gráfico representando a distribuição de flavonóides com atividade citotoxicidade, registrados na literatura...
70
Figura 10 - Flavonas com atividade anticâncer, inibição da enzima acetilcolinesterase, antioxidante, antibacteriana, antifúngica e citotoxicidade...
71
Figura 11 - Isoflavona com atividade anticâncer, inibição da enzima acetilcolinesterase, antioxidante, antibacteriana, antifúngica e citotoxicidade...
79
Figura 12 - Flavanonas com atividade anticâncer, inibição da enzima acetilcolinesterase, antioxidante, antibacteriana, antifúngica e citotoxicidade...
80
Figura 13 - Chalconas com atividade anticâncer, inibição da enzima acetilcolinesterase, antioxidante, antibacteriana, antifúngica e citotoxicidade...
83
Figura 14 - Biflavonóides com atividade anticâncer, inibição da enzima acetilcolinesterase, antioxidante, antibacteriana, antifúngica e citotoxicidade...
84
Figura 15 - Bicatequina com atividade antioxidante.... 85 Figura 16 - Catequinas com atividade antioxidante.... 85 Figura 17 - Diidrochalcona com atividade antioxidante... 85 Figura 18 – Isoflavanonas com atividade anticâncer, inibição da enzima acetilcolinesterase, antioxidante, antibacteriana, antifúngica e citotoxicidade...
86
Figura 20 - Flavanonois com atividade citotoxicidade.... 86
Figura 21 - Outras clases de flavonóides com atividade inbição da enzima acetilcolinesterase, antioxidante, antibacteriana, antifúngica e citotoxicidade... 87
Figura 22 – Espectro na região de infravermelho de LEF-1 (KBr)... 88
Figura 23 - Padrão de acoplamentos observados nos espectros de RMN 1H e COSY de LEF-1... 90 Figura 24 – Espectro de massa (IE, 70 eV) de LEF-1... 90
Figura 25 – Principais correlações observadas no espectro de HMBC de LEF-1... 91
Figura 26 - Estrutura química de Sakuranetina... 91
Figura 27 - Espectro de RMN 1H de LEF-1 (acetona-d6, 500 MHz)... 93
Figura 28 - Expansões do espectro de RMN 1H de LEF-1 (acetona-d6, 500 MHz)... 93
Figura 29 - Espectro de RMN 13C de LEF-1 (acetona-d6, 125 MHz)... 94
Figura 30 - Espectro de RMN 13C – DEPT 135º de LEF-1 (acetona-d6, 125 MHz)... 94
Figura 31 - Espectro de RMN 1H, 1H-COSY de LEF-1 (acetona-d6, 500 MHz)... 95
Figura 32 - Espectro de RMN 1H, 13C-HSQC de LEF-1 (acetona-d6, 500 x 125 MHz)... 95
Figura 33 - Espectro de RMN 1H, 13C-HMBC de LEF-1 (acetona-d6, 500 x 125 MHz).... 96
Figura 34 – Expansão do espectro de RMN 1H, 13C-HMBC de LEF-1 (acetona-d6, 500 x 125 MHz)... 96 Figura 35 – Espectro na região de infravermelho de LEF-2 (KBr)... 97
Figura 36 – Padrão de acoplamentos observados no espectro de RMN 1H e COSY de LEF-2... 98
Figura 37 – Principais correlações observadas no espectro de HMBC de LEF-2... 99
Figura 38 - Estrutura química de Pinocembrina... 99
Figura 39 - Espectro de RMN 1H de LEF-2 (acetona-d6, 500 MHz)... 101
Figura 40 - Expansões do espectro de RMN 1H de LEF-2 (acetona-d6, 500 MHz)... 101
Figura 41 - Espectro de RMN 13C de LEF-2 (acetona-d6, 125 MHz)... 102
Figura 42 - Espectro de RMN 1H, 13C-HSQC de LEF-2 (acetona-d6, 500 x 125 MHz)... 102
Figura 43 - Espectro de RMN 1H, 1H-COSY de LEF-2 (acetona-d6, 500 MHz)... 103
Figura 44 - Expansão do espectro de RMN 1H, 13C-HMBC de LEF-2 (acetona-d6, 500 x 125 MHz)... 103
Figura 45 - Espectro na região do infravermelho de LEF-3... 104
Figura 46 – Correlações observadas no espectro de COSY de LEF-3... 105
Figura 48 - Estrutura química de Naringenina... 106
Figura 49 - Espectro de RMN 1H de LEF-3 (acetona-d6, 500 MHz)... 107
Figura 50 - Expansão do espectro de RMN 1H de LEF-3 (acetona-d6, 500 MHz)... 108
Figura 51 - Espectro de RMN 13C de LEF-3 (acetona-d6, 125 MHz)... 108
Figura 52 - Espectro de RMN 1H, 1H-COSY de LEF-3 (acetona-d6, 500 MHz)... 109
Figura 53 - Espectro de RMN 1H, 13C-HSQC de LEF-3 (acetona-d6, 500 x 125 MHz)... 109
Figura 54 - Espectro de RMN 1H, 13C-HMBC de LEF-3 (acetona-d6, 500 x 125 MHz).... 110
Figura 55 - Expansão do espectro de RMN 1H, 13C-HMBC de LEF-3 (acetona-d6, 500 x 125 MHz)... 110
Figura 56 - Espectro na região de infravermelho de LEF-4... 111
Figura 57 – Correlações observadas no espectro de COSY de LEF-4... 112
Figura 58 – Principais correlações observadas no espectro de HMBC de LEF-4... 113
Figura 59 - Estrutura química de 7-metoxi-aromadendrina... 113
Figura 60 - Espectro de RMN 1H de LEF-4 (acetona-d6, 500 MHz)... 115
Figura 61 - Expansões do espectro de RMN 1H de LEF-4 (acetona-d6, 500 MHz)... 115
Figura 62 - Espectro de RMN 13C de LEF-4 (acetona-d6, 125 MHz)... 116
Figura 63 - Espectro de RMN 1H, 13C-HSQC de LEF-4 (acetona-d6, 500 x 125 MHz)... 116
Figura 64 - Espectro de RMN 1H, 1H-COSY de LEF-4 (acetona-d6, 500 x 500 MHz)... 117
Figura 65 - Espectro de RMN 1H, 13C-HMBC de LEF-4 (acetona-d6, 500 x 125 MHz).... 108
Figura 66 - Expansão do espectro de RMN 1H, 13C-HMBC de LEF-4 (a cetona-d6, 500 x 125 MHz)... 108
Figura 67 – Espectro na região de infravermelho de LEF-5 (KBr)... 119
Figura 68 - Espectro de massa (IE, 70 eV) de LEF-5... 121
Figura 69 - Estrutura química de Genkwanina... 121
Figura 70 - Espectro de RMN 1H de LEF-5 (piridina-d5, 500 MHz)... 122
Figura 71 - Espectro de RMN 13C de LEF-5 (piridina-d6, 500 MHz)... 123
Figura 72 - Espectro de RMN 13C – DEPT 135º de LEF-5 (piridina-d5, 125 MHz)... 123
Figura 73 – Espectro de RMN 1H, 1H-COSY de LEF-5 (piridina-d5, 500 MHz)... 124
Figura 74 - Espectro de RMN 1H, 13C-HSQC de LEF-5 (piridina-d5, 500 x 125 MHz).... 124
Figura 75 - Espectro de RMN 1H, 13C-HMBC de LEF-5 (piridina-d5, 500 x 125 MHz)... 125
Figura 76 – Espectro na região de infravermelho de LED-1 (KBr)... 126 Figura 77 - Padrão de acoplamentos observados nos espectros de RMN 1H e COSY de LDF-1...
Figura 78 - Espectro de massa (IE, 70 eV) de LED-1... 108
Figura 79 - Estrutura química de Ramnocitrina... 129
Figura 80 - Espectro de RMN 1H de LED-1 (piridina-d5, 500 MHz)... 130
Figura 81 - Espectro de RMN 13C de LED-1 (piridina-d5, 125 MHz)... 130
Figura 82 - Espectro de RMN 13C – DEPT 135º de LED-1 (piridina-d5, 125 MHz)... 131
Figura 83 - Espectro de RMN 1H, 1H-COSY de LED-1 (Piridina-d5, 500 MHz)... 131
Figura 84 - Espectro de RMN 1H, 13C-HSQC de LED-1 (piridina-d5, 500 x 125 MHz).... 132
Figura 85 - Espectro de RMN 1H, 13C-HMBC de LED-1 (piridina-d5, 500 x 125 MHz)... 132
Figura 86 - Espectro na região do infravermelho de LED-2... 133
Figura 87 - Padrão de acoplamentos observados nos espectros de RMN 1H e COSY de LDF-2... 134
Figura 88 - Espectro de massa (IE, 70 eV) de LED-2... 135
Figura 89 - Estrutura química do Canferol... 135
Figura 90 - Espectro de RMN 1H de LED-2 (acetona-d6, 500 MHz)... 136
Figura 91 - Espectro de RMN 13C de LED-2 (acetona-d6, 125 MHz)... 137
Figura 92 - Espectro de RMN 1H, 1H-COSY de LED-2 (acetona-d6, 500 MHz)... 137
Figura 93 - Espectro de RMN 1H, 13C-HSQC de LED-2 (acetona-d6, 500 x 125 MHz).... 138
Figura 94 - Espectro de RMN 1H, 13C-HMBC de LED-2 (acetona-d6, 500 x 125 MHz). 138 Figura 95 – Espectro na região do infravermelho de LDF-3 (KBr)... 139
Figura 96 - Padrão de acoplamentos observados no espectro de RMN 1H e COSY de LDF-3... 141
Figura 97 - Espectro de massa (IE, 70 eV) de LDF-3... 141
Figura 98 - Estrutura química de Quercetina... 141
Figura 99 - Espectro de RMN 1H de LED-3 (acetona-d6, 500 MHz)... 142
Figura 100 - Espectro de RMN 13C de LED-3 (acetona-d6, 125 MHz)... 143
Figura 101 - Espectro de RMN 1H, 1H-COSY de LED-3 (acetona-d6, 500 MHz)... 143
Figura 102 - Espectro de RMN 1H, 13C-HSQC de LED-3 (acetona-d6, 500 x 125 MHz).. 144
Figura 103 - Espectro de RMN 1H, 13C-HMBC de LED-3 (acetona-d6, 500 x 125 MHz). 144 Figura 104 – Espectro na região do infravermelho de LEC-1 (KBr)... 145
Figura 105 – Correlações observadas no espectro de COSY de LEC-1... 146
Figura 106 – Principais correlações observadas no espectro de HMBC de LEC-1... 147
Figura 107 - Estrutura química de Taxifolina... 148
Figura 109 - Espectro de RMN 13C de LEC-1 (acetona-d6, 125 MHz)... 149
Figura 110 - Espectro de RMN 1H, 1H-COSY de LEC-1 (acetona-d6, 500 MHz)... 150
Figura 111 - Espectro de RMN 1H, 13C-HSQC de LEC-1 (acetona-d5, 500 x 125 MHz).. 150
Figura 112 - Espectro de RMN 1H, 13C-HMBC de LEC-1 (acetona-d6, 500 x 125 MHz). 151 Figura 113 - Cromatograma da análise de OEFLR por CG/EM... 153
Figura 114 - Espectro de massa do α-pineno... 153
Figura 115 - Espectro de massa do limoneno... 154
Figura 116 - Espectro de massa do trans- -ocimeno... 15
Figura 117 - Espectro de massa do linalol... 154
Figura 118 - Espectro de massa do nerol... 154
Figura 119 - Espectro de massa do ácido Nerolico... 154
Figura 120 - Espectro de massa do acetato nerila... 154
Figura 121 - Espectro de massa do α-cubebeno... 154
Figura 122 - Espectro de massa do acetato de geranila... 155
Figura 123 - Espectro de massa do α-copaeno... 155
Figura 124 - Espectro de massa do -cariofileno... 155
Figura 125 - Espectro de massa do -cubebeno... 155
Figura 126 - Espectro de massa do E- -farneseno... 155
Figura 127 - Espectro de massa do α-humuleno... 155
Figura 128 - Espectro de massa do alloaromadendreno... 155
Figura 129 - Espectro de massa do α-amorfeno... 156
Figura 130 - Espectro de massa do germacreno-D... 156
Figura 131 - Espectro de massa do biciclogermacreno... 156
Figura 132 - Espectro de massa do -cadineno... 156
Figura 133 - Espectro de massa do δ-cadineno... 156
Figura 134 - Espectro de massa do trans-nerolidol... 156
Figura 135 - Espectro de massa do espatulenol... 156
Figura 136 - Espectro de massa do óxido de cariofileno... 167
Figura 137 - Espectro de massa do δ-cadinol... 167
Figura 138 - Espectros de massa dos compostos não identificados... 167
Figura 139 – Cromatograma de análise da fração LEFA-(36-54)-(12-27) por CLAE, em condições de fase reversa (MeOH/H2O 80μβ0, fluxo 4,5 mL/min e = β84 nm)... 168
Figura 141 - Halo de inibição do crescimento bacteriano de Pseudomonas aeruginosa
pelo método de difusão em disco... 184
LISTA DE TABELAS Tabela 1 - Plantas do gênero Lippia registradas na literatura com atividade anticâncer.... 27
Tabela 2 - Plantas do gênero Lippia registradas na literatura com atividade de inibição da enzima acetilcolinesterase... 28
Tabela 3 - Plantas do gênero Lippia registradas na literatura com atividade antioxidante. 28 Tabela 4 - Plantas do gênero Lippia registradas na literatura com atividade antibacteriana... 29
Tabela 5 - Plantas do gênero Lippia registradas na literatura com atividade antifúngica... 31
Tabela 6 - Plantas do gênero Lippia registradas na literatura com atividade citotoxicidade... 34
Tabela 7 - Relação dos flavonóides isolados de plantas do gênero Lippia... 36
Tabela 8 - Relação das estruturas dos flavonóides isolados de plantas do gênero Lippia com suas respectivas espécies... 38
Tabela 9 - Relação das atividades biológicas dos flavonóides isolados de plantas do gênero Lippia... 44
Tabela 10 - Flavonóides relatados na literatura com atividade anticâncer... 48
Tabela 11 - Flavonóides relatados na literatura com atividade de inibição da enzima acetilcolinesterase... 53
Tabela 12 - Flavonóides relatados na literatura com atividade antioxidante... 56
Tabela 13 - Flavonóides relatados na literatura com atividade antibacteriana... 62
Tabela 14 - Flavonóides relatados na literatura com atividade antifúngica... 65
Tabela 15 - Flavonóides relatados na literatura com atividade de citotoxicidade frente as larvas Artemia salina... 69 Tabela 16 – Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-BB e DEPT 135° de LEF-1... 89
Acetona-d6)... 92 Tabela 18 - Dados espectroscópicos de RMN 1H, 13C, HSQC e HMBC (acetona-d6) de LEF-2, comparados com dados da pinocembrina registrados na literatura (YENJAI et al., 2009 – CDCl3 + CD3OD)... 100 Tabela 19 - Dados espectroscópicos de RMN 1H, 13C, HSQC e HMBC (acetona-d6) de
LEF-3, comparados com a literatura (ALMEIDA et al., 2005 – acetona-d6)... 107 Tabela 20 - Dados espectroscópicos de RMN 1H, 13C, HSQC e HMBC (acetona-d6) de LEF-4, comparados com a literatura (ALMEIDA, et al., 2005 – acetona-d6)... 114 Tabela 21 – Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-BB e DEPT 135° de LEF-5... 120
Tabela 22 - Dados espectroscópicos de RMN 1H, 13C, HSQC e HMBC (piridina-d5) de LEF-5, comparados com a literatura (AGRAWAL, 1989)...
122
Tabela 23 – Padrão de hidrogenação dos carbonos determinado através da análise comparativa entre os espectros de RMN 13C-BB e DEPT 135° de LDF-1... 123 Tabela 24 - Dados espectroscópicos de RMN 1H, 13C, HSQC e HMBC (piridina-d5) de
LDF-1, comparados com a literatura (AGRAWAL, 1989)... 130 Tabela 25 - Dados espectroscópicos de RMN 1H, 13C, HSQC e HMBC (piridina-d5) de
LDF-2, comparados com a literatura (AGRAWAL, 1989)... 136 Tabela 26 - Dados espectroscópicos de RMN 1H, 13C, HSQC e HMBC (acetona-d6) de
LDF-3, comparados com a literatura (AGRAWAL, 1989)... 142 Tabela 27 - Dados espectroscópicos de RMN 1H, 13C, HSQC e HMBC (acetona-d6) de
Tabela 35 - Dados referentes ao fracionamento cromatográfico de LEFA por exclusão molecular em Sephadex LH-20... 167 Tabela 36 - Dados referentes ao fracionamento cromatográfico da LEFA-(36-54)... 167 Tabela 37 - Dados referentes ao fracionamento cromatográfico do decocto das folhas (LDF)...
171
Tabela 38 - Dados referentes ao fracionamento cromatográfico de LDFA... 172 Tabela 39 - Dados referente ao fracionamento cromatográfico de LDF-(40-49) e isolamento de LFD-1... 172 Tabela 40 - Dados referentes ao fracionamento cromatográfico de LDF-(40-49)-(22-31) e isolamento de LFD-2 e LFD-3... 173 Tabela 41 - Dados referentes ao fracionamento cromatográfico de LECA... 175 Tabela 42 - Dados referentes ao fracionamento cromatográfico de LECA-(32-61)... 175 Tabela 43 - Dados referente ao fracionamento cromatográfico de LECA-(32-61)-(18-25)... 176 Tabela 44 - Dados referente ao fracionamento cromatográfico de LECA-(32-61)-(18-25)-(31-37)... 176 Tabela 45 - Percentual de inibição do crescimento celular de amostras testadas em concentração única (50 g/mL) frente à linhagem de células tumorais HCT-8 (cólon)... 179 Tabela 46 – Medida do halo de inibição da enzima acetilcolinesterase... 181 Tabela 47 - Percentual de citotoxicidade frente as larvas de Artemia salina... 182 Tabela 48 - Resultado – Atividade antibacteriana pelo teste de difusão em disco Média e DP dos halos de inibição... 184
LISTA DE FLUXOGRAMAS
RESUMO
Este trabalho descreve o estudo de investigação química da espécie Lippia rigida Schauer (Verbenaceae), coletada no município de Muncugê, Bahia. A análise cromatográfica do extrato etanólico das folhas de L. rigida permitiu o isolamento e caracterização de 3 flavonóides do tipo flavanonas: sakuranetina, pinocembrina e 2 flavanonois: 7-metil-aromadendrina e taxifolina; 1 flavona: genkwanina; 3 flavonois: ramnocitrina, canferol e quercetina. Na determinação estrutural dos metabólicos secundários isolados, utilizou-se técnicas espectroscópicas como Infravermelho (IV) e Ressonância Magnética Nuclear de hidrogênio (RMN 1H) e de carbono-13 (RMN 13C), incluindo técnicas bidimensionais (COSY, HMBC e HSQC), além de espectrometria de massa (EM) e comparação com os dados da literatura. Embora todos os compostos isolados sejam conhecidos na literatura, o isolamento de flavonóides para a espécie L. rigida corrobora com a dispersão quimiotaxonômica desta classe para o gênero Lippia. Além disso, os compostos 7-metil-aromadendrina, ramnocitrina, genkwanina e canferol estão sendo relatados pela primeira vez para o gênero, além do mais os flavonoides 7-metil-aromadendrina e ramnocitrina estão sendo relatados pela primeira vez para a família Verbenaceae. O óleo essencial das folhas de Lippia rigida foi obtido por hidrodestilação e analisado em CG-EM e CG-DIC. Os componentes majoritários do óleo essencial foram α-humuleno (42,3%) e -cariofileno (13, 0%). O óleo foi submetido ensaio de atividade larvicida frente a larvas no estágio III do mosquito Aedes aegypti com e apresentou CL50 de 138, 97 ± 1,β g/mL. Ensaio de atividade de citotoxicidade frente a linhagens de células MDA-MB435, HCT-8 e SF-295, apresentou IC% 83,79, 86,80 e 79,41, respectivamente. A atividade de inibição da enzima acetilcolinesterase revelou com halo de inibição de 9 mm similar ao controle fisostigmina.
ABSTRACT
This paper describes the study of chemical research of the species Lippia rigida Schauer (Verbenaceae), collected in the municipality of Muncugê, Bahia. Chromatographic analysis of the ethanol extract from leaves of L. rigid allowed the isolation and characterization of flavonoid-type flavanones 3 sakuranetin, pinocembrin and naringenin 2 flavanonois 7-methyl aromadendrin and taxifolin, 1 flavone genkwanin, 3 flavonois ramnocitrin, kaempferol and quercetin. In the structural determination of secondary metabolites isolated, we used spectroscopic techniques such as infrared (IR) and hydrogen nuclear magnetic resonance (1H NMR) and carbon-13 (13C NMR), including two-dimensional techniques (COSY, HMBC and HSQC), and mass spectrometry (MS) and comparison with literature data. Although all the compounds are known in the literature, the isolation of flavonoids for the species L. rigida
chemotaxonomy corroborates dispersal of this class to the genus Lippia. Moreover, the compound 7-methyl-aromadendrin, ramnocitrina, genkwanina and kaempferol are being reported for the first time for the genus, besides the more flavonoids 7-methyl-aromadendrin ramnocitrina and are being reported for the first time for the family Verbenaceae. The essential oil of Lippia rigida leaves was obtained by hydrodistillation and analyzed in GC-MS and GC-FID. The major components of the essential oil were αhumulene (42.3%) and -caryophyllene (13,0%). The oil was subjected testing larvicidal activity against larvae in stage III of the mosquito Aedes aegypti and presented with LC50 of 138.97 ± 1.2 mg/mL. Assay of cytotoxicity activity against cell lines MDA-MB435, HCT-8 and SF-295, IC% showed 83.79, 86.80 and 79.41, respectively. The activity of inhibiting the enzyme acetylcholinesterase inhibition zone revealed with 9 mm similar to control physostigmine.
1 INTRODUÇÃO
O Brasil é o país com maior biodiversidade do mundo, apresentando cerca de 20% do número total de espécies do planeta, distribuídas nos diversos biomas (Floresta Amazônica, Cerrado, Mata Atlântica, Pantanal, Caatinga, Manguezal, etc), sendo que muitas dessas espécies são endêmicas (KATO, 2001). É estimado que existam cerca de 40 mil espécies vegetais distribuídas nos diferentes biomas brasileiros (FARNSWORTH, 1991). Todavia, o levantamento de recursos brasileiros em espécies vegetais ainda é incipiente, levando-se em conta que outras nações aceleram seus programas de química e farmacologia de produtos naturais oriundos de plantas, visando à obtenção de patentes para moléculas de interesse farmacológico derivadas destas.
A organização mundial de saúde (OMS) estima que um em cada cinco habitantes do planeta, procura assistência médica em terapias não convencionais. A utilização de plantas como fonte terapêutica para tratamento de diversas doenças é realizada em varias comunidades do mundo, principalmente na zona rural (RIBEIRO; LEITE; DANTAS-BARROS, 2005).
No Brasil, observa-se um crescimento na utilização de fitoterápicos (medicamentos obtidos utilizando-se exclusivamente matéria-prima vegetal) pela população. Dentre os fatores que poderiam explicar o aumento do uso desta terapêutica, destacam-se os avanços ocorridos na área científica que permitiram o desenvolvimento de fitoterápicos com segurança e eficácia reconhecidas, como também uma forte tendência de busca, pela população, por terapias menos agressivas destinadas ao atendimento primário à saúde (RIBEIRO; LEITE; DANTAS-BARROS, 2005).
Estudos fitoquímicos têm por finalidade conhecer os constituintes químicos de espécies de vegetais ou avaliar sua presença. Estes constituintes, que são substâncias micromoleculares resultantes do metabolismo secundário podem pertencer a diversas classes de compostos químicos voláteis e não voláteis.
eudicotiledôneas dos campos rupestres (GIULIETTI et al. 1987). Verbenaceae possui 36 gêneros e cerca 1000 espécies com distribuição pan-tropical, principalmente nos neotrópicos.
No Brasil, ocorrem 17 gêneros e aproximadamente 250 espécies, sendo 33 delas ocorrentes no cerrado. As espécies desta família possuem diversos hábitos, variando de arbustos, ervas, até, menos frequentemente, árvores e lianas (METCALFE e CHALK, 1950; SANO e ALMEIDA, 1998; JUDD, 1999; SOUZA e LORENZI, 2005).
A família Verbenaceae também é notabilizada pela diversidade de metabólitos encontrados, dentre os quais, estão flavonoides, terpenóides, esteróides, iridóides e seus glicosídeos, quinonas (COSTA, 2001), taninos, saponinas, resinas, alcalóides e naftoquinonas (PASCUAL et al., 2001).
Dentro da família Verbenaceae destaca-se o gênero Lippia, que possui grande importância econômica devido aos usos dos óleos essenciais. Além disso, muitas espécies apresentam diversas atividades farmacológicas (PASCUAL et al., 2001).
Diante da importância do gênero Lippia, este trabalho teve como objetivo principal realizar o primeiro estudo químico da espécie L. rigida. O trabalho compreendeu o isolamento, a determinação estrutural dos metabólitos secundários isolados utilizando técnicas espectrométricas de RMN de 1H e 13C (1D e 2D), IV, EM, além da determinação de p.f. e [α]D, a caracterização do óleo essencial e a investigação química e atividades biológicas.
Para facilitar a busca de informações, o trabalho está dividido em seis capítulos: Capítulo 1: Introdução, Capítulo 2: Cosiderações botânicas, Capítulo 3: Levantamento bibliográfico, Capítulo 4: Determinação estrutural e caracterização da composição química do óleo essencial das folhas de L. rigida, Capítulo 5: Procedimento experimental, Capítulo 6: Atividades biológicas, Capítulo 7: Considerações finais e Referências Bibliográfica.
2 COSIDERAÇÕES BOTÂNICAS
2.1 Considerações botânicas sobre a família Verbenaceae
Plantas da família Verbenaceae estão presentes em praticamente todos os ecossistemas terrestres, sendo uma das cinco mais importantes entre as eudicotiledôneas dos campos rupestres (GIULIETTI et al., 1987). A família Verbenaceae possui 36 gêneros e cerca 1000 espécies com distribuição pan-tropical, principalmente nos neotrópicos. No Brasil, ocorrem 17 gêneros e cerca de 250 espécies, sendo 33 delas ocorrentes no cerrado. As espécies desta família possuem diversos hábitos, variando de arbustos, ervas, até, menos frequentemente, árvores e lianas (METCALFE e CHALK, 1950; SANO e ALMEIDA, 1998; JUDD, 1999; SOUZA e LORENZI, 2005).
As espécies de Verbenaceae têm seu potencial econômico amplamente explorado, tanto como ornamentais (LORENZI e SOUZA, 2001), quanto como terapêuticas, neste último caso devido à presença de óleos essenciais. Muitos estudos atestam atividades analgésicas, antiespasmódicas, calmantes, sedativas, citostáticas, antimicrobianas, antitumorais, hepatoprotetoras, antiinflamatórias e laxativas de algumas de suas espécies (STEFANINI et al. 2002). Além dessas, análises bioquímicas recentes atestam as propriedades de Lantana camara L. como repelente de mosquitos do gênero Aedes e de Stachytarpheta cayennensis
(Rich) Vahl. como leishmanicida (DUA et al., 2003; MOREIRA et al., 2007).
As principais classes de substâncias encontradas na família são flavonóides, terpenóides, esteróides, iridóides e seus glicosídeos, quinonas (COSTA, 2001), taninos, saponinas, resinas, alcalóides e naftoquinonas (PASCUAL et al., 2001).
2.2 Considerações sobre o gênero Lippia
O gênero Lippia reúne aproximadamente 254 táxons, incluindo espécies e variedades, a maioria localizadas no Brasil, Paraguai e Argentina, havendo poucas espécies endêmicas na África. No Brasil, os principais centros de diversidade específica desse gênero estão localizados na Cadeia do Espinhaço em Minas Gerais e na Chapada Diamantina na Bahia (SALIMENA, 2002).
Brasil, sendo L. alba (Mill.) N. E. Brown e L. sidoides Cham. as espécies mais conhecidas e estudadas sob o ponto de vista químico e agronômico (PASCUAL et al., 2001; LEAL et al.,
2003; DUARTE et al., 2005).
Este gênero pode ser caracterizado por apresentar plantas arbustivas ou subarbustivas, com folhas decussadas, geralmente com indumento glandular, florescências parciais capituliformes ou espiciformes, congestas, axilares, brácteas membranáceas ou cartáceas, verdes ou coloridas, amarelas, róseas ou vináceas, ultrapassando ou não o comprimento das flores; flores sésseis, cálice comprimido, induplicado, membranáceo, inconspícuo, persistente no fruto; corola hipocraterimorfa, alva, rósea, magenta, lilás ou amarelas, tubo reto ou curvo, lábio superior ou adaxial, lábio inferior ou abaxial único, 2 lobos laterais; 4 estames; ovário monocarpelar, bilocular, 2 ovulado, estigma lateral e fruto dividido na maturidade em dois mericarpos (TRONCOSO, 1974).
Algumas propriedades medicinais atribuídas às espécies do gênero Lippia estão relacionadas à produção de óleos essenciais pelos tricomas secretores. Em Lippia, a morfologia, distribuição e frequência dos tricomas secretores e não secretores podem ser usados como caracteres taxonômicos discriminativos em nível específico (BONZANI et al.,
1997; SALIMENA, 2002).
Algumas espécies do gênero Lippia como a L. alba, apresentam a composição química de seu óleo essencial com variações quantitativas e qualitativas, levando à classificação de diferentes quimiotipos.
2.3 Considerações sobre a espécie Lippia rigida
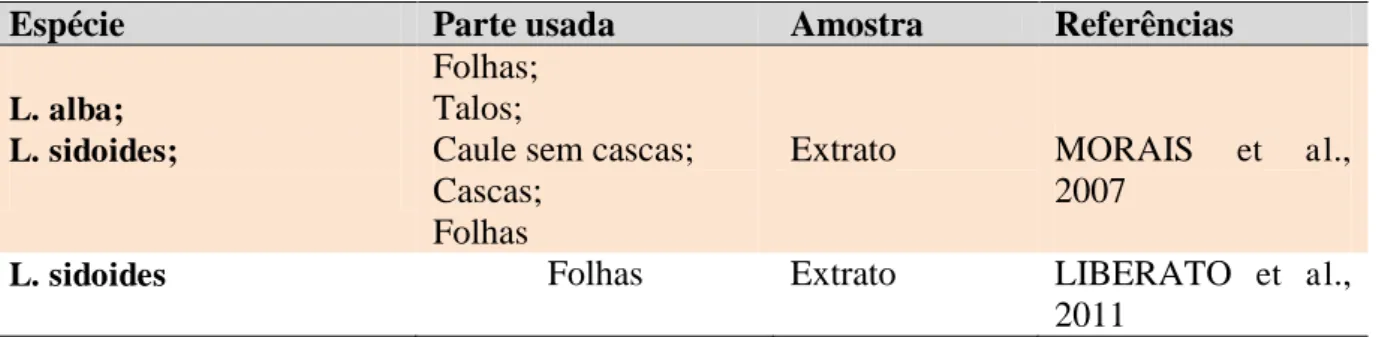
Figura 1 – Fotos de L. rigida em seu local de coleta. Planta inteira – A; folhas – B; inflorescência – C (Fotografo: Prof. Dr. Edilberto R. Silveira, 2010)
A
B
3 - LEVANTAMENTO BIBLIOGRÁFICO 3.1 - O potencial biológico do gênero Lippia
O potencial biológico de plantas do gênero Lippia pode ser observado através de levantamentos bibliográfico registrados na literatura, como no review de plantas do gênero
Lippia, realizado Pascual e colaboradores (2001), onde pode ser encontrado um grande número de espécies com a sua composição química, aspectos farmacológicos e usos tradicionais.
Diferentes atividades farmacológicas e biológicas são apontadas para plantas do gênero Lippia, dentre as quais, se destacam: anticâncer, inibição da enzima acetilcolinesterase, antioxidante, antibacteriana, antifúngica e citotoxicidade. Desta forma, realizou-se um levantamento no período de 2000 – 2011 nas bases de dados Scifinder scholar
e Science direct destas atividades para completar e atualizar informações do gênero Lippia. Os dados encontram-se apresentados nas tabelas 1 – 6.
Tabela 1 - Plantas do gênero Lippia registradas na literatura com atividade anticâncer
Espécie Linhagem de
Células
Parte usada Amostra Referências
L. dulcis Trev.
L. canescens Kunth
B16F10; MK-1;
HeLa Partes
aéreas
Extrato ABE et al., 2002
L. sidoides Cham HL60; CEM
Cerne Extrato COSTA et al., 2001
L. alba; L. citriodora; L. dulci; L. micromera; L. origanoides
Vero;
THP-1 Partes
aéreas
Óleo essencial
ESCOBAR et al., 2010
L. gracilis H.B.K;
L. thymoides Mart et Schau;
L. microphylla Cham.;
L. sidoides Cham.
Walker 256; Ehrlich
Folhas extrato PESSOA et al., 2006
L. citriodora; L. dulcis; L. origanoides; L. citriodora
Vero Folhas e
flores
Óleo essencial
CORREA-ROYER
Tabela 2 - Plantas do gênero Lippia registradas na literatura com atividade de inibição da enzima acetilcolinesterase
Espécie Parte usada Amostra Referências
L. alba; L. sidoides;
Folhas; Talos;
Caule sem cascas; Cascas;
Folhas
Extrato MORAIS et al.,
2007
L. sidoides Folhas Extrato LIBERATO et al.,
2011
Tabela 3 - Plantas do gênero Lippia registradas na literatura com atividade antioxidante
Espécie Parte usada Amostra Referências
L. cf microphylla Cham. Folhas e caule Extrato DAVID et al., 2007
L. origanoides;
L. alba (Quimiotipo carvona);
L alba (Quimiotipo limonena);
L. alba (Quimiotipo
biciclosesquifellandreno.
Folhas Óleo
essencial
OLIVERO-VERBEL
et al., 2009
L. javanica; L. wilmsii; L. rehmannii; L. scaberrima
Folhas Extrato SHIKANGA et al.,
2010
L. pseudo-thea; L. hermannioides; L. alba;
L. rubella; L. sidoide
Folhas Extrato FABRI et al., 2011
L. graveolens Partes aeréas Extrato MARTÍNEZ-ROCHA
et al., 2008
L. alba ---- Óleo
essencial
PUERTAS-MEJÍA et al., 2002
L. gracilis Schauer Folhas Óleo essencial
MENDES et al., 2010
L. multiflora Folhas Óleo
essencial
AGNANIET et al., 2005
L. nodiflora Partes aeréas Extrato SHUKLA et al., 2009
L. sidoides --- Extrato LIBERATO et al.,
2011
L. grandis Folhas Óleo
essencial
DAMASCENO et al., 2011
L. aff. gracillis Folhas e talos Óleo essencial
Tabela 4 - Plantas do gênero Lippia registradas na literatura com atividade antibacteriana Espécie Bactérias Parte usada Amostra Referências
L. alba B. subtilis; B. megaterium; S. aureus; S.lutea; S. dysentriae; V. mimicus; V.parahemolyticus; S. paratyphy
Folhas e flores Extrato COSTA et al., 2009
L. aff. gracillis
S. paratyphi; S. marcescens; M. morganii; P. mirabilis; K. pneumoniae; E. coli; S. aureus Folhas Óleo
essencial PESSOA et al., 2005
L. javanica; L. wilmsii; L. rehmannii; L. scaberrima S. aureus; E. faecalis; E. coli; P. aeruginosa
Folhas Extrato SHIKANGA et al.,
2010
L. alba L. alba f.
intermedia
S. aureus MRSA; S. aureus;
L. casei; S. mutans
Partes aéreas Óleo essencial
OLIVEIRA et al., 2006
L. origanoides
S. aureus MRSA; S. aureus;
L. casei; S. mutans
Partes aéreas
Óleo
essencial OLIVEIRA et al., 2007 L. chevalieri E. coli; S. aureus; E. hirae Partes aéreas Óleo
essencial MEVY et al., 2007
L. graveolens S. lútea; V. cholerae
Partes aéreas Extrato HERNÁNDEZ, 2009
L. multiflora
S. aureus NCTC 6571;
B. subtilis NCTC 8236;
E. coli NCTC
10418;
P. aeruginosa
ATCC 10145;
S. aureus; S. species; S. epidermidis; Enteroinvasive
E. coli;
Enterohaemorrhagic
Folhas Óleo
essencial
E. coli;
K. pneumoniae
L. rubella B. cereus Folhas Extrato FABRI et al., 2011
L. chevalieri; L. multiflora B. cereus; E. faecalis; E. coli; L. innocua; P. mirabilis; S. entérica; S. dysenteria; S. aureus; S. camorum Folhas Óleo essencial
BASSOLE et al.,
2003
L. javanica S. aureus; E. coli
Planta inteira Óleo esencial
MANENZHE et al., 2004 L. javanica S. aureus; S. epidermidis; E. coli; E. cloacae; K. pneumoniae; P. aeruginosa
Folhas Óleo
esencial
NGASSAPA et al., 2003 L. multiflora S. aureus; E. coli; P. aeruginosa; S. typhii; B. subtilis
Folhas Extrato KUNLE et al., 2003
L. nodiflora
S. epidermidis; S. aureus;
P. vulgaris; S. paratyphi A;
E. coli; S. paratyphi B
Panta inteira Extrato DURAIRAJ et al., 2007 L. sidoides S. mutans; S. sanguis; S. salivarius; S. mitis
Folhas Óleo
essencial
BOTELHO et al., 2007
L. turbinata E. coli;
P. aeruginosa; Shigella sp; S. aureus;
Partes aéreas Extrato HERNÁNDEZ et al., 2000
L. javanica
K. pneumonia; C. neoformans; B. cereus
Partes aéreas Óleo essencial
VILJOEN et al., 2005
L. integrifolia
S. aureus MS ATCC 29213;
S. aureus RM ATCC 43300;
E. coli ATCC 25922;
E. coli LM1. Partes aéreas
Óleo esencial
E. coli LM2;
P. aeruginosa
ATCC 27853;
Y. enterocolitica PI;
S. enteritidis MI;
Salmonella sp MI
L. sidoides
K. pneumoniae; Proteus sp; E. coli; S. pyogenes;
Flores Extrato MOREIRA et al.,
2011 L. turbinata S. aureus; B. cereus; E. faecalis; P. mirabilis
Partes aéreas Óleo essencial
DEMO et al., 2005
L. aff. gracillis
Salmonella sp; S. paratyphi; S. marcescens; M. morganii; P. mirabilis; K. pneumoniae; E. coli; S. aureus; P. aeruginosa Folhas Óleo
essencial LIMA, 2007
Tabela 5 - Plantas do gênero Lippia registradas na literatura com atividade antifúngica
Espécie Fungos Parte
usada
Amostra Referências
L. alba
S. cerevaceae; A. flavus; A. niger; C. albicans
Folhas e flores
Extrato COSTA et al., 2009
L. alba; L. alba f.
intermedia
C. albicans;
Serotype B
C. albicans;
C. parapsilosis;
C. guilliermondii
Partes aéreas
Óleo essencial
OLIVEIRA et al., 2006
L. origanoides
C. albicans;
Serotype B
C. albicans;
C. parapsilosis;
C. guilliermondii C. neoformans; T. rubrum Partes aéreas Óleo essencial
OLIVEIRA et al., 2007
L. chevalieri C. Albicans; S. cerevisiae
Partes aéreas
Óleo essencial
MEVY et al., 2007
L. multiflora
C. pseudotropicalis;
T. rubrum; A. flavus
essencial 2004
L. alba C. albicans Folhas
Óleo esencial; Extrato
DUARTE et al., 2005
L. alba C. krusei Folhas Extrato HOLETZ et al., 2002
L. pseudo-thea;
L. sidoide
C. albicans Folhas Extrato FABRI et al., 2011
L. multiflora C. albicans Folhas Extrato KUNLE et al., 2003
L. nodiflora C. albicans; C. neoformans
Planta inteira
Extrato DURAIRAJ et al., 2007 L. rehmannii L. theobromae; B.cinerea; R. solani; F. oxysporum; C. gloeosporioides; A. alternata; P. digitatum; A. citri Planta inteira Óleo essencial
LINDE et al., 2010
L. scaberrima P. digitatum Planta inteira
Óleo essencial
PLOOY et al., 2009
L. scaberrima C. gloeosporioides; L. theobromae
Partes aéreas
Óleo essencial
REGNIER et al., 2010
L. sidoides C. albicans Folhas Óleo
essencial
BOTELHO et al., 2007
L. alba A. flavus Folhas Óleo
essencial
SINGH et al., 2011
L. graveolens C. albicans; C. dubliniensis
Planta Óleo
essencial
POZZATTI et al., 2009 L. alba A. alternata; A. flavus; A. fumigatus; A. glaucus; A. niger; A. shydowi A. terreus; C. cladosporioides; C. lunata; F. graminearum; F. nivale; F. oxysporum; Fusarium sp.; P. italicum; R. solani; R. stolonifer; Trichoderma spp.
Folhas Óleo
essencial SHUKLA et al., 2009
L. berlandieri A. niger;
Penicillium spp.
---- Óleo
essencial
SOSA et al., 2010
inteira essencial COMBRINCK, 2010. L. citriodora; L. dulcis; L. origanoides; L. citriodora C. krusei; A. fumigatus
Folhas e flores
Óleo essencial
CORREA-ROYER
et al., 2010
L. geminate; L. alba
R. solani; B. oryzae
Folhas Óleo
esencial; Extrato
BHUYAN et al., 2010
L. integrifolia
M. gypseum; T. rubrum;
T. mentagrophytes; T. rubrum C 110; T. rubrum C 135; T. rubrum C 136; T. rubrum C 137; T. rubrum C 139; T. rubrum C 140; T. mentagrophytes C 108;
T. mentagrophytes C 364;
T. mentagrophytes C 539;
T. mentagrophytes C 738;
T. mentagrophytes C 943;
T. mentagrophytes C 726;
Partes aéreas
Óleo
esencial LIMA et al., 2011
L. rehmannii L. theobromae; C. gloeosporioides; L. theobromae; C. gloeosporioides; A. alternata; P. digitatum; A. citri; R. solani; F. oxysporum Partes aéreas Óleo esencial
LINDE et al., 2010
L. rugosa A. flavus; A. Níger; A. parasiticus; Aspergillus spp; F. moniliforme; Fusarium spp1 Fusarium spp2 P. roqueferti Penicilium spp Folhas Óleo
Tabela 6 - Plantas do gênero Lippia registradas na literatura com atividade de citotoxicidade
Espécie Parte usada Amostras Referências
L. alba Folhas e flores Extrato ARA et al., 2009
L. cf. microphylla Cham. Partes aéreas Extrato DAVID et al., 2007
L. multiflora Moldenke Partes aéreas Extrato AJAIYEOBA et al., 2006
Lippia origanoides;
Lippia alba (Quimiotipo carvona);
Lippia alba (Quimiotipo
limoneno); Lippia alba
(Quimiotipo
biciclosesquifellandreno)
Folhas Óleo
essencial
OLIVERO-VERBEL
et al., 2009
L. pseudo-thea; L. hermannioides; L. alba;
L. rubella; L. sidoide
Folhas Extrato FABRI et al., 2011
L. gracilis Folhas Óleo
essencial
TELES et al., 2010
L. grandis Folhas Óleo
essencial
DAMASCENO et al., 2011
3.2 Flavonóides no gênero Lippia:dispersão e atividades biológicas
Os flavonóides são substâncias com uma constituição química que compreende os derivados flavônicos (flavus – amarelos), os derivados antociânicos (anthos – flor e kyanus – azul), as catequias/catecóis e outros constituintes relacionados (TESTE e TRENTINI, 1997). São derivados da condensação de uma molécula de ácido cinâmico com três grupos malonil-CoA2 (MARTINEZ-FLORES, 2002) e representam um dos grupos fenólicos mais importantes e diversificados entre os produtos de origem natural, sendo amplamente distribuído no reino vegetal e encontrado em diversas formas estruturais (SIMÕES et al. 2007).
Aos flavonoides e outros polifenóis são atribuídos diversas funções, tais como, proteção dos vegetais contra a incidência de raios ultravioleta e visível, além de proteção contra insetos, fungos, vírus e bactérias, atração de animais com finalidade de polinização, antioxidantes, controle da ação de hormônios vegetais, agentes alelopáticos e inibidores de enzimas (HARBONE, 1989; HARBONE e WILLIAMS, 2000).
A estrutura básica dos flavonoides (Figura 2) consiste em dois anéis fenil (A e B) ligados através de um anel pirânico (C) (MARTINEZ-FLORES, 2002). Essa estrutura (C6-C3-C6) permite que os mesmos sofram diversos tipos de reações como hidroxilação, metoxilação, glicolisação com mono e oligossacarídeos e acetilação. Estas reações podem ocorrer em várias posições da estrutura (SHAHIDI, 1996) e estão relacionados com esquemas de proteção frente a processos oxidativos (BORS et al., 1996; ODABASOGLU et al., 2004). Figura 2 – Esqueleto básico de um flavonoide
O
O 2 3 4 5 6
7 8
9
1 0
1 ' 2 '
3 ' 4 '
5 ' 6 '
B
C A
Mais de 9.000 flavonoides foram relatados a partir de plantas superiores e micro-organismos (FERRER et al. 2008), representando uma das maiores classes de produtos naturais. Em geral, são encontrados nas frações mais polares, como acetato de etila (agliconas) e butanólica (flavonoides glicosilados). Alguns compostos menos polares, como a luteolina, são extraídos com clorofórmio ou diclorometano (NIERO, 2000). Segundo o levantamento bibliográfico realizado para o gênero Lippia, os flavonóides são representados por 51 estruturas diferentes (Tabelas 7 e 8), sendo 62,74% flavonas; 21,57% flavanonas; 3,63% biflavonóides e 11,89% chalconas, como indicado na Figura 3.
Figura 3 - Flavonóides isolados de plantas do gênero Lippia
Tabela 7 - Relação dos flavonóides isolados de plantas do gênero Lippia
Nº Nome dos flavonóides Referências
01 Desmetoxicentaureidina ABE et al., 2002
02 Eupafolina ABE et al., 2002
03 6-hidroxiluteolina ABE et al., 2002
04 Quercetina
COSTA et al., 2001 LIN et al., 2007 LIMA, 2007
05 Luteolina COSTA et al., 2001
LIN et al., 2007
06 Glucoluteolina COSTA et al., 2001
07 Taxifolina COSTA et al., 2001
LIN et al., 2007
08 Luteolina-7-diglicuronideo HENNEBELLE et
62,74%
21,57%
3,63%
11,89%
0 10 20 30 40 50 60 70
1
Flavononas
al., 2008. 09 5,5”-diidroxi-6,4’,6”,γ’”,4’”-pentametoxi-[C7–O–C7”]
-biflavona
BARBOSA et al., 2005
10 4’,4’”,5,5”-tetrahidroxi-6,6”,γ’”-trimetoxi-[C7–O–C7”] -biflavona
BARBOSA et al., 2005
11 5,γ’-diidroxi-6,7,4’,5’-tetrametoxiflavona ONO et al., 2005
ONO et al., 2006
12 Crisina ONO et al., 2005
13 Salvigenina ONO et al., 2005
KANKO et al., 2004
14 Eupatorina ONO et al., 2005
15 5-hidroxi-6,7,3’,4’-tetrametoxiflavona ONO et al., 2005
16 Galangina LIN et al., 2007
17 Metilgalangina LIN et al., 2007
18 Apigenina ONO et al., 2008
LIN et al., 2007
19 Apigenina 7-O-glucosideo LIN et al., 2007
20 Escutellareina LIN et al., 2007
21 Escutellareina 7-O-hexosideo LIN et al., 2007
22 6-Metilescutellareina LIN et al., 2007
23 6,7-Dimetilescutellareina LIN et al., 2007
24 Luteolina 7-O-glicosídeo LIN et al., 2007
25 6-Hidroxiluteolina LIN et al., 2007
26 6-Hidroxiluteolina 7-O-hexosideo LIN et al., 2007
27 6-Hidroxiluteolina 7-O-ramnosideo LIN et al., 2007
28 Pinocembrina LIN et al., 2007
29 Naringenina LIN et al., 2007
30 Sakuranetina LIN et al., 2007
31 Eriodictiol
LIN et al., 2007 ALMEIDA et al., 2010
32 Eriodictiol 7-O-glicosideo LIN et al., 2007
33 Pentahidroxiflavanona-A LIN et al., 2007
34 Pentahidroxiflavanona-A 7-O- hexosideo LIN et al., 2007
35 Pentahidroxiflavanona-B LIN et al., 2007
36 Pentahidroxiflavanona-B 7-O-hexosideo-1 LIN et al., 2007
37 Pentahidroxiflavanona-B 7-O-hexosideo-2 LIN et al., 2007
38 Floretina LIN et al., 2007
39 Floridzina LIN et al., 2007
40 3-Hidroxifloretina LIN et al., 2007
41 3-Hidroxifloretina 6-O-hexosideo LIN et al., 2007
2010
43 β’-O- -D-glicopiranosil-4,4’,6’-tri-hidroxi-di-hidrochalcona ALMEIDA et al., 2010
44 4’,5,7-tri-hidroxi-6-metoxiflavona ALMEIDA et al., 2010
LIMA 2007
45 Hispidulina ONO et al., 2008
46 Jaceosidina ONO et al., 2008
47 Cirsilineol ONO et al., 2008
48 Eupatorina ONO et al., 2008
49 Hispidulina 7-O- -D-glucosideo ONO et al., 2008
50 Jaceosidina 7- -glucosideo ONO et al., 2008
51 3-metil-quercetina LIMA 2007
Tabela 8 - Relação das estruturas dos flavonóides isolados de plantas do gênero Lippia com suas respectivas espécies
O
O
O H
OMe
O H
O H
O H
MeO (0 1 )
L. dulcis Trev.
L. canescens Kunth.
O
O
O H
O H
O H
O H
MeO (0 2 )
L. dulcis Trev.
L. canescens Kunth.
O
O
O H
O H
O H
O H
( 0 3 )
L. dulcis Trev.
L. canescens Kunth.
O
O
O H
O H
O H
O H
O H
(0 4 )
O O O H O H O H O H
(0 5 )
L. sidoides Cham.
(0 6 )
O O H O H O H O H O O H O H O H O O
L. sidoides Cham.
O O O H O H O H O H O H
(0 7 )
L. sidoides Cham.
O O O H O H O H O H
(0 8 )
L. alba
( 0 9 )
O O MeO OMe O O OMe O H OMe MeO O H O L. alba
( 1 0 ) O O O H OMe O O OMe O H O H MeO O H O L. alba O O O H O H OMe MeO
MeO ( 1 1 )
L. dulcis O O O H O H MeO
MeO ( 1 2 )
O O O H OMe MeO MeO OMe O H (1 4 )
L. dulcis O O O H OMe MeO MeO OMe
(1 5 )
L. dulcis O O O H O H O H ( 1 6 )
L. graveolens O O OMe O H
( 1 7 )
L. graveolens O O O H O H O H
(1 8 )
L. graveolens
(1 9 )
O O H O H O H O H O O H O H O O L. graveolens O O O H O H O H O
H (2 0 )
L. graveolens
( 2 2 ) O O O H O H O H MeO L. graveolens
( 2 3 )
O O MeO O H MeO L. graveolens
(2 4 ) O O H O H O H O H O O H O H O O O H L. graveolens
(2 5 )
O O O H O H O H O H O H L. graveolens
(2 6 ) O O H O H O H O H O O O O H O H O H O H L. graveolens
(2 7 ) O O H C H3 O H O H O O O O H O H O H O H L. graveolens O O O H O H O H
(2 8 )
L. graveolens O O O H O H O H O H
(2 9 )
O O O H MeO O H O H
(3 0 )
L. graveolens O O O H O H O H O H
(3 1 )
L. graveolens
(3 2 )
O O H O H O H O H O O H O H O O O H O H L. graveolens O O O H O H O H O H O H
(3 3 )
L. graveolens
( 3 4 )
O O H C H3 O H O H O O O O H O H O H O H L. graveolens O O O H O H O
H O H
(3 5 )
L. graveolens
( 3 6 ) O O H C H3 O H O H O O O O H O H O H L. graveolens
( 3 7 ) O O H C H3 O H O H O O O O H O H O H L. graveolens O H O O H O H
(3 8 )
L. graveolens
( 3 9 )
(4 0 ) O H O O H O H O H O H L. graveolens
( 4 1 )
O O H C H3 O H O H O H O O H O H O O H L. graveolens
( 4 2 ) O O H O H O H O H O H O O H O O H L. sidoides
( 4 3 )
O O H O H O H O H O H O O H O O H L. sidoides
( 4 4 ) O O O H O H MeO O H L. sidoides
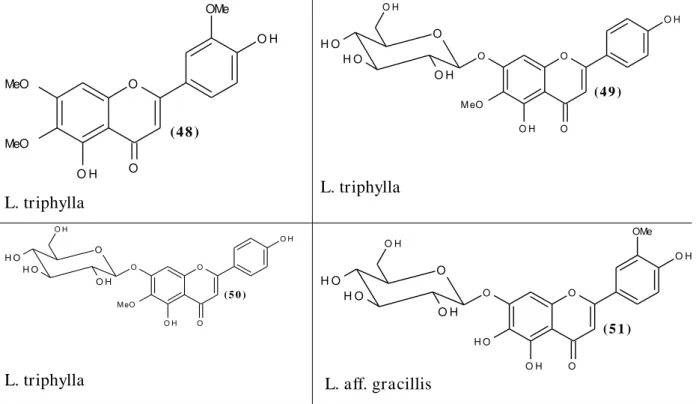
( 4 5 ) O O O H O H O H L. triphylla
(4 6 ) O O O H O H O H OMe MeO L. triphylla
(4 8 ) O O MeO O H O H MeO OMe L. triphylla
(4 9 )
O O H O H O H O H O O H O H O O M eO L. triphylla
(5 0 )
O O H O H O H O H O O H O H O O M eO L. triphylla
( 5 1 )
O O H O H O H O H O O H O H O O O H OMe
L. aff. gracillis
Para os flavonoides isolados do gênero Lippia realizou-se um levantamento bibliográfico das atividades biológicas apresentadas por estes. Dentre os flavonoides relatados, 15 apresentaram diversas atividades biológicas, confirmando o potencial biológico dos flavonoides isolados deste gênero, conforme mostra a Tabela 9.
Tabela 9 - Relação das atividades biológicas dos flavonoides isolados de plantas do gênero
Lippia
Nº Nome dos flavonoides Atividade biológica Referências
02 Eupafolina Anticâncer ABE et al., 2002
HERRERIAS, 2009
Anticâncer
WILLIAMS, 2004
CALTAGIRONE et al., 2000 TAKAHASHI et al., 1998 MANTHEY et al., 2002 SAEWAN et al., 2011 PICK et al., 2011 HE e Liu, 2006
04 Quercetina
Inibição da enzima acetilcolinesterase
JUNG e PARK, 2007 KHAN et al., 2009
Antioxidante
BRIGHENTE et al., 2007 FURUSAWA et al., 2005 FROEHLICHER et al., 2009 SÖHRETOLU et al., 2009 SILVA et al., 2008
VINSON et al., 1995
BURDA e OLESZEK, 2001 GALOTTA et al., 2008 Antibacteriana IWAGAWA et al., 1990
TALEB-CONTINI et al., 2003
Antifúngica TALEB-CONTINI et al., 2003
5 Luteolina
Anticâncer
TAKAHASHI, et al., 1998 MANTHEY et al., 2002 PLOCHMANN et al., 2007 HERRERIAS, 2009
BRIGHENTE et al., 2007
Antioxidante
MIEAN e MOHAMED, 2001 BRIGHENTE et al., 2007 SI et al., 2011
SILVA et al., 2008 BRIGHENTE et al., 2007
Antibacteriana XU e LEE, 2001
Antifúngica
XUE-GU et al., 2010
SATHIAMOORTHY et al., 2007
07 Taxifolina
Antioxidante
BRIGHENTE et al., 2007 VINSON et al., 1995
12 Crisina
Anticâncer
PICK et al., 2011 BASABE et al., 2010 USIA et al., 2002
PLOCHMANN et al., 2007
Antioxidante
BRIGHENTE et al., 2007 VINSON et al., 1995 BURDA e OLESZEK 2001 Antibacteriana ALI et al., 1998
Antifúngica YANG et al., 2011
16 Galangina
Anticâncer USIA et al., 2002
Antioxidante BURDA e OLESZEK, 2001
Antibacteriana MARCUCCI, 1996
Antifúngica YANG et al., 2011
18 Apigenina
Anticâncer
CALTAGIRONE et al., 2000 TAKAHASHI et al., 1998 USIA et al., 2002
MANTHEY et al., 2002 PICK et al., 2011
PLOCHMANN et al., 2007 HERRERIAS, 2009
Inibição da enzima acetilcolinesterase
FALÉ et al., 2011
Antioxidante
MIEAN e MOHAMED, 2001 BRIGHENTE et al., 2007 BABAEI et al., 2008 SI et al., 2011
SHARIFIFAR et al., 2009 VINSON et al., 1995
BURDA e OLESZEK, 2001 BRIGHENTE et al., 2007 Antibacteriana BASILE et al., 1999 Antifúngica LOPES et al., 2004
24 7-O- -D-glicosideo Luteolina
Antioxidante TASKOVA et al., 2003
Toxicidade TASKOVA et al., 2003
28 Pinocembrina
Anticâncer
SIMIRGIOTIS et al., 2008 USIA et al., 2002
Antioxidante SIMIRGIOTIS et al., 2008
Antibacteriana BREMMER e MEYER, 1998
Antifúngica YANG et al., 2011
29 Naringenina
Anticâncer
SCHULTZ 2003
MANTHEY et al., 2002 PLOCHMANN et al., 2007
Antioxidante
BRIGHENTE et al., 2007 BABAEI et al., 2008 DELAZAR et al., 2008 VINSON et al., 1995
BURDA e OLESZEK, 2001 Antibacteriana MALTERUND et al., 1985
31 Eriodictiol
Anticâncer PLOCHMANN et al., 2007
Antifúngica XUE-GU et al., 2010
38 Floretina Anticâncer
TAKAHASHI et al., 1998 PLOCHMANN et al., 2007
45 Hispidulina
Anticâncer PLOCHMANN et al., 2007
Toxicidade MOREIRA et al., 2003
51 3-metoxi quercetina Inibição da enzima acetilcolinesterase
JUNG e PARK, 2007
3.3 Flavonóides e atividade anticâncer
Vários flavonoides têm demonstrado suprir a carcinogênese em modelos animais (Tabela 10). Há na literatura relatos de que os flavonoides exercem um efeito benéfico em vários mecanismos que envolvem a patogenia do câncer. Estudos investigativos têm demonstrado que os possíveis mecanismos de inibição da carcinogênese por polifenois estejam relacionados com o aumento da expressão de superóxido dismutase (MANSON, 2003), inibição da cicloxigenase e lipoxigenase (HONG, 2001; SAKATA, 2003), indução de apoptose e repressão do ciclo celular, como demonstrado em células carcinogênicas humanas
in vitro (MANSON, 2003).
Os flavonoides vêm sendo extensivamente pesquisados como protetores das células contra danos de raios-X, bloqueando a progressão do ciclo celular e a síntese de prostaglandinas e inibindo mutações em experimentos animais (REDDY, 2003). Quercetina, luteolina e genistiteína têm mostrado capacidade de inibir o dano oxidativo de DNA induzido por irradiação ultravioleta (WEISS, 2003). Além disso, a quercetina expressa efeitos antiproliferativos e induz a morte celular de células tumorais predominante por mecanismos apoptóticos em diversas linhagens de células cancerosas (WILLIAMS, 2004). A naringenina é que é uma flavanona que causa citotoxicidade e apoptose via inibição do crescimento tumoral em linhagens de células humanas leucêmicas (SCHULTZ, 2003).
Dos flavonoides pesquisados com atividade anticâncer, 58,76% pertencem à classe das flavonas; 1,03% pertencem à classe das isoflavonas; 27,83% pertencem à classe das flavanonas; 10,31% pertencem à classe das chalconas e 2,06% pertencem à classe dos biflavonoides, conforme a Figura 4, p. 52.
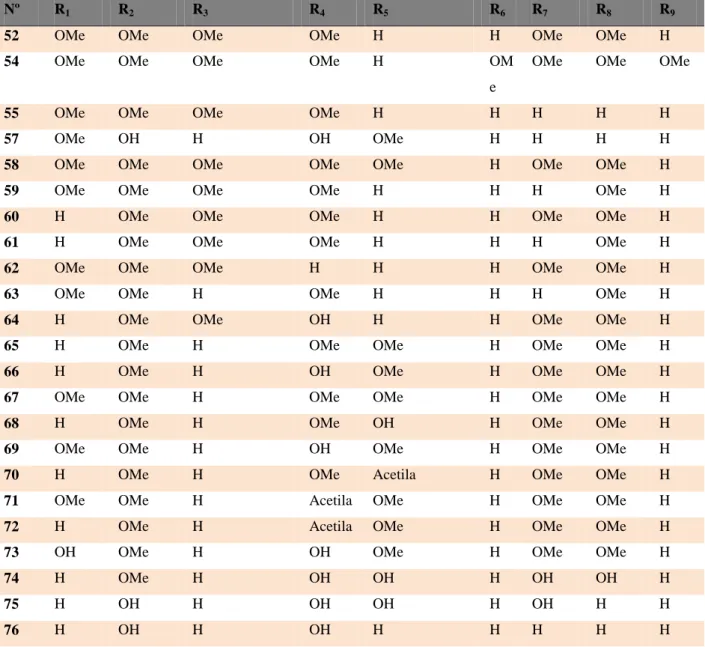
Tabela 10 - Flavonoides relatados na literatura com atividade anticâncer.
Nome dos flavonoides Linhagem de
Células
Referências
Quercetina (4) -- WILLIAMS, 2004
Naringenina (29) -- SCHULTZ, 2003
Nobiletina (52) HT-1080 SATO et al., 2002
Quercetina (4) Apigenina (18)
B16-BL6 CALTAGIRONE
et al., 2000 Genisteina (53)
Apigenina (18) Luteolina (5) Quercetina (4) Floretina (38)
HL-60 TAKAHASHI et