´Cobrançosa` olive oil and drupe: chemical
composition in two ripening stages
Cláudia Manuela Correia de Sousa
2º Ciclo em Biotecnologia e Qualidade Alimentar
Orientador: Professora Doutora Ana Novo Barros Co-orientador: Professora Doutora Paula Martins-Lopes
Com a realização desta dissertação de mestrado termina mais uma etapa e cumpre-se mais um objetivo de vida. Desta forma é essencial agradecer a todas as pessoas que de uma forma direta ou indireta contribuíram para a sua elaboração. Por isso, um grande obrigado de coração a todos, mas em particular:
À orientadora, Professora Doutora Ana Barros, pelo seu imenso profissionalismo, mas essencialmente por ser uma pessoa muito humana. Obrigado pela inteira dedicação, apoio, pela paciência demonstrada com todas as minhas distrações, pela compreensão, pela palavra sempre meiga, pela tranquilidade e por todos os sábios conselhos que sempre me transmitiu quando eu stressava mais do que era preciso. Obrigada pela confiança sempre demostrada, pelas tardes no seu gabinete que fizeram toda a diferença e acima de tudo por se ter tornado uma amiga de coração. É uma mulher muito bonita, muito especial, batalhadora, querida e acima de tudo uma “Fixolas”.
À Professora Doutora Paula Martins-Lopes, co-orientadora, que é uma excelente profissional. Obrigada por toda a disponibilidade e emprenho demostrado, pelas deslocações a Mirandela, por todas as boas sugestões, assim como pela preocupação e confiança demostrada ao longo de todo o trabalho. Gostei muito de a conhecer melhor, como professora e como pessoa, foi compensador trabalhar e aprender consigo. É uma “fixolas”.
À Professora Doutora Alice, que demostrou total disponibilidade na parte sensorial, sempre muito simpática. Obrigada pelo apoio.
À Professora Doutora Maria Teresa Carvalho e aos funcionários da Unidade Nacional de Investigação Agrária, onde foram realizadas as extrações do azeite. Obrigada pela disponibilidade e pelo espaço cedido.
A todo o pessoal do Departamento de Química da Universidade de Trás-os-Montes e Alto Douro, em especial à Ana Abraão, ao André Lemos, ao Sr. Carlos e à D. Paula que sempre cederam material quando necessário e se mostraram sempre disponíveis.
A todos os meus amigos que fazem parte das minhas histórias e que desde sempre me acompanharam em todo o meu percurso e me fazem todos os dias acreditar que eu sou capaz. Obrigada por todos os momentos.
À Diana Barreira, Irene Gouvinhas e Eunice Moreira (que deviam me agradecer por as aturar todos os dias, não é?), companheiras dos meus dias no laboratório e que sempre estiveram lá para me ajudar. Tornamos os laboratórios muito mais animados com todas as músicas, gargalhadas, cantorias e histórias. Foi bom trabalhar assim.
Um obrigado especial à minha mana do coração, Diana Barreira que até me arranjou uma família transmontana. Há amigos que não são de sempre, mas vão ser para sempre. Sê Feliz.
Finalmente resta-me agradecer à minha mamusca e ao meu papusco que são o meu orgulho, sem eles este sonho não teria sido possível, sem eles, não era parte da pessoa que sou hoje. Obrigada por me guiarem sempre e por me ajudarem a lutar sempre pelo meu futuro.
Agradecimentos ...ii
Índice de Gráficos………..v
Capítulo I – Enquadramento Temático ...2
1.1. A oliveira – Olea Europaea L. ...2
1.2. Produção de azeite em Portugal e no Mundo ...2
1.3. A cultivar Cobrançosa – Características ...4
1.4. A dieta Mediterrânica e a importância do consumo de azeitona e azeite na saúde ...5
1.5. Composição química da azeitona ...5
1.6. Composição química do azeite ...6
1.7. Estado de maturação da azeitona e as características do azeite...7
1.8. Os compostos fenólicos e as características sensoriais do azeite ...7
1.9. Objetivos do trabalho ...9
1.10. Comparação dos parâmetros: atividade antioxidante, compostos fenólicos, orto-difenois e flavonoides entre o estado semi-verde e maduro de Clones de azeitona da cultivar Cobrançosa. ...11
1.11. Comparação dos parâmetros: atividade antioxidante, compostos fenólicos, orto-difenois e flavonoides entre o estado semi-verde e maduro de azeites da cultivar Cobrançosa ...15
1.12. Perfil fenólico dos Clones de azeitonas ...19
1.13. Perfil fenólico dos azeites ...20
1.14. Análise sensorial dos azeites ...21
1.15. Referências bibliográficas...23
Capítulo II - ´Cobrançosa` olive oil and drupe: chemical composition in two ripening stages ...24
´Cobrançosa` olive oil and drupe: chemical composition in two ripening stages .25 Capítulo III–Conclusões e perspetivas para trabalho futuro ...56
3.1. Conclusões ...57
Gráfico a) Comparação da atividade antioxidante dos 6 Clones de azeitona ´Cobrançosa` entre o estado semi-verde e maduro.
Gráfico b) Comparação do teor em fenóis totais dos 6 Clones de azeitona ´Cobrançosa` entre o estado semi-verde e maduro.
Gráfico c) Comparação do teor em orto-difenóis dos 6 Clones de azeitona ´Cobrançosa` entre o estado semi-verde e maduro.
Gráfico d) Comparação do teor em flavonoides dos 6 Clones de azeitona ´Cobrançosa` entre o estado semi-verde e maduro.
Gráfico e) Comparação da atividade antioxidante dos 6 azeites ´Cobrançosa` entre o estado semi-verde e maduro.
Gráfico f) Comparação do teor em fenóis totais dos 6 azeites ´Cobrançosa` entre o estado semi-verde e maduro.
Gráfico g) Comparação do teor em orto-difenóis dos 6 azeites ´Cobrançosa` entre o estado semi-verde e maduro.
Gráfico h) Comparação do teor em flavonoides dos 6 azeites ´Cobrançosa` entre o estado semi-verde e maduro.
1.1. A oliveira - Olea europaea L.
A oliveira (Olea europaea L.) é a única espécie da família Oleaceae com fruto comestível e é das plantas cultivadas mais antigas, cuja origem data de 4000-3000 anos a.C. na zona da Palestina (Bacelar et al., 2009). É descrita como sendo uma cultura amplamente dispersa por todo o mundo, facto que está relacionado com a sua adaptabilidade a diversas condições ambientais e que resultam de algumas características específicas, tais como: elevada tolerância à seca e à salinidade e os requisitos mínimos de manutenção do olival. Além disso, é reconhecida pelo elevado valor nutricional dos seus produtos, a azeitona e o azeite (Seabra et al., 2010).
A cultura da oliveira e a valorização dos seus produtos tornou-se uma atividade económica promissora ao longo dos tempos.
1.2. Produção de azeite em Portugal e no Mundo
Cerca de 95% da superfície oleícola está localizada na zona Mediterrânica, sendo que, os principais países produtores da União Europeia como a Espanha, Itália, Grécia e Portugal são responsáveis por 71% da produção de azeite a nível mundial, (Azeite, 2012). Existem no entanto países como a Síria (6,6%), Turquia (5,4%), Marrocos (5,1%) Tunísia (4,1%) e a Argélia (1,6%) que também pertencem ao grupo dos principais países produtores (Azeite, 2012).
Em Portugal, o olival é uma cultura tradicional e tem uma importância económica em várias regiões do continente.
Apesar de, a sua cultura estar presente em todas as regiões agrárias, as principais regiões produtoras são a região do Alentejo e a de Trás-os-Montes (MADRP, 2007). A vocação predominante do olival português é para a produção de azeite, sendo que cerca de 96% da azeitona produzida é destinada para a elaboração deste produto e os restantes 4% destinam-se à produção de azeitona de mesa (MADRP, 2007).
Nos últimos anos tem-se assistido a uma evolução e até mesmo a uma recuperação na produção de azeite, após um decréscimo acentuado entre as décadas de 60 a 80, sendo que, a estimativa para a produção nacional na campanha 2010/2011 aponta para um valor de 70 mil toneladas de azeite produzido (Azeite, 2012).
Na região de Trás-os-Montes a produção de azeite e azeitona de mesa é uma fonte de rendimento para uma população que se ocupa principalmente e, por vezes, exclusivamente dessa cultura; as características desta região como: as condições edafo--climáticas, a qualidade dos solos, as variedades dominantes e características (Verdeal Transmontana, Cobrançosa, Madural e Cordovil), assim como as técnicas tradicionais de produção potenciam os requisitos necessários para um azeite de alta qualidade que é bastante apreciado (MADRP, 2007; Amaral et al., 2010; Vaz, 2011).
1.3. A cultivar Cobrançosa – Características
A ‘Cobrançosa’ é uma cultivar portuguesa bastante produtiva que está autorizada em todas as regiões agrárias (Algarve, Alentejo, Ribatejo, Beiras e Trás-os-Montes). No entanto, tem maior incidência na região de Trás-os-Montes e Alto Douro e é essencialmente utilizada para a produção de azeite com Denominação de Origem Protegida (DOP) (Alves, 2007).
Figura 1. Cultivar Cobrançosa A) aspeto geral da árvore; B) aspeto do fruto. Fotografia capturada no campo Clonal em Mirandela.
As oliveiras desta cultivar são árvores de porte pequeno ou médio (Figura 1A) cujo fruto é elipsoidal e de tamanho médio com forma apical pontiaguda ou arredondada (Figura 1B). Apresenta um bom rendimento em azeite (Vaz, 2011).
Mirandela é o conselho com maior número de oliveiras na região do Nordeste Transmontano, com aproximadamente 950 000 oliveiras, sendo que a cultivar Cobrançosa detém 30% da cota do olival que caracteriza esta zona (Vaz, 2011).
1.4. A dieta Mediterrânica e a importância do consumo de azeitona e azeite na saúde
As azeitonas e o azeite são uma componente muito importante e característica da dieta mediterrânica e são produtos muito conhecidos por serem uma fonte natural de compostos fenólicos, que são importantes antioxidantes naturais.
Um grande número de estudos epidemiológicos e experimentais relaciona o consumo destes produtos com a prevenção de certas doenças (Cioffi et al., 2009). Desempenham assim um papel importante na prevenção de doenças cardiovasculares, algumas doenças do foro cancerígena, diabetes, casos de hipertensão, obesidade e em doenças cognitivas como o caso do Alzheimer (Cioffi et al., 2009).
A oleuropeína, secoiridoide presente na azeitona e no azeite sob a forma de aglicona, apresenta uma ação anti-hipertensiva (Visioli et al., 2002).
1.5. Composição química da azeitona
A azeitona é uma drupa, ou seja, um fruto carnoso com apenas uma semente. É constituída maioritariamente por água (70 a 75%), por um baixo teor de açúcar (2,6 a 6%) e proteína (3%) e por um elevado teor de óleo (12 a 30%) que depende do estado de maturação do fruto (Conde et al., 2008; COI, 2012).
A concentração de compostos fenólicos na azeitona varia entre 1 e 3% de acordo com Servili e Montedoro (2002), sendo que as principais classes de compostos fenólicos existentes na azeitona incluem: ácidos fenólicos, álcoois fenólicos, flavonoides e os secoiridoides.
Os principais álcoois fenólicos são o hidroxitirosol e o tirosol, a luteolina-7- O-glucósido, rutina e a apigenina-7-O-glucósido são os flavonoides mais frequentemente descritos na literatura.
Os secoiridoides predominantes na azeitona são a oleuropeína e o ligostrósido, enquanto o verbascósido é o principal ácido hidroxicinâmico (Vinhas et al., 2005; Silva et al., 2006).
1.6. Composição química do azeite
O azeite é um produto obtido exclusivamente a partir do fruto da oliveira COI, (2012), é uma gordura líquida à temperatura de 20ºC obtida mediante processos de extracção física, depuração e refinação, podendo desta forma ser classificado em azeite virgem ou em azeite refinado (Regulamento CEE Nº 2568/91).
De acordo com Tuck et al. (2002) existem cerca de 30 compostos fenólicos, sendo que as principais classes identificadas e quantificadas são os fenóis simples, como o hidroxitirosol e tirosol, os secoiridoides como a oleuropeína, a aglicona do ligostrósido e a seu respetivo dialdeído descarboxilado e as linhanas como o (+)-acetopinoresinol e o (+) - pinoresinol. As três classes mencionadas e de acordo com Owen et al. (2000) têm um forte potencial antioxidante, sendo que a concentração de compostos fenólicos nos azeites varia entre 100 e 800 mg/kg (Tuck et al., 2002).
1.7. Estado de maturação da azeitona e as características do azeite
O estado de maturação da azeitona no momento da colheita, o método utilizado na apanha e o acondicionamento dos frutos antes da laboração, são factores que influenciam significativamente a qualidade do azeite (Lopes et al., 2009).
A maturação da azeitona inicia-se quando é possível observar nos frutos os primeiros tons violáceos e termina quando estes atingem a coloração característica da pele e da polpa correspondente a cada variedade (Lopes et al., 2009).
Apesar de o conteúdo total de gordura aumentar com a maturação e atingir o valor máximo quando os frutos se encontram bem maduros, a qualidade do azeite de acordo com os melhores padrões obtém-se antes da maturação completa dos frutos, ou seja, quando a azeitona ainda não está completamente madura (Pires, 2005; Lopes et al., 2009).
Como forma de valorizar a produção e atendendo à tendência global dos mercados, a colheita da azeitona tende a ser antecipada, o azeite torna-se mais frutado, com sabor a azeitona fresca, sem defeitos que o penalizem e dependendo de cada cultivar, com um amargo e picante característico (Lopes et al., 2009).
1.8. Os compostos fenólicos e as características sensoriais do azeite
As substâncias fenólicas naturais estão presentes no azeite em quantidades apreciáveis. Para além de conferirem maior resistência à oxidação, são ainda responsáveis pelas características sensoriais (Hajimahmoodi et al., 2008).
O azeite pode apresentar vários aromas, sabores e até diferentes tonalidades. Estas características estão dependentes de fatores como a cultivar em estudo, situação
As mudanças na composição fenólica influenciam as características sensoriais do azeite. Um atraso na época da colheita da azeitona origina um azeite menos fragante, mais apagado, menos amargo e mais suave, desde que o fruto seja são e proveniente da árvore (Vaz, 2011).
De acordo com Visioli et al. (2002), os ácidos fenólicos são responsáveis pelo amargo encontrado nos azeites, e a classe dos secoiridoides confere um picante característico. Os azeites definidos como “doces” são menos ricos em compostos fenólicos.
1.9. Objetivos do trabalho
Na região de Trás-os-Montes, alguns olivicultores iniciam a colheita da azeitona durante os primeiros dias do mês de Novembro. No entanto a tendência atual em diversas cultivares e inclusive na cultivar Cobrançosa é antecipar a data de colheita.
Sabe-se porém que o estado de maturação do fruto influencia significativamente a composição fenólica e a qualidade do azeite. Desta forma, o principal objetivo deste estudo é comparar o perfil fenólico de seis Clones de azeitonas da cultivar Cobrançosa e dos seus respetivos azeites em dois estados de maturação diferentes: estado semi-verde e estado maduro, com o intuito de avaliar se existem diferenças significativas entre os dois estados de maturação estudados. Assim no início de Outubro (14/10/2011) foram colhidos os seis Clones de azeitonas no estado Semi-verde e no início de Novembro (08/11/2011) as mesmas amostras foram colhidas no estado Maduro.
As amostras de azeite foram também submetidas a uma análise sensorial, com o objetivo de avaliar se os dois estados de maturação provocam alterações sensorialmente significativas.
Para os Clones de azeitonas e os seus respetivos azeites nos dois estados de maturação foram avaliados os seguintes parâmetros:
Atividade antioxidante - Método do ABTS•;
Fenóis totais - Método Colorimétrico de Follin-Ciocalteau
Orto-difenóis - Determinação colorimétrica por complexação dos orto-difenóis com os iões molibdato;
Flavonoides - Método com Cloreto de Alumínio;
Correlação entre a atividade antioxidante e o teor em flavonoides;
Determinação do perfil fenólico das amostras por RP-HPLC (Cromatografia Líquida de Alta Eficiência por Fase Reversa);
Análise sensorial dos azeites obtidos nos dois estados de maturação
Os seis Clones de azeitonas estudados foram escolhidos tendo em conta um estudo realizado durante 2 anos consecutivos na qual se utilizaram 24 Clones provenientes de um Campo Clonal situado em Mirandela.
Os olivicultores catalogaram todos os Clones de acordo com o rendimento de produção e foram estudados os parâmetros químicos em cima mencionados. Verificou-se uma correlação entre o rendimento de produção e a atividade antioxidante, ou Verificou-seja Clones com alto rendimento de produção apresentavam elevada atividade antioxidante e os Clones catalogados com baixo rendimento de produção apresentavam baixa atividade antioxidante. No entanto surgiram três excepções.
A amostragem escolhida para a realização deste trabalho engloba as três excepções estudadas anteriormente: Clone 14 e 49 (baixo rendimento de produção e alta atividade antioxidante) e o Clone 111 (alto rendimento de produção e baixa atividade antioxidante). Foram também escolhidos os Clones 80 e 85 que apresentaram o maior valor de atividade antioxidante e eram de alto rendimento de produção e o Clone 110 onde se verificou o menor valor de atividade antioxidante e foi catalogado com baixo rendimento de produção.
1.10. Comparação dos parâmetros: atividade antioxidante, compostos fenólicos,
orto-difenois e flavonoides entre o estado semi-verde e maduro de Clones de
azeitona da cultivar Cobrançosa.
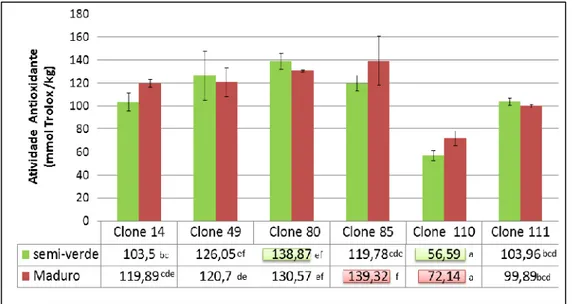
Neste trabalho foram avaliadas as modificações fenólicas e atividade antioxidante de seis Clones de azeitonas da cultivar ´Cobrançosa` entre dois estados de maturação. Os resultados encontram-se representados na tabela 1.
Os resultados da atividade antioxidante variaram entre 56,59 ± 4,39 (Clone 110) e 138,87 ± 6,81 mmol trolox kg-1(Clone 80) para o estado semi-verde e entre 72,14 ± 6,33 (Clone 110) a 139,32 ± 21,33 mmol trolox kg-1 (Clone 85) no estado maduro
(Tabela 1, Gráfico a). Ao comparar a atividade antioxidante de todos os Clones entre os dois estados de maturação verificou-se que apenas no Clone 85 existem diferenças significativas entre o estado semi-verde e o estado maduro (p <0,05).
Gráfico a) Comparação da atividade antioxidante dos 6 Clones de azeitona ´Cobrançosa` entre o estado semi-verde e maduro.
Nos Clones 14, 49, 80, 110 e 111 em relação a este parâmetro não existem diferenças significativas entre os dois estados. Verificou-se ainda que os Clones tendem a comportar-se da mesma maneira em relação a estudos anteriores sendo que, o Clone 110 é o que apresenta menor atividade antioxidante e os Clones 80 e 85 apresentam os maiores valores de atividade antioxidante, independentemente do estado de maturação.
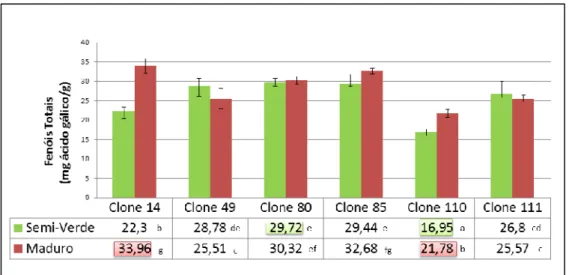
Em relação ao teor em fenóis totais, os resultados variaram respetivamente entre 16,95 ± 0,82 (Clone 110) e 29,72 ± 0,95 mg ácido gálico g-1(Clone 80) e entre 21,78 ±
0,90 (Clone 110) a 33,96 ± 1,79 mg ácido gálico g-1 (Clone 14) para o estado semi-verde e maduro, respetivamente (Tabela 1 e Gráfico b).
Gráfico b) Comparação do teor em fenóis totais dos 6 Clones de azeitona ´Cobrançosa` entre o estado semi-verde e maduro.
O conteúdo em fenóis totais, segundo os resultados de Tovar et al. (2002) para a cultivar Arbequina (g ácido cafeico kg -1 peso seco) diminui significativamente do
Contudo ao comparar dois estados de maturação próximos (semi-verde e maduro) verificou-se que não existiam diferenças significativas. Estes resultados estão de acordo com os obtidos para os Clones 80 e 111. Nos Clones 14, 85 e 110 o conteúdo em fenóis totais aumentou significativamente com a maturação e no Clone 49 diminuiu significativamente.
Nos orto-difenóis os resultados variaram para o estado semi-verde entre 13,61 ± 1,24 (Clone 110) e 41,65 ± 3,68 mg ácido gálico g-1 (Clone 49) e entre 15,84 ± 0,76
(Clone 110) e 40,76 ± 6,81 mg ácido gálico g-1(Clone 80) para o estado maduro (Tabela 1; Gráfico c). Para os Clones 14 e 80 o conteúdo em orto-difenois aumentou significativamente com o estado de maturação. Em relação aos Clones 49 e 111 o mesmo conteúdo diminuiu significativamente. Nos Clones 85 e 110 não se verificaram diferenças significativas entre os dois estados de maturação (p> 0,05).
Gráfico c) Comparação do teor em orto-difenóis dos 6 Clones de azeitona ´Cobrançosa` entre o estado semi-verde e maduro.
Em relação ao conteúdo em flavonoides, para o estado semi-verde os resultados variaram entre 5,08 ± 0,46 (Clone 110) e 21,56 ± 1,58 mg catequina g-1(Clone 49) e
para o estado maduro 7,24 ± 0,78 (Clone 110) e 26,15 ± 1,47 mg catequina g-1 (Clone 14) (Tabela 1; Gráfico d).
O comportamento do conteúdo em flavonoides é semelhante ao dos fenóis totais com exceção do clone 111, no qual se verificou uma diminuição significativa entre o estado semi-verde e maduro.
Gráfico d) Comparação do teor em flavonoides dos 6 Clones de azeitona ´Cobrançosa` entre o estado semi-verde e maduro.
Todos os parâmetros têm uma correlação significativa com a atividade antioxidante, sendo que, os compostos fenólicos são responsáveis por 87,56% da atividade antioxidante e os orto-difenóis e flavonoides por 86,83% e 82,34% da atividade antioxidante, respetivamente (Figura 1).
1.11. Comparação dos parâmetros: atividade antioxidante, compostos fenólicos,
orto-difenois e flavonoides entre o estado semi-verde e maduro de azeites da
cultivar Cobrançosa.
Os resultados para a atividade antioxidante, fenóis totais, orto-difenóis e flavonoides encontram-se representados na tabela 2.
Os valores da atividade antioxidante para os azeites estudados da cultivar Cobrançosa variaram entre: 3,01 ± 0,12 (Clone 110) e 7,49 ± 0,26 mmoles trolox kg-1 (Clone 49) para o estado semi-verde e 2,46 ± 0,15 (Clone 110) a 6,54 ± 0,56 mmoles trolox kg-1(Clones 80) para o estado maduro (Tabela 2; Gráfico e).
Ao comparar os dois estados de maturação verificou-se que três Clones 80, 110 e 111 mantiveram o mesmo comportamento que as azeitonas em relação à atividade antioxidante e não se verificaram diferenças significativas entre o estado semi-verde e maduro. Nestes três casos parece não haver efeito negativo na colheita antecipada das azeitonas, evitando assim, quer a perda de frutos quer a infeção por fungos causados por uma colheita tardia (Gomes et al., 2012).
Todas as amostras apresentaram valores de atividade antioxidante mais elevados quando comparadas com os resultados obtidos para duas cultivares Tunisinas em que os resultados variaram entre 0,61 ± 0,09 e 2,42 ± 0,12 mmol trolox kg-1 (Nabki et al., 2010). Este facto torna a cultivar Cobrançosa bastante interessante para a produção de azeite pelos seus elevados valores de atividade antioxidante, estabilidade, flavor e cor.
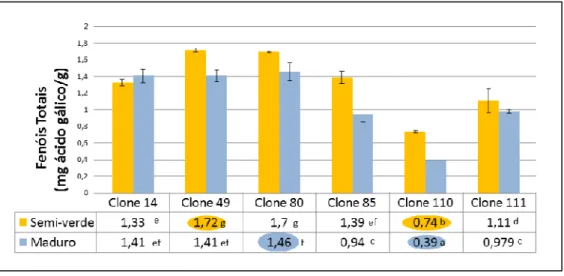
O conteúdo em fenóis totais dos azeites analisados, independentemente do estado de maturação, variou entre: 0,39 ± 0,01 e 1,72 ± 0,02 mg ácido gálico g-1. Estes
resultados mais uma vez são elevados quando comparados com os obtidos por Nabki et al. (2010) com duas cultivares Tunisinas: Chétoui (0,395 mg ácido gálico g-1) e
Chemlati (0,158 mg ácido gálico g-1).
Para o estado semi-verde os valores variaram entre 0,74 ± 0,01 (Clone 110) a 1,72 ± 0,02 (Clone 49) e para o estado maduro entre 0,39 ± 0,01 (Clone 110) to 1,46 ± 0,10 mg ácido gálico g-1(Clone 80) (Tabela 2; Gráfico f).
Gráfico f) Comparação do teor em fenóis totais dos 6 azeites ´Cobrançosa` entre o estado semi-verde e maduro.
Para todos os Clones, o conteúdo em fenóis totais diminuiu significativamente com o estado de maturação, com exceção do Clone 14, onde não se verificaram diferenças significativas entre os dois estados (p> 0,05).
Em relação ao conteúdo em orto-difenóis, nos Clones 49, 80, 110 e 111 não se verificaram diferenças significativas entre os dois estados de maturação, enquanto que nos Clones 14 e 85 se observaram diferenças significativas. Contudo, no Clone 14 houve um aumento significativo do conteúdo em orto-difenois e no Clone 85 uma diminuição do mesmo conteúdo (Tabela 2; Gráfico g). Mais uma vez, verificou-se que o conteúdo em orto-difenóis dos azeites estudados da cultivar Cobrançosa foram elevados quando comparados com resultados da bibliografia, 0,1334 mg ácido gálico g-1; 0,05319
mg ácido gálico g-1(Nabki et al., 2010).
Gráfico g) Comparação do teor em orto-difenóis dos 6 azeites ´Cobrançosa` entre o estado semi-verde e maduro.
Os flavonoides variaram entre 0,78 ± 0,01 (Clone 110) e 1,96 ± 0,03 mg catequina g-1(Clone 49) no estado semi-verde e entre 0,65 ± 0,03 (Clone 110) e 1,7 ±
0,13 (Clone 80) para o estado maduro (Tabela 2; Gráfico h). Ao comparar o conteúdo em flavonoides entre o estado semi-verde e maduro, para todos os Clones, com exceção do 49, não existiram diferenças significativas.
Gráfico h) Comparação do teor em flavonoides dos 6 azeites ´Cobrançosa` entre o estado semi-verde e maduro.
Os fenóis totais são responsáveis por 96,54% da atividade antioxidante enquanto os orto-difenóis e os flavonoides são responsáveis por 97,18 e 96,24%, respetivamente. Verificou-se assim uma correlação altamente significativa de todos os parâmetros com a atividade antioxidante (Figura 2).
1.12. Perfil fenólico dos Clones de azeitonas
O perfil fenólico dos Clones de azeitonas da cultivar Cobrançosa foram analisados por RP-HPLC-DAD.
Os principais compostos identificados compreendem a classe dos ácidos fenólicos, álcoois fenólicos, flavonoides e secoiridoides. Os diferentes Clones estudados apresentam um perfil fenólico semelhante, no entanto os compostos fenólicos identificados apresentam diferentes percentagens de área.
O hidroxitirosol é o álcool fenólico presente nas azeitonas que mais frequentemente é descrito na literatura. Está presente em todos os Clones e de um modo geral os seus valores de percentagem de área entre o estado semi-verde e maduro, não apresentam diferenças relevantes. No entanto, o Clone 110 é uma exceção, uma vez que apresenta valores mais elevados quando comparado com os restantes clones, tanto no estado semi-verde como no estado maduro, destacando-se o estado semi-verde com maior percentagem de área (Tabela 3).
De acordo com Vinhas et al. (2005) o verbascósido é o principal ácido hidroxicinâmico presente nos produtos da oliveira. Nas amostras estudadas, este composto surge com diferentes percentagens de área entre os clones, apresentando valores de 1,92% para o estado semi-verde no Clone 110 e para o mesmo estado de maturação valores de 35,75% no Clone 14. Globalmente, os valores de percentagem de área para este composto diminuem com o estado de maturação, com exceção do clone 85, no qual se verificou um aumento da percentagem de área do verbascósido.
Alguns compostos detetados nas amostras estudadas, não foram identificados, uma vez que não dispúnhamos nem de dados da literatura nem de padrões que permitissem a sua identificação inequívoca. Um desses compostos surge com um tempo de retenção de 28,00 min e é apenas detetado no estado maduro e no Clone 14. Contudo apresenta uma percentagem de área considerável (10,94%) e é um dos maiores compostos identificados (Tabela 3).
A rutina foi identificada em todos os Clones, mas apenas no estado maduro. No entanto, de acordo com os resultados de Morelló et al. (2005), este flavonóide está presente em todos os estados de maturação.
A oleuropeína e o ligostrósido são os secoiridoides mais importantes na azeitona (Morelló et al., 2005). Em relação ao ligostrósido, este foi identificado em todos os clones com uma baixa percentagem de área; no entanto, o Clone 110 foi uma exceção, apresentando uma das percentagens de área maiores. A oleuropeína não foi identificada neste Clone, estando no entanto presente em todos os outros Clones no estado semi-verde.
Um outro composto desconhecido foi identificado com um tempo de retenção de 68,65 min com uma elevada percentagem de área, principalmente no Clone 110.
1.13. Perfil fenólico dos azeites
Os diferentes Clones têm um perfil fenólico semelhante entre os dois estados de maturação, uma vez que, os compostos identificados são semelhantes assim como as percentagens de área (Figura 3), com exceção do Clone 110. Neste Clone, o flavonoide luteolina-7-O-glucósido apresenta uma percentagem de área elevada em ambos os
No entanto, os compostos identificados com tempos de retenção de 41,43 e 45,70 min neste Clone apresentam valores de percentagem de área mais baixos, em ambos os estados de maturação (Tabela 4).
Os compostos com maior percentagem de área foram identificados com tempos de retenção elevados. Mais uma vez, este facto não permite a sua identificação, uma vez que não são comparáveis nem com padrões nem com literatura.
1.14. Análise sensorial dos azeites
Os resultados da avaliação organolética mostraram que as diferentes amostras de azeite da cultivar Cobrançosa – Mirandela em dois estados de maturação foram significativamente diferentes apenas em três atributos: aroma a erva, flavor a erva e no sabor amargo.
Verificou-se que as características consideradas como defeitos dos azeites (Regulamento CEE Nº 2568/91) como aroma a ranço, aroma a vinagre, flavor metálico, flavor a terra, sensação de vinagre e sensação metálica estão presentes a um nível mínimo.
A análise de Clusters descreve a formação de dois grandes grupos, divididos de acordo com o estado de maturação. O grupo 1 engloba os clones numerados do numero (1 a 6), Clone 14 ao 111 no estado semi-verde, enquanto que o grupo 2 engloba os Clones numerados de (7 a 12), no Clone 14 a 111 no estado maduro (Figura 4).
A análise de componentes principais sugere duas componentes principais, que juntas explicam 88% da variação total dos atributos sensoriais.
Os atributos que mais contribuíram para a componente principal 1 foram: aroma a erva, flavor a erva e a sensação metálica (Figura 5). Para a componente principal 2, os atributos que mais contribuíram foram o sabor amargo e a sensação picante.
De entre todas as amostras avaliadas, os provadores mostraram preferência pelo Clone 110 no estado maduro. Esta amostra apresenta um valor médio para o sabor amargo, um aroma a erva elevado e um valor médio para o flavor a erva.
As amostras apresentavam também um amargo característico. Contudo, este atributo está de acordo com o observado por Vaz (2011) para os azeites da cultivar Cobrançosa provenientes da região de Mirandela.
1.15. Referências Bibliográficas
Alves, M. L. V. (2011). Caracterização e estrutura genética da cultivar de oliveira ´ Cobrançosa ` e a sua relação com o zambujeiro. Lisboa: Faculdade de Ciências. Mestrado em Biologia Celular e Biotecnologia, pp. 4.
Amaral, S, J., Mafra, I. e Oliveira, P.P, M. Beatriz. (2010). Characterization of three portuguese varietal olive oils based on fatty acids, triacylglycerols, phytosterols and vitamin E profiles: Application of chemometrics. In: Victor R. Preedy and Ronald Ross Watson (eds), Olives and olive oil in Health and disease prevention. Oxford: Academic Press, pp. 581-589.
Azeite, Casa do. (2012). Casa do Azeite. [online] 15 de Maio de 2012. http://www.casadoazeite.pt/DADOSSECTOR/tabid/56/Default.aspx
Bacelar, E., Gonçalves, B., Montinho-Pereira, J., Correira, C. (2009). Botânica e Morfologia da Oliveira. In: Manuel A. Rodrigues e Carlos Correia (eds). Manual da Safra e Contra Safra do Olival. Bragança: Instituto Politécnico. Capítulo 1.
Cioffi, G., Pesca, M., Caprariis, P., Braca, A., Severino, L., Tommasi, N. (2010). Phenolic compounds in olive oil ando live pomace from Cilento (Campania, Italy) and their antioxidant activity. Food Chemistry, 121, 105-111.
COI, 2012. Internetional Olive Council. [Online] 13 de Maio de 2012. http://www.internationaloliveoil.org/estaticos/view/147-microsite
Conde, C., Delrot, S., Gerós, H. (2008). Physiological, biochemical and molecular changes occurring during olive development and ripening. Journal of Plant Physiology, 165, 1545-1562.
Infection Process of Olive Fruits by Colletotrichum acutatum and the Protective Role of the Cuticle and Epidermis. Journal of Agricultural Science, 4(2), 104-114.
Hajimahmoodi, M., Sadeghi, N., Jannat, B., Oveisi, M.R., Madani, S., Kiayi, M., Akrami, M.R., Ranjbar, A.M. (2008). Antioxidant activity, Reducing Power and Total Phenolic Content of Iranian Olive Cultivar. Journal of Biological Sciences, 8 (4): 779-783.
Lopes, J., Pavão, F., Rodrigues M. Angelo. (2009). Colheita da azeitona. In: Manuel A. Rodrigues e Carlos Correia (eds). Manual da Safra e Contra Safra do Olival. Bragança: Instituto Politécnico. Capítulo 1.
MADRP. (2007). Olivicultora – Diagnóstico Setorial. Ministério da Agricultura Desenvolvimento Rural e Pescas. Lisboa: s.n., 2007.
Morelló, J.R., Romero, P.M., Ramo,T., Motilva, M.J. (2005). Evaluation of L. phenylanine ammonia-lyase activity and phenolic profile in olive drupe (Olea europaea L.) from fruit setting period to harvesting time. Food Science, 168, 65-72.
Nabki, A., Issaoui, M., Kouba, N., Echbili, A., Hammami, M., Attia, N. (2010). Evaluation of antioxidant activities of phenolic compounds from to extra virgin olive oils. Journal of Food Composition and Analysis, 23, 711-715.
Owen, RW., Haubner, R., Wurtele, G., Hull, W., Spiegelhalder, Bartsh, H. (2004). Olives and olive oil in cancer prevention. European Journal of Cancer Prevention, 13: 319-326.
Pires, R.D. (2005). Estudo da Valorização Comercial do Azeite de Trás-os-Montes e Alto Douro. Instituto Politécnico de Bragança, 32-35.
Ronald Ross Watson (eds), Olives and olive oil in Health and disease prevention. Oxford: Academic Press, 177.
Servili, M. and Montero, G. (2002). Contribution of phenolic compounds to virgin olive oil quality, European Journal of Lipid Science and Technology 104, 602-613.
Silva, S., Gomes, L., Leitão, Coelho, A.V, Vilas Boas, L. (2006). Phenolic compounds and antioxidante activity of Olea europaea L. fruits and leaves. Food Science Techology Internacional, 12(5): 385-396.
Tovar, M., Romero, M., Girona, J., Motilva, M. (2002). L-Phenylalanine ammonia-lyase activity and concentration of phenolics in developing olive (Olea europaea L. cv Arbequina) fruit grown under different irrigation regimes. Journal of the Science of Food and Agriculture, 82, 892-898.
Tuck, K. e Hayball, P. (2002). Major phenolic compounds in olive oil: metabolism and health effects. Journal of Nutritional Biochemistry, 13, 636-644.
Vaz, M. (2011). Azeite de Trás-os-Montes: Influência da localização do olival e das cultivares nas características dos azeites. (2nd Edition). Instituto Piaget, Lisboa, 10-142.
Vinhas, A., Ferreres, F., Silva, B., Valentão, P., Gonçalves, A., Pereira, A. J., Oliveira B. M., Seabra, M. R., Andrade, B.P. (2005). Phenolic profiles of portuguese olive fruits (Olea europaea L.): Influences of cultivar and geographical origin. Food Chemistry, 89, 561-568.
Visioli, F., Poli, A., Galli, C.(2002). Antioxidant and Other Biological Activities of Phenols from Olives and Olive Oil. Medicinal Research Reviews, 22(1), 65-75.
2
Cláudia Sousa1*, Diana Barreira1, Maria Teresa Carvalho3, Alice Vilela2, João Lopes4, Paula
Martins-3
Lopes2and Ana I. Barros1
4
1CQ- Chemistry Research Centre, Chemistry Department, University of Trás-os-Montes e Alto Douro,
5
5001-801 Vila Real, Portugal.
6
2Institute of Biotechnology and Bioengineering, Centre of Genomics and Biotechnology – University of
7
Trás-os-Montes and Alto Douro, Vila Real, Portugal.
8
3Instituto Nacional de Investigação Agrária, (INIAV.I.P), Elvas, Portugal.
9
4DRAPN- Direcção Regional de Agricultura e Pescas do Norte, 133, 5370-347, Mirandela, Portugal
10 * Corresponding author 11 Tel:+351259350283 12 Fax: +351259350480 13 e-mail:abarros@utad.pt 14 15
characteristics. This work aimed to study the alterations found in the chemical composition and
18
organoleptic profiles of olive oil in two different ripening stages (semi-ripen and ripe stage) on
19
Cobrançosa olive cultivar. Six different Cobrançosa Clones were used, considering olive drupes
20
and olive oils. Antioxidant activity, phenolic compounds, ortho-diphenols and flavonoid content
21
were determined in all samples using both ripening stages. Olive oils were characterized by a
22
sensorial panel. The phenolic profile was determined using HPLC. The antioxidant activity
23
revealed to not be statically different between the two ripening stages in five olive drupe and
24
three olive oil samples. All chemical parameters presented a high correlation with antioxidant
25
activity. The sensorial parameters that were affected with ripening were herbaceous aroma and
26
flavor and, bitter taste that increased with the ripening.
27 28 29
Keywords: Olive oil, drupes, ripening stage, chemical composition, sensorial parameters
Olive tree is mainly grown in the Mediterranean basin representing around 95% of 32
global area. Spain, Italy, Greece and Portugal are the main producers in the European 33
Union accounting for 76% of worldwide production.1
34
In the Trás-os-Montes region, located in the Northeast of Portugal, olive is one of the 35
most economically important crops.2 Mirandela county accounts for the largest olive
36
tree number (± 950.000) in the region. Cobrançosa cultivar is present in 30% of the 37
olive groves and it is the second most cultivated.3
38
Olea europaea L. products, such as olive oil and olives, are very important in the 39
Mediterranean diet.4
40
Many epidemiological studies have demonstrated that the Mediterranean population 41
enjoys a healthy lifestyle with decreased incidence of degenerative diseases. These same 42
studies focus the importance of olives and olive oil consumption. 5, 6 The benefits of
43
olive products seem to be intrinsically linked to the high monounsaturated fat content 44
(particularly the abundance of oleic acid in olive oil ranging 56 to 84% of total fatty 45
acids), and the presence of minor constituents as tocopherols and phenolic compounds. 46
7, 8
47
Phenolic compounds are secondary metabolites, with a great structural diversity, and an 48
essential part of human diet being considerably interesting due to their antioxidant 49
properties.9, 10 They exhibit a wide range of physiological properties, such as
anti-50
allergenic, atherogenic, inflammatory, antimicrobial, antioxidant, anti-51
thrombotic, cardioprotective and vasidilatory effects. 10 52
Olive drupes contain high phenolic compounds concentration (1-3% of the fresh pulp 53
weight),11 being responsible for important characteristics and properties such as color,
Oleuropein and ligstroside are the predominant secoiridoids and verbascoside is a 58
hydroxycinnamic acid. The flavonoids include flavonol glycosides such as: luteolin-7-59
O-glucoside, rutin and apigenin-7-O-glucoside.9, 11, 13, 14
60
Olive oil obtained directly from olive fruit, using only mechanical extraction, can be 61
consumed without further treatments.3, 7, 12 In olive oil, the major phenolic compounds 62
identified and quantified belong to five different classes: phenolic acids (especially 63
derivates of benzoic and cinnamic acids); flavones (luteolin and apigenin), lignans ((+)-64
pinoresinol and (+)-acetoxypinoresol), phenyl-ethyl alcohols (hydroxytyrosol and 65
tyrosol) and secoiridoids (aglycone derivates of oleuropein and ligstroside).12 Olive oil
66
is a natural product valued for its unique aroma and taste that is directly dependent on 67
the chemical profile. 15, 16 Many factors affect olive oil quality: ripening stage,
68
environmental conditions, cultural practices, oil extraction method, storage condition, 69
sanitary stage of olive drupe a and variety considered to be the most important, 70
influencing olive oil quality and sensory characteristics.2
71
Phenolic compounds confer a bitter and pungent taste to the olive oil. Phenolic acids 72
such as a phenol and cinnamic acid are responsible for the bitter sensation, while 73
secoiridoids confer the peculiar pungency. 7Although high phenol levels are present in
74
olive oils, they are responsible for the stability and for a strong fruity flavor, indicating a 75
high, but not necessarily the most preferred organoleptic quality of the oil.7
76
In this context, the aims were to study the alterations found in the chemical composition 77
of olive drupe and olive oil in two different ripening stages (semi-ripen and ripe stage) 78
on Cobrançosa olive cultivar. Olive oil samples were evaluated sensorial to understand 79
Reagents 82
Folin-Ciocalteu’s reagent, 2,2-azino-bis(3-ethylbenzothiazoline)-6 sulphonic acid 83
(ABTS), Trolox, 3,4,5-trihydroxybenzoic acid (gallic acid), 4-hydroxy-3-84
methoxybenzoic acid (vanillic acid), p-hydroxybenzoic acid, chlorogenic acid, catechin 85
from Sigma-Aldrich, formic acid (pro-analysis) and acetonitrile (HPLC gradient grade) 86
were purchased from Panreac. 87
88
Olive drupe and olive oil samples 89
Six Clones of Cobrançosa olive cultivar maintained in a field collection by the Direção 90
Regional de Agricultura e Pescas do Norte (DRAPN), Ministry of Agriculture, 91
Mirandela, Portugal, were used. 92
Olive drupes were collected in two maturity stages: semi-ripen and ripe. The semi-ripen 93
samples were collected in October (14/10/2011) and the ripe samples were harvested in 94
November (8/11/2011). The six genetically different ´Cobrançosa` Clones 17 were
95
chosen in accordance with previous studies and identified according to yield 18 and
96
antioxidant activity: two identified with high antioxidant activity and yield (Clone 80 97
and 85); two Clones with high antioxidant activity and low yield (Clone 14 and Clone 98
49); one Clone with low antioxidant activity and high yield (Clone 111); one Clone with 99
low antioxidant activity and yield (Clone 110). 100
The olive oil samples were prepared in the Unidade Nacional de Investigação Agrária 101
(INIAV.I.P), Elvas, Portugal. 102
Three kilos of fresh olive drupes were used for olive oil production, using the Abencor 103
system. 104
and incubated at room temperature for 30 min. After, the supernatant was decanted and 109
extractions were repeated three times. The liquid phase was filtrated and subsequent 110
centrifuged at 9.000 rpm for 10 min. To remove the fat phase the mixture was washed 111
twice with hexane (50 mL) using a separatory funnel and the organic phase was 112
discarded. Three replicates per sample were performed. Each was introduced into a 200 113
mL round bottom flask, completing the volume of solution-sign up to capacity with 114
MeOH/H2O (50:50).
115 116
Preparation of olive oil extracts 117
For the extraction of polar phenolic compounds, 4 mL of sample was weighed in a test 118
tube, followed by the addition of 2.5 mL of hexane and 2.5 mL of MeOH/H2O (80:20)
119
mixture. The mixture was centrifuged for 10 min and at 60 rpm. The lower phase was 120
carefully discarded and reserved in a 10 mL volumetric flask. To the remaining mixture, 121
2.5 mL of hexane and 2.5 mL of MeOH/H2O (80:20) was added and centrifuged for 10
122
min at 60 rpm. Once more the lower phase was discarded on the same volumetric flask. 123
This procedure has been repeated three times. For each olive oil sample triplicates were 124
made. 125
126
Antioxidant activity determination 127
The radical-scavenging activity was determined soon after extraction by the 2,2-azino-128
bis(3-ethylbenzothiazoline)-6 sulphonic acid (ABTS) radical cation decolorization 129
assay. 19, 20 For the assay, ABTS+ radical was prepared by mixing an ABTS stock
state. The ABTS+solution was diluted with 20 mM sodium acetate buffer (pH 4.5) to an 133
absorbance of 0.70±0.01 at 734 nm. The reaction was started by the addition of 25, 50, 134
100, 150 and 200 µL of the methanolic extract of the olives diluted conveniently to 2 135
mL of the diluted ABTS+solution. ABTS+bleaching was monitored at 734 nm and 25
136
ºC for at least 30 min and the percentage of discoloration after 15 min was used as the 137
measure of antioxidant activity. The ABTS+ bleaching was proportional to the 138
concentration of the sample added to the medium. The antioxidant activity of the extract 139
was calculated as Trolox Equivalent Antioxidant Capacity (TEAC) and was expressed 140
as mmoles of Trolox equivalents per kg of sample. All measurements were performed 141
in triplicate. A standard curve of the percentage of ABTS+ inhibition in function of
142
Trolox concentration (0.11 to 0.014 mM) was used for the calculations. 143
144
Total phenolic content 145
The content of total phenolic compounds in the olive samples was determined using 146
Folin-Ciocalteu reagent, with gallic acid as standard. This method is based on the 147
reduction of a phosphowolframate-phosphomolybdate complex by phenolics to blue 148
reaction products. 1 mL of diluted samples was mixed with 500 µL of Folin-Ciocalteu 149
reagent, 2 mL of 7.5 % sodium carbonate solution and 6.5 mL of water. The mixture 150
was shaken and the absorbance of the standards and samples was measured at 750 nm 151
after 30 min reaction at 70 ºC in relation to a gallic acid standard curve. All 152
measurements were performed in triplicate. The results were expressed as milligrams of 153
gallic acid equivalents per gram of dry olive (mg GAE g-1).
154 155
(w/v) sodium molibdate in 50 % ethanol to the aliquots of the extract (4 mL). Gallic 159
acid served as a standard to prepare a calibration curve in the 5-200 mg range per gram 160
of solution.21All measurements were performed in triplicate.
161
The ortho-diphenol content was expressed as milligrams of gallic acid equivalents per 162
gram of dry weight (mg GAE g-1). 163
164
Flavonoids content 165
In a test tube 0.5 mL of sample-working solution and 150 μL of NaNO2 5 % were
166
introduced. After 5 min, 150 μL of AlCl310 % were added and 6 min after 1 mL of 1 M
167
NaOH was added. The mixture was shaken and the absorbance of the standards and 168
samples was measured at 510 nm in relation to a catechin standard curve. All 169
measurements were performed in triplicate. The results were expressed as milligrams of 170
catechin per gram of dry olive (mg catechin g-1).
171 172
High Performance Liquid Chromatography (HPLC) analysis 173
RP-HPLC-DAD analysis was performed on a Dionex Ultimate 3000 apparatus (Dionex 174
Corporation) equipped with a photodiodes detector. The column used was a C-18 175
Teknocroma 250 cm in length X 4 mm in diameter and 5 mm particle (Teknocroma, 176
Barcelona). The mobile phase A was an aqueous solution of 5 % formic acid (used as 177
mobile phase to adjust the pH, due to their volatility characteristics and acidifying) and 178
mobile phase B methanol, both HPLC quality laboratories Panreac. The ultra-pure water 179
was obtained from a purification system from Milli-Q Millipore brand. The gradient 180
at 520 nm. The sample volume injected was 50 µL and the flow was 1 mL min-1, and 183
the analysis performed at 35 ºC. 184
185
Sensory Analysis 186
The sensory analyses were performed in accordance with the standard ISO 8589:2007 187
(Portuguesa standard NP 4258:1993).22 Sensory evaluation was performed in a room 188
with controlled environmental and the material necessary for each task. Twelve olive 189
oils were evaluated by a trained panel of twelve elements, belonging to the panel of 190
tasters trained in ECVA-UTAD (DeBA-Enologia). Samples were served at room 191
temperature, in tasting glasses, coded with a three digit code, with a random order of 192
presentation. With the samples, were also provided bread and granny smith apple slices 193
for cleaning the palate. It was carried out a Quantitative Descriptive Analysis (QDA), 194
using proof sheets with attributes adapted from Regulation (CEE) Nº 2568/91. 23 We
195
evaluated the following attributes: fruity aroma, herbaceous aroma, almond aroma, 196
vinegar aroma, rancid aroma, fruity flavor, herbaceous flavor, almond flavor, metallic 197
flavor, earthy flavor, sweet taste, green olives sensation, spicy sensation, vinegar 198
sensation, metallic sensation and bitter taste, with a structural scale ranging from 1 to 6 199 (ISO 4121:2003).24 200 201 Statistics 202
The four variables antioxidant activity, phenolic compounds, flavonoids and ortho-203
diphenols were statistically analysed by ANOVA, and Scheffe’s probability test was 204
performed using the software program “StatView Version 4.5”. Differences were 205
(PCA) and Cluster Analysis (the average Euclidean distance, method UPGMA – 209
unweighted pair-group average). All analyses were performed using the software 210
STATISTICA 2010 (StatSoft Inc., 2010). 211
212
Results and Discussion 213
214
Comparison of antioxidant activity, phenolic compounds, ortho-diphenols and 215
flavonoids in semi-ripe and ripe stage of olive drupes. 216
Olive drupes have been used for direct consumption and oil production, for centuries. 217
One of the major reasons is related to the high amount of polyphenolic compounds 218
present in olive flesh when compared with the majority of other fruits.25
219
In the present work the phenolic modifications and the antioxidant activity in olive 220
drupes of ‘Cobrançosa’ Clones from different yield production in two different stages of 221
ripening (semi-ripen and ripe stage) were studied. In Table 1, the results of these 222
parameters for olive drupe samples are presented. 223
The results of antioxidant activity in semi-ripen olive drupe samples ranged values 224
between 56.59 ± 4.39 (Clone 110) and 138.87 ± 6.81 mmol trolox kg-1(Clone 80) and
225
for the ripe stage ranged values of 72.14 ± 6.33 (Clone 110) to 139.32 ± 21.33 mmol 226
trolox kg-1(Clone 85). The lowest antioxidant activity values were obtained in the same
227
Clone, Clone 110, in the two ripening stages; this Clone was characterized in a previous 228
study as having low yield and low antioxidant activity (personal communication). The 229
Clones that presented the highest antioxidant values in the two ripening stages were not 230
and high antioxidant activity. 232
There are many reports describing the antioxidant activity of olives, however, these are 233
not expressed in the same units and different methodologies have been applied. In 234
accordance to the results presented by Boskou et al. (2006) the antioxidant activity 235
depends on the cultivar studied.4
236
Comparing the antioxidant activity for all the six Clones related to semi-ripen and ripe 237
stage, there are no significant differences (p>0.05) between the two ripening stages of 238
Clones 14, 49, 80, 110 and 111, being the only exception Clone 85 (p<0.05). 239
Total phenolic content, was determined by the Folin-Ciocalteu reagent, with gallic acid 240
as standard (Y= 0.0153x + 0.0813, r2= 0.9982). For semi-ripen and ripe stages the
241
results ranged from 16.95 ± 0.82 (Clone 110) to 29.72 ± 0.95 mg GAE g-1(Clone 80) 242
and from 21.78 ± 0.90 (Clone 110) to 33.96 ± 1.79 mg GAE g-1 (Clone 14),
243
respectively. The phenolic compounds behaved similar to the antioxidant activity, with 244
Clone 110 presenting the lowest values in both ripening stages. The amount of total 245
phenolic compounds presented similar results to those obtained in different Iranian 246
cultivars, 18.41 ± 0.308 and 29.97 ± 0.361 mg GAE g-1.26 247
Tovar et al. (2002) reported total polyphenol contents in olive cultivar Arbequina (g 248
caffeic acid kg-1dry weight) between 85.81 ± 7.35 in the green stage and 60.35 ± 2.83 in
249
the ripe stage, with a decrease in phenolic compounds between the maturation stages.25
250
However, in our results the behavior varied with the Clones where: three Clones (14; 85 251
and; 110) increased their total phenolic compounds, with significant differences 252
between maturation stages (p<0.05); two Clones (80 and 111) maintained similar levels 253
of total phenolic compounds (p>0.05) and; one Clone (49) presented a significant 254
and 111.25
258
The ortho-diphenols content varied between 13.61 ± 1.24 (Clone 110) and 41.65 ± 3.68 259
mg GAE g-1(Clone 49) for the semi-ripen drupes and 15.84 ± 0.76 (Clone 110) to 40.76
260
± 6.81 mg GAE g-1(Clone 80) in the ripe stage.
261
Comparing the levels of ortho-diphenols between both stages, there are two Clones that 262
are not significantly different (85 and 110); whereas Clones 49 and 111 present a 263
significant decrease in the levels of ortho-diphenols between maturation stages. 264
Considering Clones 14 and 80 the amount of ortho-diphenols increased with 265
maturation. Only Clones 85 and 110 presented similar results with previous reports in 266
Arbequina olive cultivar (Tovar et al., 2002) with non-significant differences between 267
maturation stages.25
268
The flavonoid content in the semi-ripen drupe samples was between 5.08 ± 0.46 (Clone 269
110) and 21.56 ± 1.58 mg catechin g-1(Clone 49) and in the ripe stage the values varied
270
between 7.24 ± 0.78 (Clone 110) and 26.15 ± 1.47 mg catechin g-1 (Clone 14).
271
Flavonoid profiles behaved similar to the phenolic compounds; being the exception 272
Clone 111 that presented a significant decrease with maturation. 273
The coefficient of determination between total antioxidant activity and total phenolic 274
compounds is R2=0.7667, suggesting that 87.56 % of the ‘Cobrançosa’ drupe
275
antioxidant activity results from the contribution of phenolic compounds. The ortho-276
diphenols and the flavonoids are responsible for 86.83 % (R2=0.754) and 82.34 % 277
(R2=0.6781) of antioxidant activity, respectively (Fig. 1).
278 279
flavonoids in semi-ripen and ripe stage of olive oil. 281
Many of the benefitial effect of olive oil is attributed to the phenolic compounds, which 282
have a great effect on the stability, sensory and nutritional characteristics and are 283
present in olive oils in a considerable amount.26
284
The olive drupe harvesting date is very important once it interferes in the composition, 285
color and organoleptic characteristics of olive oil. When the harvesting date is 286
anticipated some advantages may be found in comparison to late harvest, such as olive 287
tree has shorter fructification period allowing more time to recover its vegetative state; 288
olive oils are fruitier, with lower acidity and less fruit lost due to over-ripening.27
289
The results for antioxidant activity, phenolic compounds, ortho-diphenols and 290
flavonoids for olive oils are presented in Table 2 and report the different ripening stages 291
and Clones used. 292
The antioxidant activity values obtained in these samples ranged from 3.01 ± 0.12 293
(Clone 110) to 7.49 ± 0.26 mmols trolox kg-1 (Clone 49) in the semi-ripen stage, and
294
2.67 ± 0.15 (Clone 110) to 6.54 ± 0.56 mmols trolox kg-1 (Clones 80) in the ripe stage.
295
All our olive oil samples presented higher antioxidant activity values than those 296
obtained in two Tunisian cultivars, which ranged between 0.61 ± 0.09 and 2.42 ± 0.12 297
mmol trolox kg-1. 6 These can be related to the cultivar used revealing that Cobrançosa
298
may be considered an interesting cultivar to be used in olive oil in order to increase 299
antioxidant activity, and therefore stability, flavor and color. 300
Between semi-ripen and ripe stage there are no significant differences (p>0.05) in three 301
Cobrançosa Clones (80, 110 and 111), presenting the exact behavior that was found in 302
the respective olive drupe samples. In these cases there seems to be no negative effect in 303
Overall, total phenolic compounds ranged values between 0.39 ± 0.01 and 1.72 ± 0.02 306
mg GAE g-1. The results obtained in the olive oil samples are higher than those obtained
307
by Nabki et al. (2010) in two cultivars: Chétoui (0.395 mg GAE g-1) and Chemlati
308
(0.158 mg GAE g-1).6
309
The amount of polyphenols in olive oil samples decreased significantly between the 310
semi-ripen and the ripen stage in all the Clones with the exception of Clone 14 that 311
maintained similar levels (p>0.05). The results of phenolic compounds ranged values 312
between 0.74 ± 0.01 (Clone 110) and 1.72 ± 0.02 (Clone 49) and, 0.39 ± 0.01 (Clone 313
110) to 1.46 ± 0.10 mg GAE g-1(Clone 80) for semi-ripen and ripe stage, respectively.
314
In relation to ortho-diphenol content obtained ranged values between 0.37 ± 0.008 315
(Clone 110) to 0.83 ± 0.02 (Clone 80) for semi-ripen stage and 0.40 ± 0.02 (Clone 110) 316
to 0.82 ± 0.05 (Clone 80) for ripe stage. The ortho-diphenol content in the Clones 317
presented different behaviors. Four Clones (49, 80, 110 and 111) were non-significant 318
different considering the maturation stages; and two Clones (85 and 14) presented 319
significant differences among the stages. However, Clones 85 and 14 presented opposite 320
behaviors, Clone 14 an increase of ortho-diphenols content was observed with the 321
maturation stage; whereas Clone 85 presented a decrease. The ortho-diphenol content 322
obtained in the Cobrançosa olive oil samples are higher when compared with the values 323
obtained for cultivars Chétoui (0.1334 mg GAE g-1) and Chemlati (0.05319 mg GAE g
-324
1).6
325
The flavonoids contents are not significant between both stages for all the Clones, with 326
the exception of Clone 49. The values ranged 0.78 ± 0.01 (Clone 110) to 1.96 ± 0.03 mg 327
(Clone 80) mg catechin g-1for the ripe stage. 329
When comparing with the results obtained in the olive drupe samples, as expected, olive 330
oil produced from Clone 110 presented the lowest values for all the parameters. The 331
highest values were observed in the olive oils from Clones 49 and 80, independently of 332
the ripening stage. 333
The coefficient of determination between total antioxidant activity and total phenolic 334
compounds in olive oil samples is R2=0.932, these results suggest that 96.54 % of the
335
antioxidant activity of ‘Cobrançosa’ olive oil results from the contribution of phenolic 336
compounds ortho-diphenols and flavonoids are responsible for 97.18 % (R2=0.9445)
337
and 96.24 % (R2=0.9263) of antioxidant activity, respectively (Fig. 2).
338 339
Phenolic profile of olive drupe Clones 340
The phenolic profiles of the olive drupes were analyzed by RP-HPLC-DAD. Three 341
identification strategies were used for polyphenolic profile characterization in the 342
‘Cobrançosa’ olive Clones. 343
When reference compounds were available as standards, the presence or absence of a 344
particular polyphenolic compound was assessed by comparison of the retention time 345
and UV-vis spectra. Secondly, when reference compounds were not available, 346
confirmation was performed by examining the UV-vis spectra in comparison with the 347
retention time and UV-vis spectra available in the literature.29, 30Thirdly, major peaks in
348
the chromatograms that were not identified by either of the other screening processes 349
were classified according to the UV–vis spectra. 350
In table 3 are presented the main compounds identified in ‘Cobrançosa’ olive drupe that 351
Some phenolic alcohols, as hydroxytyrosol, are present in all the Clones with similar 355
percentage area values not differing among semi-ripen and ripe stage. Clone 110 is an 356
exception, once it presents higher values when compared with the other Clones; it also 357
presents higher percentage area in semi-ripen stage when compared with the ripe stage. 358
According to Vinhas et al. (2005) verbascoside is the main hydroxycinamic acid olive 359
drupe derivate.9In the present work, the Clones analyzed presented different values of
360
percentage area, ranging between 1.92 % for Clone 110 in semi-ripen stage to 35.75 % 361
in Clone 14 in the same ripening stage. Overall the value of percentage area decreased 362
with the ripening stage, but in Clone 85 there is an increase of verbascoside. 363
Some compounds detected in the studied samples have not been identified once their 364
retention time and the UV-vis spectra are not in accordance neither with the literature 365
nor with the standard samples. One of these compounds, with a retention time of 28.00 366
min is only detected in the ripe stage of Clone 14, and presents a considerable 367
percentage of area (10.94 %) being one of the major compounds identified in this 368
Clone. 369
Rutin has been identified in all the Clones, but only in the ripe stage. However, in 370
accordance to the results obtained by Morelló et al (2005), this flavonoid has been 371
described as being present in all the maturation stages. 31Oleuropein and ligstroside are
372
the most important secoiridoids in olive fruit pulp.31
373
In relation to ligstroside, it is identified in all the Clones in a low percentage of area, 374
being Clone 110, once again, an exception, once its percentage is one of the highest for 375
this Clone. Another interesting behavior of this Clone is related to the oleuropein 376
Clones studied in the semi-ripening stage. 378
Another unknown compound, with a retention time of 68.65 min, is present with a 379
significant higher percentage of area in Clone 110 when compared with the other 380 Clones. 381 382 383 384
Phenolic profile of olive oil Clones 385
The olive oil samples’ phenolic profiles considering the different Clones in semi-ripen 386
and ripe stage are presented in table 4. 387
The different Clones have a similar phenolic profile between both ripening stages once 388
the phenolic compounds identified are similar, as are the relative areas with the 389
exception of Clone 110. In this Clone the flavonoid luteolin-7-O-glucoside is higher 390
when compared with the other Clones; nevertheless the compounds identified with 391
retention times of 41.43 and 45.70 min in this Clone presented lower values for 392
percentage of areas in both ripening stages. 393
The compounds with the major percentage of area are identified with the higher values 394
of retention times. This fact doesn’t allow their identification, once they aren’t 395
comparable neither with available standards nor with literature. 396
397
Organoleptical evaluation of olive oils 398
The results obtained showed that the different olive oil samples, from cultivar 399
Cobrançosa from the Mirandela region, in two stages of ripening are significantly 400
metallic sensation) described in Regulation (CEE) Nº 2568/91 were found in our 405
samples at a minimal level.23
406
With Cluster analysis, figure 4, it was possible to observe the formation of two major 407
groups divided by their maturation stage: group 1 (Clones 14 to 111 - olive oil samples 408
in a complete mature stage), and group 2 (Clones 14 to 111- olive oil samples in semi-409
ripe stage of maturation). 410
The PCA showed two interpretable components, explaining together 88 % of the total 411
variation in sensory attributes. The attributes that most contribute for principal 412
component 1 were: herbaceous aroma, herbaceous flavor and metallic sensation. For 413
principal component 2 were: bitter taste and spicy sensation (Fig. 5). 414
Among all the olive oil samples evaluated, Clone 110 in ripe stage was the preferred by 415
the tasters. This sample has a medium value for bitter taste, high medium value for 416
herbaceous aroma, and a low medium value for herbaceous flavor. In accordance with 417
Vaz (2011) the olive oils from Mirandela region have a bitterness characteristic 418
sensation, what is in agreement with our olive oil samples.3 419
420
Conclusions 421
Overall the antioxidant activity, phenolic compounds, flavonoids and ortho-diphenol 422
contents of the olive drupes and olive oil samples of Cobrançosa Clones were different. 423
Although they presented a similar chemical profile using HPLC, the areas of the 424
identified compounds were different. 425
The ripening stage does not affect overall the chemical composition of the olive drupes 426
activity, phenolic content, ortho-diphenols and flavonoids decrease with the ripening in 429
olive oil samples, producing an higher herbaceous flavor and aroma, and bitter taste. 430
Therefore, in general the fact that olive growers harvest their drupes earlier does not 431
seem to affect the quality and acceptance of the olive oils. Thus, early harvesting can 432
avoid some olive drupe fungal infection, which can appear with the first rainfall, 433
affecting both olive oil yield and quality. 434
Considering the results obtained in this work and in a previous work the selection of 435
Cobrançosa Clones 80 and 85 is advisable once these two Clones presented the most 436
interesting features considering: high antioxidant activity values and high yield, 437
independently of maturation stage. 438
439 440 441