UNIVERSIDADE DE LISBOA
FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA E BIOQUÍMICA
BIOLOGICAL ACTIVITIES OF
Plectranthus barbatus
AQUEOUS EXTRACTS.
IN VITRO
AND
IN VIVO
STUDIES OF ACTIVITY,
BIOAVAILABILITY AND METABOLISM.
Pedro Luis Vieira Falé
DOUTORAMENTO EM BIOQUÍMICA
(Bioquímica Farmacêutica e Toxicológica)
2011
UNIVERSIDADE DE LISBOA
FACULDADE DE CIÊNCIAS
DEPARTAMENTO DE QUÍMICA E BIOQUÍMICA
BIOLOGICAL ACTIVITIES OF Plectranthus barbatus
AQUEOUS EXTRACTS.
IN VITRO AND IN VIVO STUDIES OF ACTIVITY,
BIOAVAILABILITY AND METABOLISM.
Pedro Luis Vieira Falé
DOUTORAMENTO EM BIOQUÍMICA
(Bioquímica Farmacêutica e Toxicológica)
Tese orientada por
Prof. Doutora Maria Luísa Mourato Oliveira Marques Serralheiro
Prof. Doutora Lia Maria Pereira de Ascensão Santos e Sousa
The work presented in this thesis was performed in the Centro de Química e Bioquímica da Faculdade de Ciências da Universidade de Lisboa, with the financial support of Fundação para a Ciência e a Tecnologia (SFRH/BD/37547/2007)
v
De acordo com o disposto no Artigo nº 41 do Regulamento de Estudos Pós‐Graduados da Universidade de Lisboa, Deliberação nº 1506/2006, publicada no Diário da República, 2ª série—Nº 209—30 de Outubro de 2006, foram incluidos nesta dissertação resultados dos seguintes artigos:
Falé PL, Borges C, Madeira PJA, Ascensão L, Araújo MEM, Florêncio MH, Serralheiro MLM. 2009.
Rosmarinic acid, scutellarein 4’‐methyl ether 7‐O‐glucuronide and (16S)‐coleon E are the main compounds responsible for the antiacetylcholinesterase and antioxidant activity in herbal tea of
Plectranthus barbatus (‘‘falso boldo”). Food Chem. 114: 798–805.
Porfirio S, Falé PL, Madeira PJA, Florêncio H, Ascensão L, Serralheiro MLM. 2010. Antiacetylcholinesterase and antioxidant activities of Plectranthus barbatus tea, after in vitro gastrointestinal metabolism, Food Chem. 122: 798–805.
Falé PL, Madeira PJ, Florêncio MH, Ascensão L, Serralheiro MLM. 2011. Function of Plectranthus
barbatus herbal tea as neuronal acetylcholinesterase inhibitor. Food Funct. 2: 130‐136.
Falé PL, Ascensão L, Serralheiro MLM, Haris PI. 2011. Interaction between Plectranthus barbatus herbal
tea components and human serum albumin and lysozyme: binding and activity studies. Spectroscopy. 26: 79–92.
Falé PL, Ascensão L, Serralheiro MLM, Haris PI. Interaction between Plectranthus barbatus herbal tea
components and acetylcholinesterase: binding and activity studies. Submitted to Food Funct.
Falé PL, Ascensão L, Serralheiro MLM. Bioavailability of rosmarinic acid, luteolin, apigenin‐modelling
plant herbal teas through Caco‐2 cell monolayers. To be submitted to Food Chem.
Falé PL, Filipe MA, Ascensão L, Serralheiro MLM, Mira L. Activity of Plectranthus barbatus extract against
inflammatory response in human neutrophils. To be submitted to Plant Food Hum. Nutr.
No cumprimento do disposto na referida deliberação, esclarece‐se serem da minha responsabilidade a execução das experiências que estiveram na base dos resultados apresentados, assim como a interpretação e discussão dos mesmos.
vii
Aknowledgements
Many people have contributed, directly or indirectly, to the successful completion of this work. First, I would like to express my deepest gratitude to Professor Maria Luísa Serralheiro for her guidance and counseling, all the challenges, the knowledge and, most of all, the practical (engineer-like) point of view. The elaboration of this work under her guidance was not only a scientifically rewarding experience, but also a pleasant one.
I would like also to thank to Professor Lia Ascensão for the guidance and attention to details the elaboration of this work. I would also like to thank her for the support, friendship, and continuous encouragement all these years.
To Professor Parvez Haris, his group, and staff at the De Montfort University, in Leicester, I would like to thank for the hospitality and for all the support in the studies developed there.
To Professor Maria Helena Florêncio I would like to thank the expertise in the compound identification by mass spectrometry. To Paulo Madeira I would also like to thank, not only the help in mass spectrometry anlysis, but also for the lighter moments and all his patience for listening expressions such as “Are you sure about this structure? I don’t like it!”.
I would also like to thank to Sara Porfírio, Ines Sousa Lima, Rita Carilho, Susana Santos, Catarina Costa, Leticia Silva, Pedro Cleto, Neusa Figueiredo, Ana Margarida Rodrigues, Francesca Amaral and Catarina Ferreira, the Master students that helped, even if only by their enthusiasm.
Last, but not least, I am grateful to my friends from the “family of C4 library”, for providing the encouragement and a stable (geek) environment. To Charlie, for lightening (and enlightening) my life even in the toughest moments. And to my family, especially my Mother, for the support through this period, but also in my dedication to such an odd area as Science, instead of Arts.
ix
Summary
The Plectranthus barbatus herbal tea is traditionally used to treat a wide range of health conditions, including psychiatric problems, gastrointestinal disturbances and inflammation‐related conditions. The aim of this work was to determine if P. barbatus herbal tea may be useful in the treatment of acetylcholinesterase or inflammation related diseases, such as Alzheimer’s disease.
In vitro activities of the P. barbatus aqueous extract were determined, namely anti‐
acetylcholinesterase activity, antioxidant activity as radical scavenger and preventing lipid peroxidation, and anti‐inflammatory activity by decreasing the amount of hypochlorous acid produced by activated neutrophils. The values obtained for the in vitro activities were very promising and related with its content in rosmarinic acid, flavonoid glucuronides and abietane diterpenoids. After in vitro digestion with gastric and pancreatic juices, bacterial β‐glucuronidase and metabolization by Caco‐2 cells, the anti‐acetylcholinesterase activity of the plant extract suffered a slight decrease due to the loss of one active diterpenoid.
The bioavailability of the plant extract was determined by administering it to rats and analyzing the rat plasma and brain. The extract components suffered glucuronidation, sulfation and methylation by the intestine and by the liver, but the plant compounds were found in rat brains and brain acetylcholinesterase activity showed an inhibition reaching 30%. As the bioavailability of rosmarinic acid was not the same when in the extract and when alone, the interference of plant phenolics on the permeability of each other was tested in Caco‐2 monolayers using rosmarinic acid and two flavonoids, apigenin and luteolin. This study showed that the compounds have higher intestinal permeability when in a mixture due to the inhibition of the efflux transporters that limit their bioavailability.
The compounds from the P. barbatus extract can bind to the protein structure of acetylcholinesterase, human serum albumin and lysozyme by weak interactions such as hydrophobic interactions and hydrogen bonds. These interactions are the cause of the reversible inhibition of the enzymatic activity of acetylcholinesterase and lysozyme; therefore the compounds are less susceptible to cause side effects when used therapeutically.
The P. barbatus herbal tea may be used to treat cholinesterase‐related problems such as gastrointestinal conditions and Alzheimer’s disease as its active components may reach the target organs, and brain acetylcholinesterase inhibition was detected. The compounds may circulate in the plasma bound to albumin and lysozyme, and may decrease inflammation by their radical scavenger activity, by decreasing neutrophil‐produced hypochlorous acid and by inhibiting lysozyme activity.
x
Keywords: Acetylcholinesterase; Antioxidant; Bioavailability; Plectranthus barbatus;
Rosmarinic acid.
xi
Resumo
Infusões e decocções de Plectranthus barbatus são usadas tradicionalmente para uma grande diversidade de fins terapeuticos, incluido o tratamento de problemas psiquiátricos, distúrbios gastro‐intestinais e doenças relacionadas com processos inflamatórios. O objectivo deste estudo é determinar se o extracto aquoso de P. barbatus, preparado como decocção, poderá ser útil no tratamento de problemas relacionados com a actividade do enzima acetilcolinesterase ou com processos inflamatórios.
Um extracto aquoso de P. barbatus foi preparado como decocção e foram determinadas, in vitro, as actividades anti‐acetilcolinesterase, antioxidante e anti‐inflamatória. Nestas actividades in vitro foram obtidos resultados muito promissores, com valores de IC50 baixos para a inibição da actividade do enzima acetilcolinesterase, actividade antioxidante no sequestro de radicais livres e protegendo lipidos de peroxidação, e na actividade anti‐ inflamatória pela diminuição da quantidade de ácido hipocloroso produzido por neutrófilos activados. Estas actividades estavam relacionadas com a composição do extracto de P.
barbatus, sendo ácido rosmarinico o composto maioritário, mas encontrando‐se também
presentes flavonóides glucuronados (apigenina 7‐O‐glucurónido, luteolina 7‐O‐glucurónido e acacetina 7‐O‐glucurónido) e diterpenoides. Após a digestão in vitro do extracto vegetal com sucos gástrico e pancreático artificiais, da acção de β‐glucuronidase de bactérias da microflora intestinal e da metabolização por células Caco‐2, como modelo de células intestinais humanas, a actividade do extracto sofreu uma diminuição devido à perda de um diterpenoide activo, no entanto os outros compostos activos permaneceram intactos.
A biodisponibilidade da decocção de P. barbatus foi determinada por administração intragástica e intraperitoneal a ratos, recolhendo‐se e analisando‐se o plasma e o cérebro dos ratos por HPLC. Os componentes da decocção foram metabolisados no intestino e no fígado, sofrendo glucuronidação, sulfatação e metilação. Encontrou‐se ácido rosmarínico no cérebro dos ratos após a administração do extracto, e o cérebro apresentava uma inibição da actividade da acetilcolinesterase atingindo aproximadamente 30%, sugerindo que outros compostos ou metabolitos dos componentes da decocção pudessem estar presentes em quantidades inferiores ao limite de detecção, mas que mesmo assim iriam influenciar a actividade enzimática. Como se encontraram algumas alterações entre a biodisponibilidade do ácido rosmarínico administrado no extracto ou administrado isolado, procedeu‐se ao estudo da interferência que compostos fenólicos possam ter na permeabilidade uns dos outros quando administrados em misturas, em membranas de células Caco‐2. Nesse estudo recorreu‐se ao método de “central composite design” CCD para determinar se existiriam
xii
diferenças entre a permeabilidade e metabolização de ácido rosmarínico, apigenina e luteolina em membranas de células Caco‐2, induzidas pela presença uns dos outros. Foram também co‐ administrados substractos de dois sistemas transportadores conhecidos, o transportador de ácidos monocarbóxilicos (MCT) e a glicoproteina‐P (Pgp), e concluiu‐se que os compostos da decocção de P. barbatus tinham maior permeabilidade por estarem em conjunto, uma vez que uns compostos inibiam os transportadores de efluxo dos outros. A biodisponibilidade dos substratos dos transportadores de efluxo presentes na membrana apical aumenta com a inibição dos transportadores, pois estes transportam activamente os seus substratos para o lúmen do intestino, limitando assim a passagem para a circulação sanguínea.
A interacção entre os compostos do extracto de P. barbatus e proteinas foi avaliado através de técnicas de espectrometria de fluorescência e FTIR. Os componentes da decocção de P. barbatus têm a capacidade de se ligar à estrutura proteica da acetilcolinesterase, da albumina de soro humano e da lisozima através de interacções fracas, nomeadamente interacções hidrofóbicas e pontes de hidrogénio. Por se tratarem de ligações fracas e não se terem encontrado alterações da estrutura secundária das proteinas, estas interacções serão responsáveis pela inibição reversivel da actividade enzimática da acetilcolinesterase e da lisozima. Este tipo de interacções são as mais recomendadas para compostos a ser utilizados para fins terapeuticos pois evitam efeitos secundários resultantes da inibição destes enzimas por inibidores que formam complexos através de ligações mais fortes, como ligações covalentes, e induzem alterações profundas na estrutura proteica levando à desnaturação.
Decocções de P. barbatus poderão ser utilizadas para tratar problemas relacionados com a actividade da acetilcolinesterase, como a doença de Alzheimer, pois após a administração os seus componentes poderão ser encontardos a a nivel do intestino, plasma e cérebro, inibindo a actividade da acetilcolinesterase no cérebro. Os componentes da decocção poderão circular na corrente sanguínea associados à albumina e à lisozima, e poderão reduzir processos inflamatórios devido à sua actividade sequestradora de radicais livres, à sua capacidade de diminuir a quantidade de àcido hipocloroso produzido por neutrófilos activados, e por inibir a atividade enzimática da lisozima.
Palavras‐chave: Acetilcolinesterase; Ácido Rosmarínico; Antioxidante; Biodisponibilidade;
Plectranthus barbatus.
xiii
Table of Contents
Acknowledgments
viiSummary
ixResumo
xiTable of Contents
xiiiFigure List
xviiTable List
xxAbbreviations
xxiiCHAPTER 1 – GENERAL INTRODUCTION
1 1. Literature Review 3 1.1. Plectranthus species and their ethnobotanical uses 3 1.2. Herbal tea components and their bioavailability 4 1.2.1. Phenolic acids 4 1.2.2. Flavonoids 6 1.3. Biological activities of herbal teas and their components 9 1.3.1. Acetylcholinesterase inhibitors 9 1.3.1.1. Acetylcholinesterase inhibitors and Alzheimer’s disease 10 1.3.1.2. Acetylcholinesterase inhibitors to treat gastrointestinal disorders 13 1.3.1.3. Finding acetylcholinesterase inhibitors ‐ from in vitro to in vivo studies 14 1.3.2. Inflammation and Antioxidants 16 2. Thesis overview 19CHAPTER 2 – MATERIALS AND METHODS
21 1. Plant material 23 2. Animals 23 3. Chemicals 23 4. Extract preparation 24 5. Acetylcholinesterase inhibition 24 6. Determination of antioxidant activity 25 7. HPLC analysis 26 8. NMR spectroscopy 26 9. Mass spectrometry experiments 26 10. In vitro intragastric metabolism assays 27 10.1. In vitro metabolism by the gastric juice 27 10.2. In vitro metabolism by pancreatic juice 27 10.3. Glucuronidase activity 28 10.4. Metabolism by the Caco‐2 cells 28 10.5. Antiacetylcholinesterase and antioxidant activities of the digested extracts 28 11. In vitro conjugation studies for metabolites identification 29 11.1. Preparation of cell‐free extracts 29 11.2. Glucuronidation assay 29xiv 11.3. Synthesis and identification of methyl rosmarinic acid 29 12. In vivo studies protocol 30 12.1. Intragastric and intraperitoneal administration 30 12.2. Plasma and brain sample preparation 30 12.3. Determination of glucuronidated and sulfated metabolites 30 12.4. Preparation of samples for HPLC analysis 31 12.5. Determination of acetylcholinesterase activity in brain samples 31 13. Protein fluorescence measurements 31 14. FTIR measurements 32 15. Lysozyme activity measurements 33 16. Measurement of hypochlorous acid in activated human neutrophils 33 16.1. Isolation of human neutrophils 33 16.2.Measurement of hypochlorous acid formation by human neutrophils 33 17. Caco‐2 bioavailability experiments 34 17.1. Study of the permeability and the metabolism of rosmarinic acid, luteolin and apigenin 34 17.2. Study of the effect of transport systems (MCT and Pgp) on the permeation of apigenin, luteolin and rosmarinic acid 35 17.3. HPLC analysis and bioavailability quantification 35 18. Statistical analysis 36
CHAPTER III ‐ SCREENING FOR ANTIACETYLCHOLINESTERASE AND
ANTIOXIDANT ACTIVITIES IN PLECTRANTHUS SPECIES. IN VITRO METABOLISM
AND ANTI‐INFLAMMATORY STUDIES
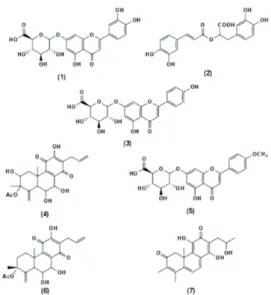
37 1. Screening for antiacetylcholinesterase and antioxidant activities in Plectranthus species 39 1.1. Introduction 39 1.2. Materials and Methods 40 1.3. Results 40 1.3.1. General 40 1.3.2. Acetylcholinesterase inhibition 41 1.3.3. Antioxidant Activity 42 1.3.4. Identification of the main component of the Plectranthus extracts, responsible for the enzyme inhibition activity 42 1.4. Discussion 45 1.5. Conclusion 46 2. In vitro Digestion Activities of Plectranthus barbatus Aqueous Extract and Activities of the Digested Product 47 2.1. Introduction 47 2.2. Materials and Methods 48 2.3. Results and Discussion 48 2.3.1. Main composition of P. barbatus herbal tea 48 2.3.2. In vitro metabolism of the extract by the gastric and pancreatic juices. Biological activity of the resulting products 50xv 2.3.3. Metabolism of the plant extract by Caco-2 cells and biological activity of
the final products 53
2.3.4. Metabolism of the plant extract by the β-glucuronidase from E. coli,
biological activities and Caco-2 cells permeation of the final products 55
2.4. Conclusion 57
3. Activity of Plectranthus barbatus extract against inflammatory response in human
neutrophils 59
3.1. Introduction 59
3.2. Materials and Methods 60
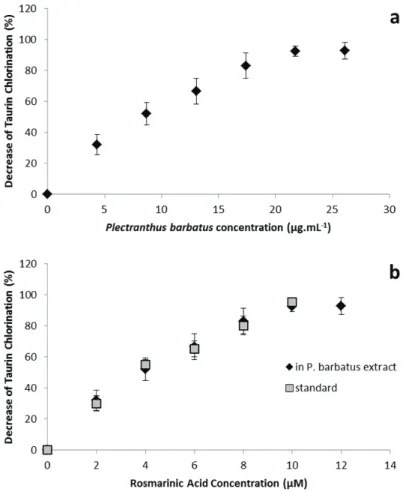
3.3. Results and Discussion 60
3.4. Conclusions 63
4. Conclusions 64
CHAPTER IV – BIOAVAILABILITY STUDIES IN RATS AND CACO-2 CELL
MONOLAYERS
651. Plectranthus barbatus aqueous extract bioavailability and resulting neuronal
acetylcholinesterase inhibition in rats 67
1.1. Introduction 67
1.2. Materials and Methods 68
1.3. Results and Discussion 68
1.3.1. Intragastric administration of P. barbatus extract 68 1.3.2. Intraperitoneal administration of P. barbatus extract 71
1.4. Conclusions 76
2. Bioavailability of mixtures of rosmarinic acid, luteolin and apigenin through Caco-2 cell monolayers, modeling the bioavailability of plant herbal teas. 77
2.1. Introduction 77
2.2. Material and Methods 78
2.3. Results 78
2.3.1. Bioavailability of Plectranthus barbatus herbal tea 79 2.3.2. Bioavailability of a mixture of the standards rosmarinic acid, apigenin and
luteolin 80
2.3.4. Effect of MCT and Pgp transporter systems on the bioavailability of the
polyphenol mixture 82
2.4. Discussion 86
2.5 Conclusions 89
3. Conclusions 91
CHAPTER V – INTERACTIONS BETWEEN THE Plectranthus barbatus HERBAL
TEA AND THE PROTEINS ACETYLCHOLINESTERASE, HUMAN SERUM ALBUMIN
AND LYSOZYME
931. Interaction between the Plectranthus barbatus extract and acetylcholinesterase. Binding of herbal tea components to the protein structure and inhibition of
enzymatic activity 95
1.1. Introduction 95
1.2. Materials and Methods 96
1.3. Results 97
1.3.1. Fluorescence studies on the binding of P. barbatus water extract to
xvi
1.3.2. Analysis of binding equilibria of P. barbatus water extract to
acetylcholinesterase 99
1.3.3. Determination of interaction forces between P.barbatus extract and
AChE 101
1.3.4. Determination of protein structure changes caused by P. barbatus
extract and its plasma metabolites by FTIR spectroscopy 102
1.4. Discussion 105
1.5. Conclusions 107
2. Interaction between Plectranthus barbatus herbal tea components and human
serum albumin and lysozyme: binding and activity studies 109
2.1. Introduction 109
2.2. Material and Methods 110
2.3. Results 110
2.3.1 Binding of P. barbatus to albumin and lysozyme 110 2.3.2. Analysis of binding equilibria 112 2.3.3. Determination of interaction forces between P. barbatus extract
metabolites and HSA and lysozyme 115
2.3.4. Determination of protein structure changes caused by P. barbatus
extract and its plasma metabolites by FTIR 116 2.3.5. Effect of P. barbatus extract on lysozyme activity 118
2.4. Discussion 118
2.5. Conclusions 122
3. Conclusions 123
CHAPTER VI – GENERAL DISCUSSION AND CONCLUSIONS
125xvii
Figure List
Figure 1.1. Plectranthus barbatus 4 Figure 1.2. Chemical structures of some common phenolic acids. 5 Figure 1.3. Basic chemical structures of the main classes of flavonoids. 7 Figure 1.4. Structures of (a) quercetin, (b) apigenin and (c) luteolin. 7 Figure 1.5. Active gorge of acetylcholinesterase (Abu‐Donia, 2003). 10 Figure 1.6. Tacrine binding to the active gorge of acetylcholinesterase, and details showing the amino acid residues involved in the interaction between the two molecules (PDB 1ACJ, Harel et al., 1993). 11 Figure 1.7. Biochemical pathways associated with the formation of amyloid plaques and neurofibrillary tangles in Alzheimers’s Disease patients. (www.calbiochem.com/alzheimers). 12 Figure 1.8. Reaction associated with the Ellman assay to quantify acetylcholinesterase activity. The final product TNB can be spectrofotometrically detected due to its absorption at a wavelength of 405 nm. (adapted from Frasco et al., 2005) 15 Figure 1.9. Antioxidant strategies in Alzheimer’s disease. Solid arrows represent the mechanisms of the disease and dashed arrows represent the mechanisms of antioxidant therapy (Adapted from Dumond and Bael (2011)). 18 Figure 3.1. HPLC chromatogram of decoctions: (a) Plectranthus barbatus and (b) Plectranthus verticillatus. 43 Figure 3.2. UV spectra obtained by HPLC‐diode array of (a) compounds with retention time 19.2 min and (b) caffeic acid. 43 Figure 3.3. NMR spectra of (a) Plectranthus barbatus extract, (b) Plectranthus verticillatus extract and (c) rosmarinic acid standard. 44 Figure 3.4. Structure of the compounds with retention time 19.2 min, rosmarinic acid. 44 Figure 3.5. Overlay of UV spectra obtained by HPLC‐diode array of compounds with a retention time 19.2 min (——) and the standard rosmarinic acid (___). 45 Fig. 3.6. HPLC chromatogram of Plectranthus barbatus herbal tea: 1, luteolin 7‐O‐glucuronide (retention time 8.68 min); 2, rosmarinic acid (RT: 9.38); 3, apigenin 7‐O‐glucuronide (RT: 10.11); 4, hydrolysed abietane (RT: 12.58); 5, acacetin 7‐O‐glucuronide (RT: 13.62); 6, abietane diterpenoid (RT: 14,15); 7, (16S)‐coleon E (RT: 18.54). 49 Figure 3.7. Chemical structure of compounds present in P. barbatus herbal tea: 1, luteolin 7‐O‐ glucuronide; 2, rosmarinic acid; 3, apigenin 7‐O‐glucuronide; 4, hydrolysed abietane; 5, acacetin 7‐O‐glucuronide; 6, abietane diterpenoid; 7, (16S)‐coleon E. 50xviii Figure 3.8. HPLC chromatograms before and after the incubation of Plectranthus barbatus extract with: (a) gastric juice, (b) pancreatic juice. *Indicates the residue of pancreatin. For the identification of the peak numbers, refer to Figure 3.4. 51 Figure 3.9. Variations in peak areas of compounds present in herbal tea after 4 h digestion with artificial pancreatic juice. () Luteolin 7‐O‐glucuronide; () rosmarinic acid; () apigenin 7‐O‐glucuronide; () hydrolysed abietane; (○) acacetin 7‐O‐glucuronide; (●) abietane diterpenoid. 53 Figure 3.10. Chromatograms of compounds inside the Caco‐2 cells (homogenates) after 6 h contact with (a) P. barbatus extract, (b) rosmarinic acid standard. 2, rosmarinic acid; *, residual peak from the Caco‐2 cells. 55 Figure 3.11. HPLC chromatogram after the action of β‐glucuronidase from E. coli on the herbal tea. Compounds identified with numbers 1–7, refer to Figure 3.6. Peaks signaled with arrows: 8, luteolin; 9, apigenin; 10, acacetin. 56 Figure 3.12. Variations in peak areas of: (a) apigenin and (b) luteolin. Each figure shows the metabolites after 6 h in the presence of Caco‐2 cells. Peak areas are presented as percentage of the initial area. () aglycones and () glucuronides. 57 Figure 3.13. Decrease of taurine chloration in the presence of several concentrations of P. barbatus extract (a and b) or standard rosmarinic acid (b). The concentration of P. barbatus is expressed in µg.mL‐1 (a) or by its content in rosmarinic acid in µM (b). 61 Figure 4.1. HPLC analysis, 30 and 60 min after intraperitoneal administration of P. barbatus extract, of (a) plasma and (b) brain. 1: luteolin 7‐O‐glucuronide (retention time 9.6 min); 2: rosmarinic acid (RT: 10.4); 3: apigenin 7‐O‐glucuronide (RT: 11.2); 4: abietane diterpenoid (RT: 13.8); 5: acacetin 7‐O‐glucuronide (RT: 15.1); 2m: monomethylated rosmarinic acid; 1g: luteolin
glucuronide derivative; 3’: apigenin. 72 Figure 4.2. Permeation surfaces for (a) rosmarinic acid, (b) luteolin and (c) apigenin with different concentrations of the other two components, built with the CCD experimental plan. The relative errors are 0.930 (a), 0.718 (b), and 0.817 (c). 81 Figure 4.3. Glucuronidation surfaces for (a) luteolin and (b) apigenin with different concentrations of rosmarinic acid and of the other flavonoid, built with the CCD experimental plan. The relative errors are 0.981 (a), and 0.766 (b). 82 Figure 4.4. Distribution of (a) rosmarinic acid, (b) luteolin and (c) apigenin six hours after being placed in the apical side of a Caco‐2 cell monolayer. The effects of co‐administration of digoxin and benzoic acid were analysed. Statistical analysis: c ‐ different from the control (P<0.05); c* ‐ different from the control (P<0.1); s – different from the other substrate (P<0.05). 83
xix Figure 4.5. Distribution of (a) benzoic acid and (b) digoxin six hours after being placed in the apical side of a Caco‐2 cell monolayer. The effects of co‐administration of a standard mixture (SM) with rosmarinic acid, luteolin and apigenin, 50µM each, was analysed. Statistical analysis: * ‐ different from the control (P<0.05). 84 Figure 4.6. Glucuronidation of (a) luteolin and (b) apigenin six hours after being placed in the apical side of a Caco‐2 cell monolayer. The effects of co‐administration of digoxin and benzoic acid were analysed. Statistical analysis: c ‐ different from the control (P<0.05); c* ‐ different from the control (P<0.1); s – different from the other substrate (P<0.05). 85
Figure 5.1. Molecular structure of (a) rosmarinic acid, (b) quercetin, (c) luteolin, and (d)
apigenin. 96 Figure 5.2. Fluorescence emission spectra of acetylcholinesterase with the addition of P. barbatus aqueous extract. Arrow points to increasing concentrations of P. barbatus plant extract, ranging 0; 0.5; 1; 5; 10; 33; 50; 100 µg.ml‐1. 97 Figure 5.3. Stern‐Volmer plot (a) and plot of log(F0‐F)/F vs. log[Q] (b) of acetylcholinesterase with P. barbatus aqueous extract. [Q] is the concentration of P. barbatus extract in mg.ml‐1. 99 Figure 5.4. FTIR spectra of the acetylcholinesterase alone, with P. barbatus extract, rosmarinic acid (RA), luteolin (Lut), apigenin (Api) and quercetin (Quer). The spectra obtained are shown (a) in the form of absorbance spectra and (b) the second derivative spectra (negative peaks). 103 Figure 5.5. Percentage of decrease of hydrogen‐deuterium exchange rate of AChE in the presence of P. barbatus extract, rosmarinic acid, luteolin, apigenin and quercetin. 104
Figure 5.6. Fluorescence emission spectra of (a) HSA and (b) lysozyme with the addition of
P. barbatus aqueous extract. Arrow points to increasing concentrations of P. barbatus plant
extract, ranging 0; 0.5; 0.75; 1; 2.5; 5; 7.5; 100 μg.ml−1. 111
Figure 5.7. Stern–Volmer plots of HSA and lysozyme with P. barbatus aqueous extract. [Q] is the
concentration of P. barbatus in μg.ml−1. 112
Figure 5.8. Plots of log([F0 − F]/F) vs. log[Q] for HSA and lysozyme with P. barbatus aqueous
extract. [Q] is the concentration of P. barbatus in g.l−1. 114 Figure 5.9. FTIR spectra of the proteins alone, with P. barbatus extract, rosmarinic acid (RA), luteolin (Lut) and apigenin (Api). The absorbance spectra obtained for HSA are shown in (a) and the second derivatives are in (c). The absorbance spectra obtained for lysozyme are shown in (b) and the second derivatives are in (d). 117 Figure 5.10. Percentage of change in protein (HSA and lysozyme) hydrogen–deuterium exchange rate, determined from the analysis of the amide II band, in the presence of P. barbatus extract, rosmarinic acid, luteolin or apigenin, in comparison with the hydrogen–deuterium exchange rate of the protein alone. 118
xx
Table List
Table 2.1. Concentrations of rosmarinic acid, luteolin and apigenin used in the phenolic
mixtures to determine the bioavailability by Caco‐2 cells, according to the CCD experimental
plan. 35
Table 3.1. Amount of dry plant extract obtained. 40
Table 3.2. Inhibition of AChE activity (%), antioxidant activity and rosmarinic acid content of
water extracts of the leaves of several Plectranthus species. 41
Table 3.3. Detected ions and attribution errors (ppm) for the collected fractions corresponding
to peaks 1, 3, 4, 5, 6 and 7. 49
Table 3.4. Antiacetylcholinesterase and antioxidant activity of P. barbatus herbal tea after in
vitro gastrointestinal digestion. The action of the pancreatic juice on the inhibition activity of rosmarinic acid (RA) is also shown. 52 Table 4.1. Concentration of rosmarinic acid, its metabolites and flavonoid glucuronide derivatives in the plasma and in the brain, 30 and 60 min after the intragastric and intraperitoneal administration of P. barbatus extract. 69
Table 4.2. Brain acetylcholinesterase inhibition (%) 30 and 60 min after administration
(intragastric and intraperitoneal) of rosmarinic acid and P. barbatus extract. Results significantly different from the control are marked with * (P < 0.05) and ** (P < 0.1). Values that are not significantly different (P < 0.05) are marked from a to d. 70 Table 4.3. Retention time of compounds from the P. barbatus extract found in plasma and their decrease from 30 to 60 min after the extract intraperitoneal administration. 74 Table 4.4. Permeation of the P. barbatus aqueous extract constituents through the Caco‐2 cell monolayer. 79
Table 5.1. Stern‐Volmer binding parameters (KSV, Kq), binding equilibria parameters (Kb, n) and
thermodynamic parameters (ΔHo, ΔSo, ΔGo) for the binding of P. barbatus extract, rosmarinic acid (RA), luteolin (Lut), apigenin (Api) and quercetin (Quer) to acetylcholinesterase (R2>0.99 to all linear regressions). Rates of Amide II/Amide I variation, reflecting the rate of hydrogen deuterium exchange in the presence of similar amount of RA, Lut, Api and Quer or 10mg/mL of
P. barbatus extract (for AChE without ligand, ‐2.345mAU.min‐1). IC50 values for the inhibition of
acetylcholinesterase activity by P. barbatus, RA, Lut and Api. (*) and Quer for P. barbatus extract the values are expressed in l.mg‐1, l.mg‐1s‐1, and mg.ml‐1 but the molarity was estimated based on the content of rosmarinic acid, luteolin and apigenin (1.1122 mmol.g‐1). 100
xxi
Table 5.2. Binding parameters (KSV, Kq, Kb, n) and thermodynamic parameters (ΔHo, ΔSo, ΔGo) for
the binding of P. barbatus extract, rosmarinic acid (RA), luteolin (Lut) and apigenin (Api) to HSA and to lysozyme (R2>0.99 to all linear regressions). Rates of Amide II/Amide I variation in the presence of similar amount of RA, Api and Lut, or 10mg/mL of P. barbatus extract (without ligand, ‐0.716 for HSA and ‐1.815 for lysozyme). IC50 values for the inhibition of lysozyme
activity. For P. barbatus extract the values are expressed in l.mg‐1(a), l.mg‐1s‐1(b) and mg.l‐1(c). 113
xxii
Abbreviations
ABC transporters ATP‐binding cassette transporters AChE acetylcholinesterase AChI acetylthiocholine AD Alzheimer’s disease ANOVA Analysis of Variance Api apigenin APP amyloid precursor protein Asp aspartic acid ATP adenosine triphosphate AU absorbance unit Aβ β‐amyloid BCRP breast cancer resistance protein BHT butylated hydroxytoluene CCD central composite design COMT catechol o‐methyl transferase DMEM Dulbecco's Modified Eagle Medium DMSO dimethyl sulfoxide DMSO‐d6 deuterated dimethyl sulfoxide DPPH di(phenyl)‐(2,4,6‐trinitrophenyl)iminoazanium DTNB 5,5'‐dithiobis‐(2‐nitrobenzoic acid) DTT dithiothreitol EDTA ethylenediamine tetraacetic acid ESI‐MS electrospray ionization mass spectrometry FBS fetal bovine serum FDA Food and Drug Administration FTIR Fourier transform infrared spectroscopy Glu glutamic acid h hour HBSS Hank’s balanced salt solution HEPES 4‐(2‐hydroxyethyl)‐1‐piperazineethanesulfonic acid His histidinexxiii
HPLC high precision liquid chromatography
HPLC‐DAD high precision liquid chromatography coupled with a diode array detector HSA human serum albumine I(%) inhibition in percentage IC50 concentration of inhibitor causing 50% inhibition Kb binding constant Kq scatter collision quenching constant KRC Krebs‐Ringer solution with calcium chloride KSV Stern‐Volmer quenching constant Lut luteolin MCT monocarboxylic acid transporter min minute MRP multidrug resistance protein MS mass spectrometry MTT 3‐(4,5‐Dimethylthiazol‐2‐yl)‐2,5‐diphenyltetrazolium bromide NADPH nicotinamide adenine dinucleotide phosphate NMR nuclear magnetic resonance spectroscopy PBS phosphate buffer saline PDB Protein Data Bank PET positron emission tomography Pgp P‐glycoprotein PMA phorbol myristate acetate Quer quercetin RA rosmarinic acid ROS radical oxygen species RT retention time SAM S‐adenosyl methionine Ser serine TEER trans‐epithelial electric resistance TFA trifluoroacetic acid TMB 3,3’,5,5’‐Tetramethylbenzidine TNB 2‐nitro‐5‐thiobenzoate Tris tris(hydroxymethyl)aminomethane
xxiv Trp tryptophan Tyr tyrosine UDPGA 5'‐diphospho‐glucuronic acid UV ultraviolet UV‐Vis ultraviolet‐visible ΔGo free energy change ΔHo enthalpy change ΔSo entropy change
Chapter I
General Introduction
Chapter I
3
1. Literature review
1.1. Plectranthus species and their ethnobotanical uses
The genus Plectranthus L’Hér., belonging to the Mint family (Lameaceae), comprises about 300 species widely distributed in the savannahs and forest regions of Africa, Asia and Australia. The majority of the Plectranthus species can be described as tender shrubs or groundcovers growing in the shade of large forests or in the partial shade of the forest edge. A few species occur in drier regions with rocky soils and have succulent or semi-succulent leaves and stems, which help the plants to survive in these habitats (Codd, 1975; van Jaarsveld, 2006).
The geographical distribution of Plectranthus is highly variable. Some species, as
P. laxiflorus, occur in smaller areas in the south-east of the African continent, while others, like P. barbatus, may naturally occur in vast areas, in Africa, India and South America (Codd, 1975;
Lukhoba et al., 2006). The later species, endemic form India, was taken to Brazil probably during the colonial period (Codd, 1975; Lukhoba et al., 2006; Lorenzi & Matos, 2002).
The value of Plectranthus species as garden plants has been long recognized. They have ornamental leaves and flowers, are easy and fast growing plants, resistant to most pests and diseases, and make colourful displays in autumn when other flowers are often scarce. Several
Plectranthus species were introduced in Europe during the expansion of the British Empire and
the founding of the Royal Botanic Gardens of Kew. In the nineteenth century some species were very popular in Scandinavia and commonly planted in window boxes and hanging baskets, as
P. oertendahii, nowadays known as “Swedish ivy”, and other Plectranthus groundcover species
(P. madagascariensis, P. verticillatus, P. strigosus, etc.) Some other species are tall shrubs that can be pruned and form colourful hedges (P. ecklonii, P. fruticosus, P. barbatus, etc.).
A great variety of ethnobotanical uses are reported for Plectranthus species. Some, due to their aromatic nature, are used as culinary plants to flavour food, or as insect repellents (P. ornatus). Others have tubers with high starch content and are eaten as vegetables (P. esculentus, P. rotundifolius). However, the most common uses are to treat a wide range of diseases (Lukhoba et al., 2006). Infusions of several Plectranthus species are used to treat coughs and colds (P. hadiensis, P. laxiflorus), liver complaints (P. hereroensis), and ailments in respiratory system and skin (P. madagascariensis).
Among the Plectranthus species used in traditional medicines P. barbatus is one of the most important (Luckhoba et al., 2006). P. barbatus (Figure 1.1) is used in Hindu and Ayurveda treataments, and in traditional medicine from Brazil, tropical Africa and China (Alabashi & Melzig, 2010a). Extensive reviews have been written about the ethnobotanical importance of
General Introduction
4
are usually prepared as a decoction or infusion and used in the treatment of pain from different aetiologies, inflammation, infections, colds and coughs (Lukhoba et al., 2006), which suggest anti‐inflammatory and antioxidant properties. P. barbatus is also used to treat psychiatric disorders in Tanzania (Lukhoba et al., 2006). Figure 1.1. Plectranthus barbatus Other significant uses for P. barbatus reported by Lukhoba et al. (2006) and Alabashi & Melzig (2010a) are as food, the leaves being cooked as vegetable in Kenya and Yemen, and as ornamental plant or garden herb, in hedges, fences or boundary markers.
1.2. Herbal tea components and their bioavailability
The main components of most medicinal teas, used traditionally by people, are phenolic acids and flavonoids (Cai et al., 2004). The flavonoids in herbal teas are usually present in glycosylated forms, which have higher solubility in water, although some flavonoid aglycones may also occur in aqueous extracts (Cai et al., 2004). As herbal teas are usually taken orally, many studies have focused on the metabolism and bioavailability of their active components.1.2.1. Phenolic acids Phenolic acids are a class of polyphenols commonly found in herbal medicines and plant‐ derived food (Lafay and Gil‐Izquierdo, 2008). The most commonly found phenolic acids, shown in Figure 1.2, are gallic acid, a component of hydrolysable tannins, and hydroxycinnamic acids, as cinnamic acid, caffeic acid (3,4‐dihydroxycinnamic acid), coumaric acid (4‐hydroxycinnamic acid), ferulic acid (3‐methoxy‐4‐hydroxycinnamic acid) and the ester derivatives of caffeic acid, the chlorogenic acid (3‐caffeoylquinic acid) and the rosmarinic acid.
Chapter I 5 Figure 1.2. Chemical structures of some common phenolic acids. When phenolic acids are ingested their bioavailability is dependent on the permeability through the intestinal barrier, and on the conjugation (glucuronidation, sulfation or methylation) by intestinal and liver cells. Bioavailability studies using rats as model animals show that hydroxycinnamic acids such as coumaric acid and caffeic acid can be found in plasma after intragastric administration, in unconjugated, sulfated and/or glucuronidated forms (Konishi et
al., 2004; Konishi et al., 2005). Both coumaric and caffeic acids presented higher bioavailability
than gallic acid, which is a simpler phenolic acid (Konishi et al., 2004 & 2005). Ferulic acid, like coumaric acid showed a higher bioavailability than caffeic acid (Konishi et al., 2006). The caffeic acid esters rosmarinic acid and chlorogenic acid showed much lower bioavailability than simpler hydroxycinnamic acids and similar to gallic acid (Konishi et al., 2005 & 2006). Some authors could not detect chlorogenic acid circulating in rat plasma after its administration, but found traces of caffeic acid and ferulic acid conjugates 6 hours after administration, suggesting that hydrolysis of chlorogenic acid might have occurred and the resulting metabolites might be more easily available (Azuma et al., 2000).
Many studies have focused on the bioavailability of rosmarinic acid, in the rats and humans, as it has a number of interesting biological activities such as antioxidant, antiviral, antibacterial and anti‐inflammatory activities that can be potentially important for public health (Peterssen and Simmonds, 2003). When rosmarinic acid was administered to rats, intact rosmarinic acid, monomethyl‐rosmarinic acid, and coumaric acid were found in plasma, mostly in conjugated forms (Baba et al., 2004). In humans the same compounds plus caffeic acid and ferulic acid were found circulating in plama, also in conjugated forms, after the intake of a rosmarinic acid‐rich Perilla extract (Baba et al., 2005). In both models the maximum amount of
General Introduction
6
free rosmarinic acid in plasma was reached around 0.5h after administration, while conjugated forms of rosmarinic acid had maximum peaks later, from 40 mins to 2h after administration (Baba et al., 2004 & 2005; Konishi et al., 2005). Eighty three per cent of the ingested rosmarinic acid was excreted between 8 and 18 hours after intake in rats (Baba et al., 2004), and 75% within the first 6h in humans (Baba et al., 2005), suggesting that rosmarinic acid metabolites may circulate for a relatively long time before being excreted and repeated intakes may be favourable to the accumulation of these active compounds in the bloodstream.
The bioavailability results obtained with Caco‐2 cell monolayers are in agreement with the in vivo results obtained in the rat model for the order of bioavailability of the phenolic acids, which is gallic acid = rosmarinic acid = chlorogenic acid < caffeic acid < p‐coumaric acid (Konishi
et al., 2005), which suggests that the same kind of transport mechanisms for phenolic acids may
be present in both models. The high permeation of caffeic acid, p‐coumaric acid and ferulic acid in Caco‐2 cells, and presumably in rat intestine, seems to be due to the fact that these compounds are substrates of the monocarboxylic acid transporter (MCT) (Konishi and Kobayashi, 2004a & 2004b). Rosmarinic acid and chlorogenic acid, which showed a very low transepithelial permeation, do not seem to be substrates of MCT, being transported by paracellular diffusion (Konishi and Kobayashi 2004a; Konishi and Kobayashi, 2005).
Compounds that were reported as metabolites of caffeic acid by gut microflora such as
m‐coumaric acid and m‐hydroxyphenylpropionic acid are also substrates of the MCT and showed
a higher influx than caffeic acid (Konishi et al., 2004b), suggesting that the action of gut microflora may increase the bioavailability of these active compounds.
1.2.2. Flavonoids
Flavonoids are a group of polyphenolic compounds that share the same structural features, namely a C6‐C3‐C6 carbon framework (Figure 1.3) or, more specifically, a phenylbenzopyran functionality. Depending on the position of linkage of the aromatic ring to the benzopyrano moiety, this group can be divided in three classes: flavonoids (2‐ phenylbenzopyrans) as shown in Figure 1.2; isoflavonoids (3‐phenylbenzopyrans) as the isoflavone in Figure 1.3; and neoflavonoids (4‐phenylbenzopyrans) the rarest group of flavonoids (not shown). In some flavonoids the C3 moiety between the two aromatic rings may not form a heterocyclic ring (ring C) in their structure, such as the chalcones (Figure 1.3) (Marais et al., 2006). Depending on the degree of saturation and oxidation of the C‐ring, some sub‐groups may be considered, the most common structures can be seen in Figure 1.3 (Marais et al., 2006). The pattern of hydroxylation of flavonoids is determinant for their identification and properties, as in
Chapter I 7 the case of quercetin, apigenin and luteolin (Figure 1.4), which are among the most commonly occurring flavonoids. Figure 1.3. Basic chemical structures of the main classes of flavonoids. Figure 1.4. Structures of (a) quercetin, (b) apigenin and (c) luteolin. Flavonoids often occur in the form of flavonoid glycosides, in which the sugar residue is bound to the flavonoid structure by one of the hydroxyl groups. The most common monosaccharide residues found in flavonoid glycosides are glucose, rhamnose and glucuronic acid.
Ingested flavonoids may undergo several changes before reaching target organs where they may have beneficial effects. Studies with quercetin, which is often used as a model of flavonoid, showed the presence of glucuronidated, sulfated and methylated forms of quercetin O H O O OH OH OH OH O H O O OH OH OH O H O O OH OH
a
b
c
General Introduction
8
in rat plasma after its intragastrical administration to rats (Morand et al., 1998; da Silva et al., 1998; Justino et al., 2004). Although the bioavailability of quercetin is low, the antioxidant activity in rat plasma after its administration increased significantly (da Silva et al., 1998; Justin
et al., 2004). Liver sulfotransferases and glucuronyltranferases seem to be highly responsible for
the metabolization of flavonoids, as in vitro studies showed that liver enzymatic extracts are able to conjugate quercetin into sulfated and glucuronidated metabolites (da Silva et al., 1998; Justino et al., 2004). Studies with liver cell lines, such as HepG2, also showed that liver cells may conjugate quercetin through sulfation, glucuronidation, and methylation reactions (O’Leary et
al., 2003), and the multidrug resistant protein 2 (MRP2) may promote the efflux of quercetin
conjugates from the cells (O’Leary et al., 2003). Although quercetin is mainly found circulating in plasma in the conjugated form, one of the characteristic features of quercetin conjugates is a slow elimination, with reported half‐times from 11 to 28 hours, favouring its accumulation in plasma after repeated intakes (Manech et al., 2005).
Several studies on the bioavailability and metabolism of flavonoids by the intestine have been performed using Caco‐2 cell monolayers as models for the intestinal barrier. Flavonoid aglycones have shown a high permeability through these membranes, which is due to active transport (Walgren et al., 1998; Walle et al., 1999). As flavonoids in food are present mainly in glycosylated form, some studies suggest that the gut microflora may increase their bioavailability by hydrolysing into flavonoid aglycones (Liu & Hu, 2002; Kobayashi et al., 2008). Studies of bioavailability of hesperetin (aglycone) and hesperidin (hesperetin glycoside) showed that the transepithelial transport of the aglycone is mainly active transport, while the glycoside passes through Caco‐2 cell monolayers mainly by passive diffusion (Kobaiashi et al., 2008), which is in good agreement with results obtained by Walgren et al. (2008) for quercetin and its glycosides. Transporters from the MCT family seem to be related to the transepithelial transport, across the Caco‐2 monolayers, of flavonoids such as hesperetin, naringenin, erydictiol and epicatechins (Kobayashi & Konishi, 2008; Vaidyanathan and Walle, 2003). Several reports show that flavonoids may be conjugated – preferentially glucuronidated, but also sulfated – by Caco‐2 cells, and transported back to the culture medium by transporters of the type multidrug resistance pump (MRP) after conjugation (Ng et al., 2005; Walle et al., 1999).
The relationship between flavonoids and intestinal membrane transporters is highly complex. Flavonoid aglycons may be transported to the bloodstream by some active transporters (Walle et al., 1999). Some flavonoids may be substrate to efflux transporters such as P‐glycoprotein (Pgp) and MRP and may return to gut lumen (Wang et al., 2009), while others may act as inhibitors of Pgp and MRP, without being their substrates (Brand et al., 2006).
Chapter I
9
Although these complex relationships are still under study, it seems that the flavonoid bioavailability depends on the balance of active influx transport, conjugation, efflux transport and inhibition of the active transporters by other compounds.
1.3. Biological activities of herbal teas and their components
Many therapeutic properties have been reported for flavonoids and phenolic acids, especially as enzyme inhibitors and antioxidants. The use of herbal teas for medicinal purposes usually gives an indication of these activities.
The present thesis focuses on the anti‐acetylcholinesterase, anti‐inflammatory and antioxidant activities, which can be useful in the treatment of several health disorders, such as gastrointestinal disturbances, or the symptomatic treatment of Alzheimer’s disease.
1.3.1. Acetylcholinesterase inhibitors
Acetylcholine is usually found in the synaptic clefts in peripheral and central nervous systems and has a neurotransmitter function. Acetylcholine is synthesized by neurons, released to the synaptic cleft upon stimulation, and binds to acetylcholine receptors on the other end of the synaptic cleft.
Acetylcholinesterase is an abundant enzyme in the synaptic cleft as it hydrolyses acetylcholine into the inactive metabolites choline and acetate, clearing acetylcholine from the synapse and ceasing the stimulation of the post‐synaptic receptors (Randall et al., 2000). The active site of acetylcholinesterase is located in an active gorge (Figure 1.5) where some groups of amino acid residues play an important role by positioning the acetylcholine molecule, the peripheral binding site (Trp286, Tyr72, Tyr124 and Asp74), the choline binding site (Trp86, Glu202, Tyr337) and the acyl pocket (Phe295, Phe297). The hydrolysis of acetylcholine is then directly catalysed by the catalytic triad (Glu334, His447, Ser203), located in the bottom of the active gorge (Abu‐Donia, 2003).
Acetylcholinesterase inhibitors can be used for the treatment of some dysfunctions, such as Alzheimer’s disease and gastrointestinal disturbances, as will be discussed in the next sections. These drugs, for instance tacrine, often bind to the active gorge with non‐covalent bonds usually to the acetylcholine binding and positioning sites and to the catalytic site, as it is shown in Figure 1.6 (Harel et al., 1993). Acetylcholinesterase inhibitors found by chemical synthesis, as carbamates and organophosphates, are irreversible inhibitors binding to acetylcholinesterase by ionic or covalent bonds, which makes them highly toxic and suitable to be used as pesticides (Abu‐Donia, 2003; Eyer et al. 2007).
General Introduction 10 Figure 1.5. Active gorge of acetylcholinesterase (Abu‐Donia, 2003).
Galanthamine, an acetylcholinesterase inhibitor approved by the Food and Drug Administration (FDA) to be used in the treatment of Alzheimer’s disease, is an alkaloid first discovered in Galanthus species, and nowadays obtained for commercialization from Narcissus spp. or synthetically (Heinrich & Teoh, 2004). The successful application of galanthamine led to the search of new acetylcholinesterase inhibitors, more effective and with less side effects, in plants used in traditional medicine (Houghton et al., 2004, Adsersen et al., 2006, Vinutha et al., 2007, Ferreira et al., 2006).
1.3.1.1. Acetylcholinesterase inhibitors and Alzheimer’s disease
Alzheimer’s disease (AD) is the most common form of dementia among older people, and its occurrence is of great concern in occidental populations where the life expectancy increased in the 20th century.
AD is a degenerative terminal disease characterized by a progressive memory loss and bodily functions, and symptoms generally include confusion, irritability, aggression, mood swings, language breakdown, long term memory loss, and decline of the senses, which leads to the withdrawal of the patients (Alzheimer’s Association, 2006). On a biochemical point of view, AD is a protein misfolding disease, as it results from the accumulation of abnormally folded amyloid beta peptides (Aβ). The Aβ may accumulate in the cell within the neuronal endoplasmatic reticulum, and outside the cell forming senile plaques in the brain of AD patients (Hashimoto et al., 2003).
Chapter I 11 Figure 1.6. Tacrine binding to the active gorge of acetylcholinesterase, and details showing the amino acid residues involved in the interaction between the two molecules (PDB 1ACJ, Harel et al., 1993).
Aβ is a short peptide that results from the proteolytic cleavage by β‐secretase and ϒ‐secretase of the amyloid precursor protein (APP) (Figure 1.7), a transmembrane protein whose function is still unknown but seems to be involved in the early development of the nervous system (Kerr & Small, 2005). Although Aβ are usually water soluble innocuous peptides with short regions of β‐sheet and predominately α‐helix secondary structures in solution, they undergo dramatic conformational changes at high concentrations to a form rich in β‐sheet
General Introduction
12
secondary structure that aggregates to form amyloid fibrils (Onishi & Takano, 2004). The extracellular deposition of these water insoluble fibrils into senile plaques is characteristic of AD. As the senile plaques are located extracellularly, they may not interfere directly with neuronal metabolism, but may hinder cellular exchanges with the extracellular environment (Tanasalli et
al., 2006) and interact with glia cells, activating the release of pro‐inflammatory signals (Figure
1.7) (Stuchbury & Munch, 2005). A resulting inflammatory response and neurodegeneration is the cause of the dementia and other symptoms felt by AD patients (Stuchbury & Munch, 2005).
Figure 1.7. Biochemical pathways associated with the formation of amyloid plaques and neurofibrillary
tangles in Alzheimers’s Disease patients. (www.calbiochem.com/alzheimers).
Due to an abnormal aggregation of tau protein, AD is also known as a tauopaty. Tau protein is a microtubule associated protein that stabilizes neuronal cytoskeleton, being
Chapter I
13
regulated by phosphorylation. In AD patients tau protein is hyperphosphorylated and accumulates as paired helical filaments, which aggregates into masses known as neurofibrillary tangles inside the nerve cell bodies, also associated with the amyloid plaques (Figure 1.7) (Stuchbury & Munch, 2005). Although some studies approach the treatment of AD by modulating the activity of ϒ‐secretase, the enzyme mainly responsible for Aβ formation, the most studied approach is by the administration of inhibitors of acetylcholinesterase activity (Salawu et al., 2011).
Patients of AD show low concentration of acetylcholine in the brain as a consequence of the cellular dysfunctions caused by the abnormal protein aggregations. The administration of acetylcholinesterase inhibitors has proved to be effective in the symptomatic treatment of AD patients (Rauf et al., 2002). This strategy to increase the acetylcholine levels in the brain is presently the most commonly used, and the drugs that have been approved by the Food and Drug Administration (FDA) to treat AD in the US are the acetylcholinesterase inhibitors tacrine, rivastigmine, donepezil and galanthamine, which have all been successful in slowing down the neurodegenerative process in AD patients (McGleenon et al., 1999; Heinrich & Teoh, 2004).
The major problem related with acetylcholinesterase inhibition treatments of AD is the bioavailability of the inhibitors, as they must reach the brain passing through the blood‐brain barrier to inhibit the brain acetylcholinesterase. If the inhibitors are too potent, or very high concentrations are needed for the therapeutic effect, unwanted side effects may arise, such as gastrointestinal and hepatic disturbances (McGleenon et al., 1999, Heinrich & Teoh, 2004). The research for new acetylcholinesterase inhibitors for the treatment of AD continues, with the aim of finding reversible inhibitors with higher specificity to brain acetylcholinesterase that may cause less side effects than the currently used acetylcholinesterase inhibitors.
1.3.1.2. Acetylcholinesterase inhibitors to treat gastrointestinal disorders
The intestinal wall consists mainly of layers of muscle, which contract and relax in a coordinated fashion, propelling food through the intestine to the anus. This complex pattern of motility is coordinated by excitatory and inhibitory pathways of the enteric nervous system, to which acetylcholine is the major excitatory neurotransmitter responsible for the peristaltic contractions (Holzer and Maggi, 1994). Acetylcholine in gut epithelial cells is also responsible for controlling ion transport, and therefore, water secretion for gut hydration. This process, very important in establishing a proper aqueous environment for the enzymatic digestion and absorption of nutrients, also provides surface lubrication to propel intestinal contents by peristaltic movements (Hirota and McKay, 2006).