UNIVERSIDADE CATÓLICA DE BRASÍLIA
MESTRADO EM CIÊNCIAS GENÔMICAS E BIOTECNOLOGIA
ANÁLISE PROTÉICA COMPARATIVA DO FLUIDO CREVICULAR GENGIVAL DE PACIENTES EM TRATAMENTO ORTODÔNTICO.
Giovanni Modesto Vieira
Brasília 2011
Pró-Reitoria de Pós-Graduação e Pesquisa
Stricto Sensu: Mestrado em Ciências Genômicas e
Biotecnologia
ANÁLISE PROTEÍCA COMPARATIVA DO FLUIDO
CREVICULAR GENGIVAL DE PACIENTES EM
TRATAMENTO ORTODÔNTICO.
Brasília - DF
ANÁLISE PROTÉICA COMPARATIVA DO FLUIDO CREVICULAR GENGIVAL DE PACIENTES EM TRATAMENTO ORTODÔNTICO
Giovanni Modesto Vieira
Brasília 2011
Dissertação apresentada ao Programa de Pós- graduação Stricto Sensu em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasilia, como requisito para obtenção do Título de Mestre em Ciências Genômicas e Biotecnologia.
ANÁLISE PROTÉICA COMPARATIVA DO FLUIDO CREVICULAR GENGIVAL DE PACIENTES EM TRATAMENTO ORTODÔNTICO.
Giovanni Modesto Vieira
Aprovada em __/__/____
BANCA EXAMINADORA
Dissertação apresentadada à coordenação do curso de Mestrado em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, como requisito parcial para a obtenção do Título de Mestre em Ciências Genômicas e Biotecnologia.
Profa. Dra. Maria Fátima Grossi de Sá Universidade Católica de Brasília
Prof. Dr. Osmundo Brilhante de Oliviera Neto Embrapa Recursos Genéticos e Biotecnologia
AGRADECIMENTOS
A Deus e ao senhor Jesus Cristo por me guiarem durante a minha estadia na Terra.
À minha esposa Paola Cristina Bueno Ananias, pela renúncia da convivência familiar e incentivo sempre presente.
Aos meus pais Fernando José Trezena Vieira e Gione Marísia Modesto Vieira, por terem me dado à oportunidade de estudar, e me indicarem sempre o caminho correto a trilhar na vida. À minha filha Viviani Ananias Vieira, minha maior paixão e razão de viver, o perdão pelas noites perdidas.
À Dra. Maria Fátima Grossi de Sá, por ter acreditado em uma pessoa que mal conhecia, e aberto às portas do seu Laboratório para um simples Dentista. Uma das poucas pessoas que conheci, onde o brilho do seu caráter ofusca o seu brilhantismo intelectual.
Ao Doutorando Erico Augusto Rosas de Vasconcelo, pela sua orientação intelectual, e ajuda incontestável, sem o qual este trabalho não se realizaria.
Ao Colega Luiz Eduardo da Silva Araújo, pela sua ajuda na busca incessante de resultados plausíveis.
Ao Amigo Marcelo Banho Reis, pela ajuda na realização dos géis 2-DE, e confidência diária dos momentos difíceis.
A todos os amigos e colegas do Laboratório Planta-Praga I da Embrapa Recursos e Biotecnologia, pela convivência diária.
“Há três métodos para ganhar sabededoria: primeiro por reflexão, que é o mais nobre, segundo por imitação, que é o mais fácil, e terceiro por experiência que é o mais amargo.
Confúcio551 ac – 479 ac
Que Deus me conceba falar com inteligência e conceber pensamentos dignos dos dons recebidos, pois é ele quem guia a sabedoria e dirige os sábios.
Em seu poder mantém a nós e nossas palavras. Invocação a Deus, fonte de todo conhecimento Sabedoria 7,15 - Bíblia sagrada
LISTA DE FIGURAS
FIGURA 1 Sistema de escores para RRIE 19
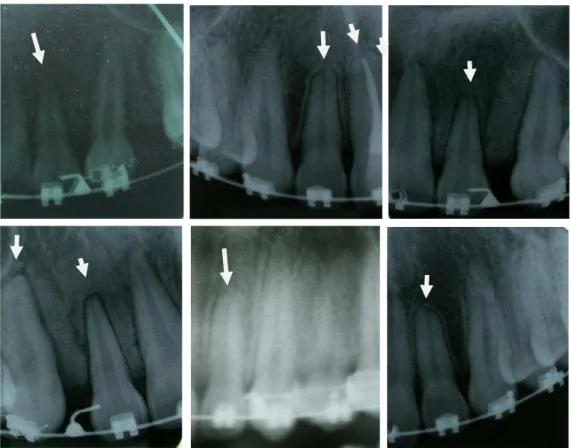
FIGURA 2 Radiografias periapicais de casos de RRIE 19
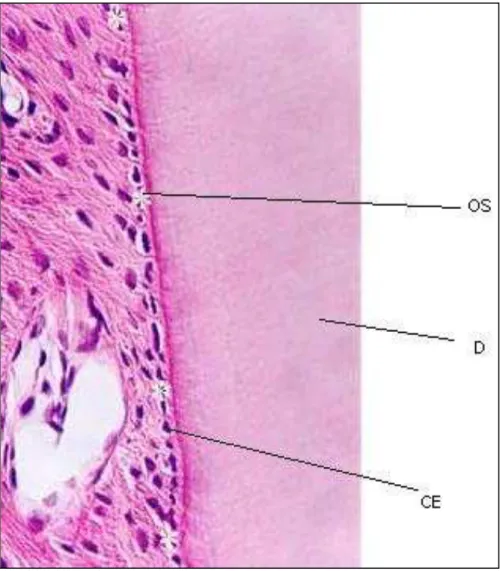
FIGURA 3 Corte histológico do ligamento periodontal 21
FIGURA 4 Imagens de paciente em tratamento ortodôntico 28 FIGURA 5 Corte histológico da região apical de dois pré-molares superiores 33
FIGURA 6 Sondagem periodontal 36
FIGURA 7 Coleta de amostra do GCF 38
FIGURA 8 Radiografias periapicais de pacientes da amostragem 53
FIGURA 9 Cones de papel absorvente para coleta do GCF 53
FIGURA 10 Paciente da amostra submetido à profilaxia prévia 54 FIGURA 11 SDS-PAGE 12% das proteínas extraídas do GCF 62 FIGURA 12 Perfil bidimensional diferencial das proteínas extraídas do GCF 64
FIGURA 13 Spots proteicos constitutivos 65
FIGURA 14 Gráfico de correlação de réplicas dos perfis bidimensionais de
Proteínas do GCF 67
LISTA DE TABELAS
TABELA 1 Proteínas dentinárias 30
TABELA 2 Principais moléculas candidatas à biomarcadores do GCF 38 TABELA 3 Identificação das proteínas de pacientes com RRIE por identidade de
LISTA DE ABREVIATURAS BAG-75 BMP BMU BSP CAP CP – 23 DGP DMP-1
Glicoproteína ácida óssea Proteína osteomorfogenética Unidade osteoremodeladora Sialofosfoproteína óssea Proteína de ligação ao cemento Proteína do cemento 23
Glicoproteína dentinária Proteínas da matriz dentina DPP Fosfoproteína dentinária DSP Fosfoproteína Dentinária DSPP EGF GLA GCF IEF Sialofosfoproteína dentinária
Fatores de crescimento epodermóide Ácido gama carboxiglutâmico Fluido crevicular gengival Focalização isoelétrica IL-1 Interleucina 1 alfa e 1 beta IL- 2 Interleucina 2 alfa
IL-6 Interleucina 6 alfa IgG Imunoglobulina G IPG
LPS Gel com gradiente imobilizado de pH Lipopolissacarídeo
MALDI Ionização e desrupção a laser assistida pela matriz NCPS
OC OPG ORF
National health and nutrition examination survey Osteocalcina
Osteopontina Open reading frame PBS Tampão fosfato salino PGE2 Prostaglandina E2
PMSF Fenilmetilsulfonilfluoreto PTH
RRIE Paratormônio Reabsorção radicular inflamatória externa SDS
SPARC
Dodecil sulfato de sódio Osteonectina
TCA TNF 2-DE
RESUMO
A reabsorção radicular inflamatória externa (RRIE) é uma seqüela comum do tratamento ortodôntico, com uma alta prevalência, de 95 a 100%, mas com pouca prevalência no que tange a severidade pós – tratamento (1 a 2%). Notavelmente, a RRIE é tida como um custo biológico do tratamento ortodôntico, e de certa maneira inevitável. A aplicação da força ortodôntica desencadeia o processo devido à liberação de mediadores locais da inflamação, e só cessa quando esta mesma força é de toda dissipada ou cessada. A sua etiologia está relacionada com a necrose da camada cementoblástica que reveste a dentina, que contém um grande número de antígenos seqüestrados, e os esconde do sistema imunológico desencadeador do processo reabsortivo. O seu diagnóstico é geralmente tardio, somente através de radiografias periapicais, quando o processo já há muito se iniciou. Alguns estudos indicam que patologias dentárias são acompanhadas pela liberação de proteínas em fluidos extracelulares como o fluido crevicular gengival. Sendo assim, uma série de marcadores protéicos podem ser utilizados para o diagnóstico precoce destas doenças. Considerando a alteração no padrão de proteínas em fluidos extracelulares em uma série de patologias dentárias e o potencial de sua utilização como marcadores para diagnóstico destas doenças, neste trabalho propõe-se a construção de mapas protéicos do fluido crevicular gengival de pacientes em tratamento ortodôntico com e sem a patologia (RRIE), visando o mapeamento de proteínas relacionadas a esta patologia. Foram extraídas 3.600 µg de dois “pools” de amostras do fluido crevicular gengival de 60 pacientes com e sem a patologia da RRIE. Os mapas protéicos foram digitalizados e a comparação dos géis bidimensionais permitiu a visualização de 6 proteínas comuns às duas amostras, 122 proteínas diferenciais e a possibilidade de utilização de 15 proteínas diferenciais de baixa massa molecular como marcadores protéicos da reabsorção radicular externa. A busca de marcadores protéicos será de grande valia para o diagnóstico precoce de grupos de risco à RRIE, e planejamento ortodôntico, minimizando seqüelas advindas desta patologia.
ABSTRACT
The external inflammatory root resorption (EIRR) is a common problem of the orthodontic treatment with a high prevalence, 95-100%, but with low prevalence in relation to severity of post-treatment (1-2%). Notably, the EIRR is considered a biological cost of orthodontic treatment, and somewhat inevitable. The application of orthodontic force triggers and perpetuates the process, due to the release of local mediators of inflammation, and only stops to EIRR, providing repair root, when this same force is dissipated or terminated all its action on dental tissue. Their etiologies is related to the necrosis of cementoblasts layer lining the dentin, which contains a large number of sequestered antigens that trigger the resorptive process and are usually diagnosed late, only by means of periapical radiographs, when the process has long begun. Some studies indicate that dental pathologies are accompanied by releasing proteins in an extracellular fluid as gingival crevicular fluid. This way, a series of proteins markers can be used for early diagnosis of these diseases. Considering the change in the pattern of proteins in extracellular fluids in a series of dental diseases and the potential for their use as markers for diagnosis of these diseases, this study proposes the construction of protein map of gingival crevicular fluid of patients in orthodontic treatment with and without the pathology (EIRR), aiming the mapping of proteins related to his pathology, excerpts 3,600 µg two “pools” of gingival crevicular fluid samples, 60 patients with and without the pathology EIRR. 2-DE gels images were scanned and comparison of two-dimensional gels allowed previewing 6 proteins common to both proteins samples, 122 showed differential deposition pattern. Possibility 15 of the differential proteins with low molecular weight could be used as root resorption markers. The search for protein markers will be valuable for early detection of risk groups for EIRR and orthodontic planning, minimizing problem from this pathology.
SUMÁRIO
LISTA DE FIGURAS vi
LISTA DE TABELAS vii
LISTA DE ABREVIATURAS viii
RESUMO ix
ABSTRACT x
I. INTRODUÇÃO
I.I Marcadores moleculares na odontologia 14
I.II Tratamento ortodôntico 16
I.III Reabsorção radicular inflamatória externa-conceito RRIE 16
I.III.I Epidemiologia da RRIE 17
I.III.II Frequência da RRIE 17
I.III.III Classificação da RRIE quanto à sua magnitude 17
I.III.IV Etiopatogenia da RRIE 18
I.III.IV.I Movimentação dentária induzida 18 I.III.IV.II Mediadores bioquímicos da RRIE 22 I.III.IV.III RRIE e forças ortodônticas 24 I.III.V Início da RRIE após movimentação ortodôntica 25 I.III.VI Diagnóstico das Reabsorções radiculares 25 I.III.VII Consequências da RRIE quanto o aporte periodontal 26 I.III.VIII Existe viabilidade da movimentação ortodôntica sem a RRIE? 27
I.III.IX Imunopatologia da RRIE 27
I.III.X Predisposição à RRIE 31
II. FLUIDO CREVICULAR GENGIVAL 34
II.I. Anatomofisiologia do fluido crevicular gengival 34 II.II. O fluido Crevicular gengival como elo entre a clínica ortodôntica e a
pesquisa biológica 35
II.III. Proteoma do fluido crevicular gengival 37
III. SIALOFOSFOPROTEÍNA DENTINÁRIA DSPP 40
III.I. Estudo da DSPP 40
III.II. Biomarcadores moleculares RRIE- DSPP? 41
IV. JUSTIFICATIVA 47
V. OJETIVOS 49
V.I. Objetivo geral 50
V.II. Objetivos específicos 50
VI. MATERIAL E MÉTODOS 51
VI.I. Coleta das amostras protéicas 52
VI.II. Amostragem 52
VI. III. Extração protéica 55
VI.IV. Eletroforese em gel unidimensional SDS-PAGE 55
VI.V. Eletroforese em gel bidimensional (2-DE) 56
VII. RESULTADOS 58 VII.I.Métodos de precipitação protéica para análise por SDS-PAGE 59 VII.II Protocolo extração protéica convencional para 2-DE 59 VII.III 2-DE de proteínas do GCF extraídas em meio aquoso 60 VII.IV Protocolo de focalização isoelétrica para proteínas do GCF extraídas em
meio aquoso 61
VIII. DISCUSSÃO 69
VIII.I. Definição do protocolo para análise de proteínas do GCF por 2-DE 70 VIII.II. Cuidados e considerações experimentais 70 VIII.III. Aumento da concentração total das proteínas do GCF X aumento do
fluxo gengival após movimentação ortodôntica 71
VIII.IV. Inferência estatística das prováveis proteínas do GCF 72 VIII.V. Similaridade do perfil protéico do GCF em relação ao plasma sanguíneo 74
VIII.VI. GCF como transudato 76
VIII.VII. Principais proteínas do GCF 76
VIII.VIII. Spot ID 12 (Albumina) e as proteínas de baixa massa molecular 76 VIII.IX. Aumento do volume porcentual dos spots constitutivos durante a RRIE 77 VIII.X. Prováveis spots candidatos a marcadores da RRIE 78
VIII.XI. Análise 2-DE da DSPP 78
IX. CONCLUSÃO 80
X. PERSPECTIVAS 82
I.I. Marcadores Moleculares na Odontologia
A Biologia Molecular vem apresentando avanços e aplicações bastante expressivos na pesquisa de marcadores protéicos úteis no diagnóstico laboratorial e na avaliação da predisposição de inúmeras doenças bucais, entre eles a doença periodontal o carcinoma de células escamosas, o ameloblastoma, o leiomiosarcoma, a reabsorção radicular externa, dentre outras (KOJIMA et al., 2000, SANDRA et al., 2002, IOI et al., 2002, YAO et al., 2002).
Muitas proteínas do câncer bucal estão sendo pesquisadas, através de técnicas de imunohistoquímica, como a superexpressão das oncoproteínas ciclina D1 e mdm2 associadas com o ciclo celular, assim como a subexpressão dos supressores tumorais p53, p16, p27, que podem ser marcadores tumorais importantes no diagnóstico precoce do câncer bucal (SANDRA et al., 2002, IOI et al., 2002, YAO et al., 2002).
As mutações somáticas do gene p53 são encontradas em aproximadamente metade dos tumores humanos, sendo ativado em respostas a sinais de dano celular, codificando um fator de transcrição que interage com outros seis genes. Algumas mutações do gene p53 podem ter um efeito negativo, onde a proteína do alelo mutante interage e inativa o alelo normal, induzindo a transformação tumoral (SANDRA et al., 2002).
A sua presença indica lesões tumorais agressivas, com chances de sobrevida baixa, assim como pode estar sendo superexpressa em lesões bucais benignas como no ameloblastoma. Além disso, a proteína mdm2 pode se associar a p53 e impedir a supressão imposta por esta mesma proteína (SANDRA et al., 2002). Este mesmo autor, analisando pacientes com ameloblastoma através de Western Blot e ELISA, mostrou que a proteína p53 não estava associada à alta atividade no ameloblastoma, mas isto era devido à atividade da proteína mdm2, principalmente no ameloblastoma de células basais, o mesmo autor relatou que existem evidências da expressão das proteínas p53 e/ou mdm2 também nas lesões de origem odontogênica.
para o prognóstico da agressividade dos carcinomas espinocelulares de língua (YAO et al., 2002).
Os genes supressores p53, e Rb são frequentemente associados ao carcinoma espinocelular, sendo que neste tipo de tumor, o gene p53 tem a capacidade de modular à expressão de outros genes, como o p21, mdm2, Bax e bcl2 (PIBOONINIYOM et al., 2003). Nikitakis e colaboradores realizaram o diagnóstico e prognóstico de dois pacientes através de marcadores moleculares, identificando a proteína p53, que podia ser identificada em leiomiosarcomas, além da expressão do oncogene mdm2, que foram histoquimicamente positivos para quinase 4 dependente da ciclina (CDK4), cuja amplificação e superexpressão são consideradas um mecanismo alternativo para a mutação no gene Rb, envolvendo a proteína do retinoblastoma, ciclinas e quinases dependentes de ciclina (NIKITAKIS et al., 2004).
No campo da reabsorção radicular externa, foram identificados receptores específicos para os cementoblastos, células com um papel primordial na etiopatogenia desta doença, mas que têm poucos receptores de superfície, destacando-se a CP – βγ (“Cementum Protein” - 23), sendo uma proteína importante no mecanismo de regulação do cemento e do periodonto (KÉMOUN et al., 2007). Alguns autores consideram a “Cementum Attachment Protein”, conhecida como CAP, outro tipo de receptor de membrana, uma precursora bioquímica da CP – 23 (ALVARES et al., 2006).
As células pré-odontoblastos e pré–cementoblastos expressam receptores de membrana do tipo STRO-1, CD146 e CD44 quando se diferenciam, e o receptor P2X7 é uma proteína presente em diferentes células humanas, como nos leucócitos polimorfonucleares, monócitos, linfócitos, macrófagos e células da medula óssea, parecendo ter um papel importante no reparo celular (COLLO et al., 1997). Este receptor está sempre presente em áreas vizinhas às regiões necróticas, ou em áreas de hipóxia e injúria celular, como ocorre nas regiões submetidas ao tratamento ortodôntico, e a sua principal função está na promoção do metabolismo de tecidos necrosados na fase aguda de um processo inflamatório (COLLO et al., 1997).
(morfologia radicular), ou seja, a mesma morfologia radicular, e a mesma força ortodôntica podem ter diferenças nas respostas devido a diferenças genéticas. Nas regiões teciduais onde não ocorre a presença do receptor, haverá mais reabsorção radicular, que noutras regiões onde este receptor está ausente, devido a sua função de reparo celular, pois será mais facilmente reparada, inclusive a camada cementoblástica radicular (VIECELLI, 2009).
I.II. Tratamento Ortodôntico
Segundo dados do “Nacional Health and Nutrition Examination Survey III” (NHANES III-1994-2004), as más oclusões na população Norte Americana e a necessidade de tratamento, ocorrem na maioria dos grupos étnicos e raciais, sendo que destes casos, 15% são irregularidades severas nos incisivos que podem afetar a mastigação, assim como a aceitabilidade social (PROFITT et al., 2004). Na população latina norte-americana, a irregularidade dos incisivos é ainda mais prevalente, sendo que 57 a 59% de cada grupo étnico-racial têm algum grau de necessidade de tratamento ortodôntico (PROFITT et al., 2004). No Brasil, apesar de não existir nenhum estudo epidemiológico nacional que retrate a necessidade deste tratamento, o grau similar de miscigenação racial comparável ao da população Norte americana, sugere índices comparáveis ao desta população (GEORGE et al., 1997). Entretanto, o tratamento ortodôntico pode superar a real necessidade em função do apelo de estética e beleza que acompanha culturalmente a população, aumentando sobremaneira a ocorrência de reabsorção radicular inflamatória externa.
I.III. Reabsorção Radicular Inflamatória Externa-RRIE.
O termo Reabsorção (“Resorption”) vem do Latim: ab = de; sorbere = sucção: perda de tecidos ou produtos intrínsecos do organismo (CONSOLARO, 2002).
I.III.I. Epidemiologia da RRIE
em termos de tratamento ortodôntico é mais incidente nos incisivos (HARRIS, 2004) o que aumenta de maneira considerável a incidência e prevalência da RRIE em nosso país.
I.III.II. Frequência da RRIE
Em determinadas situações clínicas que envolvam a movimentação dentária induzida (ortodôntica), a freqüência das RRIE é elevada, mas temporária e passageira, porém tida como patológica. Sua ocorrência não é fundamentada na renovação dos tecidos mineralizados (tecido ósseo), que têm um alto turnover metabólico (CONSOLARO, 2002).
Segundo Breziniak e Wasserstein a reabsorção radicular apical é um problema clínico comum que pode complicar a movimentação dentária ortodôntica e está presente com frequência e extensão variável (BREZINIAK, 1993; WASSERTEIN, 2002). Kurol e colaboradores mostraram que 93% dos adolescentes tratados com aparelho ortodôntico têm RRIE (KUROL et al., 1996). Em um grande estudo com mais de 860 casos, a RRIE maior que 2 mm foi vista em 25% indivíduos tratados (SAMESHIMA & SINCLAIR, 2001). Em um outro estudo com amostras de 151 incisivos maxilares de 40 pacientes em tratamento ortodôntico, por meio de radiografias periapicais da técnica do cone longo, os autores encontraram que 74% dos incisivos centrais superiores e 71% nos incisivos laterais superiores apresentavam RRIE (HARRIS et al., 1990). Kiliany reportou que a RRIE maior que 3 mm ocorre na freqüência de 30% e que somente 5% dos indivíduos tratados foi encontrado 5 mm ou mais de reabsorção radicular (KILIANY, 1999). Não foram encontradas diferenças quanto ao sexo e a incidência da RRIE, sendo a sua freqüência similar nas duas populações (PARKER et al., 1998; BLAKE et al., 1995; BECK et al.; 1994; SAMESHIMA et al., 2001). Quando se excluem pessoas submetidas a tratamento ortodôntico, a freqüência das reabsorções dentárias na população ocidental varia de 7 a 10% (HARRIS; ROBINSON; WOODS, 1993).
I.III.III. Classificação da RRIE quanto a sua magnitude
incisivos centrais e laterais superiores, e quantificação da perda é feita nas mesmas radiografias através de uma régua milimetrada ou paquímetro digital (Figura 1 e 2).
I.III.IV Etiopatogenia da RRIE
A Etiopatogenia da reabsorção radicular está associada a causas físicas como: (A) o calor excessivo, (B) traumatismo dentário com ou sem fraturas radiculares, (C) transplantes dentários, (D) cirurgias envolvendo estrutura radicular, (E) avulsão e reimplantes, (F) a movimentação dentária induzida (CONSOLARO, 2002). São fatores etiológicos independentes, que não têm nenhuma relação entre si, a não ser a sua conseqüência imediata: a necrose da camada cementoblástica radicular, responsável diretamente pelo início da reabsorção radicular externa.
I.III.IV.I Movimentação dentária induzida
A movimentação dentária induzida, também conhecida como movimentação ortodôntica, é a principal causa da rabsorção radicular externa, e a comunidade ortodôntica considera a RRIE um custo biológico do tratamento Ortodôntico. Além disso, só recentemente o aspecto etiopatogênico da RRIE, tornou-se acessível para a maioria dos Ortodontistas. A reabsorção radicular localizada é um processo fisiológico e constante de remodelação em resposta à micro-traumas bucais durante a vida do indivíduo, porém as raízes dos dentes não encurtam naturalmente com a idade, a não ser sob a ação de forças (bruxismo, interposição lingual) que comprimam bastante o seu ligamento periodontal (HARRIS, 2004). O reparo aposicional, geralmente ocorre naturalmente em defeitos reabsortivos superficiais (HARRIS, 2004; PONGSRI & PER RYGH, 1995). O encurtamento irreversível das raízes ocorre devido às forças excessivas ou ao decréscimo de resistência a forças normais (HARRIS, 2004).
Figura 1 - Sistema de escores para RRIE. A classificação da graduação no processo de RRIE foi desenvolvida por Levander e Malmgren em 1998 (Levander & Malmgren, 1988) e segue as seguintes etapas: Grau 0 - Ausência de reabsorção radicular; Grau 1 - Contorno irregular da superfície apical; Grau 2 - Redução do comprimento radicular em até 2 mm; Grau 3 - Redução do comprimento radicular de 2 mm a 1/3 da raiz; Grau 4 - Perda maior que 1/3 da raiz.
E
ser acompanhado com um aumento da duração da força ortodôntica quanto à sua aplicação, e a alta magnitude de momentos produzindo exposição da dentina radicular (CASA et al., 2001).
Em função da delicadeza da região apical, uma pequena reabsorção compromete o volume e o contorno da estrutura, impossibilitando o reparo local, e causando um arredondamento da porção final do dente, o que é facilmente detectável por exame de radiografia (CONSOLARO, 2002). Em termos de evolução clínica, podemos dizer que a região apical é a única que não tem reparo do volume estrutural inicial perdido. (CONSOLARO, 2002).
A RRIE ocorre preferencialmente na região apical, desde que mais de ¾ das lacunas de reabsorção ocorrem na região apical da raiz. Isto se deve a concentração de forças no ápice radicular, a orientação das fibras periodontais que assumem uma diferente direção no terço apical, além do terço apical ser composto de cemento celular, que depende de uma vascularização complexa, o que não ocorre no terço coronal que é composto por cemento acelular (MAVRAGANI, et al., 2002).
Na movimentação dentária induzida, a força aplicada sobre os dentes pode comprimir os vasos sanguíneos em determinadas regiões na superfície radicular, causando estresse celular advindo da compressão localizada, com hipóxia e inflamação discreta e subclínica instalada (CONSOLARO, 2002).
Pode ocorrer necrose de células que revestem o cemento radicular (cementoblastos), ou mesmo a migração destas células que são substituídas por ostoblastos que perfazem a função dos cementoblastos e são denominados cementoblastos-like, que também secretam tecido mineralizado semelhante ao cemento, mas com todos os seus receptores celulares de superfície para osteoclasia presentes, e que podem dar início a reabsorção radicular (Figura 3). A espessura média do ligamento periodontal é de 200 - 250 micrômetros (DAVIDOVITCH, 1991) e provavelmente áreas necróticas com diâmetros superiores a essa medida, pode também ocasionar a suposta migração dos osteoblastos devido à proximidade do osso alveolar, em detrimento do reparo por cementoblastos e pré-cementoblastos (CONSOLARO, 2002). A reabsorção radicular tem como pressuposto a perda do seu recobrimento por parte dos cementoblastos. A necrose dos cementoblastos em áreas de pequenas dimensões pode ser compensada pela proliferação e migração dos cementoblastos e pré-cementoblastos vizinhos, restabelecendo-se a normalidade e proteção da estrutura radicular (CONSOLARO, 2002).
I.III.IV.II Mediadores bioquímicos da RRIE
Neste quadro clínico os mediadores bioquímicos da inflamação estão presentes, e por isso a reabsorção dentária relacionada com a movimentação ortodôntica é classificada como de reabsorção inflamatória (CONSOLORA, 2002). No exudato inflamatório são encontrados em grande quantidade produtos derivados das proteínas plasmáticas, das células locais, das proteínas teciduais e dos leucócitos constituintes do exsudato inflamatório (CONSOLARO, 2002). Estes produtos geralmente são: derivados do ácido aracdônico, como as prostaglandinas (PGE2) e os leucotrienos; citocinas, geralmente secretadas pelos macrófagos; interleucina 1 alfa e 1 - beta (1 - L 1), Interleucina - 2 (IL - 2), Interleucina 6 (IL - 6), fator de necrose tumoral (TNF), fatores de crescimento epidermoíde (EGF), lipopolissacarídeos (LPS) ou endotoxinas., óxido nítrico das células estressadas (CONSOLARO, 2002).
A reabsorção normal e patológica dos tecidos mineralizados é realizada por ação dos clastos, células gigantes geralmente multinucleadas, contendo de 7 a 15 núcleos, com cerca de 200 micrometros cúbicos, mas com o seu diâmetro variando de 10 a 100 micrômetros (PIERCE et al., 1991) que interage com mediadores locais liberados pelos osteoblastos e células mononucleares da mesma linhagem dos macrófagos (CONSOLARO, 2002). Os osteoblastos e os macrófagos são modulados por mediadores locais e sistêmicos (RODAN & MATRIN, 1981). Ao conjunto destas três células (macrófagos, osteoblastos e osteoclastos), responsáveis pelo mecanismo de reabsorção dos tecidos mineralizados, dá-se o nome de unidade osteoremodeladora ou BMU (CONSOLARO, 2002). Os osteoclastos, células responsáveis pela remodelação dos tecidos minerais no corpo humano, só se fixam em estruturas mineralizadas e desnudas de osteóide, pré-cemento e pré-dentina (CONSOLARO, 2002; WENDENBERG, 1987).
Histologicamente, as áreas de reabsorções externas, revelam superfícies dentinárias irregulares, repletas de osteoclastos em lacunas de Howship, sendo que nestas lacunas abrem-se numerosos tubos dentinários sem alteração dos seus diâmetros, inclusive quando observados pelo microscópio de varredura (CONSOLARO, 2002). Os clastos apresentam-se morfologicamente variados quanto a sua forma, distribuição, contorno e quantidade de núcleos, que podem variar de 1 a 7 (CONSOLARO, 2002).
da concentração iônica crescente (do desmonte da estrutura do tecido ósseo mineralizado), gerando várias lacunas de Howship são distribuídas de forma irregular (CONSOLARO, 2002).
A fina espessura do cemento no terço cervical e médio da raiz, de cerca de 20 a 50 micrômetros, leva a ampla exposição de numerosos túbulos dentinários no compartimento periodontal, comunicando-se com o compartimento pulpar, porém, sem nenhum comprometimento da pré-dentina e da polpa dentária, se não houver contaminação bacteriana (CONSOLARO, 2002).
As alterações de natureza hormonal, nutricional ou metabólica não ocasionam processos de RRIE, o que foi comprovado por Lindskog e confirmado por outros pesquisadores, devido à descoberta de que os cementoblastos que revestem a superfície radicular cementária não têm receptores bioquímicos de superfície para os mediadores da osteoclasia, como o paratormônio (PTH) (LINDSKOG et al., 1987; CHO; LIN; GARANT, 1991). Portanto, o início de um processo reabsortivo é dependente da necrose dos cementoblastos, que são os guardiões da integridade radicular, e a reabsorção é um fenômeno estritamente local (CONSOLARO, 2002). Os cementoblastos são “surdos” para os mediadores da remodelação óssea, mesmo que os mesmos estejam em grandes quantidades no periodonto, como no hiperparatireoidismo, que exibe grandes quantidades do paratormônio no plasma sanguíneo (CONSOLARO, 2002; MIRIAN, 2001; LINDISKOG & HAMMARSTROM, 1987).
A única entidade patológica que exime condições etiológicas de caráter nitidamente local é a Osteodisplasia Fibrosa Hereditária, doença congênita e hereditária, descrita por Michel e colaboradores, que a descreveram em 43 membros de uma família, na qual foram diagnosticadas reabsorções cervicais externas coadjuvantes de uma osteopatia generalizada (MICHELL et al., 1990).
I.III.IV.III RRIE e forças ortodônticas
Uma série de estudos clínicos padronizados em adolescentes tem sido utilizada para investigar a relação entre o movimento dentário ortodôntico que induz precocemente a reabsorção radicular e a duração da força aplicada (OWMAN-MOLL, 1995), a magnitude da força aplicada (OWMAN-MOLL & LUNDGRENlL, 1996) e o tipo da força aplicada (OWMAN-MOLL & KUROL, 1995). Os resultados destes estudos foram ambíguos e as variações individuais foram consideráveis, embora os pacientes tenham sido selecionados com homogeneidade no que concerne á idade, desenvolvimento dental e tipo de mal oclusões, pois as variações nos dados indicaram uma genuína variação individual (OWMAN-MOLL & KUROL, 2000).
Para Parker e Harris, a quantidade da movimentação ortodôntica está positivamente associada com a extensão da RRIE, e é responsável por 90% da variação da RRIE (PARKER & HARRIS, 1998), ao passo que outros autores acreditam que a mesma é responsável por 1/3 das variações da RRIE (LINGE & LINGE, 1991; BAUMRIND et al., 1996; HORIUCHI et al., 1998).
O que está claro é que a quantidade requerida de movimentação ortodôntica é em função da severidade da maloclusão (HARTSFIELD et al., 2004) e grandes movimentações dentárias aumentam o risco de reabsorção radicular, e não foram encontradas diferenças entre as diversas técnicas ortodônticas fixas e a quantidade de RRIE (PARKER & HARRIS, 1998). Também nenhuma diferença foi encontrada por Blake comparando duas populares técnicas ortodônticas (BLAKE et al., 1995; EDGEWISE, 1925 & BEGG, 1950).
A intrusão é o movimento ortodôntico mais prejudicial no que concerne à RRIE, embora a distância que o ápice é movido ortodonticamente está freqüentemente correlacionada ao grau de encurtamento radicular (HARRIS, 2004). Mesmo nos movimentos dentários ditos de corpo, haverá de ter sempre certo grau de inclinação pelos movimentos pendulares requeridos, e os movimentos de inclinação dão ao ápice a característica onde as forças atuam mais eficientemente, e também onde mais se concentram devido à forma cônica da raiz (CONSOLARO, 2002). Porém Costopoulo e Nanda não encontraram valores estatisticamente significantes relacionando a intrusão com a RRIE, e que outros fatores que não os mecânicos podem afetar a RRIE, como os fatores biológicos (OSTOPOULO & NANDA, 1996).
osteoclasia, que acabam aplainando a região e o ápice dentário é arredondado (CONSOLARO, 2002).
De certa maneira, a casuística da região apical é maior que das demais regiões dentárias além de ser mais exigida nos movimentos ortodônticos e facilmente detectada nas radiografias periapicais (CONSOLARO, 2002). Em um estudo com 635 pacientes na idade de 8 a 16 anos, Satu e colegas, encontraram uma correlação entre a duração do tratamento ativo e a incidência e o grau de reabsorção radicular, mas, sobretudo a quantidade e o tipo de movimento ortodôntico são também determinantes para o aumento do risco para reabsorção radicular (SATU et al., 2007).
I.III.V. Inicio da RRIE após a movimentação dentária induzida
Segundo Owman-Mol, após 7 semanas de aplicação de forças sobre os dentes 6,7% do contorno radicular tem reabsorções dentárias inflamatórias externas (OWMAN–MOL, 1995). Contudo durante este período a reabsorção só é visível através de métodos histológicos incompatíveis incompatíveis com a detecção por métodos radiográficos (PROFIT; FIELDS; MORAY, 2004).
I.III.VI. Diagnóstico das reabsorções radiculares.
O diagnóstico das reabsorções dentárias é feito através de radiografias periapicais, que têm uma melhor acurácia em termos de detalhes que as demais radiografias, porém por serem bidimensionais falham em revelar a superfície da reabsorção no aspecto lingual e vestibular das raízes não retratam a profundidade das lesões reabsortivas, e quando as mesmas são detectadas, o processo reabsortivo já se iniciou há bastante tempo, portanto não detecta precocemente a lesão inicial (ACAR et al., 1999). Somente após a perda de 60 a 70% dos tecidos mineralizados radiculares é que é feita a detecção radiográfica, e informa primariamente as mudanças apicais, não se visualizando a lesão antes deste período (BALDUCCI et al., 2007). Tomografias computadorizadas e imagens volumétricas por Cone Beam têm mostrado aumento na sensibilidade para detecção de reabsorção radicular, mas a alta dose de exposição radioativa e o seu alto custo as tornam impraticáveis como uso corriqueiro do dia a dia da clínica ortodôntica (WALKER et al., 2005).
ortodôntico o seu diagnóstico é incerto, se utilizarmos radiografias periapicais, e somente após 5 a 6 meses de tratamento, através das mesmas radiografias, é que teremos um confiável diagnóstico de reabsorção radicular (LEVANDER et al., 1998).
As características radiográficas e histológicas no que concerne a reabsorção externa são bem incisivas no que dizem respeito aos limites anatomofisiológicos da pré-dentina, separando o tecido conjuntivo frouxo especializado pulpar (Polpa dentária) da reabsorção propriamente dita, sendo que o diagnóstico diferencial radiográfico (externa ou interna) consiste em acompanhar a linha correspondente à parede interna da dentina e o contorno do canal radicular (CONSOLARO, 2002). Portanto, é vista radiograficamente como uma linha radiolúcida irregular com comprometimento assimétrico e irregular da estrutura dentária, respeitando-se a polpa dentária (CONSOLARO, 2002).
I.III.VII. Conseqüência da RRIE quanto ao aporte periodontal.
A perda do aparato periodontal de sustentação devido ao encurtamento radicular após uma movimentação ortodôntica é uma constante no tratamento ortodôntico, e segundo Kalkwarf e colaboradores, a perda de até 3 mm no terço apical, não é motivo de preocupação, pois estes autores estabeleceram um modelo matemático de equivalência da redução da crista óssea alveolar com a perda de suporte periodontal, e verificaram que 3 mm de perda de estrutura apical, equivalia á perda de 1 mm na crista óssea alveolar, não implicando significativo comprometimento da função e sustentação do dente no alvéolo (KALKWARF et al., 1986; CONSOLARO, 2002).
Philips estabeleceu que o encurtamento radicular de 2 mm, reduz a superfície radicular em 6 a 9%, quando a perdas está em 4 mm reduz-se a superfície radicular em 18 a 22% e quando o encurtamento for de 6 mm a superfície está reduzida em 28 a 38% (PHILIPS et al., 1955). Os dados de Philips mostraram que a superfície radicular responde pela menor parte do suporte periodontal.
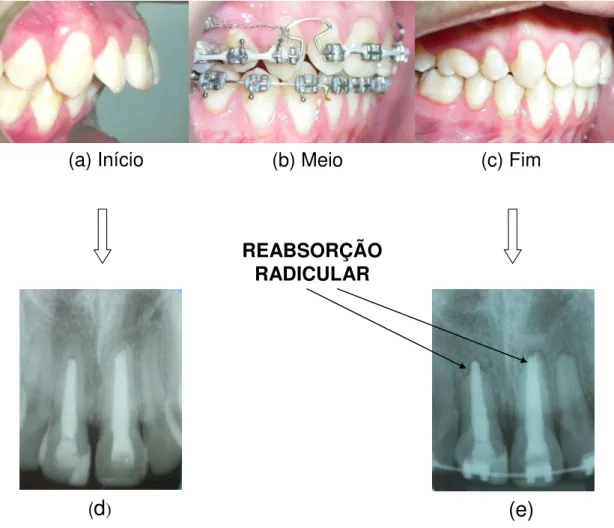
Copeland e Green constataram uma redução média de 2,93 mm em 45 pacientes analisados depois de findo o tratamento ortodôntico (COPELAND & GREEN, 1986). Linge e colaboradores relataram em 719 pacientes com 12,8 anos de idade em média um encurtamento médio de 0,73 a 0,67 mm para meninos e meninas respectivamente, porém podemos verificar a tenra idade destes pacientes com uma melhor atividade reparadora que indivíduos mais velhos, com a verificação da reabsorção radicular após 3,6 anos de tratamento ortodôntico, tempo mais que suficiente para o reparo radicular (LINGE et al., 1991). Segundo Killiany e colaboradores, a reabsorção radicular apical severa após tratamento ortodôntico é de cerca de 1% a 2% (Figura 4) (KILLIANY et al., 1999)
Uma extrema reabsorção radicular com perda de mais de um terço do comprimento original radicular foi vista em somente 0,4 a 1% dos incisivos (REMINGTON et. al., 1989; JANSON et. al., 2002). A reabsorção severa e estruturalmente importante acontece em 1% das pessoas submetidas a tratamento ortodôntico (CONSOLARO et al., 2002).
I.III.VIII. Existe viabilidade da movimentação ortodôntica sem a RRIE?
A presença de reabsorção radicular inflamatória externa caracteriza a presença de lesões significativas na camada cementoblástica, por anóxia ou remoção mecânica (CONSOLARO, 2002). A presença de necrose extensa dos cementoblastos na camada radicular ou até mesmo a sua apoptose, é a inferência de uma força biologicamente inviável aplicada na superfície radicular (CONSOLARO, 2002). Esta força é decorrente da incapacidade atual de prever e calcular com certo grau de precisão e acurácia significativa, a magnitude da força aplicada para determinado paciente, principalmente tendo em vista, que a força ótima varia de indivíduo para indivíduo (CONSOLARO et al., 2002). Isto levou a comunidade ortodôntica a propor uma pré-disposição em determinados indivíduos no que tange ao maior ou menor risco de sofrer danos em sua estrutura radicular, podendo-se afirmar que é quase impossível uma movimentação ortodôntica sem a RRIE e não é previsível a sua ocorrência, nos indivíduos por ela afetados.
I.III.IX. Imunopatologia RRIE
Figura 4 - Imagens de paciente em tratamento ortodôntico. Paciente no início do tratamento ortodôntico (a), com o aparelho fixo (b), e com o resultado final (c). As respectivas radiografias periapicais: Inicial (d) sem reabsorção radicular externa, e final (e) com reabsorção radicular externa, correspondentes ao início e final do tratamento ortodôntico.
(a) Início (b) Meio (c) Fim
REABSORÇÃO RADICULAR
interno, não permitindo a identificação das proteínas da dentina como próprias do organismo, durante o período de formação do sistema imunológico (MIRIAN, 2001).
A dentina é um tecido composto predominantemente por material inorgânico (65%), sendo a sua grande maioria por hidroxiapatita. A parte orgânica, 35%, é formada por colágeno, que corresponde a 20% desta parte orgânica, e é principalmente do tipo I, mas existem em menor quantidade outros tipos.
As proteínas presentes na dentina, incluindo o colágeno, são sintetizadas pelos odontoblastos, e com a formação da dentina radicular e da camada hialina, a bainha epitelial vai se desfazendo por apoptose (MIRIAN, 2001). O conjunto de tripla hélice do colágeno dentro de longas fibrilas (50 a 200nm de diâmetro, é o responsável pela flexibilidade e resiliência da dentina. A água corresponde á outros 13%, e finalmente o restante, cerca de 2% é composto por citrato, lactato, lipídeos e proteínas não colagênicas (NCPs) (YASUO, 2008).
Aproximadamente 9,5% da matriz extracelular dentinária é composta por proteínas derivadas do soro sanguíneo (IgG, albumina, αβHS - GP), proteoglicanas (decorina, biglicana), fatores de crescimento (TGFß, FGF, IGF, CIA) e proteínas de natureza semelhante às do tecido ósseo.
As proteínas não colagênicas podem ser classificadas em três grandes grupos:
1 - Glicoproteínas/Sialoproteínas, 2 - Fosfoproteínas, 3 - Proteínas GLA (ácido - carboxiglutâmico), (Tabela 1).
Existem basicamente duas proteínas que são específicas do tecido dentinário e que foram isoladas da matriz extracelular da dentina: a fosfoproteína dentinária - DPP (também chamada fosforina) e a sialoproteína dentinária – DSP. Ambas são sintetizadas e secretadas por odontoblastos jovens e maduros e transitoriamente por pré–ameloblastos (RITCHIE et al., 1987; BÉGUE-KIM et al., 1998).
Glicoproteinas /
Sialoproteínas Organismo
MW
(kDa) Observações
BMP- Proteína
osteomorfogenética Coelho 21,5
Osteoindutora / considerada fator crecimento
Boi 17-22
Homem 18,5
BSP - Sialoproteína óssea
Rato 23 Denominada nateriormente Sialoproteína óssea II
OPN - Osteopontina Rato 44 Denominada nateriormente Sialoproteína óssea I
DSP -Sialoproteína dentinária
Rato 53 Específica da dentina, corresponde 5 a 8% NCPs
SPARC Osteonectina Camundongo 43 Glicoproteína óssea ligada ao cálcio
Bag-75 Glicoproteína ácida óssea
Rato 75 Componente da família das sialoproteínas ósseas
Fosfoproteínas Organismo MW
(kDa) Observações
DPP Fosfoproteína
dentinária Boi 155
---Homem 140
Rato 90-95
Camundongo 75
DMP-1 Proteínas da matriz dentinária
Rato 60 Encontrada também no tecido ósseo
Proteínas GLA Organismo MW
(kDa) Observações
MGP Proteínas da matriz GLA
Rato 15 Insolúvel na matriz óssea
OC Osteocalcina Rato 15 Proteína óssea mais abundante; agente quimiotático para precursores osteoclastos
O primeiro a isolar e caracterizar a DPP humana foram Chang, Chiego e Claerkson, que através de SDS-PAGE 7,5% encontraram bandas de 140, 60, 50 e 34 kDa e sem a utilização de nenhum agente redutor, as bandas de 60, 50, 34 KDa estavam ausentes, sugerindo ser subunidades de uma proteína maior de 140 kDa (CHANG et al., 1996). Este resultado foi confirmado por Clarkson, Chang e Holland, que observaram que a massa molecular variava em decorrência da degradação (CLARKSON et al.,1998).
Como o sistema imunológico é capaz de constituir “memória”, através do reconhecimento de substâncias próprias do organismo, especialmente durante a vida intrauterina, desenvolvendo uma tolerância imunológica a estas substâncias, e o tecido dentinário não é apresentado ao sistema imunológico devido á sua proteção, foi comprovada que a dentina apresenta imunogenicidade, induzindo uma reação de anticorpo e/ou sensibilização linfocitária (MIRIAN, 2001), o que caracterizaria a dentina como um antígeno seqüestrado, pois devido à sua formação tardia, não sendo apresentado ao sistema imunológico durante o desenvolvimento da tolerância natural ou construção da memória imunológica, assim como os espermatozóides e o cristalino, (MIRIAN, 2001).
I.III.X. Predisposição à RRIE
Os incisivos centrais da maxila são os mais suscetíveis devido ao ápice de suas raízes serem mais longas e esguias, e devido aos incisivos serem movimentados a uma maior distância em relação aos outros dentes durante o tratamento ortodôntico (HARRIS, 2004; MC- FADDEN et al, 1989; KALLEY et al; 1991). Seguidos de perto, quanto á predisposição, temos os incisivos laterais superiores e os pré-molares da maxila (KUROL; OWMANN-MOLL; LUNDGREN, 1996).
Os incisivos maxilares dos pacientes que tiveram os seus primeiros pré-molares extraídos para a correção da maloclusão demonstraram significativamente mais RRIE comparado ao grupo de pacientes que não realizaram extrações dentárias (HOOMAN et al., 2007).
dentária que podem ter um papel no aumento da prevalência das RRIE, porém é contestada por alguns autores (KJAER, 1995; LEE et al., 1999).
Estudos anteriores reportaram uma significante correlação entre extração de pré-molares e RRIE (McNAB et al., 2004; HARRIS et al., 2001). As extrações requerem geralmente grandes movimentos dentários e deslocamentos apicais para corrigir as maloclusões (SHARPE et al., 1987, BECK & HARRIS, 1994). Isto resulta em mais atividade reabsortiva na região apical, o qual pode causar grandes quantidades de RRIE e uma alta porcentagem de dentes com uma reabsorção clinicamente significante, em especial os incisivos superiores (HOOMAN et al., 2007).
Interessante foi o estudo radiográfico de Linge e Linge que reportaram uma marcante variação da reabsorção radicular em dentes do mesmo indivíduo (LINGE & LINGE, 1983). Kurol e colaboradores indicaram que fatores individuais têm fator de importância no desenvolvimento de reabsorções radiculares induzidas por tratamento ortodôntico (KUROL et al., 1996). O mesmo autor demonstrou a grande diferença entre RRIE de pacientes com alto e baixo risco, em pré-molares da maxila, aplicando-se a mesma magnitude e duração da força ortodôntica (OWMANN-MOLL & KUROL., 2000). Isto foi evidenciado histologicamente, após a extração de pré-molares maxilares que foram movimentados com um aparelho ortodôntico fixo, foi realizada a aplicação de forças consideradas ótimas em um período entre 1 a 7 semanas. Os 96 indivíduos da amostra que tiveram posteriormente os seus dentes extraídos para análise histológica, eram de um grupo homogêneo quanto ao seu desenvolvimento dental e a sua maloclusão, e tinham a média de idade de 13,4 anos, mas mesmo assim, observou-se uma grande variação individual, sendo que em alguns casos, a área de reabsorção foi quase cinco vezes maior comparado com outros indivíduos que foram classificados como de baixo risco a RRIE (Figura 5) (KUROL et al., 1996).
Segundo SATU et al., 2007, o potencial ou risco de reabsorção radicular varia entre pacientes ortodônticos e pode variar entre diferentes dentes no mesmo indivíduo, e fatores biológicos individuais, como densidade óssea alveolar, vascularidade, estrutura do dente, podem explicar estas variações.
II. FLUIDO CREVICULAR GENGIVAL
II.I. Anatomofisiologia do fluido crevicular gengival
O fluido crevicular gengival (GCF) é um fluido que emerge entre a superfície do dente e o epitélio intertegumentar. A exata natureza do fluido, sua origem e composição têm sido objeto de controvérsias, mesmo após 100 anos de sua descoberta. Estas controvérsias existem em função de variações na quantidade e natureza do fluido, e as diferentes metodologias utilizadas para a sua amostragem (GARETH & GRIFFITHS, 2003).
Este fluido origina-se dos plexos de vênulas pós-capilares situados logo abaixo do epitélio juncional, e serve como barreira de proteção contra a entrada de microorganismos (BAER et al., 1987). A sua composição inclui células epiteliais, leucócitos, enzimas (gelatinase, elastase, metaloproteinases, -glucoronidase, colagenase, asparato-aminotransferase, fosfatase-alcalina, alfa1-antitripsina, alfa2-macroglobulina), metabólitos, eletrólitos, imunoglobulinas e outras proteínas (osteocalcina, transferrina, albumina, osteonectina), lipídeos, carboidratos e uréia (JOHNSON et al., 1999; EMBERY et al., 1994; BAER et al., 1987). O seu perfil bioquímico já é utilizado por alguns autores no diagnóstico de algumas patologias, como as doenças periodontais, gengivite e dentre estas a RRIE (reabsorção radicular inflamatória externa), (MASH et al., 2004; BALDUCCI et al., 2007; SHALENE et al., 2008).
A comparação entre muitos estudos revelou uma taxa do total de proteínas do fluido crevicular gengival de 64 a 422 ug/ml em sítios saudáveis e 14 a 1325 ug/ml em sítios doentes, então, valores de quantificação absolutos para muitos componentes do fluido crevicular gengival têm sido de difícil asserção (JOHNSON et al., 1999). Porém o fluxo do GCF não é um bom indicador da doença periodontal, e muito baixa correlação existe entre o fluxo do GCF e a profundidade de bolsas gengivais, não sendo o mesmo, portanto um bom indicativo da presença ativa da doença periodontal (BAER et al., 1987) (Figura 6).
Para alguns estudiosos, a qualificação dos constituintes do GCF e não o aumento do seu fluxo é que têm maior valor indicativo da presença de determinadas patologias (BAER et al., 1987).
II.II. O fluido crevicular gengival como elo entre a clínica
ortodôntica e a pesquisa biológica.
A expressão de biomarcadores do GCF é principalmente utilizada na Odontologia para estimar a resposta imunológica do hospedeiro na doença periodontal (WELLINGTON, 2010).
Assim como a doença periodontal, o tratamento ortodôntico também leva a destruição do osso alveolar e destruição do ligamento periodontal. As ativações dos aparelhos ortodônticos são realizadas sem a plena apreciação das questões biológicas. Durante a reabsorção óssea é iniciado um processo variado de etapas a fim de recrutar por quimiotaxia e manter os osteoclastos em locais específicos durante a remodelação óssea (WELLINGTON, 2010). A regulação deste processo multifásico é realizada por inúmeras substâncias como hormônios, citocinas do processo inflamatório, fatores de crescimento, fatores relacionados à osteoclastogênese e componentes da matriz óssea celular (WELLINGTON, 2010).
(A) (B)
Os métodos mais utilizados para a coleta de amostras do GCF são: micropipetas, tiras de papéis e o Millipore Periopapertm (BILDT et al., 2009; GIANNOPOULOU et al., 2008; OFFENBACHER et al., 1986) (Figura 7).
Segundo Wellington, o procedimento odontológico para a coleta das amostras do GCF consiste na remoção da placa subgengival (profilaxia) com um raspador de plástico sem tocar na gengiva, seguida pela secagem cuidadosa da gengiva por 10 segundos com ar comprimido (seringa tríplice) e isolamento relativo da saliva com roletes de algodão (WELLINGTON, 2010). Após isto, as tiras são inseridas por 30 a 60 segundos no sulco gengival dos elementos dentários selecionados. As tiras são rotuladas e transportadas para tubos eppendorf simples, com tampão de fosfato salino, e enviado imediatamente para o laboratório. No laboratório são agitados por 15 segundos à temperatura ambiente e centrifugados por 5 minutos a 3.000 g para eliminar biofilmes bacterianos e elementos celulares. O sobrenadante de todos os pacientes são então armazenados a -80 oC para posterior análise como biomarcador (SCHIERANO et al., 2008).
Os principais cadidatos à biomarcadores do GCF e seu significado clínico está especificado na Tabela 2
II.III. Proteoma do fluido crevicular gengival
Figura 7 - Coleta de amostras do GCF. Coleta com periopaper (A); Coleta com Millipore (B) (Wellington J. Rody, 2010).
(A) (B)
Tabela 2: Principais moléculas candidatas à biomarcadores do GCF.
* Modificado de Wellington J. Rody, 2010. Candidatos a
biomarcadores Nome Siginificado clínico Referências ortodônticas
Fatores relacionados a osteoclastogênese
RANK, RANKL e Osteoprotegerina
Monitorar a remodelação óssea durante a movimentação ortodôntica
Kawasaki et al., 2006 Nishijima et al., 2006 Toygar et al., 2008 George & Evans, 2009
Citocinas inflamatórias TNF, IL-1,2,6,8 IL 4.10,13
Mostrar a taxa da movimentação ortodôntica; verificar a ativação dos osteoclastos
Uematsu et al., 1996 Iwasaki et al., 2001, 2005 Ren et al., 2007 Giannopoulou et al., 2008
Associados a destruição da matriz extracelular
Metalloproteinases da matriz 1, 8 e 9
Mostrar a adaptação do ligamento periodontal às forças mecânicas
Apajalahti et al., 2003 Ingman et al., 2005 Cantarella et al., 2006 Takahashi et al., 2006 Bildt et al., 2009
Produtos da reabsorção da dentina
DSP Silaloproteína dentinária; DPP fosfoproteína dentinária
Monitorar a reabsorção radicular durante a movimentação ortodôntica
As ferramentas do arsenal proteômico, para a análise deste conjunto de proteínas, são: a eletroforese bidimensional, (2-DE) e a espectrometria de massa técnicas utilizadas na identificação e caracterização de marcadores biológicos, específicas de determinados estados patológicos, que são úteis no diagnóstico precoce, prognóstico e evolução clínica desta mesma patologia (GÖRG et al., 1985 GOBOM et al., 1999).
A eletroforese bidimensional (βDE) desenvolvida por O’Farrel e Klose, consistia de géis de poliacrilamida em forma de cilindro, cujo estabelecimento do pH, era através de anfólitos específicos, com alta capacidade tampão, em pHs próximos ao seu ponto isoelétrico. Após a focalização isoelétrica e a separação protéica por pontos isoelétricos, as proteínas eram submetidas a uma eletroforese em gel de poliacrilamida, com dodecilsulfato de sódio (SDS), um detergente anfipático cuja função reside na uniformização de cargas protéicas através de sua desnaturação, com vistas à separação das proteínas por massa molecular (O’FARREL et al., 1975).
Posteriormente, foram desenvolvidos géis de poliacrilamida em formas de tiras, com gradiente de pH imobilizado (IPG immobilized pH gel), (GÖRG et al., 1985; GINAZZA et al., 1989). Então, a eletroforese, com a sua alta capacidade de resolução, para separar um grande número de amostras complexas, e fazer análises da expressão gênica, através de comparações de padrões protéicos, é uma das melhores técnicas quantitativas e qualitativas que dispomos para separação protéica o gel é uma matriz de um polímero de poliacrilamida com ligações cruzadas de N – metil – bis – acrilamida, cuja porosidade da malha é conseqüência da concentração de acrilamida (WILKINS et al., 1997).
III. SIALOFOSFOPROTEÍNA DENTINÁRIA -DSPP
III.I. Estudo da DSPP
A maior proteína não colagênica da dentina é a DSPP, cuja antigenicidade elevada requer um estudo mais aprofundado da sua origem e síntese, visto o seu potencial como marcador molecular da reabsorção radicular externa.
O gene da DSPP está nos seres humanos no cromossomo 4q21. 3 e mutações na DSPP são relacionadas com displasias dentárias tipo II (DD - tipo II) e dentinogênese imperfeita do tipo II e III. (DGI tipo II e III), (YASUO et al., 2006). A DSPP é o maior produto de secreção dos odontoblastos e é crítico para a apropriada formação da dentina dentária, e é uma proteína multidomínio com centenas de modificações pós-traducionais (QUIN et al., 2004). Esta molécula é sintetizada como uma proteína quimérica, composta de três partes: DSP, DGP e DPP e nunca foi detectada no extrato dentinário, por que logo após a sua síntese, é clivada por proteases (MMP - 2 gelatinase e MMP - 20 enamelisina), em sua três subunidades (YASUO et al., 2006; BRESCHI et al., 2003). Durante a dentinogênese, a DSPP é clivada proteoliticamente em subunidades menores (DPP, DSP, DGP), e falhas nesta clivagem podem ser causas potenciais de desenvolvimento de defeitos dentários (YASUO et al., 2006). Gu e colaboradores, demonstraram que a DPP e a DSP são codificados para um mesmo gene, o gene DSPP, tendo um mesmo Rna mensageiro para ambos os transcritos (GU et al.,2000). A clivagem inicial é entre DGP e DPP, gerando DSP/DGP e DPP (YASUO, 2008).
A DSP é uma proteoglicana que formam dímeros covalentes (pontes dissulfeto), DGP é uma glicoproteína fosforilada, e a DPP é uma proteína altamente fosforilada que mostra extensivos polimorfismos de comprimento devido á heterogeneidade de sua região codante (YASUO, 2008).
A DPP é uma fosfoproteína altamente ácida, com ponto isoelétrico de 1.1, e têm na sua composição aminoácidos na grande maioria de serina e ácido aspártico, além disso, têm uma seqüência N-terminal conservada de Asp-Asp-Pro-Asn (YASUO et al., 2006; YASUO et al., 2008).
A DSP está no domínio N - terminal de DSPP, e DSP é codificado pelos exons 2 a 4 da DSPP, o éxon 5 codifica ambos DGP e DPP (YASUO et al., 2008). Já a DGP foi recentemente descoberta, sendo a menor das proteínas derivadas da DSPP, sendo que: DSP está na porção N-terminal da DSPP, DGP está no meio, e DPP está na porção C-terminal (YASUO et al., 2006).
III.II. Biomarcadores moleculares RRIE-DSPP?
Desde que Evans e colaboradores demonstraram a presença de certas proteínas no fluido crevicular gengival de pacientes submetidos a tratamento ortodôntico, mais especificamente a proteína da matriz dentinária (DMP - 1) e a Sialoproteína dentinária (DSP), o estudo destas proteínas aprofundou-se de maneira marcante, e pesquisas correlacionando a sua presença às reabsorções radiculares aumentou de maneira apreciável (EVANS et al., 2000).
Estas proteínas não são rotineiramente liberadas para dentro do espaço do ligamento periodontal, a não ser que haja a presença de uma ativa reabsorção radicular externa (BALDUCCI et al., 2007), pois fazem parte do tecido dentário, mais especificamente da dentina.
A perda da estrutura radicular geralmente é realizada de uma maneira seqüencial, com a perda do cemento dentário antecedendo a dissolução da dentina, porém os produtos da degradação do cemento no fluido crevicular gengival (CGF) foram detectados em ambos os grupos controle e grupos de tratamento, o que de certa forma os desqualificam como marcadores para a RRIE, durante a movimentação ortodôntica, o cemento é reabsorvido e subsequentemente reparado, então as proteínas do cemento não podem ser um indicativo da perda permanente da estrutura radicular (MASH et al., 2004; LIU et. al., 2000; OWMAN-MOLL et al., 1995).
Embora pequenas áreas de reabsorção dentinária tenham sido demonstradas que sofrem reparo; áreas maiores e áreas apicais não sofrem reparo, tornando a perda da dentina uma parte significativa da perda da estrutura radicular (MASH et al., 2004).
Outro trabalho detectou a fosfoproteína dentinária (DPP) no CGF de pacientes com vários graus de reabsorção radicular utilizando a análise por Western Blot, e embora este método não provenha informações quantitativas, foi sugerido que a DPP pode ser útil como marcador da RRIE (MASH et al., 2004; SRINIVASAN et al., 1998).
dentinária DSP), que apareceram como subprodutos da reabsorção radicular no fluido crevicular gengival, e foram analisados por ensaios imunoenzimáticos (ELISA), por James Mash (DPP), e posteriormente confirmados (Fofoproteína Dentinária DPP e Sialoproteína dentinária DSP) por Laura Balducci e colaboradores através de eletroforese unidimensional (SDS-PAGE), Western blot, ELISA, e por Shalene e colaboradores (sialoproteína dentinária - DSP) também por Western blot e ELISA (MASH et al.,2004; BALDUCCI et al.,2007; SHALENE et al., 2008).
Laura Balducci identificou e quantificou as proteínas da matriz extracelular associadas com a mineralização da dentina: a proteína 1 matriz dentinária (DMP1), a fosfoproteína dentinária (DPP), e a sialoproteína dentinária (DSP) no fluido crevicular gengival de indivíduos que estavam em tratamento ortodôntico (BALDUCCI et al.,2007).
A dentina é continuamente depositada durante a vida como dentina secundária, somente na superfície pulpar, estas proteínas não são rotineiramente liberadas dentro ou em volta deste espaço (periodontal) como dentina, e pode não existir um processo de remodelação como existente no tecido ósseo. Somente na presença de reabsorção radicular externa é que estas proteínas podem estar livres no espaço do ligamento periodontal (BALDUCCI et al., 2007).
A DMP-1, uma proteína não colágena, identificada na matriz mineral da dentina e do osso, foi encontrada em grandes quantidades no fluido crevicular gengival durante o processo de reabsorção, e isto pode ser atribuído à presença desta proteína que é removida do osso e da dentina durante a RRIE. Através de SDS - PAGE, Laura Balducci comprovou que a concentração total de proteínas do grupo com RRIE foi maior do que do grupo controle, devido à degradação das proteínas da matriz durante a RRIE (proteínas: 77, 66, 55, 50, 26 kDa (BALDUCCI et al., 2007).
Na análise de Western Blot, o tamanho das bandas foi igual para os dois grupos, mas mais intenso para o grupo com RRIE (com anticorpo DMP1: duas bandas, sendo uma de 55 kDa e outra de 66 kDa; anticorpo DPP: uma banda entre 55-60 kDa e anticorpo DSP: duas bandas entre 50 e 70 kDa) (BALDUCCI et al., 2007). A presença de apenas uma banda no anticorpo DPP, pode ser devido a sua intensa carga negativa, que talvez a total transferência para membrana do Western Blot.
grupo controle, o que não ocorreu entre os grupos com RRIE leve e severa (BALDUCCI et al., 2007).
Embora haja uma diferença estatisticamente significativa entre o grupo controle e o grupo de estudo (RRIE), o que não ocorreu numa pesquisa conduzida pelo grupo de Liu, visto que utilizaram à análise de Western Blot, DMP-1 não é específica para a dentina, e a sua presença não é apenas devido ao processo de RRIE, mas também devido ao aumento da remodelação óssea durante a movimentação dentária ortodôntica (LIU et al., 2000). A DMP-1 não é um bom marcador para a reabsorção radicular, desde que não é possível distinguir entre normalidade e atividade patológica (BALDUCCI et al., 2007).
As concentrações de DPP e DSP foram maiores no grupo com RRIE severa, seguido do grupo com RRIE leve e em menor concentração no grupo controle (BALDUCCI et al., 2007). A presença de pequenas quantidades de proteína DPP e DSP no grupo controle pode ser devido à utilização de anticorpos policlonais que têm reatividade a proteínas com epítopos similares, e talvez, a presença de pequenas quantidades de DPP no grupo controle possa ser sugestivo de pequenas mudanças estruturais, devido à reabsorção fisiológica da raiz dentária, com os odontoclastos e os odontoblastos tendo uma função similar aos osteoclastos e osteoblastos na reabsorção óssea, remodelando e mantendo a superfície radicular (BALDUCCI et al., 2007; WEHRBEIN et al., 1995). Por esse motivo, o autor sugere que devido às concentrações encontradas nas RRIE severas e brandas serem estatisticamente diferentes, e inclusive com relação ao grupo controle, a DPP e a DSP podem ser marcadores moleculares disponíveis para a detecção precoce e o monitoramento dinâmico da RRIE antes do aparecimento nas radiografias de controle, e testes de diagnósticos não invasivos podem ser desenvolvidos baseados nestes mesmos marcadores moleculares (BALDUCCI et al., 2007).
As vantagens segundo James Mash, do método de detecção dos produtos da RRIE através do fluido crevicular gengival são as seguintes:
(1) sensibilidade (2) não invasivo
(3) não há exposição à radiação
(7) prediz o subseqüente curso clínico e prognóstico da doença (8) permite implementar alterações na terapia
(9) verifica a resposta atual a alterações no tratamento
James Mash também relacionou grupos tratados com RRIE e grupos controle através de imunoensaio enzimático (ELISA), e também encontrou pequenas quantidades de DPP no grupo controle, sugerindo ser devido a alta sensibilidade do método ELISA, mesmo que o anticorpo utilizado para este fim foi desenvolvido com DPP de ratos, homólogos ao dos seres humanos, pois, o anticorpo para a DPP humana é um desafio, devido à “dobradura“ da proteína e sua extensas modificações pós-traducionais que acomete a molécula, que é “blindada” por numerosos fosfatos e grupos de carboidratos (MASH et al., 2004). Estes grupos são comumente encontrados em outras proteínas e não são particularmente antigênicos, tornando muito difícil a produção de anticorpos contra a DPP humana. Também, a presença de DPP no grupo não tratado (controle) pode ser sugestiva de mudanças sutis no nível estrutural (MASH et al., 2004), A DPP é vista na mudança do estágio de deposição para o de maturação (CHANGE et al., 1996) e esta mudança pode refletir o turnover basal das proteínas da dentina na maturação da raiz, que é parecida a remodelação óssea quando imatura, e o tecido ósseo é recolocado com osso lamelar maduro (MASH et al., 2004), lembrando que o grupo controle é formado por indivíduos de 12 a 16 anos, tempo no qual o ápice dos incisivos maxilares são formados (rizogênese), como os odontoblastos e odontoclastos, trabalhando de maneira similar aos osteoblastos e osteoclastos, formando, reabsorvendo, remodelando e mantendo a dentina (MASH et al., 2004). Não é conhecido se, a remodelação da dentina ocorre, mas estudos têm mostrado que a dentina não é um tecido homogêneo, e que os componentes protéicos mudam com a idade e maturação da raiz (CLARKSON et al., 1998).
DPP são expresso de um único RNA mensageiro transcrito, e que este transcrito é derivado de uma grande proteína precursora chamada DSPP, que é tradicionalmente considerada ser específica da dentina. Quin e coleguas encontraram que o gene da DSPP foi expresso em células osteoblásticas, DSP foi detectado nos extratos dos ossos longos de ratos na relação de 1:400 em relação à dentina (QIN et al., 2002). Usando a técnica da reação em cadeia da polimerase de transcriptase reversa, e primers específicos para a porção 5’ DSP e para a seqüência γ’ DPP, DSPP mRNA foi detectado em células osteoblásticas - like e osteoblastos da calvária de ratos, entretanto, este gene foi expresso em um nível muito inferior nos osteoblastos que nos odontoblastos (dentina) (SHALENE et al., 2008; CHANG et al., 1996).
Isto pode indicar que diferentes mecanismos regulatórios governam a expressão da DSPP e que estão envolvidos no tecido ósseo e na dentina (SHALENE et al., 2008). A presença da DSP no osso, embora em pequenas quantidades, pode explicar a presença da DSP no grupo controle (SHALENE et al., 2008). Na análise por Western Blot, Shalene sugeriu a presença de marcadores moleculares (DSP) com massa molecular entre 16 a 54 kDa, similar, segundo a autora, a massa molecular de 55 kDa da DSP achada por Waddington et al., 1998 indicando que a DSP no GCF é um produto da RRIE, pois a DSP intacta, isolada de dentes decíduos com reabsorção fisiológica teve a sua massa molecular de 89kDa, também similar aos estudos efetuados por Quin e colaboradores (SHALENE et al., 2008; QUIN et al., 2002). A indicação destas proteínas (DPP e DSP) como marcadora molecular não é de todo consensual devido: a presença destas proteínas no grupo controle, (mesmo que em pequenas quantidades); a evidência de que estas proteínas não são exclusivas da dentina (são expressas nos tecidos ósseos) podendo estar presentes no fluido crevicular gengival devido ao processo fisiológico da remodelação óssea (que normalmente é elevada em pacientes submetidos ao tratamento ortodôntico), e não devido à reabsorção radicular (MASH et al., 2004; BALDUCCI et al., 2007; WEHRBEIN et al., 1995; SHALENE et al., 2008; QIN et al., 2002).