Universidade de Trás-os-Montes e Alto Douro
Caracterização química dos extratos de carqueja (Pterospartum
tridentatum, Wilk) e de erva de S. Roberto (Geranium robertianum, L.)
e avaliação da sua toxicidade usando modelos in vitro
Dissertação de Mestrado em Bioquímica
Constance Elise Silva dos Santos
Orientadora: Amélia M. Lopes Dias da Silva Coorientador: Fernanda Maria Lopes Ferreira
Universidade de Trás-os-Montes e Alto Douro
Caracterização química dos extratos de carqueja (Pterospartum
tridentatum, Wilk) e de erva de S. Roberto (Geranium robertianum, L.) e
avaliação da sua toxicidade usando modelos in vitro
Dissertação de Mestrado em Bioquímica
Constance Elise Silva dos Santos
Orientadora: Amélia M. Lopes Dias da Silva Coorientadora: Fernanda Maria Lopes Ferreira
Composição do Júri ______________________________________________________________________ ______________________________________________________________________ ______________________________________________________________________ ______________________________________________________________________ Data: ____________________________ Vila Real, 2014
“As doutrinas expostas neste trabalho são da exclusiva responsabilidade do autor”
Agradecimentos
Na última etapa da dissertação da tese, e a terminar o Mestrado em Bioquímica, não posso deixar de agradecer a todos aqueles que de alguma forma contribuíram para que tal acontecesse e da melhor forma possível.
Em primeiro lugar queria agradecer à Professora Doutora Amélia M. Silva por ter sugerido este trabalho, que se mostrou ao longo do ano uma surpresa positiva. Obrigada pela passagem dos seus conhecimentos e experiência, pela extrema disponibilidade, simpatia e acessibilidade.
Agradeço à Professora Doutora Fernanda Ferreira por prontamente ter aceitado ser minha coorientadora e todo o apoio dado na escrita.
Ao Professor Doutor Fernando Nunes, que não tendo qualquer obrigação, mostrou-se sempre pronto para conduzir todas as tarefas laboratoriais.
Queria agradecer a TODOS aqueles que de uma forma ou de outra me auxiliaram no laboratório, a cooperação, a entreajuda, o ambiente, em especial: André, Ana, Juliana, Joana, Sandrine e ao Sr. Carlos.
Também queria agradecer a todos os meus amigos em especial à Sambrine por me aturar todos os dias deste árduo percurso, à Mara e à Carla que mesmo distantes estiveram sempre presentes.
Finalmente e o mais importante à minha família, pois sem o seu esforço nada disto seria possível. Aos meus avós por todo o apoio, força e coragem que me deram, para conseguir atingir mais uma etapa, aos meus pais pelo seu apoio incondicional em todas as minhas decisões. Agradeço-lhes por serem tão permissivos, acessíveis e liberais, por todo o amor, carinho, compreensão, conselhos e pelos seus valores e conhecimentos que me transmitiram ao longo da vida.
Resumo
As plantas são utilizadas pelo homem desde tempos imemoriais no tratamento de patologias diversas. As plantas contêm na sua composição inúmeros compostos, como por exemplo os compostos resultantes do metabolismo secundário, que, das suas várias funções, são responsáveis por inibir outras moléculas como por exemplo as espécies reativas de oxigénio (ROS) presentes nos seres vivos. Devido à crescente procura de terapias alternativas, recorrendo ao uso de substâncias não sintéticas, à evolução da tecnologia e ao interesse por parte dos investigadores em caracterizar e estudar a aplicação das plantas na área medicinal, tem aumentado a investigação da atuação de compostos naturais provenientes das plantas.
Existem inúmeras plantas utilizadas tradicionalmente em Portugal para o tratamento de várias patologias, como por exemplo a carqueja (Pterospartum tridentatum, Wilk) e a erva de S. Roberto (Geranium robertianum, L.) espécies endémicas de Portugal. São utilizadas pelo seu efeito anti-inflamatório, anti-diabético, anti-cancerígeno, anti-asmático, anti-alérgico e diurético, para o tratamento de problemas do sistema digestivo, entre outros. Assim, com a sua extensa aplicação é importante e necessário o conhecimento da aplicação dos extratos no organismo, sendo essencial saber a sua forma e local de ação e se efetivamente existe fundamento científico para todas estas aplicações.
O objetivo deste trabalho foi obter uma breve caracterização química dos extratos aquosos e hidro-etanólicos de carqueja (Pterospartum tridentatum Wilk.) e erva de S. Roberto (Geranium robertianum L.), bem como estudar o efeito da aplicação destes extratos nas linhas celulares HepG2 e Caco-2 (ensaios in vitro) para avaliar a sua potencial citotoxicidade e pesquisar a presença de possíveis compostos bioativos moduladores de vias intracelulares (e.g. apoptose) que interfiram com a proliferação celular ou com processos reresponsáveis pelos atributos medicinais das plantas.
Os principais compostos fenólicos encontrados para a carqueja foram a floretina, a isoquercetina e a miricetina. Na erva de S. Roberto foram identificados como compostos fenólicos a luteolina, o ácido elágico, um derivado da apigenina e a geraniina.
Aplicaram-se todos os extratos (aquosos e hidro-etanólicos) e frações após SPE (aquosas e metanólicas) obtidas às duas linhas celulares nas concentrações de 50, 100, 200 e 500 µg/mL, e a viabilidade celular foi medida ao fim de 24, 48 e 72 h de exposição. Verificou-se que os extratos que apresentam maior capacidade para reduzir o crescimento celular foram, no caso da carqueja os extratos aquosos iniciais nas concentrações de 200 e 500 µg/mL. Os extratos que
apresentam maior capacidade para reduzir o crescimento celular na erva de S. Roberto foram os extratos hidro-etanólicos iniciais e a fração metanólica após SPE nas concentrações de 100, 200 e 500 µg/mL.
Podemos concluir que efetivamente os extratos levaram à diminuição do crescimento e da viabilidade das linhas celulares Caco-2 e HepG2 demonstrado que a sua atividade biológica é determinada pelo tipo e concentração dos seus compostos.
Palavras-chave: Carqueja (Pterospartum tridentatum Wilk.); Erva de S. Roberto (Geranium robertianum L.); plantas medicinais; antioxidantes; atividade anticancerígena; HPLC;
Abstract
Plants were always used by the human population like a traditional form of treatment for innumerous diseases. Resulting from plant’s secondary metabolism, plants have in their composition various compounds with several properties, among them the capacity to inhibit other molecules like reactive oxygen species (ROS) present in the living organisms. Due to the increasing demand of therapies that use non-synthetic substances, to the evolution of the technology and to the interest from the scientists in characterizing and studying the application of plants in the medicinal area, it has been increasing the research of the potential bioactive role of natural compounds from the plants.
There are countless plants traditionally used for the treatment of several pathologies, as prickled broom or “carqueja” (Pterospartum tridentatum, Wilk) and herb Robert (Geranium
robertianum, L.), two endemic plants of Portugal. They are used due to their anti-inflammatory,
anti-diabetic, anti-carcinogenic, anti-asthmatic, anti-allergic and diuretics properties, as well as for the treatment of digestive system ailments, between others medicinal properties. Thus, with its extensive application, it is important and necessary to acquire knowledge about the effects of plants extracts in the organism, being essential to understand the targets and the metabolic pathways involved in the mechanism of action and if their use brings profits to cell metabolism or is just empirical.
The main goal of the proposed research is to perform a brief chemical characterization of
Pterospartum tridentatum Wilk. and Geranium robertianum L. extracts, and evaluate the in vitro effect of the application of these extracts, using Caco-2 and HepG2 cell lines, in order to
investigate its potential cytotoxicity or its potencial effects as modulator of important physiological pathways involved on the cell proliferation and viability mechanisms. The presence of potential bioactive compounds with the ability to modulate/induce apoptotic pathways will also be investigated.
The main phenolic compound identified in P. tridentatum were floretin, isoquercetin and mirycetin. G. robertianum major phenolic compounds found were luteolin, ellagic acid, apigenine derivative and geraniin
The extracts (aqueous and hydro-ethanolic) and fractions (aqueous and methanolic) were applied to both cell lines at concentrations of 50, 100, 200 and 500 µg/mL and cell viability was measured after 24, 48 and 72 h of exposures. The extracts that show higher capacity to reduce cell growth were, in P. tridentatum the initial water extract at 200 and 500 µg/mL
concentration. G. robertianum extracts that showed higher capacity to reduce cell viability were initial hydroethanolic extracts and methanolic fraction before SPE, in 100, 200 and 500 µg/mL. In conclusion the extracts showed a reduce of cell viability and/or cell growth in both cell lines, Caco-2 and HepG2 and their activity are determined by the type and concentration of the present compounds.
Key words: pickled broom; Pterospartum tridentatum Wilk.; Herb Robert; Geranium
Índice
Agradecimentos ... vii
Resumo ... ix
Abstract ... xi
Índice ... xiii
Índice de figuras ... xvii
Índice de tabelas ... xviii
Índice de equações ... xviii
Abreviaturas, siglas e acrónimos ... xix
1. Introdução ... 1
1.2. Compostos biologicamente ativos ... 2
1.2.1. Radicais livre e espécies reativas de oxigénio (ROS) e nitrogénio (RNS).... 3
1.2.2. Antioxidantes ... 3
1.2.3. Compostos fenólicos ... 4
1.2.3.1. Caracterização química e biossíntese ... 5
1.2.3.2. Classificação ... 6
1.3. Caracterização das espécies utilizadas neste trabalho ... 8
1.3.1. Pterospartum tridentatum, Wilk ... 8
1.3.1.1. Distribuição geográfica ... 8
1.3.1.2. Morfologia ... 9
1.3.1.3. Composição química e bioquímica ... 9
1.3.1.4. Aplicações ... 10
1.3.1.5. Estudos in vitro e in vivo da aplicação de extratos de P. tridentatum . 10 1.3.2. Geranium robertianum, L. ... 12
1.3.2.1. Distribuição geográfica ... 12
1.3.2.2. Morfologia ... 13
1.3.2.3. Composição química e bioquímica ... 13
1.3.2.4. Aplicações ... 14
1.3.2.5. Estudos in vitro e in vivo da aplicação de extratos de G. robertianum 14 1.4. Objetivos... 15
2. Material e métodos ... 17
2.1. Origem do material vegetal ... 17
2.2. Obtenção de extratos aquosos e hidro-etanólicos ... 17
2.2.1. Princípio teórico ... 17
2.2.2. Procedimento ... 18
2.3. Extração em fase sólida (SPE) ... 19
2.3.1. Princípio teórico ... 19
2.3.2. Procedimento ... 21
2.4. Identificação de compostos fenólicos por cromatografia líquida de alta eficiência em fase reversa (RP-HPLC) ... 21
2.4.1. Princípio teórico ... 21
2.4.2. Procedimento ... 22
2.4.3. Análise ... 23
2.5. Quantificação dos açúcares totais ... 23
2.5.1. Princípio teórico ... 23
2.5.2. Preparação de soluções ... 24
2.5.3. Hidrólise das amostras ... 25
2.5.4. Análise por cromatografia iónica de alta eficiência com deteção de pulso amperométrico (HPAEC-PAD) ... 25
2.6. Quantificação de fenóis totais pelo método de Folin-Ciocalteu ... 26
2.6.2. Procedimento ... 26
2.7. Atividade antioxidante pelo método de ABTS ... 27
2.7.1. Princípio teórico ... 27
2.7.2. Preparação de soluções ... 28
2.7.2.1. Preparação do radical ABTS+• ... 28
2.7.2.2. Preparação da solução de trabalho de ABTS ... 28
2.7.3. Determinação da capacidade antioxidante das amostras ... 28
2.7.4. Determinação da percentagem de inibição ... 29
2.8. Culturas celulares: manutenção e manuseamento ... 29
2.8.1. Características das linhas celulares ... 29
2.8.2. Meios de cultura e soluções ... 30
2.8.2.1. Meio de cultura completo ... 30
2.8.2.2. Meio de cultura sem soro ... 31
2.8.2.3. Soluções ... 31
2.8.3. Manutenção das linhas celulares ... 31
2.8.3.1. Mudança de meio de cultura ... 31
2.8.3.2. Subcultura, tripsinização de células aderentes e sua contagem ... 32
2.8.3.3. Procedimento ... 32
2.8.4. Teste de viabilidade celular pelo método de Alamar blue (AB) ... 33
2.8.4.1. Princípio teórico ... 33
2.8.4.2. Procedimento ... 34
2.9. Análise de dados ... 35
3. Resultados e discussão ... 37
3.1. Caracterização dos extratos de flor de carqueja ... 37
3.1.1. Rendimentos das extrações ... 37
3.1.2. Compostos fenólicos e atividade antioxidante ... 38
3.1.4. Quantificação de açúcares totais ... 43
3.1.5. Efeito dos vários extratos de carqueja na viabilidade celular ... 45
3.2. Caracterização dos extratos de erva de S. Roberto ... 49
3.2.1. Rendimentos das extrações ... 49
3.2.2. Compostos fenólicos e atividade antioxidante ... 50
3.2.3. Caracterização fitoquímica do extrato ... 52
3.2.4. Quantificação de açúcares totais ... 56
3.2.5. Efeitos dos extratos de erva de S. Roberto na viabilidade celular ... 58
4. Discussão geral ... 63
5. Conclusões gerais e perspetivas futuras ... 67
Índice de figuras
Figura 1 – Biossíntese geral dos compostos fenólicos nas plantas. ... 6
Figura 2 – Núcleo de um flavano. ... 7
Figura 3 – Flores e folhas de carqueja. ... 8
Figura 4 – Distribuição de P. tridentatum na Península Ibérica. ... 9
Figura 5 - Flore e folha da erva de S. Roberto. ... 12
Figura 6 – Distribuição mundial de G. robertianum. ... 13
Figura 7 – Esquema representativo do procedimento geral. ... 18
Figura 8 – Esquema elucidativo do procedimento da extração em fase sólida. ... 20
Figura 9 – Representação esquemática do sistema de RP-HPLC. ... 22
Figura 10 – Reação do fenol pelo reagente de Folin-Ciocalteu. ... 26
Figura 11 – Reação química geral do radical ABTS na determinação da capacidade antioxidante. ... 27
Figura 12 – Estrutura molecular do Trolox. ... 28
Figura 13 - Foto de células Caco-2 (A) e de HepG2 (B) mostrando a morfologia e modo de crescimento com ampliação 100x. ... 30
Figura 14 – Representação esquemática da reação de redução do Alamar blue. ... 33
Figura 15 –Cconcentração de compostos fenólicos totais (A), Atividade antioxidante (B), Percentagem de recuperação após SPE (C), dos extratos da carqueja. ... 39
Figura 16 – Caracterização dos açúcares nos extratos da carqueja e suas correspondentes frações. Valores de percentagem de monossacáridos após hidrólise ácida. ... 44
Figura 17 – Viabilidade celular de células Caco-2, em termos de percentagem de redução de Alamar blue, expostas aos extratos da carqueja por 24 e 48h. ... 46
Figura 18 – Viabilidade celular de células HepG2, em termos de percentagem de redução de Alamar blue, expostas aos extratos da carqueja por 24 e 48h. ... 48
Figura 19 - Concentração de compostos fenólicos totais (A), Atividade antioxidante (B), Percentagem de recuperação após SPE (C) dos extratos de erva de S. Roberto. ... 51
Figura 20 - Percentagem de monossacáridos nos extratos da erva de S. Roberto. ... 57 Figura 21 – Gráficos da percentagem de redução de Alamar blue em células Caco-2, expostas aos extratos da erva de S. Roberto por 24, 48 e 72h. ... 59 Figura 22 - Gráficos da percentagem de redução de Alamar blue em células HepG2, expostas aos extratos da erva de S. Roberto por 24, 48 e 72h. ... 61 Figura 23 – Comparação morfológica entre carqueja (A) e erva de S. Roberto (B). ... 64
Índice de tabelas
Tabela 1 - Massa dos açúcares para a preparação dos padrões. ... 24 Tabela 2 – Rendimentos mássicos obtidos nos extratos de carqueja e nas suas frações. ... 37 Tabela 3 – Cromatogramas obtidos nos extratos da carqueja. ... 40 Tabela 4 – Identificação química dos picos obtidos nos cromatogramas do extrato inicial e fração metanólica da extração hidro-etanólica e aquosa da carqueja. ... 42 Tabela 5 – Rendimentos mássicos obtidos nos extratos da erva de S. Roberto. ... 50 Tabela 6 – Cromatogramas obtidos nos extratos da erva de S. Roberto ... 52 Tabela 7 – Identificação química dos picos obtidos nos cromatogramas do extrato inicial e fração metanólica da extração hidro-etanólica e aquosa da erva de S. Roberto. ... 53 Tabela 7 – (continuação) ... 54 Tabela 7 – (continuação) ... 55
Índice de equações
Equação 1 – Fórmula para o cálculo da percentagem de inibição do radical ABTS. ... 29 Equação 2 – Fórmula para o cálculo da percentagem da redução de Alamar blue. ... 34
Abreviaturas, siglas e acrónimos
(p/p) Massa de soluto presente em 100 g de solução (v/v) Volume de soluto presente em 100 mL de solução
AB Alamar blue
ABTS Ácido 2,2-azino-bis-3-etilbenzotazolina-6-sulfónico AKT/PKB Proteína cinase serina/ treonina (proteína cinase B)
BAD Proteína promotora de morte associada à Bcl-2 (do inglês “Bcl-2-associated
death promoter”)
BAX Proteína pro-apoptótica
Bcl-2 Proteína reguladora da apoptose (do inglês “B-cell lymphoma 2”) BHA Butil-hidroxianisol
BHT Butil-hidroxitolueno
Caco-2 Células de adenocarcinoma do epitélio colorectal humano (do inglês “human
epethelial colorectal adenocarcinoma cell”)
Cox-2 Ciclo oxigenase 2 ou regulador enzimático de pro-inflamação (do inglês “prostaglandin-endoperoxide synthase 2”)
DL50 Dose letal mediana
DPPH 2,2-difenil-1-picril-hidrazilo (do inglês “2,2-diphenil-1picrylhydrasyl”) EDTA Ácido tetra acético de dietilamida (do inglês “ethylenediamine tetraacetic
acid”)
FADH Dinucleótido de favina e adenina FBS Soro fetal bovino
GAE Equivalente de ácido gálico (do inglês “galic acid equivalent”) GC Cromatografia gasosa (do inglês “gas chromatography”)
HBSS Solução-tampão salina de Hank (do inglês “Hank’s balanced salt solution”) HepG2 Células de hepatocarcinoma humano (do inglês “hepato cellular carcinoma”) HPAE Cromatografia iónica de alta eficiência (do inglês “High performance
anion-exchange chromatography”)
HPLC Cromatografia líquida de alta pressão (do inglês “High-performance liquid
chromatography”)
MTT Brometo de 3-[4,5-dimetil-tiazol-2-il]-2,5-difeniltetrazólio NADPH Fosfato dinucleótido de nicotinamida e adenina
NK-κB Factor nuclear kappa B (do inglês “nuclear factor
kappa-light-chain-enchancer of activated B cells”)
OMS Organização mundial de saúde PAL Fenilalanina amónia-lipase PKC Proteína cinase
PPARγ Recetor ativado por proliferador peroxissomo gama (do inglês “Peroxisome
proliferador-activated receptor gamma”)
ROS Espécies reativas de oxigénio (do inglês “reactive oxygen species”) RNS Espécies reativas de nitrogénio (do inglês “reactive nitrogen species”) rpm Rotações por minuto
RT Tempo de retenção (do inglês “retention time”)
SGLT 1 Proteína transportadora de glucose dependente de sódio (do inglês
“sodium-glucose transportproteins”)
SPE Extração em fase sólida
TEAC Capacidade antioxidante em equivalentes de Trolox (do inglês “trolox
equivalence antioxidante capacity”)
Trolox Ácido (6-hidroxi-2,5,7,8-tetrametil-2-cromonil)
UV Ultravioleta
1. Introdução
A utilização e aplicação de plantas medicinais provêm do conhecimento empírico com milhares de anos de experiência, sendo transmitida de geração em geração. Apoiada pelo método de tentativa e erro e, sem qualquer base científica, as pessoas aprenderam a reconhecer e a usar as plantas. Todas as civilizações desenvolveram para fins alimentares e/ ou terapêuticos, formas de cultivo de plantas, além da pesquisa dos benefícios que estas poderiam trazer para a saúde. Reconheceram, assim, que existiam plantas comestíveis e plantas com propriedades especiais, dotadas de maior ou menor toxicidade quando utilizadas para qualquer doença, e mostrando assim o seu poder curativo (Camejo-Rodrigues et al., 2003; Neves et al., 2008).
A utilização de espécies endémicas, com base no conhecimento das plantas da região passou a ser a única forma disponível como forma de tratamento ou prevenção de doenças (Martins, 2011; Neves et al., 2008). Até ao século XIX, as plantas eram o principal agente terapêutico usado. Contudo, durante a revolução industrial, perdeu-se parte do interesse da utilização das plantas endémicas, passando-se para o desenvolvimento da síntese química e farmacológica de drogas sintéticas. Posteriormente foram iniciados processos de isolamento de compostos a partir de plantas com ação biológica, iniciando-se uma nova fase científica da utilização de plantas medicinais. Houve assim uma substituição progressiva dos compostos sintéticos pelo extratos vegetais, onde estavam presentes os compostos farmacologicamente ativos (Martins, 2011; Rates, 2001; Pedro, 2008).
Atualmente uma grande parte da população recorre a terapias alternativas por várias razões e, segundo a Organização Mundial de Saúde (OMS), cerca de 70 a 80% da população nos países desenvolvidos, já recorreu a algum tipo de medicina alternativa (Novais et al., 2004; WHO, 2008a). Também se sabe pela OMS (WHO, 2008b) que a medicina com o recurso a plantas é a forma de medicina tradicional mais lucrativa nos mercados internacionais. Hoje em dia é comum considerar que “o que é natural é bom” e não apresenta efeitos secundários (Martins, 2011). Os avanços tecnológicos, o interesse por parte dos investigadores em diversos temas no estudo de plantas, a biodiversidade e a biodisponibilidade levaram à descoberta de substâncias responsáveis pelas propriedades medicinais (Pedro, 2008). Este facto fez com que recentemente a procura e o uso de terapias alternativas tenha aumentado, pela facilidade de obtenção e pela disponibilidade económica (Lima, 2009; Martins, 2011) ou por possíveis contra
indicações ou efeitos hepatotóxicos das substâncias sintéticas (Ferreira et al., 2010; Pedro, 2008; Rates, 2001).
1.2. Compostos biologicamente ativos
Vários estudos epidemiológicos demonstram que o consumo de frutas, vegetais e seus derivados possuíam benefícios contra doenças crónicas, como alguns tipos de cancro. Estas propriedades estão relacionadas com a presença de algumas vitaminas, fibras e fitoquímicos não essenciais, podendo-se destacar os polifenóis. Estes compostos tem sido alvo de investigação devido a possuírem propriedades redox (antioxidantes), resultando numa elevada capacidade de absorção, neutralização e eliminação de radicais livres (Brenna & Pagliarini, 2001; Gil et al., 2002; Zheng & Wang, 2001). Estas moléculas, quando se encontram em desequilíbrio no organismo, são associadas à causa de várias doenças como cancro, doenças neuro-degenerativas, doenças cardiológicas, diabetes mellitus, entre outras (Neagu et al., 2010; Singh & Rajini, 2004; Silva et al., 2007; Tawaha et al., 2007; Yokozawa et al., 2007). Pensa-se então que o motivo da existência destas doenças possa Pensa-ser provocado pelo dePensa-sequilíbrio entre os radicais livres produzidos e os antioxidantes presentes no organismo, que atuam ao nível da inativação enzimática, provocam mutações, rutura de membranas e até a morte celular. Este desequilíbrio entre o excesso de radicais livres produzidos e os antioxidantes presentes é designado por stresse oxidativo, e está na origem de inúmeras patologias, como já foi referido (Cerqueira et al., 2007; Maes et al., 2011).
Estudos realizados em várias regiões do mundo demonstram que as maiorias das plantas utilizadas tradicionalmente são espontâneas e apresentam uma variação na composição química principalmente nos metabolitos secundários, apresentando assim diferentes quimiotipos, em resposta às condições edafoclimáticas (Martins, 2011; Neves et al., 2008). Estes compostos possuem um papel importante para a sobrevivência da planta, tendo como função a resistência a situações de stresse ou defesa, como por exemplo no combate a radicais livres ou a espécies reativas de oxigénio e nitrogénio (ROS e RNS). Assim, os metabolitos secundários são geralmente os responsáveis pelas propriedades farmacológicas e medicinais das plantas (Coelho et al., 2011; Luís et al., 2009; Martins, 2011). Para além destes compostos ativos, as plantas apresentam outras substâncias que podem influenciar a ação dos metabolitos secundários, podendo por exemplo, proteger o princípio ativo de oxidações ou de hidrólises, permitindo a absorção pelo organismo. Esta atuação conjunta justifica assim que a ação da planta ou do extrato, em determinados casos, possa ser vantajosa. Os metabolitos isolados
podem ser: ácidos orgânicos, ésteres de ácidos aromáticos que se apresentam em forma de sais, alcalóides, taninos, flavonóides (muitas vezes conjugados com glúcidos), componentes voláteis que se apresentam como constituintes dos óleos essenciais, entre outros (Bourgaud et al., 2001; Coelho et al., 2011; Pedro, 2008; Ramachandra Rao & Ravishankar, 2002)
1.2.1. Radicais livre e espécies reativas de oxigénio (ROS) e nitrogénio (RNS)
Os radicais livres são átomos, moléculas ou iões que possuem eletrões desemparelhados ou uma camada de eletrões livre, tornado os radicais espécies muito reativas. Estes radicais são produzidos em todos os organismos vivos durante as reações de oxidação, nos processos do metabolismo celular. Em determinadas situações a concentração normal de radicais livres aumenta, criando-se um desequilíbrio entre o conteúdo de antioxidantes naturais, existentes nas células, e o teor de oxidantes (Bernhoft, 2010; Maes et al., 2011). Numa situação destas, o excesso de radicais livres, quando não neutralizados, pode provocar danos consideráveis ao organismo. Alguns destes radicais ao reagirem com moléculas de oxigénio, por vezes formam os ROS, onde o átomo de oxigénio possui um eletrão desemparelhado. Já no caso dos radicais livres reagiram com moléculas de azoto formam as espécies reativas de azoto (RNS). Estas moléculas, ao reagirem com outras moléculas podem dar origem ao radical superóxido (O2-•),
ao ião peroxido (O22-) ao peróxido de hidrogénio (H2O2), ao radical hidroxilo (-•OH), ao radical
hipoclorito (ClO-•) e ao oxido nítrico (NO•). Por sua vez estas podem reagir, entre si, formando outras espécies de radicais, como por exemplo o ião peroxido em conjunto com o ácido nítrico formam o peroxinitrito (ONOO-) (Adedapo et al., 2009; Bernhoft, 2010; Cerqueira et al., 2007; Fransen et al., 2012; Maes et al., 2011). Estes também são constantemente produzidos, e em caso de qualquer distúrbio, podendo afetar desde componentes celulares a pequenas moléculas biológicas, acabando por desencadear doenças mais ou menos graves (Singh & Rajini, 2004; Tawaha et al., 2007; Yokozawa et al., 2007). Este processo é designado por stresse oxidativo, e pode ser agravado pela exposição a metais pesados, poluentes, toxinas, entre outros (Neagu
et al., 2010; Santos, 2010).
1.2.2. Antioxidantes
Os antioxidantes podem ser definidos como compostos que, em baixas concentrações, e na presença de um substrato oxidável atrasam ou inibem a oxidação desse mesmo substrato de forma eficaz. Os seres vivos desenvolveram mecanismos de defesa contra os radicais livres, através da inativação enzimática, como por exemplo a enzima superóxido dismutase, a catálase
e a glutationa peroxidase. Estas enzimas evitam reações de oxidação no DNA, nos lípidos e nas proteínas. (Bernhoft, 2010). Os organismos também possuem antioxidantes não enzimáticos, como a glutationa, o ácido ascórbico (vitamina C) e tocoferol (vitamina E), que tem a capacidade de impedir a produção de ROS, ou mesmo inibi-los quando formados (Bianchi & Antunes, 1999). Devido aos meios naturais de prevenção ou eliminação de radiais livres, nem sempre ser eficaz, ou insuficiente, torna-se imprescindível ingerir fontes que contenham antioxidantes exógenos. Assim os antioxidantes obtidos a partir da dieta alimentar indispensáveis para uma defesa apropriada do organismo, tendo um papel importante para saúde (Cerqueira et al., 2007). Os antioxidantes podem ser classificados como primários e secundários (Reische et al., 2002).
Os antioxidantes primários ou inibidores são aceitadores de radicais livres, atrasando ou inibindo a iniciação ou interrompendo a propagação da auto-oxidação. Assim sendo o mecanismo de atuação destes antioxidantes é o sequestro de radicais livres. A maior parte destes antioxidantes são compostos sintéticos como butil hidroxianisol (BHA) ou butil hidroxitolueno (BHT). Nos alimentos também existem antioxidantes naturais como os fenóis e os carotenóides (Cerqueira et al., 2007; Reische et al., 2002).
Os antioxidantes secundários ou preventivos atuam por diversos mecanismos, diminuindo a taxa de oxidação, mas não convertem os radicais livres em produtos mais estáveis. Podem quelar metais pró-oxidantes e desativá-los, decompor espécies reativas a espécies não radicalares, absorver radiação ultravioleta ou agir como captador de oxigénio. Além, disso também promovem a ação dos antioxidantes primários. De entre os antioxidantes naturais que se inserem nesta classificação podem-se indicar a vitamina E, o ácido ascórbico ou vitamina C, o ácido cítrico e o ácido tartárico (Cerqueira et al., 2007; Reische et al., 2002).
1.2.3. Compostos fenólicos
Os compostos fenólicos correspondem a um grande grupo de moléculas complexas que estão divididas pela base da sua estrutura química e padrão de substituição. Estes compostos são metabolitos secundários das plantas, sintetizados em resposta a condições de stresse, podendo atuar como atrativo para a polinização, como pigmento vegetal ou como antioxidante, protegendo a planta de radiação e de agentes patogénicos. Vários estudos têm demonstrado que os compostos fenólicos possuem uma vasta aplicação farmacológica como: bactericidas, antivirais, antialérgicos, anti-trombóticos, anti-inflamatórios, anti-carcinogénicos, hepato-protetores e vasodilatadores (Cheynier, 2005; Huang & Zheng, 2006; Lee et al., 2009;
Soobrattee et al., 2005; Silva et al., 2007; Tawaha et al., 2007). Vários estudos revelam que os compostos fenólicos podem exercer uma ação moduladora em células, interagindo com um enorme leque de moléculas alvo, nomeadamente com a maquinaria da sinalização celular, como por exemplo a ativação de (Jeong & Jeong, 2010; Soobrattee et al., 2005): i) Proteína cinase C (PKC); ii) Proteína cinase serina/treonina (Akt/PKB); iii) Factor nuclear kappa B(NF-κB); iv) Reguladores enzimáticos de pro-inflamação (COX-2); v) Recetor do peroxissoma proliferador-ativado gama (PPARγ); vi) Regulação da homeostasia de cálcio. Soobratte e colaboradores (2005) também indicaram que os compostos fenólicos podem prevenir o stresse oxidativo induzindo a abertura dos poros da mitocôndria, diminuindo assim a produção de proteínas pro-apoptóticas (Bax e Bad). Algumas evidências destes fatos são descritas em imensos trabalhos na bibliográfica, a título de exemplo, sabe-se que a luteolina inibe a proliferação das células de glioblastoma, por aumento da expressão de proteínas pro-apoptóticas como a Bax e a Bad e diminui a expressão de proteínas anti-apoptóticas com a Bcl-2, induzindo ainda à inibição da divisão celular, contudo, em células normais, induz baixa citotoxicidade, o que indica que este composto pode ser utilizado com segurança (Tsai et al., 2013). Está também descrito que o ácido elágico interage com fatores de crescimento e promove a apoptose, tendo como alvos o NF-κB e a p53 (Aggarwal & Shishodia, 2006; Fjaeraa & Nånberg, 2009). A epicatequina influência a transcrição de fatores de regulação redox, e ativa proteínas de sobrevivência como a AKT/PKB e a PKC (Granado-Serrano et al., 2009). Segundo Fraga e Oteiza (2011) a equicatequina também consegue inibir o fator NF-κB, que é responsável pela regulação de inúmeras vias celulares em situações de stresse.
1.2.3.1. Caracterização química e biossíntese
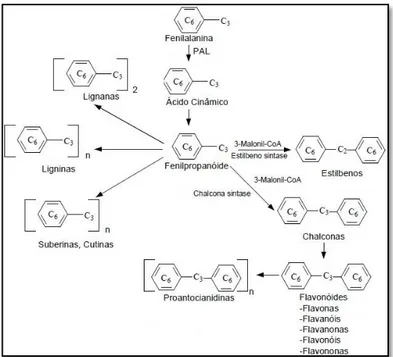
Os compostos fenólicos são caracterizados por possuírem um ou mais grupos hidroxilo ligados a um anel aromático (C6) (Michalak, 2006; Vermerris & Nicholson, 2006b). A sua
biossíntese (figura 1), de uma forma geral, tem início no ácido cinâmico, que é formado pela atuação da enzima fenilalanina amónia-lipase (PAL) sobre o aminoácido fenilalanina. O ácido cinâmico é subsequente hidrolisado pela enzima ácido cinâmico 4-hidroxilase, formando ácido
p-cumárico. A partir desde composto, cada classe de compostos fenólicos segue uma via
específica (Treutter, 2001; Vermerris & Nicholson, 2006a). A determinação das classes e subclasses de compostos fenólicos que a planta tem a sintetizar, envolve parâmetros genéticos, mas pode ser influenciada pela espécie, pela variedade, pelo stresse ambiental, pelos estádios de crescimento e maturação (Cruz, 2008).
1.2.3.2. Classificação
Os compostos fenólicos são divididos pela sua estrutura química, em duas classes, flavonóides e não-flavonóides. Os não-flavonóides não possuem uma estrutura básica, sendo um grupo muito heterogéneo, que segundo Burns e colaboradores (2001) é classificado da seguinte forma:
Os derivados da estrutura química C6-C1: específicos dos ácidos fenólicos (o ácido
benzoico, gálico, elágico), os estilbenos (as ligninas);
Os derivados da estrutura química C6-C3: específicos dos ácidos cafeicos e
p-cumárico;
Os derivados da estrutura química C6-C3-C6: específicos do resveratrol;
Figura 1 – Biossíntese geral dos compostos fenólicos nas plantas. (adaptado de Naczk & Shahidi, 2004)
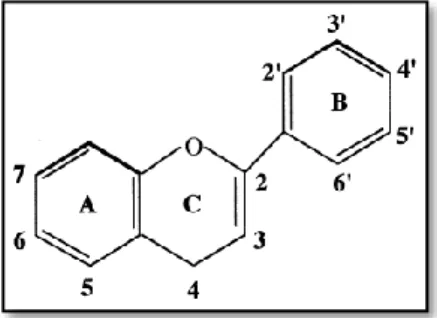
Os flavonóides são compostos com um baixo peso molecular, que possuem uma estrutura comum composta por dois anéis aromáticos (A e B) ligados por três carbonos e um átomo de oxigénio, formando um heterociclo oxigenado, denominado de núcleo flavano (C) (figura 2). O padrão de substituição do anel C (heterociclo) e o grau de oxidação determinam as classes
de flavonóides. Dentro destas o padrão de substituição dos anéis A e B indicam os compostos específicos (Cruz, 2008; Naczk & Shahidi, 2004).
Figura 2 – Núcleo de um flavano. (adaptado de Aherne & O’Brien, 2002)
As principais classes de flavonóides encontrados nos vegetais utilizados na alimentação são: flavonas; flavanóis, flavanonas, isoflavonas, chalconas, auronas e antocianinas (Aherne & O’Brien, 2002; Rhodes, 1996). A maioria destes compostos surge nas plantas sempre acompanhados por hidratos de carbono, sendo assim denominados de glico-flavonóides; no caso dos hidratos de carbono estarem ausentes são designados de agliconas (Aherne & O’Brien, 2002; Soobrattee et al., 2005). Segundo Cheynier (2005) estão descritos mais de 4000 flavonóides em plantas, estando o seu número em contínuo crescimento, devido ao elevado padrão de substituições possíveis dos substituintes primários (ex.: hidroxilos, metoxilos ou grupos glicosídeos) que poderão também ser eles próprios substituídos (ex.: glicosilados ou acilados) formando estruturas complexas (Aherne & O’Brien, 2002).
1.3. Caracterização das espécies utilizadas neste trabalho
1.3.1. Pterospartum tridentatum, Wilk
Nome comum: Carqueja; Espécie: Pterospartum tridentatum; Género: Pterospartum; Família: Fabaceae1; Ordem: Fabales; Classe: Magnoliopsida; Filo: Spermatophyta; Reino: Plantae; Domínio: Eucária
Figura 3 – Flores e folhas de carqueja. (adaptado de Flora.on, 2012)
1.3.1.1. Distribuição geográfica
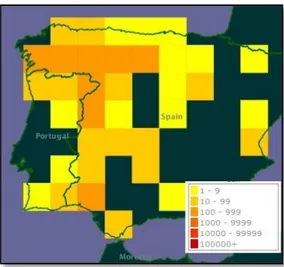
A carqueja, Pterospartum tridentatum Willk. (figura 3) (anteriormente designada por
Genista Tridentata, L.), é uma Fabaceae endémica da zona Noroeste da Península Ibérica
(figura 4), conhecida como erva carqueja, carqueija ou carqueja (Camejo-Rodrigues et al., 2003; Coelho et al., 2011; Ferreira et al., 2012; Grosso et al., 2007; Martins, 2011). É encontrada na flora ibérica bem como no norte africano sendo muito comum nas regiões montanhosas do norte e centro da península. Encontra-se num microclima temperado a frio que é característico dos vários maciços montanhosos destas regiões (Camejo-Rodrigues et al., 2003; Neves et al., 2008). É encontrada associada a espécies como Arbustus unedo, Pinus pinaster e florestas de Eucalyptus, em zonas montanhosas, terrenos agrícolas abandonados e matos com solos ácidos (Coelho et al., 2011; Ferreira et al., 2012).
Figura 4 – Distribuição de P. tridentatum na Península Ibérica. (adatado de GBIF, 2013)
1.3.1.2. Morfologia
É um arbusto de pequeno porte podendo atingir um 1 metro de altura e apresenta caule prostrado ou ereto. Este é alado lateralmente, formando assim falsas folhas duras, estreitas e recortadas de um tom verde-escuro. O que é considerado como folhas verdadeiras são 3 pequenas estípulas pontiagudas em forma de dentes localizadas em cada nó daí advém o seu epiteto específico tridentatum. As flores amarelas e com um aroma adocicado surgem em inflorescências de 3 a 10 flores na parte terminal dos caules. Apresentam brácteas para proteção da flor típico das inflorescências, uma pétala superior destacada, a estandarte, duas pétalas adjacentes chamadas de asas que rodeia as duas pétalas inferiores e quando fundidas formam a quilha. A sua floração vai de Março a Junho (Castroviejo, 1999; Grosso et al., 2007; Neves et
al., 2008; Ribeiro et al., 2000).
1.3.1.3. Composição química e bioquímica
Estudos fitoquímicos de extratos de P. tridentatum revelam a presença de compostos fenólicos, alcalóides e flavonóides que conferem a estes extratos propriedades farmacológicas e toxicológicas. Os compostos até então identificados em extratos aquosos são a prunetina, a genistina, o 7-metil-orobol, a sissotrina, a isoquercitrina e a rutina (Ferreira et al., 2012; Paulo
essenciais, apresentando como compostos maioritários o cis-teaspirano, o trans-teaspirano e o octen-3-ol (Grosso et al., 2007).
1.3.1.4. Aplicações
A carqueja é frequentemente citada em estudos devido à sua predominância na flora do interior de Portugal ou pelas suas inúmeras utilizações (Camejo-Rodrigues et al., 2003; Martins, 2011; Novais et al., 2004; Pedro, 2008). Esta leguminosa possuiu variadas aplicações, como por exemplo na alimentação e forragem para gado, como fertilizante, como combustível para fogões tradicionais, na alimentação humana e na medicina tradicional (Ferreira et al., 2012; Grosso et al., 2007; Martins, 2011). Na alimentação as parte áreas são utilizadas como condimento em arroz e carnes de caça (Camejo-Rodrigues et al., 2003; Ferreira et al., 2012; Grosso et al., 2007; Pedro, 2008). Na medicina tradicional (ou popular) a carqueja é das plantas mais utilizadas em Portugal, com uma vasta aplicação no corpo humano, na forma de infusão, cataplasma e sob a forma de xarope para as infeções respiratórias. A infusão das flores é utilizada para afeções febris, gástricas, intestinais, hepáticas, biliares, das vias urinárias e do aparelho respiratório (Camejo-Rodrigues et al., 2003; Coelho et al., 2011; Grosso et al., 2007; Martins, 2011). Também é utilizada para casos de hiperglicemia, hipercolesterolemia, hiperuricemia, hipertensão arterial e obstipação. É usado como digestivo, analgésico gástrico, anti-inflamatório intestinal, diurético, sedativo e protetor tanto hepático como biliar (Coelho et
al., 2011; Grosso et al., 2007; Novais et al., 2004; Pedro, 2008; Vitor et al., 2004). Pode ser
aplicado como anti-inflamatório em contusões ou problemas reumáticos (Grosso et al., 2007; Martins, 2011). Esta planta, em Portugal é muito utilizada na forma de infusão, sendo conhecida como “a cura para todos os males” (Ferreira et al., 2012; Neves et al., 2008). A infusão das raízes, também é utilizada externamente para problemas dermatológicos (Martins, 2011).
1.3.1.5. Estudos in vitro e in vivo da aplicação de extratos de P. tridentatum
Existem vários estudos da caracterização bioquímica dos extratos tanto aquosos como etanólicos da carqueja. Estes extratos são realizados a partir de várias partes da planta (folhas, flores ou raízes), caracterizados por cromatografia líquida de alta eficiência (HPLC) ou por cromatografia gasosa (GC) (Grosso et al., 2007) e avaliada a sua atividade antioxidante por diferentes métodos como a capacidade de eliminação do radical DPPH (2,2-difenil-1-picril-hidrazila) (Coelho et al., 2011) ou pelo método de Folin-Ciocalteu (Luís et al., 2009).
O stresse oxidativo associado à diabetes tipo 2 induz danos vasculares, pelo que Vítor e colaboradores (2004) procederam à caracterização da planta e à aplicação de extratos aquosos das partes aéreas de P. tridentatum em células do endotélio da veia umbilical humana a fim de observar os seus efeitos biológicos. Avaliaram a capacidade respiratória mitocondrial, pela medição da redução do MTT (brometo de 3-4,5-dimetil-tiazol-2-il-2,5-difeniltetrazólio). Chegaram assim, à conclusão que apenas um dos compostos maioritários, a isoquercitina, identificado por HPLC prevenia o efeito oxidativo com concentrações de 0,3 mg/mL de extrato aquoso. Não foram registados qualquer tipo de toxicidade nas células, dos compostos isolados ou do extrato aquoso de carqueja para concentrações superiores a 1mM ou 1 mg/mL, respetivamente (Vitor et al., 2004).
A hiperglicemia pós-prandial é uma disfunção presente nos indivíduos com diabetes tipo 2, onde existe um elevado aumento de glucose no sangue devido à diminuição da secreção de insulina nos primeiros 30 minutos após uma refeição ou ao aumento da resistência à insulina. Paulo e colaboradores (2008) aplicaram extratos das flores de P. tridentatum em ratos Wistar, de forma a observar eventuais variações na glicémia e a existência de possíveis compostos que possam substituir fármacos antidiabéticos orais. Os níveis de glucose foram avaliados pelo teste oral de tolerância à glucose (OGTT) e foi estudado em particular o efeito de dois compostos maioritários do extrato (isoquercetina e sissotrina) de forma isolada. Os resultados que obtiveram mostram que a isoquercetina apresenta uma atuação anti-hiperglicémica, pois a concentração de glucose no sangue diminuiu no período de 30 min após ingestão. Já pelo contrário a sissotrina mostrou ter o efeito contrário, chegando à conclusão que a aplicação do extrato no seu global, tanto pode ser anti-hiperglicémico como hiperglicémico. Referem assim, que embora o seu efeito antioxidante, os diabéticos necessitam ter precaução na ingestão do extrato, pois este pode mascarar ou aumentar os níveis de glucose no sangue após ingestão de alimentos (Paulo et al., 2008).
Mais recentemente, Ferreira e colaboradores (2012) realizaram um estudo toxicológico tanto em células de carcinoma hepático humano (HepG2) como em mitocôndrias isoladas de fígado de ratos (Wistar) onde aplicaram extratos aquosos de folhas e flores de carqueja. Foi feita a caracterização dos polifenóis dos extrato por LC-MS e foi determinado o seu conteúdo antioxidante. Nas células HepG2 foi avaliada a citotoxicidade pelo método do MTT; já com as preparações mitocondriais dos ratos foram realizados estudos na respiração e intumescimento (ou swelling) mitocondrial para a avaliação da potencial toxicidade dos compostos. Este estudo permitiu concluir que os extratos não apresentavam toxicidade para as células nas
concentrações de 125 e 375 mg/L, e não apresentavam qualquer tipo de interação com a respiração mitocondrial, apresentando-se assim inócuos para as mesmas (Ferreira et al., 2012). Apesar de existirem alguns estudos sobre a caracterização química dos extratos e de algumas aplicações in vivo e in vitro como foi referido, ainda existem muitos aspetos que deverão ser investigados, entre os quais a determinação dos mecanismos de atuação dos compostos ou do extrato no organismo, comprovando-se efetivamente se existe fundamento científico para todas as suas aplicações terapêuticas.
1.3.2. Geranium robertianum, L.
Nome comum: Erva de S. Roberto; Espécie: Geranium robertianum;
Género: Geranium; Família: Geraniaceae; Ordem: Geraniales; Classe: Magnoliopsida; Filo: Magnoliophyta; Reino: Plantae; Domínio: Eucária
Figura 5 - Flore e folha da erva de S. Roberto. (Flora.on, 2012)
1.3.2.1. Distribuição geográfica
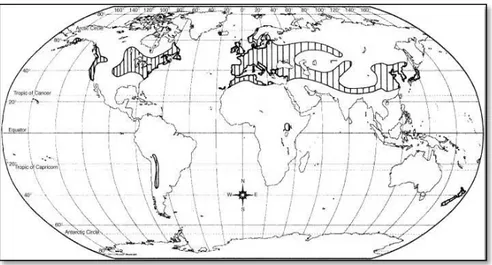
A erva de São Roberto, Geranium robertianum L. (figura 5) pertencente à família Geraniaceae é originária da Europa mas também se encontra distribuída pela Ásia (Japão e China), Estados Unidos da América (EUA), América do Sul (Chile) e Nova Zelândia (figura 6) (Tofts, 2004). É muito comum em Portugal sendo encontrada em locais variados, entre florestas húmidas e sombrias, associada a árvores como Acer pseudoplatanus, Juglans, Populus spp., matos, locais abertos ou muros, até uma altitude de 1800 m. É frequentemente encontrada em solos ricos em azoto (Lima, 2009; Neagu et al., 2010; Tofts, 2004).
Figura 6 – Distribuição mundial de G. robertianum. (adaptado de Tofts, 2004)
1.3.2.2. Morfologia
G. robertianum é uma planta herbácea anual ou bianual, apresenta um caule delgado e
ereto com 10 a 45 cm que se ramifica facilmente, de cor vermelha ou verde brilhante, com um indumento aveludado. Os pedúnculos alongados ramificam-se de dois ou em três pés que se vão ramificando por sua vez. As suas folhas são triangulares com 3 a 5 segmentos lobulados de cor verde clara e adquirem, no final do verão, um bordo avermelhado. As flores são constituídas por 5 pétalas ovais de cor vermelha violácea com uma zona mais escura no centro. A sua época de floração é entre Maio e Outubro. O seu sistema radicular é esbranquiçado, e muito frágil sendo facilmente retirada da terra (Lima, 2009; Ribeiro et al., 2000; Santos, 2010; Tomanová, 1981; Tofts, 2004; Volák et al., 1983).
Esta planta possui uma grande capacidade de adaptação de acordo com habitats com distintas composições, o tempo de exposição de luz solar, altitude, temperatura e nutrição (Lima, 2009). Estes factos justificam a sua variadíssima distribuição geográfica e localização. É conhecida por apresentar um odor forte e desagradável (Volák et al., 1983)
1.3.2.3. Composição química e bioquímica
A erva de S. Roberto não está completamente caracterizada mas é possível encontrar na literatura os principais compostos que a constituem. Sendo descrita pela ausência de alcalóides
(Rauter et al., 2009; Tofts, 2004). Outros estudos demonstram que as folhas possuem elevadas concentrações de cálcio, sódio, ferro, e vitamina C, além da existência de taninos, óleos voláteis, flavonóides, ésteres, polifenóis dos quais a quercitrina, canferol, ácido elágico, cafeico, ferúlico, gálico, málico e acético (Ivancheva & Petrova, 2000; Lima, 2009; Neagu et al., 2010; Rigano et al., 2009; Santos, 2010; Santos et al., 2011; Tofts, 2004).
1.3.2.4. Aplicações
Sabe-se que G. robertianum é utilizado como anti-inflamatório, antibacteriano, anticancerígeno, antiasmático, antialérgico, anti-hepatotóxico, anti-hemorrágico, diurético, imuno-modulador, anti hiperglicémico, (Ferreira et al., 2010; Neagu et al., 2010; Paun et al., 2012) Também existem registros da sua utilização em afeções febris, dores de costas, inflamações de garganta e tosse, hemorragias, dores reumáticas, gota e problemas de estômago entre outras (Lima, 2009).
1.3.2.5. Estudos in vitro e in vivo da aplicação de extratos de G. robertianum
A aplicação de extratos de G. robertianum ainda necessita de ser mais explorada, desde a sua caracterização bioquímica e, mais especificamente, a caracterização dos efeitos da aplicação in vivo e in vitro, de forma a comprovar a sua variadíssima aplicação popular.
Lima (2009) realizou um estudo com objetivo de determinar se o extrato de G.
robertianum poderia ser utilizado como terapêutica na doença de Alzheimer, através da ação
inibitória da acetilcolinesterase.
Demonstrou que o extrato apresentou atividade inibitória da acetilcolinesterase, além de apresentar uma elevada atividade antioxidante, tendo sido identificado como compostos maioritários a quercetina, o ácido gálico, o ácido sinápico glucosilado, ácido elágico e a cianidia. Este estudo permitiu verificar que o extrato não sofre qualquer tipo de metabolização no trato gastrointestinal. Pelo que o extrato aquoso de G. robertianum apresenta atividade biológica bastante passível de ser aplicada à terapêutica de Alzheimer, uma vez que o extrato é estável além de inibir a atividade da acetilcolinesterase, que é terapia mais usual para minimizar os efeitos perniciosos desta doença.
Num estudo realizado com ratos diabéticos Goto-Kakizaki (GK), um modelo animal de diabetes tipo 2, foram aplicados extratos de G. robertianum para avalização do seu efeito na glicémia. Foram realizadas medições de glucose através de um glucómetro e testes de tolerância à glucose (teste de tolerância intraperitonal à glucose). Também foram avaliados os índices
respiratórios mitocondriais, inferindo os seus efeitos em termos das alterações no metabolismo energético. Demonstraram que ocorria diminuição da glicemia ocasional nos ratos em comparação com o controlo (Ferreira et al., 2010). Segundo Ferreira e colaboradores (2010) o efeito do extrato só foi visível 60 minutos após a administração de glucose, pensando assim que haja um efeito dos compostos existentes no extrato. Relativamente à respiração mitocondrial houve um aumento da atividade dos complexos respiratórios, eventualmente devido à sobre-expressão dos complexos da cadeia respiratória, sendo apoiado por estudos anteriores na biogénese mitocondrial (Ferreira et al., 2010; Ferreira et al., 1999a; Ferreira et al., 2003; Ferreira et al., 1999b)
Recentemente, Radulovic e colaboradores (2012) realizaram uma avaliação da composição química e da atividade antimicrobiana dos compostos presentes nos óleos essenciais existentes em G. robertianum. Foram estudadas bactérias Gram positivas,como:
Staphylococcus aureus, Bacillus subtilis e Gram negativas, como: Eschericia coli, Klebsiella pneumoniae, e ainda fungos filamentosos Aspergillus restrictus e Penicillium chrysogenum. Os
resultados demostraram inibição da atividade microbiana por parte dos óleos testados na maioria das espécies estudadas, embora houvesse espécies como E. coli, K. pneumoniae e S.
enteritidis que se mostraram resistentes na gama de concentrações usadas. Pensa-se que esta
atividade antimicrobiana possa estar relacionada com a presença de compostos maioritários, como o linalol, o fitol, o óxido de cariofileno, o ácido hexadecanóico e a acetona de hexa-hidrofarnesil referidos como antimicrobianos (Radulovic et al., 2012).
1.4. Objetivos
O objetivo deste trabalho foi obter uma breve caracterização química dos extratos aquosos e hidro-etanólicos de carqueja (Pterospartum tridentatum Wilk.) e de erva de S. Roberto (Geranium robertianum L.).
Mais especificamente ao longo deste trabalho pretendeu-se:
Avaliar a sua atividade antioxidante e a concentração de compostos fenólicos;
Caracterizar estes extratos e respetivas frações obtidas por extração em fase sólida, no que diz respeito aos seus principais constituintes fenólicos usando a técnica de HPLC;
Quantificar os açúcares totais existentes nos extratos;
Também se pretendeu estudar o efeito da aplicação destes extratos nas linhas celulares HepG2 e Caco-2 (ensaios in vitro) para avaliar a sua potencial citotoxicidade e pesquisar a
presença de possíveis compostos bioativos moduladores de vias intracelulares (e.g. apoptose) que interfiram com a proliferação celular.
2. Material e métodos
2.1. Origem do material vegetal
A carqueja (Pterospartum tridentatum) foi colhida na primavera de 2012 na região do Pombal, Portugal. Após a colheita foi colocada a secar à sombra, em local muito arejado e com baixa humidade. A erva de S. Roberto (Geranium robertianum) foi adquirida à empresa ERVITAL (ERVITAL – Plantas Aromáticas e Medicinais, Lda; Mezio Castro Daire, Portugal), foi colhida na região de Castro Daire, Portugal em condições de produção biológica, secas em ambiente arejado.
2.2. Obtenção de extratos aquosos e hidro-etanólicos
2.2.1. Princípio teórico
Para poder realizar qualquer estudo que envolva análise de compostos, e os seus efeitos a nível biológico, é essencial proceder à obtenção dessas mesmas substâncias. O processo extrativo visa extrair substâncias existentes na composição das plantas, que é extremamente complexa, obtendo-se várias substâncias em simultâneo. Existem fatores que podem influenciar o processo de extração como seja o tipo de material vegetal, a forma como o solvente penetra no material, a escolha do solvente, entre outros (Barreto Júnior et al., 2005; Extratos Vegetais, 2010; Pereira, 2010). Atualmente a obtenção de extratos vegetais é possível por diversos métodos extrativos como a maceração, a infusão, a percolação, a digestão, a decocção, entre outros (Handa et al., 2008). Estes processos estão classificados conforme os fatores a cima referidos. Neste estudo o processo extrativo selecionado foi a decocção que segue os seguintes passos:
1. Trituração - seleção prévia do material vegetal a utilizar (folhas, caules, raízes ou flores) e a forma de como este se encontra, fresco ou seco. O objetivo deste passo é destruir o tecido vegetal para que os seus constituintes sejam expostos à extração do solvente, aumentando o rendimento do processo (Handa et al., 2008).
2. Extração - O princípio da extração é o contacto entre um ou mais solventes e o material vegetal, de forma a dissolver os compostos existentes no vegetal. Este processo tem como base um gradiente de concentração, onde a quantidade
de substâncias no material vegetal vai diminuindo, e a massa dos compostos em solução vai aumentando, até se atingir um equilíbrio (Handa et al., 2008). 3. Filtração - Após o processo de extração é necessário recorrer a uma filtração
de forma a separar os detritos e suspensões do material vegetal existentes na solução (Handa et al., 2008). Por norma recorre-se a um sistema de kitasato com bomba de vácuo para aumentar a velocidade de filtração.
4. Concentração - O extrato obtido é colocado num evaporador rotativo, onde é concentrado sobre efeito de vácuo e banho quente, por evaporação do solvente. 5. Liofilização- O extrato concentrado é colocado num liofilizador de forma a
obter um sólido livre do (s) solvente (s) utilizado (s) (Handa et al., 2008).
Figura 7 – Esquema representativo do procedimento geral.
Iniciou-se o processo de extração pela obtenção de extratos aquosos e hidro-etanólicos (extratos brutos) que depois foram fracionados. As amostras iniciais e as amostras obtidas após o fracionamento foram analisadas quanto aos tópicos referidos no esquema.
2.2.2. Procedimento
Os extratos das plantas foram preparados, a partir de 25 g de amostra vegetal seco, pré-triturada num moinho de café (tabela 1). No caso da carqueja usaram-se as flores e no da erva de S. Roberto usou-se a planta toda (caules, flores e folhas). As amostras trituradas foram deixadas em decocção, sob agitação magnética, até à ebulição e ai deixadas por 15 min em 1 L de solvente. Na extração aquosa apenas foi utilizado como solvente água ultra pura, para a extração hidro-etanólica 80 % (v/v) utilizou-se a água ultra pura e foi utilizado etanol comercial a 95 % (v/v), combinados para a percentagem pretendida. As decocções foram deixadas
arrefecer à temperatura ambiente até poderem ser manipuladas (aproximadamente 30 min) onde foram filtradas (filtros Whatman 4) por sistema de kitasato com vácuo. As soluções filtradas foram colocadas no evaporador rotativo (Rotary Evaporator RE 300), associado a uma bomba de ar (VWR Vacuum Gas Pump), e em banho-maria (Digital Water Bath Stuart RE 3000 DB) a 35 °C, até à obtenção de um volume aproximado de 30 mL. Os extratos hidro-etanólicos foram deixados evaporar, até aproximadamente ao mesmo volume, foi-lhes adicionado mais 100 mL de água ultrapura para que a solução final não possuísse etanol. O extrato obtido foi armazenado no congelador a 20 °C. Após congelamento, as amostras foram colocadas a liofilizar (Dura
DryTM µP) a uma temperatura de 41 °C e a uma pressão de 500 mTorr, por um período de 5
dias. No final foi determinado o peso seco de cada amostra e calculado o seu rendimento. Os extratos aquosos e hidro-etanólicos de ambas as espécies foram realizados em triplicado.
2.3. Extração em fase sólida (SPE)
2.3.1. Princípio teórico
A análise quer seja quantitativa quer qualitativa de um analito geralmente requer o isolamento do mesmo. O objetivo da extração em fase sólida (SPE) é facilitar e tornar o resultado final mais fidedigno, evitando assim outras interferências (Moors et al., 1994). A SPE baseia-se no mecanismo de interações entre a fase sólida (adsorvente) e o composto desejado. O processo tem como principio a separação de compostos de acordo com a sua polaridade, ou seja, depende das propriedades hidrofóbicas/hidrofílicas, polares e iónicas dos compostos que constituem a amostra a analisar. Consiste na passagem de uma solução liquida ou gasosa (polar) pelo adsorvente (apolar) onde o analito é seletivamente retido (López, 2003; Moors et al., 1994; Zwir-Ferenc & Biziuk, 2006). Neste tipo de procedimentos utilizam-se colunas comerciais onde a fase sólida é constituída por uma cadeia de alcano linear de 18 átomos de carbono (octadecílico de sílica) que se denomina genericamente coluna C18 (López, 2003). Esta coluna é utilizada para separar desde compostos apolares até moderadamente polares tais como: antibióticos, cafeina, corantes, óleos essenciais, pesticidas, fenóis, esteroides, vitaminas hidrossolúveis, entre outros (Sigma Aldrich, 1998).
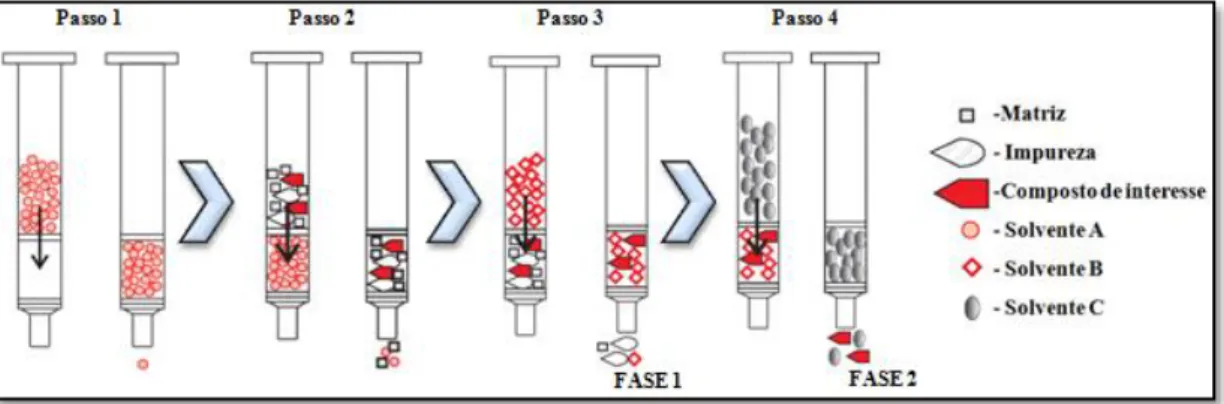
O procedimento de uma SPE geralmente consiste em 4 passos (figura 8):
6. Primeiro é adicionado um solvente que serve para ativação da coluna uma vez que no estado seco as cadeias do alcano estão “torcidas” e colapsadas devido à interações inter-cadeias da fase estacionária. Com o contacto de um solvente
orgânico estas cadeias são solvatadas, fazendo com que as cadeias distendam e fiquem disponíveis para a interação com os analitos. Isto garante que haja contacto entre o analito e a fase sólida. Geralmente a ativação é realizada um solvente orgânico. Após ativação a coluna é condicionada com as condições apropriadas que permitem a retenção da substancia desejada e a não retenção dos interferentes sempre que possível (George et al., 2005; Sigma Aldrich, 1998);
7. Realiza-se a passagem da amostra pela coluna utilizando vácuo ou uma força positiva. Para evitar a retenção de compostos não desejados e a formação de suspensões poderá ser necessário realizar um ajuste de pH ou uma centrifugação prévia (Sigma Aldrich, 1998; Moors et al., 1994);
8. Procede-se a uma lavagem para que quaisquer impurezas que possam ter ficado retidas na fase sólida sejam eliminadas (fração 1) (Sigma Aldrich, 1998);
9. De seguida é adicionado outro solvente, que é seletivo do (s) analito (s) que se pretende purificar. É novamente lavada a coluda de forma a assegurar que todos os compostos a extrair passaram através da mesma (fração 2) (Sigma Aldrich, 1998; Moors et al., 1994); No final é necessário limpar a coluna de forma a poder ser reutilizada.
Figura 8 – Esquema elucidativo do procedimento da extração em fase sólida.
Passo 1 – Passagem do solvente para ativação da coluna; Passo 2 – Passagem da amostra; Passo 3 – Lavagem da coluna; Passo 4 – Passagem do solvente para obtenção do analito (Sigma Aldrich, 1998).
Ao terminar o processo de extração em fase sólida, as frações recolhidas (1 e 2) são geralmente evaporadas em sistema de vácuo, para concentrar a amostra, e são colocados num liofilizador de formar a eliminar a presença de qualquer solvente nos extratos.
2.3.2. Procedimento
Foram diluídas 0,250 g de amostra liofilizada em 35 mL de água ultrapura (tabela 2), com agitação magnética. Foi realizado um ajuste do pH para 2 com adição de HCl 1 M (Crison
Micro pH 2000). Devido à presença de suspensões na solução foi realizada uma centrifugação
a 10. 000 rpm (Sigma 3-30K) durante 15 min a 6 °C. O sobrenadante foi transferido para um copo de precipitação e o sedimento foi armazenado no congelador a 20 ºC. Para a extração em fase sólida foi utilizado uma coluna de SPE pack C18 (Supelco SPE pack, Sigma-Aldrich). Foi necessário proceder à sua ativação com 10 mL de metanol PA e 20 mL água ultra pura. Com a coluna ativa foi feita a passagem da amostra seguido de 20 mL de água ultra pura que foram recuperados para um recipiente (fração aquosa ou fração 1). De seguida foi feita a passagem, de 20 mL de metanol e 5 mL de água ultra pura, pela coluna, que também foi recuperado para outro recipiente (fração metanólica ou fração 2). As soluções recuperadas foram colocadas no evaporador rotativo até ao volume mínimo e depois armazenadas a 20 °C e liofilizadas.
2.4. Identificação de compostos fenólicos por cromatografia líquida de alta eficiência em fase reversa (RP-HPLC)
2.4.1. Princípio teórico
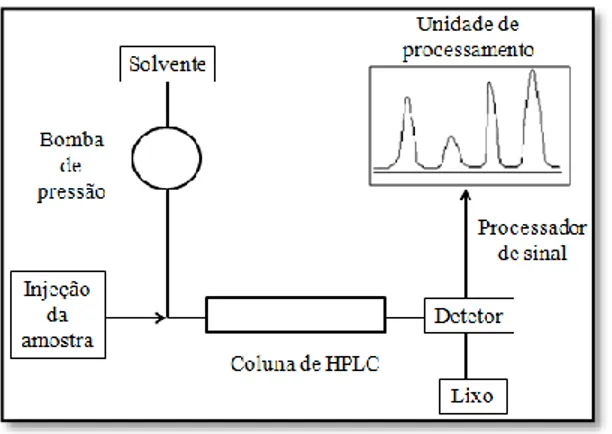
A cromatografia líquida de alta eficiência utiliza uma coluna de cromatografia altamente especializada, com o objetivo de separar compostos de uma mistura, com base na sua polaridade. Neste tipo de cromatografia um solvente é sujeito a altas pressões, tornando o processo mais rápido, além de permitir uma maior interação entre a fase estacionária e as moléculas que passam através da coluna, tornando a separação mais eficiente. O processo geral apresenta um reservatório para o solvente (fase móvel), uma bomba que cria a pressão desejada, um sistema de injeção das amostras na coluna, a coluna propriamente dita (fase estacionária) e um sistema de deteção acoplado a um processador de informação (figura 9). A cromatografia em fase reversa possui uma coluna de sílica modificada que a torna apolar, sendo então utilizado um solvente polar. Assim as moléculas polares vão ser arrastadas com o solvente, já as
moléculas apolares serão retidas durante mais tempo na coluna devido à criação de interações dipolo-dipolo, para além de pouca solubilidade no solvente (Clark, 2007; Possible, 1995).
Figura 9 – Representação esquemática do sistema de RP-HPLC. (adaptado de Clark, 2007)
Existem várias formas de detetar a passagem de uma substância pela coluna, sendo a mais utilizada a absorção ultravioleta (UV). Muitos dos compostos orgânicos absorvem luz na gama do UV a vários comprimentos de onda, sendo possível estabelecer uma relação da quantidade de luz que é absorvida com quantidade de composto existente na amostra (Clark, 2007; Possible, 1995).
2.4.2. Procedimento
Para a análise cromatográfica dos compostos fenólicos presentes nos extratos, quer nas iniciais quer nas amostras obtidos após SPE, foi realizada uma cromatografia líquida de alta eficiência em fase reversa (RP-HPLC) utilizando um sistema de fornecimento de solventes (Ultimate 3000) e um detetor de díodos (PD-100 UV-Vis). A separação foi realizada por um gradiente de eluente numa coluna C18 (ACE 5, com 5 µm de dimensão, 250 mm x 4,6 mm;
Advanced Chromatography Technologies, Scotland). As condições de análise foram as
seguintes:
Solvente A – mistura água/ ácido fórmico 95:5 (v/v).
Solvente B - metanol.
Foi realizado um gradiente linear, com um tempo total de 80 min, seguindo as seguintes fases: iniciou-se com 5 % do solvente B durante 2 min, aumentando para 80 % até aos 68 min, estabilizando durante 8 min (fase isocrática), diminuindo novamente para os 5 % por 2 min, e
por último mais 5 min de fase isocrática. Foi injetado um volume de 50 µl das amostras (1 mg/ml), com uma taxa de fluxo de 1,0 mL/min, e a coluna foi mantida a uma temperatura de 30 °C durante a corrida. O eluente foi constantemente monitorizado entre 240 a 600 nm, com uma detetor de foto díodo (PDA-100, Dionex).
2.4.3. Análise
Foram utilizadas 3 estratégias de identificação para a caracterização do perfil poli-fenólico das amostras:
10. Utilização de compostos de referência como padrões, onde a presença de um determinado composto fenólico foi avaliado comparando o tempo de retenção (RT) e o espectro UV-Vis.
11. Quando os compostos referência não se encontravam disponíveis, a confirmação foi realizada examinando o espectro UV-Vis e o tempo de retenção de dados existente na literatura.
12. Os maiores picos do cromatograma que não foram identificados por ambos os pontos anteriores foram classificados segundo os espectros UV-Vis.
2.5. Quantificação dos açúcares totais
2.5.1. Princípio teórico
O estudo da composição em açúcares entre os quais os monossacáridos, dissacarídeos e polissacarídeos, tem vindo a aumentar na comunidade científica em diversas áreas, especialmente na indústria alimentar, farmacêutica, entre outras (Boual et al., 2012; Zhang et
al., 2012). Alguns estudos demonstraram que alguns hidratos de carbono possuem propriedades
imuno-modeladoras e antioxidante (Corradini et al., 2012; Zhang et al., 2012). O processo mais aplicado para a quantificação de açúcares totais é a hidrólise ácida de forma a permitir libertar os monossacarídeos constituintes dos di-, oligo- e polissacarídeos, sendo normalmente realizada através de um ácido mineral forte como o ácido sulfúrico (72%) (Selvendran et al., 1979). Este método permite a hidrólise das ligações glicosídicas de forma a obter apenas unidades de monossacáridos (glucose, xilose, manose, galactose, arabinose, entre outros). Estes podem ser identificados por várias técnicas entre elas a cromatografia de troca aniónica (HPAEC) utilizando resinas de troca iónica. Este tipo de procedimento é utilizado para separar analitos que podem ser ionizados a valores elevados de pH, como no caso dos hidratos de