Análise da função miocárdica sistólica e
diastólica na cirrose hepática
Dissertação de candidatura ao grau de Doutor apresentada à
Faculdade de Medicina da Universidade do Porto
Regulamento da Faculdade de Medicina da Universidade do Porto Decreto-Lei n.º 19337 de 29 de Janeiro de 1931
Presidente: Reitor da Universidade do Porto
Vogais:
Doutor Fausto José da Conceição Alexandre Pinto
Professor Catedrático Convidado da Faculdade de Medicina da Universidade
de Lisboa
Doutora Ana Maria Gomes de Almeida
Professora Associada da Faculdade de Medicina da Universidade de Lisboa
Doutor Joaquim Adelino Correia Ferreira Leite Moreira
Professor Catedrático da Faculdade de Medicina da Universidade do Porto
Doutor Paulo Miguel Bettencourt Sardinha Pontes Fernando
Professor Catedrático Convidado da Faculdade de Medicina da Universidade
do Porto
Orientador da Tese
Doutor Luís Filipe Vilela Pereira de Macedo
Professor Associado Convidado da Faculdade de Medicina da Universidade
do Porto
Doutora Maria Júlia Pires Maciel Barbosa
Professores Catedráticos Efectivos
Doutor Manuel Alberto Coimbra Sobrinho Simões Doutora Maria Amélia Duarte Ferreira
Doutor José Agostinho Marques Lopes
Doutor Patrício Manuel Vieira Araújo Soares Silva Doutor Daniel Filipe Lima Moura
Doutor Alberto Manuel Barros da Silva Doutor José Manuel Lopes Teixeira Amarante Doutor José Henrique Dias Pinto de Barros
Doutora Maria Fátima Machado Henriques Carneiro Doutora Isabel Maria Amorim Pereira Ramos Doutora Deolinda Maria Valente Alves Lima Teixeira Doutora Maria Dulce Cordeiro Madeira
Doutor Altamiro Manuel Rodrigues Costa Pereira Doutor Rui Manuel Almeida Mota Cardoso Doutor António Carlos Freitas Ribeiro Saraiva Doutor José Carlos Neves da Cunha Areias Doutor Manuel Jesus Falcão Pestana Vasconcelos
Doutor João Francisco Montenegro Andrade Lima Bernardes Doutora Maria Leonor Martins Soares David
Doutor Rui Manuel Lopes Nunes
Doutor José Eduardo Torres Eckenroth Guimarães Doutor Francisco Fernando Rocha Gonçalves Doutor José Manuel Pereira Dias de Castro Lopes
Doutor António Albino Coelho Marques Abrantes Teixeira Doutor Joaquim Adelino Correia Ferreira Leite Moreira Doutora Raquel Ângela Silva Soares Lino
Doutor Abel Vitorino Trigo Cabral
Doutor Alexandre Alberto Guerra Sousa Pinto Doutor Álvaro Jerónimo Leal Machado de Aguiar Doutor Amândio Gomes Sampaio Tavares Doutor António Augusto Lopes Vaz
Doutor António Carvalho Almeida Coimbra Doutor António Fernandes da Fonseca
Doutor António Fernandes Oliveira Barbosa Ribeiro Braga Doutor António José Pacheco Palha
Doutor António Manuel Sampaio de Araújo Teixeira Doutor Belmiro dos Santos Patrício
Doutor Cândido Alves Hipólito Reis
Doutor Carlos Rodrigo Magalhães Ramalhão Doutor Cassiano Pena de Abreu e Lima Doutor Daniel Santos Pinto Serrão
Doutor Eduardo Jorge Cunha Rodrigues Pereira Doutor Fernando Tavarela Veloso
Doutor Francisco de Sousa Lé
Doutor Henrique José Ferreira Gonçalves Lecour de Menezes Doutor Jorge Manuel Mergulhão Castro Tavares
Doutor José Carvalho de Oliveira
Doutor José Fernando Barros Castro Correia Doutor José Luís Medina Vieira
Doutor José Manuel Costa Mesquita Guimarães Doutor Levi Eugénio Ribeiro Guerra
Doutor Luís Alberto Martins Gomes de Almeida Doutor Manuel António Caldeira Pais Clemente Doutor Manuel Augusto Cardoso de Oliveira Doutor Manuel Machado Rodrigues Gomes Doutor Manuel Maria Paula Barbosa
Doutor Maria da Conceição Fernandes Marques Magalhães Doutor Maria Isabel Amorim de Azevedo
Doutor Mário José Cerqueira Gomes Braga Doutor Serafim Correia Pinto Guimarães
Doutor Valdemar Miguel Botelho dos Santos Cardoso Doutor Walter Friedrich Alfred Osswald
publicações:
I. Sampaio F, Pimenta J, Bettencourt N, Fontes-Carvalho R, Silva AP, Valente J, Bettencourt
P, Fraga J, Gama V. Systolic and diastolic dysfunction in cirrhosis: a tissue-Doppler and
speckle tracking echocardiography study. Sampaio F, Pimenta J, Bettencourt N,
Fontes-Carvalho R, Silva AP, Valente J, Bettencourt P, Fraga J, Gama V. Liver Int. 2013;33:1158-65
II. Sampaio F, Pimenta J, Bettencourt N, Fontes-Carvalho R, Silva AP, Valente J, Bettencourt
P, Fraga J, Gama V. Left atrial function is impaired in cirrhosis: a speckle tracking
echocar-diographic study. Hepatol Int 2014; 8:146-53
III. Sampaio F, Lamata P, Bettencourt N, Alt SC, Ferreira N, Kowallick JT, Valente J, Kutty S,
Pimenta J, Fraga J, Bettencourt P, Gama V, Schuster A. Assessment of cardiovascular
physi-ology using magnetic resonance myocardial stress testing reveals impaired contractile
reserve in patients with cirrhotic cardiomyopathy [Submitted]
IV. Sampaio F, Pimenta J, Bettencourt N, Fontes-Carvalho R, Silva AP, Valente J, Bettencourt P,
Fraga J, Gama V. Systolic dysfunction and diastolic dysfunction do not influence
medium-term prognosis in patients with cirrhosis. Eur J Intern Med. 2014;25:241-6
A contribuição pessoal para a realização destes trabalhos foi a seguinte:
Contribuição importante na sua concepção, na recolha do material, obtenção e análise dos
dados e redacção dos manuscritos.
À minha Família
Aos meus Amigos
“At the outset do not be worried about this big question—Truth. It is a very simple matter if each
one of you starts with the desire to get as much as possible. No human being is constituted to know
the truth, the whole truth, and nothing but the truth; and even the best of men must be content with
fragments, with partial glimpses, never the full fruition. In this unsatisfied quest the attitude of mind,
the desire, the thirst—a thirst that from the soul must arise!—the fervent longing, are the be-all and
the end-all”.
Sir William Osler – The Students Life, 1905
Mesmo consciente da impossibilidade de vislumbrar mais do que fugazes lampejos da
verda-de, o desenvolvimento de um projecto de investigação clínica, capaz de se revestir da robustez
necessária à elaboração de uma tese de doutoramento a apresentar à Faculdade de Medicina
da Universidade do Porto, apresenta inúmeras dificuldades. Não posso deixar assim de
agrade-cer a todos os que generosamente contribuíram – alimentando a insatisfação, a sede e o desejo
durante a demanda – para o resultado final, na forma desta dissertação.
De entre todos, o meu reconhecimento especial:
Ao Professor Doutor Paulo Bettencourt, por me ter desafiado, no início, a inscrever-me na
primeira edição do Programa Doutoral de Ciências Cardiovasculares, e pela confiança que em
mim depositou ao aceitar ser o meu orientador. A sua inteligência e argúcia, a sua qualidade
como clínico e como investigador e a sua rectidão na forma de abordar ambas as actividades
são para mim um exemplo. Agradeço-lhe a disponibilidade e o auxílio na idealização e na
con-dução dos trabalhos, na avaliação crítica dos resultados e na revisão cuidada dos artigos e desta
dissertação.
na discussão dos resultados e na revisão dos manuscritos. O sucesso destes trabalhos
depen-deu, em boa parte, da sua capacidade de trabalho, dedicação e incentivo. A amizade que nos
une, há longos anos, sai pois ainda mais consolidada desta colaboração.
Ao Dr. Vasco Gama, director do Serviço de Cardiologia do Centro Hospitalar de Gaia/
Espinho, pela disponibilidade manifestada para a realização dos trabalhos naquele serviço, pelo
entusiasmo e pelo interesse sempre demonstrado sobre o seu andamento e resultados. A sua
energia, a constante busca pela inovação e pela melhoria e superação dos objectivos são a base
da excelência atingida pelo serviço que dirige, e um modelo a seguir. Sem a sua colaboração,
este projecto estaria votado ao insucesso.
Aos meus colegas nos serviços de Cardiologia, Gastroenterologia e Medicina Interna – em
particular ao Dr. Ricardo Fontes de Carvalho, Dr. Nuno Ferreira, Dra. Ana Paula Silva e Dr. João
Valente – que me auxiliaram no recrutamento dos doentes e na realização e análise dos
exa-mes efectuados nos vários trabalhos, bem como na revisão cuidada dos manuscritos.
Ao Professor Doutor Andreas Schuster, e a toda a sua equipa, pela análise das imagens de
ressonância magnética adquiridas e pela discussão minuciosa dos resultados. Sem a sua
colabo-ração desinteressada, a elabocolabo-ração deste trabalho não teria sido possível.
Aos enfermeiros da consulta externa de Cardiologia – Enf. José Dias e Enf. Isabel Gomes –
pela disponibilidade que sempre demonstraram na colheita de amostras para os vários estudos
desta tese. Devo-lhes uma palavra de gratidão e amizade.
Aos técnicos da Ressonância Magnética do serviço de Radiologia, pela colaboração na
aqui-sição das imagens para um dos estudos desta tese. O seu profissionalismo e qualidade foram
indispensáveis para o sucesso alcançado.
Manifesto também o meu reconhecimento aos doentes e controlos que aceitaram
partici-par neste projecto.
Ao Professor Doutor Carlos Ramalhão, pelo incentivo constante e sobretudo pela
genero-sidade e amizade incondicionais que aumentam, diariamente, a minha dívida de gratidão para
com ele.
À Joana, por partilhar a vida comigo, por não me ter deixado desistir, e por ser capaz de,
simultaneamente, co-orientar os trabalhos, manter uma actividade clínica e docente dedicada e
gerir uma família (nos dias de hoje numerosa), e ser exemplar em todas estas tarefas.
À Inês, ao João Francisco e à Rita, por serem a alegria dos meus dias e por me fazerem,
periodicamente, recordar aquilo que verdadeiramente conta.
Aos meus Pais, à minha irmã e restante família, pelos valores que me ensinaram e pela
for-mação que me proporcionaram.
ÍNDICE
I. INTRODUÇÃO ... 23
1.1. A cardiomiopatia cirrótica ... 25
1.1.1. A circulação na cirrose ... 25
1.1.2. Evidência experimental ... 26
1.1.3. Evidência clínica ... 29
1.1.3.1. Disfunção sistólica ... 29
1.1.3.2. Disfunção diastólica ... 29
1.1.3.3. Alterações electrofisiológicas ... 30
1.1.4. Definição de cardiomiopatia cirrótica ... 31
1.1.5. Importância clínica ... 31
1.2. Técnicas imagiológicas para avaliação da função miocárdica... 33
II. OBJECTIVOS ... 45
III. MÉTODOS ... 49
IV. PUBLICAÇÕES ... 55
4.1. Systolic and diastolic dysfunction in cirrhosis: a tissue-Doppler and speckle tracking
echocardiography study ... 57
4.2. Left atrial function is impaired in cirrhosis: a speckle tracking echocardiographic
study ... 65
4.3. Assessment of cardiovascular physiology using magnetic resonance myocardial
stress testing reveals impaired contractile reserve in patients with cirrhotic
cardiomyopathy. ... 73
4.4. Systolic dysfunction and diastolic dysfunction do not influence medium-term
prognosis in patients with cirrhosis ... 93
V. DISCUSSÃO ... 99
5.1. Disfunção sistólica ... 101
5.2. Disfunção diastólica ... 102
5.3. Prognóstico ... 104
VI. CONCLUSÕES ... 115
VII.RESUMO/ABSTRACT ... 119
1.1. A CARDIOMIOPATIA CIRRÓTICA
Durante décadas, o único elo de ligação reconhecido entre cirrose hepática e a presença
de disfunção cardiovascular foi o consumo excessivo de álcool. Sendo uma das etiologias mais
frequentes de cirrose hepática, o álcool é igualmente uma causa reconhecida de cardiomiopatia
caracterizada por dilatação das câmaras cardíacas e disfunção sistólica
[1]. O termo “doença
car-díaca alcoólica” terá sido utilizado pela primeira vez na literatura médica por William
Macken-zie em 1902
[2]. A sua etiopatogenia é complexa, envolvendo factores genéticos e ambientais,
estando o efeito tóxico directo do álcool nos miócitos amplamente documentado
[3-6]. A
pre-sença de uma circulação hiperdinâmica em doentes com cirrose hepática de etiologia alcoólica
foi descrita na década de 50 do século XX sendo igualmente atribuída, numa fase inicial, aos
efeitos do álcool na circulação periférica
[7, 8]. No entanto, desde a década de 80 do século XX,
vários trabalhos experimentais têm revelado a presença de várias alterações cardiovasculares
associadas à cirrose, sugerindo a existência de uma cardiomiopatia cirrótica, independente da
sua etiologia.
1.1.1. A circulação na cirrose
As alterações hemodinâmicas na cirrose parecem relacionar-se com o desenvolvimento de
hipertensão do sistema porta, resultante da instalação de fibrose e de nódulos de regeneração
no parênquima hepático e consequente aumento das resistências vasculares intrahepáticas.
Estas alterações foram também demonstradas em modelos animais de hipertensão portal
pré-sinusoidal, sugerindo a sua correlação primária com a hipertensão portal,
independente-mente da existência de doença do parênquima hepático e da sua etiologia
[9-11]. A hipertensão
portal associa-se a um aumento dos níveis circulantes de vários mediadores – como o óxido
nítrico, monóxido de carbono, endocanabinóides, adrenomedulina, factor de necrose tumoral
ou o peptídeo relacionado com o gene da calcitonina – com efeito vasodilatador, quer por
aumento da sua produção, quer por diminuição da sua degradação hepática
[12-16]. A
vasodilata-ção arteriolar esplâncnica resultante, com “pooling” de sangue na periferia, contribui para uma
“hipovolémia central” com activação secundária, via baroreceptores, de sistemas
vasoconstri-tores de regulação da pressão arterial como o sistema nervoso simpático, o sistema
renina-angiotensina-aldosterona, e a secreção de arginina-vasopressina. O aumento do débito e da
frequência cardíaca daí resultantes e que caracterizam a circulação hiperdinâmica da cirrose
constituem, assim, um mecanismo compensatório que permite manter um “volume arterial
efetivo” normal nas fases mais precoces da doença. No entanto, a activação destes sistemas
promove igualmente retenção renal de sódio e água, contribuindo para o desenvolvimento de
ascite e edema, assim como de disfunção renal por hipoperfusão secundária à vasoconstrição
arteriolar. De facto, nas fases mais avançadas da doença, a incapacidade de aumentar o débito
cardíaco poderá ser um mecanismo importante no desenvolvimento de síndrome
hepatorre-nal, que se associa normalmente a mau prognóstico
[17, 18].
1.1.2. Evidência experimental
No entanto a disfunção cardiovascular na cirrose não parece limitar-se à circulação
perifé-rica e vários estudos experimentais, em modelos de cirrose, documentaram diferentes
altera-ções estruturais e funcionais no cardiomiócito, resultando em disfunção contráctil. Múltiplos
mecanismos fisiopatológicos estão envolvidos.
A disfunção dos receptores adrenérgicos beta parece ser um achado universal na
cardio-patia cirrótica e explica parcialmente a incompetência cronotrópica e inotrópica descrita na
cirrose
[10]. Diversos mecanismos contribuem, por sua vez, para esta disfunção. A constante
esti-mulação do sistema nervoso simpático envolvida na fisiopatologia da circulação hiperdinâmica,
levam à diminuição da densidade e dessensibilização destes receptores
[19, 20]. Por outro lado, os
mecanismos de sinalização intracelular, envolvidos na transdução do sinal após a activação dos
receptores adrenérgicos beta, e que regulam os movimentos do cálcio intracelular através da
cascata adenilcíclase – AMP cíclico – proteína cínase A podem estar igualmente
comprometi-dos na cirrose. Alterações na expressão genética comprometi-dos reguladores desta cascata, com aumento
da expressão de proteínas G inibitórias e de outros mediadores que resultam na inibição da
adenilcíclase e na degradação acelerada do AMP cíclico foram documentadas e envolvidas na
patofisiologia da cardiomiopatia cirrótica
[21, 22]. Finalmente, foram ainda descritas alterações das
características físicas da membrana celular dos cardiomiócitos, com aumento do conteúdo de
colesterol e da razão colesterol/fosfolípidos membranares, resultando em diminuição da
flui-dez da membrana. Esta alteração afecta a função de todos os receptores transmembranares,
incluindo os receptores adrenérgicos beta, inibindo o seu acoplamento com as proteínas Gs e
deteriorando ainda mais a função do já reduzido número de receptores membranares
[23, 24]. A
redução da produção de AMP cíclico em resposta à estimulação adrenérgica e a sua correlação
com a fluidez da membrana foram demonstradas em modelos animais de cirrose e explicam a
hiporeactividade às catecolaminas observada na cirrose
[23, 25].
Tendo em conta o efeito cronotrópico, inotrópico e lusitrópico positivo da estimulação
adrenérgica nos cardiomiócitos, as alterações dos bloqueadores beta encontradas em modelos
de cirrose desempenham, provavelmente, um papel importante na disfunção sistólica e
diastó-lica descrita nos doentes cirróticos.
Para além da disfunção dos receptores adrenérgicos beta, as alterações das características
da membrana celular podem contribuir para as alterações nos diferentes canais iónicos
encon-tradas em vários estudos. A diminuição na densidade de canais de cálcio tipo L foi descrita num
modelo animal de cirrose
[11, 26],resultando na redução da disponibilidade de cálcio intracelular e
em menor contractilidade cardíaca. Foram igualmente documentadas alterações dos diferentes
tipos de canais de potássio, com diminuição da sua condutância e da densidade das correntes
de potássio em miócitos de ratos, resultando numa maior duração do potencial de acção
[27].
Esta observação pode justificar o prolongamento do intervalo QT descrito em doentes com
cirrose.
Por outro lado, foram encontradas alterações ultraestruturais das proteínas contrácteis
e da matriz extracelular. O aumento da expressão da isoforma beta das cadeias pesadas de
miosina, alterações na modulação da titina (uma proteína do citosqueleto que é a principal
determinante da tensão passiva do cardiomiócito) e um aumento do colagénio tipo I na matriz
extracelular (relativamente à forma mais complacente de colagénio tipo III) podem
desempe-nhar um papel importante na disfunção sistólica e diastólica na cirrose
[28, 29].
Uma segunda vertente da fisiopatologia da cardiomiopatia cirrótica relaciona-se com o
efei-to cardiodepressor de diferentes substâncias, que se acumulam como resultado da insuficiência
hepática e do desenvolvimento de shunts porto-sistémicos.
O sistema dos canabinoides tem uma expressão muito reduzida em indivíduos normais. Este
sistema de sinalização celular é activado pela ligação de canabinoides endógenos ou exógenos
a receptores próprios (CB1 e CB2) expressos em múltiplos tecidos – miócitos, células
endote-liais, células musculares lisas e células do sistema imune
[30]. Na cirrose, há evidência de
aumen-to de produção de endocanabinóides endógenos nomeadamente anandamida que, actuando
através da ligação a receptores CB1, exercem um efeito vasodilatador e inotrópico negativo
via activação de uma proteina G inibitória e diminuição da produção de AMP cíclico
[31]. Este
mecanismo agrava assim a diminuição da resposta contráctil dos miócitos após estimulaçao
adrenérgica e a sua inibição através de antagonistas específicos dos receptores CB-1 parece
reverter este efeito
[32]. O excesso de endocanabinoides promove ainda a apoptose dos
hepa-tócitos favorecendo o agravamento da hipertensão portal e da circulação hiperdinâmica
[33, 34].
O óxido nítrico desempenha um papel importante na fisiopatologia da cardiomiopatia
cir-rótica. O aumento da expressão da forma indutível da síntase do óxido nítrico (iNOS),
pos-sivelmente relacionada com níveis aumentados de citocinas pró-inflamatórias como o factor
de necrose tumoral a (TNF-a) e a interleucina 1b está demonstrado em modelos animais de
cirrose
[35, 36]. Para além dos efeitos na circulação periférica referidos previamente, esta forma
de óxido nítrico exerce um efeito inotrópico negativo no cardiomiócito através da estimulação
do sistema guanilcíclase – GMP cíclico – proteína cinase G que resulta numa diminuição da
entrada de cálcio pela inibição quer dos canais de cálcio tipo L quer dos receptores
rianodí-nicos do retículo sarcoplasmático
[26, 37]. A indução da apoptose é outro dos mecanismos pelo
qual este mediador exerce o seu efeito cardiotóxico
[38]. Tal como no sistema dos canabinoides,
também com a inibição deste sistema por antagonistas do óxido nítrico se observou uma
re-versão da disfunção cardíaca
[39, 40].
Os mesmos mecanismos fisiopatológicos são partilhados pelo monóxido de carbono, cuja
produção está igualmente aumentada na cirrose como consequência da estimulação do
siste-ma nervoso simpático e da acumulação de citocinas pró-inflasiste-matórias. De igual modo, a
inibi-ção deste sistema associa-se a melhoria da contractilidade do músculo cardíaco
[41].
Mais recentemente, foi sugerido o papel da activação do factor nuclear kB (NF-kB), um
fac-tor de transcrição que regula várias respostas celulares, na disfunção cardiovascular da cirrose.
Num modelo animal de cirrose, foram encontrados níveis aumentados de NF-kB e TNF-a, e
a inibição daquele factor resultou numa redução significativa dos níveis de TNF-a e numa
me-lhoria da contractilidade
[42]. Estes dados sugerem que os níveis de TNF-a estão dependentes
da activação deste factor de transcrição e reforçam a importância da expressão das citocinas
na fisiopatologia da cardiomiopatia cirrótica.
Para além do seu papel na contractilidade, o papel de citocinas como o TGF-b na indução de
fibrose e apoptose está bem documentado; níveis aumentados deste mediador foram
encon-trados na cirrose e podem igualmente contribuir para a disfunção contráctil
[43, 44].
1.1.3. Evidência clínica
1.1.3.1. Disfunção sistólica
A utilização de testes não invasivos de imagiologia cardíaca tem permitido evidenciar
ano-malias cardíacas morfológicas e funcionais em doentes com cirrose. No entanto, embora se
tenha observado um aumento do volume das câmaras esquerdas em alguns estudos, as
altera-ções das dimensões cardíacas e da massa ventricular, em repouso, parecem ser modestas
[45-47].
Do mesmo modo, índices de função sistólica como a fracção de ejecção são frequentemente
normais em condições de repouso, em consequência da diminuição da pós-carga característica
da circulação na cirrose
[48-50]. A disfunção sistólica nestes doentes poderá no entanto ser
reve-lada em situações de stress. Vários autores demonstraram que doentes com cirrose exibem
uma variação anormal do débito cardíaco, frequência cardíaca e da fracção de ejecção do
ven-trículo esquerdo e aumentos das pressões de enchimento ventriculares em resposta ao
exer-cício físico
[51-54]. A incompetência inotrópica e cronotrópica parece ser assim um dos achados
clínicos mais consistentes da cardiomiopatia cirrótica. Respostas semelhantes foram
encontra-das em resposta a stress farmacológico com vasoconstritores
[55, 56]ou alterações posturais
[57].
No entanto o papel dos testes de sobrecarga com dobutamina, frequentemente utilizados na
avaliação de reserva contráctil
[58], no diagnóstico da cardiomiopatia cirrótica é controverso,
com resultados díspares em diferentes estudos
[59, 60].
Mais recentemente, a utilização de técnicas ecocardiográficas modernas permitiu a
detec-ção de alterações da fundetec-ção sistólica ventricular também em condições de repouso
[61].
1.1.3.2. Disfunção diastólica
As alterações previamente descritas nas proteínas contrácteis e na matriz extracelular,
as-sim como os achados de hipertrofia ventricular, fibrose e edema subendocárdico relatados,
desde há várias décadas, em diferentes séries de autópsias de doentes com cirrose de várias
etiologias
[62, 63], fornecem a base patofisiológica da disfunção diastólica na cirrose.
A presença de fibrose intramiocárdica foi igualmente documentada em doentes com
cirro-se, utilizando ressonância magnética cardíaca
[64].
A ecocardiografia tem sido, no entanto, a técnica mais utilizada para a avaliação clínica da
função diastólica na cirrose. Durante muitos anos, esta análise baseou-se na avaliação, por
Doppler pulsado, do fluxo de sangue através da válvula mitral durante a diástole
[65]. Usando
este método, vários autores encontraram sinais de disfunção diastólica em cerca de 50% dos
doentes com cirrose
[66]. Pozzi et al descreveram um aumento da velocidade da onda A, inversão
da relação E/A e prolongamento do tempo de desaceleração da onda E – sugerindo atraso do
relaxamento ventricular – em doentes com cirrose e ascite de grande volume,
comparativa-mente com um grupo controlo; após paracentese evacuadora, os autores observaram
melho-ria parcial destes índices de enchimento ventricular
[67]. Achados semelhantes foram relatados
por Wong et al
[68], sugerindo que a presença de disfunção diastólica se possa relacionar com
a gravidade da doença hepática e com a presença de ascite. Contrariamente, Finucci et al não
encontraram relação entre o tempo de desaceleração da onda E e a presença de ascite
[69]. A
dilatação da aurícula esquerda – um reconhecido marcador de cronicidade de disfunção
dias-tólica
[70, 71]– foi igualmente encontrada nestes estudos. Do mesmo modo, níveis aumentados
de peptídeo natriurético tipo A (ANP) – produzido nas aurículas em resposta ao estiramento
das fibras auriculares
[72]– foram descritos em doentes com cirrose, podendo também traduzir
disfunção diastólica.
No entanto, a análise ecocardiográfica da função diastólica baseada no fluxo mitral
apre-senta várias limitações
[73-77]. Em particular, alterações na pré-carga e na frequência cardíaca,
podem influenciar significativamente o padrão do fluxo através da válvula mitral, mesmo em
indivíduos normais
[78, 79]. Este aspecto pode ser particularmente relevante nos doentes com
cir-rose hepática, atendendo às alterações hemodinâmicas associadas a esta doença. A associação
da dilatação auricular esquerda e dos níveis de ANP com a volémia demonstrada em doentes
com cirrose parece apoiar esta hipótese
[46]. Atendendo a estas questões, foram elaboradas
recomendações mais recentes para avaliação da função diastólica, nas quais as novas técnicas
ecocardiográficas, como o Doppler tecidular, assumem um papel preponderante na avaliação
funcional da diástole; os parâmetros derivados do fluxo são usados em segunda linha como
complemento dos primeiros
[80].
1.1.3.3. Alterações electrofisiológicas
A presença de prolongamento do intervalo QT parece ser um achado frequente em
do-entes com cirrose independentemente da sua etiologia, tendo sido descrito em até 50% dos
casos
[81, 82]. O grau de prolongamento relaciona-se com a gravidade da doença hepática embora
esta alteração tenha sido encontrada mesmo em estádios mais precoces
[83]. O prolongamento
do intervalo QT parece associar-se a alterações no acoplamento electromecânico, i.e, na
rela-ção temporal entre a sístole elétrica e a sístole mecânica
[84].
1.1.4. Definição de cardiomiopatia cirrótica
Baseando-se na evidência disponível até então, um grupo de trabalho reunido no Congresso
Mundial de Gastroenterologia de 2005 elaborou uma proposta de definição de cardiomiopatia
cirrótica, descrevendo-a como uma disfunção cardíaca crónica caracterizada por atenuação da
resposta contráctil ao stress e/ou anomalia do relaxamento ventricular e por alterações
elec-trofisiológicas, na ausência de outra doença cardíaca
[85]. Os critérios de diagnóstico propostos
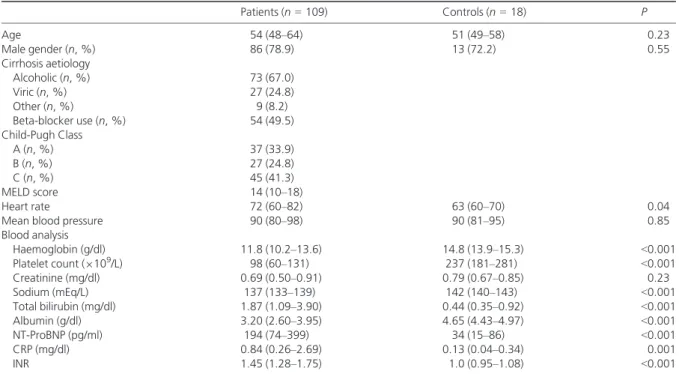
por este grupo são apresentados na tabela 1.
Critérios de diagnóstico Disfunção Sistólica
Resposta anormal do débito cardíaco após exercício ou estimulação farmacológica Fracção de ejecção em repouso ≤55%
Disfunção Diastólica
Relação E/A <1 (corrigida para a idade) Tempo de desaceleração da onda E > 200 mseg Tempo de relaxamento isovolumétrico > 80 mseg Critérios de suporte
Alterações electrofisiológicas Resposta cronotrópica diminuída Dilatação da aurícula esquerda Hipertrofia ventricular esquerda
Níveis de peptídeos natriuréticos aumentados Níveis de troponina aumentados
1.1.5. Importância clínica
O impacto clínico da cardiomiopatia cirrótica não é claro. A vasodilatação periférica
carac-terística da circulação na cirrose resulta numa diminuição da pós-carga imposta ao ventrículo
esquerdo que pode mascarar a disfunção contráctil. Assim, a cardiomiopatia cirrótica parece
ser bem tolerada e não causar sintomas durante longos períodos.
No entanto, a descrição de casos de insuficiência cardíaca após transplante hepático ou
implantação de shunt porto-sistémico (TIPS), em doentes sem história prévia de doença
car-diovascular
[86, 87], sugeriram a potencial relevância clínica desta entidade e desencadearam um
interesse crescente pelo seu estudo. A presença de disfunção diastólica foi implicada na
pato-fisiologia desta complicação. A implantação do shunt porto-sistémico leva a um aumento do
retorno venoso na circulação central
[88]. O aumento da pressão arterial pulmonar, da pressão
de encravamento pulmonar bem como das dimensões da aurícula esquerda e da massa
ven-tricular observados nos doentes submetidos a esse procedimento sugerem uma incapacidade
do coração em acomodar um aumento súbito da pré-carga
[89, 90]. Para além disso, a presença de
disfunção diastólica, avaliada pela relação E/A, associou-se a aumento de mortalidade e menor
mobilização da ascite após inserção de TIPS
[91, 92].
Por outro lado, foi também sugerida a associação entre disfunção sistólica, particularmente
a resposta atenuada ao stress, e o prognóstico destes doentes. Ruiz-del-Arbol et al
demonstra-ram que um débito cardíaco mais baixo se associava a risco aumentado de desenvolvimento de
insuficiência renal em doentes com peritonite bacteriana espontânea
[93]. Mais tarde, o mesmo
grupo reportou a associação entre um débito cardíaco inferior a 6 L/min e desenvolvimento
de síndrome hepatorenal, em doentes internados por ascite de grande volume
[94]. Na mesma
linha, Krag et al encontraram uma associação entre débito cardíaco baixo, risco de
desenvol-vimento de síndrome hepatorenal e mortalidade, em doentes com cirrose descompensada
[95].
Estes trabalhos lançaram a hipótese da existência de um efeito causal entre disfunção sistólica
e disfunção renal em doentes com cirrose descompensada, em que a incapacidade de aumentar
o débito cardíaco na presença de vasodilatação se associa a um risco aumentado de
compli-cações
[96].
Mais recentemente Ruiz-del-Arbol et al relataram igualmente uma associação entre
disfun-ção diastólica, evoludisfun-ção para síndrome hepatorenal e mortalidade
[97]; no entanto, em contraste
com os seus achados prévios, o débito cardíaco não foi preditor do risco de insuficiência renal
pelo que os mecanismos patofisiológicos envolvidos na associação entre disfunção diastólica e
disfunção renal não são claros.
Por fim, trabalhos de outros autores não conseguiram estabelecer uma associação entre
disfunção cardíaca – avaliada por técnicas ecocardiográficas modernas – e prognóstico em
do-entes com cirrose, contribuindo para a incerteza quanto ao impacto clínico da cardiomiopatia
cirrótica
[98, 99].
Em resumo, nas últimas décadas foi acumulada evidência científica abundante,
provenien-te quer de modelos experimentais, quer de estudos clínicos, da existência de alprovenien-terações da
contractilidade e do relaxamento cardíacos na cirrose hepática. No entanto, a patofisiologia
desta disfunção cardiovascular é complexa e multifactorial, envolvendo alterações estruturais
e funcionais, a nível central e periférico. Por outro lado, a sua definição é vaga e não existem
critérios de diagnóstico bem definidos e universalmente aceites, pelo que a prevalência exacta
desta patologia não pode ser determinada. Finalmente, o seu impacto prognóstico,
nomeada-mente a sua contribuição para a mortalidade foi sugerido em alguns estudos, mas os
mecanis-mos envolvidos nesta associação não são claros.
1.2. TÉCNICAS IMAGIOLÓGICAS PARA AVALIAÇÃO DA FUNÇÃO
MIOCÁRDICA
Nos últimos anos, múltiplas técnicas imagiológicas foram desenvolvidas e aplicadas na
ava-liação morfológica e funcional do coração.
A ecocardiografia, sendo a mais antiga
[100], continua também a ser, por questões de
acessibili-dade, portabiliacessibili-dade, segurança e custo, a modalidade de imagem mais utilizada
[101-104]. A avaliação
das dimensões das câmaras, e da massa e função ventriculares são das indicações mais
frequen-tes para a requisição de um ecocardiograma
[105]. De acordo com as recomendações actuais, a
ecocardiografia é o método de imagem de primeira linha na avaliação de doentes com suspeita
de insuficiência cardíaca, fornecendo informação estrutural (anatomia, volumes e massa) e
fun-cional (incluindo a análise da função diastólica)
[106]. No entanto várias limitações dos diferentes
parâmetros ecocardiográficos devem ser tidas em conta aquando da sua utilização. Por
exem-plo, a fracção de ejecção, apesar de ser a medida mais generalizada de função sistólica global e
ter, comprovadamente, importância prognóstica, não é um índice de contractilidade e depende
fortemente da pré- e pós-carga, da frequência cardíaca e da função valvular
[106]. O mesmo se
aplica aos índices classicamente utilizados para avaliação da função diastólica
[78, 107, 108]. Novos
métodos ecocardiográficos entretanto desenvolvidos poderão permitir ultrapassar algumas
destas limitações, permitindo uma análise quantitativa da deformação miocárdica (uma medida
indirecta do encurtamento e distensão dos miócitos durante o ciclo cardíaco). Estas novas
técnicas baseiam-se na determinação das velocidades relativas de diferentes pontos do
mio-cárdio aplicando o princípio Doppler ao movimento do músculo cardíaco (Doppler tecidular)
ou no cálculo da distância inicial e final entre vários pontos na imagem bidimensional através
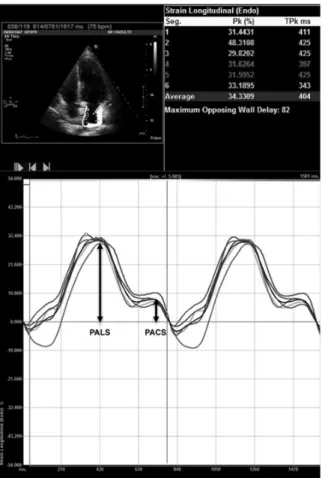
do seu seguimento ao longo do ciclo cardíaco (“speckle tracking”). A medida de deformação
miocárdica define-se como strain e é expressa em percentagem. A velocidade a que a
defor-mação miocárdica se dá, ou seja, a variação do strain num período de tempo é definida como
strain rate e é expressa em 1/segundo
[109, 110]. Não sendo medidas totalmente independentes
das condições de carga
[111-114],strain/strain rate são sobretudo determinados pela
contractilida-de intrínseca dos miócitos e correlacionam-se bem com índices invasivos contractilida-de contractilidacontractilida-de
[115, 116]. A sua utilidade clínica tem sido demonstrada em diversos contextos – desde o diagnóstico
de doença subclínica (onde a sua maior sensibilidade permite detectar alterações da função
miocárdica em estadios precoces), à melhoria da acuidade diagnóstica na doença coronária e
à monitorização terapêutica
[117-122]. Foi igualmente documentado o seu potencial na avaliação
do prognóstico
[123-126].
Também na análise da função diastólica, os novos métodos ecocardiográficos,
particular-mente a análise das velocidades do miocárdio por Doppler tecidular, assumiram uma
impor-tância crescente. A velocidade de deslocamento do anel mitral no início da diástole (E’) é um
parâmetro mais sensível de relaxamento que as variáveis do fluxo mitral, correlacionando-se
bem com a constante Tau de relaxamento medida invasivamente
[127-130].Mais importante ainda
é a boa correlação da razão entre a velocidade da onda E mitral por Doppler pulsado (E) e
a velocidade da onda E’ com as pressões de enchimento do ventrículo esquerdo
[130, 131]. Esta
observação resulta do facto da velocidade E’ ser um indicador da quantidade do volume de
sangue que entra no ventrículo esquerdo durante a fase de enchimento rápido enquanto que a
velocidade da onda E representa o gradiente de pressão necessário para que essa quantidade
de sangue entre no ventrículo esquerdo. Assim, a razão E/E’ reflecte a quantidade de sangue
que entra no ventrículo esquerdo para um dado gradiente de pressão; uma razão E/E’ elevada
representa uma pequena mudança de volume para um gradiente aurícula esquerda/ventrículo
esquerdo elevado, e é um marcador de disfunção diastólica. Visto de outra forma, a velocidade
da onda E depende do relaxamento, do gradiente de pressão AE/VE e da idade enquanto que
a velocidade E’ depende sobretudo do relaxamento e da idade; deste modo, a razão entre as
duas permite eliminar o efeito do relaxamento e da idade traduzindo apenas o gradiente de
pressão entre as duas câmaras e a pressão de enchimento do ventrículo esquerdo
[132].
Atenden-do a estes achaAtenden-dos, a medição das velocidades diastólicas Atenden-do anel mitral por Doppler tecidular
e a determinação da razão E/E’ são, de acordo com as recomendações actuais, mandatórias na
avaliação ecocardiográfica da função diastólica
[80].
A ressonância magnética cardíaca (RMC) tem, nos últimos anos, adquirido crescente
impor-tância na avaliação do sistema cardiovascular
[133]. A sua excelente resolução espacial
permite-lhe definir, com exactidão, os bordos endocárdico e epicárdico, sem dependência de qualquer
“janela acústica”. Deste modo, a RMC é considerada o método “gold-standard” na avaliação
dos volumes cardíacos e da fracção de ejecção
[133, 134]. Esta técnica permite igualmente avaliar
os vários componentes da deformação miocárdica utilizando diferentes técnicas
[135-138].
Final-mente, a capacidade de caracterização tecidular da RMC, permite a quantificação de áreas de
edema ou fibrose, com identificação precisa de lesão miocárdica (mesmo subclínica) assim
como de miocárdio viável, sendo igualmente o actual “gold-standard” para a definição de
via-bilidade
[139-141].
Algumas destas novas modalidades de imagem foram já utilizadas na avaliação de doentes
com cirrose
[61, 64]. No entanto, dado o pequeno número de estudos e doentes envolvidos, a sua
utilidade na detecção de alterações morfológicas e funcionais neste contexto é ainda incerta e
o seu potencial papel no diagnóstico da cardiomiopatia cirrótica não está estabelecido.
Referências
[1] Elliott P, Andersson B, Arbustini E, Bilinska Z, Cecchi F, Charron P, et al. Classification of the cardiomyo-pathies: a position statement from the European Society Of Cardiology Working Group on Myocardial and Pericardial Diseases. Eur Heart J. 2008;29:270-6.
[2] Mackenzie. The study of the pulse, arterial, venous, and hepatic, and of the movements of the heart. Am J Med Sci. 1902;124:325.
[3] Haunstetter A, Izumo S. Apoptosis: basic mechanisms and implications for cardiovascular disease. Circ Res. 1998;82:1111-29.
[4] Capasso JM, Li P, Guideri G, Malhotra A, Cortese R, Anversa P. Myocardial mechanical, biochemical, and structural alterations induced by chronic ethanol ingestion in rats. Circ Res. 1992;71:346-56.
[5] Beckemeier ME, Bora PS. Fatty acid ethyl esters: potentially toxic products of myocardial ethanol me-tabolism. J Mol Cell Cardiol. 1998;30:2487-94.
[6] Delbridge LM, Connell PJ, Harris PJ, Morgan TO. Ethanol effects on cardiomyocyte contractility. Clin Sci (Lond). 2000;98:401-7.
[7] Shorr E, Zweifach BW, Furchgott RF, Baez S. Hepatorenal factors in circulatory homeostasis. IV. Tissue origins of the vasotropic principles, VEM and VDM, which appear during evolution of hemorrhagi and tourniquet shock. Circulation. 1951;3:42-79.
[8] Kowalski HJ, Abelmann WH. The cardiac output at rest in Laennec’s cirrhosis. J Clin Invest. 1953;32:1025-33.
[9] Benoit JN, Womack WA, Hernandez L, Granger DN. “Forward” and “backward” flow mechanisms of portal hypertension. Relative contributions in the rat model of portal vein stenosis. Gastroenterology. 1985;89:1092-6.
[10] Battarbee HD, Farrar GE, Spears RP. Responses to hypotension in conscious rats with chronic portal venous hypertension. Am J Physiol. 1990;259:G48-55.
[11] Zavecz JH, Bueno O, Maloney RE, O’Donnell JM, Roerig SC, Battarbee HD. Cardiac excitation-contrac-tion coupling in the portal hypertensive rat. Am J Physiol Gastrointest Liver Physiol. 2000;279:G28-39. [12] Laleman W, Landeghem L, Wilmer A, Fevery J, Nevens F. Portal hypertension: from pathophysiology to
clinical practice. Liver Int. 2005;25:1079-90.
[13] Sanyal AJ, Bosch J, Blei A, Arroyo V. Portal hypertension and its complications. Gastroenterology. 2008;134:1715-28.
[14] Hendrickson H, Chatterjee S, Cao S, Morales Ruiz M, Sessa WC, Shah V. Influence of caveolin on cons-titutively activated recombinant eNOS: insights into eNOS dysfunction in BDL rat liver. Am J Physiol Gastrointest Liver Physiol. 2003;285:G652-60.
[15] Bolognesi M, Sacerdoti D, Piva A, Di Pascoli M, Zampieri F, Quarta S, et al. Carbon monoxide-mediated activation of large-conductance calcium-activated potassium channels contributes to mesenteric vaso-dilatation in cirrhotic rats. J Pharmacol Exp Ther. 2007;321:187-94.
[16] Woitas RP, Heller J, Stoffel-Wagner B, Spengler U, Sauerbruch T. Renal functional reserve and nitric oxide in patients with compensated liver cirrhosis. Hepatology. 1997;26:858-64.
[17] D’Amico G, Morabito A, Pagliaro L, Marubini E. Survival and prognostic indicators in compensated and decompensated cirrhosis. Dig Dis Sci. 1986;31:468-75.
[18] Gines P, Quintero E, Arroyo V, Teres J, Bruguera M, Rimola A, et al. Compensated cirrhosis: natural his-tory and prognostic factors. Hepatology. 1987;7:122-8.
[19] Gerbes AL, Remien J, Jungst D, Sauerbruch T, Paumgartner G. Evidence for down-regulation of beta-2-adrenoceptors in cirrhotic patients with severe ascites. Lancet. 1986;1:1409-11.
[20] Lee SS, Marty J, Mantz J, Samain E, Braillon A, Lebrec D. Desensitization of myocardial beta-adrenergic receptors in cirrhotic rats. Hepatology. 1990;12:481-5.
[21] Ceolotto G, Papparella I, Sticca A, Bova S, Cavalli M, Cargnelli G, et al. An abnormal gene expression of the beta-adrenergic system contributes to the pathogenesis of cardiomyopathy in cirrhotic rats. Hepa-tology. 2008;48:1913-23.
[22] Ma Z, Miyamoto A, Lee SS. Role of altered beta-adrenoceptor signal transduction in the pathogenesis of cirrhotic cardiomyopathy in rats. Gastroenterology. 1996;110:1191-8.
[23] Ma Z, Meddings JB, Lee SS. Membrane physical properties determine cardiac beta-adrenergic receptor function in cirrhotic rats. Am J Physiol. 1994;267:G87-93.
[24] Ma Z, Lee SS, Meddings JB. Effects of altered cardiac membrane fluidity on beta-adrenergic receptor signalling in rats with cirrhotic cardiomyopathy. J Hepatol. 1997;26:904-12.
[25] Gazawi H, Ljubuncic P, Cogan U, Hochgraff E, Ben-Shachar D, Bomzon A. The effects of bile acids on beta-adrenoceptors, fluidity, and the extent of lipid peroxidation in rat cardiac membranes. Biochem Pharmacol. 2000;59:1623-8.
[26] Ward CA, Liu H, Lee SS. Altered cellular calcium regulatory systems in a rat model of cirrhotic cardio-myopathy. Gastroenterology. 2001;121:1209-18.
[27] Ward CA, Ma Z, Lee SS, Giles WR. Potassium currents in atrial and ventricular myocytes from a rat model of cirrhosis. Am J Physiol. 1997;273:G537-44.
[28] Glenn TK, Honar H, Liu H, ter Keurs HE, Lee SS. Role of cardiac myofilament proteins titin and collagen in the pathogenesis of diastolic dysfunction in cirrhotic rats. J Hepatol. 2011;55:1249-55.
[29] Gaskari SA, Honar H, Lee SS. Therapy insight: Cirrhotic cardiomyopathy. Nat Clin Pract Gastroenterol Hepatol. 2006;3:329-37.
[30] De Petrocellis L, Cascio MG, Di Marzo V. The endocannabinoid system: a general view and latest addi-tions. Br J Pharmacol. 2004;141:765-74.
[31] Gaskari SA, Liu H, Moezi L, Li Y, Baik SK, Lee SS. Role of endocannabinoids in the pathogenesis of cir-rhotic cardiomyopathy in bile duct-ligated rats. Br J Pharmacol. 2005;146:315-23.
[32] Batkai S, Mukhopadhyay P, Harvey-White J, Kechrid R, Pacher P, Kunos G. Endocannabinoids acting at CB1 receptors mediate the cardiac contractile dysfunction in vivo in cirrhotic rats. Am J Physiol Heart Circ Physiol. 2007;293:H1689-95.
[33] Liu H, Gaskari SA, Lee SS. Cardiac and vascular changes in cirrhosis: pathogenic mechanisms. World J Gastroenterol. 2006;12:837-42.
[34] Moezi L, Gaskari SA, Lee SS. Endocannabinoids and liver disease. V. endocannabinoids as mediators of vascular and cardiac abnormalities in cirrhosis. Am J Physiol Gastrointest Liver Physiol. 2008;295:G649-53.
[35] Liu H, Ma Z, Lee SS. Contribution of nitric oxide to the pathogenesis of cirrhotic cardiomyopathy in bile duct-ligated rats. Gastroenterology. 2000;118:937-44.
[36] Herring N, Danson EJ, Paterson DJ. Cholinergic control of heart rate by nitric oxide is site specific. News Physiol Sci. 2002;17:202-6.
[37] Seddon M, Shah AM, Casadei B. Cardiomyocytes as effectors of nitric oxide signalling. Cardiovasc Res. 2007;75:315-26.
[38] Kim YM, Bombeck CA, Billiar TR. Nitric oxide as a bifunctional regulator of apoptosis. Circ Res. 1999;84:253-6.
[39] van Obbergh L, Vallieres Y, Blaise G. Cardiac modifications occurring in the ascitic rat with biliary cir-rhosis are nitric oxide related. J Hepatol. 1996;24:747-52.
[40] Garcia-Estan J, Ortiz MC, Lee SS. Nitric oxide and renal and cardiac dysfunction in cirrhosis. Clin Sci (Lond). 2002;102:213-22.
[41] Liu H, Song D, Lee SS. Role of heme oxygenase-carbon monoxide pathway in pathogenesis of cirrhotic cardiomyopathy in the rat. Am J Physiol Gastrointest Liver Physiol. 2001;280:G68-74.
[42] Liu H, Lee SS. Nuclear factor-kappaB inhibition improves myocardial contractility in rats with cirrhotic cardiomyopathy. Liver Int. 2008;28:640-8.
[43] Zardi EM, Abbate A, Zardi DM, Dobrina A, Margiotta D, Van Tassell BW, et al. Cirrhotic cardiomyopathy. J Am Coll Cardiol. 2010;56:539-49.
[44] Timoh T, Protano MA, Wagman G, Bloom M, Vittorio TJ. A perspective on cirrhotic cardiomyopathy. Transplant Proc. 2011;43:1649-53.
[45] Moller S, Sondergaard L, Mogelvang J, Henriksen O, Henriksen JH. Decreased right heart blood volume determined by magnetic resonance imaging: evidence of central underfilling in cirrhosis. Hepatology. 1995;22:472-8.
[46] Rector WG, Jr., Adair O, Hossack KF, Rainguet S. Atrial volume in cirrhosis: relationship to blood volume and plasma concentration of atrial natriuretic factor. Gastroenterology. 1990;99:766-70.
[47] Valeriano V, Funaro S, Lionetti R, Riggio O, Pulcinelli G, Fiore P, et al. Modification of cardiac function in cirrhotic patients with and without ascites. Am J Gastroenterol. 2000;95:3200-5.
[48] Keller H, Bezjak V, Stegaru B, Buss J, Holm E, Heene DL. Ventricular function in cirrhosis and portasys-temic shunt: a two-dimensional echocardiographic study. Hepatology. 1988;8:658-62.
[49] Ahmed SS, Howard M, ten Hove W, Leevy CM, Regan TJ. Cardiac function in alcoholics with cirrhosis: absence of overt cardiomyopathy--myth or fact? J Am Coll Cardiol. 1984;3:696-702.
[50] Gould L, Shariff M, Zahir M, Di Lieto M. Cardiac hemodynamics in alcoholic patients with chronic liver disease and a presystolic gallop. J Clin Invest. 1969;48:860-8.
[51] Kelbaek H, Rabol A, Brynjolf I, Eriksen J, Bonnevie O, Godtfredsen J, et al. Haemodynamic response to exercise in patients with alcoholic liver cirrhosis. Clin Physiol. 1987;7:35-41.
[52] Wong F, Girgrah N, Graba J, Allidina Y, Liu P, Blendis L. The cardiac response to exercise in cirrhosis. Gut. 2001;49:268-75.
[53] Grose RD, Nolan J, Dillon JF, Errington M, Hannan WJ, Bouchier IA, et al. Exercise-induced left ventricu-lar dysfunction in alcoholic and non-alcoholic cirrhosis. J Hepatol. 1995;22:326-32.
[54] Bernardi M, Rubboli A, Trevisani F, Cancellieri C, Ligabue A, Baraldini M, et al. Reduced cardiovascular responsiveness to exercise-induced sympathoadrenergic stimulation in patients with cirrhosis. J Hepa-tol. 1991;12:207-16.
[55] Krag A, Bendtsen F, Mortensen C, Henriksen JH, Moller S. Effects of a single terlipressin administration on cardiac function and perfusion in cirrhosis. Eur J Gastroenterol Hepatol. 2010;22:1085-92.
[56] Limas CJ, Guiha NH, Lekagul O, Cohn JN. Impaired left ventricular function in alcoholic cirrhosis with ascites. Ineffectiveness of ouabain. Circulation. 1974;49:754-60.
[57] Laffi G, Barletta G, La Villa G, Del Bene R, Riccardi D, Ticali P, et al. Altered cardiovascular responsiveness to active tilting in nonalcoholic cirrhosis. Gastroenterology. 1997;113:891-8.
[58] Sicari R, Nihoyannopoulos P, Evangelista A, Kasprzak J, Lancellotti P, Poldermans D, et al. Stress echocar-diography expert consensus statement: European Association of Echocarechocar-diography (EAE) (a registered branch of the ESC). Eur J Echocardiogr. 2008;9:415-37.
[59] Dahl EK, Moller S, Kjaer A, Petersen CL, Bendtsen F, Krag A. Diastolic and autonomic dysfunction in early cirrhosis: a dobutamine stress study. Scand J Gastroenterol. 2014;49:362-72.
[60] Kim MY, Baik SK, Won CS, Park HJ, Jeon HK, Hong HI, et al. Dobutamine stress echocardiography for evaluating cirrhotic cardiomyopathy in liver cirrhosis. Korean J Hepatol. 2010;16:376-82.
[61] Kazankov K, Holland-Fischer P, Andersen NH, Torp P, Sloth E, Aagaard NK, et al. Resting myocardial dysfunction in cirrhosis quantified by tissue Doppler imaging. Liver Int. 2011;31:534-40.
[62] Lunseth JH, Olmstead EG, Abboud F. A study of heart disease in one hundred eight hospitalized patients dying with portal cirrhosis. AMA Arch Intern Med. 1958;102:405-13.
[63] Ortiz-Olvera NX, Castellanos-Pallares G, Gomez-Jimenez LM, Cabrera-Munoz ML, Mendez-Navarro J, Moran-Villota S, et al. Anatomical cardiac alterations in liver cirrhosis: an autopsy study. Ann Hepatol. 2011;10:321-6.
[64] Lossnitzer D, Steen H, Zahn A, Lehrke S, Weiss C, Weiss KH, et al. Myocardial late gadolinium enhan-cement cardiovascular magnetic resonance in patients with cirrhosis. J Cardiovasc Magn Reson. 2010;12:47.
[65] How to diagnose diastolic heart failure. European Study Group on Diastolic Heart Failure. Eur Heart J. 1998;19:990-1003.
[66] Wiese S, Hove JD, Bendtsen F, Moller S. Cirrhotic cardiomyopathy: pathogenesis and clinical relevance. Nat Rev Gastroenterol Hepatol. 2014;11:177-86.
[67] Pozzi M, Carugo S, Boari G, Pecci V, de Ceglia S, Maggiolini S, et al. Evidence of functional and structural cardiac abnormalities in cirrhotic patients with and without ascites. Hepatology. 1997;26:1131-7. [68] Wong F, Liu P, Lilly L, Bomzon A, Blendis L. Role of cardiac structural and functional abnormalities in
the pathogenesis of hyperdynamic circulation and renal sodium retention in cirrhosis. Clin Sci (Lond). 1999;97:259-67.
[69] Finucci G, Desideri A, Sacerdoti D, Bolognesi M, Merkel C, Angeli P, et al. Left ventricular diastolic func-tion in liver cirrhosis. Scand J Gastroenterol. 1996;31:279-84.
[70] Pritchett AM, Mahoney DW, Jacobsen SJ, Rodeheffer RJ, Karon BL, Redfield MM. Diastolic dysfunction and left atrial volume: a population-based study. J Am Coll Cardiol. 2005;45:87-92.
[71] Douglas PS. The left atrium: a biomarker of chronic diastolic dysfunction and cardiovascular disease risk. J Am Coll Cardiol. 2003;42:1206-7.
[72] Boomsma F, van den Meiracker AH. Plasma A- and B-type natriuretic peptides: physiology, methodology and clinical use. Cardiovasc Res. 2001;51:442-9.
[73] Caruana L, Davie AP, Petrie M, McMurray J. Diagnosing heart failure. Eur Heart J. 1999;20:393.
[74] Palmieri V, Innocenti F, Pini R, Celentano A. Reproducibility of Doppler echocardiographic assessment of left ventricular diastolic function in multicenter setting. J Am Soc Echocardiogr. 2005;18:99-106. [75] Cahill JM, Horan M, Quigley P, Maurer B, McDonald K. Doppler-echocardiographic indices of diastolic
function in heart failure admissions with preserved left ventricular systolic function. Eur J Heart Fail. 2002;4:473-8.
[76] Thomas MD, Fox KF, Wood DA, Gibbs JS, Coats AJ, Henein MY, et al. Echocardiographic features and brain natriuretic peptides in patients presenting with heart failure and preserved systolic function. He-art. 2006;92:603-8.
[77] Petrie MC, Hogg K, Caruana L, McMurray JJ. Poor concordance of commonly used echocardiographic measures of left ventricular diastolic function in patients with suspected heart failure but preser-ved systolic function: is there a reliable echocardiographic measure of diastolic dysfunction? Heart. 2004;90:511-7.
[78] Choong CY, Herrmann HC, Weyman AE, Fifer MA. Preload dependence of Doppler-derived indexes of left ventricular diastolic function in humans. J Am Coll Cardiol. 1987;10:800-8.
[79] Thomas JD, Choong CY, Flachskampf FA, Weyman AE. Analysis of the early transmitral Doppler velocity curve: effect of primary physiologic changes and compensatory preload adjustment. J Am Coll Cardiol. 1990;16:644-55.
[80] Nagueh SF, Appleton CP, Gillebert TC, Marino PN, Oh JK, Smiseth OA, et al. Recommendations for the evaluation of left ventricular diastolic function by echocardiography. Eur J Echocardiogr. 2009;10:165-93. [81] Bernardi M, Calandra S, Colantoni A, Trevisani F, Raimondo ML, Sica G, et al. Q-T interval prolongation in cirrhosis: prevalence, relationship with severity, and etiology of the disease and possible pathogenetic factors. Hepatology. 1998;27:28-34.
[82] Bal JS, Thuluvath PJ. Prolongation of QTc interval: relationship with etiology and severity of liver disease, mortality and liver transplantation. Liver Int. 2003;23:243-8.
[83] Ytting H, Henriksen JH, Fuglsang S, Bendtsen F, Moller S. Prolonged Q-T(c) interval in mild portal hyper-tensive cirrhosis. J Hepatol. 2005;43:637-44.
[84] Henriksen JH, Fuglsang S, Bendtsen F, Christensen E, Moller S. Dyssynchronous electrical and mechani-cal systole in patients with cirrhosis. J Hepatol. 2002;36:513-20.
[85] Moller S, Henriksen JH. Cardiovascular complications of cirrhosis. Gut. 2008;57:268-78.
[86] Lebrec D, Giuily N, Hadengue A, Vilgrain V, Moreau R, Poynard T, et al. Transjugular intrahepatic por-tosystemic shunts: comparison with paracentesis in patients with cirrhosis and refractory ascites: a randomized trial. French Group of Clinicians and a Group of Biologists. J Hepatol. 1996;25:135-44.
[87] Franco D, Vons C, Traynor O, de Smadja C. Should portosystemic shunt be reconsidered in the treat-ment of intractable ascites in cirrhosis? Arch Surg. 1988;123:987-91.
[88] Kovacs A, Schepke M, Heller J, Schild HH, Flacke S. Short-term effects of transjugular intrahepatic shunt on cardiac function assessed by cardiac MRI: preliminary results. Cardiovasc Intervent Radiol. 2010;33:290-6.
[89] Gines P, Uriz J, Calahorra B, Garcia-Tsao G, Kamath PS, Del Arbol LR, et al. Transjugular intrahepatic portosystemic shunting versus paracentesis plus albumin for refractory ascites in cirrhosis. Gastroen-terology. 2002;123:1839-47.
[90] Huonker M, Schumacher YO, Ochs A, Sorichter S, Keul J, Rossle M. Cardiac function and haemodyna-mics in alcoholic cirrhosis and effects of the transjugular intrahepatic portosystemic stent shunt. Gut. 1999;44:743-8.
[91] Cazzaniga M, Salerno F, Pagnozzi G, Dionigi E, Visentin S, Cirello I, et al. Diastolic dysfunction is asso-ciated with poor survival in patients with cirrhosis with transjugular intrahepatic portosystemic shunt. Gut. 2007;56:869-75.
[92] Rabie RN, Cazzaniga M, Salerno F, Wong F. The use of E/A ratio as a predictor of outcome in cirrhotic pa-tients treated with transjugular intrahepatic portosystemic shunt. Am J Gastroenterol. 2009;104:2458-66.
[93] Ruiz-del-Arbol L, Urman J, Fernandez J, Gonzalez M, Navasa M, Monescillo A, et al. Systemic, renal, and hepatic hemodynamic derangement in cirrhotic patients with spontaneous bacterial peritonitis. Hepa-tology. 2003;38:1210-8.
[94] Ruiz-del-Arbol L, Monescillo A, Arocena C, Valer P, Gines P, Moreira V, et al. Circulatory function and hepatorenal syndrome in cirrhosis. Hepatology. 2005;42:439-47.
[95] Krag A, Bendtsen F, Henriksen JH, Moller S. Low cardiac output predicts development of hepatorenal syndrome and survival in patients with cirrhosis and ascites. Gut. 2010;59:105-10.
[96] Krag A, Bendtsen F, Burroughs AK, Moller S. The cardiorenal link in advanced cirrhosis. Med Hypotheses. 2012;79:53-5.
[97] Ruiz-del-Arbol L, Achecar L, Serradilla R, Rodriguez-Gandia MA, Rivero M, Garrido E, et al. Diastolic dysfunction is a predictor of poor outcomes in patients with cirrhosis, portal hypertension, and a nor-mal creatinine. Hepatology. 2013;58:1732-41.
[98] Alexopoulou A, Papatheodoridis G, Pouriki S, Chrysohoou C, Raftopoulos L, Stefanadis C, et al. Diastolic myocardial dysfunction does not affect survival in patients with cirrhosis. Transpl Int. 2012;25:1174-81. [99] Nazar A, Guevara M, Sitges M, Terra C, Sola E, Guigou C, et al. LEFT ventricular function assessed by
echocardiography in cirrhosis: relationship to systemic hemodynamics and renal dysfunction. J Hepatol. 2013;58:51-7.
[100] Edler I, Hertz C. Use of ultrasonic reflectoscope for the continuous recording of movements of heart walls. Kungl Fysiogr Sallsk Lung Forth 1954;24.
[101] Kirkpatrick JN, Vannan MA, Narula J, Lang RM. Echocardiography in heart failure: applications, utility, and new horizons. J Am Coll Cardiol. 2007;50:381-96.
[102] Dokainish H, Nguyen JS, Bobek J, Goswami R, Lakkis NM. Assessment of the American Society of Echocardiography-European Association of Echocardiography guidelines for diastolic function in pa-tients with depressed ejection fraction: an echocardiographic and invasive haemodynamic study. Eur J Echocardiogr. 2011;12:857-64.
[103] Nagueh SF, Bhatt R, Vivo RP, Krim SR, Sarvari SI, Russell K, et al. Echocardiographic evaluation of hemo-dynamics in patients with decompensated systolic heart failure. Circ Cardiovasc Imaging. 2011;4:220-7. [104] Popescu BA, Andrade MJ, Badano LP, Fox KF, Flachskampf FA, Lancellotti P, et al. European Association
of Echocardiography recommendations for training, competence, and quality improvement in echocar-diography. Eur J Echocardiogr. 2009;10:893-905.
[105] Lang RM, Bierig M, Devereux RB, Flachskampf FA, Foster E, Pellikka PA, et al. Recommendations for chamber quantification. Eur J Echocardiogr. 2006;7:79-108.
[106] McMurray JJ, Adamopoulos S, Anker SD, Auricchio A, Bohm M, Dickstein K, et al. ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure 2012: The Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure 2012 of the European Society of Cardiology. Developed in collaboration with the Heart Failure Association (HFA) of the ESC. Eur Heart J. 2012;33:1787-847. [107] Appleton CP, Hatle LK, Popp RL. Relation of transmitral flow velocity patterns to left ventricular
dias-tolic function: new insights from a combined hemodynamic and Doppler echocardiographic study. J Am Coll Cardiol. 1988;12:426-40.
[108] Appleton CP. Influence of incremental changes in heart rate on mitral flow velocity: assessment in lightly sedated, conscious dogs. J Am Coll Cardiol. 1991;17:227-36.
[109] Mor-Avi V, Lang RM, Badano LP, Belohlavek M, Cardim NM, Derumeaux G, et al. Current and evolving echocardiographic techniques for the quantitative evaluation of cardiac mechanics: ASE/EAE consensus statement on methodology and indications endorsed by the Japanese Society of Echocardiography. Eur J Echocardiogr. 2011;12:167-205.
[110] Teske AJ, De Boeck BW, Melman PG, Sieswerda GT, Doevendans PA, Cramer MJ. Echocardiographic quantification of myocardial function using tissue deformation imaging, a guide to image acquisition and analysis using tissue Doppler and speckle tracking. Cardiovasc Ultrasound. 2007;5:27.
[111] Grossman W, Jones D, McLaurin LP. Wall stress and patterns of hypertrophy in the human left ventricle. J Clin Invest. 1975;56:56-64.
[112] Bijnens BH, Cikes M, Claus P, Sutherland GR. Velocity and deformation imaging for the assessment of myocardial dysfunction. Eur J Echocardiogr. 2009;10:216-26.
[113] Burns AT, La Gerche A, D’Hooge J, MacIsaac AI, Prior DL. Left ventricular strain and strain rate: charac-terization of the effect of load in human subjects. Eur J Echocardiogr. 2010;11:283-9.
[114] Mirsky I, Aoyagi T, Crocker VM, Fujii AM. Preload dependence of fiber shortening rate in conscious dogs with left ventricular hypertrophy. J Am Coll Cardiol. 1990;15:890-9.
[115] Weidemann F, Jamal F, Sutherland GR, Claus P, Kowalski M, Hatle L, et al. Myocardial function defined by strain rate and strain during alterations in inotropic states and heart rate. Am J Physiol Heart Circ Physiol. 2002;283:H792-9.
[116] Greenberg NL, Firstenberg MS, Castro PL, Main M, Travaglini A, Odabashian JA, et al. Doppler-derived myo-cardial systolic strain rate is a strong index of left ventricular contractility. Circulation. 2002;105:99-105. [117] Andersen NH, Poulsen SH, Eiskjaer H, Poulsen PL, Mogensen CE. Decreased left ventricular longitudinal
contraction in normotensive and normoalbuminuric patients with Type II diabetes mellitus: a Doppler tissue tracking and strain rate echocardiography study. Clin Sci (Lond). 2003;105:59-66.
[118] Cardim N, Oliveira AG, Longo S, Ferreira T, Pereira A, Reis RP, et al. Doppler tissue imaging: regional myocardial function in hypertrophic cardiomyopathy and in athlete’s heart. J Am Soc Echocardiogr. 2003;16:223-32.
[119] Poulsen SH, Andersen NH, Heickendorff L, Mogensen CE. Relation between plasma amino-terminal propeptide of procollagen type III and left ventricular longitudinal strain in essential hypertension. He-art. 2005;91:624-9.
[120] Jurcut R, Wildiers H, Ganame J, D’Hooge J, De Backer J, Denys H, et al. Strain rate imaging detects early cardiac effects of pegylated liposomal Doxorubicin as adjuvant therapy in elderly patients with breast cancer. J Am Soc Echocardiogr. 2008;21:1283-9.
[121] Voigt JU, Exner B, Schmiedehausen K, Huchzermeyer C, Reulbach U, Nixdorff U, et al. Strain-rate ima-ging during dobutamine stress echocardiography provides objective evidence of inducible ischemia. Circulation. 2003;107:2120-6.
[122] Faber L, Prinz C, Welge D, Hering D, Butz T, Oldenburg O, et al. Peak systolic longitudinal strain of the lateral left ventricular wall improves after septal ablation for symptomatic hypertrophic obstructive cardiomyopathy: a follow-up study using speckle tracking echocardiography. Int J Cardiovasc Imaging. 2011;27:325-33.
[123] Bjork Ingul C, Rozis E, Slordahl SA, Marwick TH. Incremental value of strain rate imaging to wall motion analysis for prediction of outcome in patients undergoing dobutamine stress echocardiography. Circu-lation. 2007;115:1252-9.
[124 Weidemann F, Jung P, Hoyer C, Broscheit J, Voelker W, Ertl G, et al. Assessment of the contractile reserve in patients with intermediate coronary lesions: a strain rate imaging study validated by invasive myocar-dial fractional flow reserve. Eur Heart J. 2007;28:1425-32.
[125] Yu CM, Sanderson JE, Marwick TH, Oh JK. Tissue Doppler imaging a new prognosticator for cardiovas-cular diseases. J Am Coll Cardiol. 2007;49:1903-14.
[126] Jasaityte R, Dandel M, Lehmkuhl H, Hetzer R. Prediction of short-term outcomes in patients with idio-pathic dilated cardiomyopathy referred for transplantation using standard echocardiography and strain imaging. Transplant Proc. 2009;41:277-80.
[127] Nagueh SF, Sun H, Kopelen HA, Middleton KJ, Khoury DS. Hemodynamic determinants of the mitral annulus diastolic velocities by tissue Doppler. J Am Coll Cardiol. 2001;37:278-85.
[128] Oki T, Tabata T, Yamada H, Wakatsuki T, Shinohara H, Nishikado A, et al. Clinical application of pulsed Doppler tissue imaging for assessing abnormal left ventricular relaxation. Am J Cardiol. 1997;79:921-8. [129] Sohn DW, Chai IH, Lee DJ, Kim HC, Kim HS, Oh BH, et al. Assessment of mitral annulus velocity
by Doppler tissue imaging in the evaluation of left ventricular diastolic function. J Am Coll Cardiol. 1997;30:474-80.
[130] Ommen SR, Nishimura RA, Appleton CP, Miller FA, Oh JK, Redfield MM, et al. Clinical utility of Doppler echocardiography and tissue Doppler imaging in the estimation of left ventricular filling pressures: A comparative simultaneous Doppler-catheterization study. Circulation. 2000;102:1788-94.
[131] Dokainish H, Zoghbi WA, Lakkis NM, Al-Bakshy F, Dhir M, Quinones MA, et al. Optimal noninvasive assessment of left ventricular filling pressures: a comparison of tissue Doppler echocardiography and B-type natriuretic peptide in patients with pulmonary artery catheters. Circulation. 2004;109:2432-9. [132] Paulus WJ, Tschope C, Sanderson JE, Rusconi C, Flachskampf FA, Rademakers FE, et al. How to diagnose
diastolic heart failure: a consensus statement on the diagnosis of heart failure with normal left ventri-cular ejection fraction by the Heart Failure and Echocardiography Associations of the European Society of Cardiology. Eur Heart J. 2007;28:2539-50.
[133] Lima JA, Desai MY. Cardiovascular magnetic resonance imaging: current and emerging applications. J Am Coll Cardiol. 2004;44:1164-71.
[134] Zerhouni EA, Parish DM, Rogers WJ, Yang A, Shapiro EP. Human heart: tagging with MR imaging--a me-thod for noninvasive assessment of myocardial motion. Radiology. 1988;169:59-63.
[135] Lawton JS, Cupps BP, Knutsen AK, Ma N, Brady BD, Reynolds LM, et al. Magnetic resonance imaging detects significant sex differences in human myocardial strain. Biomed Eng Online. 2011;10:76.
[136] Hor KN, Gottliebson WM, Carson C, Wash E, Cnota J, Fleck R, et al. Comparison of magnetic reso-nance feature tracking for strain calculation with harmonic phase imaging analysis. JACC Cardiovasc Imaging. 2010;3:144-51.
[137] Schuster A, Kutty S, Padiyath A, Parish V, Gribben P, Danford DA, et al. Cardiovascular magnetic resonan-ce myocardial feature tracking detects quantitative wall motion during dobutamine stress. J Cardiovasc Magn Reson. 2011;13:58.
[138] Zagrosek A, Abdel-Aty H, Boye P, Wassmuth R, Messroghli D, Utz W, et al. Cardiac magnetic resonan-ce monitors reversible and irreversible myocardial injury in myocarditis. JACC Cardiovasc Imaging. 2009;2:131-8.
[139] Iles L, Pfluger H, Phrommintikul A, Cherayath J, Aksit P, Gupta SN, et al. Evaluation of diffuse myocardial fibrosis in heart failure with cardiac magnetic resonance contrast-enhanced T1 mapping. J Am Coll Cardiol. 2008;52:1574-80.
[140] Schuster A, Morton G, Chiribiri A, Perera D, Vanoverschelde JL, Nagel E. Imaging in the management of ischemic cardiomyopathy: special focus on magnetic resonance. J Am Coll Cardiol. 2012;59:359-70.