Universidade de Trás-os-Montes e Alto Douro
A problemática da Flavescência dourada da videira e o seu
vetor na Região dos Vinhos Verdes (concelho de Santo Tirso)
Dissertação de Mestrado em Engenharia Agronómica
Ricardo André Costa Machado
Orientadora: Prof.ª Ana Maria Nazaré Pereira
Co-orientadora: Prof.ª Laura Monteiro Torres
Universidade Trás-os-Montes e Alto Douro
A problemática da Flavescência dourada da videira e o seu
vetor na Região dos Vinhos Verdes (concelho Santo Tirso)
Dissertação de Mestrado em Engenharia Agronómica
Ricardo André Costa Machado
Orientadora: Prof.ª Ana Maria Nazaré Pereira
Co-orientadora: Prof.ª Laura Monteiro Torres
Composição do Júri:
____________________________________________________________
____________________________________________________________
____________________________________________________________
“As doutrinas apresentadas neste trabalho são da exclusiva responsabilidade do autor.”
Agradecimentos
Quero agradecer à DRAP Norte, sob a presidência do Eng. Manuel Cardoso, por ter permitido a minha integração no trabalho desenvolvido na temática Flavescência dourada e o seu vector.
Agradeço aos meus mestres: ao Eng. Joaquim Guerner e à Eng. Gisela Chicau por todo o conhecimento que me transmitiram e pela amizade que se foi estabelecendo ao longo desta caminhada na “rota da Flavescência dourada” na Região dos Vinhos Verdes.
Também quero agradecer ao Sr. Carlos Coutinho por toda a informação que me tem disponibilizado não só no âmbito da Flavescência dourada e seu vetor bem como em outros domínios da fitopatologia.
Agradeço à Dr.ª Margarida e às suas irmãs, pela cedência das Qtas para a implementação do trabalho de campo, bem como ao senhor António, feitor das mesmas, por me ter “aturado” todas as semanas.
Agradeço à Qta do Ameal pela colheita das amostras, para o diagnóstico de fungos do lenho em videiras infectadas com FD.
Agradeço ao Eng. Joaquim Pedras pela cedência das fotos de Flavescência dourada na casta Chardonnay.
Agradeço à Estación Fitopatolóxica do Areeiro, Pontevedra, dirigida pelo Eng. Pedro Mansilla Vázquez, pela análise laboratorial dos fitoplasmas da FD e BN.
Agradeço ao Sr. Carlos pelo auxílio no diagnóstico do GLRaV-3 bem como à D. Ana e à Vanda pela boa disposição instalada no laboratório.
Um agradecimento muito especial é dirigido à Prof.ª Ana Maria e à Prof.ª Laura, por me terem aceite como aluno estagiário para a realização desta dissertação. Uma apaixonada pelos vírus e fitoplasmas, outra pela entomologia, envolvidas pelo mundo da patologia vegetal como se estivéssemos a falar da relação FD/ST. Foi através dessa união que demostram a um “filho” do ensino que as barreiras conseguem ser ultrapassadas sendo estas por vezes extremamente difíceis. Acreditaram no meu trabalho e depositaram uma confiança inigualável, onde a partilha de conhecimentos foi recíproca, interlaçando-se o verdadeiro sentido da amizade. OBRIGADO.
Por fim quero agradecer a todos aqueles que me ajudaram nesta etapa da minha vida, com um carinho especial à minha mãe em que muitas vezes durante o processo de escrita ouvia no silêncio “o mundo está amarrado, é necessário uma ajuda” e sem dúvida que estarei sempre “amarrado” a ti. OBRIGADO.
Índice Geral
Índice de Figuras ... I Índice de Quadros ... IV Lista de Abreviaturas Utilizadas ao Longo do Texto ... VI Resumo ... VIII Abstract ... XI
1. Introdução ... 1
2. Estado da Arte ... 3
2.1. A Flavescência dourada da videira... 3
2.2. O vetor da Flavescência dourada da videira... 9
2.3. Flavescência dourada da videira em Portugal e o PAN-FD ... 22
2.4. Estratégias de proteção contra o complexo FD/S. titanus ... 28
2.5. A doença do enrolamento foliar da videira ... 33
2.6. Doenças do lenho da videira ... 39
3. Material e Métodos ... 50
3.1. Estudo da evolução da sintomatologia de possível infeção por FD ... 53
3.2. Deteção laboratorial de FD/BN ... 53
3.3. Deteção laboratorial de GLRaV-3... 55
3.4. Monitorização das ninfas e adultos de S. titanus ... 55
3.5. Isolamento de fungos do lenho de videiras suspeitas de FD ... 56
4. Resultados e Discussão ... 58
4.1. Estudo da evolução da sintomatologia de possível infeção por FD ... 58
4.2. Deteção laboratorial de FD/BN ... 60
4.3. Deteção laboratorial de GLRaV-3... 62
4.4. Análise global da deteção laboratorial nas seis videiras em estudo ... 64
4.6. Isolamento de fungos do lenho de videiras suspeitas de FD ... 80
5. Conclusão ... 85
Referências Bibliográficas ... 89
Índice de Figuras
Fig. 1 – Alguns dos sintomas provocados pelo fitoplasma da Flavescência dourada da
videira na casta Loureiro (setembro de 2014). ... 9
Fig. 2 – Diferentes estádios ninfais e adulto de Scaphoideus titanus (Fonte: adaptado de
ADVID). ... 16
Fig. 3 – Adulto de Scaphoideus titanus (Fonte: adaptado de www.inra.fr). ... 16 Fig. 4 – Forma apopléctica num braço de Vitis vinifera em na casta Loureiro (julho de
2013). ... 43
Fig. 5 – Forma apoplética na totalidade da cepa, em Vitis vinífera na casta Loureiro
(julho de 2013). ... 43
Fig. 6 – “Amadou” (julho de 2013). ... 46 Fig. 7 – Sintomas típicos de esca nas folhas e cacho de videira na casta Loureiro (agosto
de 2014). ... 48
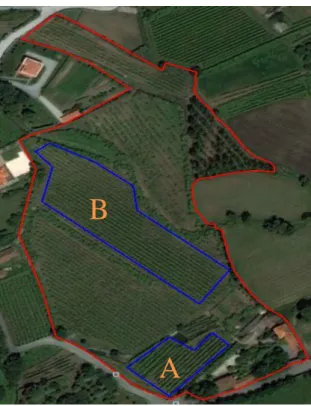
Fig. 8 – Imagem de satélite da Qta da Cerdeira onde se assinalam as parcelas em estudo
(Fonte: adaptado de Google Earth). ... 51
Fig. 9 – Imagem de satélite da Qta de Lamelas onde se assinalam as parcelas em estudo
(Fonte: adaptado de Google Earth). ... 51
Fig. 10 – Folhas sobrepostas em forma de telhado de um pâmpano ligeiramente
douradas e com início de enrolamento para a página inferior (parcela C, casta Trajadura, 22-jul-2013). ... 59
Fig. 11 – Folha com “amarelos” delimitados pelas nervuras secundárias e enrolamento
para a página inferior (parcela B, casta Loureiro, 22-jul-2013). ... 59
Fig. 12 – Dourados caraterístico de possível infeção por FD e/ou BN, visualizados na
videira 2.2 (parcela B, casta Loureiro, 14-out-2013). ... 60
Fig. 13 – Resultado teste ELISA a 2h de reação. ... 62 Fig. 14 – Casta Chardonnay com pâmpano com folhas sobrepostas em forma de
telhado, com dourados, enroladas para a página inferior e secamento das inflorescências. Qta das Figueiras, Felgueiras. (Fonte: Joaquim Pedras). ... 65
Fig. 15 – Número de ninfas e adultos de S. titanus observados na Qta da Cerdeira, casta
Arinto (parcela A). A seta indica a data em que foi realizada a aplicação de Decis para combater a traça-da-uva... 67
Fig. 16 – Número de ninfas e adultos de S. titanus observados na Qta da Cerdeira, casta
Loureiro (parcela B). A seta indica a data em que foi realizada uma aplicação de Decis para combater a traça-da-uva. ... 67
Fig. 17 – Número de ninfas e adultos de S. titanus observados na Qta de Lamelas - parte
de cima casta Trajadura (parcela C). A seta indica a data em que foi realizada a
aplicação de Decis para combater a traça-da-uva. ... 68
Fig. 18 – Número de ninfas e adultos de S. titanus observados na Qta de Lamelas - parte de cima casta Arinto (parcela D). A seta indica a data em que foi realizada a aplicação de Decis para combater a traça-da-uva. ... 68
Fig. 19 – Número de ninfas e adultos de S. titanus observados na Qta de Lamelas – parte de baixo, casta Arinto (parcela E). A seta indica a data em que foi realizada a aplicação de Decis para combater a traça-da-uva. ... 69
Fig. 20 – Número de ninfas e adultos de S. titanus observados na Qta de Lamelas - parte de baixo, casta Arinto (parcela F). A seta indica a data em que foi realizada a aplicação de Decis para combater a traça-da-uva. ... 69
Fig. 21 - Número de ninfas e adultos de S. titanus observados na Qta de Lamelas – parte de baixo, casta Loureiro (parcela G). A seta indica a data em que foi realizada a aplicação de Decis para combater a traça-da-uva. ... 70
Fig. 22 – Exúvia de S. titanus na casta Arinto, na Qta da Cerdeira. (parcela A, 17-jun-2013). ... 73
Fig. 23 – Temperatura e humidade relativa registadas durante o período de estudo numa estação meteorológica localizada na Escola Profissional Agrícola Conde São Bento, em Santo Tirso. A partir de 16 de setembro deixou de se poder aceder aos dados. ... 73
Fig. 24 – Número total de ninfas de S. titanus contabilizado por amostragem nas parcelas em estudo (A – Qta da Cerdeira, casta Arinto, B – Qta da Cerdeira, casta Loureiro, C – Qta de Lamelas-parte de cima, casta Trajadura, D – Qta de Lamelas-parte de cima, casta Arinto, E – Qta de Lamelas-parte de baixo, casta Arinto); nas parcelas F e G não se observaram ninfas. ... 76
Fig. 25 – Número total de adultos de S. titanus contabilizado por amostragem nas parcelas em estudo (A – Qta da Cerdeira, casta Arinto, B – Qta da Cerdeira, casta Loureiro, C – Qta de Lamelas - parte de cima, casta Trajadura, D – Qta de Lamelas - parte de cima, casta Arinto, E – Qta de Lamelas - parte de baixo, casta Arinto, F – Qta de Lamelas - parte de baixo, casta Arinto, G – Qta de Lamelas - parte de baixo, casta Loureiro). ... 76
Fig. 26 – Necrose A: necrose castanha, central dura; Necrose B: pontuações negras (a formar uma linha) com exsudado; Necrose C: necrose castanha dura (cicatrização de ferida de poda). ... 81
Fig. 27 – Necrose D: necrose em cunha, castanha e dura; Necrose B: pontuações negras (a formar uma linha) com exsudado. ... 81
Fig. 28 – Necrose E: manchas brancas e castanhas “Amadou”. ... 82
Fig. 29 – Colónias de Fomitiporia mediterranea. ... 83
Fig. 31 – Videira com sintomas típicos de Flavescência dourada e esca (videira 3, casta
Loureiro, 21-jun-2013). ... 84
Índice de Quadros
Quadro 1 – Classificação taxonómica de 63 vírus cujo hospedeiro é a videira. ... 34 Quadro 2 – Caraterização genómica dos diversos GLRaV`s. ... 37 Quadro 3 – Caracterização das parcelas onde decorreu a parte experimental do presente
estudo. ... 50
Quadro 4 – Tratamentos fitossanitários efetuados às vinhas em estudo em 2013 e datas
de aplicação. ... 52
Quadro 5 – Deteção de GLRaV-3, por DAS – ELISA, para as seis videiras em estudo.
... 63
Quadro 6 – Deteção de FD/BN por PCR e deteção de GLRaV-3 por ELISA para as seis
videiras no âmbito da prospeção da Flavescência dourada. ... 64
Quadro 7 – Número de dias decorridos entre 1 de janeiro e a data do surgimento da
primeira ninfa e do primeiro adulto de S. titanus, bem como do máximo das curvas correspondentes ao seu número, nas parcelas em estudo. ... 70
Quadro 8 – Número de dias (média e desvio padrão) decorridos entre 1 de janeiro e a
data do surgimento da primeira ninfa e do primeiro adulto de S. titanus, bem como do máximo das curvas correspondentes ao seu número, nas parcelas em estudo. ... 71
Quadro 9 – Monitorização e observação à lupa binocular por parcela, das ninfas de S.
titanus. ... 72
Quadro 10 – Número de adultos de S. titanus capturados durante a realização do
presente estudo em armadilhas cromotrópicas, por parcela, nas diferentes datas de amostragem. ... 75
Quadro 11 – Tipos de necroses identificadas em videiras com sintomatologia suspeita
de FD e doenças do lenho. ... 80
Quadro 12 – Identificação de colónias e/ou fungos de acordo com o tipo de necrose
Lista de Abreviaturas Utilizadas ao Longo do Texto
% - percentagem ºC – graus Celcius ºN – graus Norte μL – microlitro χ2 – qui-quadrado BDA – Black Dead Arm BN – Bois noirCa. P – Candidatus phytoplasma
Cl – cloro
cm – centímetros
CSOB – Cordão Sobreposto Retombante CSR – Cordão Simples Retombante
CVRVV – Comissão de Viticultura da Região dos Vinhos Verdes
DAS-ELISA – Double Antibody Sandwich – Enzyme Linked Immunosorbent Assay DGAV – Direção Geral de Alimentação e Veterinária
DNA – Deoxyribonucleid Acid
DRAPC – Direção Regional de Agricultura e Pescas do Centro DRAPN – Direção Regional de Agricultura e Pescas do Norte EAEDM – Estação de Avisos do Entre-Douro e Minho Eng. – Engenheiro (a)
FD – Flavescência dourada da videira g/l – gramas por litro
GFLV – Grapevine fanleaf vírus
GLRaV – Grapevine leafroll associated virus
GLRaV-1 - Grapevine leafroll associated virus, tipo 1 GLRaV-2 - Grapevine leafroll associated virus, tipo 2 GLRaV-3 - Grapevine leafroll associated virus, tipo 3 H2O2 – peróxido de hidrogénio
ha - hectare Hz - hertz
ICVG – International Council for the Study of Virus and Virus-like IFV – Institut Français de la Vigne et du Vin
INIAV – Instituto Nacional de Investigação Agrária e Veterinária INRA – Institut National de la Recherche Agronomique
IVV – Instituto da Vinha e do Vinho Km – Kilómetro
LabEFA – Laboratório da Estación Fitopatológica do Areeiro
LabFitoUTAD – Laboratório de Fitopatologia da Universidade de Trás-os-Montes e
Alto Douro
LabINIAV – Laboratório do Instituto Nacional de Investigação Agrária e Veterinária min – minutos
MLOs – Micoplasma Like Organisms mm - milímetro
nm – nanómetro
OEPP-EPPO – Organização Europeia e Mediterrânica da Proteção das Plantas
PAN-FD – “Plano de Ação Nacional para o Controlo da Flavescência Dourada da
Videira”
PCR – Polymerase Chain Reaction
PORVID – Associação Portuguesa para a Diversidade da Videira Qta – Quinta
RFLP – Restriction Fragment Length Polymorphism SIVV – Sistema de Informação da Vinha e do Vinho
S. titanus – Scaphoideus titanus Ball
UTAD – Universidade de Trás-os-Montes e Alto Douro ZIP`s – Zonas de Intervenção Prioritárias
Resumo
A Flavescência dourada da videira (FD) é uma doença parasitária da videira causada por um fitoplasma e eficientemente transmitida pelo inseto vetor Scaphoideus titanus Ball. É uma doença de quarentena na Europa e que, em 2006, foi pela primeira vez diagnosticada em Portugal, em videira, na região de Amares, embora o seu vetor tivesse sido identificado pela primeira vez, em 1998, em Arcos de Valdevez, e em 1999, em Vila Real e houvesse, também já resultados positivos de FD no vetor em exemplares colhidos na região norte de Portugal entre 2001 e 2003. Atualmente, Portugal tem definido nove Zonas de Intervenção Prioritária (ZIP`s) para esta problemática.
Este trabalho foi realizado acompanhando a prospeção oficial da FD na Região dos Vinhos Verdes, face ao “Plano de Ação Nacional para o Controlo da Flavescência Dourada da Videira” (PAN-FD) em que o objetivo primordial foi conhecer a situação da problemática da Flavescência dourada da videira e do seu vetor, em 2013, no concelho de Santo Tirso, onde, até 2012, não tinha sido detetada a presença do fitoplasma, apesar de S. titanus já ter sido detetado pela Estação de Avisos do Entre-Douro e Minho (EAEDM) em anos anteriores, sendo a primeira vez em 2008.
Foram realizadas monitorizações semanais ao inseto vetor bem como à sintomatologia de videiras que aparentemente (por registos de anos anteriores) estavam supostamente infetadas com o fitoplasma da FD, elaborando um ficheiro fotográfico evolutivo em CD. Estas observações foram realizadas nas três castas brancas recomendadas pela Comissão de Viticultura da Região dos Vinhos Verdes (CVRVV) para a sub-região do Ave: Loureiro, Arinto e Trajadura.
Face à sintomatologia observada foram colhidas seis amostras de seis videiras suspeitas de FD e enviadas para o Laboratório do Instituto Nacional de Investigação Agrária e Veterinária (LabINIAV), em Lisboa, e posteriormente para o Laboratório da Estación Fitopatológica do Areeiro (LabEFA) em Pontevedra, Espanha, para confirmação do diagnóstico de campo. Os resultados, de ambos os laboratórios, foram negativos para as seis videiras relativamente aos fitoplasmas da FD e do “Bois noir” (BN). De acordo com estes resultados, e face à sintomatologia nas folhas das seis videiras em observação, recorreu-se, no Laboratório de Fitopatologia da Universiade de
Trás-os-Montes e Alto Douro (LabFitoUTAD), ao teste Double Antibody Sandwich – Enzyme Linked Immunosorbent Assay (DAS-ELISA) para diagnosticar o Vírus do enrolamento foliar da videira, tipo 3 (Grapevine leafroll associated virus 3, GLRaV-3) sendo os resultados todos positivos. Perante esta situação concluiu-se que o diagnóstico em campo da FD (e ou do BN) não é de fácil identificação pelo facto de existirem outros fatores em simultâneo (outras fitopatologias, carências/toxicidades, perturbações fisiológicas, etc.) em que alguns dos sintomas são muito idênticos aos de FD.
Relativamente à monitorização de S. titanus recorreu-se à observação visual para identificação das ninfas e às armadilhas adesivas amarelas para os adultos sendo esta monitorização realizada por casta, sugerindo os resultados que o inseto apresenta um comportamento diferente dependendo da casta e da localidade. Contudo estes resultados devem ser encarados com precaução devido à grande variabilidade das condições e desenvolver estudos orientados para o tema.
Durante o acompanhamento da monitorização de S.titanus na Qta do Ameal, em Ponte de Lima, em videiras com sintomas evidentes de FD e de doenças do lenho foram isolados vários fungos do lenho, confirmando-se que estas videiras, muito provavelmente e simultaneamente com FD e doenças do lenho, apresentam uma produção reduzida ou nula levando-as mais depressa à morte.
É necessário, por isso, definir uma estratégia de proteção para esta problemática fitossanitária, a fim de se praticar uma viticultura sustentável.
Abstract
Grapevine Flavescence dorée (FD) is a grapevine parasitic disease caused by a phytoplasma and efficiently transmitted by the insect vectorScaphoideus titanus Ball. It is a quarantine disease in Europe and, in 2006, was identified for the first time in Portugal, in vines, in the Amares region, despite its vector had been already identified in 1998 in Arcos de Valdevez and, in 1999, in Vila Real. There were also positive results of FD in the vector, in specimens collected in the Portuguese northern region, between 2001 and 2003. Currently, Portugal has defined nine priority intervention zones (ZIP’s – Zonas de Intervenção Prioritária) to deal with this problem.
This work was accomplished accompanying the official prospection of the FD in the ”Região dos Vinhos Verdes”, following the “National Action Plan for the Grapevine Favescence dorée Control (PAN-FD)” and the main objective was to know the situation regarding the Grapevine Flavescence dorée problem and its vector, in 2013, in the Santo Tirso county, where, until 2013, the phytoplasma has not been detected, although S.
titanus has been detected by the Entre-Douro and Minho Warning Station in previous
years, the first time being in 2008.
Weekly monitoring of the vector insect were done, as well as to the symptomatology of the grapevines that apparently (according to previous year’s registers), were infected with the FD phytoplasma, elaborating an evolutionary photographic file in CD. These observations were performed in the three grapevine white varieties recommended by the Viticulture Commission of the ”Região dos Vinhos Verdes” (CVRVV) for the Ave sub-region: Loureiro, Arinto and Trajadura.
Due to the symptomology observed, six samples of six grapevines suspected of being infected with FD were collected and sent to the Laboratory of the National Institute for the Agrarian and Veterinary Investigation (INIAV), in Lisbon (and afterwards, to the Laboratory of the Areeiro Phytopathologic Station in Pontevedra, Spain) for confirmation of the field diagnosis. The results, of both laboratories, were negative for the six grapevines regarding the FD and “Bois noir” (BN) phytoplasmas. According to these results, and due to the symptomology on the leaves of the six grapevines in observation, on Laboratory of Phytopathology of the University of Tras-os-Montes and
Alto Douro (LabFitoUTAD) a Double Antibody Sandwich – Enzyme Linked Immunosorbent Assay (DAS-ELISA) test was performed in order to diagnose
Grapevine leafroll associated virus 3, GLRaV-3, being the results all positive. This
situation indicates that the field diagnosis of FD (and/or BN) is not easy, due to the occurrence of other factors (other infectious diseases, deficiencies / toxicities, physiological disorders, etc) with some symptoms being identical to the ones of FD.
Concerning the monitoring of S. titanus, visual observations were done aiming to identify the nymphs, and yellow sticky traps were used to identify adults, being these monitorizations done by grapevine variety, being the results suggestive of different behavior of the insect depending on the variety and place. However, these results should be treated with care due to the significant variability of the conditions and more studies oriented towards this thematic should be conducted.
During the accompaniment of the official prospections of S. titanus in Quinta do Ameal, in Ponte de Lima, in grapevines with evident FD symptoms and wood diseases, several wood fungi were isolated, confirming that these vines, most likely affected with both FD and wood diseases, present a reduced or null production and shorter life time.
Therefore, it is necessary to define a protection strategy for this phytosanitary problem, in order to practice a sustainable viticulture.
1. Introdução
A Flavescência dourada da videira (FD) é uma doença parasitária da videira causada por um fitoplasma do grupo ribossomal 16SrV-C ou 16SrV-D e é eficientemente transmitida pelo inseto vetor Scaphoideus titanus Ball. É uma doença de quarentena na Europa, mencionada na Lista A2 da OEPP-EPPO (Organização Europeia e Mediterrânea da Proteção das Plantas) e no Anexo IIAII da Diretiva nº 2000/29/CE do Conselho, de 8 de maio de 2000.
Desde a primeira deteção da FD em Portugal que as entidades oficiais têm tentado controlar a dispersão da doença. Assim, anualmente, por despacho do diretor-geral da Direção Geral de Alimentação e Veterinária (DGAV) são publicados no Diário da Republica (2ª serie) a lista dos concelhos, e respetivas freguesias, onde foi registada a presença do fitoplasma da FD assim como a lista dos concelhos, e respetivas freguesias, onde foi detetado o inseto Scaphoideus titanus. Estas listas são disponibilizadas na página web da DGAV (www.dgav.min-agricultura.pt), nas páginas web das Direções Regionais de Agricultura envolvidas, e que atualmente são a DRAPN (www.drapn.min-agricultura.pt/) e a DRAPC (www.drapc.min-agricultura.pt) e são também afixadas por edital nas câmaras municipais e juntas de freguesia afetadas.
Este trabalho inseriu-se no âmbito da prospeção da FD na Região dos Vinhos Verdes, coordenado pela DRAPN nomeadamente pela Delegação Regional do Entre Douro e Minho, e decorreu no concelho de Santo Tirso, onde até 2012, não tinha sido detetada a presença do fitoplasma da FD.
Assim, o primeiro objetivo do nosso trabalho foi acompanhar as prospeções oficiais e, caso houvesse sintomas da doença, as amostras recolhidas seriam enviadas, sob coordenação da mesma delegação, para o laboratório oficial do INIAV (LabINIAV) e efetuaríamos o estudo da evolução dos mesmos durante a primavera-verão de 2013 recorrendo à fotografia (vide CD em Anexo).
Um segundo objetivo do trabalho foi efetuar a monitorização das ninfas e adultos de
S.titanus para analisar a sensibilidade das castas recomendadas no concelho de Santo
No decorrer do trabalho, só muito tardiamente tivemos acesso aos resultados das videiras enviadas para o diagnóstico oficial e verificámos que as videiras suspeitas de infeção por FD, não estavam infetadas por FD nem por BN (o fitoplasma “Bois noir”); então, e como a sintomatologia encontrada poderia resultar de infeção pelo Vírus do enrolamento foliar da videira, tipo 3 (GLRaV-3, Grapevine leafroll associated virus 3), realizámos o diagnóstico laboratorial para este vírus, constituindo assim o terceiro objetivo do nosso trabalho.
Por fim, o quarto objetivo foi o acompanhamento no isolamento de fungos do lenho de videiras supostamente infetadas por FD, trabalho também em curso nos últimos anos na Delegação Regional do Entre-Douro e Minho da DRAPN.
Pretendemos assim ajudar na problemática do complexo FD/S. titanus no concelho de Santo Tirso e contribuir para a sustentabilidade da viticultura na região.
2. Estado da Arte
2.1. A Flavescência dourada da videira
A Flavescência dourada da videira (FD) é uma doença parasitária da videira cujo agente causal é nacionalmente referido como “Grapevine flavescence doreé phytoplasma” (DGAV, 2013) e é eficientemente transmitida pelo inseto vetor Scaphoideus titanus Ball (Bertaccini & Duduk, 2013; Quartau et al., 2001). É uma doença de quarentena na Europa, o que significa que o fitoplasma é um organismo prejudicial e a sua dispersão pelos estados membros está sob vigilância e por isso está mencionado na Lista A2 da OEPP-EPPO e no Anexo IIAII da Diretiva nº 2000/29/CE do Conselho, de oito de maio de 2000, que contem a lista de organismos prejudiciais cuja introdução e dispersão nos estados membros é proibida quando estiverem presentes em certos vegetais ou produtos vegetais (DGAV, 2013).
Os custos inerentes ao fitoplasma da FD estão associados a uma menor produção, ao controlo químico obrigatório do inseto vetor, à renovação das videiras infetadas e à baixa produtividade nos primeiros anos das videiras que foram substituídas. Esta doença apresenta um grande impacto na economia local e nacional nomeadamente na intervenção governamental (Belli et al., 2010, citado por Chuche & Thiery, 2014).
Inicialmente pensava-se que os sintomas que hoje são atribuídos aos fitoplasmas, nomeadamente os “yellows” (“amarelos”) e “witches broom” (“vassoura de bruxa”), correspondiam a uma sintomatologia de uma planta normalmente infetada por vírus (Hogenhout et al., 2008), mas a sistemática presença destes organismos de estrutura arredondada no floema das plantas sintomáticas e a sua ausência no floema em plantas sãs, observados por microscopia eletrónica, permitiu a sua identificação e verificou-se que eram semelhantes aos patogéneos animais conhecidos por micoplasmas (Doi et al., 1967, citado por Borges, 1975). Face a esta semelhança estes organismos parasitas de plantas tomaram então a designação de MLOs (“Micoplasma Like Organisms”) mas, em 1994, no 10º Congresso da Organização Internacional de Micoplasmologia a designação MLOs foi substituído pelo termo fitoplasma atribuído pelo “Phytoplasma Working Team” (Hogenhout et al., 2008). A partir de 2004, foi proposto que os fitoplasmas se agrupassem no género “Candidatus phytoplasma” podendo estes serem considerados como novos “Candidatus phytoplasma” se a semelhança na sequenciação
do gene 16Sr DNA for inferior a 97,5% comparado com outros “Candidatus phytoplasma” já identificados. Caso essa semelhança for superior ou igual a 97,5% ainda é possível considerar uma nova espécie de “Candidatus phytoplasma”(“Ca. P”) no entanto para além da sequenciação do gene 16Sr DNA é necessário utilizar outros marcadores moleculares, excluindo o 16Sr DNA, estudar a especificidade de anticorpos, hospedeiros, mecanismos de transmissão e vetor (Bertaccini & Duduk, 2013; Seemüller & Schneider, 2004). No género “Ca. P”, estão caraterizadas várias espécies, como por exemplo “Ca. P. mali” para a doença Apple proliferation, “Ca. P. pyri” para a doença Pear decline e, embora ainda não publicado oficialmente, “Ca. P. vitis” para a doença Flavescence dorée e “Ca. P. solani” para a doença Bois noir (Bertaccini & Duduk, 2013). No entanto, como ainda há muitas dúvidas em relação à espécie “Ca. P. vitis” é mais correto, por enquanto, não referir nenhum nome científico para o agente causal da FD e referir apenas que a doença da FD é causada por um fitoplasma do grupo ribossomal 16SrV-C ou 16SrV-D (com. pess. Assunta Bertaccini, em Fevereiro de 2014). Atualmente a viticultura europeia está perante duas doenças causadas por fitoplasmas: a Flavescência dourada da videira (FD) causada por estirpes de fitoplasma do grupo “elm yellows” (grupo 16SrV) (Angelini et al., 2003) e o Bois noir (BN) causado por “Candidatus Phytoplasma solani” (grupo 16SrXII) (Quaglino et al., 2013).
Os fitoplasmas foram englobados no Reino Bacteria, Filo Tenericutes e Classe Mollicutes (Lee et al., 2000; Woese et al., 1990). São organismos procariontes unicelulares, despromovidos de parede celular o que faz com que não apresentem uma forma definida (são pleomórficos) e por outro lado são organismos resistentes à penicilina e sensíveis aos antibióticos do grupo das tetraciclinas. Apresentam um diâmetro entre os 450 a 500 nm o que lhes permite ultrapassar poros entre esse tamanho (Marques, 2011; Bertaccini, 2007). Apesar de serem parasitas obrigatórios do floema das plantas já foi recentemente possível a sua cultura fora do hospedeiro (Contaldo et al., 2012).
Inicialmente as doenças provocadas por fitoplasmas eram detetadas através da observação de material infetado ao microscópio eletrónico e o fitoplasma era classificado de acordo com a sintomatologia da planta infetada, com os géneros ou espécies vegetais que poderiam ser infetados e a relação com o inseto vetor (Lee et al., 2000). Face ao elevado custo do equipamento e à exigência de mão-de-obra
especializada, este método passou a ser inviável para a deteção dos fitoplasmas visto que esta técnica não os identifica pelo facto de não os diferir morfologicamente (Barros, 1997). Foi graças à aplicação de técnicas associadas à biologia molecular (aplicação de marcadores moleculares, RFLP e sequenciação nucleotída dos produtos de PCR) que se procedeu à classificação dos fitoplasmas em que os genes ribossomais 16S e 23S são utilizados como marcadores moleculares (Guttel et al., 1994).
Em torno da célula do fitoplasma está presente uma membrana plasmática com três camadas sobrepostas (trilaminar) que substitui a parede celular com uma espessura aproximada de 10 nm constituída com 2/3 de proteínas e 1/3 de lípidos como é normal nos procariontes. No citoplasma está presente uma molécula circular de DNA, ribossomas para a síntese de proteínas e também foi descoberto DNA extracromossómico (Nishigawa et al., 2002). O genoma dos fitoplasmas é de reduzida dimensão pelo facto dos genes estarem bastante concentrados (Bai et al., 2006; Gundersen & Lee, 1996; Neimark & Kirkpatrik, 1993). Utilizando estudos serológicos e moleculares descobriu-se que os fitoplasmas possuem um gene que codifica uma proteína de membrana, proteína essa presente na superfície externa da célula, que é específica para cada tipo o que poderá explicar a interação entre o fitoplasma e o seu hospedeiro (Norton et al., 2003).
Como já foi referido, os fitoplasmas para sobreviverem e multiplicarem-se necessitam de um hospedeiro podendo este ser animal (inseto vetor) ou vegetal. Nas plantas, estes organismos foram encontrados em plantas infetadas localizados sobretudo no floema, quer nos tubos crivosos quer nas células novas do floema visto que o seu tamanho permite a transposição do fitoplasma através dos poros da célula. Por outro lado já foi encontrado DNA do fitoplasma em tecidos embrionários de plantas o que sugere a possível migração do patogéneo à semente, no entanto esta situação ainda não foi comprovada (Cordova et al., 2003). A presença deste organismo nas plantas causa impactos económicos elevados e importantes num diverso número de espécies, nomeadamente na videira. O fitoplasma da FD que causa restrições no seu cultivo em determinadas localidades do mundo em que as perdas de produção e de qualidade poderão ser parciais ou totais. Por outro lado as plantas infetadas exibem uma sintomatologia típica (Lee et al., 2000), nomeadamente os amarelos (“dourados”), que através do estudo do DNA ribossómico foi possível a identificação dos diversos
fitoplasmas concluindo que estes se encontram distribuídos de acordo por áreas geográficas (Caudwell & Martelli, 1993). O fitoplasma da FD faz com que os tubos crivosos da videira fiquem bloqueados e, consequentemente, os produtos resultantes da fotossíntese não chegam aos locais de consumo (sink) nem se acumulam para reservas levando a uma forte diminuição na produtividade, debilitando a videira progressivamente podendo mesmo leva-la à morte em três anos (Barrios et al., 1998; Rahola et al., 1997).
Em videira, a primeira doença a ser relacionada com os “amarelos” provocados por fitoplasmas foi a “Flavescence dorée” em 1949, em Armagnac, no sudeste de França (www.inra.fr). Hoje em dia a doença já está dispersa por outros países da Europa nomeadamente Itália, Espanha, Sérvia, Portugal, Suíça, Áustria, Eslovévia, Croácia (Sousa, 2014), na Hungria apenas foi detetado o inseto vetor (Dér et al., 2007). Está classificada como uma doença epidémica, propagando-se rapidamente pela vinha, devido ao auxílio do cicadelídeo Scaphoideus titanus ou por material de propagação infetado. É de notar que o material de propagação vegetativa, nomeadamente os porta-enxertos, não exibem sintomas o que propicia a dispersão da doença (Sousa et al., 2013). Uma vez que a videira seja infetada permanece para todo o seu período de vida (Sousa, 2014).
O fitoplasma associado à doença da FD está atualmente classificado no grupo 16SrV dividindo-se em dois sub-grupos: 16SrV-D (FD-D) e 16SrV-C (FD-C) sendo estes os mais presentes na Europa (Bertaccini & Duduk, 2013; Martini et al., 1999). Até ao momento só foi identificado em Portugal o sub-grupo FD-D em Vitis vinifera cv. Loureiro e cv. Vinhão da região de Amares (Sousa et al., 2010). Para a deteção deste fitoplasma foram utilizadas as técnicas de PCR (Polymerase Chain Reaction) e RFLP (Restriction Fragment Lenght Polymorphism), em que se utilizaram os “primers” universais P1/P7 com a finalidade da amplificação do gene ribossomal 16Sr DNA. De seguida utilizaram os “primers” universais R16 F2/R2 e por último os “primers” específicos do grupo V ou seja R16(V) F1/R1 prosseguindo-se a eletroforese em gel de agarose a 1%.; para a identificação do frupo dos fitoplasmas presentes nas amostras positivas foi utilizada a técnica de RFLP com as enzimas de restrição AluI e TaqI permitindo a confirmação do fitoplasma e a identificação do sub-grupo FD-D (Sousa et al., 2010; Sousa et al., 2007).
Em Portugal, a colheita das amostras para a confirmação oficial do fitoplasma da FD (análise laboratorial) realiza-se de acordo com o estabelecido no PAN-FD publicado pela DGAV do atual Ministério da Agricultura, Mar e Ordenamento do Território (DGAV, 2013).
É de salientar que os mesmos sintomas em videira podem ser provocados por diferentes fitoplasmas (Sousa et al., 2013). Os sintomas associados à FD amplamente documentados por vários autores (por exemplo DGAV, 2013; Sousa et al., 2013; Pearson & Goheen, 1988; Caudwell & Larrue, 1986, citado por Carlos et al., 2004; Caudwell, 1981, citado por Carlos et al., 2004) são mais notórios durante o verão dentro dos quais se destacam: abortamento de gomos folheares e florais, inflorescências raquíticas, folhas mais pequenas, queda antecipada da folha com ou sem pecíolo, os lançamentos secam a partir do ápice vegetativo, o amarelecimento (“dourados”) das folhas nas castas brancas ou o avermelhamento nas castas tintas com enrolamento para a página inferior em forma de triângulo, a folha também adquire uma consistência mais quebradiça e pode ocorrer manchas amareladas ou avermelhadas delimitadas pelas nervuras que mais tarde podem necrosar. Entre os estados fenológicos floração– vingamento verifica-se o secamento das inflorescências (caem ao toque) e mais tarde nos cachos observa-se a murchidão e secamento dos mesmos que pode ser parcial ou total. Os pâmpanos apresentam um mau atempamento o que leva a um porte prostrado dos mesmos (porte “chorão”). As folhas podem ficar agarradas até mais tarde. Consequentemente a videira é afetada levando a um menor vigor, a menores produções e a uma qualidade das uvas mais reduzida devido às baixas concentrações de açúcares face à elevada acidez conduzindo à morte das videiras (DGAV, 2013; Sousa et al., 2013). A produtividade pode ser reduzida para metade e a diminuição da qualidade deve-se à redução da atividade fotossintética e transporte dos fotoassimilados (Credi, 1989, citado por Chuche & Thiery, 2014). As videiras na presença deste fitoplasma podem morrer ou recuperar, no entanto, caso recuperem são menos produtivas (Boudon-Padieu, 2000, citado por Chuche & Thiery, 2014; Credi, 1989, citado por Chuche & Thiery, 2014). A identificação de videiras contaminadas nem sempre é simples, pois depende do ano e das castas podendo a sintomatologia ser detetada antes do verão (www.flavescencedoree.jimdo.com). Para que esta seja “confirmada” em campo, três sintomas têm de estar simultaneamente presentes nomeadamente: a mudança de cor nas folhas (amarelos nas castas brancas e vermelhos nas castas tintas), o não atempamento
do pâmpano e a morte das inflorescências/cacho (Fig. 1). Por vezes, as dificuldades no diagnóstico ainda aumentam visto que a planta pode ser assintomática, os sintomas nem sempre aparecem todos num ano, nem em anos consecutivos, e podem estar localizados apenas num ramo. As diferentes castas não apresentam a mesma sensibilidade ao agente patogénico e a manifestação dos sintomas não é de igual intensidade. Os porta-enxertos muitas vezes são híbridos de várias espécies de Vitis americanas não apresentando sintomas, no entanto são portadores da doença (www.inra.fr). Por outro lado, existem outros fitoplasmas, nomeadamente o BN, que induzem os mesmos sintomas da FD e perante esta situação a identificação será só por testes moleculares (nested PCR e PCR) (www.inra.fr). A coloração manifestada nas folhas nem sempre é uniforme de casta para casta e até mesmo dentro da mesma casta, apesar de nas castas tintas o avermelhamento ser mais notório devido ao contraste com as restantes folhas verdes e o enrolamento foliar é mais ou menos intenso dependendo da casta bem como o não atempamento das varas (www.flavescencedoree.jimdo.com). Sousa, (2014) refere que os porta-enxertos não manifestam sintomas, no entanto de acordo com um grupo de trabalho para a FD de várias entidades francesas (Anónimo, 2006), observaram-se sintomas em condições experimentais nos porta-enxertos Riparia Gloire, 101-14 Mgt, 420 A, 5 C, SO 4, 110 R e 140 Ru quando estes foram inoculados com S. titanus infetados com o fitoplasma; no mesmo ensaio os porta-enxertos Rupestris du lot, 5 BB, 125 AA, 1103 P, 41 B e Gravesac não demonstraram sintomas e a técnica para visualizar se o porta-enxerto estava infetado consistiu em enxertar o enxerto numa casta sensível e se o porta-enxerto tiver infetado irá demonstrar os sintomas na casta enxertada (técnica de indexagem em hospedeiros lenhosos). Apesar dos porta-enxertos não manifestarem sintomas, esta ausência não significa que não possam ser considerados como uma fonte de inóculo. A expressão dos sintomas dá-se, pelo menos, um ano após a contaminação da cepa; perante esta situação se existirem populações de S. titanus a disseminação do fitoplasma pode ser extremamente elevada. Por isso o controlo do inseto vetor é um eixo importante na regressão da dispersão da doença (Constant & Lernould, 2014).
Fig. 1 – Alguns dos sintomas provocados pelo fitoplasma da Flavescência dourada da videira na casta Loureiro (setembro de 2014).
Por curiosidade, é de referir que Lafon et al., (1966), citados por Gomes 2000, verificaram que o míldio da videira não se consegue desenvolver em folhas onde a FD esteja presente, apesar dos zoósporos conseguirem germinar; esta situação é possivelmente explicada pelo aumento dos produtos originados da fotossíntese que ficam acumulados na folha devido ao bloqueio do floema pelo fitoplasma aumentando assim a pressão osmótica que é superior à do micélio impedindo que este se desenvolva.
2.2.
O vetor da Flavescência dourada da videira
A doença da Flavescência dourada da videira é dispersa a longas distâncias, através de material vegetativo infetado (DGAV, 2013; Sousa et al., 2013) mas a curtas distâncias é também dispersa eficientemente pelo seu vetor, Scaphoideus titanus Ball durante o processo de alimentação (Mori et al., 2002), sendo este o principal vetor conhecido da FD (www.inra.fr). Este inseto pertence à família Cicadellidae (vulgarmente designados por cigarrinhas) cuja origem remete para as videiras selvagens (Vitis labrusca) da região dos grandes lagos da América do Norte. Esta cigarrinha terá sido introduzida na Europa, nomeadamente em França por volta dos anos 50 do Séc. XX através de material vegetal portador de ovos de inverno (Constant & Lernould, 2014; Papura et al., 2012; Olivier et al., 2011). Na década de 60 do Séc. XX, o vetor da FD foi encontrado em outras vinhas francesas e europeias (Vidano, 1964) e atualmente estende-se por vários países da Europa. Está identificado em Itália (Vidano, 1964), Suíça (Baggiolini et al., 1968),
Ricardo Machado Ricardo Machado
Eslovénia (Seljak, 1987, citado por Dér et al., 2007), Espanha (Batlle et al., 1997), Hungria e Sérvia (Magud & Tosevski, 2004) e Áustria (Zeisner, 2005, citado por Dér et al., 2007). Em Portugal o cicadelídeo da FD foi mencionado pela primeira vez de material recolhido, em 1998, nos Arcos de Valdevez e, em 1999, em Vila Real (Quartau et al., 2001).
A introdução de S. titanus na Europa, nomeadamente em França, pode estar associada à crise da filoxera e míldio, quando se importaram grandes quantidades de material vegetal da América do Norte, maioritariamente antes de 1930 (Granett et al., 2001, citado por Chuche & Thiery, 2014; www.inra.fr). No sudoeste de França foi realizado um viveiro de multiplicação vegetativa desse material (Carton et al., 2007, citado por Chuche & Thiery, 2014). O material vegetal americano continha ovos de S. titanus e provavelmente foi todo importado da mesma região do norte dos Estados Unidos sendo este o fator chave para a dispersão da doença pela França e Europa (www.inra.fr). S.
titanus é o grande responsável pela rápida disseminação da FD quer na França quer pela
Europa (www.inra.fr).
Estudos realizados às caraterizações genéticas de S. titanus americanos e europeus, revelam que na Europa existe um haplótipo o que significa que as populações europeias descendem de uma única introdução dos Estados Unidos e que a região vitícola da costa leste norte americana é a origem provável das populações europeias de S. titanus (Papura et al., 2012; Papura et al., 2009, citado por Chuche & Thiery, 2014; www.inra.fr). A disseminação do vetor pela Europa deve-se à dispersão do inseto, e não por novas introduções, estando relacionado com a comercialização de material vegetal infestado com ovos do inseto para as novas plantações visto que a capacidade do adulto se movimentar na vinha é reduzida (25 a 30 m) (Papura et al., 2009, citado por Chuche & Thiery, 2014). Devido a esta fraca mobilidade na vinha o vento é um fator crucial na dispersão do inseto (Compton, 2002, citado por Chuche & Thiery, 2014) havendo referência de que os adultos se podem deslocar até 30 km (Constant & Lernould, 2014; Roche, 2012; Rahola et al., 1997; Galet, 1995). Mas, a expansão de S. titanus ainda não terminou; Steffek et al., (2007) prevêem que populações de S. titanus podem estabelecer-se em regiões vitícolas no nordeste europeu, e mesmo até na China, face às condições climáticas favoráveis (Steffek et al., 2007, citados por Chuche & Thiery, 2014).
Segundo Cook et al., (2008), citados por Chuche & Thiery, 2014, a capacidade de um vetor conseguir transmitir uma doença está relacionada com cinco variáveis sendo esta adaptada à relação FD/S. titanus dando origem à seguinte fórmula: em que “V” é a capacidade que o vetor apresenta para transmitir a doença, “m” é a quantidade de vetores (dimensão da população), “a” representa a probabilidade do S. titanus se estar a alimentar numa planta infetada, “p” a probabilidade da sobrevivência do vetor e
a longevidade do vetor após o período de incubação. Quanto maior for a diversidade de hospedeiros maior é a capacidade vetorial. A capacidade vetorial também está relacionada com os comportamentos alimentares, condições ambientais e inimigos naturais (Daugherty et al., 2010, citados por Chuche & Thiery, 2014). Intervindo na biologia e comportamento de S. titanus é possível afetar a capacidade vetorial em alternativa ao controlo inseticida utilizando assim medidas de controlo mais sustentáveis.
Por enquanto, S.titanus está limitado geograficamente, sendo o limite Norte o norte de Bourgogne, em França (Boudon-Padieu, 2003, citado por Carlos et al., 2004) devido ao verão ser demasiado curto impedindo que os adultos se desenvolvam até à postura (Caudwell, 1981, citado por Carlos et al., 2004) e o limite Sul o norte de Portugal e as comarcas catalãs, situadas a uma latitude de 41ºN, (Carlos et al., 2004) em que a suavidade dos invernos não estabelece uma boa diapausa dos ovos (Caudwell, 1981, citado por Carlos et al., 2004).
A monitorização de S. titanus é realizada recorrendo a quatro técnicas principais: contagem das ninfas na página inferior das folhas, técnica das pancadas, utilização de um aparelho de sucção, por exemplo D vac, e armadilhas cromotrópicas, sendo estas duas últimas técnicas utilizadas preferencialmente para adultos por estes se movimentarem mais rápido do que as ninfas. O rigor destas técnicas é variável sendo por isso meramente indicativo. Segundo Bernard et al., (1988), citados por Chuche & Thiery, 2014, as ninfas não são observadas na página inferior da folha até três dias depois das chuvas. A eficácia das armadilhas cromotrópicas depende das condições meteorológicas (temperatura, vento e chuva) e densidade populacional.
Na captura de indivíduos a distinção entre sexos apresenta uma importância relativa, pois na totalidade dos indivíduos capturados os machos são os mais capturados (Lessio
et al., 2009b, citados por Chuche & Thiery, 2014; Bosco et al., 1997). O sexo de S.
titanus nas armadilhas varia com a localização e a época (dá-se uma maior captura de
machos no início da emergência de adultos e mais de fêmeas no final do ciclo) (Lessio et al., 2009b), pois os machos emergem primeiro e a longevidade é mais curta em relação à das fêmeas (Bressan et al., 2005). Por outro lado, os machos são mais ativos antes do acasalamento (Mazzoni et al., 2009) enquanto as fêmeas que acasalaram precisam de efetuar as posturas no final do ciclo.
A cor amarela da armadilha parece ser a mais atraente para as ninfas e adultos nas vinhas (Chuche et al., 2011, citados por Chuche & Thiery, 2014; Mazzoni et al., 2011, citado por Chuche & Thiery, 2014; www.inra.fr) apesar da cor vermelha atrair fêmeas em laboratório (Mazzoni et al., 2011, citado por Chuche & Thiery, 2014) e machos nas vinhas em estudo (Lessio & Alma, 2004). Esta atração poderá estar associada às folhas jovens em desenvolvimento cujo teor de azoto é mais elevado, logo apresentam um valor nutricional mais elevado para o inseto (www.inra.fr). Por outro lado a atração a estas cores, ou seja, por videiras infetadas com coloração nas folhas, é fundamental para a propagação da FD (www.inra.fr).
A posição da armadilha também tem efeito nas capturas, pois a colocação da armadilha na horizontal, nas folhas ou por baixo das videiras permite uma maior captura deste cicadelídeo em relação à vertical (Jermini et al., 1992, citado por Chuche & Thiery, 2014).
Em Portugal, desde 2001 e até à data, está em curso um programa de prospeção do cicadelídeo e do fitoplasma realizado pelas Direções Regionais de Agricultura e Pescas sob coordenação da DGAV com a colaboração do INIAV (DGAV, 2013). Tem-se verificado a dispersão do inseto para sul e interior a partir do noroeste do país (DGAV, 2013). Em 2008, foi detetado S.titanus na região centro no concelho da Mealhada (DRAPC, 2009) onde se tem verificado um aumento da sua dispersão quer para novas freguesias quer para novos concelhos (DRAPC, 2012). Actualmnete, o ponto mais a sul onde se verifica a presença do vetor da FD é em Coimbra na freguesia de S. João do Campo (Sousa et al., 2013). Em 2010, foi detetada a sua presença pela primeira vez na ilha da Madeira, e em 2011, essa prospeção foi alargada a toda a ilha e verificaram que
S. titanus estava presente nos três concelhos mais a norte (DGAV, 2013). A partir de
vetor da FD e foram identificadas novas freguesias nas regiões do Douro e Trás-os-Montes com a presença do cicadelídeo (Mesquita, 2014) o que significa que a dispersão do cicadelídeo tem aumentado. Em 2011 a prospeção obrigatória para além de ser realizada em vinhas de produção foi alargada a viveiros e campos de pés-mãe (Mesquita, 2014).
S. titanus, sendo um hemíptero, apresenta uma armadura bucal picadora-sugadora
alimentando-se da seiva que circula nas nervuras das folhas. Tem como principal hospedeiro a videira (espécie monófaga), motivo pelo qual a doença se transmite rapidamente de videira para videira, e apresenta uma geração anual (monovoltina) (www.inra.fr). Apresenta hábitos crepusculares ou notívago e por conseguinte a sua maior atividade de voo é entre o final da tarde e o início da manhã (Lessio & Alma, 2004b, citado por Chuche & Thiery, 2014). Esta atividade depende principalmente do fotoperíodo e da humidade relativa que apresentam um carater negativo correlacionado com o voo (Lessio & Alma, 2004b, citado por Chuche & Thiery, 2014).
A cigarrinha da FD, nome como é vulgarmente conhecido S. titanus, hiberna sob a forma de ovo. As fêmeas põem os ovos no final do verão, isolados ou em grupos, com uma estimativa entre 10 a 15 ovos podendo atingir os 20, (Eriksson et al., 2012; Xavier, 2008; Vidano, 1964; www.inra.fr), sob o ritidoma em madeira com dois ou mais anos (Bagnoli & Gargani, 2011, citado por Chuche & Thiery, 2014; www.inra.fr), eclodindo por volta do mês de maio (durante a primavera, início de verão) e dura cerca de um mês e meio até três meses dependendo das temperaturas de inverno e da primavera (Constant & Lernould, 2014). Para que a diapausa quebre não é necessário temperaturas muito baixas (Chuche & Thiéry, 2012; www.inra.fr). As eclosões parecem variar com a altitude, latitude e as condições que ocorreram durante o ano na vinha e ocorrem durante um período de tempo mais ou menos longo (Caudwell et al., 1974, citado por Chuche & Thiery, 2014) sendo característico em locais onde a temperatura de inverno é amena (Boubals & Caudwell, 1971, citado por Chuche & Thiery, 2014) podendo-se encontrar ninfas no primeiro estado de desenvolvimento e adultos. No processo de acasalamento, os machos e as fêmeas comunicam através de vibrações e não através de compostos voláteis (Mazzoni et al., 2009b, citado por Chuche & Thiery, 2014). Os machos, após um dia do estado adulto, conseguem emitir sinais vibratórios enquanto que as fêmeas podem demorar cerca de seis dias a atingir a maturidade sexual e por
conseguinte emitir vibrações (Mazzoni et al., 2009). As vibrações, realizadas por uma membrana situada no abdomén, são descontínuas no macho enquanto que as da fêmea são contínuas e esta apenas emite a vibração quando capta a do macho. O pico das vibrações verificam-se ao fim da tarde e início da noite e têm uma frequência inferior a 900 Hz. (Mazzoni et al., 2009). A vibração de chamamento da espécie é específica e caso uma fêmea estiver disponível estabelece-se um diálogo vibratório (Mazzoni et al., 2009c, citado por Chuche & Thiery, 2014; www.inra.fr). O período de acasalamento pode durar entre 40 a 70 min, no entanto, a fêmea apenas acasala uma vez enquanto o macho pode acasalar várias vezes (Mazzoni et al., 2009c, citado por Chuche & Thiery, 2014; Lucchi et al., 2004, citado por Chuche & Thiery, 2014). A sua atividade sexual é maior entre as 18h e as 20h (Mazzoni et al., 2009c, citado por Chuche & Thiery, 2014). A intensidade, o comprimento de onda e a frequência das vibrações da fêmea, comunica ao macho a sua localização e recetividade (www.inra.fr). Caso exista um outro macho por perto de um casal de S. titanus, este pode interromper a comunicação vibratória entre estes e/ou aproximar-se da fêmea recetiva, silenciosamente, e acasalar (Mazzoni et al., 2009c, citado por Chuche & Thiery, 2014).
Durante o período de acasalamento pode-se observar comportamentos de interrupção, competição e oportunismo (Mazzoni et al., 2009c, citado por Chuche & Thiery, 2014).
A transmissão do sinal realiza-se entre duas plantas vizinhas pelo ar e é realizado na margem entre duas camadas de folhas (Eriksson et al., 2011).
Os ovos são lisos, alongados, lateralmente achatados, por vezes ligeiramente arqueados e apresentam um comprimento entre 1-1,5 mm e 0,3 mm de largura com cor branca hialina a amarela (Roche, 2012; Xavier, 2008; Rahola et al., 1997; Galet, 1995).
Após a eclosão as ninfas procuram as folhas mais jovens para se alimentarem (DGAV, 2013; Caudwell & Larrue, 1986, citado por Carlos et al., 2004) e é tanto mais escalonada quanto mais amenas forem as temperaturas de inverno (Chuche & Thiéry, 2009) podendo-se prolongar entre seis (Galet, 1995; Rouzet et al., 1989) a oito semanas (Barrios et al., 1998). Outros autores mencionam que o início das eclosões ocorre em meados de maio e podem prolongar-se até meados de agosto (Frausin, 2000, citado por Chuche & Thiery, 2014). As temperaturas mais frias durante o inverno dão origem a uma eclosão mais precoce face aos invernos mais amenos (Chuche, 2010, citado por
Chuche & Thiery, 2014; Chuche & Thiéry, 2009; www.inra.fr), tendo assim uma importância no controlo das ninfas antes de estas ficarem infeciosas (www.inra.fr). As fêmeas apresentam uma sensibilidade maior do que os machos em relação às variações da temperatura durante o período invernal, o que significa que esta característica tem consequências no rácio de sexos após a eclosão (Chuche & Thiéry, 2012).
Após a eclosão, as ninfas, ápteras, desenvolvem-se ao longo de cinco instares para atingirem o estado adulto (Fig. 2) (Sousa et al., 2013; Xavier, 2008; Carlos et al., 2004), durante sete a oito semanas, em França (Rahola et al., 1997; Vidano, 1964; www.inra.fr) e entre cinco a sete semanas em Espanha (Rahola et al., 1997; www.inra.fr) e Itália (Vidano, 1964; www.inra.fr). São alongadas, inicialmente (nos dois primeiros estados de desenvolvimento) apresentam uma cor branco pérola com um comprimento entre 1,0 a 1,5 mm e no último estado ninfal já apresentam uma coloração amarela com manchas escuras irregulares e medem entre 4,5 a 5,0 mm de comprimento; em todos os estados ninfais apresentam dois pontos negros na extremidade posterior do abdómen, caraterística que as distingue das outras cigarrinhas, e possuem a capacidade de saltar (DGAV, 2013; Roche, 2012; Rahola et al., 1997). Nos dois últimos estados verifica-se o delineamento das asas devido às manchas irregulares (Blanc, 2000) e nas exúvias são visíveis os pontos negros no último segmento abdominal (Bagard, 1987). De um estado para o outro é realizada uma muda deixando a exúvia, quase sempre, fixada à folha (Bagard, 1987). As ninfas são relativamente pouco móveis e estão principalmente na base da parede vegetativa e saltam quando perturbadas (Constant & Lernould, 2014). Permanecem geralmente na videira em que eclodem (Maixner et al., 1993) mas a sua mobilidade permite-lhes deslocarem-se de videira em videira e alimentam-se, preferencialmente, de ramos “ladrões” quando não são removidos (Posenato et al., 2001, citado por Chuche & Thiery, 2014; Schvester et al., 1962b, citado por Chuche & Thiery, 2014). Segundo Bernard & Du Fretay, (1988), citado por Chuche & Thiery, 2014, a mortalidade das ninfas é elevada entre o primeiro e o terceiro instar.
Fig. 2 – Diferentes estádios ninfais e adulto de Scaphoideus titanus (Fonte: adaptado de ADVID).
Os adultos apresentam um corpo afunilado, alongado de cor amarelo-acastanhado cujas fêmeas medem entre 5,0 a 5,6 mm de comprimento e os machos entre 4,8 a 5,2 mm. As asas anteriores são acastanhadas, as nervuras são castanhas-escuras bem como as manchas e estão dispostas sobre o abdómen em forma de telhado (Fig. 3). Têm uma grande mobilidade, se auxiliados pelo vento, podendo alcançar uma distância de 30 Km e na cabeça das fêmeas são visíveis três faixas transversais acastanhadas enquanto o macho apenas tem uma (Constant & Lernould, 2014; DGAV, 2013; Roche, 2012; Rahola et al., 1997; Galet, 1995).
Os primeiros adultos surgem em fins de junho com o máximo populacional entre meados de julho a meados de agosto prolongando a sua curva de voo até finais de outubro variando de região para região (Constant & Lernould, 2014; Lessio & Alma, 2004). Após 10 dias do surgimento dos adultos, atingem a maturidade sexual, acasalam, e alguns dias depois as fêmeas fazem as posturas (Galet, 1995; Schvester et al., 1962b, citado por Chuche & Thiery, 2014; www.inra.fr) entre os meses de agosto e setembro (Roche, 2012). Têm um tempo de vida aproximadamente de um mês (Schvester et al., 1962b, citado por Chuche & Thiery, 2014; www.inra.fr).
Todos os instares preferem as partes mais basais e protegidas da parede vegetativa, no entanto também podem ser encontradas na parte superior (Bernard & Du Fretay, 1988, citado por Chuche & Thiery, 2014).
O inseto apresenta uma maior atividade ao início da manhã e ao fim da tarde e regista pouco movimento durante horas de elevada intensidade luminosa e por outro lado a direção dos ventos dominantes interfere na dispersão da cigarrinha (DGAV, 2013; Torres, 2013)
Este cicadelídeo acarreta uma elevada importância visto que, apesar de não causar estagos diretos na videira; transmite o fitoplasma da FD, de videira para videira, de uma forma persistente e com caraterísticas epidémicas (Weintraub & Beanland, 2006, citado por Chuche & Thiery, 2014) causando estragos, e levando a prejuízos consideráveis. Entre 2007 e 2012, a nível nacional, foram arrancados cerca de 194 ha de vinha, oficialmente confirmadas com a doença (Mesquita, 2014; Sousa, 2014).
Na primavera, após a inoculação, o fitoplasma coloniza as folhas através do floema sendo assim uma fonte de inóculo para S. titanus (Schvester et al., 1969, citado por Chuche & Thiery, 2014). As plantas antes de manifestarem os sintomas (infeção recente) não apresentam qualquer risco para a dispersão da FD (Morone et al., 2007). Visto que existe uma elevada especificidade entre o patogénio e o seu vetor sendo uma forma de transmissão natural, a taxa de infeção no ano n está fortemente correlacionada com o tamanho da população do ano n-1 (Marone et al., 2007).
Sem qualquer tratamento inseticida a população de S. titanus pode atingir as dezenas de milhares de indivíduos por hectare (Schevester, 1969, citado por Chuche & Thiery,
2014) sendo por este motivo que a FD apresenta um caráter epidémico (EPPO/ Cabi, 1997, citado por Chuche & Thiery, 2014). No sudoeste de França a área infetada por FD aumentou de 60 ha em 1991 para 20 000 ha em 1993 (Pueyo et al., 2008, citado por Chuche & Thiery, 2014).
A deslocação de S. titanus na vinha depende da sua densidade populacional e da arquitetura da parede vegetativa (Lessio & Alma, 2004) sendo que estes dois fatores estão relacionados com o facto de S. titanus se movimentar preferencialmente ao longo da linha (Lessio et al., 2009a, citado por Chuche & Thiery, 2014). Estudos recentes baseiam-se na criação de modelos a nível espaço-temporal para perceber melhor a dinâmica do inseto e a epidemiologia da FD. S. titanus alimenta-se em vasos condutores das folhas nomeadamente no floema, bem como no xilema e parênquima (Carle & Moutous, 1965, citado por Chuche & Thiery, 2014). A perfuração da epiderme é feita entre duas células e a direção do estilete é aos tecidos vasculares podendo ser intra ou inter celular. As ninfas preferem alimentar-se em vasos condutores secundários da folha enquanto os adultos preferem alimentarem-se em tecidos vasculares principais ou nos pecíolos. Esta preferência alimentar pode estar relacionada com os estiletes das ninfas e dos adultos mas também com a pressão a que se encontra a seiva nos diferentes vasos condutores (Chuche et al., 2011b, citado por Chuche & Thiery, 2014).
O comportamento alimentar ainda é pouco conhecido porque dá-se no interior dos tecidos vegetais, podendo este ser aprofundado com a técnica de eletropenetrografia que permite o estudo dos processos fundamentais da alimentação dos insetos picadores-sugadores (Chuche et al., 2011b, citado por Chuche & Thiery, 2014; www.inra.fr).
O fitoplasma pode ser adquirido por S. titanus logo no primeiro instar em plantas infetadas (Boudon-Padieu et al., 1989; Schevester et al., 1969, citado por Chuche & Thiery, 2014) mas sendo necessário um período de tempo mínimo na alimentação para que este se torne infeccioso e quanto mais tempo durar o processo de alimentação maior é a probabilidade do vetor adquirir o fitoplasma na planta infetada (Purcell, 1982, citado por Chuche & Thiery, 2014). A aquisição do fitoplasma pode ser realizada nos primeiros instares mas a eficácia da aquisição é maior pelos instares mais velhos podendo ser explicado pelo aumento da concentração do fitoplasma no floema ao longo do ciclo vegetativo (Bressan et al., 2005b, citado por Chuche & Thiery, 2014) e pelas diferentes formas e comportamentos na alimentação. O comportamento alimentar, a
sensibilidade das castas (Bressan et al., 2005b, citado por Chuche & Thiery, 2014), a concentração do fitoplasma em castas tolerantes e sensíveis (Eveillard et al., 2012, citado por Chuche & Thiery, 2014; Bosco & Marrachi, 2011, citado por Chuche & Thiery, 2014) tem efeitos na eficiência da aquisição do fitoplasma (Bressan et al., 2005b, citado por Chuche & Thiery, 2014) sendo um fator chave na relação fitoplasma-vetor e consequentemente na epidemiologia da FD.
A cigarrinha da flavescência dourada tem preferência pelas folhas ensombradas situadas no interior da parede vegetativa. As ninfas dos primeiros instares estão mais presentes nas folhas da base, nomeadamente nos ramos ladrões, pelo facto do inseto procurar zonas mais frescas, e alimentam-se nas nervuras secundárias, enquanto as ninfas de quarto e quinto instares, e os adultos, para além das nervuras secundárias também se podem alimentar nas nervuras principais e até em varas não atempadas (DGAV, 2013; Vidano, 1964).
Após a aquisição, segue-se a incubação onde ocorre a multiplicação do fitoplasma em que este coloniza o corpo do vetor, desde o intestino do inseto, onde se multiplica aceleradamente, atravessa a parede intestinal alcançando a hemolinfa acabando por chegar às glândulas salivares onde continua a sua multiplicação, demorando cerca de um mês (período de latência), período a partir do qual a cigarrinha se torna infecciosa (Sousa et al., 2007; Boudoun-Padieu, 2000, citado por Chuche & Thiery, 2014; www.inra.fr) e uma vez infetada torna-se um inseto infeccioso até ao final do seu ciclo de vida (Christersen et al., 2005, citado por Chuche & Thiery, 2014; www.inra.fr). Logo que o fitoplasma atinja as glândulas salivares, é excretado juntamente com a saliva durante o processo de alimentação do inseto verificando-se a fase de inoculação da planta (Sousa, 2014; Schvester et al., 1969 citado por Torres, 2013; Sousa et al., 2007).
No inseto o fitoplasma multiplica-se no citoplasma das células do trato gastrointestinal, de seguida estas passam à hemolinfa colonizando todos os órgãos exceto as glândulas sexuais. Visto que os órgãos genitais nunca são atingidos pelos fitoplasmas explica o facto de estes não serem transmitidos aos ovos dando origem a ninfas saudáveis (DGAV, 2013; Roche, 2012; Xavier, 2008; Cousin, 1995). Verifica-se um aumento da concentração do fitoplasma na hemolinfa e de seguida nas glândulas salivares sugerindo que ou a hemolinfa é um local de reprodução tardio ou é colonizado por outros órgãos infetados (Lefol et al., 1994; 1993, citado por Chuche & Thiery, 2014). Após a