E
STUDO RETROSPECTIVO DA
E
STENOSE
A
ÓRTICA
NO
C
ÃO
Ana Cristina Gomes Coelho
Orientadora:
Professora Doutora Maria João Miranda Pires Co-Orientador:
Doutor Luís Lima Lobo
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO VILA REAL, 2010
“Temos que conhecer as origens, se queremos dizer que temos algo”
iii
RESUMO
A Estenose Aórtica (EA) é uma doença cardíaca congénita (DCC) caracterizada por uma obstrução parcial ao fluxo de saída ventricular esquerdo. Apesar de em alguns estudos EA ser referida como a terceira DCC mais diagnosticada no cão, a frequência com que este defeito tem sido identificado nas últimas duas década tem vindo a aumentar, surgindo como a DCC mais frequentemente observada em cães, em muitos hospitais veterinários. A forma de EA mais comum é a Estenose Subaórtica (ESA), que tem uma base hereditária em cães de raça Terra Nova, surgindo, no entanto, também frequentemente em outros cães de raça grande, como Boxers, Golden Retrievers e Rottweilers. Os sinais clínicos mais frequentes são a síncope, a intolerância ao exercício e a morte súbita. À auscultação, normalmente, detecta-se um sopro sistólico de ejecção com o seu ponto máximo de intensidade localizado na região cardíaca basilar esquerda. A ecocardiografia é de valor inestimável no diagnóstico e na classificação da gravidade da doença. O tratamento cirúrgico é limitado devido à perícia técnica e a custos que este implica. O prognóstico depende da gravidade da lesão. Este trabalho teve como objectivo estudar a EA, na sua índole epidemiológica e clínica em cães.
Neste estudo, fez-se uma análise retrospectiva das alterações cardiovasculares diagnosticadas a cães no serviço de ecocardiografia do Hospital Veterinário do Porto, entre Março de 2003 e Março de 2010. Assim, em 642 cães com alterações cardiovasculares, a prevalência de DCCs foi de 13.9%. A EA foi a DCC mais diagnosticada nesta população de animais (6.9%), surgindo em 44 dos 89 cães com DCCs (49.4%).
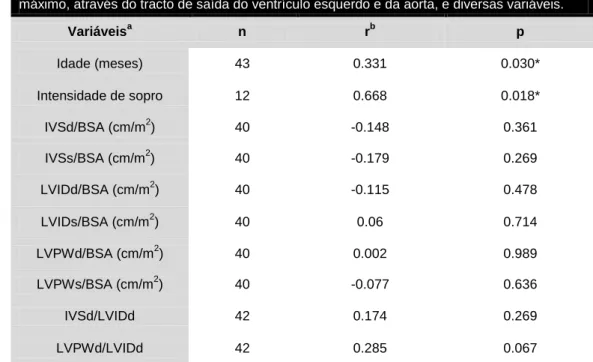
A forma de EA mais diagnosticada foi a subaórtica. A raça mais afectada por EA nesta população foi a Boxer, que apresentou um elevado risco relativo de apresentar esta alteração cardiovascular específica. O sexo masculino também foi especialmente afectado (70.5%). Neste estudo também se verificou existir uma correlação entre o gradiente de pressão sistólico máximo, medido entre o TSVE e a aorta, e a idade e a intensidade do sopro dos cães com EA.
A instauração de um programa de rastreio da EA em cães reprodutores, em Portugal, parece ser essencial de forma a se conhecer a verdadeira prevalência desta doença entre a população canina e a prevenir a sua ocorrência.
Palavras-chaves: Doenças cardíacas congénitas; Estenose Aórtica; cão; ecocardiografia; sopro sistólico.
iv
ABSTRACT
Aortic stenosis (AS) is a congenital heart disease (CHD) characterized by a partial obstruction of the left ventricular outflow. In some studies, AS is referred to be the third most diagnosed CHD in the dog, but the frequency of this defect has been growing in the last two decades, emerging as the most commonly observed CHD in dogs in many veterinary hospitals. The AS type most commonly described is the Subaortic Stenosis (SAS), that has a hereditary basis in the Newfoundland, but affects also other breeds such as Boxers, Golden Retrievers and Rottweilers. The clinical symptoms are syncope, exercise intolerance, and sudden death. Auscultation usually detects an ejection systolic murmur with its point of maximum intensity located in the left base of the heart. Echocardiography is invaluable in the diagnosis and classification of disease severity. The surgery treatment is limited due to technical expertise and cost. The prognosis depends on the severity of the injury. The aim of this work is the study of AS in dogs, in its clinical and epidemiology nature.
In this study, the archive of cardiovascular disorders diagnosed in dogs, over 7 years, by the echocardiography service of the Hospital Veterinário do Porto was reviewed. Of 642 dogs affected with cardiovascular disorders, the prevalence of CHD was 13.9%. AS was the most diagnosed CHD in this population affected with cardiovascular disorders (6.9%), affecting 44 of 89 dogs with CHD (49.4%).
In this study, SAS was the most commonly diagnosed form of AS. The race most affected by AS in this population was the Boxer, which showed a high relative risk of this specific cardiovascular disorder. The males were particularly affected (70.5%).
Correlations between the measured systolic maximum pressure gradient, between the LVOT and the aorta, and the age and the intensity of the murmur of dogs affected with AS were also found.
The introduction of a screening program of EA in breeding dogs in Portugal seems to be essential in order to determine the real prevalence of this disease among the dog population and prevent its occurrence.
v
ÍNDICE
1. Introdução ... 1
1.1. Doenças cardíacas congénitas ... 1
1.2. Estenose Aórtica ... 4
1.2.1. Definição ... 4
1.2.2. Tipos de Estenose Aórtica ... 4
1.2.3. Etiologia: embriologia e genética ... 7
1.2.4. Fisiopatologia ... 9 1.2.5. A natureza progressiva da EA ... 13 1.2.6. Diagnóstico ... 14 1.2.7. Tratamento ... 27 1.2.8. Prognóstico ... 29 1.2.9. Prevenção da doença ... 30 2. Objectivos ... 33 3. Material e Métodos ... 34
3.1. Animais admitidos ao estudo ... 34
3.2. Recolha de dados ... 34
3.3. Critérios ecocardiográficos usados para o diagnóstico e classificação da EA segundo a sua gravidade ... 35
3.4. Análise estatística ... 35
4. Resultados ... 37
5. Discussão ... 44
6. Conclusões ... 48
vi
ÍNDICE DE FIGURAS
Figura 1 - Radiografia torácica (projecção ventrodorsal) de um cão com Estenose Subaórtica evidenciando dilatação da raiz aórtica ... 19
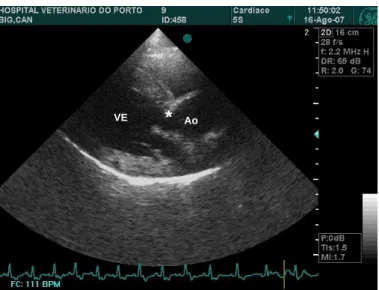
Figura 2 - Imagem ecocardiográfica do coração de um cão com Estenose Aórtica Subvalvular, em modo Bidimensional na projecção paraesternal direita, em eixo longo com aorta ... 20 Figura 3 - Imagem ecocardiográfica do coração em modo Bidimensional em projecção subcostal (a), e medição da velocidade do fluxo sanguíneo, na região supravalvular, com Doppler espectral pulsado (b), de um cão com Estenose Aórtica Supravalvular ... 24
Figura 4 - Gráfico circular representativo da distribuição percentual de 95 doenças cardíacas congénitas diagnosticadas, entre Março de 2003 e Março de 2010, numa população de 89 cães ... 38
vii
ÍNDICE DE TABELAS
Tabela 1: Classificação das doenças cardíacas congénitas no cão, de acordo com a sua fisiopatologia ... 2
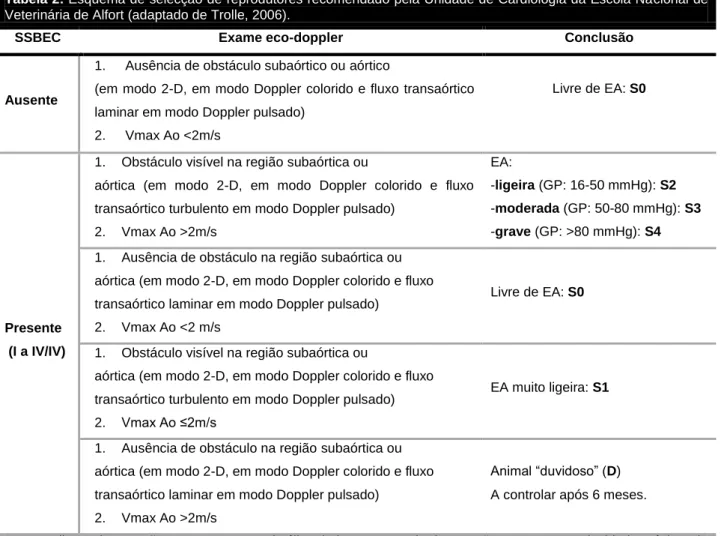
Tabela 2: Esquema de selecção de reprodutores recomendado pela Unidade de Cardiologia da Escola Nacional de Veterinária de Alfort ... 32
Tabela 3: Alterações cardiovasculares diagnosticadas em 642 cães, entre Março de 2003 e Março de 2010, por ecocardiografia. ... 37
Tabela 4: Distribuição percentual das doenças cardíacas congénitas registadas em 89 cães e percentagem de cada malformação cardíaca em relação à população de cães diagnosticados com alguma alteração cardiovascular (n=642), durante o mesmo período de tempo. ... 38
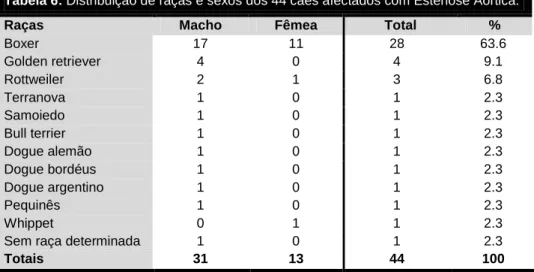
Tabela 5: Características da população de animais com Estenose Aórtica. ... 39 Tabela 6: Distribuição de raças e sexos dos 44 cães afectados com Estenose Aórtica. 39 Tabela 7: Riscos relativos estimados para as três raças mais afectadas com Estenose Aórtica na população de cães com alterações cardiovasculares (n=642). ... 40 Tabela 8: Distribuição dos 44 cães afectados por EA em relação à localização anatómica da lesão. ... 40 Tabela 9: Classificação da EA quanto à gravidade. ... 40 Tabela 10: Idade e parâmetros ecocardiográficos segundo a gravidade de EA. ... 41 Tabela 11: Coeficientes de correlação (r) de Pearson entre o gradiente de pressão sistólico máximo, através do tracto de saída do ventrículo esquerdo e da aorta, e diversas variáveis. ... 42
Tabela 12: Parâmetros ecocardiográficos e idade de animais afectados por Estenose Aórtica tendo em conta a presença ou a ausência de sinais clínicos relacionados com a doença. ... 43
viii
LISTA DE ACRÓNIMOS, ABREVIATURAS E SÍMBOLOS
ACVIM – American College of Veterinary Internal Medicine
Ao – raiz aórtica
AoSA – Ângulo aorto-septal BSA – Área de superfície corporal CMH – Cardiomiopatia Hipertrófica DAP – Ducto arterioso persistente
DCC(s) – Doença(s) cardíaca(s) congénita(s) EA – Estenose Aórtica
EASV – Estenose Aórtica Supravalvular EAV – Estenose Aórtica Valvular
ESA – Estenose Subaórtica EP – Estenose pulmonar GP – Gradiente de Pressão
HVP – Hospital Veterinário do Porto
IVSd – Septo interventricular no final da diástole IVSs – Septo interventricular no final da sístole
LVFWd – Parede livre do ventrículo esquerdo no final da diástole LVFWs – Parede livre do ventrículo esquerdo no final da sístole LVIDd – Diâmetro interno do ventrículo esquerdo no final da diástole LVIDs – Diâmetro interno do ventrículo esquerdo no final da sístole MAS – Movimento anterior sistólico
mm – Milímetro
Modo M – Modo movimento m2 – Metro quadrado
m/s – Metro por segundo MHz – MegaHertz
mmHg – Milímetro de mercúrio
TSVE – Tracto de saída do ventrículo esquerdo VE – Ventrículo esquerdo
Vmax – Velocidade máxima 2-D – Bidimensional
© – direitos de autor ® – Marca registada
ix
AGRADECIMENTOS
Na elaboração deste trabalho foram muitas as pessoas que, de várias formas, contribuíram para que se tornasse uma realidade e que, por isso, merecem a minha gratidão e o meu reconhecimento.
Foram ainda mais as pessoas que me apoiaram ao longo do Curso e às quais devo a minha amizade.
À Professora Maria João por ter aceitado orientar este trabalho, por todas as horas que dispôs para que a sua realização fosse possível, por toda a sua amizade e apoio, por me incentivar a não desistir e querer sempre melhorar e por toda a confiança depositada em mim.
Ao Dr. Luís Lobo, por me ter recebido no HVP, pelos preciosos conhecimentos transmitidos, pela paciência e amizade que sempre revelou perante todas as minhas dúvidas e por ter confiado em mim dando-me a oportunidade de desenvolver este trabalho com o seu apoio.
Ao Professor Jorge Colaço pelo apoio e ajuda no processamento e interpretação dos dados estatísticos.
A todos os docentes desta universidade com quem tive a oportunidade de aprender e que contribuíram de certa forma para a profissional que serei no futuro.
A todo o corpo clínico do Hospital Veterinário do Porto, pela forma como me receberam e pelo ambiente agradável de aprendizagem que me proporcionaram durante os 6 meses de estágio.
Aos companheiros de estágio, por todos os momentos de boa disposição e amizade que partilhámos durante os 6 meses de estágio.
Ao Prof. Dr. Xavier Roura por me ter dado a oportunidade de estagiar no Hospital Clinic Veterinari da Universidade Autónoma de Barcelona e a toda a equipa médica hospitalar pela transmissão de conhecimentos e pelo profissionalismo.
À Ana, ao Rodrigo e à Pisco, por terem sido os meus anfitriões na Bila e por me terem guiado no início desta longa caminhada.
x
À Amélia, à Catarina (Cunha) e à Ritinha, por terem estado sempre presentes nos bons e maus momentos desta longa caminhada, mas sobretudo por toda a amizade que sempre me transmitiram.
À Chefe, à Lúcia e ao Valter e a todos os colegas e amigos que me cativaram durante o percurso académico e com quem experimentei momentos inesquecíveis.
À “Ana da Sebenta”, por toda a preocupação que sempre revelou em proporcionarmos os melhores apontamentos “a tempo e horas” e por toda a sua amizade.
A todos os meus amigos da Guarda, mas em especial à Lili, que apesar da distância, nunca deixou que a nossa amizade se dissolvesse.
Ao meu irmão e à minha irmã, por tudo o que eles significam para mim, por serem a constante da minha vida e pelo apoio incondicional.
Aos meus pais, por me terem apoiado sempre em todas as minhas decisões ao longo da vida, por todo o amor e carinho desmedido que sempre me proporcionaram e por todos os sacrifícios que fizeram para proporcionar a mim e aos meus irmãos as melhores condições para realizarmos os nossos sonhos.
1
1. INTRODUÇÃO
1.1. Doenças cardíacas congénitas
O termo doença cardíaca congénita (DCC) refere-se à ocorrência de malformações morfológicas ou funcionais no coração ou nos grandes vasos adjacentes, presentes ao nascimento, causadas por alterações ou paragens em determinadas fases do desenvolvimento embrionário do coração fetal (MacDonald, 2006; Oyama et al., 2010). O termo congénito não implica que o defeito seja hereditário, podendo ter ocorrido espontaneamente ou ter sido secundário a factores ambientais (infecciosos, toxicológicos, farmacêuticos, nutricionais, etc.), ou ser mesmo o resultado de uma combinação de factores, e na maioria dos casos, o agente causador não se chega a identificar. Estas malformações são consideradas congénitas mesmo que sejam identificadas tardiamente (Oyama et al., 2010).
Em Medicina Humana, entre todas as malformações congénitas, os defeitos cardíacos congénitos são os mais comuns, existindo estudos que apontam para uma incidência de 6 a 8 por cada 1000 nados - vivos (Sadowski, 2009). Na espécie canina, apesar da prevalência real das DCCs não ser conhecida, dados provenientes de várias universidades da América do Norte indicam que a sua prevalência global varia entre 0.46 a 0.85% em relação a todas as admissões hospitalares (Buchanan, 1999), o que é concordante com o estudo de Patterson (1968) que refere uma prevalência de DCCs de 6.8 por cada 1000 admissões hospitalares. Porém, estes dados estão provavelmente subestimados, pois muitos animais são assintomáticos e outros morrem antes das DCCs serem identificadas e sem se efectuarem necrópsias (Oyama et al., 2010). Um estudo realizado através da base de dados do Hospital Veterinário da Universidade da Pennsylvania, entre 1990 e 1993, revelou que de 300 animais com sinais de doença cardíaca, 16.4% apresentavam defeitos congénitos (Buchanan, 1999). Mais recentemente, segundo a base de dados do Hospital Veterinário da Universidade da Califórnia, com registos de um período de 10 anos, 17% dos cães avaliados pelo serviço de cardiologia foram diagnosticados com DCCs (MacDonald, 2006).
As DCCs são causas significativas de morbilidade e mortalidade cardiovascular em pequenos animais (Bonagura e Lehmkuhl, 1999). Estudos genéticos realizados no homem e no rato, revelaram que centenas de genes podem ser responsáveis por defeitos cardíacos congénitos isolados e/ou múltiplos (Hyun e Lavulo, 2006; Hyun e Park, 2006). Em Medicina Veterinária, desde muito cedo, alguns autores também sugeriram uma provável base genética para a maioria das DCCs, devido ao facto de se verificar uma prevalência racial (maior em raças puras) e sexual, e às evidências de transmissão mendeliana através de gerações (Patterson, 1968; Pyle et al., 1976; Dukes-McEwan, 2006; Hyun e Park, 2006). No entanto, pouco foi o trabalho já desenvolvido para confirmar ou mesmo identificar o defeito molecular
2
genético na origem de cada doença (Dukes-McEwan, 2006). As únicas excepções são a displasia da tricúspide na raça Labrador retriever, considerada uma característica autossómica dominante com reduzida penetração, em que o locus responsável foi mapeado no cromossoma 9, tendo já sido identificados os possíveis genes candidatos responsáveis pela malformação valvular; e os defeitos conotruncais no Keeshound, cujos estudos moleculares sugerem uma herança poligénica (Werner et al., 2005; Hyun e Park, 2006). A recente publicação da sequência do genoma canino vai proporcionar grandes avanços na identificação dos genes responsáveis por muitas das DCCs, no diagnóstico baseado em testes moleculares e testes genéticos, e no aconselhamento e desenvolvimento de estratégias de reprodução de animais saudáveis sem problemas cardíacos congénitos (Hyun e Park, 2006; Parker et al., 2006).
São vários os sistemas desenvolvidos para classificar os defeitos cardíacos congénitos no cão. A tabela 1 classifica as várias DCCs de acordo com as consequências fisiopatológicas e hemodinâmicas que cada uma origina (sobrecarga de volume, sobrecarga de pressão, comunicações que provocam cianose e malformações complexas), sem ter em conta a base embriológica, genética ou molecular que originou cada malformação (Oyama et al., 2010).
Tabela 1: Classificação das doenças cardíacas congénitas no cão, de acordo com a sua fisiopatologia (adaptado de Oyama, 2010).
Defeitos que causam uma sobrecarga de volume Defeitos que causam cianose
Comunicações sistémicas-pulmonares (esquerda para a direita)
Comuns
Ducto arterioso persistente Defeito do septo interventricular
Raros
Defeito do septo atrial Defeito de almofadas endocárdicas
(Pseudo) Tronco arterioso
Regurgitação Valvular Comuns Displasia da mitral Displasia da tricúspide Raros Insuficiência pulmonar Insuficiência aórtica Comuns Tetralogia de Fallot Raros
Defeitos do septo interventricular (comunicações pulmonares-sistémicas)
Ducto arterioso persistente (comunicações pulmonares-sistémicas) Atresia da tricúspide / hipoplasia do ventrículo
direito
Dupla saída do ventrículo direito Transposição dos grandes vasos
Tronco arterioso
Comunicação aórtico-pulmonar
Defeitos cardiovasculares complexos Comuns
Hérnia peritoneopericárdica-diafragnática Arco aórtico persistente direito
Veia cava cranial esquerda persistente
Defeitos que causam uma sobrecarga de pressão Comuns
Raros
Fibroelastose endocárdica Defeitos pericárdicos Retorno venoso pulmonar anómalo
Arco aórtico duplo
Artéria subclávia retroesofágica esquerda
Situs inversus
Estenose pulmonar Estenose subaórtica
Raros
Estenose aórtica valvular
Coarctação e interrupção do desenvolvimento da aorta
3
Segundo vários autores, a Estenose Aórtica (EA) é uma das DCCs mais comuns em cães, existindo diversas opiniões sobre a sua prevalência. Num estudo publicado em 1968, realizado no Hospital da Universidade da Pennsylvania, em 290 cães com malformações cardiovasculares, o ducto arterioso persistente (DAP; 28%), a estenose pulmonar (EP; 20%) e a EA (14%), foram as doenças mais prevalentes. Por outro lado, a persistência do 4º arco aórtico direito (8%), os defeitos do septo interventricular (7%) e outras malformações, como a tetralogia de Fallot, a persistência da veia cava cranial esquerda e os defeitos do septo interatrial foram as menos diagnosticadas (menos de 5%) (Patterson, 1968). Num outro estudo, que inclui informações de uma base de dados norte americana com mais de 1300 casos, realizado em 1992, o DAP continua a ser o defeito mais frequentemente identificado (32%), mas a Estenose Subaórtica (ESA; 22%) ultrapassa agora a EP (18%) em prevalência (Bonagura e Lehmkuhl, 1999).
Nos anos 80, no Reino Unido, em 339 casos de DCCs, os diagnósticos mais comuns foram a ESA (32%), o DAP (20%), a displasia da mitral (14%), a EP (12%) e os defeitos do septo interventricular (8%) (Oyama et al., 2010).
Na Suécia, Tidholm (1997) realizou um estudo retrospectivo de DCCs diagnosticadas em 151 cães, onde a EA foi a mais prevalente (37.7%), seguida da EP (21.9%), do defeito do septo interventricular (13.2%) e do DAP (11.9%).
Num estudo retrospectivo de 105 Boxers diagnosticados com DCCs na Unidade de Cardiologia da Escola Nacional de Veterinária de Alfort, a prevalência da EP (4.8%) é muito menor que a da ESA (46.7%). No entanto, verifica-se uma maior prevalência do defeito do septo atrial de tipo secundum (56.2%) e da displasia da mitral (55.2%). Os autores desse estudo acreditam que a prevalência de outras DCCs, como o defeito do septo atrial, pode ter sido subestimada até agora, particularmente no Boxer (Chetboul et al., 2006).
A prevalência das malformações congénitas difere entre raças e países e frequentemente também entre regiões do mesmo país, isto deve-se provavelmente às diferenças que estão naturalmente relacionadas com as alterações na popularidade de certas raças caninas ao longo do tempo e conforme a zona geográfica, mas também com as linhagens dos animais afectados (Kienle et al., 1994). Isto sugere a importância dos pools de genes regionais na etiologia das DCCs, devendo-se ter isso em consideração quando se interpretam diferentes estudos de prevalência (Buchanan, 1999).
4
1.2. Estenose Aórtica 1.2.1. Definição
A EA é uma DCC caracterizada por uma obstrução parcial ao fluxo de saída ventricular esquerdo, que provoca uma sobrecarga de pressão (Oyama et al., 2010). A EA congénita está descrita em cães (Pyle et al., 1976; O'Grady et al., 1989; Höllmer et al., 2008; Bussadori et al., 2009), gatos, vacas, ovelhas, porcos, cavalos (King et al., 1988) e humanos (Hoffman e Kaplan, 2002).
1.2.2. Tipos de Estenose Aórtica
Anatomicamente, a EA pode ser classificada em: valvular, caracterizada pela presença de malformações do aparelho valvular da aorta; supravalvular, quando a lesão obstrutiva está localizada imediatamente após a valva aórtica; ou subvalvular, quando a obstrução se localiza imediatamente abaixo da valva ou mais profundamente a nível do tracto de saída do ventrículo esquerdo (TSVE) (Oyama et al., 2010). A EA supravalvular e a valvular isolada são pouco comuns no cão, enquanto que a subvalvular é das DCCs mais comuns (O'Grady et al., 1989; Kienle, 2000). De acordo com as características da obstrução, isto é, funcionalmente, a EA pode-se classificar como fixa ou dinâmica. No entanto, apenas as estenoses subvalvulares podem ser dinâmicas (Kienle, 2000).
1.2.2.1. Estenose Aórtica Valvular
A Estenose Aórtica Valvular (EAV) está normalmente associada ao espessamento, à fusão ou à insuficiente separação dos folhetos da valva aórtica. Geralmente, resulta do facto das suas extremidades distais estarem fundidas ou de se apresentarem pouco móveis (ou mesmo imóveis) com protusão para o lúmen arterial, em vez da sua normal abertura durante a sístole (Chetboul e Pouchelon, 2004). Apesar de rara, a ocorrência de uma valva aórtica bicúspide também pode originar uma estenose ligeira (Bussadori et al., 2000; Oyama et al., 2010).
Apesar da EAV ter uma ocorrência rara entre a população canina, os Bull Terriers parecem estar predispostos a este tipo de obstrução (Oyama et al., 2003; Oyama et al., 2010). Em 2003, foi publicado um estudo em Bull Terriers, em que, histologicamente, as lesões valvulares observadas incluíram a degenerescência mixomatosa difusa, a deposição de material hialino eosinofílico e uma marcada metaplasia cartilaginosa dos folhetos da valva, semelhante ao observado em humanos com estenose valvular calcificada. Estes dados levaram os autores desse estudo a considerar que esta EAV, geralmente grave, no Bull Terrier, pode constituir uma doença adquirida e não congénita. Todos os cães desse estudo apresentavam, concomitantemente, algum grau de displasia da valva mitral (Oyama et al., 2003).
5
Um outro estudo, de 2005, identificou alguma predisposição em cães Bull Terrier com Doença Renal Poliquística para os vários tipos de obstruções congénitas ao fluxo de saída ventricular esquerda, incluindo a forma valvular da EA. Se existirá ou não algum factor genético que predisponha estes animais ao desenvolvimento de lesões valvulares aórticas não está esclarecido (O'Leary et al., 2005).
1.2.2.2. Estenose Aórtica Supravalvular
A Estenose Aórtica Supravalvular (EASV) é ainda mais rara e ocorre devido a constrições (estreitamento) ou à coarctação da aorta ascendente, a nível ou imediatamente após os seios aórticos (de Valsalva) (Bussadori et al., 2000; French et al., 2000). Em cães de raça Boxer, foi detectada uma aorta de diâmetro relativamente pequeno sem obstruções, representando algum grau de hipoplasia de aorta, associada a sopros cardíacos e a velocidades do fluxo sanguíneo aórtico elevadas e turbulentas (Bussadori et al., 2000).
1.2.2.3. Estenose Aórtica Subvalvular
A EA subvalvular, também conhecida como ESA, é o tipo de estenose mais frequente no cão, constituindo mais de 95% dos casos de EA (Buchanan, 1999; Kienle, 2000). É uma doença problemática, pois é muito difícil de diagnosticar em cães ligeiramente afectados, e quando a gravidade aumenta é difícil de tratar (Oyama et al., 2010).
A ESA considera-se fixa, quando as dimensões do orifício de ejecção são definidas pelas características anatómicas da lesão e a gravidade da obstrução não se altera com os batimentos cardíacos, nem ao longo da sístole; e dinâmica (lábil), quando a dimensão do orifício de ejecção e a gravidade da obstrução se alteram com mudanças no ritmo cardíaco, estado inotrópico ou ao longo da sístole. A maioria dos cães com ESA apresenta a forma fixa e em casos muito raros, obstruções fixas e dinâmicas ocorrem simultaneamente (Palacio et al., 1998; Kienle, 2000; Pikula et al., 2005).
1.2.2.3.1. Estenose Aórtica Subvalvular fixa
No cão, a apresentação clássica de ESA caracteriza-se por uma obstrução a nível do TSVE sob a valva aórtica, causada por vários nódulos ou cristas endocárdicas fibrosas de diferentes tamanhos (alguns milímetros de comprimento) que se projectam da superfície endocárdica e invadem o lúmen do TSVE, podendo formar um anel subaórtico incompleto ou mesmo completo em alguns animais, reduzindo dessa forma a área transversal por onde o fluxo sanguíneo circula (Pyle et al., 1976; Bussadori et al., 2000).
Pyle et al. (1976) realizaram estudos pioneiros, baseados em necrópsias e cateterizações cardíacas, em colónias de reprodução de cães de raça Terra Nova, demonstrando que existe uma ampla variedade de tipos e de gravidade de lesões anatómicas de ESA, classificando-as
6
em três graus. A ESA de grau 1, ou ligeira, é caracterizada pela presença de pequenas formações nodulares de endocárdio espessado, proeminentes e esbranquiçadas, localizadas no septo interventricular imediatamente abaixo da aorta. Em alguns animais também foram identificadas lesões semelhantes na superfície ventral das válvulas semilunares aórticas. A ESA de grau 2, ou moderada, consiste numa estreita crista de endocárdio espessado e esbranquiçado que envolve parcialmente a saída ventricular esquerda sob a valva aórtica. Na ESA de grau 3, ou grave, uma banda, crista ou anel fibroso envolve por completo o TSVE imediatamente abaixo da valva aórtica. Esta lesão faz uma protuberância de 1 a 2 mm na superfície endocárdica, podendo incluir a base da cúspide anterior da valva mitral. Os animais com este tipo de lesão apresentaram também um espessamento da superfície ventricular dos folhetos da valva aórtica (Pyle et al., 1976).
Histologicamente, o anel estenótico é constituído por fibras reticulares e elásticas dispostas irregularmente numa matriz de mucopolissacarídeos. Em lesões avançadas podem-se encontrar feixes discretos de colagéneo e até mesmo cartilagem (Pyle et al., 1976; Palacio et
al., 1998).
Em humanos, cerca de 20% dos casos de EA estão associados a outras DCCs, como o DAP ou a coarctação da aorta. Para além disso, esta doença foi registada como parte de síndromes com envolvimento genético (Hyun e Park, 2006). No cão, apesar da forma mais comum de ESA ser a isolada, esta malformação pode ocorrer associada a outros defeitos congénitos, nomeadamente à displasia da valva mitral, à EP, ao DAP, a defeitos do septo interventricular, e a várias anomalias relacionadas com o desenvolvimento dos arcos aórticos (Kienle et al., 1994; Bussadori et al., 2000; Oyama et al., 2010).
Em 151 animais diagnosticados com DCCs no Albano Animal Hospital of Stockholm, Tidholm (1997) relatou a associação de EA com EP em aproximadamente 2.6%, com o defeito do septo interventricular em 0.7% e com o DAP também em 0.7%. No Boxer, Bussadori et al. (2001) identificaram uma elevada prevalência de EA associada à EP (27.8%). No entanto, essa percentagem diminuiu marcadamente no estudo realizado em 2009 (10.7%), podendo ser resultado do programa de rastreio de DCCs estabelecido em Itália (Bussadori et al., 2009). Chetboul et al. (2006) apresentaram um estudo em que aproximadamente 63% dos casos diagnosticados de ESA em Boxers surgiam associados a uma ou duas DCCs, entre as quais o defeito do septo atrial, a displasia da mitral e a EP.
Também está descrita a ocorrência de ESA associada a doenças adquiridas, como a cardiomiopatia dilatada idiopática (Kienle et al., 1994). Está descrito um caso de EA associada a uma comunicação portosistémica intrahepática e a uma fístula arteriovenosa intrahepática congénita num Golden Retriever (Koide et al., 2004).
7
1.2.2.3.2. Estenose Aórtica Subvalvular dinâmica
Em alguns cães afectados com ESA, as alterações anatomopatológicas divergem da descrição clássica. Em vez de um típico anel fibroso a nível do TSVE, o septo interventricular encontra-se uniformemente hipertrofiado ou apresenta um feixe fibromuscular largo que faz protusão para o TSVE, causando um ligeiro estreitamento. A cúspide anterior da valva mitral pode também encontrar-se engrossada e em aposição com uma placa de fibrose endocárdica a nível do septo interventricular, formada devido ao impacto das cúspides dessa valva contra este, constituindo o designado movimento anterior sistólico (MAS) da valva mitral (Palacio et
al., 1998; Oyama et al., 2010). Este fenómeno consiste numa aproximação da cúspide anterior
da valva mitral ao septo interventricular, através do TSVE, durante a sístole, podendo mesmo existir contacto entre as duas estruturas anatómicas, formando uma espécie de túnel. Deste modo, o MAS da valva mitral conduz a uma obstrução do fluxo de saída ventricular esquerdo e ao desenvolvimento de um gradiente de pressão (GP) através do seu tracto de saída (Bonagura, 2001; Paige et al., 2007). Os músculos papilares também podem apresentar malformações, estar malposicionados ou com características malignas, as cordas tendinosas engrossadas, e as cúspides da valva mitral distorcidas e alongadas, contribuindo para o desenvolvimento da obstrução (Palacio et al., 1998; Oyama et al., 2010). A valva mitral alterada pode secundariamente conduzir a uma ligeira dilatação da aurícula esquerda e lesões, que sugerem a presença de regurgitação mitral. Esta regurgitação pode, assim, ser secundária a um acoplamento anormal das cúspides valvulares devido a alterações hemodinâmicas do TSVE ou dever-se a um defeito da valva mitral coexistente (Kienle, 2000).
O fenómeno de ESA dinâmico é raro e tem sido descrito em cães, tanto como lesão isolada ou, mais frequentemente, associado a outras doenças concomitantes, entre as quais, a ESA fixa, a displasia da valva mitral, a cardiomiopatia hipertrófica (CMH), e outras doenças que causam hipertrofia do septo interventricular (e.g., EP, tetralogia de Fallot) (Palacio et al., 1998; Kienle, 2000; Connolly e Boswood, 2003; Pikula et al., 2005).
1.2.3. Etiologia: embriologia e genética
A base embriológica de todas as formas de EA não se encontra muito clara e suscita controvérsia. A EAV deve-se, provavelmente, a um defeito no desenvolvimento das almofadas endocárdicas embrionárias do septo conotruncal (relevos do tronco), a partir das quais se originam os folhetos desta valva. A EASV e a ESA podem ter diferentes apresentações anatómicas e cada uma resultar de alterações embriológicas distintas. A EASV parece resultar de um desenvolvimento exagerado da prega transversal da parede aórtica, situada imediatamente acima dos seios de Valsalva, que em condições normais é de pequeno tamanho. A EASV membranosa deriva de tecido anormal dos folhetos aórticas (Kienle, 2000).
8
O TSVE forma-se durante o desenvolvimento do septo conotruncal, do septo interventricular e da cúspide anterior (septal) da valva mitral. Assim, o desenvolvimento anormal destas estruturas pode produzir uma ESA. Existem teorias que afirmam que a ESA fixa no cão deve-se provavelmente a uma falha no desenvolvimento da zona de transição do cone arterioso (conus cordis) para o tronco arterioso (truncus cordis), um local predisposto a inflamação durante a cardiogénese em humanos (Pyle et al., 1976; Kienle, 2000). Por outro lado, no cão também se sugere que o anel fibrocartilaginoso que surge em alguns casos de ESA, deriva de tecido embrionário endocárdico persistente que conserva a sua capacidade de proliferação e o seu potencial condrogénico, durante algum tempo após o nascimento (Pyle et
al., 1976).
Em Medicina Humana, Cape et al. (1997) sugerem que o processo etiológico da ESA segue 4 etapas: (1) alterações morfológicas; (2) aumento do atrito do fluxo sanguíneo turbulento a nível do septo interventricular; (3) predisposição genética e (4) proliferação celular em resposta ao atrito do fluxo sanguíneo turbulento. Essas alterações morfológicas a nível do TSVE podem ser devido a uma maior separação das valvas mitral e aorta, a uma diminuição do ângulo aorto-septal (AoSA) e à presença de um anel aórtico de menor diâmetro (Cape et al., 1997; Sigfússon et al., 1997; Cilliers e Gewillig, 2002). Em estudos recentes, verificou-se que o AoSA medido por ecocardiografia bidimensional (2-D), em eixo longo da via paraesternal direita, era significativamente mais acentuado em cães com ESA isolada do que em cães livres de doença (Höllmer et al., 2008; Quintavalla et al., 2010). Também se verificou que esse ângulo diminuía à medida que a gravidade da ESA aumentava (Quintavalla et al., 2010). No entanto, os valores obtidos em cães de raça Boxer com ESA (AoSA<148º) foram diferentes dos obtidos em cães de raça Dogue de Bordéus com ESA (todos, excepto um, possuíam um AoSA<125º). Esta discrepância pode ser explicada por diferenças anatómicas a nível do TSVE e da aorta existentes entre estas duas raças caninas. Assim, o AoSA parece estar relacionado com a ESA e, tal como em humanos, pode ser um factor de risco para o desenvolvimento e/ou progressão da doença em cães. No entanto, serão necessários mais estudos para comprovar o verdadeiro papel do AoSA. A definição do AoSA mínimo poderá ter grande valor na identificação precoce de cães em risco de desenvolvimento e/ou progressão de ESA (Quintavalla et al., 2010).
Tanto em humanos como em pequenos animais ainda não foi definida a herança genética da EA (Hyun e Park, 2006). Em estudos reprodutivos realizados por Pyle et al. (1976), verificou-se que a ESA é uma doença com carácter hereditário em cães de raça Terra Nova. Porém, a hereditariedade da ESA nesta raça não é consistente com nenhuma hipótese genética mendeliana simples. O seu padrão de herança é mais compatível com um modo de transmissão autossómico dominante com influência de genes modificadores que afectam a sua expressão fenotípica (penetrância variável); contudo, um mecanismo de herança poligénico
9
não pode ser excluído (Pyle et al., 1976). A transmissão autossómica dominante implica uma alta taxa de transmissão da doença por pais afectados à sua descendência (50 a 100%). A penetrância variável deste modo de transmissão leva a que alguns indivíduos que não apresentem evidências desta doença sejam, no entanto, capazes de a transmitir à sua descendência; e ainda à ocorrência de diversos graus de gravidade da lesão nos indivíduos afectados (O'Grady et al., 1989).
Em estudos mais recentes de cruzamentos de animais de raça Terra Nova, concluiu-se que uma anomalia associada a um gene único pode estar subjacente a este defeito cardíaco, apesar de cruzamentos subsequentes não terem conseguido comprovar a segregação completa desse gene (Hyun e Park, 2006). Com base nesses estudos, suspeita-se que possa existir uma base hereditária da ESA e talvez da EAV em outras raças e famílias afectadas com mais frequência (Bonagura e Lehmkuhl, 1999), como é o caso do Boxer (Kienle et al., 1994), Golden Retriever (O'Grady et al., 1989) e do Rotweiller (Meurs, 2010).
1.2.4. Fisiopatologia
Independentemente da natureza da obstrução, a principal consequência hemodinâmica da EA consiste num aumento da resistência ao fluxo de saída do ventrículo esquerdo (VE), durante a sístole. De acordo com a lei de Ohm (resistência = GP/fluxo sanguíneo), este aumento da resistência pode ser o resultado de três possíveis causas: um aumento do GP a nível da região estenosada (aumento das diferenças de pressão antes e depois do obstáculo que está a originar a estenose), uma diminuição do fluxo sanguíneo que a atravessa, ou uma combinação destas duas. Assim, o GP aumenta de forma directamente proporcional ao aumento da resistência (isto é, à diminuição do tamanho do orifício). Se o fluxo sanguíneo se mantiver constante, a velocidade do mesmo através da estenose aumenta também de forma directamente proporcional ao tamanho do anel estenótico (isto é, quanto mais estreito for o anel, maior é a velocidade do fluxo). A velocidade do fluxo sanguíneo (V) e o GP mantêm uma relação constante, definida pela equação de Bernoulli modificada (GP = 4V2), e permitem identificar as alterações hemodinâmicas associadas à ESA e determinar de forma quantitativa a gravidade da lesão (Kienle, 2000).
Na ESA, a pressão aórtica geralmente é normal, mas a existência de um GP através da lesão subaórtica produz um aumento da pressão sistólica no VE. O aumento da tensão na parede do VE leva a um aumento da sua massa muscular (hipertrofia concêntrica) (Kienle, 2000). Apesar de não ser surpreendente, verifica-se que magnitude da hipertrofia concêntrica do VE está positivamente relacionada com a gravidade da obstrução, quer em animais com
10
EAV, EASV, ou subvalvular fixa ou dinâmica (Bélanger et al., 2001; Oyama e Thomas, 2002; Linde e Koch, 2006).
A hipertrofia concêntrica compensa o aumento de tensão na parede do VE, permitindo a normalização da função ventricular sistólica e a manutenção de um volume de ejecção também dentro dos limites normais (Kienle, 2000). No entanto, esta hipertrofia concêntrica do VE devido a uma sobrecarga de pressão crónica, consequente à ESA, predispõe particularmente ao desenvolvimento de uma disfunção diastólica, sobretudo em animais com EA moderada a grave (Schober e Fuentes, 2002). Uma hipertrofia muito marcada do VE acompanhada de fibrose pode levar à alteração da geometria do VE, a um relaxamento do miocárdio prolongado ou incompleto, e a uma diminuição da compliance deste, originando um enchimento insuficiente do VE e, portanto, uma redução do débito cardíaco e um aumento das pressões de enchimento ventricular. O padrão anormal de enchimento ventricular pode provocar um aumento da onda a de pressão na aurícula esquerda e nos capilares pulmonares e, frequentemente, leva a uma ligeira dilatação da aurícula esquerda. Porém, o aumento da pressão no VE no final da diástole como consequência da diminuição da contractilidade ventricular é, geralmente, ligeiro, não sendo suficientemente grande para provocar edema pulmonar (Kienle, 2000).
A função sistólica é normal na maioria dos cães com EA ligeira ou moderada. A disfunção sistólica ventricular é um achado raro em animais com EA; no entanto, se presente é precedida ou acompanhada sempre de uma disfunção diastólica, sendo um sinal de doença avançada e de mau prognóstico (Schober e Fuentes, 2002).
A ESA pode em última instância originar uma insuficiência cardíaca congestiva esquerda; no entanto, a sua incidência é muito baixa na ausência de outras DCCs significativas ou de endocardite infecciosa (Kienle et al., 1994). Assim, se cães com ESA grave desenvolverem uma insuficiência cardíaca congestiva esquerda será, provavelmente, consequente a uma insuficiência miocárdica de instauração lenta, ou à presença de outras complicações como uma regurgitação da valva mitral moderada a grave, ou uma insuficiência aórtica (Kienle, 2000).
A dilatação pós-estenótica da aorta ascendente, do arco aórtico e do tronco braquiocefálico, pode ocorrer e é secundária ao choque energético do fluxo turbulento contra as paredes vasculares nessas zonas (Kienle, 2000; Oyama et al., 2010).
Em cães com ESA observa-se, com muita frequência, uma insuficiência aórtica ligeira, devido ao espessamento, à diminuição da mobilidade dos folhetos da valva e/ou à dilatação pós-estenótica da aorta ascendente. O espessamento dos folhetos valvulares é provavelmente secundário a traumatismos produzidos por um fluxo de alta velocidade que afecta a valva durante a ejecção (O'Grady et al., 1989; Kienle, 2000). French et al. (2000) verificaram que 50% dos cães que inicialmente apenas apresentavam ESA, desenvolveram posteriormente
11
espessamento valvular. As lesões no endotélio valvular aórtico provocadas pelo fluxo turbulento (jet lesions) predispõem à ocorrência de endocardite bacteriana em cães com ESA (Chomel et al., 2001; Ohad et al., 2010).
A regurgitação através da valva mitral ocorre menos frequentemente e pode ser o resultado de uma malformação desta valva, do envolvimento da cúspide septal da valva mitral no anel subaórtico (Kienle, 2000), de alterações geométricas do VE hipertrofiado (Schober e Fuentes, 2002) e/ou também devido ao MAS da valva mitral (Paige et al., 2007).
Em cães com ESA está descrita a presença de malformações estruturais e funcionais do VE e da circulação coronária. A determinação do fluxo nas artérias coronárias extramurais demonstra uma diminuição do fluxo diastólico e um fluxo sistólico reverso. As artérias coronárias intramurais encontram-se frequentemente alteradas, principalmente as que estão localizadas nas áreas focais de enfarte e de fibrose do miocárdio. O subendocárdio e os músculos papilares do ventrículo de cães com ESA grave são os locais mais vulneráveis à isquémia. Estas artérias intramurais podem apresentar uma proliferação de tecido conjuntivo e de músculo liso na túnica íntima e uma hipertrofia e uma desorganização do músculo liso da túnica média (Oyama et al., 2010). Estas alterações estão provavelmente relacionadas com a grande tensão da parede do ventrículo em animais com ESA e com a formação de angiotensina II ou de outros mediadores bioquímicos de hipertrofia e remodelação cardíaca (Shimizu et al., 2006). Falk et al. (2004), efectuaram um estudo histopatológico do coração e das artérias coronárias de 44 cães com ESA, assim como de 8 cães sem doença cardíaca, verificando que os animais com ESA apresentavam claramente um maior estreitamento das artérias coronárias intramiocárdicas e fibrose miocárdica. Estas alterações arteriais são mais acentuadas em animais com uma hipertrofia ventricular mais marcada e, curiosamente em cães machos (Falk et al., 2004). O estreitamento dos vasos coronários intramurais não se agrava com a idade. No entanto, em animais com ESA, a fibrose de determinadas zonas do miocárdio parece aumentar com a idade, em resposta à ocorrência de lesões crónicas de isquémia (Falk et al., 2004). Estas lesões arteriais podem explicar a origem de arritmias ventriculares malignas e da morte súbita (Oyama et al., 2010). No entanto, no estudo de Falk et
al.(2004), o grau de estreitamento arterial não estava estatisticamente associado com a
ocorrência de morte súbita.
A ocorrência de síncopes após o exercício ou de morte súbita são os sinais clínicos mais frequentemente descritos em animais com ESA. Os sinais de síncope e fraqueza estão provavelmente relacionados com o aumento das pressões a nível do VE após o exercício, que estimulam os barorreceptores ventriculares que vão desencadear um reflexo depressor que produz vasodilatação periférica reflexa aguda (hipotensão), que pode estar associada a uma bradicardia (Muir et al., 1989). Alguns investigadores defendem que as arritmias ventriculares,
12
secundárias à isquémia, podem também estar na origem das síncopes (Kienle, 2000; MacDonald, 2006). No entanto, outros estudos defendem que a síncope é a alteração primária e que as arritmias malignas ou fatais são secundárias a alterações hemodinâmicas produzidas pelo colapso. As arritmias ventriculares malignas são, provavelmente, a causa de morte súbita (Kienle, 2000).
Recentemente, num cão com ESA, foi descrito o primeiro caso de aneurisma coronário na espécie canina. A origem deste aneurisma não foi determinada, não se excluindo a hipótese de poder ser secundário ao aumento da resistência coronária vascular provocada pela hipertrofia ventricular associada à ESA (Hernandez et al., 2008).
Não está definido se a ESA dinâmica, no cão, é o resultado de uma doença miocárdica primária (como a CMH) ou de uma anomalia congénita do TSVE e/ou do aparelho valvular mitral (Kienle, 2000). O facto de se observar o MAS da valva mitral em situações que não a CMH, pode significar que a sua ocorrência é o resultado de uma geometria anormal do ventrículo que resulta numa lassitude do aparelho valvular mitral, originando um estado sistólico hiperdinâmico. O facto de poder ser experimentalmente induzido em cães saudáveis apoia a teoria do MAS da valva mitral não ser uma característica intrínseca de uma CMH obstrutiva, mas o resultado de forças hemodinâmicas anormais que se desenvolvem devido a outras alterações (Connolly e Boswood, 2003; Paige et al., 2007). A ESA dinâmica pode também ser distinguida da CMH pelo facto de em vários casos se ter verificado uma resolução progressiva da obstrução e de outros parâmetros indicativos de doença (como a hipertrofia ventricular) (Loureiro et al., 2008).
Os primeiros mecanismos propostos para explicar a ESA dinâmica centravam-se na hipertrofia do septo interventricular, como causa do estreitamento do TSVE. Este estreitamento originaria uma pressão negativa sobre a valva mitral (efeito Venturi), sendo a consequente aposição entre o septo e a valva a causa da obstrução do fluxo de saída do VE. Outras teorias sugerem que o efeito Venturi não explica algumas das características observadas na ESA, tais como, o ponto de contacto entre a valva e o septo ou o grau de inactividade dos folhetos da valva mitral necessário para o aparecimento da ESA. Além disso, a hipótese de Venturi não explica o facto do início da ESA ter lugar antes da abertura da valva aórtica, que a obstrução persista no final da diástole ou que um animal com anomalias primárias da valva mitral (que não tenha hipertrofia do septo) possa também ter ESA dinâmica (Kienle, 2000). Investigações mais recentes indicam que a presença de anomalias estruturais ou de alterações da disposição do aparelho papilar-mitral, desempenham um papel fundamental no desequilibro das forças que actuam sobre as cúspides valvulares, predispondo ao MAS da valva mitral (Paige et al., 2007). O deslocamento anterior dos músculos papilares e um aumento da área e do
13
alongamento da cúspide anterior da valva mitral parecem ser factores importantes deste tipo de ESA (Kienle, 2000).
Em casos de obstruções fixas graves, como consequência do aumento da resistência ao fluxo, a ejecção sistólica máxima “atrasa-se”, causando um pulso arterial tardio, cuja intensidade está reduzida em grau variável (pulsus tardus et parvus). A pressão arterial média continua, geralmente, normal (Kienle, 2000).
Em casos de ESA dinâmica, o estreitamento progressivo do TSVE durante a sístole provoca, frequentemente, um aumento da aceleração do fluxo sanguíneo nas mediações do ponto de aposição entre a valva mitral e o septo, e um GP sistólico máximo no final da sístole, um fenómeno que não é observado em casos de obstruções fixas. Registos simultâneos do fluxo aórtico fásico e da pressão no coração esquerdo demonstraram que entre 80 a 90% do volume de ejecção do VE se expulsa na primeira metade da sístole, onde o GP é relativamente pequeno, em seguida o GP aumenta e reduz progressivamente o fluxo à medida que a sístole avança. Assim, o pulso arterial dos animais com ESA dinâmica tende a ter um pico mais precoce, ao contrário do que acontece nos casos de EA fixa (Kienle, 2000).
1.2.5. A natureza progressiva da EA
Nos estudos de Pyle et al. (1976), as lesões anatomopatológicas de ESA não foram encontradas em cães Terra Nova com menos de 3 semanas de idade. O animal mais novo em que se detectaram lesões tinha 24 dias de vida e nos animais entre 3 e 12 semanas de idade apenas se detectaram lesões de grau 1. As lesões de grau 3 foram encontradas, preferencialmente, em cães com mais de 6 meses de idade. O facto de cada tipo de lesão afectar unicamente uma determinada idade sugere que a ESA não é um defeito congénito “verdadeiro”, isto é, presente ao nascimento, desenvolvendo-se no pós-natal e agravando-se progressivamente durante, pelo menos, os primeiros 6 meses de vida (Pyle et al., 1976). Assim, apesar da ESA ser classificada como uma DCC, o facto de em muitos casos não ser identificada no momento do nascimento e durante o crescimento, o seu curso progressivo e a sua alta taxa de recorrência, sugerem que seja uma condição adquirida (Pyle et al., 1976; French et al., 2000; Hyun e Park, 2006). Em Medicina Humana, as alterações hemodinâmicas e os sinais clínicos de ESA apresentam uma evolução progressiva durante as primeiras duas décadas de vida, não estando relatados casos de presença de ESA ligeira em recém-nascidos. No entanto, a EAV de elevada gravidade é muito frequente nesta faixa etária e é responsável por uma alta taxa de mortalidade (Yap et al., 2007).
Palacio et al. (1998) diagnosticaram uma ESA com lesões de grau 3 num Rottweiler de 8 semanas de idade, o que pode sugerir que as lesões obstrutivas podem ter surgido nesse cão antes das 3 semanas de idade, ou que a lesão obstrutiva se desenvolveu mais rapidamente do
14
que o observado anteriormente na raça Terra Nova. Assim, o desenvolvimento e a progressão da obstrução pode ser diferente do descrito anteriormente.
Em estudos conduzidos por French et al. (2000), confirmou-se a natureza progressiva da ESA e da EAV em 17% dos 35 Boxers adultos acompanhados. O’Grady et al. (1989) verificaram que a progressão da ESA é relativamente mais rápida em indivíduos jovens do que em indivíduos com mais idade, sugerindo que muitos dos cães podem viver a maior parte das suas vidas com uma ESA ligeira, sem apresentarem sinais de doença.
O mecanismo de progressão da EAV está relatado em Medicina Humana, através da ocorrência de calcificação da valva (Yap et al., 2007). Durante o acompanhamento de um Boxer afectado com EAV, French et al. (2000) verificaram a progressão da doença com o aumento da gravidade da obstrução. Apesar do mecanismo de progressão não ter sido identificado, observou-se, através de ecocardiografia, um aumento da ecogenicidade da valva sem apresentar sombra acústica, mais sugestivo de fibrose do que de calcificação.
1.2.6. Diagnóstico
1.2.6.1. Identificação do animal
Os animais de raças grandes, como o Terra Nova, o Golden Retriever, o Rottweiler, o Boxer e o Pastor Alemão, surgem como os mais afectados por ESA (Patterson, 1968; Kienle et
al., 1994; Tidholm, 1997; Buchanan, 1999). No Ontario Veterinary College também se verificou
um aumento da ocorrência da ESA em raças como o Bouvier de Flandres e o Bull Terrier (O'Grady et al., 1989). Outras raças que parecem também apresentar alguma predisposição de desenvolver a doença são o Schnauzer, o Dogue Alemão, o Bulldog e o Samoyedo (Marcy, 2006) e o Pointer Alemão de pêlo curto (Oyama et al., 2010). Em 2008, um estudo prospectivo para avaliar a ocorrência da EA na raça Dogue de Bordéus, na Dinamarca, sugeriu que esta também é uma raça predisposta, pois em 53 animais, 17% foram diagnosticados com a doença e 34% foram considerados casos “duvidosos” (Höllmer et al., 2008).
Um estudo realizado no British Boxer Club Championship, em 1990, demonstrou que quase 30% dos 125 cães testados possuíam um sopro típico de EA e 45% dos cães diagnosticados com EA na Universidade de Edimburgo eram da raça Boxer (Cattanach, 2001).
Num estudo onde a ESA foi identificada em trinta e duas raças diferentes, verificou-se, que os animais da raça Terra Nova apresentaram um risco de terem ESA 88.1 vezes superior ao das outras raças, enquanto que este risco foi de 19.3 para o Rottweiler, 8.6 para o Boxer e 5.5 para o Golden Retriever (Kienle et al., 1994).
Apesar de existirem estudos onde a predisposição sexual não foi provada (Tidholm, 1997), noutros esta parece ocorrer com uma frequência ligeiramente maior em machos do que em
15
fêmeas, com os machos a terem 1.4 vezes mais de risco de apresentar a doença (Kienle et al., 1994). Em Boxers verificou-se que a ESA atinge significativamente mais machos do que fêmeas. Assim, o sexo pode representar um factor de risco para esta doença (Buchanan, 1999; Bussadori et al., 2009; Quintavalla et al., 2010).
1.2.6.2. História Clínica
A maioria dos cachorros afectados por uma ESA ligeira ou moderada, e mesmo muitos dos gravemente afectados, são assintomáticos. Muitas vezes, a maioria dos proprietários acredita que o seu animal está aparentemente saudável, e é em consultas de rotina que ocorre a detecção acidental de um sopro cardíaco que, no entanto, em animais jovens pode ser erradamente interpretado como inocente/funcional (Kienle, 2000).
Os sinais clínicos mais frequentemente observados em cães afectados por EA são a intolerância ao exercício, a fraqueza, o atraso no crescimento em relação aos irmãos, a síncope, e raramente, sinais característicos de uma insuficiência cardíaca congestiva esquerda (e.g. ascite, dispneia, tosse). É habitual a ocorrência de casos de morte súbita, sem sinais premonitórios, nos 3 primeiros anos de vida do animal, durante ou após situações de exercício vigoroso e repentino (Kienle et al., 1994; Oyama et al., 2010).
1.2.6.3. Exame Físico
O exame físico não parece fornecer muita informação, excepto a detecção por auscultação do sopro característico de EA, que resulta da turbulência que o sangue sofre ao passar pelo obstáculo subaórtico, aórtico ou supravalvular, no momento da contracção do VE e ejecção do sangue através da aorta. Este é um sopro sistólico de ejecção e, normalmente, com o seu ponto máximo de intensidade localizado na região cardíaca basilar esquerda (3º-4º espaço intercostal) (Dukes-McEwan, 1998). A radiação do sopro, se existir, é característica e, geralmente, estende-se até ao ápice esquerdo do coração e até ao tórax cranial direito, provavelmente devido à sua radiação através da aorta ascendente. Também se pode ouvir sobre as artérias carótidas, quando se ausculta a zona cervical de ambos os lados da traqueia. Na maioria dos animais, o sopro tem a mesma intensidade no tórax cranial direito e na zona basilar esquerda, mas em outros é mais intenso ou só se ausculta no tórax cranial direito (Kienle, 2000). Em cães com lesões ligeiras, o sopro é de qualidade musical e breve, ocorrendo no primeiro terço da sístole (protossistólico). No entanto, nos casos mais graves, e mais frequentemente, é classificado como holossistólico, e de qualidade mais áspera (O'Grady
et al., 1989). Em animais com estenose moderada a grave pode ainda ser detectado um
choque pré-cordial esquerdo proeminente devido à hipertrofia do VE (Oyama et al., 2010). Em cães com ESA dinâmica, o sopro é semelhante ao da ESA fixa, no entanto, a sua intensidade pode variar de uma auscultação para outra (Kienle, 2000; Koplitz et al., 2003).
16
Devido à natureza evolutiva da ESA fixa, a intensidade do sopro pode aumentar durante os primeiros meses de vida (pelo menos nos primeiros 6 meses) (French et al., 2000).
Em vários estudos foi demonstrado que a intensidade do sopro estava positivamente correlacionada com a velocidade aórtica de ejecção, isto é, com a gravidade da obstrução (Kvart et al., 1998; Koplitz et al., 2003; Linde e Koch, 2006; Höllmer et al., 2008). Assim, em animais com ESA, a determinação da intensidade do sopro pode ter algum valor de prognóstico, tal como observou Chetboul et al. (2006) num estudo retrospectivo em que Boxers com sopros de intensidade ≤III/VI possuíam um menor GP sistólico máximo (31±20 mmHg) do que os que apresentavam sopros ≥IV/VI (71±45 mmHg).
Apesar da distribuição das intensidades dos sopros cardíacos diferir significativamente entre cães saudáveis e afectados por DCCs, existe uma óbvia sobreposição entre os dois grupos quando a auscultação de sopros cardíacos é usada como parâmetro de rastreio. Assim, a auscultação isolada não pode ser considerada um meio fidedigno de diagnóstico de forma a diferenciar animais afectados de não afectados nos programas de rastreio (Bussadori et al., 2009). A natureza subjectiva da auscultação prende-se também no facto de ocorrerem variações individuais na intensidade do sopro entre batimentos cardíacos, constituindo um entrave para o seu valor como ferramenta de diagnóstico de EA e aconselhamento em programas de reprodução. Também se verifica que o aumento da intensidade de um sopro após stresse induzido é substancialmente maior em cães com sopros de menor grau (I/VI) do que em cães que apresentam sopros de graus mais elevados (II-III/VI). Assim, o diagnóstico de cães com sopros de graus elevados, considerados os afectados por EA mais grave e portanto os que devem ficar afastados de programas de reprodução, será menos influenciado pela variação do grau de sopro entre os batimentos cardíacos em relação aos cães com sopros de menor grau (Heiene et al., 2000; Höglund et al., 2004).
A fonocardiografia, apesar de ser uma técnica raramente aplicada na prática clínica, é mais objectiva e sensível do que a auscultação isolada na detecção de sopros de baixa intensidade, menos influenciada pelo nível de experiência do examinador, fornecendo informações acerca da duração, frequência e formato (crescendo-decrescendo) do sopro característico da EA. Também se demonstrou que pode determinar a gravidade da doença, diferenciando com segurança a EA moderada da grave com base na duração do sopro e na presença de componentes de frequência média a baixa (Kvart et al., 1998).
Os sopros de ejecção de baixa intensidade sentidos na base esquerda da região cardíaca são frequentemente identificados em Boxers; em alguns estudos chegam a ser detectados em pelo menos 50% dos cães desta raça. Estes sopros podem estar associados a causas obstrutivas ou a alterações fisiológicas.Os sopros fisiológicos/funcionais são muito comuns em animais atléticos, mas também podem surgir devido ao aumento exagerado do tónus
17
simpático, ou à anatomia específica do TSVE dos Boxers (tais como, o tamanho ou o formato da aorta relativamente à porção proximal do TSVE), que provocam alterações do fluxo sanguíneo a esse nível (French et al., 2000; Koplitz et al., 2003). A detecção deste tipo de sopros em cães de raças com grande prevalência de EA, como os Boxers, pode ser indicativa de uma estenose ligeira; sendo difícil de distinguir sopros fisiológicos/funcionais de sopros ligeiros de EA por auscultação, electrocardiografia, radiologia torácica e, por vezes, até por ecocardiografia (Kvart et al., 1998).
Assim, a auscultação de sopros de baixa intensidade em animais jovens, principalmente da raça Boxer, é particularmente difícil de avaliar, especialmente quando se pretende descartar a presença de EA em programas de selecção de reprodutores, o que tem levado ao desenvolvimento de técnicas especiais de fonocardiografia, que conseguem detectar diferenças significativas entre os sopros de animais que à ecocardiografia não apresentam alterações morfológicas de EA e os que possuem alterações morfológicas evidentes de EA, tornando-se um bom método para diferenciar correctamente sopros fisiológicos de sopros patológicos nesta raça (Ahlstrom et al., 2008).
Apesar da ESA ser a causa mais provável de sopros sistólicos da base esquerda do coração, o defeito do septo atrial também pode originar sopros com essas características, como se verificou num estudo de Chetboul et al. (2006) realizado em Boxers, em que foi o responsável por aproximadamente 30% dos sopros detectados. Isto confirma o facto do diagnóstico de ESA não se dever basear unicamente na auscultação cardíaca, que pode conduzir a um sobrediagnóstico da doença e a uma incorrecta exclusão de Boxers dos programas de reprodução (Chetboul et al., 2006). No entanto, também se verificou que a maioria dos cães (61%) que possuíam um sopro sistólico da base esquerda do coração de baixa intensidade (grau I ou II/VI) tinham um defeito do septo atrial e, de igual forma, todos os cães com um sopro de alta intensidade (grau ≥IV/VI) tinham ESA. Com base nestes resultados, pode-se dizer que o defeito do septo atrial pode explicar alguns dos sopros sistólicos da base esquerda do coração de intensidade baixa e de origem indeterminada descritos em vários estudos realizados na raça Boxer. Para evitar erros de diagnóstico, em Boxers com sopros sistólicos da base esquerda do coração de baixa intensidade deve-se sempre realizar uma ecocardiografia 2-D combinada com o modo Doppler a cores (Chetboul et al., 2006).
Em animais com ESA também se pode detectar um sopro diastólico na região basilar esquerda devido a uma insuficiência aórtica ligeira ou moderada. No entanto, esses sopros são difíceis de detectar, pois apresentam baixas frequências (Valdes-Cruz et al., 1985; O'Grady et
al., 1989; French et al., 2000).
Ocasionalmente, os cães com EA podem desenvolver regurgitação da valva mitral, no entanto, a diferenciação do sopro causado por esta insuficiência e o sopro da EA é muito difícil
18
de efectuar devido à sua ocorrência simultânea (durante a sístole) e à proximidade das suas áreas de intensidade máxima (Oyama et al., 2010).
1.2.6.4. Electrocardiografia
O electrocardiograma de animais com EA, fixa ou dinâmica, geralmente encontra-se dentro dos parâmetros normais, não apresentando interesse de diagnóstico, no entanto, fornece informações acerca da evolução da doença (Kienle, 2000). Em casos de EA grave, por vezes, verifica-se um aumento da amplitude das ondas R nas derivações II, III, aVF, V2 e V4, que
sugere uma hipertrofia ventricular esquerda (O'Grady et al., 1989; Linde e Koch, 2006; Oyama
et al., 2010). O eixo eléctrico médio do coração encontra-se geralmente dentro de valores
normais, podendo, contudo, estar presente um desvio à esquerda (Kienle, 2000).
Em animais com ESA grave, o segmento S-T pode estar mal definido, deprimido ou elevado (de acordo com a derivação) e podem-se observar alterações da onda T. Tanto na EA em humanos como no cão, estas alterações parecem ser indicadores clínicos fiáveis de isquémia do miocárdio. Em cães com gradientes de pressão transvalvular aumentados também se podem observar contracções ventriculares prematuras (Kienle, 2000). Geralmente, as alterações do segmento ST e as arritmias ventriculares são induzidas por situações de exercício ou stresse, assim, tornam-se mais evidentes em traçados contínuos obtidos por monitorização Holter (Oyama et al., 2010). A gravidade das arritmias detectadas por este método, frequentemente, corresponde à gravidade da doença e à probabilidade de ocorrência de morte súbita (Kienle, 2000). Davainis et al. (2004) não verificaram diferenças estatisticamente significativas entre o GP transvalvular e o número de complexos prematuros ventriculares (CPV) registados, durante 24 horas, entre cães com e sem depressões S-T, apenas verificando que esta alteração electrocardiográfica era mais específica na identificação de cães com GP ≥80 mmHg. Assim, segundo este estudo as alterações do segmento S-T não são boas indicadoras da gravidade da ESA ou da frequência dos CPV em cães em repouso. Nesse mesmo estudo, também não se verificou a existência de correlação entre o desvio do segmento S-T e o número de CPV detectados em 24 horas, o que sugere que as taquiarritmias ventriculares não estão relacionadas com a ocorrência de isquémia do miocárdio, podendo estar relacionadas com outras alterações morfológicas associadas à ESA, como a hipertrofia ou a fibrose do miocárdio.
1.2.6.5. Radiologia torácica
As principais alterações radiográficas encontradas em animais com EA consistem em uma cardiomegalia por hipertrofia ventricular esquerda e num alargamento do arco aórtico como resultado de dilatação pós-estenótica, consequente ao fluxo turbulento. Esta dilatação é visível como um alargamento do mediastino pré-cardíaco (Figura 1). Se existir disfunção mitral