MÁRIO JORGE FARIA DOS SANTOS ARAÚJO
ECOLOGIA E COMPOSIÇÃO NUTRICIONAL DA
LAMPREIA-MARINHA (Petromyzon marinus, L.) NO
RIO MINHO INTERNACIONAL
Dissertação de Candidatura ao grau de Mestre em
Ciências do Mar
– Recursos Marinhos submetida
ao Instituto de Ciências Biomédicas de Abel
Salazar da Universidade do Porto
Orientador
– Professor Doutor José Carlos
Fernandes Antunes
Categoria – Professor auxiliar
Afiliação – Escola Superior Gallaecia
Co-orientador
– Doutor Rodrigo Otávio de Almeida
Ozório
Categoria – Investigador auxiliar
Afiliação
– Centro Interdisciplinar de Investigação
Marinha e Ambiental
Agradecimentos
Agradecimentos
O sucesso de uma tese nunca é devido exclusivamente à pessoa que a realiza, pois toda a história da vida do autor, pessoal e profissional, contribuiu de alguma forma para o resultado final do trabalho. Assim, gostaria aqui de agradecer a todos aqueles que fazem parte desta minha história.
Ao Dr. José Carlos Antunes pela liderança e pela constante apresentação de desafios que entusiasmam e estimulam a aquisição de novos conhecimentos teóricos e metodológicos.
Ao Dr. Rodrigo Ozório que aceitou o desafio desde o início, pelos conhecimentos em nutrição que transmitiu e por ter organizado as condições necessárias para a determinação da composição nutricional.
À Dra. Luísa Valente por ter permitido realizar a determinação do valor nutricional (matéria seca, cinza, proteína total e energia) LANUCE/CIIMAR e à equipa deste laboratório (Eduarda, Pedro, Sónia, Amélia, Vânia, Vera, Bruno e Cátia), pela disponibilidade no esclarecimento de dúvidas durante os trabalhos práticos e na utilização dos equipamentos.
Ao Dr. Rui Bessa do CIISA/UTL e também à Eng.ª Maria José pelo apoio e disponibilidade no acompanhamento na determinação dos ácidos gordos.
Ao Dr. Anake Kijoa do Laboratório de Química do ICBAS e à Júlia Bessa, que juntamente com o Dr. José Fernando Gonçalves, Elsa (Departamento de Biologia Celular), Dr. Jorge Machado e Dra. Mariana (Departamento de Fisiologia) propiciaram condições para a realização da extracção dos lípidos no ICBAS.
Ao “Engenheiro” Eduardo Martins pelo auxílio fundamental nas saídas de campo e na partilha do conhecimento empírico.
Aos meus colegas e amigos do Aquamuseu: António Roleira, Ana Catarina Braga, Ana Rita Carvalho, Cláudio Ramos Hugo Ribeiro e Micaela Mota, que auxiliaram nas saídas de campo e nos trabalhos de laboratório.
À equipa do LMCEE (EEL) /CIIMAR: Allan Souza, Estér Dias, Fabiana Freitas, Martina Illari, Joana Campos, Pedro Morais e Ronaldo Sousa, pela amizade ao longo dos últimos anos e por contribuírem de várias formas para a realização deste trabalho. Um agradecimento especial ao Felipe Ribas pelo desenho da capa deste trabalho.
Ao Pedro Reis (CIIMAR) pela determinação dos níveis de metais e pela constante boa disposição.
A toda a equipa do Aquamuseu do rio Minho, em Vila Nova de Cerveira, onde a parte prática do trabalho foi realizada: Ana Araújo, Ana Pitta, Patrício Bouça, Tânia, D. Cidália e Rodrigo.
À Capitania do Porto de Caminha, que através do Capitão Luís Mamede Alves facilitou acesso aos dados históricos de capturas de lampreias.
À comunidade de pescadores do rio Minho, especialmente àqueles que contribuíram para a aquisição de dados sobre as lampreias, nomeadamente ao Luís Costa e ao seu parceiro de pesca e ao Sr. Napoleão de Vila Nova de Cerveira; ao Sr. Manuel Rodrigues; ao Sr. João, Sr. Jorge e Sr. José Manuel Barros de S. Pedro da Torre; ao Sr. José Pomba de Alvaredo; ao Sr. Ilídio e ao Sr. Jorge Calota; ao José Benito Guerreiro e também aos 2 pescadores anónimos que partilharam os registos de pesca desde 2005 a 2011 e da época de 2011.
Ao Sr. Luís Afonso, da empresa “Rei da Enguia e da Lampreia” e ao Sr. Eduardo pela constante disponibilidade e pelo importante contributo que fazem à ciência.
Às pessoas com quem cresci e mais contribuíram para o que sou hoje: aos meus pais, à minha irmã e ao Hugo e aos meus avós, tios e primos.
Por fim, à Sílvia pela paciência que o mestrado exigiu, pela cumplicidade e pelos sonhos que nos guiam.
Parte dos resultados foram obtidos no âmbito do projecto Natura Minho-Miño - “Valorização dos recursos naturais da bacia hidrográfica do Miño-Minho” (POCTEP/FEDER) e do projecto MIGRANET – “Observatório das populações de peixes migradores no Espaço Sudoe” (MIGRANET-SOE2-P2-288-2011-020).
Resumo
Resumo
A lampreia-marinha, Petromyzon marinus, é uma das seis espécies diádromas capturadas ao longo do troço internacional do rio Minho. Durante o Inverno e a Primavera, as lampreias adultas sobem os rios para realizar as posturas e morrer. Tem-se registado uma diminuição generalizada na abundância de lampreia-marinha nos rios europeus, contudo tem-se verificado uma tendência no aumento das capturas declaradas do rio Minho, por um número de pescadores profissionais que se tem mantido constante ao longo dos anos. Com este trabalho pretendeu-se (1) determinar os níveis de metais (Cd, Cr, Cu, Fe, Mn, Pb e Zn) no músculo, gónada e fígado de fêmeas adultas e em amocetes e (2) determinar a composição nutricional (matéria seca, cinza, proteína, energia e lípidos totais) e os grupos de ácidos gordos da posta, da gónada e do fígado de lampreias adultas capturadas em três pontos do rio Minho internacional durante a migração.
Os amocetes estão susceptíveis à acumulação de metais devido à sua alimentação por filtração e à absorção através da derme por viverem enterradas no sedimento durante vários anos. Verificou-se que os níveis de Fe, Mn e Zn aumentam significativamente com o tamanho dos amocetes (p<0,05), sendo que o Fe é o elemento com valores mais elevados na fase de amocete e também no músculo e no fígado das fêmeas adultas. O fígado das fêmeas adultas é o órgão com níveis mais elevados de Cd, Cu, Fe, Mn, Pb e Zn. Também se verificaram valores de Zn próximos nas gónadas e no fígado e de Cr no músculo e no fígado. Os níveis de Fe nos três tecidos das fêmeas adultas e os níveis de Cu no fígado parecem sugerir uma diminuição significativa (p<0,01) ao longo da migração, provavelmente devido à cessação da alimentação. Pelo contrário, os valores de Cd, Mn, Pb, Zn no fígado, parecem aumentar significativamente ao longo da migração (p<0,05). O Cd e Pb não têm funções conhecidas para os organismos vivos e nos tecidos das fêmeas estes metais estavam abaixo dos teores máximos admissíveis para peixe fresco. Verificou-se que os VDR (Valores Diários de Referência) de Cr, Cu, Fe e Zn não são alcançados em 100 g de tecido de adultos. As fêmeas têm uma maior percentagem de VDR de metais do que o músculo.
A composição nutricional mostrou um aumento significativo da proteína e uma redução dos lípidos na posta, sugerindo uma elevada importância deste tecido como fonte de energia para os machos durante a migração. O fígado das fêmeas parece fornecer a energia necessária para a migração, uma vez que os seus níveis diminuem acentuadamente (0,02<p<0,04), quando se comparam as lampreias capturadas junto à foz e a montante. Um pequeno mas significativo aumento da energia da gónada das
fêmeas é também aparente para os mesmos indivíduos, apesar da ausência de diferenças significativas nos níveis de proteína nos três pontos de amostragem.
Deverão ser definidas medidas de conservação integradas para promover a sustentabilidade das populações diádromas do rio Minho, dado que o habitat disponível estimado para a lampreia-marinha é bastante reduzido (considerando a totalidade da bacia hidrográfica do rio Minho, apenas 1,74 % na área portuguesa da bacia está disponível) e esta espécie é importante para a nutrição humana e para o balanço energético de todo o ecossistema.
Palavras-chave: Petromyzon marinus, rio Minho, metais, composição nutricional,
VDR (Valor Diário de Referência).Abstract
Abstract
The sea lamprey, Petromyzon marinus, is one of the six diadromous species angled along the international section of Minho River. This species swim upstream to spawn and die during winter and spring. There is a generalized tendency to diminution of lamprey abundances in European rivers; however, there is a tendency in increasing numbers of declared captures in Minho River, by a standing number of professional fishermen through the years. I aimed to (1) determine the levels of metals (Cd, Cr, Cu, Fe, Mn, Pb and Zn) in the muscle, gonads and liver of female migrating lampreys and ammocoetes; and (2) determine the nutritional composition (dry matter, ash, lipids and energy) of eviscerate slice of carcass, gonads and liver of adult lamprey fished downstream, intermediate and upstream of Minho River international section during spawn migration.
The ammocoetes are vulnerable to metal accumulation due to filter feeding and dermal absorption as they live several years in burrows. It was found that Fe, Mn and Zn increase significantly with ammocoetes length (p<0.05), and the Fe levels are higher levels in ammocoetes and also in muscle and liver of adult migrating female. The liver of adult females is the organ with higher levels of Cd, Cu, Fe, Mn, Pb and Zn. Hence, Cr levels were higher in the muscle and Zn gonads levels were close to liver levels. The Fe levels in the three tissues and the Cu liver levels point that there is a significant decrease (p<0,01) during the migration, apparently due to feeding cessation. On the contrary, Cd, Mn, Pb and Zn liver levels, seemed to increase significantly (p<0.05) throughout migration. The Cd and Pb are unnecessary to the living organisms, and the levels of these elements were below maximum concentration limits for fresh fish tissue. It was shown that DRI (Daily Reference Intakes) for Cr, Cu, Fe and Zn are not achieved with 100 g of adult tissues. The female gonads have higher percentages of DRI for metals than muscle.
The nutritional composition analysis showed a significant increase in protein and a reduction in lipid content of the eviscerated carcass, suggesting that such tissue is important lipid source in the male during migration. The females liver seems to provide the necessary energy to migration, as the lipid levels sharply decreased (0.02< p<0.04), when comparing lampreys captured downstream with upstream. A slight but significant increase of gonads energy is also apparent from the analysis of the same female lampreys, despite the absence of significant differences in protein levels at the three sampling points.
Appropriate measures of conservation should be undertaken in order to encourage the sustainability of the diadromous populations of Minho River, as the
estimated available habitat for the sea-lamprey is quite small considering the total watershed area (only 1.74% of the total Portuguese area is available) and sea lamprey contributes locally to the human nutrition and to the energetic balance of the ecosystem.
Keywords
: Petromyzon marinus, lamprey, Minho River, metal, nutritional
content, DRI (Daily Reference Intake).Índice
Índice
Agradecimentos ………... i Resumo ……….. iii Abstract ………... v Abreviaturas e Símbolos ………... x Índice de Tabelas ………... xiÍndice de Figuras ………. xii
1 Introdução ... 1 1.1 Petromyzontiformes ... 1 1.2 A lampreia-marinha ... 2 1.2.1 Sistemática... 2 1.2.2 Sinónimos ... 2 1.2.3 Ciclo de vida... 3 1.2.4 Morfologia ... 5 1.2.5 Habitat dulçaquícola ... 8 1.2.6 Alimentação ... 9 1.2.7 Distribuição ... 9 1.2.8 “Homing” ... 10 1.2.9 Estatuto de Conservação ... 11
1.3 Exploração comercial da lampreia-marinha ... 12
1.3.1 Valores oficiais de capturas ... 13
1.3.2 Artes de pesca ... 14 1.4 Metais ... 15 1.5 Composição nutricional ... 18 1.6 Objectivo... 19 2 Material e métodos ... 21 2.1 Área de estudo ... 21 2.1.1 Rio Minho ... 21 2.1.2 Geologia e litologia ... 21 2.1.3 Clima ... 22 2.1.4 Estuário ... 22 2.1.5 Hidrologia ... 23 2.1.6 Caracterização físico-química... 24 2.2 Caracterização do habitat ... 24
2.2.1 Caracterização dos pontos de amostragem ... 24
2.2.2 Cálculo da área disponível ... 25
2.2.3 Dados biológicos de reprodutores ... 26
2.3 Caracterização ecológica ... 27
2.3.1 Amocetes ... 27
2.3.2 Lampreias adultas ... 29
2.4 Determinação dos níveis de metais ... 30
2.4.1 Amocetes ... 31
2.4.2 Adultos ... 32
2.4.3 Procedimento experimental ... 32
2.5 Composição nutricional ... 34
2.5.1 Determinação de matéria seca e cinza ... 34
2.5.2 Determinação da quantidade de lípidos totais... 35
2.5.3 Determinação de proteínas por combustão ... 35
2.5.4 Determinação de energia total ... 36
2.5.5 Análise do perfil de ácidos gordos ... 36
2.5.6 Análise dos resultados ... 37
3 Resultados ... 39
3.1 Caracterização do habitat ... 39
3.1.1 Caracterização dos pontos de amostragem ... 39
3.1.2 Cálculo da área disponível ... 40
3.1.3 Actividade piscatória ... 41 3.2 Caracterização ecológica ... 44 3.2.1 Amocetes ... 44 3.2.2 Lampreias adultas ... 46 3.3 Metais ... 47 3.3.1 Amocetes ... 47 3.3.2 Lampreias adultas ... 51
3.3.3 Níveis médios em peso húmido ... 57
3.4 Composição nutricional ... 59 4 Discussão ... 67 4.1 Caracterização do habitat ... 67 4.2 Caracterização ecológica ... 71 4.2.1 Amocetes ... 71 4.2.2 Lampreias adultas ... 72 4.3 Metais ... 73 4.3.1 Cádmio ... 74 4.3.2 Crómio ... 75 4.3.3 Cobre ... 76 4.3.4 Ferro ... 77 4.3.5 Manganês ... 78 4.3.6 Chumbo ... 79 4.3.7 Zinco ... 80 4.3.8 Comentário final ... 81 4.4 Composição nutricional ... 82 4.4.1 Qualidade alimentar ... 84 4.5 Conservação ... 85 5 Referências ... 89 ANEXOS ... i
ANEXO I. Caracterização dos locais de amostragem de amocetes por pesca eléctrica . ii ANEXO II. Resumo de presenças de amocetes por ponto de amostragem. ... iv
ANEXO III. Características biométricas dos amocetes ... v
ANEXO IV. Características biométricas e merísticas dos amocetes ... vi
ANEXO V. Características biométricas das lampreias adultas ... x
ANEXO VI. Características biométricas das lampreias adultas ... xii
Índice ANEXO IX. Concentração de ácidos gordos em lampreias adultas. ... xvii ANEXO X. Fotografias ... xx
Índice de abreviaturas e símbolos
AGI Ácidos gordos insaturadosAGMI Ácidos gordos monoinsaturados AGPI Ácidos gordos polinsaturados AGS Ácidos gordos saturados Cd Cádmio
CPUE Capturas Por Unidade de Esforço Cu Cobre
Cr Crómio Fe Ferro
ICE Índice de carcaça eviscerada (%) IGS Índice gonadossomático (%) IHS Índice hepatossomático (%) Mn Manganês
Pb Chumbo
ppb partes por milhar de milhão (µg.kg-1 ou ng.g-1) ppm partes por milhão (µg.g-1 ou mg.kg-1)
VDR Valor Diário de Referência Zn Zinco
Índice de Tabelas
Índice de Tabelas
Tabela 1. Fases de desenvolvimento das lampreias (adaptado de Hardisty, 1986a), ... 4
Tabela 2. Parâmetros físico-químicos da água do rio Minho. ... 24
Tabela 3. Largura média por valor de ordem de Strahler. ... 26
Tabela 4. Lista e símbolos dos metais analisados. ... 31
Tabela 5. Classes de comprimento dos amocetes e respectiva idade estimada. ... 31
Tabela 6. Níveis de metais nos materiais de referência. ... 33
Tabela 7. Níveis dos limites de detecção dos metais analisados. ... 33
Tabela 8. Habitat disponível para a lampreia-marinha na bacia do rio Minho internacional. ... 41
Tabela 9. Parâmetros biométricos médios por estado de desenvolvimento. ... 45
Tabela 10. Parâmetros da relação biométrica dos amocetes do rio Minho e afluentes. ... 46
Tabela 11. Caracterização biométrica e índices das lampreias adultas. ... 47
Tabela 12. Caracterização biométrica das lampreias adultas. ... 47
Tabela 13. Características biométricas dos amocetes. ... 48
Tabela 14. Coeficientes dos níveis de metais em função do comprimento. ... 48
Tabela 15. Parâmetros obtidos no procedimento WingMav – níveis em amocetes ... 49
Tabela 16. Níveis de metais em amocetes. ... 50
Tabela 17. Parâmetros obtidos no procedimento WingMav – níveis em adultos. ... 51
Tabela 18. Níveis médios dos metais em peso húmido de amocetes e adultos. ... 58
Tabela 19. Percentagem do VDR de metal por 100 g de tecido. ... 59
Tabela 20. Índices morfológicos e composição corporal (posta) dos machos. ... 60
Tabela 21. Ácidos gordos da posta, fígado e gónada de fêmeas. ... 64
Índice de Figuras
Figura 1. Lampreia-marinha, Petromyzon marinus. ... 2
Figura 2. Amocete de lampreia-marinha. ... 3
Figura 3. Ninho de lampreia-marinha. ... 4
Figura 4. Disco bocal da lampreia-marinha. ... 7
Figura 5. Capturas anuais de lampreia-marinha no rio Minho. ... 13
Figura 6. Recolha de uma lampreia capturada com lampreeira. ... 14
Figura 7. Pesqueira do rio Minho. ... 15
Figura 8. Bacia hidrográfica do rio Minho internacional e o seu enquadramento na Península Ibérica. ... 21
Figura 9. Caudal do rio Minho. ... 23
Figura 10. Caudal do rio Minho sobre a influência de maré viva. ... 23
Figura 11. Locais de amostragem de amocetes. ... 28
Figura 12. Parâmetros biométricos medidos em amocetes e respectivos acrónimos. . 29
Figura 13. Pontos de amostragem dos adultos migradores. ... 29
Figura 14. Parâmetros biométricos registados nos adultos e respectivos acrónimos. . 30
Figura 15. Amostra de posta. ... 34
Figura 16. Temperatura da água na Marina da Lenta. ... 40
Figura 17. Capturas totais declaradas e capturas por época por embarcação. ... 42
Figura 18. Valores médios mensais de capturas por saída na época de 2011. ... 43
Figura 19. Valores médios mensais de capturas por saída entre 2005 e 2011. ... 43
Figura 20. Ocorrência de amocetes. ... 44
Figura 21. Biomassa e densidade de amocetes nos afluentes do rio Minho. ... 45
Figura 22. Concentração de cádmio nos tecidos de lampreias fêmeas adultas. ... 52
Figura 23. Concentração de crómio nos tecidos de lampreias fêmeas adultas. ... 53
Figura 24. Concentração de cobre nos tecidos de lampreias fêmeas adultas. ... 53
Figura 25. Concentração de ferro nos tecidos de lampreias fêmeas adultas. ... 54
Figura 26. Concentração de manganês nos tecidos de lampreias fêmeas adultas. .... 55
Figura 27. Concentração de chumbo nos tecidos de lampreias fêmeas adultas. ... 56
Figura 28. Concentração de zinco nos tecidos de lampreias fêmeas adultas. ... 57
Figura 29. Percentagem de matéria seca, lípidos e proteína em peso húmido das lampreias fêmeas. ... 61
Figura 30. Conteúdo energético das gónadas e do fígado das lampreias fêmeas. ... 62
Introdução
1 Introdução
1.1 Petromyzontiformes
São conhecidas cerca de 50 espécies de lampreias da ordem Petromyzontiformes (do latim petra i.e. pedra e do grego myzon i.e. sugador), no entanto hoje em dia existem aproximadamente 38 (Hardisty, 1986a; Hardisty, 2006; Janvier, 2007). A forma da boca (ou “sugador bocal”/ventosa) diferencia estes vertebrados anguiliformes dos peixes verdadeiros e outros vertebrados (Janvier, 2007). Juntamente com os myxiniformes, as lampreias são consideradas os únicos representantes dos agnatas (organismos sem mandíbula) em toda a evolução dos vertebrados. São também designados por ciclóstomos dado a sua boca ter a forma de disco. Não possuem escamas, apenas possuem duas barbatanas dorsais dispostas longitudinalmente e uma barbatana caudal alongada, possuem um único orifício olfactivo e sete orifícios branquiais sem opérculo ao contrário dos peixes vertebrados mandibulados ou gnatostomados (Maitland, 2003; Janvier, 2007).
As lampreias são consideradas fósseis vivos, a par do Limulus polihemus (Classe Merostomata), da Latimeria chalumnae (Coelacanto) e dos Sarcopterygii (Selander et al., 1970; Riska, 1981; Eldredge & Stanley, 1984; Hardisty, 2006). O conceito de fóssil vivo, apesar de vago e subjectivo, é aplicado no âmbito da sistemática evolutiva quando nos referimos a espécies com caracteres morfológicos que apareceram filogeneticamente muito cedo e que foram mantidos por um longo período (Janvier, 2007). As lampreias e os myxini são os únicos exemplos de taxa "pancrónicos" referidos como fósseis vivos devido à sua capacidade de adaptar-se e persistirem ao longo do tempo (Janvier, 2007). Existem evidências paleo-biológicas que revelam que houve conservação de algumas características primitivas de fósseis de lampreias com 450 milhões de anos que se alteraram muito pouco morfologicamente do ponto de vista evolutivo em relação aos seus antepassados (Maitland, 2003; Hardisty, 2006; Janvier, 2007). As primeiras lampreias conhecidas têm 360 milhões de anos e possuíam uma morfologia geral muito semelhante às actuais, nomeadamente a morfologia do esqueleto da região cefálica, a existência de uma cartilagem anular em torno da boca, a cartilagem lingual tipo pistão e a forma de fixação tipo ventosa (Janvier, 2007).
As várias espécies diferenciam-se ecologicamente nos parâmetros biométricos, forma e número de dentes do disco bocal, tipo de alimentação e habitats onde se desenvolvem (Janvier, 2007). É notável que cerca 60 a 80 % do ciclo de vida, que
corresponde à duração da fase de amocete, estas espécies não possuem visão (Hardisty, 1986a).
1.2 A lampreia-marinha
1.2.1 Sistemática
Em Portugal existem três espécies de lampreia: Lampetra
fluviatilis, Lampetra planeri e
Petromyzon marinus (figura 1),
sendo que apenas a presença da última é citada na bacia hidrográfica do rio Minho, onde é conhecida como
lampreia de mar ou lampreia-marinha (Antunes & Rodrigues, 2004; Almeida et al., 2011; Braga et al., 2011). A sua sistemática está representada de seguida (Hardisty, 1986a e b; Janvier, 2007):
Reino Animalia Filo Chordata
Classe Petromyzontida ou Hyperoartia Ordem Petromyzontiformes
Família Petromyzontidae
Subfamília Petromyzontinae
Género Petromyzon
Espécie Petromyzon marinus (Linnaeus, 1758)
1.2.2 Sinónimos
Existem vários sinónimos na literatura para referir P. marinus. Estes encontram-se reunidos a partir dos trabalhos de Afonso (1989), Hardisty (1986b) e Blanco & Gonzaléz (2005) por ordem alfabética:
Ammocoetes bicolor LeSueur, 1818 Bathymyzon bairdii Gill, 1884 Lampetra marina Malm,1863 Oceanomyzon wilsoni Fowler, 1908 Petromyzon adriaticus Nardo, 1847 Petromyzon americanus LeSueur, 1818 Petromyzon bairdii Gill, 1883
Petromyzon concolor Wright, 1892
Introdução
Petromyzon lampetra Pallas, 1811 Petromyzon maculosus Gronow, 1854 Petromyzon marinus Gray, 1851 Petromyzon marinus Linnaeus, 1758 Petromyzon marinus dorsatus Berg, 1931 Petromyzon marinus dorsatus Wilder, 1883 Petromyzon marinus unicolor Gage, 1928 Petromyzon marinus unicolor Meek, 1886 Petromyzon maximus Cuvier, 1816 Petromyzon nigricans LeSueur, 1818 Petromyzon ruber Lacepède, 1800
1.2.3 Ciclo de vida
As lampreias-marinhas são organismos semelparos, pois desenvolvem um único ciclo de vida anádromo: nascem em águas continentais, passam a fase adulta em meio marinho e migram posteriormente rio acima para se reproduzir e morrer (Hardisty & Potter, 1971a e b). Após os 18 estádios embrionários que duram entre 17 a 33 dias, com uma temperatura da água aproximada de 22ºC, os amocetes de lampreia-marinha são empurrados para jusante dos sítios onde foi realizada a postura, até zonas de remanso onde se enterram (Applegate, 1950; Piavis,
1971). Quando preparadas para a alimentação emergem parcialmente do substrato. Esta fase é denominada de “amocete” (derivada de Ammocoete do grego ámmo i.e. areia e de koítē i.e. cama;
figura 2) e está restrita à água doce em todas as espécies de lampreia. Estes organismos vivem enterrados em zonas de substrato mole e na presença de vegetação (Applegate, 1950; Taverny et al., in press). Não são encontrados amocetes a montante das zonas de postura, dado que vão descendo gradualmente as linhas de água (Applegate, 1950). Em Portugal, o tempo médio de descida dos rios varia, sendo regra geral aceite um período superior a 4 anos e inferior a 7 (Afonso, 1989; Quintella et al., 2003). A distinção das fases de amocetes em metamorfose e de lampreias metamorfoseadas é feita através de (1) perda da cápsula oral em forma de U; (2) desenvolvimento do disco oral com dentes e pistão lingual cartilagíneos; (3) aparecimento dos olhos à superfície e a aquisição de visão; (4) alteração da cor castanha para um azul acinzentado na zona dorsal e prateado/esbranquiçado na zona ventral; (5) aumento em altura de ambas as barbatanas dorsais (Applegate, 1950). A metamorfose terá uma duração entre 1 mês e 3 meses, sendo importante na preparação dos organismos para o habitat estuarino e para o novo tipo de alimentação parasitária (Applegate, 1950; Ducasse & Leprince, 1980; Afonso, 1989).
Posteriormente seguem para as águas costeiras onde irão permanecer mais de 18 meses (Hardisty & Potter, 1971a). As condições em que estes organismos se desenvolvem no mar ainda são pouco conhecidas, dado que a sua captura é ocasional (Kircheis, 2004). Promovida por factores ambientais e fisiológicos, as lampreias-marinhas adultas acumulam-se junto da desembocadura dos rios durante a Primavera e Verão e iniciam a
migração para os rios onde se irão reproduzir (Hardisty & Potter, 1971b). Durante esta fase migratória o sistema digestivo atrofia dado que cessam a alimentação (Applegate, 1950; Youson, 1981a). As zonas de postura são caracterizadas pelo sedimento com gravilha e seixo e com águas rápidas e de pouca profundidade. Antes de depositarem os ovos, as lampreias formam ninhos através da fixação da sua boca e arrastamento dos seixos, formando depressões no leito das linhas de água (figura 3.). O macho inicia a formação do ninho, sendo depois acompanhado por uma ou mais fêmeas (Kircheis, 2004). Toda a população reprodutora que sobe em determinado momento acaba por morrer, ao contrário do que acontece com outras populações de espécies migradoras diádromas (Hardisty & Potter, 1971). Hardisty (1986a) realizou um resumo das fases de desenvolvimento dos Petromyzontiformes com base nos dados de Balabai (1954) e Potter et al. (1982) (tabela 1).
Tabela 1. Fases de desenvolvimento das lampreias (adaptado de Hardisty, 1986a),
Fase Descrição
Larva / Amocete
Lábio superior rectangular formando uma cobertura. Cirros orais ramificados na superfície ventral do lábio superior e na superfície dorsal do lábio inferior. Aberturas branquiais triangulares localizadas numa fenda longitudinal.
Amocete em metamorfose
1 Pequenos olhos tornam-se visíveis; início do espessamento e encurtamento do lábio superior; cirros dorsais anteriores menos ramificados.
2 Mais espessamento e encurtamento do lábio superior, redução do tamanho dos cirros orais; aberturas triangulares orais começam a adquirir forma oval; lábio transversal encurta e largura oral diminui; extremidade anterior menos profunda e mais arredondada; cirros transversais posteriores menos ramificados.
Figura 3. Ninho de lampreia-marinha.
Introdução Tabela 1. Fases de desenvolvimento das lampreias (continuação)
Fase Descrição
Amocete em metamorfose (cont.)
3 Cobertura oral desaparece completamente; lábio superior funde-se aos limites laterais do lábio inferior; uma fenda longitudinal estreita está presente no lado ventral do lábio inferior; limite anterior do lábio superior torna-se arredondado; os cirros orais reduzem-se a pequenos tubérculos probosciformes; olhos marcadamente maiores; aberturas branquiais ovais; pequenas marcas à frente e sob os olhos e ventralmente entre o olho e a primeira abertura branquial; maior parte dos cirros anteriores reduzidos a pequenas papilas; cirros posteriores menos ramificados mas mais conspícuos com extensão frontal até à extremidade anterior; separação parcial da íris e da pupila nos olhos.
4 Limite anterior do lábio superior completamente arredondada; redução no tamanho dos cirros orais remanescentes; apenas cirros anteriores de maiores dimensões permanecem visíveis; cirros posteriores reduzidos a pequenas papilas; olhos projectados; pupila distinta da íris cinzenta; fenda na zona branquial menos distinta; em P. marinus, o pistão está pouco visível, aumento em altura da primeira e segunda barbatanas dorsais.
5 Desaparecimento da fenda longitudinal ventral do lábio inferior; abertura oral com forma oval e pode ser contraída até uma pequena invaginação; aparecimento de pequenas fímbrias orais na periferia da abertura oral; poucos cirros orais de pequenas dimensões permanecem dentro da boca; aberturas branquiais deixam de estar unidas pela fenda branquial; a cor dorsal e lateral torna-se mais escura e o ventre torna-se prateado; a pupila escurece e a íris torna-se prateada; mais crescimento em altura das barbatanas dorsais; extremidade anterior mais alinhada; em P. marinus torna-se visível a lâmina infra-oral; crescimento pontiagudo dos cúspes; presença das lamelas longitudinais e transversais.
6 Fímbrias orais aumentam em tamanho e forma-se a coroa de fímbrias; cirros orais completamente substituídos por tubérculos orais independentes; aparecimento de pequenas fendas transversais na garganta; alargamento pronunciado do focinho; cor verde escura dorsal e lateralmente; ventre prateado/esbranquiçado; aberturas branquiais pronunciadamente ovais; mais alargamento dos olhos; íris prateadas claras; lâmina supra-oral visível; lâmina lingual alargada e branca.
Adulto pré-reprodutor
7 Paredes da cavidade oral tornam-se alargadas; presença de dentes cónicos; aprofundamento e alargamento lateral da fenda transversal da “garganta”; aumento em altura, especialmente da segunda barbatana dorsal; mais alargamento dos olhos, barbatanas maiores e proeminentes; cúspes mais largos, apontados e amarelo-pálidos; cúspes espinhosos na lâmina infra-oral; lâmina lingual esbranquiçadas amareladas, com cúspes ou em forma de serra; cor prateada brilhante; alargamento do disco oral; fimbrias orais formam uma densa coroa; mais crescimento em comprimento da região pré-nasal. Adulto reprodutor
Marcado encurtamento do comprimento; enrugamento da pele; barbatanas dorsais unidas na base; o dorso e parte lateral tornam-se escuros.
1.2.4 Morfologia
Todas as espécies de lampreia possuem um corpo anguiliforme desprovido de barbatanas pares e o comprimento total no estado adulto varia entre os 80 e os 1000
mm, sendo que de entre todas a lampreia-marinha Petromyzon marinus é a maior, alcançando no máximo 1200 mm de comprimento e 2300 g de peso (Hardisty, 1986a e b). A pele das lampreias é lisa e desprovida de escamas, com glândulas que produzem muco.
Os amocetes sofrem uma metamorfose que envolve a aquisição da visão, alterações da cor da pele e desenvolvimento do disco bocal e de dentes queratinosos. As duas barbatanas dorsais, que estão unidas durante a fase de amocete, separam-se e torna-se mais evidente a sua forma triangular após a metamorfose. A barbatana dorsal posterior é maior que a anterior e ambas são suportadas por raios cartilagíneos associados aos músculos radiais (Hardisty, 1986b). Os dentes duros e afiados dos adultos encontram-se dispostos concentricamente no disco bocal, aumentando em tamanho com a aproximação ao centro (Hubbs & Potter, 1971). Em redor do seu disco bocal existem pequenas extensões na pele (entre 130 a 150) denominadas “fímbrias orais” secretoras de muco durante a alimentação (Hardisty, 1986b; Maitland, 2003). Lateralmente e abaixo do disco oral e à frente dos olhos localizam-se pequenos órgãos sensíveis electricamente que fazem parte do sistema da linha lateral (Albert & Crampton, 2005). Na superfície dorsal existe um “nostril”, ou abertura nasohipofisial, que contacta internamente com o sistema naso-hipofisial. Numa posição anterior ao nostril encontra-se a pineal sob uma pequena zona de pele mais clara e sobre o “di-encéfalo”. Durante a fase de amocete, as brânquias localizam-se sobre uma fenda longitudinal e posteriormente à metamorfose a fenda desaparece, formando-se sete orifícios ovalados independentemente alinhados, em posição posterior aos olhos de cada um dos lados da lampreia e cujo funcionamento permite a respiração através do bombeamento de água para dentro e para fora desses orifícios (Hardisty, 1986a). Esta forma de respiração desenvolveu-se porque durante a sua fixação aos hospedeiros, a lampreia não consegue fazer entrar água pelo disco. No entanto, também existem ductos que permitem a passagem de água entre o disco e as brânquias (Evans et al., 2005). As lampreias não possuem um “verdadeiro” estômago, apenas um intestino alargado desde a abertura esofágica até à cloaca, o coração está confinado dentro de uma cápsula cartilagínea periférica, o esqueleto é totalmente cartilagíneo e a coluna vertebral é achatada e assenta no notocórdio que confere rigidez ao organismo (Hardisty, 1986a).
De acordo com o estudo de Dawson (1905) sobre a Lampetra wilderi e
Ichthyomyzon concolor, verifica-se que quando fixas numa placa de vidro, o disco oral
das lampreias ajusta-se no “plano” e desliza nessa superfície. Este autor também verificou que as lampreias se mantêm fixas após morrerem, ou seja, o vácuo não é devido à acção muscular, mas sim devido ao desenvolvimento da cápsula oral. Assim, é
Introdução possível que muitas vezes as lampreias permaneçam fixas a hospedeiros e ao substrato (seixos ou pedras grandes) durante as migrações sem qualquer consumo de energia.
Durante a migração reprodutora verificam-se alterações morfológicas que aprofundam o dimorfismo sexual. O espaço entre as barbatanas dorsais desaparece, o comprimento do corpo reduz-se, a pele fica enrugada, as barbatanas unem-se na base, o dorso e a parte lateral torna-se mais escura. Nos machos desenvolve-se uma estrutura evidente em forma de corda ao longo do dorso e nas fêmeas desenvolve-se uma prega junto do orifício genital durante a época de reprodução (Hardisty, 1986a). De entre todos os Petromyzontiformes, a lampreia-marinha é a espécie que realiza a postura de um maior número de ovos, entre 152 000 e 304 000 e as contagens de oócitos em amocetes dão valores entre 182 00 e 328 000 (Applegate, 1950; Hardisty, 1971, Hardisty & Potter, 1971a).
Apesar de no meio nativo a lampreia-marinha realizar migrações anádromas anfialinas, nos meios onde é considerada uma praga (Grandes Lagos, EUA) todo o ciclo de vida da espécie é passado em água doce. Verificam-se variações morfológicas entre estes dois grupos (Applegate, 1950; Smith, 1971). No que se refere à forma restrita a água doce, o número de ovos é inferior (entre 21 000 e 107 000 em adultos), a fecundidade é superior (344 em vez de 233), o número de oócitos em amocetes é entre 114 000 e 165 000 e também do ponto de vista da biometria há diferenças, dado que o comprimento total dos adultos é mais reduzido (320 a 536 mm; Applegate, 1950; Hardisty, 1971; Hardisty & Potter, 1971b).
1.2.4.1 Chave de identificação
A lampreia-marinha é a única espécie do género
Petromyzon. Este género distingue-se das outras duas
espécies que ocorrem em Portugal (L. fluviatilis e L.
planeri) pelas suas características biométricas e merísticas, nomeadamente: comprimento e peso total, número de miómeros (blocos de tecido conjuntivo em
zig-zag que se encontram ao longo de todo o corpo, com
maior visibilidade nos amocetes) do tronco e tipo, número e posição dos dentes no disco bocal (Hubbs & Potter,
1971; Hardisty, 1986a e b, figura 4). De acordo com Zerunian (2004), os indivíduos adultos do género Petromyzon e Lampetra distinguem-se pelas seguintes características:
Figura 4. Disco bocal da lampreia-marinha.
- Placa supra-oral estreita; dentes labiais numerosos e dispostos em série; comprimento total grande (até cerca de 90 cm) ..………. Petromyzon - Placa supra-oral grande, dentes labiais escassos e não dispostos em série, tamanho pequeno ou médio (até 30-35 cm) ... Lampetra 1. Dentes labiais posteriores presentes (embora muitas vezes não estejam visíveis porque encontram-se escondidos no muco), e dois cúspides médios na placa lateral ……….…… L. zanandreai - Dentes labiais posteriores ausentes; três cúspides na placa média lateral ………..………... 2 2. 52-66 miómeros entre o último orifício branquial e o ânus; tamanho pequeno (20 cm) ...L. planeri - 63-70 miómeros entre o último orifício branquial e o Ânus; tamanho médio (20-35 cm) ………... L. fluviatilis
Os amocetes de Petromyzon marinus distinguem-se dos amocetes de L. fluviatilis e L. planeri pela maior intensidade de pigmentação na zona da cápsula oral e das zonas pré-branquiais e pré-orbitais na lampreia-marinha (Hardisty, 1986b; Gardiner, 2003). O número de “tentáculos velares” (i.e. estruturas precursoras do pistão cartilagíneo oral que ocorrem no interior da cápsula oral) podem ser utilizadas como estruturas taxonómicas (Hardisty, 1986a), sendo o seu número mais elevado nas espécies parasíticas. O número de miómeros também é uma importante característica taxonómica (Hardisty, 1986a).
1.2.5 Habitat dulçaquícola
De acordo com Harvey & Cowx (2003), os amocetes de lampreias-marinhas partilham microhabitats de semelhantes características com outras espécies de lampreias, no entanto frequentam zonas espaciais diferentes, sendo a lampreia-marinha tipicamente encontrada nas zonas mais próximas dos estuários. As preferências da lampreia-marinha também parecem variar com a fase do ciclo de vida em que se encontram (Maitland, 2003; Almeida et al., 2002; Almeida & Quintella, 2002).
Os habitats dos amocetes de lampreia-marinha são áreas tipicamente sem flutuações de nível da água ou corrente e de velocidade baixa, sendo estas condições comuns junto de meandros, onde se acumulam elementos siliciosos e arenosos e detritos orgânicos (raízes de árvores submersas) próximos de margens ricas em vegetação, promovendo substrato adequado para os amocetes se enterrarem, sendo a percentagem de areia um dos componentes que define a distribuição destes organismos (Harvey & Cowx, 2003; Almeida & Quintella, 2002). Reconhece-se ainda que o tamanho das partículas afecta a distribuição de amocetes, pois em função da classe de tamanho os
Introdução amocetes têm preferências por habitats com diferentes tamanhos de partículas (Almeida & Quintella, 2002). Segundo estes autores, enquanto os amocetes de tamanhos menores (20-60 mm) preferem locais com sedimentos mais finos, os amocetes de tamanhos intermédios (60-140 mm) têm preferência por sedimentos mais heterogéneos e os amocetes de tamanhos maiores (140-200mm) preferem sedimentos de gravilha e areia.
1.2.6 Alimentação
Os amocetes alimentam-se de algas, microorganismos e principalmente detritos orgânicos (Moore & Mallat, 1980; Sutton & Bowen, 1994). No final da metamorfose há uma interrupção na paragem da alimentação que tem como consequência uma perda de peso (Applegate, 1950; Afonso, 1989). A espécie Petromyzon marinus é uma das 18 espécies de Petromyzontiformes que vivem parasitariamente e que se alimentam de sangue. As restantes espécies não se alimentam nem crescem enquanto adultas (Hardisty, 1986a). As lampreias metamorfoseadas macroftálmicas iniciam a alimentação de forma parasitária durante a sua permanência nos estuários, fixando o disco bocal às secções laterais dos hospedeiros tais como mugilídeos. Este tipo de alimentação continua durante a fase adulta com a ingestão de fluídos e músculo de salmonídeos, clupeídeos, mugiliformes e também de mamíferos marinhos (Beamish, 1980; Nichols & Hamilton, 2004; Nichols & Tscherter, 2011). Verificam-se muitos impactos ecológicos pelas espécies parasitárias de lampreia. Beamish & Neville (1995) verificaram elevadas mortalidades de espécies como salmão do Pacífico, Oncorhynchus tshawytscha e arenque do Pacífico, Clupea pallasii, devidas a Lampetra ayresi. Applegate (1950) verificou haver uma relação entre as percentagens de abundância de lampreias-marinhas e o número de cicatrizes de lampreia-marinha em ciprinídeos. Este autor verificou que a lampreia-marinha pode desenvolver um estilo de alimentação canibal, sem ainda se saber se esta atitude é desenvolvida apenas em caso de escassez de alimento.
1.2.7 Distribuição
A lampreia-marinha encontra-se distribuída pela costa Atlântica da Europa, desde a Noruega, até à parte Oeste do Mediterrâneo e também desde a costa do Canadá na América do Norte até ao Sul da Florida (Hubbs & Potter, 1971; Hardisty, 1986b). Uma grande parte dos estudos sobre a lampreia-marinha tem sido direccionada com a presença desta espécie nos Grandes Lagos, EUA (Nislow & Kynard, 2009; Andersen et
al., 2010). A responsabilidade do estabelecimento desta espécie a montante das
Cataratas do Niagara, onde a lampreia-marinha não é endémica, é atribuída à construção de um canal de navegação, apesar de haver um desfasamento temporal de cerca de 90 anos entre a abertura do canal de navegação (entre o Atlântico Norte e os Grandes
Lagos) e o estabelecimento da espécie propriamente dito (Applegate, 1950; Smith, 1971). Aí, esta espécie realiza todo o ciclo de vida em água doce. Desde que esta espécie se estabeleceu nos Grandes Lagos muitas medidas têm sido tomadas, incluindo capturas de amocetes, a captura e esterilização de machos, libertação de pesticidas devido aos impactos que causam sobre as espécies endémicas (Applegate, 1950; Smith, 1971).
1.2.8
“Homing”
O comportamento de “homing” (i.e. o regresso dos indivíduos para reprodução nos mesmos rios onde nasceram e se desenvolveram) está comprovado para espécies anádromas (tais como o sável e a savelha, Allosa spp. e o salmão do Atlântico, Salmo
salar), no entanto este comportamento não está comprovado na lampreia-marinha,
(Hardisty & Potter, 1971a; Hardisty 1986a; Maitland, 2003). Esta dúvida é sugerida por vários estudos. Bergstedt & Seelye (1995) obtiveram resultados que apontam para a não existência de “homing” na lampreia-marinha através da realização de marcação, libertação e captura-recaptura de indivíduos metamorfoseados e adultos. Além disso, também não existem diferenças nas frequências de haplótipos de lampreias capturadas ao longo da costa Oeste do Atlântico ao contrário do que acontece com outras espécies, tais como o salmão, Salmo salar ou o esturjão do Atlântico, Acipenser oxyrinchus (Waldman et al., 2008). Uma das razões que pode implicar a não existência do homing na lampreia-marinha está relacionada com o facto da sua alimentação parasitária poder exigir que se dispersem para longe do rio onde nasceram. Contudo, vários estudos indicam que a lampreia-marinha não sobe para realizar a postura em cursos de água onde os amocetes foram exterminados ou removidos em números significativos e onde não existem os fluidos biliares (feromonas) que estes organismos excretam para o meio (Torblaa & Westman, 1980; Li et al., 1995; 2002; 2003). As lampreias na fase reprodutora parecem identificar os rios adequados à postura, através dos ácidos biliares que são libertados por amocetes em desenvolvimento que existem nestes rios, sendo os adultos fortemente atraídos por reduzidas concentrações destas feromonas (Li et al., 1995; Sorensen & Vrieze, 2003; Fine et al., 2004). Os adultos reprodutores conseguem identificar concentrações de um amocete em cerca de 40.000 L de água através de reconhecimento olfactivo (Taverny & Elie, 2009). Esta estratégia pode ter-se desenvolvido uma vez que a existência de amocetes implica a existência de locais adequados para a postura (Li et al., 1995; Sorensen & Vrieze, 2003; Fine et al., 2004;). Contudo, não está comprovado que as lampreias consigam identificar com exactidão os afluentes mais adequados para a postura através deste método (Applegate, 1950).
Introdução
1.2.9 Estatuto de Conservação
Tem-se verificado uma diminuição acentuada à escala europeia da abundância de lampreias-marinhas que entram pelos rios para a reprodução (Maitland, 2003). Esta redução estará relacionada com vários factores de origem antrópica. As principais razões apontadas são a poluição, sobre-pesca, pesca ilegal de reprodutores, a fragmentação, destruição e perda de habitat devido à existência de estruturas como barragens que impedem o acesso a zonas de postura adequadas e a extracção de inertes e regulação de caudais em zonas de desenvolvimento de amocetes (Afonso & Vaz-Pires, 1989; Renaud, 1997; Almeida et al., 2002; Maitland, 2003; Antunes & Rodrigues, 2004; Solórzano, 2004) A existência de barragens e canalização dos rios promovem a eutrofização em albufeiras e impedem a migração para montante e acesso a zonas adequadas de reprodução e desenvolvimento (Nicola et al., 1996; Dagreve, 2005; Limburg & Waldman, 2009). As estruturas que alteram o regime de caudais afectam negativamente a estabilidade dos habitats dos amocetes devido à intermitência das correntes impedindo a fixação dos ovos durante o tempo necessário, e ao aumento e/ou descida súbitos do nível da água em determinados momentos, que podem fazer com que os ovos fiquem expostos em zonas secas quando o caudal é interrompido (Almeida et al., 2002; Maitland, 2003). A degradação da qualidade da água devido à poluição pela existência de descargas de poluentes de origem doméstica, industrial e agrícola poderá impedir o desenvolvimento de amocetes, afectando a sua abundância (Solórzano, 2004; Maitland, 2003).
De acordo com Renaud (1997) e com actualização de IUCN (2011), das cerca de 34 espécies de lampreias que são citadas no Hemisfério Norte, 9 delas encontram-se “Em risco”, uma encontra-se extinta e 9 possuem estatuto de “Vulnerável” pelo menos em parte da sua área de distribuição. A nível global, o estatuto de Petromyzon marinus é “Baixo Risco / Pouco Preocupante” (Freyhof & Kottelat, 2008). A nível nacional o seu estatuto é “Vulnerável” (Cabral et al., 2005) e três documentos principais atribuem protecção legal à lampreia-marinha:
Encontra-se nos anexos B-II e B-V do Decreto-Lei nº 49/2005, de 24 de Fevereiro que ajusta e altera o Decreto-Lei nº 140/99, de 24 de Abril, que transpõe a Directiva Habitats (92/43/CEE), de 21 de Maio, para a legislação nacional. Nestes anexos incluem-se as espécies de plantas e animais de interesse comunitário cuja conservação exige a designação de zonas especiais de conservação e cuja captura ou colheita na natureza e exploração podem ser objecto de medidas de gestão.
Encontra-se no anexo III do documento que transpõe a Convenção de Berna para a legislação nacional, nomeadamente o Decreto-Lei nº316/89, de 22 de Setembro, enquanto espécie de fauna protegida.
Encontra-se também protegida pela Lei nº 2097, de 6 de Junho de 1959 (Lei da pesca nas águas interiores) e respectiva regulamentação (Decreto nº44623, de 10 de Outubro de 1962; Decreto nº312/70, de 6 de Julho e legislação complementar) É referida no Decreto Regulamentar nº43/87, de 17 de Julho e Decreto
Regulamentar nº7/2000, de 30 de Maio e regulamentação complementar (regulamentos de pesca para os rios Minho, Lima, Cávado, Douro, Ria de Aveiro, Mondego, S. Martinho do Porto, Lagoa de Óbidos, Tejo, Sado e Ria Formosa) (Lei da pesca nas águas interiores não oceânicas) (Cabral et al., 2001).
Também em Espanha o estatuo de P. marinus é “Vulnerável” (Doadrio, 2001) e encontra-se no “Catálogo Nacional de Espécies Amenazadas” (2002) classificada como “em Perigo de extinção” quanto às populações do Guadiana, Guadalquivir, Sul de Espanha e Ebro.
1.3 Exploração comercial da lampreia-marinha
Portugal é um dos países onde a pesca sazonal da lampreia-marinha para consumo é elevada, a par da França e Espanha (Almeida et al., 2002; Hardisty, 2006; Andrade et al., 2007; Beaulaton et al., 2008; Cobo, 2009; Cobo et al., 2010a). Se por um lado, a sobrepesca e a pesca ilegal são apontadas como uma ameaça às populações migradoras dado o elevado valor económico desta espécie (Almeida et al., 2002; Duarte
et al., 2003; Sousa et al., 2003; OSPAR, 2009), o decréscimo das populações de
espécies migradoras também é consequência de outros factores de origem humana (Souto, 2001; Andrade et al., 2007; Suissas, 2010).
No rio Minho e em particular na sua foz, realiza-se com maior intensidade a pesca da lampreia-marinha e de outros migradores diádromos anfialinos tais como o salmão do Atlântico, Salmo salar, sável, Alosa alosa, savelha, Alosa fallax e truta-marisca, Salmo
trutta var. trutta, que entram no rio, após um período no meio marinho, para realizar a
postura. A lampreia-marinha é uma das espécies migratórias capturadas pelos pescadores profissionais e artesanais com mais tradição no rio Minho, devido ao seu valor gastronómico que atrai muitas pessoas de várias partes da Península Ibérica. Neste rio, entre Janeiro e Maio, são capturadas anualmente grandes quantidades de lampreias em comparação com outros rios ibéricos, contribuindo economicamente para o sustento
Introdução da comunidade piscatória, tanto portuguesa como espanhola (Antunes & Rodrigues, 2004; Cobo, 2009; Suissas, 2010).
1.3.1 Valores oficiais de capturas
A pesca no Troço Internacional do Rio „Minho é regulada pela Comissão Internacional Permanente do Rio Minho, que compõe elementos das autoridades marítimas portuguesas e espanholas. De acordo com o Regulamento da Pesca (Decreto-Lei nº 8/2008 de 9 de Abril) é autorizada a pesca da lampreia-marinha em dois troços: do início do troço internacional a montante até à Torre de Lapela na margem portuguesa (Monção) (cerca de 40 km) e desde a Ínsua do Conguêdo na margem portuguesa (Valença) até ao mar (cerca de 35 km). As lampreias capturadas no troço entre Monção e o limite montante do troço internacional, utilizando a cabaceira e o botirão em pesqueiras, não podem ser comercializadas, pelo que os indivíduos capturados legalmente só servirão para consumo próprio. Por esta razão as quantidades capturadas com estas artes não estão incluídas nos valores declarados às autoridades.
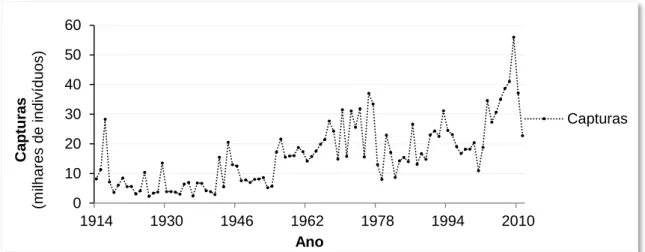
Os pescadores profissionais do rio Minho declaram periodicamente à Capitania do Porto de Caminha as quantidades que foram capturadas de cada espécie. Verifica-se um crescimento irregular dos valores declarados desde o início do século passado, com mínimos na época de 1926 (2280 indivíduos) e máximo na época de 2009 (55930 indivíduos) (figura 5).
Figura 5. Capturas anuais de lampreia-marinha no rio Minho.
Valores declarados entre 1914 e 2011 por pescadores à Capitania do Porto de Caminha (pescadores portugueses).
No rio Minho a pesca da lampreia realiza-se ao longo de todo o troço internacional (aproximadamente 75 km de extensão). A sua captura é mais limitada em outros rios nacionais, tanto espacialmente, como em abundância de indivíduos declarados. No rio Douro a pesca da lampreia está limitada ao troço estuarino dado que é praticamente
0 10 20 30 40 50 60 1914 1930 1946 1962 1978 1994 2010 Ca pt ura s (m ilha res de i nd iv ídu os ) Ano Capturas
inexistente na área mais a montante (Cortes, 2006) e no rio Guadiana a pesca é realizada na zona de Mértola e nas ribeiras que desaguam no troço jusante do rio (Afonso-Dias et al., 2001), onde a lampreia-marinha é considerada um recurso pouco comum (Sousa et al., 2003). Através da análise de capturas declaradas em lota e de pescas experimentais, verifica-se que os valores de capturas do rio Minho são superiores às capturas do rio Tejo (Suissas, 2010), do rio Lima (Afonso & Vaz-Pires, 1989) e do rio Mondego (Duarte et al., 2003).
1.3.2 Artes de pesca
As artes de pesca autorizadas e o período hábil de pesca (i.e. o período durante o qual é permitido pescar) variam no troço
internacional do rio Minho. Entre o limite montante do rio Minho, em território Português, e Monção, a largura média do rio é de 91,6 m e aumenta para os 338 m a jusante, entre Monção e a foz, onde alcança um máximo de cerca de 1600 m, seguida de um estreitamento antes da desembocadura (Araújo et al., 2011; INAG, s/ data). Estas condições implicam a utilização de diferentes artes
de pesca pelos pescadores. De acordo com o Edital nº 27/2010 (Capitania do Porto de Caminha), existem três artes de pesca autorizadas para a pesca da lampreia-marinha no troço internacional do rio Minho: lampreeira, botirão e cabaceira.
A lampreeira é uma arte de pesca composta por 3 panos (tresmalho) cuja rede central (miúdo) possui a menor malha, com mínimo legal de 70 mm na diagonal (figura 6). O comprimento máximo legal desta arte é de 120 metros e 70 malhas de altura (cerca de 4,9 metros). O material das redes é normalmente o nylon. A “tralha” (cabo) do “pandulho” possui bolsas de areia ou chumbos para manter a rede vertical e a “tralha” das bóias permite a flutuação da rede. Esta arte de deriva é utilizada entre a Ínsua do Conguêdo e o mar. Este facto justifica-se pelo estreitamento do canal acima deste local, onde facilmente redes mais compridas poderiam alcançar ambas as margens em alguns locais, exercendo uma pressão muito elevada sobre os recursos piscícolas. Para montante da Ínsua do Conguêdo não é permitido pescar nenhuma espécie piscícola com redes de deriva. O tresmalho é a arte de pesca mais utilizada pelos pescadores para capturar a lampreia-marinha no rio Minho. O período hábil de pesca com esta rede na época de
Figura 6. Recolha de uma lampreia capturada com lampreeira.
Introdução com lampreeira é feita nas “reças” (i.e.
secções do rio) enquanto os caudais fluviais ou tidais não tiverem demasiada força que impeça condições de pesca adequadas.
O botirão e a cabaceira possuem uma malha de 60 mm de diagonal e a sua utilização faz-se em pesqueiras a montante da Torre de Lapela. As pesqueiras são exploradas a título individual ou em regime comunitário, onde o “patrão” de pesqueira
faz a gestão dos dias atribuídos a cada pescador (figura 7). As pesqueiras são estruturas em pedra construídas perpendicularmente ao curso do rio, que não podem prolongar-se por mais de um terço da distância entre as margens. Estas paredes possuem pontos de ancoragem para botirões e cabaceiras. Os botirões são armadilhas (desmontáveis) compostas por vários aros cujos diâmetros vão diminuindo até ao aro da boca, que possui a forma de U invertido e de construção mais rígida (ferro, madeira ou vime) que os restantes (Martins et al., 2000). Dentro, localiza-se o endiche, com forma cónica que encaminha o pescado para o interior e não permite a sua saída. A base da boca prende-se ao fundo e o extremo da rede prende-prende-se às pesqueiras, com a boca voltada para jusante para capturar o peixe que sobe o rio. A instalação desta rede pode ser auxiliada com a ajuda de um croque.
As cabaceiras são redes simples (de pano único) em forma de barragem (Martins
et al., 2000). O pescado que sobe o rio é encaminhado para um saco devido à existência
de uma asa que se prende lateralmente na parede da pesqueira através de dois cabos. O saco flutua aberto no sentido da corrente. A asa é presa no fundo através de duas pedras (moleira e coleiro) e na parte superior da boca do saco existe uma bóia para fazer flutuar o extremo da asa que não está preso à margem. Dado que a pesqueira provoca uma zona de remanso no curso do rio, a cabaceira não é esticada no sentido de montante para jusante. Antigamente em vez de bóias utilizavam-se cabaças e daí o nome desta arte de pesca. Tanto o botirão como a cabaceira só podem ser utilizados na boca da pesqueira (Dec.-Lei 8/2008). Na época de 2011 a utilização de cabaceiras e botirões foi permitida entre 14 de Fevereiro e 7 de Maio.
1.4 Metais
Muitos dos estudos sobre a toxicologia de vários compostos para as lampreias têm visado a identificação de “lampricidas” eficazes dado o impacto da lampreia-marinha
em determinados ecossistemas (Andersen et al., 2010). As conclusões desses estudos não auxiliam na determinação de medidas de conservação desta espécie. Verifica-se escassez de informação sobre os níveis de metais biodisponíveis, tanto durante a fase adulta, como na fase de amocete da lampreia-marinha. Durante os últimos anos foram publicados vários estudos sobre os níveis de contaminantes na água e sedimento do rio Minho (Fidalgo, 2000; Moreno et al., 2004 e 2005a; Moreno et al., 2005b; Lyra, 2007; Reis et al., 2009; Santos et al., 2011), contudo não são encontradas referências sobre os níveis de metais que ocorrem nos organismos que habitam permanentemente ou que passam uma fase da sua vida neste rio. Dado que os amocetes são um recurso alimentar para vários predadores durante esta fase e para o Homem durante a fase adulta, devem ser analisadas quanto aos níveis de contaminantes que possuem nos seus tecidos, tais como os metais, dado o potencial de acumulação, derivado da ocorrência ubíqua destes elementos no ambiente e da inexistência de organismos que os degradem (Clark, 2002). Os metais podem ocorrer naturalmente nos solos mesmo em locais não contaminados, sendo assumidos valores teóricos para alguns deles: 200 ppm de crómio (Cr), 80 ppm de níquel (Ni), 16 ppm de chumbo (Pb), 0,5 ppm de mercúrio (Hg) e 0,2 ppm de cádmio (Cd), e alcançam as águas de superfície através da actividade vulcânica, deslizamentos e cheias (AFS, 2011). Ocorrem concentrações de metais em alguns ecossistemas muito acima destes níveis naturais, decorrentes principalmente das actividades antropogénicas, tais como agricultura, exploração mineira, libertação de águas residuais industriais e urbanas insuficientemente tratadas e actividades portuárias (Talbot & Chegwidden, 1982; Francesconi et al., 1994; USDA, 2000; Mokhtar et al., 2009). Os elementos Pb, Cd, Zn e Cu estão entre os metais mais tóxicos e serão provenientes das actividades industriais e agrícolas (Mason, 2002). No entanto, alguns destes elementos são essenciais, tais como o Zn e Cu para o crescimento e reprodução dos organismos vivos, em quantidades bastante limitadas (Kruger, 2002; Abdullah et al., 2007). A ausência de contaminação é generalizada no canal principal do rio Minho, no entanto os níveis de contaminação de Zn, Cr, Ni, Cu e Pb indiciam contaminação no troço final (Moreno et al., 2005a; Reis et
al., 2009; Santos et al., 2011). Também Reis et al. (2009) constataram que os níveis de
metais no estuário do rio Minho, além de serem de origem natural, também têm influência antropogénica, sendo ainda assim inferiores aos níveis encontrados em outros estuários portugueses. De acordo com Moreno et al. (2005a), os níveis de ferro, manganês, zinco, crómio, chumbo e cobre entre outros elementos químicos serão maioritariamente reflexo dos processos naturais de meteorização, transporte e sedimentação, e os sedimentos do fundo estarão relativamente pouco influenciados pelas actividades humanas, com excepção dos pontos afectados pelas descargas urbanas de Caminha. Estes resultados
Introdução rio Minho não serão principalmente de origem antrópica. De acordo com Santos et al. (2011) a montante de Valença a água do rio Minho apresenta boa qualidade, encontrando-se em conformidade com os valores máximos admissíveis (D.L. 236/98), incluindo os níveis de cádmio, chumbo, crómio, cobre e zinco. De acordo com Reis et al., (2008), a biodisponibilização dos metais não é elevada para os organismos bentónicos e a distribuição de metais não é homogénea ao longo de todo o estuário.
A absorção de metais enquanto contaminantes aquáticos, pode acontecer pela epiderme, vísceras, ou brânquias dos peixes, sendo estas últimas o local principal de absorção dos metais diluídos na água e as vísceras as vias de entrada dos metais ligados ao sedimento (Holmes & Youson, 1996). Após libertação dos metais nos meios aquáticos, estes vão acumular-se nos sedimentos próximos dos locais onde foram libertados e consequentemente entram a partir daí nas cadeias tróficas, visto que alguns organismos de níveis tróficos mais baixos têm grande tendência em acumular metais (Holmes & Youson, 1996; Reis & Almeida, 2008). As concentrações de metais nos sedimentos dependerão na sua natureza (composição em termos de minerais silicatados tais como os feldspatos, quartzo, olivinas, piroxenos, granadas e micas) (Reis et al., 2008). Para muitos organismos aquáticos e até para o Homem, os alimentos são um vector de ingestão de metais (Holmes & Youson, 1996; Voegborlo et al., 1999). O potencial de absorção de metais do meio ambiente pelos organismos filtradores pode ser maior em comparação com outros organismos. Para os organismos com este tipo de alimentação, tais como a moluscos e amocetes, a ingestão de metais merece especial atenção. A duração da filtradora sedentária das lampreias-marinhas pode ascender a mais de 5 anos (Applegate, 1950; Potter et al., 1982; Almeida & Quintella, 2008). Durante este período de tempo, podem estar expostos a grandes quantidades de metais. Estes três factores, duração, tipo de habitat e forma de alimentação, podem contribuir para a acumulação de metais e para a introdução destes compostos para níveis superiores nas cadeias tróficas, conferindo aos amocetes características adequadas à sua utilização como bioindicadores. Alguns metais são importantes nutricionalmente dado o seu papel na formação de metalo-enzimas ou como co-factores em reacções enzimáticas (Holmes & Youson, 1996). As metalotioneinas são proteínas de baixo peso molecular (6-7 kDa) ricas em cisteína, que se ligam a metais, sendo encontradas em mais de 80 espécies de peixes e invertebrados aquáticos, cujo papel é essencial na complexação de metais para que não se verifiquem efeitos tóxicos e na regulação homeostática de funções que implicam a utilização de metais essenciais (Roesijadi, 1992; Livingstone, 1993; Clark, 2002). Recentemente também começou a evidenciar-se a necessidade de estudos sobre a transferência de metais dos progenitores para a descendência (Lam & Wang, 2006; AFS, 2011), dado que os embriões dispõem dos nutrientes transferidos pelos
progenitores e contidos nesses nutrientes podem ocorrer outros compostos (Guirlet et al., 2008). No ser humano, o chumbo pode ser transferido pela placenta (HC, 1992) e em cefalópodes o zinco é um dos metais que são transferidos para os ovos, sendo que os seus níveis podem estar relacionados com as exigências metabólicas do desenvolvimento do ovo (Lacoue-Labarthe et al., 2008). Apesar da sua reduzida velocidade de acumulação, os metais não podem ser biodegradados nem destruídos completamente, mas podem ser “complexados” com outras moléculas, assumindo assim formas mais tóxicas ou menos tóxicas e estáveis após ingestão ou absorção (Kruger, 2002). A complexação e a toxicidade de um metal variam em função de factores ambientais tais como o oxigénio, dureza, pH e temperatura (Mason, 2002; Kruger, 2002). Várias espécies de peixes teleósteos e também os amocetes de lampreias-marinhas têm capacidade de regular homeostaticamente as concentrações dos metais nos seus organismos, principalmente metais essenciais (Holmes & Youson, 1996).
1.5 Composição nutricional
Os seres vivos dependem de um adequado balanço dos nutrientes ingeridos para disporem de energia necessária para as suas diversas actividades metabólicas e comportamentais (Halver, 1989; Choat & Clements, 1998). A retenção de energia nos seres vivos verifica-se predominantemente na forma de proteínas e lípidos (Kielanowski, 1965; Smith, 1989; Lovell, 1998).
As migrações evoluíram no sentido de proporcionar melhores oportunidades de alimentação, maiores taxas de crescimento e de sucesso reprodutivo nas zonas mais adequadas para as espécies diádromas, contudo envolvem consideráveis gastos energéticos e alterações fisiológicas de adaptação aos meios por onde passam (Crisp, 2000; Lucas & Baras, 2001; Ramenofsky & Wingfield, 2007). Dada a cessação da alimentação durante a fase migratória da maior parte das espécies diádromas, a energia disponível para todas as funções durante a migração tem de ser adquirida previamente, verificando-se que uma parte substancial das reservas somáticas de energia, principalmente sob a forma de lípidos, são utilizadas para este fim (Bird & Potter, 1981, 1983; Jonsson et al., 1997; Mesa & Magie, 2006; Boran & Karaçam, 2011).
Algumas espécies em cativeiro e selvagens migradoras como os salmonídeos têm sido alvo de aprofundado estudo ao nível da nutrição (Shearer et al., 1994; Jonsson et al., 1997; FAO, 2010). No entanto, dado que a importância geográfica da lampreia-marinha enquanto recurso de consumo se restringe a Portugal, Espanha e parte de França, o estudo da sua composição proximal não tem recebido muita atenção. Excepção são os estudos de Beamish et al. (1979) e Beamish (1979), onde se avaliou a variação da