UNIVERSIDADE FEDERAL DE OURO PRETO
NÚCLEO DE PESQUISAS EM CIÊNCIAS BIOLÓGICAS
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS
BIOLÓGICAS
MILLA MARQUES HERMIDORFF
ESTUDO DO ENVOLVIMENTO DA ADENOSINA NA AÇÃO
CARDIOPROTETORA DOS ANTAGONISTAS DE RECEPTOR
MINERALOCORTICÓIDE ESPIRONOLACTONA E EPLERENONA
ESTUDO DO ENVOLVIMENTO DA ADENOSINA NA AÇÃO
CARDIOPROTETORA DOS ANTAGONISTAS DE RECEPTOR
MINERALOCORTICÓIDE ESPIRONOLACTONA E EPLERENONA
Tese apresentada ao Programa de Pós-Graduação em Ciências Biológicas da Universidade Federal de Ouro Preto como requisito parcial para a obtenção do título de Doutor em Ciências Biológicas.
Área de Concentração: Bioquímica
Metabólica e Fisiológica
Orientador: Prof. Dr Mauro Cesar Isoldi
Catalogação: www.sisbin.ufop.br
H426e Hermidorff, Milla Marques .
Estudo do envolvimento da adenosina na ação cardioprotetora dos antagonistas de receptor mineralocorticóide espironolactona e eplerenona [manuscrito] / Milla Marques Hermidorff. - 2018.
133f.: il.: color; grafs; tabs.
Orientador: Prof. Dr. Mauro Cesar Isoldi.
Tese (Doutorado) - Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas. Programa de Pós-Graduação em Ciências Biológicas.
Área de Concentração: Bioquímica Metabólica e Fisiológica.
1. Adenosina. 2. Diuréticos. 3. Coração - Proteção. I. Isoldi, Mauro Cesar. II. Universidade Federal de Ouro Preto. III. Titulo.
MINISTÉRIO DA EDUCAÇÃO
UNIVERSIDADE FEDERAL DE OURO PRETO
PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS
~,,~
'
,
,.
'
BIOLÓGICAS
-ATA DE DEFESA DE TESE
Aos 13 dias do mês de abril do ano de 2018, às 09 : 30 horas, nas dependências Núcleo de Pesquisas em Ciências Biológicas (Nupeb), foi instalada a sessão pública para a defesa de tese da doutoranda Milla Marques Hermidorff, sendo a banca examinadora composta pelo Prof. Mauro Cesar Isoldi (Presidente - UFOP), pela Profa. Gabriela Guerra Leal de Souza (Membro - UFOP), pelo Prof. Gustavo Henrique Bianca de Souza (Membro - UFOP), pelo Prof. Leonardo Maximo Cardoso (Membro - UFOP), pela Profa. Simone Aparecida Rezende (Membro - UFOP). Dando início aos trabalhos, o presidente, com base no regulamento do curso e nas normas que regem as sessões de defesa de tese, concedeu à doutoranda Milla Marques Hermidorff 30 minutos para apresentação do seu trabalho intitulado "Estudo do Envolvimento da Adenosina Na Ação Cardioprotetora dos Antagonistas de Receptor Mineralocorticóide Espironolactona e Eplerenona", na área de concentração : Bioquímica Metabólica e Fisiológica . Terminada a exposição, o presidente da banca examinadora concedeu , a cada membro , um tempo máximo de3J minutos, para perguntas e respostas à candidata sobre o conteúdo da tese. Dando continuidade, ainda de acordo com as normas que regem a sessão, o presidente solicitou aos presentes que se retirassem do recinto para que a banca examinadora procedesse à análise e decisão, anunciando, a seguir, publicamente, que a doutoranda foi aprovada por unanimidade, sob a condição de que a versão definitiva da tese deva incorporar todas as exigências da banca , devendo o exemplar final ser entregue no prazo máximo de 60 (sessenta) dias à Coordenação do Programa . Para constar, foi lavrada a presente ata que, após aprovada, vai assinada pelos membros da banca examinadora e pela doutoranda. Ouro Preto, 13 de abril de 2018.
Membro: _ _ _
...,c+ ,,..=
Este trabalho foi realizado no Laboratório de Hipertensão do Programa de Pós-Graduação em Ciências Biológicas do Núcleo de Pesquisas em Ciências Biológicas
Agradecimentos
Hermidorff. M. M.
AGRADECIMENTOS
A Deus pelo dom da vida, pela saúde e por sempre iluminar meus caminhos.
Ao meu pai pelo amor, dedicação e por ser a força que me impulsiona a
chegar cada vez mais longe. Uma perda muito grande no meio dessa jornada, mas que de onde estiver sei que estará sempre olhando por mim. Saudades eternas!
A minha mãe por ter se tornado a maior incentivadora deste projeto e por ter
sido o exemplo que precisei, por sempre acreditar em mim e, principalmente, pelo exemplo de vida, força e fé. E por viver meus sonhos comigo!
A minha irmã Klícia pelo apoio constante, pela amizade incondicional, pelas
palavras de incentivo em todas as horas difíceis.
Ao Higor pela dedicação e paciência nos momentos conturbados e por sempre
demonstrar muito mais do que as palavras podem expressar!!! Por ser meu melhor amigo nos momentos de ansiedade e angústia e meu maior incentivador nesse processo de desenvolvimento intelectual. Te amo!!!
Ao meu orientador Prof. Dr. Mauro César Isoldi pelo incentivo. Obrigada por
abrir as portas do Laboratório de Fisiologia e Hipertensão, me direcionar na carreira científica e me proporcionar a oportunidade de trilhar novos caminhos. Serei eternamente grata por tudo!!!
Aos amigos do Laboratório de Fisiologia e Hipertensão, Andréa e Claudiane,
pela paciência e amizade!
A Prof. Andréia Alzamora, pelo acolhimento no Laboratório de Fisiologia e Hipertensão e confiança. Exemplo de profissional a ser seguido!!!
Gabi peça fundamental para esse trabalho e pela amizade e companhia
Agradecimentos
Hermidorff. M. M.
Carol, por sempre ser um ombro amigo-irmão em todos os momentos mais
difíceis dessa caminhada, e por também compartilhar comigo várias vitórias e alegrias!!!
Leonardo, pela ajuda intelectual e na tradução de nossos artigos, sua visão
crítica elevou o nível de nossos trabalhos. Parceria que deu certo!
A todos os professores do NUPEB pela disposição em ajudar e por
proporcionar um intercâmbio sadio entre os laboratórios da pós-graduação.
Ao Prof. Dr. Antônio José Natali e ao Laboratório de Biologia do Exercício
(UFV) pela paciência, disponibilidade, ensinamentos e ajuda nos experimentos de
contratilidade e transientes de cálcio.
Ao Prof. Dr. Milton Hércules pela persistência e paciência impares para
conseguirmos obter sucesso nos experimentos de HPLC, sem você esse trabalho não seria possível.
À FAPEMIG pelo apoio financeiro APQ-02112-10 e APQ 00793-13.
À Eclipse, família que eu escolhi e que me escolheu, e todas as eclipsianas,
pelo acolhimento, amor, companheirismo e convivência.
Ao Centro de Ciência Animal da UFOP e a todos os seus funcionários, em
especial à Lorena pela paciência e por fazer com que esse trabalho fosse realizado de forma correta pelo bom trato com os animais.
Aos animais que com inocência sacrificam suas vidas pela ciência.
“Só existe uma maneira de evitar as críticas: não fazer nada, não dizer nada e não ser nada”.
Resumo
Hermidorff. M. M.
Hermidorff MM. Estudo do envolvimento da adenosina na ação cardioprotetora dos antagonistas de receptor mineralocorticoide espironolactona e eplerenona [tese]. Ouro Preto: Núcleo de Pesquisa em Ciências Biológicas, Universidade Federal de Ouro Preto; 2018
RESUMO
Introdução: Os antagonistas de receptores mineralocorticoides
(espironolactona e eplerenona) possuem propriedades cardioprotetoras. No entanto, parte dessa característica é perdida quando há bloqueio ou inativação de receptores de adenosina ou quando a enzima de síntese de adenosina não está presente, o que nos permite sugerir que a ação da espironolactona e da eplerenona nesse órgão pode ser mediada diretamente pela adenosina. Objetivos: Investigar a participação da adenosina no mecanismo cardioprotetor da espironolactona e eplerenona.
Métodos: Foi avaliado in vivo, em ratos Wistar adultos, a concentração plasmática
de adenosina, 5’-ecto-nucleotidase (enzima de síntese de adenosina) e adenosina
deaminase (enzima de degradação de adenosina) e a atividade dessas enzimas. In
vitro, em cardiomiócitos isolados de ratos, vários parâmetros de contratilidade e níveis de cálcio foram avaliados após o tratamento com espironolactona, eplerenona, adenosina, DPCPX (antagonista de receptor A1 de adenosina) e MRS1523 (antagonista de receptor A3 de adenosina) seguidos de estimulação
elétrica. Resultados: Espironolactona e eplerenona aumentaram a concentração de
adenosina plasmática, os níveis de concentração e atividade de 5’
-ecto-nucleotidase. Os níveis de adenosina deaminase não foram afetados pelos fármacos. Entretanto, a atividade dessa enzima foi reduzida em ratos tratados com espironolactona em relação ao controle e a eplerenona. Espironolactona e eplerenona aumentaram a amplitude de contração e velocidade máxima de contração, em relação ao controle, em cardiomiócitos isolados. Quando os receptores de adenosina foram antagonizados e associados aos fármacos, observou-se um perfil diferente: somente eplerenona reverteu a amplitude de contração; velocidade máxima de relaxamento e amplitude do transiente de cálcio
em comparação aos antagonistas de receptor de adenosina. Conclusão: A
adenosina tem participação importante em parte dos efeitos cardioprotetores mediados pela espironolactona e eplerenona, nos modelos estudados.
Abstract
Hermidorff. M. M.
Hermidorff MM. Study of the involvement of adenosine in the cardioprotective action of the mineralocorticoid receptor antagonists spironolactone and eplerenone [tese]. Ouro Preto: Núcleo de Pesquisa em Ciências Biológicas, Universidade Federal de Ouro Preto; 2018
ABSTRACT
Introduction: The antagonists of the mineralocorticoid receptor (spironolactone
and eplerenone) are cardioprotective. However, this feature is lost upon blockade or inactivation of adenosine receptors, or when the enzyme that synthesizes adenosine is absent. These findings, therefore, suggest that the action of spironolactone and
eplerenone in the heart can be mediated by adenosine. Objectives: To investigate
the role of adenosine in the cardioprotective mechanism of spironolactone and eplerenone. Methods: Was evaluated in vivo the plasma concentration of adenosine,
5’-ecto-nucleotidase, and adenosine deaminase, enzymes that synthesize and
breakdown adenosine, as well as the activity levels of the latter enzymes. In isolated cardiomyocytes of rats several contractility parameters and calcium levels were evaluated after the treatment with spironolactone, eplerenone, adenosine, DPCPX, and MRS1523 (both adenosine receptor A1 and A3 antagonists, receptively), followed by electrical stimulation. Results: Spironolactone and eplerenone increased the plasma concentration of adenosine, and plasma concentration and enzyme activity of 5’-ecto-nucleotidase. Plasma levels of adenosine deaminase were not affected by the treatments; however, the activity of the latter enzyme was reduced in spironolactone-treated rats compared to control and eplerenone-treated ones. Spironolactone and eplerenone increased the amplitude of contraction and maximal velocity of relaxation compared to control in isolated cardiomyocytes. When adenosine receptors were antagonized and associated with spironolactone and eplerenone a different scenario was found: only eplerenone reverted the amplitude of contraction; maximal velocity of relaxation, and amplitude of calcium transient in
comparison to adenosine receptors alone. Conclusion: Adenosine plays an
important role in cardioprotection mediated by spironolactone and eplerenone, in the models studied.
Lista de Figuras
Hermidorff. M. M.
LISTA DE FIGURAS
Figura 1 - Estruturas químicas da espironolactona e da eplerenona. Fonte: (Núñez e Tamargo, 2006). ... 18
Figura 2 - Estrutura química da adenosina (Marzagalli R, 2015 ) ... 20
Figura 3 - Receptores de adenosina. Os receptores A1 e A3 de adenosina estão
acoplados às proteínas Gi/Go e os receptores A2 de adenosina estão acoplados à
proteína Gs.. ... 21
Figura 4 - Esquema ilustrativo das vias de produção e degradação da adenosina. Fonte: (Latini e Pedata, 2001) ... 23
Figura 5 - Desenho ilustrativo mostrando a participação do cálcio na contratilidade do cardiomiócito. Fonte: https://waitimstudying.wordpress.com/2016/09/10/mecanica-cardiaca/. ... 28
Figura 6 - Fluxograma do procedimento para obtenção das amostras. ... 35
Figura 7 - Câmara experimental acoplada a microscópio invertido. Observam-se o par de eletrodos conectado ao estimulador (fios preto e vermelho) e os tubos usados para levar e retirar a solução de perfusão dessa câmara. ... 42
Figura 8 - Representação do programa utilizado na aquisição das imagens e dos registros das contrações das células cardíacas (Ionoptix, EUA). As projeções dos picos verde e vermelho representam as definições das bordas direita e esquerda de um cardiomiócito, respectivamente. ... 42
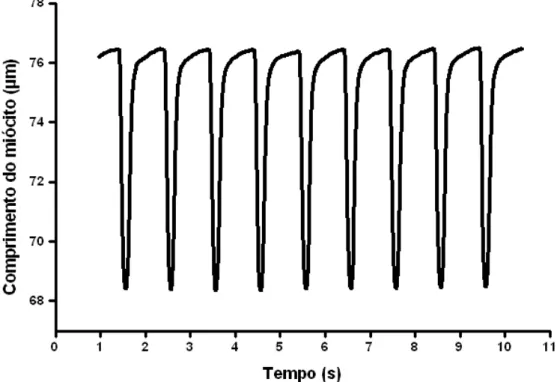
Figura 9 - Registro experimental de encurtamento de uma célula do ventrículo estimulada na frequência de 1 Hz em temperatura ambiente (~25ºC) (Roman-Campos et al., 2009). ... 43
Figura 10 - Representação de uma contração celular e os parâmetros avaliados (adaptado de ... 44
Lista de Figuras
Hermidorff. M. M.
Figura 12 - Concentração de adenosina em plasma de ratos tratados. C: Controle; ADO: 1 µM; ESP: 0.01 µM; EPL: 0.001 µM. Resultado de três experimentos independentes realizados em triplicatas por cromatografia liquida de alta eficiência. Resultados expressos em média ± desvio padrão. ... 48
Figura 13 - A. Concentração da enzima 5’-ecto-nucleotidase em plasma de ratos tratados. B. Atividade da enzima 5’-ecto-nucleotidase em plasma de ratos tratados. C: Controle; ESP: Espironolactona 10 mg/Kg; EPL: Eplerenona 10 mg/Kg. N = 6 animais por grupo. Experimento realizado em triplicata. Resultados expressos em média ± desvio padrão. ... 49
Figura 14 - A. Concentração da enzima adenosina deaminase (ADA) em plasma de ratos tratados. B. Atividade da enzima adenosina deaminase (ADA) em plasma de ratos tratados. C: Controle; ESP: Espironolactona 10 mg/Kg; EPL: Eplerenona 10 mg/Kg. N = 6 animais por grupo. Experimento realizado em triplicatas. Resultados expressos em média ± desvio padrão. ... 50
Figura 15 - Papel da ESP e EPL na amplitude de contração (comprimento celular de repouso, %) em A e velocidade máxima de relaxamento (µm/s) em B sob diferentes concentrações. C: Controle; Cloreto de Lítio (LiCl) 50 mM; ESP: Espironolactona 1 µM, 0.1 µM e 0.01 µM; EPL: Eplerenona 1 µM, 0.1 µM, 0.01 µM, e 0.001 µM. * = diferente do controle, p < 0.0001. ** = diferente do grupo tratado com LiCl, p < 0.0001. Boxplots mostram a mediana, quartis, valores máximos e mínimos de cada grupo. N = 6 por tratamento. ... 52
Figura 16 - Amplitude de contração (comprimento celular de repouso, %) por condição: C: Controle; ADO: 1 µM; ESP: 0.01 µM; EPL: 0.001 µM; DPCPX: 0.1µM; MRS 1523: 1µM. Boxplots mostram a mediana, quartis, valores máximos e mínimos de cada grupo. N = 6 por tratamento... 54
Lista de Figuras
Hermidorff. M. M.
Figura 18 - Velocidade máxima de relaxamento (velocidade pico de relaxamento celular, μm/seg) por tratamento. C: Controle; ADO: 1 µM; ESP: 0.01 µM; EPL: 0.001 µM; DPCPX: 0.1µM; MRS 1523: 1µM. Boxplots mostram a mediana, quartis, valores máximos e mínimos de cada grupo. N = 6 por tratamento. ... 58
Figura 19 - Amplitude do transiente intracelular de Ca+2 por tratamento. C: Controle; ADO: 1 µM; ESP: 0.01 µM; EPL: 0.001 µM; DPCPX: 0.1µM; MRS 1523: 1µM. Boxplots mostram a mediana, quartis, valores máximos e mínimos de cada grupo. N = 6 por tratamento. ... 60
Figura 20 - Tempo para remoção de metade (1/2) de [Ca2+]i por tratamento. C: Controle; ADO: 1 µM; ESP: 0.01 µM; EPL: 0.001 µM; DPCPX: 0.1µM; MRS 1523: 1µM. Boxplots mostram a mediana, quartis, valores máximos e mínimos de cada grupo. N = 6 por tratamento. ... 62
Lista de Tabelas
Hermidorff. M. M.
LISTA DE TABELAS
Tabela 1 - Composição da solução de parada ... 32
Tabela 2 - Composição do tampão fosfato, fase móvel, pH = 6,5 ... 32
Tabela 3 - Composição da fase estacionaria (fase B), pH = 6,0 ... 33
Tabela 4 – Composição da solução base para as soluções de isolamento de cardiomiócitos ventriculares (mM), pH = 7,3 ... 39
Tabela 5 - Composição da solução 1 (solução de isolamento contendo Ca2+) ... 39
Tabela 6 – Composição da solução 2 (solução de isolamento livre de Ca2+) ... 39
Tabela 7 – Composição da solução 3 (solução enzimática de isolamento) ... 40
Tabela 8 – Composição da solução estoque (mM) ... 40
Tabela 9 – Composição da solução sopa (mM) ... 40
Tabela 10 – Composição da solução de perfusão tampão HEPES, pH = 7,4 ... 40
Tabela 11 - Recuperação determinada para validação da metodologia analítica. .... 47
Lista de Abreviaturas
Hermidorff. M. M.
LISTA DE ABREVIATURAS
AC - Adenilil ciclase
ADA - Adenosina deaminase ADO - Adenosina
AK - Adenosina quinase AKAP - Proteína quinase A
Akt – Proteína quinase serina/treonina AMPc - Adenosina monofosfato cíclico
AMRs – Antagonistas de receptores mineralocorticóides ANOVA - Análise de variância
ATPase - Adenosina Trifosfatase
BAY 60-6583 - Agonista de receptor A2b - 2-[[6-Amino-3,5-diciano-4-[4-(ciclopropil metoxi) fenil] -2-piridinil]tio]-acetamide
Ca2+ - Íon cálcio
CaCl2 - Cloreto de cálcio
CAMKII – Calmodulina quinase tipo 2 CCA - Centro de ciência animal CCTL - canais de Ca do tipo L
CEUA - Comitê de ética de uso animal
CI-IB-MECA - Agonista de A3 - 2-Cloro-N6-(3-iodobenzil) -adenosine-5′ -N-metiluronamide
DHPR – Receptores dihidropiridina DNA - Ácido Desoxirribonucleico
DPCPX - Antagonista de A1 - 8-Ciclopentil-1,3-dipropilxantina
EC – Mecanismo de excitação-contração
EDTA - Ácido etilenodiamino tetra- acético EGTA - Ácido tetracético etilenoglicol
EHNA – Hidrocloreto de eritro-9-amino-β-hexil-α-metil-9H-purina-9-etanol, EPHESUS - Eplerenone Heart failure in Survival study
EPL - Eplerenona
Lista de Abreviaturas
Hermidorff. M. M.
ESP – Espironolactona FA – Fibrilação atrial FLB - fosfolaban
Fura-2AM - Éster acetoximetil GAP- Junções comunicantes Gi - Proteína G inibitória
G0 –Proteína quinase reguladora de canais de cálcio Gq - Proteína G tipo q
Gs - Proteína G estimulatória HCl – Ácido clorídrico
HPLC – Cromatografia líquida de alta performance H2SO4 – Ácido sulfúrico
HEPES – Ácido etanosulfônico 2-[4-(2-hidroxietil)piperazin-1-il] IAM - Infarto agudo do miocárdio
IC - Insuficiência cardíaca ICa – Corrente de Ca2+ I.P - Intraperitoneal IP3 - Inositol trifosfato
I-R – Isquemia e reperfusão KCl - Cloreto de potássio K2PO4 – Fosfato de potássio LiCl - Cloreto de Lítio
mAKAP - Proteína adaptadora de proteína quinase A muscular MAPK - Proteína quinase ativada por mitógeno
MAPK1/2 - Proteína quinase ativada por mitógeno tipo 1/2 MgCl2 -Cloreto de magnésio
MgSO4 -Sulfato de magnésio mmol/ L - Milimol por litro
MR - Receptor mineralocorticoide
MRS1754 - Antagonista de A2b MRS 1754 (N -(4-Cianofenil)-2-[4-(2,3,6,7-tetrahidro-2,6-dioxo-1,3-dipropil-1H-purin-8-il)fenoxi]-acetamide)
Lista de Abreviaturas
Hermidorff. M. M.
N5TE - 5’-ecto-nucleotidase NaCl - Cloreto de sódio
NaH2PO4 - Fosfato monobásico de sódio NCX – Trocador de Na+/Ca2+
NO – Óxido Nítrico
PCI – Pré condicionamento isquêmico pH - Potencial de Hidrogênio
PKA - Proteína quinase A PLC - Fosfolipase C pmol - Picomol
PP1 – Proteína fosfatase 1 PP2A – Proteína fosfatase 2a q.s.p – Quantidade suficiente para
RAAS - Sistema renina angiotensina aldosterona
RALES - Randomized Aldosterone Evaluation Study – Principal estudo clinico sobre espironolactona
RNA – Ácido ribonucleico RS – Retículo sarcoplasmático RyR2 – Receptor de rianodina SAH - S-Adenosilhomocísteina SEM - Erro padrão da média
SERCA – Bomba de Ca2+ do retículo sarcoplasmático SGK - Quinase sérica induzida por glicocorticoide
ST – Intervalo entre o fim da despolarização e o início da repolarização ventricular
TCA – Tricloroacético Tnl - Troponina I
TT – Túbulos transversos
TnC – Troponina C, liga-se ao Ca2+
Tnl – Troponina I, interação actina e miosina UI - Unidades internacionais
Sumário
Hermidorff. M. M.
SUMÁRIO
INTRODUÇÃO ... 15
1.1DOENÇAS CARDIOVASCULARES ... 15
1.2ESPIRONOLACTONA E EPLERENONA ... 16
1.3ADENOSINA ... 19
1.3.1 Receptores de adenosina ... 21
1.3.2 Formação de adenosina ... 22
1.4ANTAGONISTAS DE MR E ARRITMIAS CARDÍACAS ... 24
1.5GERENCIAMENTO DE CA+2 E CONTRATILIDADE CARDÍACA ... 25
1.5.1 Contratilidade celular e Ca+2 ... 26
1.6RECEPTORES DE ADENOSINA E ESPIRONOLACTONA E EPLERENONA ... 28
OBJETIVOS ... 30
2.1OBJETIVO GERAL ... 30
2.2OBJETIVOS ESPECÍFICOS ... 30
2.2.1 Ensaios in vivo ... 30
2.2.2 Ensaios in vitro ... 30
METODOLOGIA ... 31
3.1INVIVO ... 31
3.1.1 Animais ... 31
3.1.2 Avaliação da concentração da adenosina em plasma de ratos ... 31
3.1.3 Análise Cromatográfica ... 33
3.1.4 Curva de calibração ... 33
3.1.5 Recuperação ... 34
3.1.6 Avaliação da concentração da enzima 5’- ecto-nucleotidase (NT5E) ... 35
3.1.7 Análise da atividade enzimática de 5’- ectonucleotidase (NT5E) ... 36
3.1.8 Avaliação da concentração da enzima adenosina deaminase (ADA) ... 37
3.1.9 Análise da atividade enzimática de adenosina deaminase (ADA) ... 37
3.2INVITRO ... 38
3.2.1 Isolamento dos cardiomiócitos ... 38
Sumário
Hermidorff. M. M.
3.2.3 Soluções de perfusão ... 40
3.2.4 Tratamentos ... 40
3.2.5 Contratilidade celular ... 41
3.2.6 Análises do transiente de cálcio ... 44
3.3ANÁLISES ESTATÍSITICAS ... 45
RESULTADOS ... 46
4.1AVALIAÇÃO DA CONCENTRAÇÃO DA ADENOSINA EM PLASMA DE RATOS ... 46
4.1.1 Curva de calibração ... 46
4.1.2 Recuperação ... 47
4.2.3 Análise da presença plasmática de adenosina ... 47
4.1.4 Avaliação da concentração e da atividade da enzima 5’-ecto-nucleotidase (NT5E) ... 48
4.1.5 Avaliação da concentração e atividade da enzima adenosina deaminase (ADA) ... 50
4.2AVALIAÇÃO DA ATIVIDADE MECÂNICA DOS CARDIOMIÓCITOS ... 51
4.2.1 Amplitude de contração e velocidade máxima de relaxamento ... 51
4.2.2 Tempo para o pico de contração ... 55
4.2.3 Velocidade máxima de relaxamento ... 57
4.3ANÁLISE DE TRANSIENTE DE CÁLCIO EM CARDIOMIÓCITOS ISOLADOS ... 59
4.3.1 Amplitude do transiente de [Ca2+] i ... 59
4.2.2 Tempo para remoção de metade do [Ca2+] i ... 61
DISCUSSÃO ... 63
CONCLUSÃO ... 72
REFERÊNCIAS BIBLIOGRÁFICAS ... 73
APÊNDICE A ... 89
APÊNDICE B ... 115
APÊNDICE C ... 127
ANEXO 1 ... 130
Introdução
Hermidorff. M. M.
15 INTRODUÇÃO
1.1 DOENÇAS CARDIOVASCULARES
A Organização Mundial da Saúde estima, que até 2030, as doenças cardiovasculares e outras afecções do coração e da circulação serão responsáveis por, aproximadamente, 22,2 milhões de mortes em todo o mundo (Who, 2015). Diante destes números, é evidente que doenças cardiovasculares são um problema de saúde pública importante e estudos voltados à prevenção e tratamento são essenciais para reduzir a morbidade e mortalidade dos pacientes.
Existem diferentes tipos de doenças cardiovasculares, entre as mais comuns estão o infarto do miocardio, angina e aterosclerose. Entre esses tipos, o infarto agudo do miocárdio (IAM) é o que provoca mais mortes em todo o mundo (White e
Chew, 2008). O termo infarto agudo do miocárdio significa, basicamente, a morte de
cardiomiócitos causada por isquemia prolongada, provocada pela oclusão da artéria coronária ou de algum de seus ramos. Essa oclusão geralmente ocorre pela formação e/ou ruptura de trombos (coágulos) e erosão de placa aterosclerótica coronariana, fazendo com que o fluxo sanguíneo e o suprimento de oxigênio para o músculo cardíaco seja inadequado ou interrompido (Pesaro, 2004; Liao et al., 2015).
Os fatores de risco associados a essas doenças são principalmente: dislipidemias (níveis elevados de lipídeos no sangue), hipertensão arterial, tabagismo, diabetes mellitus, sedentarismo, estresse e obesidade (Colombo, 1997; Yanai et al., 2018)
Introdução
Hermidorff. M. M.
16 1.2 ALDOSTERONA
A aldosterona está inserida em uma importante cascata de sinalização de proteção dos rins que se inicia com a queda de pressão arterial, conhecida por sistema renina-angiotensina-aldosterona (RAAS). O RAAS é um sistema neuroendócrino complexo, responsável pela modulação do equilíbrio hidroeletrolítico e regulação da pressão arterial. Através das suas múltiplas interações, esse sistema contribui para a proteção do tecido endotelial, cardíaco, cerebral e renal. Adicionalmente, ele regula ainda a resposta do endotélio à inflamação e a lesão. A sua ativação crônica induz hipertensão e perpetuação de uma cascata pró-inflamatória, pró-trombótica e aterogênica, e é a base da lesão de vários órgãos-alvo (coração, cérebro, rim, endotélio) (Giestas et al., 2010).
A ação da aldosterona sobre receptores mineralocorticóides nos rins causa retenção de sódio e subseqüente aumento no volume sanguíneo. Esse hormônio atua promovendo a reabsorção de sódio e excreção de potássio (Alves, 2007). A água segue o movimento do sódio, via osmose, estabilizando o volume plasmático e, consequentemente, a pressão arterial (Balakumar e Jagadeesh, 2010). Consequentemente, o excesso de aldosterona causa hipertensão, que é conhecida por apresentar efeitos adversos no sistema cardiovascular (Takeda, 2004). Entretanto, existem também evidências de que a aldosterona exerça efeitos diretos sobre o sistema cardiovascular, independentes do aumento de pressão sangüínea, pois o excesso de aldosterona parece promover conseqüências adversas, não só em pacientes com hipertensão, mas também em pacientes com diabetes mellitus e doença renal crônica (Swedberg, 1990; Rossier et al., 2010).
Introdução
Hermidorff. M. M.
17 tecidos, por indução da hipertrofia e a desregulação da proliferação e apoptose, levando a fibrose e remodelamento do tecido (Oberleithner et al., 2004).
O Randomized ALdactone Evaluation Study (RALES) demonstrou que a aldosterona desempenha papel fundamental em doenças cardíacas (Stockand e Meszaros, 2003). Estudos adicionais realizados in vitro e in vivo suportaram os resultados do RALES por demonstrarem que a aldosterona altera a remodelagem cardíaca e promove fibrose (Brilla et al., 1994; Fullerton e Funder, 1994; Kohler et
al., 1996). Além disso, a aldosterona, em alguns modelos in vitro, promove a produção de colágeno em fibroblastos cardíacos (Brilla et al., 1993) e in vivo aumenta a deposição de colágeno, fibrose e necrose (Rossier et al., 2010)
Os efeitos prejudiciais da aldosterona sobre o coração incluem a indução de inflamação vascular e lesão, hipertrofia e fibrose do miocárdio, arritmia ventricular e disfunção cardíaca (Nagata et al., 2002). Estudos clínicos e experimentais têm demonstrado que o bloqueio do RAAS com inibidores de enzimas conversoras de angiotensina, bloqueadores do receptor de angiotensina II do tipo 1 (AT1) ou antagonistas de receptores mineralocorticóides (MR) promovem substancial proteção cardiovascular (Rossier et al., 2010). Essas observações têm implicações terapêuticas, dado o fato de que o MR se torna um dos principais alvos de medicamentos farmacológicos na prática clínica para prevenir a descompensação da função cardíaca e evolução para insuficiência cardíaca e arritmias letais (Chun et al., 2003).
Pacientes que sofrem infarto do miocárdio são tratados com antagonistas de receptores mineralocorticoides da aldosterona. Os altos níveis de aldosterona apresentados por esses pacientes são associados com o aumento de fibrose e morte do miocárdio. Aldosterona é, atualmente, reconhecida como potencialmente cardiotóxica, embora seus efeitos locais no coração ainda sejam pouco compreendidos (Grossmann e Gekle, 2009).
1.3 ESPIRONOLACTONA E EPLERENONA
Introdução
Hermidorff. M. M.
18 solúvel em clorofórmio, levemente solúvel em éter, álcool metílico e óleos fixos. Possui peso molecular de 416,57 e fórmula química C24H32O4S (Fig.1).
Foi desenvolvida, originalmente, na tentativa de neutralizar os efeitos do excesso de aldosterona (hormônio mineralocorticoide sintetizado nas glândulas suprarrenais, molécula efetora final no sistema renina-angiotensina-aldosterona - Apêndice A) (Hermidorff et al., 2017), principalmente os efeitos relacionados à excreção de potássio. A espironolactona foi usada por décadas no tratamento de grande volume sanguíneo de potássio, embora geralmente exerça um papel secundário em relação aos diuréticos mais potentes (Nappi e Sieg, 2011).
Seu isolamento ocorreu pela primeira vez no início dos anos 60 (Funder, 2003) e tem sido usada para reverter efeitos adversos no sistema cardiovascular em muitos pacientes com doença cardíaca crônica como insuficiência cardíaca congênita e hipertrofia do miocárdio (Sohn et al., 2010).
A eplerenona (EPL) (9,11α-epoxi-17-hidroxi-3-oxo-17α-pregn-4-eno-7α,21-ácido dicarboxilico-γ-lactona metil este) é o nome genérico e o princípio ativo do medicamento Inspra®, é insolúvel em água e solúvel em DMSO (dimetilsulfóxido). Possui peso molecular de 414,50 e fórmula química C24H30O6 (Fig.1). Além de ser um antagonista competitivo da aldosterona, derivado da espironolactona, ela possui seus efeitos progesterônicos e anti-androgênicos minimizados, o que potencializa sua seletividade ao receptor de aldosterona (Núñez e Tamargo, 2006).
Introdução
Hermidorff. M. M.
19 Esse antagonista, além de ser capaz de antagonizar algumas ações não genômicas da aldosterona na atividade vascular, que se produzem pela ativação de diversas vias de sinalização como, por exemplo, MAPK, PKC e PI3K (Núñez e
Tamargo, 2006),também produz um efeito anti-hipertensivo, como consequência do
bloqueio do MR, tanto em tecidos epiteliais, como nos não epiteliais. Assim, a
eplerenona antagoniza o aumento da reabsorção de Na+ e água nos túbulos distal e
coletor provocado pela aldosterona e aumenta a excreção de K+ (Faiez Zannad et
al., 2011).
Dois importantes estudos clínicos, o Randomized ALdosterone Evaluation
Study (RALES) (Pitt et al., 1999) e o EPlerenone HEart failure and SUrvival Study (EPHESUS) (Pitt et al., 2003) indicaram que tanto a espironolactona como a eplerenona reduzem a mortalidade em pacientes com insuficiência cardíaca e disfunção ventricular esquerda pós-infarto. O mecanismo responsável por essa diminuição da mortalidade promovida por esses fármacos pode envolver mudanças na excreção renal de eletrólitos e inibição da fibrose miocárdica (Danser, 2006).
1.4 ADENOSINA
Introdução
Hermidorff. M. M.
20
Figura 2 - Estrutura química da adenosina (Marzagalli R, 2015 )
Esse autacóide exerce múltiplos efeitos sobre o sistema cardiovascular durante a isquemia e reperfusão, além de possuir efeitos benéficos na frequência cardíaca, contratilidade e fluxo coronário através da ativação de seus receptores de membrana acoplados a proteína G: A1 e A3, que atuam via Gαi e A2a, A2b, que atuam via Gαs (Braganca et al., 2016; Um et al., 2017).
Entretanto, esses receptores podem se acoplar a outros tipos de proteína G ativando diferentes vias de sinalização (Gao, 1999). Todos estes receptores vêm sendo demonstrados como cardioprotetores e encontram-se expressos nos vários tipos de células presentes no coração, como fibroblastos, células endoteliais, células musculares lisas e cardiomiócitos. (Headrick e Lasley, 2009). Além dos seus efeitos fisiológicos, como diminuição do ritmo cardíaco, vasodilatação coronária e efeitos anti β-adrenérgicos, a adenosina atua diretamente sobre as células cardíacas desencadeando vias cardioprotetoras (Ely e Berne, 1992; Shin et al., 2018).
Introdução
Hermidorff. M. M.
21
Figura 3 - Receptores de adenosina. Os receptores A1 e A3 de adenosina estão acoplados às proteínas Gi/Go e os receptores A2 de adenosina estão acoplados à proteína Gs. Protein Kinase – Proteína quinase, Vasoditation – vasodilatação, Cyclic AMP – AMP cíclico, Adenylate cyclase – adenilato ciclase, Inhibit – inibe, Stimulate – estimula, Outside cell – extracelular, Inside cell – intracelular. Fonte: http://www.aderis.com/img/art_adenosine.gif.
1.4.1 Receptores de adenosina
Estudos experimentais sugerem que a ativação de receptores A1 e A3 antes da isquemia promovem ação cardioprotetora, reduzindo a área lesada, promovendo melhora da função pós-isquêmica e redução da área infartada tanto em corações isolados de animais quanto in vivo, (Bunch et al., 1992; Lasley et al., 1999; Louttit et
al., 1999; Urmaliya et al., 2010) além de também proteger miócitos ventriculares isolados contra lesão e morte celular em modelos de isquemia e hipóxia in vitro (Narayan et al., 2001; Safran et al., 2001).
De forma semelhante, o agonista de A3 (2-Chloro-N6
-(3-iodobenzyl)-adenosine-5′-N-methyluronamide, CI-IB-MECA) também é capaz de promover efeitos
cardioprotetores, quando administrado antes da isquemia (Kilpatrick et al., 2001). Uma série de estudos subsequentes demonstram o mesmo em outras espécies, incluindo modelos de coração isolado, indicando que os efeitos cardioprotetores ocorrem diretamente sobre o miocárdio (Auchampach et al., 2003; Peart et al., 2003; Wan et al., 2008).
Introdução
Hermidorff. M. M.
22 Adicionalmente, o receptor A1 também tem função importante não apenas antes da isquemia, mas também durante a reperfusão, já que nesse período sua ativação é responsável por iniciar uma cascata protetiva de transdução de sinal que envolve MEK1/2 e ERK1/2 (Solenkova et al., 2006).
Ao contrário de A1, receptores A2A não possuem efeito cardioprotetor quando administrado antes da isquemia. Seus efeitos são ativados no início da reperfusão. Norton et al, 1992 foram os primeiros a descrever essa cardioproteção em um modelo in vivo de isquemia em coelhos (Norton et al., 1992).
Receptores A2B também possuem ação cardioprotetora na reperfusão. O
agonista do receptor A2B (2-[[6-Amino-3,5-diciano-4-[4-(ciclopropilmetoxi)
fenil]-2-piridinil]tio]-acetamida, BAY 60-6583) administrado antes ou no início
da reperfusão do miocárdio, reduz o tamanho do infarto em corações isolados de coelho e de ratos e em camundongos e ratos in vivo (Eckle et al., 2008; Xi et al.,
2009).
Agonistas dos receptores A2B administrados nos primeiros minutos de reperfusão podem elevar o nível de fosforilação das quinases de sobrevivência, Akt
e ERK1/2, semelhante ao pré condicionamento isquêmico (PCI) (Kuno et al., 2007).
Além disso, o antagonista do receptor da adenosina A2B MRS 1754 (N -(4-Cianofenil)-2-[4-(2,3,6,7-tetrahidro-2,6-dioxo-1,3-dipropil-1H
-purin-8-il)fenoxi]-acetamida), bloqueou a fosforilação de quinases de sobrevivência por BAY 60-6583 (agonista A2B) (Kuno et al., 2007; Busse et al., 2016).
1.4.2 Formação de adenosina
A adenosina (ADO) é um autacóide que desempenha uma variedade de funções tecido-específicas. Durante a isquemia, a produção de adenosina é aumentada no coração, apresentando efeitos potencialmente cardioprotetores (Sommerschild e Kirkeboen, 2000). Inicialmente, acreditava-se que seus efeitos estavam relacionados apenas a regulação da circulação coronariana, sendo esta um potente vasodilatador. Em 1985, foi descoberto que a adenosina exerce efeitos cardioprotetores diretos sobre os miócitos (Ely et al., 1985).
No miocárdio, a adenosina pode ser formada pela ação da endo-5’
Introdução
Hermidorff. M. M.
23 celular, a partir da desfosforilação do AMP intra ou extracelular, respectivamente (Sommerschild e Kirkeboen, 2000). Uma outra maneira apresentada pelas células para sintetizar adenosina é através da hidrólise de S-Adenosilhomocísteina (SAH). No entanto, durante a isquemia a taxa de hidrólise de SAH não aumenta muito, sugerindo que esta via não seja fonte significativa de produção de adenosina no tecido cardíaco nessas condições (Sommerschild e Kirkeboen, 2000) (Fig. 4).
Figura 4 - Esquema ilustrativo das vias de produção e degradação da adenosina. Cyclic AMP – AMP cíclico, PDE – fosfodiesterase, AK – adenosina quinase, adenosine – adenosina, Inosine – inosina, ADA – adenosina deaminase, nucleotides – nucleotídeos, Equilibrative nucleoside transportes – transportador de nucleosídeo em equilíbrio, NBMPR – nitrobenzylthioinosina inibidor de transportador de nucleosideo, AOPCP - α,β-Metileno-ADP inibidor de ecto-5`-nucleotidase. Fonte: (Latini e Pedata, 2001)
Além da formação de adenosina, processos envolvendo sua degradação podem estar envolvidos na alteração de sua disponibilidade. Sua degradação é feita basicamente através das enzimas adenosina quinase (AK) e adenosina deaminase (ADA) (Latini e Pedata, 2001).
Introdução
Hermidorff. M. M.
24 ações benéficas (aumento de proteção via agonismo de receptores de adenosina; reduzida geração de radicais livres) e/ou prejudiciais (acúmulo de desoxi-ATP e SAH; apoptose) .
Além disso, ADA tem sido implicada na regulação não-enzimática da funcionalidade dos receptores de adenosina A1 e A2A (Franco et al., 1997; Hashikawa et al., 2004). Estudos em tecidos não cardíacos indicam que na superfície da célula, ADA interage com o receptores de adenosina, aumentando a afinidade do receptor pela adenosina (Torvinen et al., 2002) permitindo a internalização do receptor e posterior dessensibilização (Saura et al., 1998; Kutryb-Zajac et al., 2016).
Diferentemente do que ocorre com a adenosina deaminase (ADA), a adenosina quinase promove a degradação da adenosina intracelular através da refosforilação do AMP, enquanto que a adenosina deaminase promove a sua degradação através da desaminação enzimática da adenosina em inosina (Moreno et al., 2018).
A adenosina pode servir como um substrato para a síntese de AMP através de vias diferentes (''salvamento de purinas''), preferencialmente através da fosforilação pela adenosina quinase e, assim, reabastecer o pool de nucleotídeos durante reperfusão (Ely e Berne, 1992; Mubagwa et al., 1996).
Há evidências de que até 70% de adenosina do fluido intersticial é transportada de volta para os cardiomiócitos (Deussen et al., 1999) onde estima-se que 90% é convertida a AMP por adenosina-quinase (AK) (Kroll e Schrader, 1993), com o restante degradada em inosina pela adenosina deaminase (Moreno et al., 2018).
1.5 ANTAGONISTAS DE MR E ARRITMIAS CARDÍACAS
Fibrilação atrial (FA) é um tipo comum de arritmia cardíaca na qual o ritmo dos batimentos cardíacos é rápido e irregular. Milliez e cols (2005) sugeriram que antagonistas de MR (AMRs), como espironolactona e eplerenona, possuem efeitos benéficos no tratamento dessa arritmia (Milliez et al., 2005). Desde então surgiram outros estudos que demonstram que o uso de AMRs é efetivo no tratamento de desordens eletrofisiológicas por serem capazes de reduzir a remodelagem cardíaca
e a taxa de taquicardia ventricular espontânea. ESP e EPL também demonstraram
Introdução
Hermidorff. M. M.
25 ação (De Mello, 2006). De forma similar, a espironolactona evita a remodelação da junção gap e restaura a velocidade de condução transversal no modelo de
constrição aórtica torácica (De Mello, 2006; Zhao et al., 2010).
Adicionalmente, estudos clínicos já demonstraram que AMRs são capazes de prevenir arritmias ventriculares (Pitt et al., 1999; Pitt et al., 2003; Pitt, 2016). Entretanto, a susceptibilidade para arritmias é associada não apenas a desordens eletrofisiológicas, mas também à fibrose cardíaca e perfusão inadequada do tecido (Karagueuzian, 2011). Dessa forma, também já foi demonstrado que tanto ESP como EPL são capazes de diminuir a proliferação de fibroblastos (diminuindo fibrose cardíaca) (Hermidorff et al., 2015), fortalecendo o papel antiarrítmico dos AMRs.
1.6 GERENCIAMENTO DE Ca+2 E CONTRATILIDADE CARDÍACA
Os mecanismos de contração do coração podem ser afetados durante o processo de instalação da hipertensão e consequente hipertrofia cardíaca. Os canais de Ca2+ voltagem-dependentes que participam da função contrátil dos cardiomiócitos foram inicialmente identificados por Fatt e Katz em 1953 (Fatt e Katz, 1953). Posteriormente, Hagiwara e cols. (1975) sugeriram a classificação dos canais em dois tipos distintos, de acordo com suas propriedades eletrofisiológicas: canais de Ca2+ de baixa e alta voltagem (Hagiwara et al., 1975).
O canal de Ca2+ do tipo-T, que é classificado como de baixa voltagem, se abre quando o potencial de membrana está baixo e se inativa rapidamente. Os canais do
tipo-L (CCTL) são frequentemente denominados “receptores dihidropiridina” (DHPR)
e predominam nos ventrículos. Em cardiomiócitos, inclusive de ratos, estão presentes os canais do tipo T e L (Bers, 2002; Harzheim et al., 2009)
Em cardiomiócitos, os canais do tipo-L são o principal caminho para o influxo de Ca2+ proveniente do espaço extracelular para o citoplasma, a corrente de Ca2+ (ICa), induz a contração do músculo cardíaco e regula sua força contrátil (Bers, 2002; Richard et al., 2006). A fosforilação dos canais de Ca2+ do tipo-L aumenta a corrente de Ca2+ e o conteúdo desse íon no retículo sarcoplasmático (Magyar et al., 2011)
Introdução
Hermidorff. M. M.
26 subdividida em domínio estrutural e funcional, ou seja, porções longitudinal e juncional, respectivamente (Rossi, 2008).
O canal de liberação de Ca2+ do RS (ou receptor de rianodina, RyR2) é um componente fundamental no mecanismo de excitação-contração (EC) cardíaco. A
liberação do Ca2+ oriundo do RS através dos canais de RyR2 inicia o processo de
contração do coração (Berti et al., 2017).
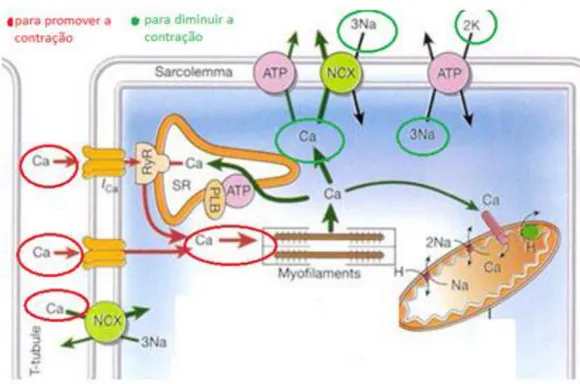
1.6.1 Contratilidade celular e Ca+2
Após a despolarização da membrana do cardiomiócito, os canais de Ca2+ tipo – L, ativados por influxo de Ca2+,são ativados na membrana do sarcolema atingindo os túbulos transversos (TT). O influxo subsequente de Ca2+ muito maior que o efluxo através dos canais de RyR2 no RS desencadeia um processo denominado “liberação de Ca2+ induzida por Ca2+”. Durante a sístole, um aumento de cerca de dez vezes na concentração intracelular de Ca2+ resulta na formação de pontes
cruzadas entre actina e miosina, após a ligação do Ca2+ com a troponina C (TnC).
Com ATP suficiente ocorre o deslizamento dos miofilamentos. Esse processo permite a contração muscular (Gordon et al., 2000). As fases da contração (sístole e diástole) são intimamente controladas pelo estado funcional dos canais de Ca2+ voltagem-dependentes, RyRs, TnC, TnI, SERCA, FLB, NCX e outras proteínas (Sheehan et al., 2007; Berti et al., 2017)
A gradação da contratilidade é estreitamente regulada a nível celular. A
ativação simpática dos receptores β acoplados à proteína G e a formação de AMPc
ativa a PKA e amplifica a entrada da corrente de Ca2+, abertura dos canais de RyR e
liberação de Ca2+ pelo RS. Há um aumento na probabilidade de abertura do canal
Introdução
Hermidorff. M. M.
27 Para facilitar a coordenação da liberação de Ca2+ induzida por Ca2+, grupos de canais de RyR2 são localizados em áreas estratégicas na membrana do RS (conhecidas como unidades de liberação de cálcio), diretamente adjacentes aos CCTL (canais de Ca2+ do tipo L), dentro dos TT do sarcolema (Ruiz-Hurtado et al., 2015). Nas concentrações diastólicas de Ca2+, a TnI inibe a interação entre alguns monômeros de actina e miosina (Layland et al., 2005). O influxo de Ca2+ através dos CCTL ativa os canais de RyR2 próximos, os quais são acoplados funcionalmente (Marx et al., 2001), induzindo a liberação sincronizada do Ca2+ (Bers, 2002). Essa liberação gera uma concentração transitória de Ca2+ intracelular suficiente para induzir a contração. O aumento na concentração do Ca2+ citosólico durante a contração é imediatamente seguido de sua remoção, resultando na desativação da maquinaria contrátil e relaxamento do miocárdico durante a diástole. O Ca2+ citosólico é bombeado de volta para o RS pela SERCA2a. Esta bomba controla o processo de contração e relaxamento do cardiomiócito e a fosfolamban (FLB) regula sua atividade. A SERCA2a utiliza a energia fornecida pela hidrólise do ATP para transportar o Ca2+ através da membrana. Dois íons Ca2+ são transportados para cada molécula de ATP hidrolisada (Maclennan e Kranias, 2003)
Introdução
Hermidorff. M. M.
28 PP1 (proteína fosfatase 1) e PP2A (proteína fosfatase 2A), que removem um grupo fosfato das proteínas quinases fosforiladas (Bovo et al., 2017)
Figura 5 - Desenho ilustrativo mostrando a participação do cálcio na contratilidade do cardiomiócito. Fonte: https://waitimstudying.wordpress.com/2016/09/10/mecanica-cardiaca/.
1.7 RECEPTORES DE ADENOSINA E ESPIRONOLACTONA E EPLERENONA
Estudos clínicos têm demonstrado que baixas doses de espironolactona e eplerenona reduzem a morbidade e mortalidade em pacientes com insuficiência cardíaca e infarto do miocárdio, apesar dos níveis normais de aldosterona no plasma (Pitt et al., 1999; Spertus et al., 2002; Pitt, 2016).
Introdução
Hermidorff. M. M.
29 Chai e cols., 2005 e 2006 em estudos com corações isolados de ratos submetidos a isquemia e reperfusão, relatou que espironolactona e eplerenona administrados antes da isquemia reduziram a área infartada em relação ao grupo controle (Chai et al., 2005; Chai et al., 2006). Sugerindo, que de alguma forma, elas
promovem pré-condicionamento farmacológico. Schmidt e cols., 2010 em umestudo
subsequente, também realizado em coração isolado de ratos submetidos a I-R (isquemia e reperfusão), demonstrou que ambas também eram capazes de reduzir a área infartada quando administradas antes da reperfusão (pós-condicionamento), e esses efeitos foram bloqueados por um antagonista não-seletivo de receptores de adenosina (Schmidt et al., 2010). Neste mesmo estudo, o efeito cardioprotetor do carenoato de potássio (metabólito ativo da espironolactona) foi bloqueado em camundongos nocautes para a enzima ecto-5’-nucleotidase (enzima envolvida na síntese de adenosina) (Schmidt et al., 2010).
Nosso grupo avaliou, comparativamente, os efeitos in vitro da espironolactona
e da eplerenona e demonstrou que ambas possuem efeito cardioprotetor per se, ou
seja, independente do antagonismo sobre a aldosterona. Além disso, também há evidencias que assim como a aldosterona, tanto a espironolactona como a eplerenona possuem vias de sinalização para respostas rápidas (não genômicas) (Hermidorff et al., 2015), porém ainda não se sabe sob em qual receptor esses fármacos produziriam tais respostas.
Essas evidências somadas ao que se conhece sobre os efeitos cardioprotetores da adenosina no coração, nos permitem sugerir que a ação da espironolactona e da eplerenona nesse órgão pode ser mediada diretamente pela adenosina. Isso se daria pelo aumento da disponibilidade da adenosina pela ação desses fármacos, que poderiam atuar sobre sua síntese, liberação e/ou degradação.
Objetivos
Hermidorff. M. M.
30 OBJETIVOS
2.1 OBJETIVO GERAL
Investigar a participação da adenosina no mecanismo cardioprotetor promovido pela espironolactona e eplerenona.
2.2 OBJETIVOS ESPECÍFICOS
2.2.1 Ensaios in vivo
Em plasma de animais tratados, ou não, com espironolactona, eplerenona, adenosina:
Avaliação da concentração plasmática de adenosina;
Análise da concentração plasmática e da atividade da enzima de síntese de adenosina (5’ -ecto-nucleotidase);
Análise da concentração plasmática e da atividade da enzima de degradação de adenosina (adenosina deaminase);
2.2.2 Ensaios in vitro
Caracterizar a atividade contrátil de cardiomiócitos isolados de coração de ratos quando tratados, ou não, com espironolactona, eplerenona, adenosina e seus antagonistas de receptores A1 e A3, em relação a:
Amplitude de contração;
Tempo para o pico de contração; Velocidade máxima de relaxamento;
Avaliar os transientes de cálcio de cardiomiócitos isolados de coração de ratos quando tratados, ou não, com espironolactona, eplerenona, adenosina e seus antagonistas de receptores A1 e A3, em relação a:
Amplitude do transiente de [Ca2+]i ;
Metodologia
Hermidorff. M. M.
31 METODOLOGIA
3.1 IN VIVO
3.1.1 Animais
Ratos Wistar machos, pesando entre 200 e 250 g.
Os animais foram fornecidos pelo Centro de Ciência Animal – CCA da Universidade Federal de Ouro Preto. Todos os procedimentos com animais foram realizados de acordo com os protocolos 2012/22 e 2016/06 aprovados pela Comissão de Ética de uso animal (CEUA) da Universidade Federal de Ouro Preto (Certificados de aprovação em anexo – Anexos 1 e 2).
3.1.2 Avaliação da concentração da adenosina em plasma de ratos
Para os ensaios in vivo foram usados animais conforme descrito no item 3.1.1. Para avaliação da concentração de adenosina plasmática em ratos, as soluções dos fármacos e solução controle (veículo – solução salina) foram administradas por via oral (V.O - gavagem) ou intraperitoneal (I.P) em dose única, 30 minutos antes da indução da anestesia. Os tratamentos foram:
1 - ESP (10mg/Kg) – V.O (Pereira et al., 2002) 2 - EPL (10mg/Kg) – V.O (Kobayashi et al., 2006) 3 - ADO (10mg/Kg) – I.P (Kaster Mp, 2007)
Metodologia
Hermidorff. M. M.
32
Tabela 1 - Composição da solução de parada
Componentes Quantidade
Dipiridamol 75 µM
EHNA 15 µM
EDTA 3 mM
Solução salina isotônica (pH=6,0)
q.s.p 1 L
Logo em seguida, as amostras de sangue foram centrifugadas a 3300g por 10 minutos a 4ºC. As amostras de plasma foram separadas dos elementos figurados e 500 µl de cada amostra foram transferidos para novos tubos e acondicionados em gelo. Em seguida, a cada tubo foi adicionado 1,0 ml de acetona para promover a precipitação proteica, agitou-se cada tubo por dois minutos e, então, as amostras foram deixadas em repouso por 10 minutos para ocorrer a precipitação. Posteriormente, as amostras foram novamente centrifugadas a 3300g por 10 minutos à 4ºC e o sobrenadante foi transferido para tubos de vidro. A acetona presente nas as amostras foi retirada por evaporação com auxílio de fluxo de gás
nitrogênio. As amostras foram concentradas em liofilizador (BenchTop™ “K” Series –
VirTis). O precipitado obtido foi ressuspendido em 100 µl de solução de fase móvel (fase A), tampão fosfato 0,25M (Maguire et al., 1998), acrescido de acetonitrila e metanol para evitar contaminação (tabela 2) e 200 µl de fase estacionária (fase B) (Maguire et al., 1998) (tabela 3).
Tabela 2 - Composição do tampão fosfato, fase móvel, pH = 6,5
Componentes Quantidade
Fosfato de sódio monobásico 0,171M
Fosfato de sódio dibásico 0,079 M
Acetonitrila 5,0 ml
Metanol 50 ml
Água Milli-Q 945 ml
Metodologia
Hermidorff. M. M.
33
Tabela 3 - Composição da fase estacionaria (fase B), pH = 6,0
Componentes Quantidade
Acetonitrila 500 ml
Tetrahidrofurano 1 ml
Água Milli-Q 490 ml
A fase móvel foi filtrada em membrana 0,45 µm (Millipore®) e desgaseificada em banho ultrassônico (S70H Elma Quality).
As amostras contendo somente solução de parada também foram submetidas a cromatografia líquida de alta eficiência para avaliar sua interferência na detecção, de forma que, o valor da leitura da amostra de solução de parada foi subtraída dos valores de leitura das amostras de plasma.
3.1.3 Análise Cromatográfica
As amostras de plasma obtidas foram submetidas à análise em cromatografia líquida de alta eficiência (CLAE) em fase reversa para análise dos níveis plasmáticos de adenosina. As análises foram realizadas em coluna C18 (150 mm x 4,6 mm) de 3 µm (Phenomenex®), em sistema CLAE da Shimadzu®, acoplado a detector de ultravioleta monocromático; a coluna foi previamente condicionada com a fase móvel (5ml de acetonitrila e 50ml de metanol a 945ml de tampão fosfato - tabela 2), por 30 minutos, em fluxo de 1 mL/min, à temperatura de 40ºC. As amostras foram eluídas em sistema de fase móvel isocrático citado acima, sendo a eluição das amostras monitoradas em 263 nm.
3.1.4 Curva de calibração
A curva de calibração define, adequadamente, a relação existente entre as concentrações das amostras analisadas e a resposta obtida pelo equipamento. Assim, a construção dessa curva foi realizada mediante a análise cromatográfica de 4 amostras submetidas ao método de extração avaliado.
Metodologia
Hermidorff. M. M.
34 conjunto de pontos experimentais e menor a incerteza dos coeficientes de regressão estimados.
3.1.5 Recuperação
A recuperação (ou fator de recuperação), “R”, é definido como a quantidade da substância de interesse, presente ou adicionada na porção analítica do material teste, que é extraída e passível de ser quantificada. A recuperação mede a eficiência do procedimento de extração de um método analítico dentro de um limite de variação. A porcentagem de recuperação do analito e do padrão interno desejável seria próximo de 100%, porém também são admitidos valores menores para a
extensão da recuperação de um analito, inclusive na ordem de 50 – 60%, desde que
a recuperação seja precisa, exata e reprodutível (Lanças, 2004).
Metodologia
Hermidorff. M. M.
35
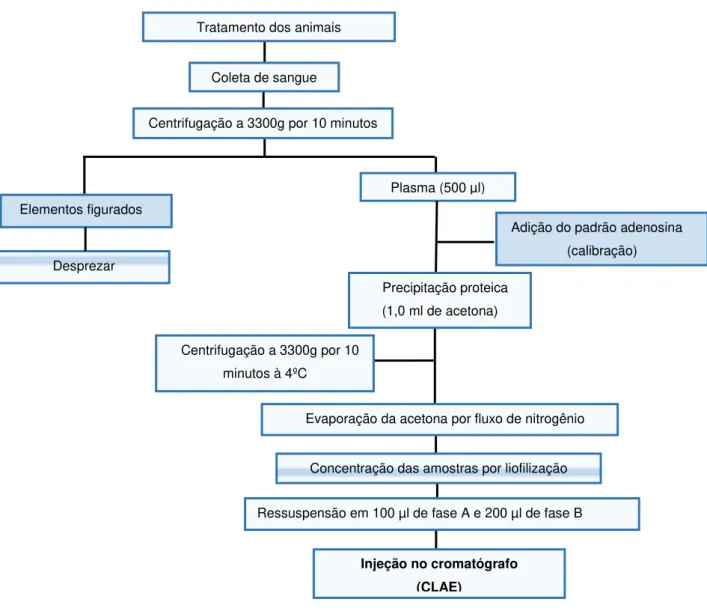
Figura 6 - Fluxograma do procedimento para obtenção das amostras.
3.1.6 Avaliação da concentração da enzima 5’- ecto-nucleotidase (NT5E)
As análises das concentrações de NT5E foram realizadas seguindo recomendações do ELISA Kit for 5'-Nucleotidase, Ecto (NT5E) - Rattus norvegicus (Rat) – Cat. EKU02035 –Marca Biomatik.
A microplaca do ensaio é pré-revestida com anticorpo específico para NT5E (5’-ecto-nucleotidase). Padrões ou amostras foram adicionados aos poços da microplaca com anticorpo conjugado com biotina específico para NT5E. Em seguida, avidina conjugada com peroxidase (HRP) foi adicionado a cada poço da microplaca e incubada. Quando uma solução do substrato TMB é adicionada, apenas os poços
Tratamento dos animais
Coleta de sangue
Centrifugação a 3300g por 10 minutos
Elementos figurados
Plasma (500 µl)
Desprezar
Adição do padrão adenosina (calibração)
Precipitação proteica (1,0 ml de acetona)
Centrifugação a 3300g por 10 minutos à 4ºC
Evaporação da acetona por fluxo de nitrogênio
Concentração das amostras por liofilização
Ressuspensão em 100 µl de fase A e 200 µl de fase B
Metodologia
Hermidorff. M. M.
36 que contêm NT5E, o anticorpo conjugado com biotina e enzima conjugada com avidina, apresentam uma mudança de cor. A reação enzima - substrato foi terminada pela adição de solução de ácido sulfúrico e a alteração da cor foi medida espectrofotometricamente no comprimento de onda de 450 nm ± 10 nm em leitor de ELISA (Elx800 - BioTek® Instruments). A concentração de NT5E nas amostras foi então determinada por comparação da D.O das amostras com a curva padrão.
A 5’-nucleotidase é uma fosfomonoesterase específica, que hidrolisa fosfato monoéster que se liga na posição 5’ de DNA e RNA. Diferentes mononucleotídeos
podem ser hidrolisados, mas 5’ -AMP é o substrato mais susceptível. A enzima não
hidrolisa 3’ -AMP, p-nitrofenilfosfato e ribose-5’-fosfato, que são substratos de fosfomonoesterases não-específicas
Em condições fisiológicas, a maior parte da adenosina é derivada do AMP intracelular que se difunde a favor de um gradiente de concentração para o exterior celular, encontrando assim a 5’-ecto-nucleotidase, essa enzima ancorada à
membrana celular é responsável por converter AMP em adenosina. (Fredholm et al.,
2001).
3.1.7 Análise da atividade enzimática de 5’- ectonucleotidase (NT5E)
A atividade de NT5E foi avaliada conforme descrito por Heymann (1984) e Taussky & Shorr (1953) (Taussky e Shorr, 1953; Heymann et al., 1984).
Resumidamente, 20 µl de plasma (0,1µg – 0,4µg de enzima) foi adicionado a 200 µl
de meio de reação (10 mM de MgSO4 em 100 mM de Tris-HCl, pH = 7,5) e incubado
a 37°C por 20 minutos. Em seguida, foi acrescentado 5´AMP 10 mM ao meio, para concentração final 2 mM, e o mesmo foi incubado a 37°C por 20 minutos. A reação foi parada pela adição de 200 µl TCA 10%. A solução foi então resfriada em gelo por 10 minutos e, posteriormente, centrifugada a 3300g por 5 minutos. A análise colorimétrica foi realizada através da adição de 40 µl de reagente colorimétrico para cada 200 µl de volume de ensaio. A leitura foi realizada em leitor de ELISA (Elx800 - BioTek® Instruments), usando-se comprimento de onda de 630 nm e a atividade enzimática expressa em nmol Pi liberado/min-1/µg-1.
Metodologia
Hermidorff. M. M.
37 Jager, 1993). O resultado foi comparado com uma curva padrão para a determinação da quantidade de Pi liberado. As soluções padrões foram produzidas
através da diluição seriada da solução composta por 1,5 mg de KH2PO4 em 1ml de
H2SO4 10M (Taussky e Shorr, 1953; Kancirová, 2016).
3.1.8 Avaliação da concentração da enzima adenosina deaminase (ADA) As análises das concentrações de ADA foram realizadas através do Rat
Adenosine Deaminase (ADA) ELISA Kit – Cat. MBS267634 – Marca: MyBioSource.
O kit aplica a técnica de imunoensaio enzimático por competição utilizando um anticorpo monoclonal anti-ADA e um conjugado ADA-HRP. A amostra de ensaio e o tampão foram incubados juntamente com o conjugado ADA-HRP, na placa pré-revestida, durante uma hora. Após o período de incubação, os poços foram decantados e lavados cinco vezes. Os poços foram incubados com um substrato para a enzima HRP. O produto da reação enzima-substrato forma um complexo de cor azul. Finalmente, foi adicionado uma solução de parada para interromper a reação, que então torna a solução amarela. A intensidade da cor foi medida por espectrofotometria a 450 nm em um leitor de microplacas (Elx800 - BioTek® Instruments). A intensidade da cor é inversamente proporcional à concentração de ADA, uma vez que a ADA das amostras e o conjugado ADA-HRP competem pelo sitio de ligação do anticorpo anti-ADA. Uma vez que o número de sítios é limitado, à medida que mais ítios são ocupados pela ADA da amostra, menos sítios formam o conjugado ADA-HRP. Uma curva padrão foi plotada relacionando a intensidade da cor (D.O) com a concentração de padrão. A concentração de ADA em cada amostra foi interpolada a partir desta curva padrão.
Metodologia
Hermidorff. M. M.
38 com pH ajustado para 6,5 e diluído em 25 ml de solução tampão fosfato. Os tubos foram então incubados em banho-maria, a 37°C por 45 minutos, com agitação a cada 15 minutos.
A reação foi parada com a adição de 1,5 ml de solução de fenol/nitroprussianato (106 mM de fenol e 0,17 mM de nitroprussianato de sódio), com imediata mistura de solução alcalina de hipoclorito de sódio (11 mM de hipoclorito de sódio em 125 mM de hidróxido de sódio) e vigorosa agitação dos tubos. Esses foram então, incubados a 37°C por 30 minutos, para o desenvolvimento da reação colorimétrica. O conteúdo dos tubos foi transferido para placa de 96 poços e a absorbância medida em 630 nm.
O resultado foi comparado com uma curva padrão para a determinação da
quantidade de NH3 produzido. A curva foi construída usando-se 0,5 ml de soluções
obtidas por diluições sucessivas de uma solução de 150 mM de sulfato de amônio Desta forma, calculou-se a atividade de ADA existente em cada amostra de plasma. Os valores foram expressos em U/L (unidade por litro), que é definida como sendo a
quantidade em µmol de NH3 produzido, a 37°C, por minuto, pela enzima contida em
1 litro da amostra.
3.2 IN VITRO
3.2.1 Isolamento dos cardiomiócitos
Após a eutanásia dos animais, por decapitação, os mesmos foram submetidos a uma toracotomia mediana para ressecção do coração.
Metodologia
Hermidorff. M. M.
39 mg.ml-1 de protease (solução 3), durante 10 a 15 minutos, para destruição da matriz extracelular e fibras de colágeno. Durante o isolamento, todas as soluções foram oxigenadas (O2 100% - White Martins, Brasil) e mantidas a 37º C.
Após a perfusão, os ventrículos (direito e esquerdo) foram separados dos átrios. Os músculos papilares e o tecido conjuntivo foram removidos manualmente de sua superfície. Fragmentos finos (< 1mm) foram obtidos. As amostras foram colocadas em solução contendo 5 ml de solução enzimática. Os frascos foram agitados durante cinco minutos, em banho-maria, à temperatura de 37º C, com oxigenação dos tecidos (O2 100% - White Martins, Brasil). A seguir, o conteúdo dos frascos foi filtrado e centrifugado (3000 rpm) por 30 segundos. O sobrenadante foi removido e os cardiomiócitos suspendidos na solução 1. Os processos de agitação e filtração foram repetidos por três vezes.
3.2.2 Soluções de Isolamento
Tabela 4 – Composição da solução base para as soluções de isolamento de cardiomiócitos ventriculares (mM), pH = 7,3.
Componentes Quantidades
NaCl 7,6 g
MgCl2 0,28 g
KCl 0,4 g
HEPES 0, 062 g
Glicose 1,8 g
Taurina 2,38 g
Creatina 1,3 g
Água Milli-Q [q.s.p] 1L
Tabela 5 - Composição da solução 1 (solução de isolamento contendo Ca2+)
Componentes Quantidades
Solução base 500 ml
CaCl2 (1M) 375 μl
Tabela 6 – Composição da solução 2 (solução de isolamento livre de Ca2+)
Componentes Quantidades
Solução base 250 ml
Metodologia
Hermidorff. M. M.
40
Tabela 7 – Composição da solução 3 (solução enzimática de isolamento)
Componentes Quantidades
Solução base 30 ml
Colagenase tipo 2 30 mg
Protease 3 mg
3.2.3 Soluções de perfusão
Tabela 8 – Composição da solução estoque (mM)
Componentes Quantidades
NaCl 65,99 g
HEPES 11,9 g
NaH2PO4 1,42 g
MgSO4 2,46 g
KCl 3,72 g
Água Milli-Q [q.s.p] 1 L
Tabela 9 – Composição da solução sopa (mM)
Componentes Quantidades
Na acetato 16,4 g/100 ml
Glicose 18,1g/100 ml
Insulina 0,5 g/100 ml
Tabela 10 – Composição da solução de perfusão tampão HEPES, pH = 7,4
Componentes Quantidades
Solução estoque 100 ml
Solução sopa 10 ml
CaCl2 1 ml
3.2.4 Tratamentos
As células foram tratadas com:
1 - LiCl (Cloreto de Lítio): 50mM (Vogel e Terzic, 1989; Repetto et al., 2001; Shaikh Qureshi et al., 2014).
2 - Espironolactona (ESP): 1 µM, 0,1µM e 0,01 µM