BORELLI, B. M. Quantificação dos indicadores higiênico-sanitários e da diversidade de leveduras durante a fabricação do queijo Minas curado da Serra da Canastra - MG. 2002. 109p. Dissertação (Mestrado em Biologia) –
Instituto de Ciências Biológicas, Universidade Federal de Minas Gerais, Belo Horizonte.
1 - INTRODUÇÃO
O queijo Minas é produzido no Brasil desde o período colonial, sendo que sua fabricação originou-se no estado de Minas Gerais, com procedimentos caseiros desenvolvidos, principalmente, na cidade do Serro e na região da Serra da Canastra. Desta forma, tal produto apresenta grande valor sócio-cultural para o Estado. De acordo com dados do Instituto Mineiro de Agropecuária, foram cadastrados cerca de 830 produtores na Serra da Canastra, responsáveis pela produção de 373,5 toneladas de queijo por mês. Esse queijo é produzido de forma artesanal e não se caracteriza por uma tecnologia de fabricação definida. Atualmente a comercialização deste produto é mais acentuada nas zonas leiteiras da região Sul e Sudeste do Brasil.
O queijo Minas curado apresenta considerável importância em Saúde Pública, dada as suas condições peculiares de produção. A utilização do leite cru para a fabricação deste tipo de queijo é motivo de preocupação, pois este constitui uma importante via de transmissão de inúmeros patógenos, tais como:
Não existem dados sobre a microbiota de leveduras envolvida no processo de fabricação do queijo Canastra. A produção artesanal dá-se ao nível da fazenda sem qualquer apoio tecnológico. As leveduras tem um papel importante durante a produção e maturação de queijos, pois estes microrganismos contribuem para o desenvolvimento das características organolépticas do produto final.
2 - REVISÃO BIBLIOGRÁFICA
2.1- Considerações gerais
O queijo é um dos mais antigos alimentos preparados que a história da humanidade registra, e é tido como uma das formas mais antigas de se conservar o leite. A arte de sua fabricação teve início num passado remoto, milhares de anos antes do nascimento de Cristo (FURTADO, 1991).
Os processos de fabricação de queijos compreendem métodos que transformam grande parte dos componentes do leite num produto de fácil conservação, com menor quantidade de água, grande valor nutritivo e sabor agradável (LEITE et al., 2000). A fabricação de queijos no Brasil é de história relativamente recente, firmando-se do ponto de vista industrial, no início deste século e, sobretudo, a partir da década de 20, com o estabelecimento de imigrantes dinamarqueses no sul de Minas Gerais e holandeses na região de Santos Dumont e Barbacena (FURTADO,1991). O estado de Minas Gerais destaca-se por sua produção leiteira (30% da produção nacional) e pelos produtos derivados do leite, sendo o queijo Minas bastante difundido e comercializado no Brasil (SANTOS et al., 1981; FONSECA et al., 1995).
2.2- Produção de queijo Minas
pequenos e médios produtores de queijo, principalmente nas regiões Centro, Nordeste, e algumas áreas do Triângulo e Sul de Minas.
Segundo a definição do Regulamento da Inspeção Industrial e Sanitária de Produtos de Origem Animal (BRASIL, 1980), o queijo Minas Curado é o produto obtido do leite integral ou padronizado, pasteurizado, de massa crua, prensado mecanicamente e devidamente maturado durante 20 dias. Embora a pasteurização do leite tenha permitido melhorar a qualidade do queijo Minas e prolongar sua vida de prateleira, este continua a ser produzido de forma artesanal (com leite cru) e em quantidade expressiva em algumas regiões do Estado (OLIVEIRA, 1999). Em função da política de pagamento do leite, os produtores têm preferido produzir o queijo Minas na própria fazenda, não tendo quelquer assistência, o que resulta na obtenção de um produto de composição e características bastante variadas, comprometendo sua qualidade final e acarretando problemas na sua comercialização.
2.3- Queijo Canastra
O queijo Minas da Serra da Canastra é fabricado há dezenas de anos, de maneira empírica e tradicional, com leite cru, nos municípios de Tapira, Vargem Bonita e cercanias, tendo como centro polarizador o município de São Roque de Minas, onde este produto tem as características mais representativas. As características micro-climáticas da região possibilitam a interação de condições e agentes que proporcionam o sabor característico e singular do produto. A região possui cerca de 600 produtores de queijo e estima-se que só a cidade de São Roque produza cerca de 90 toneladas de queijo Minas por semana, a maior parte sendo vendida em São Paulo (IMA, 1999). De acordo com os dados do IMA, foram cadastrados cerca de 830 produtores na Serra da Canastra, responsáveis pela produção de 373,5 toneladas de queijo por mês.
como sendo o mais adequado em virtude do seu sabor picante e aroma amanteigado moderado, características que conferem sabor peculiar ao produto (OLIVEIRA, 1999). No entanto, entre as dificuldades apontadas pelos produtores de pão de queijo, encontra-se a qualidade do queijo do Canastra. Uma vez que o queijo é produzido de forma artesanal este não apresenta uniformidade em suas propriedades físico-químicas e organolépticas, o que dificulta a padronização do pão de queijo.
2.4- Tecnologia de fabricação
O queijo Minas da Serra da Canastra é produzido artesanalmente a partir de leite cru, na própria fazenda, sem acompanhamento tecnológico, resultando na obtenção de um produto de composição variada, e características de sabor, aroma, corpo e textura bastante diferenciados, o que pode comprometer sua qualidade final (SIQUEIRA et al., 1986). A cozinha, onde o queijo é produzido, é geralmente caracterizada por uma construção simples, de alvenaria, quase nunca azulejada, nas proximidades do curral. Para a fabricação dos queijos, utiliza-se o leite cru recém-ordenhado e geralmente não se mistura o leite ordenhado a tarde, por receio da ocorrência de um defeito conhecido como estufamento precoce. Algumas fazendas fazem duas fabricações, uma com o leite da manhã e outra com o leite da tarde.
O leite é coado em panos, diretamente dentro de uma bombona de plástico onde a fabricação é realizada. Em seguida, adiciona-se o coalho, dissolvido no “pingo”, e então o leite é homogeneizado. O “pingo” é um soro-fermento muito peculiar e característico da região. Ele é coletado durante a noite a partir do soro que escorre dos queijos cobertos com sal grosso. Dessa forma, a microbiota bacteriana nativa é bastante tolerante ao sal. A quantidade de “pingo” adicionada varia entre 0,5 e 1,0 litro para cada 100 litros de leite.
tamanhos irregulares submersos em um soro geralmente leitoso ou amarelado. A coalhada é deixada para decantar por 10 a 15 minutos para que ocorra a liberação do soro.
A coalhada decantada é coletada em peneiras, e a massa é prensada, manualmente, em formas de plástico; em algumas fazendas a massa é prensada no interior de panos. A bancada e os queijos são lavados com água corrente para a retirada dos restos de soro ou massa. Os queijos são cobertos com sal grosso e deixados em repouso por 5-6 horas. Um recipiente é colocado no piso, logo abaixo do furo existente na porção inclinada da bancada, para a coleta do soro que será utilizado como “pingo” no dia seguinte. Após o repouso inicial (5-6 horas), o sal grosso é removido da superfície dos queijos e estes são virados, recobertos com sal e deixados, na mesma posição, até o dia seguinte.
O sal, então, é removido e os queijos são mantidos nas formas onde ficam secando por mais 24 horas. Os queijos são retirados das formas e levemente raspados, com o auxílio de um ralinho, para que a casca fique bem fina. Os queijos são colocados em prateleiras e virados todos os dias. Estes são mantidos curando nas prateleiras à temperatura ambiente por até 10-15 dias.
Assim, o queijo Canastra possui formato cilíndrico, com aproximadamente 14cm de diâmetro e altura variando entre 4 e 6 cm. Sua casca é esbranquiçada, tendendo a se transformar em uma crosta fina e amarelada quando o queijo é curado por alguns dias. Internamente a massa é branca e consistente, às vezes ligeiramente quebradiça. O queijo apresenta olhaduras mecânicas de pequeno tamanho e algumas vezes, pequenas olhaduras irregulares. Devido ao processo de fermentação natural acentuado, a coalhada, mesmo não sendo prensada sofre uma dessoragem espontânea, o que resulta em queijos mais firmes e secos que outros de fabricação similar (IMA, 1999). Seu sabor é bastante típico e acentuadamente mais ácido que o do queijo Minas industrial (FURTADO, 1980).
umidade do produto final, pode-se encontrar no mercado, uma grande variedade de queijos Canastra que não obedecem a qualquer padrão de identidade e qualidade. Como na região da Serra da Canstra, não há comercialização legal do produto, nem por cooperativa ou outra instituição; 100% da produção é entregue ao “queijeiro”, comprador que vai até a fazenda buscar o queijo. O atravessador ou “queijeiro” pressiona o preço do produto justificando o excesso de oferta, dificuldades com a estrada, entre outros motivos. Estas pessoas atuam também, em determinados casos, como agentes de degradação da qualidade do queijo, uma vez que transportam os queijos das fazendas para seus depósito, dentro de sacos plásticos, a granel ou em caixas pláticas em carrocerias de caminhonetes, simplesmente cobertos com lona. Os queijos são comprados do produtor rural pelo “queijeiro”, geralmente antes de completarem uma semana de cura à temperatura ambiente.
mostraram que usando-se o leite pasteurizado obtem-se um produto menos atraente organolepticamente.
2.5- A legislação e o queijo Canastra
Em vários países, sobretudo na Europa, os queijos artesanais adquiriram um lugar privilegiado no meio do patrimônio gastronômico e cultural. Juntamente com os queijos de leite cru, eles deram à França sua notoriedade de “país do queijo”. Essa reputação vem acompanhada das necessárias garantias de segurança e higiene a que o consumidor tem direto (ENCONTRO TÉCNICO, 2000).
As produções de tipos de queijos que se identificam aos do Serro e da Serra da Canastra datam do século XVIII. Hoje, com as pressões de modernização dos processos produtivos foi introduzida a pasteurização do leite destinado à fabricação de queijos. Entretanto ainda assim, as práticas tradicionais utilizando leite cru permanecem vivas e atuantes em Minas Gerais (VARGAS et al., 1998).
Embora conhecidos e procurados pelo consumidor, os queijos tradicionais, nem sempre podem garantir a segurança alimentar necessária. Os produtos são pouco maturados, fabricados a partir de leite cru e não existe uma legislação vigente adaptada às características deste tipo de produção. Sua comercialização se faz, em geral, de forma clandestina, como produtos não inspecionados dificultando o controle de qualidade. Assim a continuidade da atividade e a manutenção de um modo de vida tradicional que garante a sobrevivência do grande número de produtores, instalados em regiões pouco propícias a outras atividades agrícolas encontra-se ameaçada (ENCONTRO TÉCNICO, 2000).
quando o tempo de maturação é bem reduzido e a atividade de água do produto acabado é bem elevada (VARGAS et al., 1998). Os queijos fabricados com leite cru quando produzidos a partir de matéria-prima hígida obtida de animais certificados apresentam propriedade nutricionais diferenciadas dos demais queijos obtidos a partir de leite pasteurizado (VARGAS et al., 1998).
A qualidade e características do queijo não são constantes. Os principais fatores que contribuem para estas variações são a cultura iniciadora e o tipo de leite, os quais levam à obtenção de um produto de composição variada e, características de sabor, aroma, corpo e textura bastante diferenciados, comprometendo a qualidade do produto final (FONSECA et al., 1995). A Legislação Brasileira não permite a comercialização de queijo produzidos a partir de leite cru, a não ser que seja produzido a partir de leite higienizado e seja submetido a um processo de maturação a temperatura superior a 50C, durante
Quadro 1 – Padrões de identidade e qualidade microbiológica, provisivos, como ponto de partida para a melhoria contínua da qualidade para o queijo Canastra fabricado de leite cru no Município de são Roque de Minas 1 (VARGAS et al., 1998).
Contagens microbiológica (data expedida)
Limites de higidez: (fim da validade)
Limites de higidez: (queijos
naturais)
Método indicado:
Aeróbios a 30o C/g2 105 106 FIL 100B: 1991
Coliformes 45o C/g3 102 103 APHA (1992)
Salmonella em 25 g4 Ausência Ausência FIL 93A: 1985 Staphylococcus
aureus/g5
102 103 FIL 145:1990
Streptreptococcus β hemolíticos A, B, C, G e L6
Ausências em 0,10 g
Ausência em 0,10 g
France, DGAL/SV HA /No 87/No 8149;
02/11/87 (1985) L. monocytogenes7 Ausência em 25
g
Ausência em 25 g FIL 143: 1990
Mofos e leveduras/g8
5 x 102 5 x 103 FIL. 94B: 1991
3 - OBJETIVOS
3.1 - Objetivo Geral
- Caracterizar os indicadores higiênico-sanitários e a diversidade de leveduras durante o processo de fabricação artesanal do queijo Minas curado (queijo Canastra) produzido na região da Serra da Canastra, Município de São Roque de Minas, Estado de Minas Gerais.
3.2- Objetivos Específicos
3.2.1 - Avaliar a qualidade microbiológica da água utilizada no processo de fabricação do queijo Canastra verificando a presença de coliformes fecais e totais, Pseudomonas aeruginosa, Clostridios sulfito redutores, Enterococos e leveduras.
3.2.2 – Determinar a presença de indicadores higiênico-sanitários no leite “in natura”, pingo, massa coagulada e queijo Minas curado da Serra da Canastra, quantificando a presença de coliformes totais e fecais, bactérias aeróbias mesofílicas, Staphylococcus aureus, Listeria spp., Salmonella spp., Campylobacter spp. e Bacillus cereus durante o processo de fabricação.
4 - MATERIAIS & MÉTODOS
4.1 - Amostragem
As coletas foram feitas em dez fazendas do município de São Roque de Minas localizado próximo dos limites do Parque Nacional da Serra da Canastra, há aproximadamente 300 Km de Belo Horizonte. De cada fazenda foram amostradas a água, leite cru bovino, “pingo” (soro-fermento característico da região), coalhada e queijo curado pronto para consumo, perfazendo um total de 10 amostras para cada substrato. Nas fazendas 1, 4 e 6 era utilizada a ordenha mecânica, enquanto que nas demais fazendas a retirada do leite era realizada manualmente. As amostras de leite, “pingo” e coalhada foram oriundas de um mesmo lote de fabricação. A coalhada corresponde à massa fresca obtida após a quebra do coágulo formado em decorrência do período de coagulação do leite. A coalhada foi coletada antes da prensagem nas fôrmas plásticas, geralmente após uma hora da adição do coalho. O material foi coletado, assepticamente, em frascos ou sacos plásticos esterilizados e, transportado para o laboratório em caixas de material isotérmico contendo gelo e, processadas no período de no máximo 24 horas. As análises das amostras foram realizadas nos Laboratórios de Microbiologia de Alimentos e de Enterotoxinas Estafilocócicas da Fundação Ezequiel Dias e no Laboratório de Ecologia e Biotecnologia de Leveduras, da UFMG.
4.2 - Análise da água
4.2.1 - Quantificação do Número mais Provável (NMP) de coliformes totais e fecais
de uma pipeta estéril 10 ml da amostra foram inoculados em uma série de cinco tubos contendo caldo Lauril Sulfato Triptose de concentração dupla (teste presuntivo). Os tubos foram homogenizados e incubados a 35±0,50C por 48
horas. Após este período foi verificada a turvação e a presença de gás no interior do tubo de Duhran presente no meio. Para os tubos considerados positivos, turvos e com bolhas de gás no interior do tubo de Duhran, uma alçada foi transferida para caldo lactosado verde brilhante bile a 2%. Os tubos foram incubados por 24-48 horas a 35±0,5ºC. O teste confirmativo para coliformes totais foi considerado positivo para os tubos que apresentaram formação de gás. O ensaio confirmativo para coliformes fecais foi feito a partir dos tubos positivos de caldo lactosado verde brilhante bile a 2%, transferindo-se uma alçada para os tubos contendo meio E.C. Os tubos foram incubados em banho-maria a 44,5 ±
0,2ºC durante 24 horas. Os tubos foram considerados positivos quando houve formação de bolhas no interior do tubo de Duhran. Os resultados foram expressos como NMP, de bactérias do grupo coliforme e/ou coliformes de origem fecal por 100 mL.
4.2.2 - Quantificação do Número Mais Provável de Pseudomonas aeruginosa pela Técnica dos Tubos Múltiplos
Após a homogeneização das amostras de água, 10ml foram inoculados assepticamente, com o auxílio de uma pipeta estéril, em cada um dos 5 tubos contendo 10ml de caldo asparagina de concentração dupla. Os tubos foram incubados a 35-37ºC por 48 horas. Após 24-48 h de incubação, os tubos foram examinados sob luz ultra violeta. Dos tubos que apresentaram fluorescência verde, três alçadas foram transferidas para tubos contendo 10ml de caldo acetamida e, estes foram incubados por 48 horas a 35-37ºC. Em seguida, foi realizada a leitura e foram considerados positivos para a presença de
crescimento de P. aeruginosa em ágar leite foi evidenciado pela presença de colônias verdes fluorescentes quando expostas a luz ultra-violeta 365nm. Os resultados foram expresso como NMP de P. aeruginosa por 100mL.
4.2.3 - Quantificação do Número Mais Provável de Enterococos
Para a determinação do número mais provável de enterococos (estreptococos fecais) 10 ml das amostras de água foram inoculados em cada um dos 5 tubos contendo 10 ml de caldo dextrose azida de concentração dupla. Os tubos foram homogeneizados e incubados a 35-37ºC por 48 horas. Após a incubação foi feita a leitura e foram considerados positivos os tubos que apresentaram turvação e/ou precipitado. Uma alçada dos tubos positivos foi inoculada na superfície de placas de ágar seletivo para enterococos. As placas foram incubadas em posição invertida durante 24-48 horas a 35º C. Foram consideradas como positivo para estreptococos fecais todas as placas que apresentaram colônias com coloração castanho enegrecido com halo marrom. O cálculo do NMP foi feito a partir do número de placas que apresentarem resultados positivos em meio seletivo para enterococos. Os resultados foram expressos como NMP de estreptococos fecais por 100 mL, obtido através da tabela.
4.2.4 - Quantificação do Número Mais Provável de Clostrídios Sulfito Redutores
horas a 35ºC. Foram considerdos positivos os tubos onde foi observado o enegrecimento do meio DRCM. Dos tubos positivos, três alçadas foram transferidas para tubos contendo leite tornassolado. Os tubos foram incubados em jarras de anaerobiose por 48 horas a 350C. Os tubos que apresentaram acidificação, coagulação e formação de gás foram considerados positivos para presença de Clostrídios Sulfito Redutores. Os resultados das análises foram expressos como NMP de Clostrídios Sulfito Redutores por 100ml.
4.2.5 - Isolamento e identificação de leveduras em água
Alíquotas de 0,1 ml das amostras de água foram inoculadas em triplicata na superfície do meio ágar extrato de malte-extrato de levedura (glicose 1%, peptona 0.5%, extrato de malte 0.3%, extrato de levedura 0.3% e Agar 2%), contendo 100mg/L de cloranfenicol. As placas foram incubadas aerobicamente por 3-5 dias a 250C (ROSSITA & FLEET, 1996). O número de colônias dos diferentes morfotipos de leveduras foram contados e um representante de cada foi purificado e estocado em ágar GYMP (glicose 1%, extrato de levedura 0.5%, extrato de malte 1%, NaH2PO4 0.2% e Agar 2%) sob camada de óleo mineral em
geladeira, ou em freezer a –860C para posterior identificação. As leveduras foram identificadas segundo procedimento padrão (van der WALT & YARROW, 1984) e chaves taxonômicas presentes em KURTZMAN & FELL (1998).
4.3 – Análises do leite cru bovino
4.3.1- Contagem de bactérias aeróbias mesofílicas
meio de cultura. Após a solidificação do ágar as placas foram incubadas a 35-370C por 48 horas. Após a incubação foi realizada a contagem das colônias (SIQUEIRA, 1995).
4.3.2 - Isolamento e identificação de Staphylococcus aureus
Para a enumeração de S. aureus das amostras de leite 25ml das amostras foram homogeneizadas em 225ml de água peptonada tamponada, para a obtenção da diluição 10-1, a partir desta foram realizadas diluições
seriadas e alíquotas de 0,1ml de diliuções 10-1, 10-2 e 10-3 foram semeadas e
espalhadas, com auxílio de alça de Drigalski, na superfície do ágar Baird-Parker (Difco) enriquecido com emulsão de gema de ovo e telurito de potássio. As placas foram incubadas por 24-48 horas a 35-370C (SPECK, 1992). Em seguida,
foi realizada a contagem das colônias típicas e atípicas, e os resultados anotados separadamente. As colônias típicas foram caracterizadas por apresentarem coloração negra brilhante, forma arredondada, convexa, com bordos regulares, circundadas por um halo branco (lipase) e um outro externo, maior (protease), transparente, contrastando com meio originalmente opaco. As colônias cinzentas, ou negras brilhantes desprovidas de halos, ou apresentando apenas um deles, foram consideradas atípicas.
4.3.2.1 Provas bioquímicas para a identificação de Staphylococcus aureus
coloração pelo método de Gram, produção de coagulase, termonuclease (Tnase), fermentação da glicose (anaerobiose), fermentação do manitol (aerobiose e anaerobiose) e produção de hemólise em agar sangue de carneiro (KLOOS, 1990).
Nos tubos contendo culturas crescidas por 24 horas em caldo infusão de cérebro e coração foram pipetados 0,3 mL de plasma de coelho. Os tubos foram incubados a 37oC por 24 horas sendo realizada uma leitura preliminar após 6 horas de incubação. Foram utilizados controles positivo (cepa padrão coagulase positiva) e negativo (caldo infusão de cérebro coração mais plasma) para a realização deste teste. Em seguida foi feita a leitura dos resultados comparando-os com o padrão utilizado.
4.3.4 – Contagem de coliformes totais e fecais
A enumeração de coliformes totais e fecais foi baseada na técnica dos tubos múltiplos utilizando-se três séries de três tubos. Para a realização do testte preseuntivo o meio de cultura usado foi o caldo lauril sulfato (LST). A partir das diluições previamente preparadas foi inoculado um ml nos tubos contendo LST. Estes foram incubados por 24-48 horas a 35-37ºC. Os tubos positivos onde houve desenvolvimento de turvação e formação de bolha de gás no interior do tubo de Durhan, foram inoculados em caldo verde brilhante bile 2%, com o auxílio de alça de platina para a realização do teste confirmativo para coliformes totais. A incubação dos tubos foi realizada a 35-37ºC por 24-48 horas. A partir dos tubos positivos foram inoculados tubos contendo caldo EC, para a confirmação da presença de coliformes fecais. Após o período de incubação de 24 horas a 44,5ºC + 0,5ºC foi realizada a leitura dos tubos positivos.
4.3.5 – Contagem de Bacillus cereus
o meio de ágar manitol-vermelho de fenol-polimixina e, incubadas a 35-37°C por 24-48 horas. Após o crescimento, as placas que apresentaram colônias com as seguintes características: cerosas, com coloração rósea indicativa de manitol negativo, circundadas por um halo de precipitação evidenciando-se a produção de lecitinase foram contadas e selecionadas para a realização das provas bioquímicas. Com auxílio de uma alça de níquel-cromo, as colônias selecionadas foram transferidas para tubos contendo ágar nutriente inclinado e incubadas a 35-37°C por 24 horas. Transcorrido este período, foi realizada a coloração de Gram das amostras e, foram consideradas características as culturas que apresentaram bacilos gram-positivos, com esporos elipsoidais, centrais ou sub-terminais não-deformantes. A partir da cultura em ágar nutriente, foram realizadas as seguinte provas: fermentação de glicose, teste de Voges-Proskauer, hemólise em ágar sangue de carneiro.
4.3.6 - Pesquisa de Salmonella spp.
placas foram incubadas por 24 horas a 35-37oC. Após este tempo, foi observada a presença de colônias típicas com as seguintes características: em ágar Hecktoen entérico (He) as colônias de Salmonella são de cor esverdeada, com ou sem centro negro. Algumas cepas podem apresentar colônias com grande centro negro ou totalmente negras e brilhantes; já em ágar Salmonella-Shigella (SS) as colônias de Salmonella são incolores tendendo ao amarelo, excepcionalmente com centro negro. Após a observação das características morfológicas das colônias nos meios semeados foram selacionadas de cada placa duas ou mais colônias consideradas típicas e semeadas no meio de IAL (Instituto Adolfo Lutz). Os tubos foram incubados a 35-37oC por 24 horas e, em
seguida realizada a leitura.
4.3.7- Isolamento e identificação de Listeria monocytogenes.
Para a determinação de Listeria monocytogenes, 25 ml de cada uma das amostras, foram pipetados assepeticamente, e adicionados de 225ml de caldo para enriquecimento de Listeria (LEB1). A mistura foi homogeneizada e incubada por 24-48horas a 300C (SILVA et al., 1998). Após a incubação, uma alíquota de 0,1 ml foi transferida para 10ml de caldo para enriquecimento de Listeria (LEB2) para o enriquecimento secundário e, incubada por 24-48 horas a 300C (FURLANETTO et al., 1996). Transcorrido este tempo, uma alçada do cultivo do caldo LEB2 foi semeada na superfície dos meios: ágar PALCAM e ágar Oxford. As placas foram incubadas a 300C por 24-48 horas. Em seguida, as colônias características de Listeria foram semeadas em ágar tripticase de soja-extrato de levedura (TSA-TE) e incubadas a 300C por 24-48 horas. Após a incubação, as colônias foram submetidas às provas de coloração de Gram, motilidade em tubo, reação da catalase (FURLANETTO et al., 1996).
Para determinação da presença de Campylobacter spp., as amostras de leite foram homogeneizadas e em seguida, uma aliquota de 30 mL centrifugada a 15000 rpm por 20 minutos (4ºC). Descartado o sobrenadante, 0,1mL do pelete formado foi transferido para Caldo Brucela suplementado com solução redutora F.B.P.(Sulfato Ferroso 0,25g/L, Metasulfito de Sódio 0,25g/L e Piruvato 0,25g/L), 5mL para 100mL de meio, solução antibiótica I (vancomicina 15mg, Trimrtoprim 7,5mg e Polimixina B 8mg em 10 mL de água destilada estéril), 1mL para cada 100ml de meio. Os tubos foram incubados por 48 horas a 43±0,20 C em
atmosfera de microaerofilia (Anaérocult C-MERCK). Em seguida, as amostras foram plaqueadas por esgotamento (plaqueamento em T) em uma base rica (ágar brucella, BHI etc.) suplementado com F.B.P e solução antibiótica II (Trimetoprim 10mg, Polimixina B 8mg, Actidione 100mg e Cefalotina 10mg em 10 mL de água destilada estéril), nas mesmas proporções, e carvão a 5g%. As placas foram incubadas por 48 horas a 43±0,20 C em atmosfera de microaerofilia (Anaérocult C- MERCK). As colônias suspeitas selecionadas (colônias com brilho molhado, convexas e às vezes espalhadas ao longo da estria), foram submetidas à coloração de Gram apenas com cristal violeta para a observação da morfologia típica do gênero (bastonetes finos e curtos em forma de “S” ou espiral),
3.4.1- Contagem de bolores e leveduras das amostras de “pingo”, massa coagulada e queijo Canastra
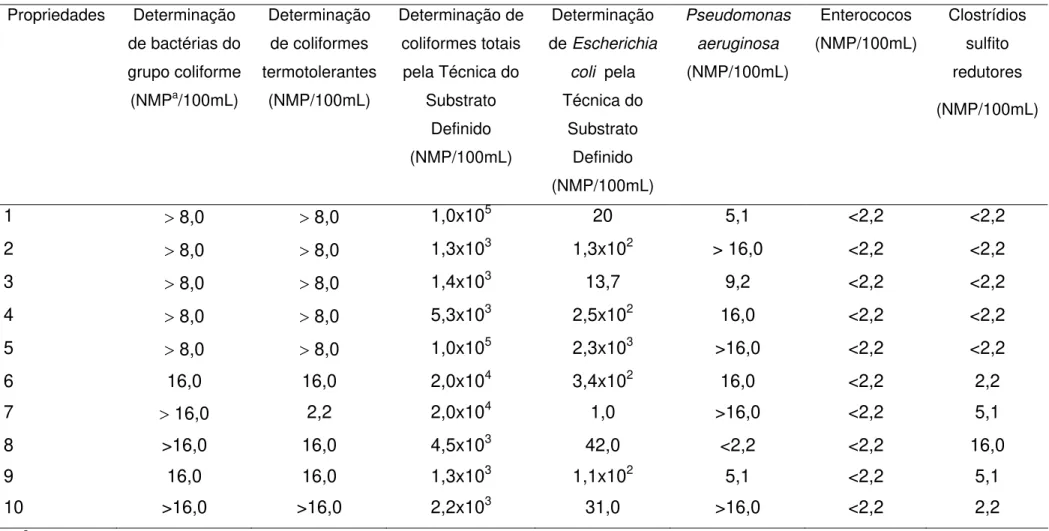
TABELA 1: Avaliação da qualidade microbiológica de amostras de água in natura de 10 propriedades rurais da região da Serra da Canastra, MG.
Propriedades Determinação de bactérias do grupo coliforme (NMPa/100mL)
Determinação de coliformes termotolerantes (NMP/100mL) Determinação de coliformes totais
pela Técnica do Substrato
Definido (NMP/100mL)
Determinação de Escherichia
coli pela
Técnica do Substrato Definido (NMP/100mL) Pseudomonas aeruginosa (NMP/100mL) Enterococos (NMP/100mL) Clostrídios sulfito redutores (NMP/100mL)
1 > 8,0 > 8,0 1,0x105 20 5,1 <2,2 <2,2
2 > 8,0 > 8,0 1,3x103 1,3x102 > 16,0 <2,2 <2,2
3 > 8,0 > 8,0 1,4x103 13,7 9,2 <2,2 <2,2
4 > 8,0 > 8,0 5,3x103 2,5x102 16,0 <2,2 <2,2
5 > 8,0 > 8,0 1,0x105 2,3x103 >16,0 <2,2 <2,2
6 16,0 16,0 2,0x104 3,4x102 16,0 <2,2 2,2
7 > 16,0 2,2 2,0x104 1,0 >16,0 <2,2 5,1
8 >16,0 16,0 4,5x103 42,0 <2,2 <2,2 16,0
9 16,0 16,0 1,3x103 1,1x102 5,1 <2,2 5,1
10 >16,0 >16,0 2,2x103 31,0 >16,0 <2,2 2,2
TABELA 2: Determinação dos indicadores higiênico-sanitários de leite in natura coletado em 10 propriedades rurais da região da Serra da Canastra, MG.
Propriedades Contagem padrão em placa- bactérias
mesofílicas (UFCb/mL)
Determinação de bactérias do grupo coliforme
(NMPa/mL)
Determinação de coliformes termotolerantes
(NMP/mL)
Staphylococcus
coagulase positiva (UFC/mL)
1c 1,1X107 460 24,0 4,4x103
2 2,4x103 <0,3 <0,3 <100
3 2,3x104 <0,3 <0,3 <100
4c 1,7x104 240 24,0 <100
5 4,6x103 24,0 24,0 <100
6c 3,6x102 <0,3 <0,3 <100
7 1,6x104 2,3 <0,3 6,4x102
8 1,0x104 2,3 2,3 <100
9 7,7x104 9,3 4,3 4,2x104
10 1,3x105 460 15,0 <100
a - NMP: Número Mais Provável.
b - UFC: Unidade Formadora de Colônia.
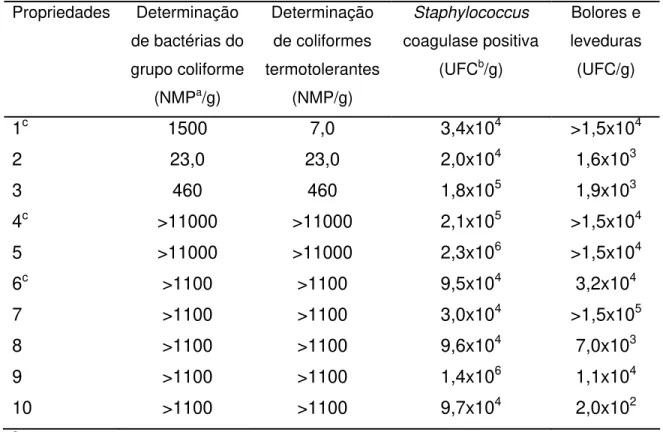
TABELA 3: Avaliação da qualidade microbiológica da massa coagulada de 10
propriedades rurais da região da Serra da Canastra, MG.
Propriedades Determinação de bactérias do grupo coliforme
(NMPa/g)
Determinação de coliformes termotolerantes
(NMP/g)
Staphylococcus
coagulase positiva (UFCb/g)
Bolores e leveduras (UFC/g)
1c 1500 7,0 3,4x104 >1,5x104
2 23,0 23,0 2,0x104 1,6x103
3 460 460 1,8x105 1,9x103
4c >11000 >11000 2,1x105 >1,5x104
5 >11000 >11000 2,3x106 >1,5x104
6c >1100 >1100 9,5x104 3,2x104
7 >1100 >1100 3,0x104 >1,5x105
8 >1100 >1100 9,6x104 7,0x103
9 >1100 >1100 1,4x106 1,1x104
10 >1100 >1100 9,7x104 2,0x102
a - NMP: Número Mais Provável.
TABELA 4: Avaliação da qualidade microbiológica do queijo curado produzido em 10 propriedades rurais da região da Serra da Canastra, MG.
Propriedades de bactérias do Determinação grupo coliforme
(NMPa/g)
Determinação de coliformes termotolerantes
(NMP/g)
Staphylococcus
coagulase positiva (UFCb/g)
Bolores e leveduras (UFC/g)
1c >11000 >11000 NDd >1,5x104
2 1100 460 1,2x106 >1,5x104
3 2400 2400 1,6x106 >1,5x104
4 >11000 >11000 1,7x106 >1,5x104
5 >11000 >11000 2,0x106 >1,5x104
6c >1100 >1100 8,6x105 >1,5x105
7 >1100 150 7,0x104 >1,5x105
8 240 240 <100 7,0x103
9 >1100 >1100 1,0x106 >1,5x105
10 >1100 >1100 <100 >1,5x105
a - NMP: Número Mais Provável.
b - UFC: Unidade Formadora de Colônia.
C - Ordenha mecânica.
5 - RESULTADOS
5.1 – Avaliação da qualidade microbiológica da água in natura
Na TAB. 1 estão representados os resultados relativos à qualidade microbiológica da água in natura (Portaria 1469, MS/2000). Todas as amostras revelaram a presença de bactérias do grupo coliformes e coliformes termotolerantes quando analisadas pelo método do número mais provável. Utilizando-se a Tecnologia do Substrato Definido (Colilert), a fim de se determinar o nível de contaminação das amostras, foi observado que a densidade bacteriana variou de 1,3 x 103 a 1,0 x 105 NMP/100mL para bactérias do grupo coliformes e 1,0 a 2,3 x 103 NMP/100mL para Escherichia coli. Pseudomonas aeruginosa foi encontrada em 90% (9/10) das amostras estudadas e os resultados obtidos variaram entre 2,2 e maior que 16,0 NMP/100mL. Em 50% (5/10) das amostras foi detectada a presença de clostrídios sulfito redutores. Não foram isolados enterococos em nenhuma das amostras analisadas.
5.2 – Avaliação da qualidade higiênico-sanitária de amostras de leite in natura
presença de Staphylococcus coagulase-positiva em populações que variaram de 6,4 x 102 a 4,2 x 104 UFC/mL. O leite da fazenda 6 foi o que apresentou menor índice de contaminação.
5.3 – Determinação da qualidade higiênico-sanitária das amostras de massa coagulada
De acordo com os dados apresentados na TAB. 4, 80% (8/10) das amostras de massa coagulada apresentaram contagens de bactérias do grupo coliforme acima de 1100 NMP/g. Para os coliformes termotolerantes foram observados valores superiores a 1100 NMP/g em 70% (7/10) das amostras. Nas fazendas 3, 4, 5 e 9 a população de Staphylococcus coagulase-positiva foi superior a 105 UFC/g. Em 90% (9/10) das amostras de massa coagulada as contagens de bolores e leveduras foram superiores a 103 UFC/g.
16.1
64.4
48.4
3.2 6.
5
0 10 20 30 40 50 60 70 80 90 100
Porcentagem
Toxinas
SEA
SEB
SEC
SED
TSST-1
FIGURA 9: Freqüência (%) de “pools” de Staphylococcus aureus (31 “pools”) produtores de enterotoxinas A, B, C e D toxina TSST-1 obtidos a partir das amostras de leite, “pingo”, massa coagulada e queijos produzidos na Serra da Canastra, MG.
RESUTADOS PINGO
Propriedades Determinação de bactérias do grupo coliforme (NMP/mL) Determinação de coliformes termotolerantes (NMP/mL) Staphylococcus coagulase positiva (UFC/mL) Bolores e leveduras (UFC/mL)
1 1100 210 <100 1,0x104
2 1100 1100 4,7x105 3,7x103
3 93 93 1,2x105 >1,5x104
4 240 21 1,5x104 >1,5x104
5 460 150 <100 >1,5x104
6 >1100 240 3,2x102 >1,5x105
7 >1100 1100 <100 6,2x104
8 1100 240 1,4x103 9,8x104
9 240 240 1,4x102 3,5x104
10 150 9 <100 3,5x104
a - NMP: Número Mais Provável.
b - UFC: Unidade Formadora de Colônia.
Os resultados da avaliação da qualidade microbiológica do “pingo” estão apresentados na TAB. 3. Como pode ser observado, as bactérias do grupo coliformes e os coliformes termotolerantes estiveram presentes em todas as amostras analisadas com valores que variaram de 93 a superior a 1100 NMP/mL e 9 a 1100 NMP/mL, respectivamente. Os Staphylococcus-coagulase-positiva estiveram presentes em 60% (6/10) das amostras em contagens entre 1,4 x 102 e 4,7 x 105 UFC/mL. No “pingo” também foi avaliada a presença de bolores e leveduras e os resultados encontrados variaram de 3,7 x 103 a maior que 1,5 x 105 UFC/mL.
5.4 – Avaliação da qualidade microbiológica do queijo Canastra
amostras de queijo das fazendas 8 e 10, a população de Staphylococcus coagulase-positiva foi inferior a 100 UFC/g, sendo que nas fazendas 2, 3, 4, 5, 6 e 9, as populações de Staphylococcus coagulase-positiva encontradas estiveram acima de 105 UFC/g. As contagens de bolores e leveduras apresentaram
resultados entre 7,0 x 103 e superior a 1,5 x 105 UFC/g.
Em nenhuma das amostras de leite in natura, “pingo”, massa coagulada e queijo analisadas foi detectada a presença de Samolnella spp., Listeria spp., Campylobacter spp. ou Bacillus cereus.
CONCLUSÕES
- Todas as amostras de água encontram-se fora dos padrões de potabilidade estabelecidos pela Legislação vigente (Portaria 1469 MS, 2000).
- As amostras de leite in natura das fazendas 2, 3, 6, 7 e 8 estavam dentro dos níveis de tolerância microbiológica estabelecidos para leite pasteurizado (Resolução RDC 12 MS, 2001). No entanto nas demais amostras o leite apresentou elevada contaminação por microrganismos indicadores de condições higiênico-sanitárias deficientes
1 - INTRODUÇÃO
O queijo Minas é produzido no Brasil desde o período colonial, sendo que sua fabricação originou-se no estado de Minas Gerais, com procedimentos caseiros desenvolvidos, principalmente, na cidade do Serro e na região da Serra da Canastra. Desta forma, tal produto apresenta grande valor sócio-cultural para o Estado. De acordo com dados do Instituto Mineiro de Agropecuária, foram cadastrados cerca de 830 produtores na Serra da Canastra, responsáveis pela produção de 373,5 toneladas de queijo por mês. Esse queijo é produzido de forma artesanal e não se caracteriza por uma tecnologia de fabricação definida. Atualmente a comercialização deste produto é mais acentuada nas zonas leiteiras da região Sul e Sudeste do Brasil.
O queijo Minas curado apresenta considerável importância em Saúde Pública, dada as suas condições peculiares de produção. A utilização do leite cru para a fabricação deste tipo de queijo é motivo de preocupação, pois este constitui uma importante via de transmissão de inúmeros patógenos, tais como: Staphylococcus aureus, Escherichia coli, Salmonella spp., Shigella spp., Listeria monocytogenes, dentre outros. A Legislação Brasileira não permite a produção de queijo a partir de leite cru, o que inviabiliza a comercialização legal do produto. Neste trabalho serão analisados alguns dos principais indicadores microbiológicos de qualidade presentes durante a fabricação artesanal do queijo produzido na região da Serra da Canastra. Este estudo poderá vir a contribuir com informações relevantes para a criação do padrão de identidade e qualidade do produto.
Não existem dados sobre a microbiota de leveduras envolvida no processo de fabricação do queijo Canastra. A produção artesanal dá-se ao nível da fazenda sem qualquer apoio tecnológico. As leveduras tem um papel importante durante a produção e maturação de queijos, pois estes microrganismos contribuem para o desenvolvimento das características organolépticas do produto final.
2 - REVISÃO BIBLIOGRÁFICA
2.1- Considerações gerais
O queijo é um dos mais antigos alimentos preparados que a história da humanidade registra, e é tido como uma das formas mais antigas de se conservar o leite. A arte de sua fabricação teve início num passado remoto, milhares de anos antes do nascimento de Cristo (FURTADO, 1991).
Os processos de fabricação de queijos compreendem métodos que transformam grande parte dos componentes do leite num produto de fácil conservação, com menor quantidade de água, grande valor nutritivo e sabor agradável (LEITE et al., 2000). A fabricação de queijos no Brasil é de história relativamente recente, firmando-se do ponto de vista industrial, no início deste século e, sobretudo, a partir da década de 20, com o estabelecimento de imigrantes dinamarqueses no sul de Minas Gerais e holandeses na região de Santos Dumont e Barbacena (FURTADO,1991). O estado de Minas Gerais destaca-se por sua produção leiteira (30% da produção nacional) e pelos produtos derivados do leite, sendo o queijo Minas bastante difundido e comercializado no Brasil (SANTOS et al., 1981; FONSECA et al., 1995).
2.2- Produção de queijo Minas
Segundo a definição do Regulamento da Inspeção Industrial e Sanitária de Produtos de Origem Animal (BRASIL, 1980), o queijo Minas Curado é o produto obtido do leite integral ou padronizado, pasteurizado, de massa crua, prensado mecanicamente e devidamente maturado durante 20 dias. Embora a pasteurização do leite tenha permitido melhorar a qualidade do queijo Minas e prolongar sua vida de prateleira, este continua a ser produzido de forma artesanal (com leite cru) e em quantidade expressiva em algumas regiões do Estado (OLIVEIRA, 1999). Em função da política de pagamento do leite, os produtores têm preferido produzir o queijo Minas na própria fazenda, não tendo quelquer assistência, o que resulta na obtenção de um produto de composição e características bastante variadas, comprometendo sua qualidade final e acarretando problemas na sua comercialização.
2.3- Queijo Canastra
O queijo Minas da Serra da Canastra é fabricado há dezenas de anos, de maneira empírica e tradicional, com leite cru, nos municípios de Tapira, Vargem Bonita e cercanias, tendo como centro polarizador o município de São Roque de Minas, onde este produto tem as características mais representativas. As características micro-climáticas da região possibilitam a interação de condições e agentes que proporcionam o sabor característico e singular do produto. A região possui cerca de 600 produtores de queijo e estima-se que só a cidade de São Roque produza cerca de 90 toneladas de queijo Minas por semana, a maior parte sendo vendida em São Paulo (IMA, 1999). De acordo com os dados do IMA, foram cadastrados cerca de 830 produtores na Serra da Canastra, responsáveis pela produção de 373,5 toneladas de queijo por mês.
encontra-se a qualidade do queijo do Canastra. Uma vez que o queijo é produzido de forma artesanal este não apresenta uniformidade em suas propriedades físico-químicas e organolépticas, o que dificulta a padronização do pão de queijo.
2.4- Tecnologia de fabricação
O queijo Minas da Serra da Canastra é produzido artesanalmente a partir de leite cru, na própria fazenda, sem acompanhamento tecnológico, resultando na obtenção de um produto de composição variada, e características de sabor, aroma, corpo e textura bastante diferenciados, o que pode comprometer sua qualidade final (SIQUEIRA et al., 1986). A cozinha, onde o queijo é produzido, é geralmente caracterizada por uma construção simples, de alvenaria, quase nunca azulejada, nas proximidades do curral. Para a fabricação dos queijos, utiliza-se o leite cru recém-ordenhado e geralmente não se mistura o leite ordenhado a tarde, por receio da ocorrência de um defeito conhecido como estufamento precoce. Algumas fazendas fazem duas fabricações, uma com o leite da manhã e outra com o leite da tarde.
O leite é coado em panos, diretamente dentro de uma bombona de plástico onde a fabricação é realizada. Em seguida, adiciona-se o coalho, dissolvido no “pingo”, e então o leite é homogeneizado. O “pingo” é um soro-fermento muito peculiar e característico da região. Ele é coletado durante a noite a partir do soro que escorre dos queijos cobertos com sal grosso. Dessa forma, a microbiota bacteriana nativa é bastante tolerante ao sal. A quantidade de “pingo” adicionada varia entre 0,5 e 1,0 litro para cada 100 litros de leite.
A coalhada decantada é coletada em peneiras, e a massa é prensada, manualmente, em formas de plástico; em algumas fazendas a massa é prensada no interior de panos. A bancada e os queijos são lavados com água corrente para a retirada dos restos de soro ou massa. Os queijos são cobertos com sal grosso e deixados em repouso por 5-6 horas. Um recipiente é colocado no piso, logo abaixo do furo existente na porção inclinada da bancada, para a coleta do soro que será utilizado como “pingo” no dia seguinte. Após o repouso inicial (5-6 horas), o sal grosso é removido da superfície dos queijos e estes são virados, recobertos com sal e deixados, na mesma posição, até o dia seguinte.
O sal, então, é removido e os queijos são mantidos nas formas onde ficam secando por mais 24 horas. Os queijos são retirados das formas e levemente raspados, com o auxílio de um ralinho, para que a casca fique bem fina. Os queijos são colocados em prateleiras e virados todos os dias. Estes são mantidos curando nas prateleiras à temperatura ambiente por até 10-15 dias.
Assim, o queijo Canastra possui formato cilíndrico, com aproximadamente 14cm de diâmetro e altura variando entre 4 e 6 cm. Sua casca é esbranquiçada, tendendo a se transformar em uma crosta fina e amarelada quando o queijo é curado por alguns dias. Internamente a massa é branca e consistente, às vezes ligeiramente quebradiça. O queijo apresenta olhaduras mecânicas de pequeno tamanho e algumas vezes, pequenas olhaduras irregulares. Devido ao processo de fermentação natural acentuado, a coalhada, mesmo não sendo prensada sofre uma dessoragem espontânea, o que resulta em queijos mais firmes e secos que outros de fabricação similar (IMA, 1999). Seu sabor é bastante típico e acentuadamente mais ácido que o do queijo Minas industrial (FURTADO, 1980).
pressiona o preço do produto justificando o excesso de oferta, dificuldades com a estrada, entre outros motivos. Estas pessoas atuam também, em determinados casos, como agentes de degradação da qualidade do queijo, uma vez que transportam os queijos das fazendas para seus depósito, dentro de sacos plásticos, a granel ou em caixas pláticas em carrocerias de caminhonetes, simplesmente cobertos com lona. Os queijos são comprados do produtor rural pelo “queijeiro”, geralmente antes de completarem uma semana de cura à temperatura ambiente.
2.5- A legislação e o queijo Canastra
Em vários países, sobretudo na Europa, os queijos artesanais adquiriram um lugar privilegiado no meio do patrimônio gastronômico e cultural. Juntamente com os queijos de leite cru, eles deram à França sua notoriedade de “país do queijo”. Essa reputação vem acompanhada das necessárias garantias de segurança e higiene a que o consumidor tem direto (ENCONTRO TÉCNICO, 2000).
As produções de tipos de queijos que se identificam aos do Serro e da Serra da Canastra datam do século XVIII. Hoje, com as pressões de modernização dos processos produtivos foi introduzida a pasteurização do leite destinado à fabricação de queijos. Entretanto ainda assim, as práticas tradicionais utilizando leite cru permanecem vivas e atuantes em Minas Gerais (VARGAS et al., 1998).
Embora conhecidos e procurados pelo consumidor, os queijos tradicionais, nem sempre podem garantir a segurança alimentar necessária. Os produtos são pouco maturados, fabricados a partir de leite cru e não existe uma legislação vigente adaptada às características deste tipo de produção. Sua comercialização se faz, em geral, de forma clandestina, como produtos não inspecionados dificultando o controle de qualidade. Assim a continuidade da atividade e a manutenção de um modo de vida tradicional que garante a sobrevivência do grande número de produtores, instalados em regiões pouco propícias a outras atividades agrícolas encontra-se ameaçada (ENCONTRO TÉCNICO, 2000).
certificados apresentam propriedade nutricionais diferenciadas dos demais queijos obtidos a partir de leite pasteurizado (VARGAS et al., 1998).
A qualidade e características do queijo não são constantes. Os principais fatores que contribuem para estas variações são a cultura iniciadora e o tipo de leite, os quais levam à obtenção de um produto de composição variada e, características de sabor, aroma, corpo e textura bastante diferenciados, comprometendo a qualidade do produto final (FONSECA et al., 1995). A Legislação Brasileira não permite a comercialização de queijo produzidos a partir de leite cru, a não ser que seja produzido a partir de leite higienizado e seja submetido a um processo de maturação a temperatura superior a 50C, durante um
Quadro 1 – Padrões de identidade e qualidade microbiológica, provisivos, como ponto de partida para a melhoria contínua da qualidade para o queijo Canastra fabricado de leite cru no Município de são Roque de Minas 1 (VARGAS et al.,
1998).
Contagens microbiológica (data expedida)
Limites de higidez: (fim da validade)
Limites de higidez: (queijos
naturais)
Método indicado:
Aeróbios a 30o C/g2 105 106 FIL 100B: 1991
Coliformes 45o C/g3 102 103 APHA (1992)
Salmonella em 25 g4 Ausência Ausência FIL 93A: 1985 Staphylococcus
aureus/g5
102 103 FIL 145:1990
Streptreptococcus β hemolíticos A, B, C, G e L6
Ausências em 0,10 g
Ausência em 0,10 g
France, DGAL/SV HA /No 87/No 8149; 02/11/87 (1985) L. monocytogenes7 Ausência em 25
g
Ausência em 25 g FIL 143: 1990
Mofos e leveduras/g8
5 x 102 5 x 103 FIL. 94B: 1991
1 – Este quadro faz referência aos queijos com a atividade de água Aw>0,970 na escala divulgada POR VAN DENDER (1995) onde: Aw=1,024321 – 1,157 . 10-4 DPC, ou com a umidade superior 50 a 58%, em qualquer momento do período de validade; estes queijos devem apresentar fosfatase e peroxidade positivas (+++), em qualquer fase da comercialização. Devem também se apresentar totalmente livres de pêlos, partículas estranhas ou de contaminação com fragmentos de inseto; 2- Microrganismo aeróbios quantificados à temperatura de incubação de 30o C/48 a 72 horas; 3- n=5;c=2; m=50; M=500 (Brasil, MAARA,1996); 4- n=5;c=0; m=0 (Brasil, MAARA, 1996); 5- n=5;c= 1; m= 500;M= 500 (Brasil; MAARA,1996); 6- n=5;c= 1; m= 0 (Brasil; MAARA,1996); 7- n=5;c= 0; m= 0;M= 0 (Brasil; MAARA,1996); 8- n= 5; c= 2; m= 50; M= 500.
3 - OBJETIVOS
3.1 - Objetivo Geral
- Caracterizar os indicadores higiênico-sanitários e a diversidade de leveduras durante o processo de fabricação artesanal do queijo Minas curado (queijo Canastra) produzido na região da Serra da Canastra, Município de São Roque de Minas, Estado de Minas Gerais.
3.2- Objetivos Específicos
3.2.1 - Avaliar a qualidade microbiológica da água utilizada no processo de fabricação do queijo Canastra verificando a presença de coliformes fecais e totais,
Pseudomonas aeruginosa, Clostridios sulfito redutores, Enterococos e leveduras.
3.2.2 – Determinar a presença de indicadores higiênico-sanitários no leite “in natura”, “pingo”, coalhada e queijo Minas curado da Serra da Canastra, quantificando a presença de coliformes totais e fecais, bactérias aeróbias mesofílicas, Staphylococcus aureus,Listeria spp., Salmonella spp., Campylobacter spp. e Bacillus cereus durante o processo de fabricação.
4 - MATERIAIS & MÉTODOS
4.1 - Amostragem
As coletas foram feitas em dez fazendas do município de São Roque de Minas localizado próximo dos limites do Parque Nacional da Serra da Canastra, há aproximadamente 300 Km de Belo Horizonte. De cada fazenda foram amostradas a água, leite cru bovino, “pingo” (soro-fermento característico da região), coalhada e queijo curado pronto para consumo, perfazendo um total de 10 amostras para cada substrato. Nas fazendas 1, 4 e 6 era utilizada a ordenha mecânica, enquanto que nas demais fazendas a retirada do leite era realizada manualmente. As amostras de leite, “pingo” e coalhada foram oriundas de um mesmo lote de fabricação. A coalhada corresponde à massa fresca obtida após a quebra do coágulo formado em decorrência do período de coagulação do leite. A coalhada foi coletada antes da prensagem nas fôrmas plásticas, geralmente após uma hora da adição do coalho. O material foi coletado, assepticamente, em frascos ou sacos plásticos esterilizados e, transportado para o laboratório em caixas de material isotérmico contendo gelo e, processadas no período de no máximo 24 horas. As análises das amostras foram realizadas nos Laboratórios de Microbiologia de Alimentos e de Enterotoxinas Estafilocócicas da Fundação Ezequiel Dias e no Laboratório de Ecologia e Biotecnologia de Leveduras, da UFMG.
4.2 - Análise da água
4.2.1 - Quantificação do Número mais Provável (NMP) de coliformes totais e fecais
pipeta estéril 10 ml da amostra foram inoculados em uma série de cinco tubos contendo caldo Lauril Sulfato Triptose de concentração dupla (teste presuntivo). Os tubos foram homogenizados e incubados a 35±0,50C por 48 horas. Após este
período foi verificada a turvação e a presença de gás no interior do tubo de Duhran presente no meio. Para os tubos considerados positivos, turvos e com bolhas de gás no interior do tubo de Duhran, uma alçada foi transferida para caldo lactosado verde brilhante bile a 2%. Os tubos foram incubados por 24-48 horas a 35±0,5ºC. O teste confirmativo para coliformes totais foi considerado positivo para os tubos que apresentaram formação de gás. O ensaio confirmativo para coliformes fecais foi feito a partir dos tubos positivos de caldo lactosado verde brilhante bile a 2%, transferindo-se uma alçada para os tubos contendo meio E.C. Os tubos foram incubados em banho-maria a 44,5 ± 0,2ºC durante 24 horas. Os tubos foram considerados positivos quando houve formação de bolhas no interior do tubo de Duhran. Os resultados foram expressos como NMP, de bactérias do grupo coliforme e/ou coliformes de origem fecal por 100 mL.
4.2.2 - Quantificação do Número Mais Provável de Pseudomonas aeruginosa pela Técnica dos Tubos Múltiplos
Após a homogeneização das amostras de água, 10ml foram inoculados assepticamente, com o auxílio de uma pipeta estéril, em cada um dos 5 tubos contendo 10ml de caldo asparagina de concentração dupla. Os tubos foram incubados a 35-37ºC por 48 horas. Após 24-48 h de incubação, os tubos foram examinados sob luz ultra violeta. Dos tubos que apresentaram fluorescência verde, três alçadas foram transferidas para tubos contendo 10ml de caldo acetamida e, estes foram incubados por 48 horas a 35-37ºC. Em seguida, foi realizada a leitura e foram considerados positivos para a presença de
colônias verdes fluorescentes quando expostas a luz ultra-violeta 365nm. Os resultados foram expresso como NMP de P. aeruginosa por 100mL.
4.2.3 - Quantificação do Número Mais Provável de Enterococos
Para a determinação do número mais provável de enterococos (estreptococos fecais) 10 ml das amostras de água foram inoculados em cada um dos 5 tubos contendo 10 ml de caldo dextrose azida de concentração dupla. Os tubos foram homogeneizados e incubados a 35-37ºC por 48 horas. Após a incubação foi feita a leitura e foram considerados positivos os tubos que apresentaram turvação e/ou precipitado. Uma alçada dos tubos positivos foi inoculada na superfície de placas de ágar seletivo para enterococos. As placas foram incubadas em posição invertida durante 24-48 horas a 35º C. Foram consideradas como positivo para estreptococos fecais todas as placas que apresentaram colônias com coloração castanho enegrecido com halo marrom. O cálculo do NMP foi feito a partir do número de placas que apresentarem resultados positivos em meio seletivo para enterococos. Os resultados foram expressos como NMP de estreptococos fecais por 100 mL, obtido através da tabela.
4.2.4 - Quantificação do Número Mais Provável de Clostrídios Sulfito Redutores
incubados em jarras de anaerobiose por 48 horas a 350C. Os tubos que apresentaram acidificação, coagulação e formação de gás foram considerados positivos para presença de Clostrídios Sulfito Redutores. Os resultados das análises foram expressos como NMP de Clostrídios Sulfito Redutores por 100ml.
4.2.5 - Isolamento e identificação de leveduras em água
Alíquotas de 0,1 ml das amostras de água foram inoculadas em triplicata na superfície do meio ágar extrato de malte-extrato de levedura (glicose 1%, peptona 0.5%, extrato de malte 0.3%, extrato de levedura 0.3% e Agar 2%), contendo 100mg/L de cloranfenicol. As placas foram incubadas aerobicamente por 3-5 dias a 250C (ROSSITA & FLEET, 1996). O número de colônias dos diferentes morfotipos de leveduras foram contados e um representante de cada foi purificado e estocado em ágar GYMP (glicose 1%, extrato de levedura 0.5%, extrato de malte 1%, NaH2PO4 0.2% e Agar 2%) sob camada de óleo mineral em geladeira,
ou em freezer a –860C para posterior identificação. As leveduras foram
identificadas segundo procedimento padrão (van der WALT & YARROW, 1984) e chaves taxonômicas presentes em KURTZMAN & FELL (1998).
4.3 – Análises do leite cru bovino
4.3.1- Contagem de bactérias aeróbias mesofílicas
4.3.2 - Isolamento e identificação de Staphylococcus aureus
Para a enumeração de S. aureus das amostras de leite 25ml das amostras foram homogeneizadas em 225ml de água peptonada tamponada, para a obtenção da diluição 10-1, a partir desta foram realizadas diluições seriadas e
alíquotas de 0,1ml de diliuções 10-1, 10-2 e 10-3 foram semeadas e espalhadas,
com auxílio de alça de Drigalski, na superfície do ágar Baird-Parker (Difco) enriquecido com emulsão de gema de ovo e telurito de potássio. As placas foram incubadas por 24-48 horas a 35-370C (SPECK, 1992). Em seguida, foi realizada a
contagem das colônias típicas e atípicas, e os resultados anotados separadamente. As colônias típicas foram caracterizadas por apresentarem coloração negra brilhante, forma arredondada, convexa, com bordos regulares, circundadas por um halo branco (lipase) e um outro externo, maior (protease), transparente, contrastando com meio originalmente opaco. As colônias cinzentas, ou negras brilhantes desprovidas de halos, ou apresentando apenas um deles, foram consideradas atípicas.
4.3.2.1 Provas bioquímicas para a identificação de Staphylococcus aureus
Nos tubos contendo culturas crescidas por 24 horas em caldo infusão de cérebro e coração foram pipetados 0,3 mL de plasma de coelho. Os tubos foram incubados a 37oC por 24 horas sendo realizada uma leitura preliminar após 6
horas de incubação. Foram utilizados controles positivo (cepa padrão coagulase positiva) e negativo (caldo infusão de cérebro coração mais plasma) para a realização deste teste. Em seguida foi feita a leitura dos resultados comparando-os com o padrão utilizado.
4.3.2.2 - Produção de enterotoxina
Do total de 299 cepas de Staphylococcus spp. isoladas, aquelas que apresentaram um mesmo perfil bioquímico-fisiológico e eram procedentes de uma mesma amostra foram agrupadas, formando um total de 75 “pools”. Os “pools” foram crescidos em 5,0 ml de caldo BHI por 24 horas a 370 C. Para testar a enterotoxigenicidade das culturas, foi utilizado o método de plaqueamento em membrana de diálise sobre ágar. Placas de Petri preparadas com 20 mL de ágar infuso de cérebro e coração (BHI) acrescido de 1% de extrato de levedura e 0,1% de fosfato dibásico de potássio, foram cobertas com disco de membrana de diálise Spectra/6000 – 8000 – 100mm, esterelizadas pelo calor (OLSON et al., 1970). Após a acomodação cuidadosa da membrana sobre o ágar, 0,5 mL do inóculo do “pool” foi espalhado com auxilio de uma alça de Drigalski, em seguida a placa foi incubada a 37°C por 24 horas. Após este procedimento o crescimento bacteriano foi lavado da superfície da membrana com 2,5 mL de tampão PBS (Na2HPO4
0,02M, pH 7.4), em duas etapas, usando-se 1,5 mL e 1,0 mL do mesmo. Em seguida, o material assim obtido, foi centrifugado a 10.000g por dez minutos a 4ºC. O sobrenadante obtido foi transferido para um frasco de vidro com tampa e acrescido de 20μl de timerosol como conservante e, posteriormente, utilizado no teste para detecção de enterotoxina (CARMO, 1997; CARMO, 2001).
Para a detecção de enterotoxinas estafilocócicas foi utilizado o método Sensibilidade Ótima em Placa (OSP) (ROBBINS et al. 1974). Neste método, 3mL de ágar preparado com 1,2% de ágar nobre em tampão PBS 0,02M, pH 7.4 foi distribuído em placas de Petri 50mm x 12 mm. Após a solidificação, foram feitos 5 orifícios de 8,3 mm e 2 medindo 6,7 mm, conforme molde mostrado na figura 1. Nos dois orifícios menores foram colocados 4μg/mL de uma toxina padrão e o orifício central foi preechido com um anti-soro de título conhecido, de forma que as linhas de precipitina formadas pela reação antigeno/anticorpo, se situassem na metade das distâncias entre este e cada um dos orifícios menores. Os outros orifícios restantes foram preechidos com os sobrenadantes das culturas testes, obtidas na etapa anterior. Assim, diferentes placas foram utilizadas para cada enterotoxina a ser testada (SEA, SEB, SEC, SED e toxina TSST-1). Após a inoculação, as placas foram incubadas em câmara úmida a 37°C por 24 horas. Foram consideradas positivas as placas que apresentaram uma linha de precipitina entre o sobrenadante e os anti-soros testados (CARMO, 1997; CARMO, 2001). As toxinas-padrão e os anti-soros específicos utilizados neste estudo foram gentilmente cedidos pelo Dr. Luiz Simeão do Carmo (Laboratório de Enterotoxinas da FUNED).
4.3.4 – Contagem de coliformes totais e fecais
positivos foram inoculados tubos contendo caldo EC, para a confirmação da presença de coliformes fecais. Após o período de incubação de 24 horas a 44,5ºC + 0,5ºC foi realizada a leitura dos tubos positivos.
4.3.5 – Contagem de Bacillus cereus
Para a contagem de Bacillus cereus nas amostras de leite, 0,1ml das diluições 10
-1, 10-2, 10-3 foram inoculadas e espalhadas na superfície de placas contendo o
meio de ágar manitol-vermelho de fenol-polimixina e, incubadas a 35-37°C por 24-48 horas. Após o crescimento, as placas que apresentaram colônias com as seguintes características: cerosas, com coloração rósea indicativa de manitol negativo, circundadas por um halo de precipitação evidenciando-se a produção de lecitinase foram contadas e selecionadas para a realização das provas bioquímicas. Com auxílio de uma alça de níquel-cromo, as colônias selecionadas foram transferidas para tubos contendo ágar nutriente inclinado e incubadas a 35-37°C por 24 horas. Transcorrido este período, foi realizada a coloração de Gram das amostras e, foram consideradas características as culturas que apresentaram bacilos gram-positivos, com esporos elipsoidais, centrais ou sub-terminais não-deformantes. A partir da cultura em ágar nutriente, foram realizadas as seguinte provas: fermentação de glicose, teste de Voges-Proskauer, hemólise em ágar sangue de carneiro.
4.3.6 - Pesquisa de Salmonella spp.
Para a pesquisa de Salmonella spp., 25 ml de cada amostra de leite foi transferida, assepticamente, para frascos contendo 225ml de água peptonada 1% acrescida de 2ml de solução de verde brilhante 0,25%, para inibir o crescimento de microrganismos Gram positivos. Os frascos foram incubados por 24 horas a 35-370C. Nesta fase de pré-enriquecimento, o objetivo foi reparar as células
cistina e caldo Rappaport-Vassiliadis para favorecer o crescimento de Salmonella e inibir o crescimento da microbiota acompanhante. Foram transferidos 1ml do subcultivo em água peptonada para tubos contendo 10 ml de caldo selenito cistina e 0,1 ml para tubos contendo 10 ml de caldo Rappaport.-Vassiliadis. Os tubos de caldo selenito cistina foram incubados a 35-37oC por 24 horas e os tubos de
Rappaport-Vassiliadis foram incubados a 43oC por 24 horas. Após o período de
incubação uma alçada foi semeada por estria em placas contendo os meios
Salmonella-Shigella (SS) e Hecktoen entérico (He). As placas foram incubadas por 24 horas a 35-37oC. Após este tempo, foi observada a presença de colônias
típicas com as seguintes características: em ágar Hecktoen entérico (He) as colônias de Salmonella são de cor esverdeada, com ou sem centro negro. Algumas cepas podem apresentar colônias com grande centro negro ou totalmente negras e brilhantes; já em ágar Salmonella-Shigella (SS) as colônias de Salmonella são incolores tendendo ao amarelo, excepcionalmente com centro negro. Após a observação das características morfológicas das colônias nos meios semeados foram selacionadas de cada placa duas ou mais colônias consideradas típicas e semeadas no meio de IAL (Instituto Adolfo Lutz). Os tubos foram incubados a 35-37oC por 24 horas e, em seguida realizada a leitura.
4.3.7- Isolamento e identificação de Listeria monocytogenes.
Para a determinação de Listeria monocytogenes, 25 ml de cada uma das amostras, foram pipetados assepeticamente, e adicionados de 225ml de caldo para enriquecimento de Listeria (LEB1). A mistura foi homogeneizada e incubada por 24-48horas a 300C (SILVA et al., 1998). Após a incubação, uma alíquota de
0,1 ml foi transferida para 10ml de caldo para enriquecimento de Listeria (LEB2) para o enriquecimento secundário e, incubada por 24-48 horas a 300C
(FURLANETTO et al., 1996). Transcorrido este tempo, uma alçada do cultivo do caldo LEB2 foi semeada na superfície dos meios: ágar PALCAM e ágar Oxford. As placas foram incubadas a 300C por 24-48 horas. Em seguida, as colônias
levedura (TSA-TE) e incubadas a 300C por 24-48 horas. Após a incubação, as colônias foram submetidas às provas de coloração de Gram, motilidade em tubo, reação da catalase (FURLANETTO et al., 1996).
4.3.8 – Pesquisa de Campylobacter spp.
Para determinação da presença de Campylobacter spp., as amostras de leite foram homogeneizadas e em seguida, uma aliquota de 30 mL centrifugada a 15000 rpm por 20 minutos (4ºC). Descartado o sobrenadante, 0,1mL do pelete formado foi transferido para Caldo Brucela suplementado com solução redutora F.B.P.(Sulfato Ferroso 0,25g/L, Metasulfito de Sódio 0,25g/L e Piruvato 0,25g/L), 5mL para 100mL de meio, solução antibiótica I (vancomicina 15mg, Trimrtoprim 7,5mg e Polimixina B 8mg em 10 mL de água destilada estéril), 1mL para cada 100ml de meio. Os tubos foram incubados por 48 horas a 43±0,20 C em atmosfera de microaerofilia (Anaérocult C-MERCK). Em seguida, as amostras foram plaqueadas por esgotamento (plaqueamento em T) em uma base rica (ágar brucella, BHI etc.) suplementado com F.B.P e solução antibiótica II (Trimetoprim 10mg, Polimixina B 8mg, Actidione 100mg e Cefalotina 10mg em 10 mL de água destilada estéril), nas mesmas proporções, e carvão a 5g%. As placas foram incubadas por 48 horas a 43±0,20 C em atmosfera de microaerofilia (Anaérocult C-
CONCLUSÕES
- Todas as amostras de água encontram-se fora dos padrões de potabilidade estabelecidos pela Legislação vigente (Portaria 1469 MS, 2000).
- As amostras de leite in natura das fazendas 2, 3, 6, 7 e 8 estavam dentro dos níveis de tolerância microbiológica estabelecidos para leite pasteurizado (Resolução RDC 12 MS, 2001). No entanto nas demais amostras o leite apresentou elevada contaminação por microrganismos indicadores de condições higiênico-sanitárias deficientes
- As amostras de “pingo” apresentaram elevado índice de contaminação por indicadores higiênico-sanitários, sendo, portanto uma importante fonte de contaminação para o produto final.
- A amostra de queijo Canastra da fazenda 8 foi a única que estava dentro dos padrões microbiológicos estabelecidos para queijos de leite pasteurizado (Resolução RDC 12, MS/2001).
- As enterotoxinas mais freqüentemente produzidas pelas cepas de
Staphylococcus sp. isoladas das amostras foram a SEB e SEC. As cepas de S. aureus foram produtoras de enterotoxinas A, B, C e D e toxina TSST-1, enquanto que as cepas de Staphylococcus coagulase-negativa produziram as enterotoxinas B, C, D e toxina TSST-1.