Dissertação para atribuição do Grau de Mestre em Bioquímica
Sara Daniela Cerqueira Ramos
Orientadores:
Carlos Manuel Marques Palmeira Dario Loureiro dos Santos
Universidade de Trás-os-Montes e Alto Douro
Dissertação para atribuição do Grau de Mestre em Bioquímica
Sara Daniela Cerqueira Ramos
Orientadores:
Carlos Palmeira:
Dario Loureiro dos Santos:
Composição do júri:
______________________________________________________________________ ______________________________________________________________________ ______________________________________________________________________
“As doutrinas expostas no presente trabalho, são da exclusiva responsabilidade do autor.”
Todo o trabalho desenvolvido durante este ano só foi possível graças ao apoio de muitas pessoas. Pela colaboração, seja a nível profissional ou emocional, agradeço:
- Ao professor Doutor Carlos Palmeira, que aceitou orientar a minha tese de mestrado, por toda a amizade, paciência, disponibilidade e ajuda dada.
- Ao professor Doutor Dario por ter aberto a porta para Coimbra e por ter tornado tudo isto possível.
- À Ana Varela, por todo o tempo perdido comigo e por tudo o que me ensinou. Pela forma como aceitou ser tanto a minha “chefe” como minha “partner” no laboratório, por toda a dedicação, paciência, apoio, amizade e confiança. Por me ter acolhido tanto no laboratório como em Coimbra.
- À Anabela, pelo tempo perdido comigo, tal como pela amizade, paciência e ajuda dada.
- Ao MitoLab e a todos os MitoCientistas, em particular ao Filipe, ao João, à Luana, ao Daniel e á Inês, com quem aprendi muito, mas com quem também passei bons momentos.
- Aos meus pais e ao meu maninho, pela motivação, pelo apoio e pelo amor que sempre me deram. Tal como a toda a família, principalmente à minha avó, á Livita, à Tita e ao Gito. Por serem um exemplo a seguir, por nunca me deixarem desistir e por me ensinarem a querer sempre mais.
- Ao meu avô, que mesmo já não estando cá, está mais presente do que nunca. - À Lau, por toda a força, apoio e amizade…Por estar sempre lá, mesmo quando as gargalhadas e os planos risonhos eram trocados por alturas de desespero e muita ansiedade, mesmo que às vezes tivesse de ser á distância de um telemóvel. Muito obrigada por fazeres parte da minha vida!
- À Irina e à Helena, por tudo o que passamos, pela presença quando a distância física aumentou, pela amizade, pela força, pelos concelhos científicos, nos bons e maus momentos e que a distância não separou.
- Ao Élio, por todo o amor, força, apoio e principalmente por toda a paciência. -A todos os que me acolheram nesta eterna cidade de estudantes, principalmente à Sílvia e ao João Rito.
- A Coimbra que tem ainda mais encanto na hora da despedida…
- A Vila Real e a todos os que marcaram de certa forma a minha passagem por lá.
- A todos os meus amigos em geral, aos mais presentes e aos mais ausentes, que sabem que tem um lugarzinho especial no meu coração.
- E a todos aqueles que de algum modo contribuíram para este trabalho, aqui fica a minha gratidão.
A mitocôndria desempenha um papel chave na bioenergética celular, sendo o principal local de síntese de ATP. Participa na regulação de vários aspectos biológicos celulares, como na morte celular, no estado redox, na promoção da homeostase do cálcio e na apoptose.
Os terpenóides são amplamente encontrados na natureza e constituem uma grande variedade de substâncias vegetais. São classificados de acordo com o número de carbonos, em que o geraniol e o mirtenol são monoterpenóides e fitol é um diterpenóide. Os monoterpenos são os principais componentes dos óleos essenciais, enquanto os outros terpenos são componentes de bálsamos, resinas, ceras e borrachas. São hidrofóbicos e actuam na membrana dos organismos, podendo provocar alterações nesta e até mesmo lise celular. Os diterpenos possuem funções antioxidantes, anti carcinogénicas, anti-inflamatórias e anti bactericidas.
Testou-se o fitol (25µM, 50µM, 100µM e 250µM), o geraniol (25µM, 50µM e 100µM) e o mirtenol (25µM, 50µM e 100µM) em mitocôndrias hepáticas isoladas de ratos e na linha celular HepG2 com o intuito de se ver se a estas concentrações os compostos possuíam toxicidade.
Avaliou-se a nível mitocondrial, o potencial transmembranar através de um eléctrodo de TPP+, o consumo de oxigénio, a indução da MPT com Ca2+, a medição de fluxos de Ca2+, a quantificação de citocromo c através do Western blott e a produção de espécies reactivas de oxigénio. A nível celular avaliou-se o crescimento celular através do uso de Sulfarrodamina B, a viabilidade celular através do uso do MTT e a produção de espécies reactivas oxigénio.
Relativamente ao fitol, nas concentrações usadas e quando comparadas com o controlo, só o estado 4 apareceu sempre ligeiramente aumentado. Apresentou um efeito protector na indução da MPT e não induziu a produção de ROS pelas mitocôndrias isoladas e pela cultura celular HepG2. Não apresentou efeito na viabilidade e na morte celular.
Quanto ao geraniol, nas concentrações usadas e quando comparadas com o controlo, as concentrações 50 µM e 100 µM induziram uma ligeira diminuição tanto no potencial inicial, como na repolarização. Contrariamente ao estado 4 e à V oligomicina em
µM e 50 µM mantiveram o conteúdo citocromo c mitocondrial enquanto que a 100 µM induziu a abertura da MPT. Tanto a nível mitocondrial, como celular houve um aumento da produção de ROS. Relativamente ao MTT, o resultado corroborou directamente com o resultado obtido no ensaio da Sulfarrodamina B, uma maior morte celular levou a que houvessem menos células activas e consequentemente uma menor viabilidade celular.
Relativamente ao mirtenol, nas concentrações usadas e quando comparadas com o controlo, a concentração 50 µM induziu uma ligeira diminuição na repolarização. Contrariamente ao estado 4 e à V oligomicina que se apresentaram aumentados em todas as
concentrações. As concentrações 25 µM e 50 µM do mirtenol, mantiveram o conteúdo citocromo c mitocondrial enquanto que a 100 µM induziu a abertura da MPT. Tanto a nível mitocondrial, como celular houve um aumento da produção de ROS. Relativamente ao MTT, o resultado corroborou directamente com o resultado obtido no ensaio da Sulfarrodamina B, uma maior morte celular levou a que houvessem menos células activas e consequentemente uma menor viabilidade celular.
Conclui-se assim que os compostos geraniol e mirtenol possuem actividade hepatotóxica e que estes efeitos tóxicos são revelados não apenas a nível celular, mas também a nível mitocondrial.
Mitochondria play a key role in cellular bioenergetics, being the main ATP production source in the cell. Mitochondria also take part in the regulation of several biological processes, such as metabolism, redox status, calcium homeostasis and cell death/apoptosis induction.
Terpenoid compounds are widely spread in the nature and can be found in a great diversity of vegetal species. They are categorized according to carbon number: geraniol and myrtenol are monoterpenoids, and phytol is a diterpenoid. Monoterpens are the main components present in essential oils, while other terpens are found in balsams, resins, waxes and rubbers. Monoterpens are hydrophobic molecules that act on the membrane, thus being able to induce alterations, which can even lead to cell lysis. Diterpens have some antioxidant, anticarcinogenic, inflammatory and anti-bactericidal actions.
In this work we have tested phytol (25µM, 50µM, 100µM and 250µM), geraniol (25µM, 50µM and 100µM) e o myrtenol (25µM, 50µM and 100µM), evaluating their effects on isolated mitochondria from rat liver and on HepG2 cell line. The purpose was to explore putative toxicity of the compounds towards hepatic mitochondria/cells.
At the mitochondrial level several parameters were evaluated, such as mitochondrial transmembrane potential (using a TPP+ electrode), oxygen consumption, MPT induction, calcium fluxes, cytochrome c release (using Western Blot) and ROS production. At the cellular level, we evaluated cell proliferation (using SrB method), cell viability (using MTT method) and ROS production.
Regarding the compound phytol, for the concentrations tested and when compared with the control, only the mitochondrial respiratory state 4 appears slightly increased. It showed a protective effect towards the induction of the MPT and it did not induced ROS production on isolated mitochondria or HepG2 cell culture. It also had no visible effects on the cell viability and cell death.
Concerning the compound geraniol, for the concentrations tested and when compared with the control, the concentrations 50µM and 100µM induced a slight decrease in the initial mitochondrial membrane potential and also in repolarization. Regarding mitochondrial respiration, both the respiratory state 4 and Voligomycin showed
µM maintained mitochondrial cytochrome c content, whereas the 100µM induced opening of MPT and consequent cytochrome c release. Both in isolated mitochondria and cell culture there was an increased production of ROS. Additionally, the MTT results were in agreement with the results of SrB assays, both methods indicating higher cell dead after incubation with the compound.
As far as the myrtenol compound is concerned, for the concentrations tested and when compared with the control, the concentration 50 µM induced a slight decrease in mitochondrial repolarization potential. On the other hand, both the respiratory state 4 and Voligomycin exhibit an increase with all concentrations of the test compound. The
concentrations 25 µM and 50 µM maintained mitochondrial cytochrome c content, whereas the 100µM was able to induce the opening of MPT. The ROS production rate was also increased, in isolated mitochondria and cell culture as well. Relatively to the MTT assay, the results are in agreement with the results of SrB experiments, both assays showing that myrtenol action elicited a decrease in cell viability and increased cytotoxicity effects.
We can conclude that geranyol and myrtenol has hepatotoxic activity and these effects are revealed not only in mitochondria but in the cells too.
... I ... III ... V ... 1 1.1 Fígado ... 1 1.1.1 Anatomia hepática ... 1 1.1.2 Funções hepáticas ... 2 1.2 Mitocôndria ... 5 1.2.1 Estrutura Mitocondrial ... 7
1.2.2 Cadeia respiratória e fosforilação oxidativa ... 9
1.2.3 Modelos da cadeia respiratória mitocondrial ... 12
1.2.4 Teoria quimiosmótica ... 12
1.2.5 Produção de espécies reactivas de oxigénio (ROS) e consequente stresse oxidativo ... 15
1.2.6 Defesas antioxidantes ... 17
1.2.7 O papel da mitocôndria na homeostasia do cálcio ... 18
1.2.8 Permeabilidade transitória mitocondrial (MPT) ... 20
1.2.9 Regulação da permeabilidade mitocondrial ... 20
1.2.10 Composição molecular do poro de permeabilidade mitocondrial ... 22
1.2.11 Morte celular ... 24 1.2.12 Necrose ... 26 1.2.13 Apoptose... 26 1.2.14 Necroapoptose ... 28 1.3 Compostos semi-sintéticos ... 28 1.3.1 Fitol ... 31 1.3.2 Geraniol ... 33 1.3.3Mirtenol ... 36 1.4 Objectivos ... 37 ... 41 2.1 Animais ... 41 2.2 Materiais ... 41 2.3 Mitocôndrias ... 41
2.3.1 Homogeneização do fígado de rato e isolamento de mitocôndrias ... 41
2.3.2 Determinação da concentração de proteína ... 42
2.3.3 Medição do potencial transmembranar mitocondrial ... 43
2.3.5 Detecção da indução da permeabilidade transitória mitocondrial (MPT) ... 45
2.3.5 Determinação de fluxos mitocondriais de Ca2+ utilizando a sonda Cálcium-green ... 47
2.3.6 Avaliação da produção de espécies reactivas de oxigénio (ROS) ... 48
2.4 Células ... 49
2.4.1 Cultura de células ... 49
2.4.2 Tratamentos ... 49
2.4.3 Ensaios com Sulfarrodamina B ... 50
2.4.4 Ensaios com MTT ... 51
2.4.5 Ensaios de determinação de espécies reactivas de oxigénio (ROS)... 52
2.5 Análise Western Blott ... 53
2.6 Análise estatística ... 54
3.1 Mitocôndrias ... 57
3.1.1 Potencial transmembranar mitocondrial... 57
3.1.2 Medição do consumo de oxigénio pelas mitocôndrias... 59
3.1.3 Detecção da indução da permeabilidade transitória mitocondrial (MPT) ... 63
3.1.4 Determinação de fluxos mitocondriais de Ca2+ utilizando a sonda de Cálcium-green ... 66
3.1.5 Análise por Western Blott ... 70
3.1.6 Avaliação da produção de espécies reactivas de oxigénio (ROS) ... 72
3.2 Células ... 74
3.2.1 Determinação da proliferação celular utilizando Sulfarrodamina (SFR) ... 74
3.2.2 Determinação da viabilidade celular utilizando MTT... 75
3.2.3 Ensaios de determinação de espécies reactivas de oxigénio (ROS)... 76
... 79 4.1 Fitol ... 79 4.2 Geraniol ... 81 4.3 Mirtenol ... 86 ... 93 ... 97
Figura 1- Anatomia hepática ... 2
Figura 2- Visualização de mitocôndrias através de microscopia electrónica (A) e de fluorescência (B)... 6
Figura 3- Representação esquemática da cadeia transportadora de electrões e do complexo F1F0 ATPsintase. ... 9
Figura 4- Representação esquemática das consequências da produção de espécies reactivas de oxigénio na mitocôndria. ... 15
Figura 5- Esquematização dos sistemas de transporte de Ca2+ na mitocôndria. ... 19
Figura 6- Esquema representativo da mitocôndria na regulação do processo de morte celular. ... 25
Figura 7- Representação da estrutura química do fitol. ... 31
Figura 8- Representação da estrutura química do geraniol ... 34
Figura 9- Representação da estrutura química do mirtenol ... 36
Figura 10- Placas usadas no ensaio da Sulfarrodamina B depois de coradas e secas. ... 51
Figura 11- Placas usadas no ensaio do MTT, a primeira depois do acréscimo imediato de MTT e a segunda 3 horas depois da incubação. ... 52
Figura 12- Registo tipo de um potencial transmembranar mitocondrial. ... 57
Figura 13- Susceptibilidade à indução da MPT nas mitocôndrias incubadas, durante três minutos, com as diferentes concentrações de fitol, com DMSO e com CyA. ... 64
Figura 14- Susceptibilidade à indução da MPT nas mitocôndrias incubadas, durante 3 minutos, com as diferentes concentrações de geraniol, com DMSO e com CyA. ... 65
Figura 15- Susceptibilidade à indução da MPT nas mitocôndrias incubadas, durante 3 minutos, com as diferentes concentrações de mirtenol, com DMSO e com CyA. ... 66
Figura 16- Efeitos do fitol nos fluxos de cálcio mitocondriais. ... 67
Figura 17- Efeitos do fitol nos fluxos de cálcio mitocondriais. ... 68
Figura 18- Efeitos do mirtenol nos fluxos de cálcio mitocondriais. ... 69
Figura 19- Avaliação e quantificação de citocromo c nas preparações recolhidas após incubação com o fitol. ... 70
Figura 20- Avaliação e quantificação de citocromo c nas preparações recolhidas após incubação com o geraniol. ... 71
Figura 21- Avaliação e quantificação de citocromo c nas preparações recolhidas após incubação com o mirtenol. ... 71
Figura 22- Efeitos do fitol na produção de ROS pelas mitocôndrias hepáticas. ... 72 Figura 23- Efeitos do geraniol na produção de ROS pelas mitocôndrias hepáticas. ... 72 Figura 24- Efeitos do mirtenol na produção de ROS pelas mitocôndrias hepáticas. ... 73 Figura 25- Medição da proliferação celular das células HepG2 expostas durante 24 horas a várias concentrações dos compostos testados (fitol, geraniol e mirtenol). ... 74 Figura 26- Medição da actividade das células HepG2 através das desidrogenases mitocondriais expostas durante 24 horas a várias concentrações dos compostos testados (fitol, geraniol e mirtenol). ... 75 Figura 27- Efeitos do fitol na produção de ROS pela cultura celular HepG2 em condições de stresse oxidativo.. ... 76
Tabela 1- Descrição das funções hepáticas. ... 5
Tabela 2- Ensaio tipo usado na indução da MPT com o fitol ... 46
Tabela 3- Ensaio tipo usado na indução da MPT com o geraniol ... 46
Tabela 4- Ensaio tipo usado na indução da MPT com o mirtenol ... 47
Tabela 5- Ensaio tipo usado na determinação de fluxos mitocondriais de Ca2+ utilizando a sonda de Cálcium-green. ... 48
Tabela 6- Potencial transmembranar das mitocôndrias incubadas na presença de diferentes concentrações de fitol. ... 58
Tabela 7- Potencial transmembranar das mitocôndrias incubadas na presença de diferentes concentrações de geraniol. ... 58
Tabela 8 - Potencial transmembranar das mitocôndrias incubadas na presença de diferentes concentrações de mirtenol. ... 59
Tabela 9- Efeito do fitol nos vários parâmetros respiratórios mitocondriais. ... 60
Tabela 10- Efeito do Geraniol nos vários parâmetros respiratórios mitocondriais. ... 61
T4 - Tiroxina T3 - Triiodotironina
IGF1 - Insulin Growth Factor-1
NADPH - Fosfato de dinucleótido de nicotinamida e adenina ATP - Adenosina trisfosfato
mtADN - Acido desoxirribonucleico mitocondrial ADN - Acido desoxirribonucleico
VDAC - Canal aniónico dependente da voltagem
TIM/TOM - Transportador da membrana interna/externa ANT - Translocador de nucleótidos de adenina
ATP - Adenosinatrifosfato
UCP - Proteínas desacopladoras mitocondriais NADH - Dinucleótido de nicotinamida e adenina ROS - Espécies reactivas de oxigénio
MPP+ - Neurotoxina 1-metil-4-fenilpiridina ADP - Adenosina difosfato
Q - Ubiquinona QH - Semiubiquinona
IF1 - Inibidor da subunidade 1
OSCP - Proteína sensível á Oligomicina DCCD - N,N’-diciclohexilcarbodimida RNS - Espécies reactivas de Nitrogénio
MPT - Permeabilidade transitória mitocondrial ΔpH - Gradiente pH
Δp - Força protomotriz
ΔΨ - Potencial transmembranar
ΔG - Variação negativa da energia livre Mn-SOD - Manganês Superóxido Dismutase OH - Radical Hidroxilo
O - Oxigénio singlete
GPX - Glutationa Peroxidase O2- - Superóxido GSSG - Glutationa Oxidada GSH - Glutationa RE - Reticulo endoplasmático RS - Reticulo sarcoplasmático
UCM - Uniporte de cálcio mitocondrial RaM - Transporte de cálcio de forma rápida Pi - Fosfato mitocondrial
CypD - Ciclofilina D CyA - Ciclosporina A
BPR - Receptor periférico benzodiazepino HKII - Hexoquinase II
AIF - Factor da indução da apoptose IAP - Inibidor da apoptose
TNFα - Factor de necrose tumoral DMBA - 7,12-dimetilben[a]antraceno LDH - Lactato desidrogenase
FCCP - Flurocarbonil-cianeto fenilhidrazona ICR - Indice de controlo respiratório
URF - Unidades relativas de fluorescência SFR – Sulfarrodamina
H2DCF-DA – 2’,7’-diclorodidrofluorescin diacetato
AA - Antimicina
TPP+ - Ião Tetrafenilfosfonium
1.1 Fígado
O fígado é o principal órgão onde várias substâncias químicas exógenas são metabolizadas para seguidamente serem excretadas (via sistema urinário e/ou digestivo). Como consequência, as várias células do fígado estão expostas a concentrações significativas destes compostos químicos que pode resultar a curto, médio ou longo prazo, disfunção hepática, variadas lesões hepatocelulares e até mesmo falência hepática. Os efeitos adversos no fígado são uma das principais razões citadas para a interrupção do processo associado ao desenvolvimento de novos medicamentos (Casarett and Doul's, 2008).
1.1.1 Anatomia hepática
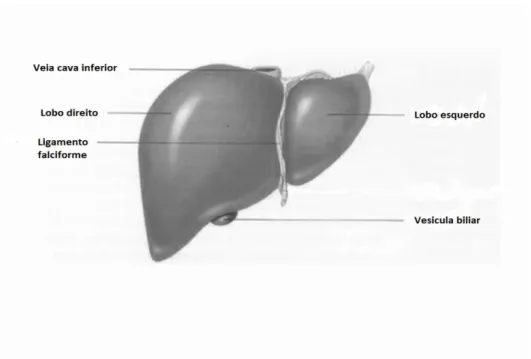
O fígado (Figura 1) é o maior órgão interno do corpo e pesa num adulto em média 1,36 Kg (Tortora and Derrickson, 2008; Seeley et al., 2003; Motta, 2003). Está localizado no quadrante superior direito do abdómen, apoiado contra a face inferior do diafragma (Motta, 2003), e é constituído por dois lobos principais, o esquerdo e o direito (maior do que o esquerdo), e por dois lobos menores, o caudado e o quadrado (Seeley et al., 2003), que são considerados por muitos anatomistas pertencentes ao lobo direito, porém devido à sua morfologia interna (distribuição primária das veias sanguíneas) é mais adequado dizer que pertencem ao lobo esquerdo (Tortora and Derrickson, 2008). É revestido por uma cápsula de tecido conjuntivo e por peritoneu visceral (Tortora and Derrickson, 2008), excepto numa pequena área rodeada por um ligamento coronário, na face diafragmática, na qual não existe peritoneu, a dita área descoberta (Seeley et al., 2003).
Encontra-se associado ao sistema digestivo e recebe um suprimento sanguíneo duplo, cerca de 20% do seu fluxo é rico em O2 e provém da artéria hepática, enquanto o
restante 80% é rico em nutrientes e provém da veia porta (Nunes and Moreira, 2007). A veia porta faz chegar ao fígado o sangue enriquecido em nutrientes, com excepção de lípidos que seguem inicialmente no sistema linfático, absorvidos ao nível do intestino, e
só depois desta travessia hepática o sangue se dirige para os restantes órgãos (Motta, 2003).
O fígado possui uma estrutura anatómica única e uma vasta rede vascular. Os hepatócitos estão em contacto directo com a circulação sanguínea, enquanto que os canalículos biliares se reúnem para formar os ductos que irão transportar as secreções biliares para o intestino delgado provenientes dos hepatócitos, funcionando assim como um sistema de escoamento (Motta, 2003).
Figura 1- Anatomia hepática (Seeley et al., 2003)
O fígado é rico em células hepáticas, sendo que as principais células existentes são os hepatócitos (Cingolani and Housay, 2000), as células dos sinusóides hepáticos, as células endoteliais, as células de Kupffer (Schinoni, 2006) e células estreladas ou de “Ito” (Wake, 1980).
1.1.2 Funções hepáticas
O fígado tem como principais funções:
- Metabolismo, conjugação e excreção de diversos compostos, o fígado metaboliza uma grande variedade de compostos, não só endógenos, como por exemplo os sais biliares, bilirrubina e hormonas, mas também exógenos, como por exemplo
medicamentos e toxinas. Os hepatócitos captam estas substâncias plasmáticas através de vários transportadores e canais existentes na membrana basolateral. Fazem o processamento destas substâncias, que inclui o transporte e modificação química intracelular através de várias enzimas e por fim ocorre a secreção de substâncias. Esta secreção pode ser através de excreção, isto é, secreção através da membrana apical para a bílis, mas também pode ser secreção para o plasma sendo a substância reutilizada ou excretada por outras vias, como a via renal(Nunes and Moreira, 2007).
- Produção de bílis, cerca de 600 a 1000 ml por dia. Embora esta não contenha enzimas digestivas, desempenha um papel na digestão diluindo e neutralizando o ácido gástrico e emulsionando as gorduras. Contém ainda produtos de excreção, pigmentos biliares, como por exemplo a bilirrubina que resulta da degradação da hemoglobina e contém também colesterol, gorduras, hormonas lipossolúveis e lecitina (Seeley et al., 2003; Motta, 2003).
- Armazenamento, os hepatócitos retêm variadas substâncias do sangue que passam no fígado através da veia porta. Armazenam glicose sob a forma de glicogénio, gorduras, vitaminas (A, B12, D, E e K), cobre e ferro. Quando necessário são
recolocados em circulação. Este armazenamento é geralmente temporário, tal como a quantidade de produtos retidos pelos hepatócitos (Seeley et al., 2003; Schinoni, 2006; Motta, 2003).
- Regulação do metabolismo de nutrientes, é o órgão responsável pela regulação dos níveis energéticos do organismo, tendo um papel essencial em manter o nível plasmático constante da glicose. Responsável pelos metabolismos dos hidratos de carbono, das proteínas e dos lípidos (Schinoni, 2006; Nunes and Moreira, 2007; Motta, 2003).
- Função endócrina, apesar de o fígado não ser considerado um órgão do sistema endócrino tem a capacidade de converter importantes hormonas e vitaminas numa forma mais activa. Destaca-se a hidroxilação inicial da vitamina D, a desiodinização da tiroxina (T4) em triiodotironina (T3) e a síntese de hormonas de crescimento (IGF-1) produzidas na hipófise. Para além disso, tem também um papel importante na degradação de diversas hormonas (Schinoni, 2006; Nunes and Moreira, 2007).
- Desintoxicação, o fígado é uma das primeiras linhas de defesa contra várias substâncias tóxicas para o nosso organismo. Isto pode acontecer através da alteração da sua estrutura, tornando assim a substância menos tóxica e/ou mais fácil de eliminar.
Estas substâncias podem ser eliminadas através da urina ou através da bílis (Seeley et al., 2003; Schinoni, 2006).
- Fagocitose, as células fagocitárias hepáticas (células de Kupffer) estão localizadas ao longo da parede dos sinusóides hepáticos. Fagocitam hemácias e leucócitos em fim de vida ou danificados, bactérias, endotoxinas e outros detritos que possam entrar no fígado através da circulação (Seeley et al., 2003; Nunes and Moreira, 2007; Schinoni, 2006).
- Metabolização de fármacos e posterior excreção, enquanto alguns medicamentos são inactivados pela acção hepática, outros são activados ou convertidos a produtos tóxicos pela transformação hepática. Geralmente são metabolizadas no fígado nos retículos endoplasmáticos lisos dos hepatócitos, em duas fases: I e II. A fase I é uma oxidação catalisada por citocromo P-450, citocromo b5 e NADPH (fosfato de dinucleótido de nicotinamida e adenina) citocromo c redutase (Schinoni, 2006). As reacções importantes da fase II são a conjugação com a glutationa, com o glucuronato e com o sulfato. Após estas reacções as substâncias tornam-se mais solúveis e menos tóxicas e são excretadas pelos rins ou eliminadas directamente pela bílis (Schinoni, 2006; Nunes and Moreira, 2007; Motta, 2003).
- Síntese, muitas das proteínas séricas sanguíneas como a albumina, transportadores de hormonas, heparina, alguns factores da coagulação e fibrinolíticos, o fibrinogénio, factores de crescimento, citocromo P-450, lipoproteínas e as globulinas, são produzidos no fígado e libertados para a circulação sanguínea. É capaz também de sintetizar todos os aminoácidos não essenciais e outros peptídeos de menor tamanho dos quais se destaca a 5-glutationa (um tripeptídeo). Cerca de 90% da glutationa plasmática tem origem no fígado sendo crítica na protecção contra o stress oxidativo em múltiplos órgãos (Seeley et al., 2003; Schinoni, 2006; Nunes and Moreira, 2007).
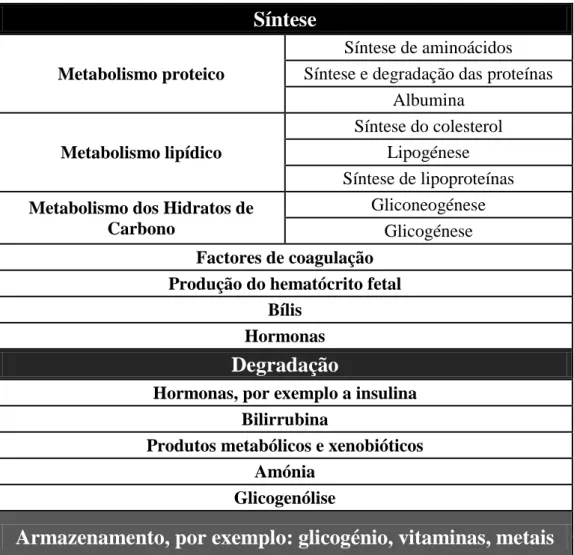
Tabela 1- Descrição das funções hepáticas (Casarett and Doul's, 2008).
Síntese
Metabolismo proteico
Síntese de aminoácidos Síntese e degradação das proteínas
Albumina Metabolismo lipídico
Síntese do colesterol Lipogénese Síntese de lipoproteínas Metabolismo dos Hidratos de
Carbono
Gliconeogénese Glicogénese Factores de coagulação
Produção do hematócrito fetal Bílis
Hormonas
Degradação
Hormonas, por exemplo a insulina Bilirrubina
Produtos metabólicos e xenobióticos Amónia
Glicogenólise
Armazenamento, por exemplo: glicogénio, vitaminas, metais
Actividade Imunitária (sistema reticuloendotelial)
1.2 Mitocôndria
A mitocôndria (Figura 2) é um organelo com dimensões de 1x2 µm, encontrando-se em grande número, em média 2000 por célula, representando aproximadamente 25 % do volume celular (Koolman and Roehm, 2005) e estão mais concentradas perto do reticulo endoplasmático (Collins et al., 2002). A mitocôndria desempenha um papel chave na bioenergética celular, sendo o principal local de síntese de ATP (adenosina trifosfato) (Koolman and Roehm, 2005). Além disso participa na regulação de vários aspectos biológicos das células, tais como na morte celular (Schapira, 2012), estado redox, promoção da homeostase do cálcio, desenvolvimento de
precondicionamento isquémico e não isquémico e na apoptose (Monteiro et al., 2003). A mitocôndria, também pode funcionar como um reservatório de cálcio intracelular e desempenha também um papel importante na morte celular programada, que está directamente relacionada com os reservatórios de cálcio (Koolman & Roehm, 2005). Possuem também um genoma reduzido que codifica algumas das proteínas essenciais ao seu funcionamento; cada mitocôndria tem várias cópias de ácido desoxirribonucleico mitocondrial (mtADN) e cada cópia é constituída por uma só hélice de 16 569 nucleótidos, os quais codificam 13 proteínas (das quais 7 pertencem ao complexo I) (Monteiro et al., 2003).
São descendentes das primeiras bactérias aeróbias e entraram em simbiose com eucariontes anaeróbios primordiais (Koolman and Roehm, 2005; Goodsell, 2010), o que permitiu a evolução de organismos multicelulares mais complexos capazes de realizar respiração aeróbia, estando assim evolutivamente na origem das primeiras células eucarióticas (Nicholls and Fergunson, 2002). Esta teoria endossimbiótica é apoiada por vários factos. Como por exemplo, as mitocôndrias têm um ADN (ácido desoxirribonucleico) circular (quatro moléculas por mitocôndria) e têm os seus próprios ribossomas; o genoma mitocondrial tem vindo a diminuir no decurso da evolução; o envelope mitocondrial que consiste em duas membranas também suporta a teoria endossimbiótica (Koolman and Roehm, 2005). A membrana externa representa a membrana plasmática original do hospedeiro eucarionte invaginada enquanto que a interna, derivada dos antigos organismos simbiontes, tem uma estrutura e composição química semelhante aos procariotas (Câmara and Guerra, 2008), contém o lípido cardiolipina invulgar, mas praticamente nenhum colesterol (Koolman and Roehm, 2005).
Com o passar dos anos a ideia de que as mitocôndrias participavam de um modo solitário nas células trabalhando unicamente para produção da energia necessária tem vindo a mudar. Avanços na genética e biologia celular forneceram informações valiosas sobre a função das mitocôndrias e a contribuição anómala do metabolismo mitocondrial para doenças humanas (Schapira, 2012).
1.2.1 Estrutura Mitocondrial
Geralmente as mitocôndrias são descritas de acordo com a sua forma oval e alongadas (Koolman and Roehm, 2005), porém a sua forma, tamanho e número variam de célula para célula e consoante o tecido, mas mantendo sempre as suas propriedades básicas (Scheffler, 2008; Koolman and Roehm, 2005). A sua forma reflecte os diferentes estados metabólicos das células, desde as estruturas tubulares no fígado até às multiramificações no tecido muscular (Schatz, 1995). O músculo cardíaco, que é um tecido com um intenso metabolismo oxidativo, possui mitocôndrias com um grande número de cristas mitocondriais. Possuem um sistema de dupla membrana, uma externa e outra interna. A externa separa a mitocôndria do citosol e a interna forma invaginações para o espaço matricial que são as chamadas cristas mitocondriais. O espaço intermembranar está localizado entre as duas membranas e a matriz mitocondrial encontra-se delimitada pela membrana interna (Koolman and Roehm, 2005).
As duas membranas que compõem a mitocôndria são diferentes tanto na composição como na função. A membrana externa é composta por lípidos e proteínas, na proporção aproximada de 1:1 (Câmara and Guerra, 2008), é permeável a pequenas moléculas (<10 kDa) o que possibilita trocas entre o citoplasma e o espaço intermembranar (Koolman and Roehm, 2005). O canal aniónico dependente da voltagem (VDAC) é a proteína mais abundante da membrana mitocondrial externa (Rostovtseva et al., 2005; Harris and Thompson, 2000). Existem ainda complexos formados por várias subunidades proteicas, características de ambas as membranas – complexo TIM/TOM (transportador da membrana interna/transportador da membrana externa), que permitem o transporte de peptídeos para o interior das mitocôndrias (Paschen and Neupert, 2001).
A membrana interna é impermeável, mesmo a moléculas pequenas (com a excepção de O2, CO2, H2O e NH3) (Koolman and Roehm, 2005) e é composta por 20%
de lípidos e 80% de proteínas (Câmara and Guerra, 2008). Assim, qualquer movimento de solutos é rigorosamente controlado e permitido apenas através das proteínas da membrana, canais altamente selectivos e regulados. Algumas proteínas estão livremente ligadas à superfície da membrana e outras estão inseridas como uma parte integrante da membrana. Possuí diversos elementos de várias vias metabólicas, como componentes da cadeia transportadora de electrões, o complexo ATPsintase (Hatefi, 1985), os transportadores de ácidos di- e tricarboxílicos, os sistemas de transporte e oxidação de ácidos gordos, a piruvato desidrogenase, o transportador de fosfato, o translocador de nucleótidos de adenina (ANT) e as proteínas desacopladoras mitocondriais (UCP) (Caldwell et al., 2004). Tal como se referiu anteriormente, tem na sua constituição o fosfolípido cardiolipina (difosfatidilglicerol), importante na função mitocondrial, dado que este fosfolípido aniónico confere fluidez e estabilidade á membrana interna mitocondrial (Ott et al., 2007). Além disso, a sua presença é importante para o bom funcionamento de várias proteínas mitocondriais, como o complexo IV (citocromo-c-oxidase) (Hoch, 1992; Paradies et al., 1998; Scheffler, 2008; Ott et al., 2007).
A membrana interna desempenha também um papel importante na fosforilação oxidativa. Como é impermeável a protões, a cadeia respiratória que bombeia protões a partir da matriz para dentro do espaço intermembranar através dos complexos I, III, e IV estabelece um gradiente de protões através da membrana interna, na qual a energia libertada durante a oxidação do NADH (dinucleótido de nicotinamida e adenina) é conservada. O ATPsíntase usa a energia armazenada no gradiente para formar ATP a partir de ADP e fosfato inorgânico. Muitos dos sistemas de transporte são dependentes do gradiente de protões (Koolman and Roehm, 2005).
As cristas mitocôndrias não são simples invaginações da membrana interna, mas estruturas independentes que nem sempre estão conectadas com a membrana interna. O tamanho e a sua área de contacto varia, sendo maior nos tecidos com grande actividade respiratória (Frey and Mannella, 2000). Também a organização e forma das cristas se altera, bem como a densidade matricial, dependendo das variações nos conteúdos em proteínas, ácidos nucleícos e lípidos (Schatz, 1995).
Na matriz mitocondrial encontram-se as enzimas responsáveis pelo metabolismo de aminoácidos, do ciclo dos ácidos tricarboxílicos ou ciclo de Krebs, ciclo da ureia e
2010). É também na matriz que se encontram as múltiplas cópias do mtDNA, tornando assim as mitocôndrias os únicos organitos de células animais com capacidade de se auto replicarem (Anderson, 1981). Mutações no mtDNA podem interromper ou afectar de alguma forma a bioenergética mitocondrial, resultando numa possível disfunção e/ou morte celular (Smeitink et al., 2001). No entanto, a maioria das proteínas mitocondriais são codificadas pelo genoma nuclear (Wallace, 1994).
1.2.2 Cadeia respiratória e fosforilação oxidativa
Nas células eucarióticas, a mitocôndria é responsável por, aproximadamente, 90% da produção de energia celular (Câmara and Guerra, 2008), associada à oxidação de hidratos de carbono, lípidos e aminoácidos, a qual ocorre através da fosforilação oxidativa na membrana interna mitocondrial (Koolman and Roehm, 2005).
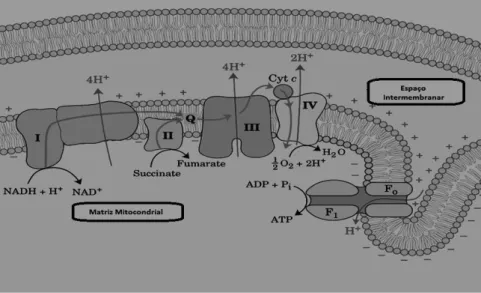
A cadeia respiratória mitocondrial (Figura 3) transfere electrões (e-) através de um intervalo de potencial redox de 1,1 V do NAD+/NADH para o O2/2H20, originando
uma reacção exergónica (Koolman and Roehm, 2005). A transferência de e- nas proteínas constituintes dos complexos respiratórios é reversível e para catalisar ambas as reacções (em ambos os sentidos), é necessário que os componentes redox operem em condições onde as formas oxidada e reduzida existam em concentrações apreciáveis (Nicholls and Fergunson, 2002).
Figura 3- Representação esquemática da cadeia transportadora de electrões e do complexo F1F0
ATPsintase.
A cadeia respiratória é responsável pela ejecção vectorial de protões da matriz para o espaço intermembranar, na sequência da transferência de e- dos equivalentes de redução para o oxigénio
molecular. Os protões ejectados através dos Complexos I, III e IV da cadeia respiratória são utilizados pela ATPsintase ou Complexo V para a síntese de ATP (Nelson and Cox, 2000).
A cadeia transportadora de e- possui cinco complexos formados por diferentes proteínas (quatro complexos respiratórios e o F1F0-ATPsintase) (Monteiro et al., 2003),
o citocromo c (proteína extrínseca de pequenas dimensões) e a coenzima Q10 (ou
ubiquinona, uma quinona hidrofóbica) (Goodsell, 2010; Nicholls and Fergunson, 2002; Scheffler, 2008). Os quatro complexos são:
- Complexo I ou NADH: ubiquinona oxiredutase. É constituido por 41 polipéptidos diferentes, sendo capaz de oxidar o NADH. Transporta contragradiente protões para o exterior da mitocôndria e contribui directamente para o gradiente electroquímico de protões. É inibido por neurotoxina 1-metil-4-fenilpiridina (MPP+), pela rotenona e pelo óxido nítrico.
- Complexo II ou Succinato desidrogenase. É formado por quatro proteínas, catalisa a oxidação do succinato em fumarato, com a formação de ubiquinol a partir da ubiquinona e é inibido por ácido 3-nitropropiónico, malonato e óxido nítrico.
- Complexo III ou Ubiquinol: citocromo c oxiredutase. Tem na sua constituição onze proteínas e através do ubiquinol, e ao mesmo tempo que um protão é bombeado para o exterior, um electrão é transferido para o citocromo c. É inibido pela antimicina.
- Complexo IV ou citocromo c oxidase. Este complexo reduz o O2 a água e
utiliza a energia produzida para transportar contragradiente para o exterior da mitocôndria. É inibido pelo cianeto e monóxido de carbono (Monteiro et al., 2003; Koolman and Roehm, 2005; Nicholls and Fergunson, 2002).
O ATP é produzido pelo F1F0-ATPsintase, também conhecido por complexo V
(Scheffler, 2008) que apesar de integrar o sistema da oxidação fosforilativa não faz parte da cadeia transportadora de electrões (Koolman and Roehm, 2005).
Os transportadores de electrões da cadeia respiratória são estruturas quinóides (flavinas (FAD/FMN), quinonas) e/ou centros metálicos (centros FeS, grupos heme e centros cúpricos) que proporcionam a transferência sequencial de e- para o oxigénio molecular (Nicholls and Fergunson, 2002; Goodsell, 2010; Scheffler, 2008; Koolman and Roehm, 2005), ocorrendo da seguinte forma: complexo I → ubiquinona → complexo III → citocromo c → complexo IV → oxigénio (O22). O Complexo I aceita e
-do NADH e transfere-os para a ubiquinona. O Complexo II reduz o succinato em fumarato, e os e- dessa reacção são transferidos para a ubiquinona membranar. Esta
molécula é reduzida a ubiquinol, molécula altamente móvel e hidrofóbica que vai ser então capaz de transferir e- para o Complexo III, passando novamente pelos estados QH (semi-ubiquinona) e Q10. Os e- fluem então para o Complexo III de onde são
transferidos para o citocromo c e deste para o Complexo IV. Aqui, são finalmente transferidos para o aceitador final, o O2 que, conjuntamente com protões origina o H2O
(Nicholls and Fergunson, 2002; Scheffler, 2008). Este fluxo de e- é possível devido ao facto de cada complexo e respectivos transportadores terem maior potencial “redox” do que o anterior. Assim, a ubiquinona tem maior afinidade para e- do que os Complexos I e II, o Complexo III tem maior afinidade para e- do que o ubiquinol, e assim sucessivamente.
A transferência sequencial de e- dos equivalentes de redução para o oxigénio molecular e consequente ejecção de protões, promove a criação de um gradiente electroquímico (Koolman and Roehm, 2005), formado por um gradiente de pH e um gradiente eléctrico, entre o espaço intermembranar e a matriz. Assim, há uma elevada concentração de protões no espaço intermembranar. Como a membrana interna é impermeável a protões, a dissipação do gradiente ocorre através da ATPsintase (Nicholls and Fergunson, 2002).
A ATPsintase é um complexo proteico formado por dois componentes, a F0 e a
F1 (Nicholls and Fergunson, 2002). A componente F0 é um segmento hidrofóbico que
atravessa a membrana interna mitocondrial, formando um canal protónico. A componente F1, consiste em 5 tipos de cadeias polipeptídicas e é responsável pela
fosforilação do ADP, sendo também capaz, em circunstâncias adversas para a mitocôndria, de hidrolisar ATP, de modo a tentar repor o gradiente protónico. Outras subunidades fazem parte da ATPsintase, nomeadamente a proteína reguladora do fluxo protónico e da síntese de ATP, denominada inibidor da subunidade F1 (IF1), proteína
sensivel à oligomicina (OSCP – oligomycin sensibility conferring protein) (Boyer, 1997; Boyer, 1998). Através deste complexo, os protões fluem para a matriz mitocondrial, graças à combinação de dois gradientes, o de concentração de protões e o do potencial eléctrico membranar (negativo no interior da mitocôndria) (Monteiro et al., 2003). A ATPsintase é inibida especificamente por oligomicina (Monteiro et al., 2003) e DCCD (N,N’-diciclohexilcarbodiimida) (Boyer, 1997; Boyer, 1998; Nicholls and Fergunson, 2002).
1.2.3 Modelos da cadeia respiratória mitocondrial
Foram propostos dois modelos relativos á organização da cadeia respiratória mitocondrial. O modelo “estado fluído” onde os complexos da oxidação fosforilativa difundem individualmente na membrana e a transferência de e- depende da colisão aleatória dos complexos dos e transportadores de electrões. E o modelo “estado sólido” onde os complexos juntos formam supercomplexos ou respirossomas (Dudkina et al., 2008; Schon and Dencher, 2009). Contudo, é a combinação dos dois modelos acima referidos que originam o modelo mais aceite actualmente. Trabalhos desenvolvidos por Acin-Perz e os seus colegas, com mitocôndrias de fígado de rato, mostraram que o complexo I é encontrado como uma entidade independente, podendo estar associada com o complexo III em diferentes supercomplexos (Acín-Pérez et al., 2008). Algumas destas associações contem a Coenzima Q10, o citocromo c e o complexo IV, com ou
sem o complexo II, mas conseguem realizar a respiração mitocondrial. Existem duas formas abundantes de supercomplexos I / III que diferem na sua massa molecular e não se associam ao complexo IV, mas podem interagir com o complexo V. O complexo III também geralmente é o que se encontra mais associado a outros complexos em mitocôndrias de fígado. A associação com o complexo I já foi anteriormente descrita, mas pode formar outras associações adicionais, como II/III/IV. (Acín-Pérez et al., 2008; Scheffler, 2008).
1.2.4 Teoria quimiosmótica
Peter Mitchell em 1961 propôs pela primeira vez a teoria quimiosmótica, interligando as reacções de oxidação de substratos pela cadeia respiratória e a fosforilação do ADP (Mitchell, 1961). Neste modelo, a função principal da cadeia respiratória é a ejecção vectorial de protões da matriz para o exterior, que seriam usados pela ATPsintase na síntese do ATP durante o refluxo de H+ para a matriz (Harris, 1995). A energia “acumulada” neste gradiente electroquímico de protões pode ser utilizada em outras funções mitocondriais, como o transporte iónico e a produção de calor (Scheffler, 2008).
O gradiente electroquímico de protões possui dois componentes: - gradiente de pH (ΔpH, com pH alcalino na matriz);
- gradiente eléctrico (ΔΨ, negativo no interior da mitocôndria) (Matsuyama and Reed, 2000).
O movimento de protões, do espaço intermembranar para a matriz, está associado a uma variação negativa da energia livre (ΔG). Esta variação tem o mesmo valor do gradiente electroquímico de protões (ΔμH+
). Assim:
ΔG = ΔμH+ = nFΔΨ + 2,3RTlog ([H+]d/[H+]f)
F é a constante de Faraday, n é o número de equivalentes (1), R é a constante dos gases perfeitos, T é a temperatura absoluta (ºK) e [H+]d e [H+]f são as concentrações de
protões dentro e fora da mitocôndria, respectivamente. Assim, uma análise à equação permite perceber que ΔμH+ é definida como a diferença do potencial electroquímico de
protões entre o interior e o exterior da mitocôndria. Esta equação pode assumir uma forma mais simples, considerando que pH = - log[H+]
ΔG = ΔμH+ = nFΔΨ + 2,3RT(pHf-pHd)
ou ainda
ΔG = ΔμH+ = nFΔΨ – 2,3RTΔpH
em que
ΔpH = pHd-pHf
Esta expressão, embora traduza uma variação da energia livre do sistema (expressa em Joules (J) ou calorias (cal)) é escrita geralmente sob a forma de uma diferença de potencial eléctrico, sendo por isso expressa em unidades de potencial (volts (V)):
ΔμH+ /nF = ΔΨ – (2,3RT/F)ΔpH
À temperatura de 25ºC, o factor 2,3RT/F tem o valor de 59 mV, pelo que a equação anterior é definida por (em mV):
ΔμH+ /nF = ΔΨ – 59ΔpH
O quociente ΔμH+/F designa-se por força protomotriz (Δp):
Δp = ΔμH+/nF
Apesar de ΔμH+ traduzir uma variação da energia do sistema e de Δp se referir a
uma variação do potencial eléctrico (sendo essa a razão pela qual ΔμH+ se expressa em J
ou cal e Δp em V), ambos se referem à mesma grandeza, a força responsável pelo fluxo de protões para o interior da mitocôndria.
O gradiente eléctrico, ΔΨ, também designado por potencial transmembranar, traduz a diferença de carga eléctrica entre o exterior e o interior da mitocôndria. O potencial é negativo no interior devido à ejecção protónica produzida pela cadeia respiratória.
A fosforilação oxidativa pode ser dividida em três subsistemas da força protomotriz:
- a cadeia respiratória, geradora da força protomotriz, resultado da ejecção vectorial de protões para o espaço intermembranar;
- o sistema fosforilativo, que inclui a ATPsintase, o transportador de fosfato e o transportador de nucleótidos de adenina, envolvidos na fosforilação do ADP a ATP. Este subsistema utiliza Δp para sintetizar ATP mediante o refluxo de H+ para a matriz através da ATPsintase;
- o “leak” a protões, que se pode considerar a permeabilidade passiva da membrana mitocondrial interna a protões. Desta forma, há refluxo de protões para a matriz mitocondrial, (diminuindo Δp) mas não associado à fosforilação de ADP.
A força protomotriz usada pela ATPsintase durante a fosforilação oxidativa é dissipada com o aumento da permeabilidade da membrana interna mitocondrial a protões.
1.2.5 Produção de espécies reactivas de oxigénio (ROS) e consequente stresse oxidativo
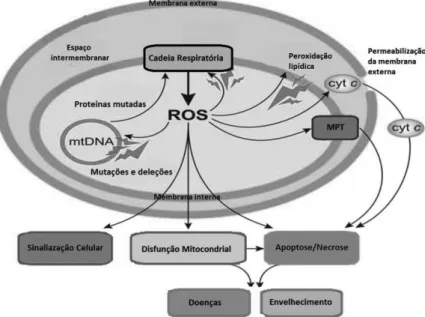
A manutenção do equilíbrio entre a produção de radicais livres e as defesas antioxidantes (enzimas e moléculas não enzimáticas) é uma condição essencial para o funcionamento normal do organismo. Quando a produção de radicais livres aumenta perante as defesas antioxidantes, dizemos que o organismo está em stresse oxidativo, e nestas situações os radicais livres em excesso podem oxidar e danificar lípidos, proteínas e ácidos nucleicos (Distelmaier et al., 2011; Ferreira and Abreu, 2007), alterando a sua função normal e podendo conduzir a várias doenças (figura 4). Em organismos aeróbios, os radicais livres são constantemente produzidos durante o funcionamento normal da célula, na maior parte sob a forma de ROS e de nitrogénio (RNS) (Ferreira and Abreu, 2007).
Figura 4- Representação esquemática das consequências da produção de espécies reactivas de oxigénio
na mitocôndria.
A produção de ROS pela mitocôndria pode levar a danos oxidativos nas proteínas mitocondriais, membranas e mtDNA, prejudicando a capacidade da mitocôndria para sintetizar ATP e para levar a cabo as suas funções metabólicas. Pode também aumentar a permeabilização da membrana mitocondrial externa e induzir a libertação de proteínas específicas, como citocromo c, para o citosol, activando assim a maquinaria apoptótica da célula. Além disso, a produção de ROS mitocondrial aumenta a susceptibilidade à indução da permeabilidade transitória mitocondrial (MPT) (Murphy, 2009).
O stresse oxidativo pode ser causado devido a situações de exercício físico extremo e processos de inflamação, mas pode também ser causado pela presença de xenobióticos no organismo ou em situações relacionadas com várias doenças, entre as
quais, cancro, diabetes, cirrose, doenças cardiovasculares e desordens do foro neurológico. A sobreprodução de ROS tem sido inclusivamente relacionada com o processo de envelhecimento (Ferreira and Abreu, 2007).
As moléculas de oxigénio singlete (O), o superóxido (O2 • -), o peróxido de
hidrogénio (H2O2) e os radicais hidroxilo (• OH) são os diferentes tipos de ROS
formados (Scheffler, 2008). Estes produtos são originários do metabolismo normal, que actuam como mensageiros redox na sinalização e regulação intracelular (Distelmaier et al., 2011), permitindo a comunicação entre a mitocôndria e o citosol (Mittler et al., 2011; D’Autréaux and Toledano, 2007).
A mitocôndria é responsável pela maior parte da produção endógena de ROS (Câmara and Guerra, 2008; Scheffler, 2008; Cardoso et al., 2012; Ferreira and Abreu, 2007; Alfadda and Sallam, 2012), resultado de uma disfunção na cadeia respiratória mitocondrial (Distelmaier et al., 2011). Além do complexo IV, os complexos I e III, e mais recentemente o complexo II, têm sido implicados na geração de ROS (Scheffler, 2008). Por este motivo a mitocôndria é particularmente susceptível a danos oxidativos (Ferreira and Abreu, 2007). Os ROS não tem só origem na mitocôndria, o retículo endoplasmático e as membranas nucleares possuem cadeias transportadoras de electrões também (Alfadda and Sallam, 2012). Estes podem ser formados através da acção de vários sistemas enzimáticos existentes nas células (Ferreira and Abreu, 2007), como as flavoproteínas (Cardoso et al., 2012; Scheffler, 2008) e a peroxidação lipídica (Ferreira and Abreu, 2007). Os e- libertados da cadeia transportadora que não são totalmente reduzidos formam o superóxido, que por sua vez é convertido em H2O2 pela Mn-SOD
(manganês superóxido dismutase) na mitocôndria.
Tal como já foi referido, a produção de ROS pode ter varias consequências (Scheffler, 2008), dado que estes podem controlar a duração da vida da célula (Monteiro et al., 2003). No que toca à oxidação do mtADN pelos ROS, isto pode resultar em mutações que levarão à inibição da fosforilação oxidativa, aumento do leak de protões, com um consequente aumento de ROS e uma redução da produção de ATP. O mtADN é muito susceptível a lesões oxidativas, dado não possuir histonas, ter mecanismos de reparação pouco eficientes e estar espacialmente próximo da cadeia respiratória, local de produção dos ROS (Monteiro et al., 2003).
A produção de ROS também contribui directamente para o bem-estar do organismo, participando em mecanismos essenciais e protectores, como por exemplo,
na defesa imunitária, na acção antibacteriana e na sinalização e regulação celular (Alfadda and Sallam, 2012).
1.2.6 Defesas antioxidantes
A exposição dos organismos a radicais livres, conduziu ao desenvolvimento de mecanismos de defesa endógenos para os eliminar. Estas defesas são a resposta da evolução à inevitabilidade da existência de ROS em condições aeróbias (Ferreira and Abreu, 2007; Scheffler, 2008).
Alguns produtos naturais com actividade antioxidante, podem auxiliar o sistema protector endógeno, como por exemplo os antioxidantes presentes na dieta assumem grande importância como possíveis agentes protectores, reduzindo os danos oxidativos. Um dos exemplos destes antioxidantes envolvidos na nossa dieta são os fitoquímicos, compostos bioactivos provenientes de diferentes partes de plantas (sementes, cereais, vegetais, frutos, folhas, raízes, especiarias, ervas) que estão envolvidos na redução dos riscos de várias doenças, como por exemplo, do cancro (Ferreira and Abreu, 2007).
São necessários mecanismos antioxidantes que actuem na manutenção da função mitocondrial e celular, sendo os seguintes: remoção catalítica dos radicais livres; redução de radicais livres através de doadores de e-; um mecanismo quelante para iões metálicos pro-oxidantes e mecanismos de reparo (Cardoso et al., 2012). A mitocôndria possuí um sistema antioxidante habitualmente capaz de neutralizar eficientemente os ROS. Este sistema antioxidante enzimático é fundamentalmente constituído pela superóxido dismutase (SOD), pela glutationa peroxidase (GPX) e pela catalase, pertencentes a classe antioxidante enzimática (Ferreira and Abreu, 2007; Monteiro et al., 2003), A SOD converte o O2- em H2O2 e a GPX reduz o H2O2 a água, utilizando a
glutationa reduzida (GSH) como substrato, a qual é convertida em glutationa oxidada (GSSG) (Monteiro et al., 2003). Como defesas antioxidantes não enzimáticas destacam-se, entre muito, compostos como a glutationa o α-tocoferol (vitamina E), o ácido ascórbico (vitamina C), o ácido lipóico, os carotenóides e os flavonóides (Ferreira and Abreu, 2007).
1.2.7 O papel da mitocôndria na homeostasia do cálcio
O cálcio (Ca2+) intracelular é essencial tanto no bem-estar da célula como na ruptura da sua homeostasia, que poderá levar a várias doenças (Scheffler, 2008).
As concentrações de Ca2+ diferem da membrana plasmática para o retículo endoplasmático/sarcoplasmático (RE/RS) (Parekh, 2003). As concentrações de Ca2+ no citosol e na matriz mitocondrial determinam a absorção do Ca2+ pela mitocôndria. Quando as concentrações de Ca2+ fora da mitocôndria são elevadas (devido a um armazenamento de cálcio intracelular pelos canais de cálcio da membrana plasmática), a mitocôndria acumula os níveis de Ca2+ em excesso.
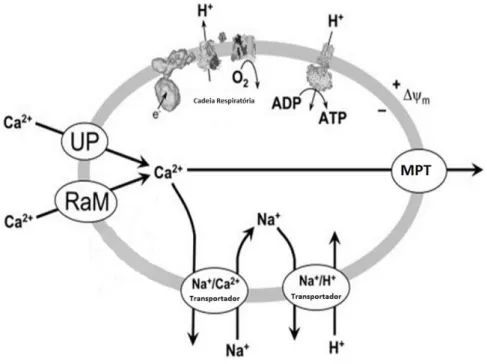
O aumento fisiológico mitocondrial de Ca2+ actua como sinal na regulação da actividade mitocondrial, activando as enzimas intramitocondriais envolvidas no metabolismo energético, sendo que uma das principais funções do transporte mitocondrial de Ca2+ é aumentar a produção de NADH. A absorção de Ca2+ pela mitocôndria estimula a actividade do ciclo de Krebs e a fosforilação oxidativa, e assim, a síntese de ATP (Balaban, 2009; Scheffler, 2008). O transporte de Ca2+ para a mitocôndria ocorre através de canais iónicos, existentes na membrana interna mitocondrial (Ryu et al., 2010b) (Figura 5).
O uniporte de Ca2+ mitocondrial (UCM) (Scheffler, 2008; Pizzo et al., 2012) é um complexo proteico formado por um canal e uma subunidade reguladora. O UCM permite o transporte de Ca2+ através do estabelecimento do gradiente electroquímico para a matriz mitocondrial e sem recorrer á hidrólise de ATP ou ao cotransporte através de uma outra molécula ou ião (Gunter and Pfeiffer, 1990). O uniporte de Ca2+ é regulado por uma série de moduladores, sendo que o vermelho de ruténio funciona como inibidor especifico (Noack and Greeff, 1971) enquanto que o fosfato inorgânico facilita o transporte do Ca2+ (Rossi et al., 1973).
Outro mecanismo responsável pela entrada de cálcio na mitocôndria é conhecido por via de transporte de cálcio de forma rápida (RaM) (Rizzuto et al., 1993). A condutividade de Ca2+ é muito mais rápida através de RaM do que através do sistema uniporte. Em concentrações altas de Ca2+ extra mitocondrial, a captação do cálcio é mediada por ambos os sistemas, RaM e UCM, porém, o UCM não procede ao transporte do cálcio quando a sua concentração é inferior á sua entrada (Sparagna et al., 1995). O RaM também é inibido pelo vermelho de ruténio (mas de forma menos
Figura 5- Esquematização dos sistemas de transporte de Ca2+ na mitocôndria.
Os mecanismos de influxo de cálcio por uniporte ou pelo modo rápido de captura (RaM), através de transportadores de Na+/Ca2+ e do poro da permeabilidade transitória mitocondrial (Brookes et al., 2004).
Existem outras proteínas transportadoras de Ca2+, como por exemplo, o receptor de rianodina (mRyR) (Beutner et al., 2001), as proteínas desacopladoras UCP2 e UCP3 (Trenker et al., 2007; Pizzo et al., 2012) e por fim os canais de cálcio mitocondriais dependentes da voltagem e altamente selectivos (Michels et al., 2009).
O efluxo de cálcio da mitocôndria ocorre através de duas vias distintas: a dependente (Gunter and Pfeiffer, 1990) e a independente de sódio (Puskin et al., 1976). Ambos os sistemas têm cinéticas diferentes, mas os dois necessitam de energia, uma vez que o efluxo de cálcio ocorre contra o gradiente electroquímico. A saída de cálcio da mitocôndria através do antiporte (Pizzo et al., 2012) dependente de sódio é abundante em tecidos como o coração e ocorre na estequiometria de 3Na+:1Ca2+. O mecanismo independente de sódio (H+/Ca2+ uniporte) encontra-se no fígado e consiste na saída de um ião cálcio em troca de dois protões, esta via é extremamente lenta (Gunter et al., 1994).
O equilíbrio entre o influxo de Ca2+ e o efluxo através da membrana mitocondrial interna estabelece a homeostase do Ca2+ mitocondrial. O transportador mitocondrial Na+/ Ca2+ serve normalmente como um importante mecanismo de efluxo de Ca2+, mas a abertura transitória do poro representa um outro mecanismo importante
para a libertação do Ca2+ a partir das mitocôndrias em condições fisiológicas (Pizzo et al., 2012). Quando o Ca2+ citosólico aumenta, a mitocôndria aumenta a sua captação, funcionando como um sistema tamponizante de Ca2+, tentando garantir a manutenção das concentrações citosólicas de Ca2+. Esta capacidade tamponizante é limitada, dado que um aumento do Ca2+ matricial induz a formação de “poros”, os quais atravessam as membranas mitocondriais interna e externa, com dissipação do potencial eléctrico mitocondrial e perda de citocromo c para o citosol (Monteiro et al., 2003).
1.2.8 Permeabilidade transitória mitocondrial (MPT)
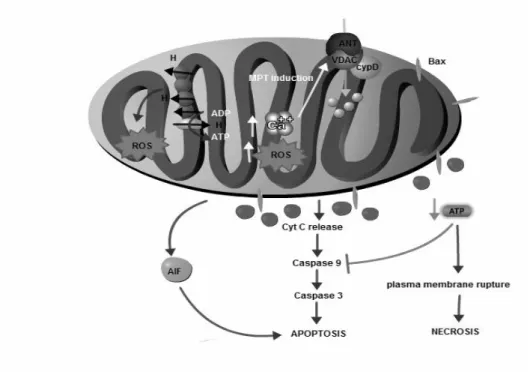
A permeabilidade transitória mitocondrial é definida com um aumento não selectivo da permeabilidade na membrana mitocondrial interna a solutos com massa molecular até 1500 Da, originado um poro não específico. Resulta na perda do potencial de membrana da mitocôndria, swelling mitocondrial e ruptura da membrana externa mitocondrial (Juhaszova et al., 2008; Scheffler, 2008; Lisa and Bernardi, 2009; Lemasters et al., 2009).
Em condições de sobrecarga mitocondrial de cálcio, especialmente quando acompanhados por stresse oxidativo, concentrações elevadas de fosfato e de depleção de nucleótidos de adenina, ocorre a indução da MPT (Scheffler, 2008; Lisa and Bernardi, 2009) e quando o poro se encontra completamente aberto o seu diâmetro é cerca de 3 nm (Lisa and Bernardi, 2009). Isto leva a um aumento do volume da matriz mitocondrial, devido à entrada da água para o interior das mitocôndrias, resultando num aumento do volume mitocondrial associado á despolarização da membrana e desacoplamento da mitocôndria, libertação de cálcio e desdobramento das cristas mitocôndrias na membrana interna (Bernardi, 1999; Crompton et al., 1999), tal como a perda de citocromo c e de nucleótidos de piridina. Isto vai contribuir para a ruptura da membrana mitocondrial externa e para uma produção em grande escala de ROS (Lisa and Bernardi, 2009).
1.2.9 Regulação da permeabilidade mitocondrial
MPT é difícil de determinar, uma vez que a concentração necessária é altamente variável consoante os tecidos e é influenciada por vários factores que modificam com a acumulação de Ca2+, tais como o Pi (fosfato mitocondrial) e o pH da matriz (Scheffler, 2008).
As concentrações crescentes de Pi diminuem o Ca2+ presente na matriz, o que deveria diminuir a probabilidade de indução da MPT, mas por outro lado, a acumulação mitocondrial de Pi aumenta a capacidade de captação de Ca2+, contrariando a alcalinização da matriz estabelecida pela extrusão do H+ em resposta á entrada do Ca2+ na matriz. Assim, o elevado gradiente electroquímico de Ca2+ existente na membrana interna da mitocôndria favorece a acumulação na matriz tanto de Ca2+ como Pi. Portanto, Pi é geralmente referido como um indutor da MPT, devido ao tamponamento do pH da matriz, uma vez que a transição é inibida na matriz com um pH inferior a 7,0. A probabilidade de abertura da MPT decresce acentuadamente abaixo deste valor de pH devido à redução reversível dos resíduos de histidina e que podem ser bloqueados pelo dietilpirocarbonato (Bernardi, 1992; Lisa and Bernardi, 2009). A regulação da MPT através dos resíduos de histidina não está localizada na ciclofilina D (CypD), um possível componente da MPT, dado que a modulação da MPT pelo pH da matriz não é afectada pela eliminação da CypD (Basso et al., 2005; Lisa and Bernardi, 2009).
A indução da MPT é favorecida pela despolarização mitocondrial (Bernardi, 1992; Lisa and Bernardi, 2009). A dependência do ΔΨ também pode ser relacionada com os processos redox, e especialmente com o stresse oxidativo. Os agentes que promovem o estado de oxidação dos nucleótidos de piridina (Monteiro et al., 2003) e tiol são indutores da MPT. Por outro lado, os antioxidantes têm um papel preventivo (Petronilli et al., 1994). A susceptibilidade à indução da MPT pode ser aumentada pelas respostas celulares desencadeadas pelo aumento de Ca2+ intracelular, tais como a geração de ácido araquidónico através da fosfolipase A2 e a activação da calpaina (Penzo et al., 2004; Polster et al., 2005; Lisa et al., 2007). Assim, as condições e os xenobióticos que causam o stresse oxidativo, a diminuição dos nucleótidos de adenina, o aumento das concentrações de Pi, despolarização mitocondrial e produção de ROS na matriz vão promover a indução da MPT (Monteiro et al., 2003; Scheffler, 2008).
A principal consequência da indução do MPT é a morte celular, sendo esta uma das principais causas de morte das células relacionada com um serie de estados fisiopatológicos como por exemplo a isquemia/reperfusão, doenças neurodegenerativas e cardiovasculares, lesão cerebral traumática e toxicidade aos fármacos (Duarte et al.,
2013). A MPT está também associada a outros mecanismos de morte celular como a necrose e a apoptose através da libertação de factores apoptóticos (Monteiro et al., 2003; Lemasters et al., 2009).
1.2.10 Composição molecular do poro de permeabilidade mitocondrial
Embora a identidade molecular da MPT permaneça incerta, várias proteínas têm sido implicados quer na sua estrutura quer na sua regulação (Duarte et al., 2013). O modelo inicial para a MPT é baseado em estudos bioquímicos e farmacológicos e tinha três componentes: o canal aniónico dependente da voltagem (VDAC), presente na membrana externa (Harris and Thompson, 2000) e também conhecido por porina, um translocador de nucleótidos de adenina (ANT) presente na membrana interna, e a CypD presente na matriz (Monteiro et al., 2003; Scheffler, 2008; Juhaszova et al., 2008).
Apesar do VDAC (existem três isoformas, VDAC1,VDAC2, VDAC3) ter sido considerado um componente fundamental da MPT, os elementos comprovativos da sua participação são circunstanciais. O VDCA1 está em maioria em relação ao VDAC 2 e VDAC3, e facilita um eficiente transporte de ATP/ADP através da monocamada externa (Rostovtseva et al., 2005). Foi exposto que os inibidores e os anticorpos bloqueadores do VDAC podem impedir a MPT, mas a especificidade destes agentes mantem-se incerta (Cesura et al., 2003; Toth et al., 2006). Por outro lado, demonstrou-se que as mitocôndrias e as células sem as três isoformas VDAC mostraram uma abertura normal do MPT, demonstrando assim que o VDAC não é um componente essencial do MPT (Halestrap, 2005)
O translocador de nucleótidos de adenina (ANT) é a proteína mais abundante na mitocôndria. A família das ANT medeiam a troca de ATP e ADP através da membrana mitocondrial interna (o ATP da matriz para o citosol através da troca com uma molécula de ADP). Existem três isoformas da ANT: ANT-1, ANT-2 e ANT-3 (Fiore et al., 1998). ANT-1 é a proteína da membrana mitocondrial interna mais abundante. Algumas evidências sugerem que a ANT-1 ou ANT-3 é um componente da MTP (Yang et al., 2012). A função da ANT é funcionar como poro entre a conformação C e a M, em que os sítios de ligação do substrato estão do lado citosólico da membrana interna - conformação C - ou no lado da matriz – conformação M. A conformação C tende a mudar com a ligação de Ca2+ que induz a MPT, porém isto não se aplica na