UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
ESCOLA DE CIÊNCIAS AGRÁRIAS E VETERINÁRIASRelatório de Estágio
Casos Clínicos de Medicina e Cirurgia de Animais de Companhia
Dissertação de Mestrado Integrado em Medicina Veterinária
Ana Sequeira Gomes
Orientadora: Maria Isabel Ribeiro Dias, DVM, PhD
iii
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO
Relatório de Estágio
Casos Clínicos de Medicina e Cirurgia de Animais de Companhia
Dissertação de Mestrado Integrado em Medicina Veterinária
Ana Sequeira Gomes
Orientadora: Maria Isabel Ribeiro Dias, DVM, PhD
Composição do Júri:
Presidente: Maria da Conceição Medeiros Castro Fontes
Vogais:
Carlos Alberto Antunes Viegas
Maria Isabel Ribeiro Dias
v
Dedicatória
vii
Agradecimentos
À minha família e professores, em especial à Professora Isabel Dias, pela disponibilidade, apoio e compreensão.
ix
Resumo
No âmbito do 6º ano do Mestrado Integrado em Medicina Veterinária na Universidade de Trás-os-Montes e Alto Douro foi redigido o seguinte relatório, com base em cinco dos casos clínicos acompanhados durante o período de estágio curricular.
A primeira etapa de estágio consistiu em 9 semanas (Setembro – Novembro) de prática clínica num hospital de pequenos animais e exóticos - Panorama Veterinary Clinic & Specialist Centre – na Cidade do Cabo. Neste, foi possível acompanhar as variadas especialidades (cirurgia de tecidos moles, ortopedia, oncologia, cardiologia, neurologia, dermatologia, endocrinologia, etc), observando e colaborando nos respetivos procedimentos, durante as consultas, exames complementares, cirurgia, urgências, internamento geral, cuidados intensivos. É desta etapa do estágio que resultam os casos clínicos que constituem este relatório de estágio. A segunda componente de estágio consistiu em 13 semanas (Janeiro – Março) e foi realizada na área de análises clínicas e histopatologia no hospital escolar da Faculdade de Medicina Veterinária da Universidade Lusófona, em Lisboa, incidindo, essencialmente, na elaboração de diagnósticos com base na realização de análises clínicas, histopatologia e citologia.
Ao longo deste período foram proporcionadas várias oportunidades de aprendizagem, de desenvolvimento do raciocínio clínico, de trabalho em equipa e crescimento enquanto profissional. Um trabalho que nunca deve ser dado como terminado, procurando manter sempre um espírito crítico, curioso e de aprendizagem constantes.
Palavras-chave: cão, gato, cardiologia, oncologia, nefrologia, gastroenterologia, endocrinologia, derrame pleural, cardiomiopatia hipertrófica, tumores de pele, mastocitoma, insuficiência renal crónica, complexo dilatação-torção gástrico, necropsia, Diabetes mellitus, cetoacidose
xi
Abstract
Under the 6th year of the Integrated Masters in Veterinary Medicine at the Trás-os-Montes and Alto Douro University this report was written, based on five on the clinical cases followed during the time of internship.
The first phase of internship entailed 9 weeks (September-November) of clinical practice in a small animal and exotics hospital – Panorama Veterinary Clinic & Specialist Centre – at Cape Town. During this time it was possible to follow the several specialties (soft tissue surgery, orthopedics, oncology, cardiology, neurology, dermatology, endocrinology, etc), observing and collaborating on the procedures involved, during consultations, laboratory tests, surgery, emergencies, general internment, intensive care. During this phase of internship data was collected for the five clinical cases represented in this report. The second phase of internship consisted in 13 weeks (January-March) and it was conducted in the field of clinical analysis and histopathology in the teaching hospital of the Veterinary Medicine Faculty of the Lusófona University in Lisbon, focusing, essentially, on performing diagnoses based on clinical analysis, histopathology and cytology.
Throughout this period several opportunities were provided for learning, improvement of clinical reasoning, teamwork and growth as a professional. A job that should never be given as finished, always maintaining a critical spirit, curious and of constant learning.
Keywords: dog, cat, cardiology, oncology, nephrology, gastroenterology, endocrinology, pleural effusion, hypertrophic cardiomyopathy, skin tumors, mast cell tumor, chronic kidney disease, gastric dilation-torsion complex, necropsy, Diabetes mellitus, ketoacidosis
xiii
Índice
Dedicatória……….v Agradecimentos………...vii Resumo………xix Abstract………...xi Índice………...xiiiÍndice de figuras, tabelas, esquemas e gráficos………xv
Abreviaturas, siglas e símbolos……….xix
Casos clínicos Caso clínico nº1 – Cardiologia: Cardiomiopatia hipertrófica……….1
Caso clínico nº2 – Oncologia: Mastocitoma……….23
Caso clínico nº3 – Nefrologia: Insuficiência renal crónica………...45
Caso clínico nº4 – Gastroenterologia: Complexo dilatação-torção gástrico……….71
Caso clínico nº5 – Endocrinologia: Cetoacidose diabética………...93
Referências Bibliográficas Caso clínico nº1……….19 Caso clínico nº2……….41 Caso clínico nº3……….65 Caso clínico nº4……….88 Caso clínico nº5………...113 Anexo I………125 Anexos Anexo I - Tabelas com valores/intervalos de referência……….119
xv
Índice de figuras, tabelas, esquemas e gráficos
Índice de figuras
Caso clínico nº1 – Fig.1 – Sparkles, posição ortopneica... 15
Caso clínico nº1 – Fig.2 – Mucosas cianóticas, pálidas, húmidas ... 15
Caso clínico nº1 – Fig.3 – Radiografia torácica, vista latero-lateral (em decúbito direito) ... 15
Caso clínico nº1 – Fig.4 – Líquido pleural ... 15
Caso clínico nº1 – Fig.5 – Citologia líquido pleural; observação de linfócitos (setas) ... 15
Caso clínico nº1 – Fig.6 – Citologia líquido pleural; observação de neutrófilo hipersegmentado (seta) e macrófago (cabeça seta) ... 16
Caso clínico nº1 – Fig.7 – Citologia líquido pleural; observação de eritrócitos (setas)... 16
Caso clínico nº1 – Fig.8 – Esquema a demonstrar o mecanismo do MAS da válvula mitral para o TSVE ... 16
Caso clínico nº1 – Fig.9 – Ecocardiograma em modo B, plano longitudinal: evidenciação de regurgitação na válvula mitral, num gato com CMH, registado com efeito de Doppler a cores ... 16
Caso clínico nº1 – Fig.10 – Técnica de toracocentese, utilizando uma torneira de três vias ... 16
Caso clínico nº1 – Fig.11 – Radiografia torácica: herniação diafragmática de ansas intestinais ... 16
Caso clínico nº1 – Fig.12 – Sparkles no dia 16/11/2014, antes de ter alta... 18
Caso clínico nº1 – Fig.13 – Ecocardiograma em modo B, plano transversal: contraste espontâneo em AE dilatado, num gato com CMH ... 18
Caso clínico nº1 – Fig.14 – Ecocardiograma em modo B, plano longitunial: contraste espontâneo em AE dilatado, num gato com CMH ... 18
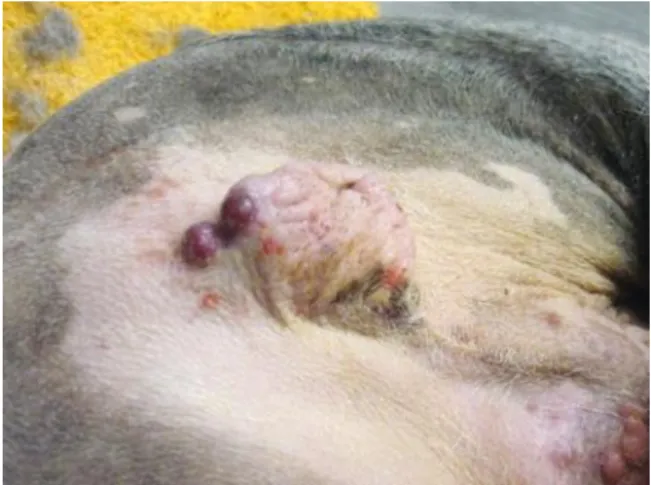
Caso clínico nº2 – Fig.1 – Massa na região inguinal esquerda ... 36
Caso clínico nº2 – Fig.2 – Nódulos na porção posterior do escroto ... 36
Caso clínico nº2 – Fig.3 – Citologia de PAAF de mastocitoma na região prepucial de um canídeo. Mastócitos com quantidade de grânulos citoplasmáticos variável, moderada anisocitose, anisocariose e pleomorfismo ... 36
Caso clínico nº2 – Fig.4 – PAAF do linfonodo inguinal direito ... 37
Caso clínico nº2 – Fig.5 – Marcação de aproximadamente 2cm de margem em relação à massa principal ... 37
xvi
Caso clínico nº2 – Fig.7 – Incisão longitudinal na porção proximal do pénis, até à uretra ... 37
Caso clínico nº2 – Fig.8 – Ligação do pénis, sua amputação e remoção da massa ... 37
Caso clínico nº2 – Fig.9 – Sutura da túnica albugínea, com pontos simples e interrompidos . 37 Caso clínico nº2 – Fig.10 – Esquematização de amputação peniana e uretrostomia ... 38
Caso clínico nº2 – Fig.11 – Realização de pontos de aproximação (técnica: longe-perto-perto-longe) ... 38
Caso clínico nº2 – Fig.12 – Incisões de relaxamento para alívio da tensão nos tecidos ... 38
Caso clínico nº2 – Fig.13 – Local de uretrostomia ... 38
Caso clínico nº2 – Fig.14 – Zibadee no pós-cirúrgico, com o colar isabelino ... 38
Caso clínico nº2 – Fig.15 – Nódulo na região torácica esquerda ... 38
Caso clínico nº2 – Fig.16 – Lipoma ... 39
Caso clínico nº2 – Fig.17 – Peça enviada para histopatologia ... 39
Caso clínico nº3 – Fig.1 – Sparky no dia da consulta ... 61
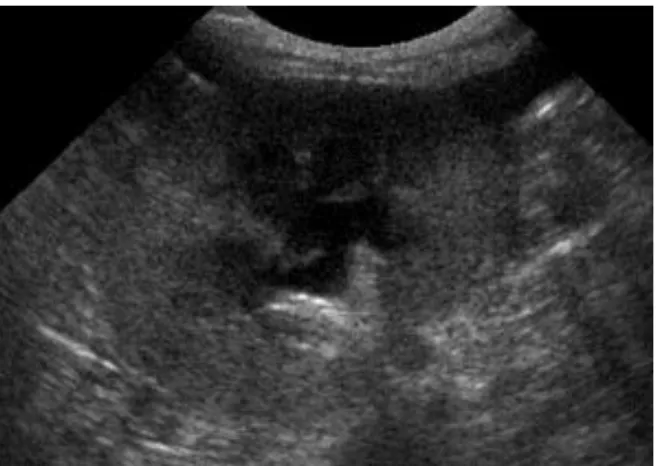
Caso clínico nº3 – Fig.2 – Ecografia em modo B: rim em corte sagital, com pobre diferenciação corticomedular (mas de contornos regulares) ... 61
Caso clínico nº3 – Fig.3 – Ecografia em modo B: rim em corte sagital, diferenciação corticomedular quase ausente, de menor dimensão, com bordos irregulares ... 64
Caso clínico nº4 – Fig.1 – Radiografia abdominal, vista latero-lateral (em decúbito direito) . 85 Caso clínico nº4 – Fig.2 – Gastropexia incisional... 85
Caso clínico nº4 – Fig.3 – Estômago (curvatura maior) ... 85
Caso clínico nº4 – Fig.4 – Baço (contração) ... 85
Caso clínico nº4 – Fig.5 – Intestino delgado e omento ... 85
Caso clínico nº4 – Fig.6 – Cavidade torácica (hidrotórax) ... 85
Caso clínico nº4 – Fig.7 – Massa mediastínica (conteúdo) ... 86
Caso clínico nº4 – Fig.8 – Estrutura viscosa ... 86
Caso clínico nº4 – Fig.9 – Líquido do derrame pleural ... 86
Caso clínico nº4 – Fig.10 – Esfregaço: quilotórax, cão ... 86
Caso clínico nº4 – Fig.11 – Torção gástrica, mediante graus de rotação ... 86
Caso clínico nº5 – Fig.1 – Clovis no dia de admissão no hospital ... 108
Caso clínico nº5 – Fig.2 – Radiografia torácica, em decúbito lateral direito ... 108
Caso clínico nº5 – Fig.3 – Radiografia toraco-abdominal, dorsoventral ... 108
xvii
Caso clínico nº5 – Fig.5 – Clovis na tarde de 23/10/2014 ... 108
Caso clínico nº5 – Fig.4 – Clovis no dia 04/11/2014, na sua primeira consulta de acompanhamento ... 111
Índice de tabelas Caso clínico nº1 – Tabela 1 – Classificação do tipo de derrame pleural com base na cor/transparência, densidade específica, PT, contagem celular e tipo de células predominantes ... 17
Caso clínico nº1 – Tabela 2 – Características das causas frequentes de derrame pleural no gato ... 17
Caso clínico nº1 – Tabela 3 – Resumo de estudos publicados sobre gatos com presença de derrame pleural, demonstrando as principais etiologias ... 18
Caso clínico nº2 – Tabela 1 – Mastocitomas: Estadiamento clínico – WHO ... 36
Caso clínico nº2 – Tabela 2 – Classificação histopatológica de mastocitomas ... 39
Caso clínico nº2 – Tabela 3 – Citologia de linfonodo e sua interpretação para prever probabilidade de metastização em mastocitoma ... 40
Caso clínico nº3 – Tabela 1 – Estadiamento da IRC em gatos, mediante o valor da creatinina sanguínea ... 61
Caso clínico nº3 – Tabela 2 – Fatores de risco associados ao desenvolvimento de IRC ... 62
Caso clínico nº3 – Tabela 3 – Sub-estadiamento da IRC: UP:C em gatos ... 62
Caso clínico nº3 – Tabela 4 – Sub-estadiameto da IRC: avaliação da pressão sanguínea ... 62
Caso clínico nº3 – Tabela 5 – Maneio de IRC em gatos (baseado em evidências) ... 63
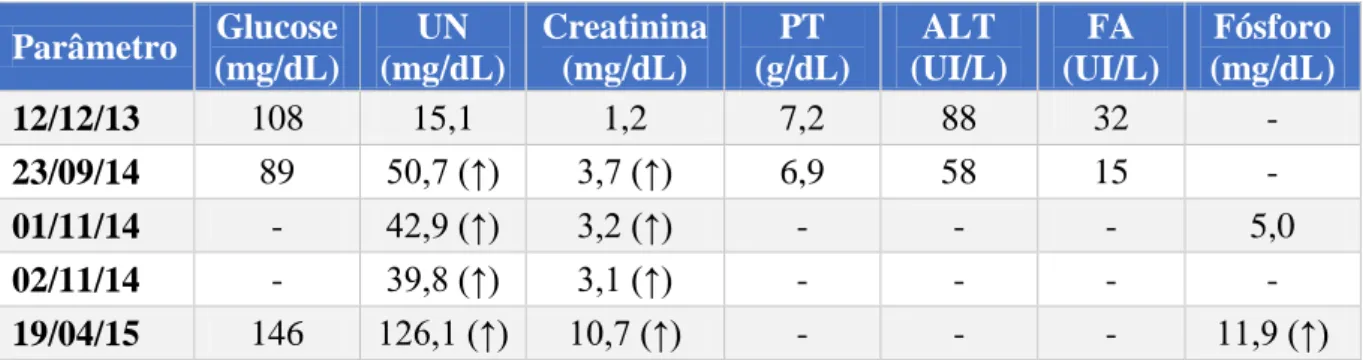
Caso clínico nº3 – Tabela 6 – Historial de análises de bioquímica sérica do Sparky ... 64
Caso clínico nº3 – Tabela 7 – Recomendações dos níveis de P para gatos com IRC, mediante ... 64
Caso clínico nº5 – Tabela 1 – Caracterização dos diferentes tipos de DM mediante etiologia, com base em humanos, frequentemente considerados para classificação da DM em gatos ... 109
Caso clínico nº5 – Tabela 2 – Guia de abordagem terapêutica, por etapas, para a CAD em pequenos animais ... 110
Caso clínico nº5 – Tabela 3 – Valores da medição da glucose da consulta de acompanhamento da Clovis do dia 09/01/2015 ... 112
xviii
Anexo I – Tabela 1 – Sistema de pontuação da condição corporal para canídeos ... 121 Anexo I – Tabela 2 – Sistema de pontuação da condição corporal para gatos ... 122 Anexo I – Tabela 3 – Intervalos de referência de constantes vitais ... 123 Anexo I – Tabela 4 – Classificação da % de hidratação com base em dados obtidos no exame
físico ... 123 Anexo I – Tabela 5 – Intervalos de referência para parâmetros hematológicos ... 123 Anexo I – Tabela 6 – Intervalos de referência com variados parâmetros para gatos ... 124 Anexo I – Tabela 7 – Intervalos de referência para gatos em ecocardiografia em modo M .. 124
Índice de esquemas
Caso clínico nº2 – Esquema 1 – Algoritmo de decisão para mastocitomas ... 40 Caso clínico nº4 – Esquema 1 – Hipótese explicativa do desenvolvimento do CDTG ... 87 Caso clínico nº4 – Esquema 2 – Potenciais consequências que podem derivar de um episódio
de CDTG ... 87 Caso clínico nº5 – Esquema 1 – Síntese esquemática com os principais intervenientes no
desenvolvimento de Cetoacidose Diabética (CAD) ... 109
Índice de gráficos
Caso clínico nº3 – Gráfico 1 – Registo da evolução das medições da creatinina, P e UN, desde a data de diagnóstico ... 64 Caso clínico nº5 – Gráfico 1 – Resumo da evolução da Clovis ao longo do período de
hospitalização, com curva de glucose (medida a partir de capilar no pavilhão auricular), momentos de administração de terapia, alimentação e primeira análise de urina com glucose e CC’s negativos ... 111 Caso clínico nº5 – Gráfico 2 – Curva de glucose da consulta de acompanhamento da Clovis,
xix
Abreviaturas, siglas e símbolos
ACVIM – American College of Veterinary Internal Medicine
AE – Átrio esquerdo
AGL’s – Ácidos gordos livres
AINE – Anti-inflamatório não esteroide ALB – Albumina
ALT – Alanina transaminase Ao – Aorta
ATP – Adenosina trifosfato
BID – Bis in die (2 vezes por dia / 12h em 12h)
bpm – Batimentos por minuto Ca – Cálcio
CAD – Cetoacidose diabética CC – Condição corporal CC’s – Corpos cetónicos CDTG – Complexo dilatação-torção gástrico CE – Corpo estranho CHCM – Concentração de hemoglobina corpuscular média CMD – Cardiomiopatia dilatada CMH – Cardiomiopatia hipertrófica
CMHE – Cardiomiopatia hipertrófica esquerda
CO2 – Dióxido de carbono
DIVE – Dimensão interna ventricular esquerda DM – Diabetes mellitus DU – Densidade urinária FA – Fosfatase alcalina FC – Frequência cardíaca Fe – Ferro FE – Fração de encurtamento
FeLV – Feline leukemia virus (vírus da leucemia felina)
FIV – Feline immunodeficiency virus (vírus da imunodeficiência felina)
FR – Frequência respiratória GGT – Gama-glutamil transferase GI – Gastrointestinal
HCM – Hemoglobina corpuscular média IC – Insuficiência cardíaca
ICC – Insuficiência cardíaca congestiva ICD – Insuficiência cardíaca direita
ICCE – Insuficiência cardíaca congestiva esquerda
ICCD – Insuficiência cardíaca congestiva direita
ID – Intestino delgado
IECA – Inibidor da enzima conversora da angiotensina
IM – Via intramuscular IR – Insuficiência renal
IRA – Insuficiência renal aguda IRC – Insuficiência renal crónica
IRIS – International Renal Interest Society IV – Via intravenosa
K – Potássio
MAS – Movimento anterior sistólico Mg – Magnésio
xx
MP – Membro pélvico
MPA – Medicação pré-anestésica Na – Sódio
NaCl – Cloreto de sódio OsmE – Osmolalidade efetiva
OsmT – Osmolalidade total
P – Fósforo
PA – Princípio ativo
PAAF – Punção aspirativa por agulha fina PAS – Pressão arterial sistólica
PD – Polidipsia
PIF – Peritonite infeciosa felina PLVE – Parede livre do ventrículo esquerdo
PO – Per os (via oral) PS – Pressão sanguínea PT – Proteínas totais
PTH – Parathyroid hormone (hormona paratiroide)
PU – Poliúria
RAA – Renina-angiotensina-aldosterona rpm – Respirações por minuto
SAMe – S-adenosilmetionina SC – Via subcutânea
SC’s – Sinais clínicos
SID – Semel in die (1 vez por dia / 24h em 24h)
SIV – Septo interventricular SNC – Sistema nervoso central SNS – Sistema nervoso simpático SRD – Sem raça determinada T4 – Tiroxina
TCHO – Colesterol total
TFG – Taxa de filtração glomerular TGI – Trato gastrointestinal
TID – Ter in die (3 vezes por dia / 8h em 8h)
TRC – Tempo de repleção de capilar TSVE – Trato de saída do ventrículo esquerdo
UN – Ureia nitrogenada
UP:C – Rácio urinário de proteína:creatinina
VCM – Volume corpuscular médio VE – Ventrículo esquerdo
VPM – Volume plaquetário médio WHO – World Health Organization
1
CASO CLÍNICO Nº1 – CARDIOLOGIA
IDENTIFICAÇÃO DO PACIENTE
Nome do animal: Sparkles Espécie: gato Raça: SRD
Sexo: feminino Data de nascimento: 14/11/2009 (5 anos) Peso: 3,800Kg
Castrado: sim Data de consulta: 13/11/2014
MOTIVO DA CONSULTA
Dispneia grave.
ANAMNESE E HISTÓRIA CLÍNICA
No dia 13/11/2014 a Sparkles chegou para consulta de urgência às 23h30. O proprietário explicou que ela tem vindo a demostrar dificuldades respiratórias nas duas últimas semanas, mas que como esta ainda continuava a ronronar não achou haver qualquer problema subjacente. Afirmou ainda que a Sparkles tem vindo a perder peso durante o último mês e não tem certeza se esta tem comido ultimamente. Ainda não havia sido feita qualquer aproximação terapêutica. A Sparkles não tem acesso ao exterior, é o único animal em casa e até à data tem-se demonstrado um animal saudável; planos de vacinação e desparasitação externa (Frontline Combo®) em dia e interna irregular. Alimentação essencialmente com ração seca comercial (ad libitum), por vezes alguns “petiscos” (comida caseira) e tem sempre água à disposição.
EXAME FÍSICO
Quando chegou, a Sparkles, apresentava-se com estado mental ligeiramente deprimido, prostrada, em stress respiratório, com dispneia inspiratória e posição ortopneica (Fig.1). Temperatura rectal de 38,2°C (N). Estado de hidratação superior a 95% (N), avaliada pela prega de pele. CC 4/9 (↓) (escala no Anexo I). Mucosas cianóticas pálidas e húmidas/brilhantes (Fig.2), com TRC impossível de avaliar pela palidez presente. Pele e faneras sem alterações a registar. FC acima dos 200bpm (↑) e presença de sons cardíacos alterados à auscultação, nomeadamente, abafados. FR de 100rpm (↑), com dispneia grave, respiração com boca aberta
2
(ausência de corrimento nasal ou bocal) e com padrão respiratório abdominal. A auscultação pulmonar revelou sons respiratórios mais audíveis dorsalmente e diminuídos ventralmente. Pulso forte, simétrico e síncrono. Os linfonodos superficiais apresentaram-se sem alterações à palpação. As extremidades aparentavam ter uma temperatura normal/quente e com aparente sensibilidade à dor profunda. Não se efetuou palpação abdominal dado o stress respiratório.
LISTA DE PROBLEMAS
Dispneia inspiratória, taquipneia, mucosas pálidas e cianóticas, taquicardia, sons cardíacos e pulmonares alterados, perda crónica de CC.
DIAGNÓSTICOS DIFERENCIAIS
1) Doença cardíaca
2) Tromboembolismo pulmonar 3) Neoplasia (pulmonar, mediastínica) 4) Causas de Edema pulmonar
5) Causas de Derrame pleural
6) Tóxicos/Fármacos (Paracetamol) 7) Pneumonia
8) Pneumotórax 9) Traumatismo
10) Causa parasitária (Dirofilariose)
EXAMES COMPLEMENTARES
Antes da realização de qualquer exame completar, bem como de parte do exame físico, a Sparkles foi colocada de imediato a receber oxigenoterapia; quando a FR e a coloração das mucosas melhoraram ligeiramente, prosseguiu-se com o exame.
a) Radiografia (torácica)
Foi efetuada uma radiografia torácica em decúbito lateral direito (Fig.3), onde se pode observar radiopacidade aumentada dos tecidos moles em quase todo o tórax. Ausência da silhueta cardíaca, bem como contorno pouco marcado do diafragma. Os pulmões encontram-se pequenos e comprimidos caudo-dorsalmente, com o parênquima anormalmente denso, pela sua incompleta expansão; limites dos bordos caudais arredondados; ligeira denotação de fissuras interlobulares. Observa-se ainda a traqueia deslocada dorsalmente.
b) Avaliação do líquido pleural
Foi drenado um volume total de 145mL de líquido pleural, de consistência aquosa, aspeto serosanguinolento, translúcido, inodoro, de cor laranja escura e sem formação de
3
coágulos (Fig.4). Com auxílio de um refratómetro, procedeu-se à medição da densidade específica, com um valor de 1,017, bem como do nível de proteínas totais, cujo valor obtido foi de 2,8g/dL.
De seguida foi efetuado um esfregaço direto do líquido pleural, corado pela técnica de Diff-Quick, para observação ao microscópio. Na objetiva de ampliação de 400x, foi possível observar, por campo, uma estimativa de contagem manual, dos seguintes elementos celulares: eritrócitos (10 por campo), linfócitos (2 por campo), neutrófilos (1 por campo e com núcleo hipersegmentado) e raros macrófagos (Fig.5 a 7). A partir do esfregaço, foi ainda efetuada uma estimativa manual de contagem de células nucleadas, com um valor de 3,2 x 103/μL.
c) Hemograma
No hemograma, todos os valores se encontravam dentro dos limites de referência, à exceção das plaquetas, com um valor de 146x103/μL (↓) e o número de linfócitos muito próximo do limite inferior (1068/μL). Dada a trombocitopenia, foi efetuado um esfregaço sanguíneo, corado pela técnica de Diff-Quick, no qual não se verificaram quaisquer alterações dignas de registo, além da presença de agregados plaquetários e com uma estimativa manual de contagem de plaquetas de 347x103/μL (N).
d) Bioquímica sérica
A pedido do proprietário, por contenção de custos, não foram realizadas medições séricas de quaisquer parâmetros bioquímicos, embora houvesse indicação para alguns. A serem realizados posteriormente, apenas, se estritamente necessários.
e) Ecografia (torácica)
Durante a manhã do dia seguinte, com a Sparkles já mais estável, prosseguiu-se com a realização de uma ecografia a nível torácico. Foi possível observar ainda algum líquido na cavidade pleural; ausência de massas ao nível do mediastino e sem derrame pericárdico.
A ecocardiografia transtorácica foi executada segundo as diretrizes da ACVIM e realizada tanto no eixo curto, como no eixo longo, com visualização das 4 câmaras em modo M e em modo bidimensional. No coração direito não foram detetadas quaisquer alterações dignas de registo, enquanto que no coração esquerdo, foi feito o registo das seguintes medições:
Ventrículo esquerdo: em sístole: SIV 8.1mm (N), DIVE 3.6mm (↓), PLVE 8.9mm (↑); em diástole: SIV 5.4mm (N), DIVE 8.3mm (↓), PLVE 6.5mm (↑);
AE: 18,7mm (↑);
Ao: 9,6mm (N);
4 FE: 56,6% (N).
Na válvula mitral detetou-se presença de movimento anterior sistólico (MAS), pela observação de uma má coaptação entre as suas cúspides (Fig.8) e com consequente fluxo regurgitante, detetado pelo sinal de aliasing com fluxo de cor (registado com auxílio do efeito de Doppler (Fig.9)).
A Sparkles suportou bem a ecografia, não ficando muito stressada.
DIAGNÓSTICO
Derrame pleural secundário a CMH (diagnóstico presuntivo).
TERAPIA APLICADA
Oxigenoterapia
Como já referido, no início do tópico “Exames Complementares”, a Sparkles foi colocada a receber oxigenoterapia, com auxílio de máscara, por, aproximadamente, 30 minutos, tempo ao fim do qual a Sparkles estabilizou minimamente (diminuição da FR e mucosas ligeiramente mais rosadas), para se prosseguir para a realização de radiografias.
Toracocentese
Dado o stress respiratório da Sparkles, pela presença de líquido torácico, prosseguiu-se com a preparação cirúrgica (para realizar toracocentese e drenagem do líquido), com tricotomia e assepsia do tórax lateral direito. Manteve-se por mais algum tempo a oxigenoterapia.
Para realização de toracocentese deve fazer-se infiltração local de anestésico (Lidocaína a 1%), abrangendo todas as camadas da pele até ao espaço pleural. Vários tipos de agulhas e cateteres podem ser utlizados e, em animais pequenos, pode ainda recorrer-se ao uso de cateter “butterfly”, acoplando a uma torneira de três vias e subsequentemente a uma seringa (Fig.10). A toracocentese é geralmente feita ao nível do 7º ou 8º espaços intercostais e o animal deve ser colocado na posição que lhe gere menor stress. O local de inserção da agulha, para drenagem de líquidos, está mais recomendada ao nível do terço médio do 7º espaço intercostal, com o animal em pé ou em decúbito esternal (Crowe & Devey, 2014).
No caso da Sparkles utilizou-se um cateter “butterfly” de 21 gauge, no terço médio do 7º espaço intercostal e em decúbito esternal. A drenagem foi interrompida a partir do momento que se fez sentir maior resistência no êmbolo da seringa. Efetuou-se drenagem de 145mL de
5
fluido sero-sanguinolento. A respiração melhorou, verificaram-se também mais melhoras na coloração das mucosas e a oxigenoterapia deixou de ser necessária para manter a Sparkles estável.
De seguida, foi realizada nova radiografia torácica, na qual os pulmões já eram mais facilmente visualizados, no entanto, ainda com presença de derrame pleural grave.
Salix®(PA: furosemida) 0,15mL SC BID (início à 0h00 de 15/11/2014)
Fortekor® (PA: cloridrato de benazepril) 5mg ½ comprimido PO SID (início às 12h de 15/11/2014)
EVOLUÇÃO
O objetivo foi de manter a Sparkles hospitalizada, em princípio até dia 17/11/2014, iniciar medicação com efeito diurético e medicação para suporte cardíaco, avaliar a sua evolução e, se melhorar, dar alta. Ao longo do período de hospitalização a Sparkles foi seguida de forma contínua e com exames físicos completos a cada 4h.
14/11/2014 – 06h40: Exame físico: estado mental alerta; temperatura rectal de 38°C (N); FC 164bpm (↑) (continua a não ser possível distinguir claramente os sons cardíacos); FR 40rpm (N), a respiração mantém o padrão abdominal mas com menor esforço inspiratório e sem posição ortopneica; mucosas rosadas e brilhantes e com TRC < 2s (N); estado de hidratação superior a 95% (N). Ainda não quis comer (tentativas com ração seca genérica e húmida – Hill’s® a/d). Não urinou, nem defecou. Em suma, a Sparkles melhorou muito em relação à noite anterior, já não se encontra stressada, respirando mais facilmente, ainda que abdominal, não ofegante e com boa cor ao nível das mucosas. 16h13: Sem muitas alterações em relação ao exame matinal; estável; urinou; continua, no entanto, sem querer comer (optou-se por não se forçar para não a stressar desnecessariamente e uma vez que o proprietário vem visitar no final do dia pode ser que coma na sua companhia). 18h24: O proprietário veio visitar e a Sparkles comeu quase 2 taças de alimento húmido (Hill’s® a/d) e bebeu água. Tem estado estável, a respiração mantém-se um pouco “forçada”.
15/11/2014 – 09h10: A Sparkles continua estável, a responder bem à terapia, com evolução do padrão respiratório para costoabdominal. Continua a comer bem. 11h30: O proprietário veio visitar e a Sparkles comeu novamente muito bem com ele (meia lata de 156g). A Sparkles tem previsão de alta para o dia seguinte, ficando mais uma noite para supervisão.
6
16/11/2014 – A Sparkles respondeu bem durante a noite, apresentando-se alerta, com um exame físico muito satisfatório, a FR normalizou e a respiração é agora apenas torácica. O proprietário veio buscá-la durante a tarde e levou para casa a seguinte medicação: Furosemide (PA: furosemida) 40mg, ¼ de comprimido a cada 2 dias.
DISCUSSÃO
A Sparkles deu entrada com um quadro clínico cujos sinais são consideravelmente inespecíficos. Por esse facto a lista de diagnósticos diferenciais apresentada é um pouco extensa. No topo da lista, vem indicada como um dos diagnósticos diferenciais mais suspeito, uma afeção cardíaca, que acaba, no fundo, por englobar uma considerável sublista de doenças específicas que poderão estar na origem deste quadro clínico. Uma doença cardíaca conduz, geralmente, a uma insuficiência cardíaca (IC), a qual pode tomar diferentes características, podendo ter como origem a alteração de uma, ou mais, das camadas cardíacas; por alterações no impulso cardíaco (arritmia), seja na formação como na condução do mesmo; por alterações congénitas do coração; ou mesmo por alterações a nível mais periférico (vasos sanguíneos). No caso da Sparkles, alterações cardíacas de índole congénita apresentam, no entanto, uma baixa probabilidade de serem diagnosticadas, uma vez que é um animal já com 6 anos de idade, seguido regularmente e sem antes ter demostrado outros problemas de saúde. No pericárdio situações como a de um derrame poderiam originar este quadro; no miocárdio, alterações como as resultantes de uma cardiomiopatia hipertrófica, cardiomiopatia restritiva, cardiomiopatia dilatada (muito rara no gato), entre outras; e no endocárdio e válvulas o caso de uma afeção valvular (degenerescência valvular mixomatosa). Neste seguimento de ideias, insere-se outra potencial causa, um tromboembolismo pulmonar, que pode, também ele, ter origem numa IC, doenças infeciosas (como, p. ex., PIF ou sepsis), coagulopatia intravascular disseminada (secundária a outra doença), anemia hemolítica imuno-mediada, neoplasia, pancreatite, traumatismo, entre outras (Goggs et al., 2009). Uma vez que várias situações podem predispor a formação de um trombo e consequente embolia a nível pulmonar, significa que os mecanismos que o originam, também eles, podem ser vários (alterações na superfície endotelial, alterações na composição do sangue, situações que provoquem estase sanguínea) (Smith, 2006). Tal como os SC’s apresentados pela Sparkles, também os relacionados com um tromboembolismo pulmonar, são inespecíficos, como sejam: letargia, depressão, cianose, taquipneia e/ou dispneia e então a forte necessidade de suporte com os exames complementares
7
a realizar. A suspeita de uma neoplasia tende a ser um diagnóstico diferencial muito recorrente dada a variedade de manifestações que as mesmas podem provocar. Num quadro dispneico, neoplasias a nível torácico, podem, muito frequentemente, levar a um aumento da pressão hidrostática capilar e resultar em alterações que originam dificuldades respiratórias. Segundo Hawkins (2009), os pulmões são um local frequente para metástases de neoplasias malignas de outros locais do corpo bem como para tumores pulmonares primários. Tumores multicêntricos podem envolver os pulmões. Tais tumores incluem o linfoma, histiocitose maligna e mastocitoma. A maioria dos SC’s refletem um envolvimento do trato respiratório. Infiltração do pulmão pelo tumor pode causar interferência na oxigenação, levando a aumento de esforços respiratórios e intolerância ao exercício. Lesões massivas podem comprimir as vias aéreas, provocando tosse e obstrução na ventilação. Edema, inflamação asséptica, ou infeção bacteriana podem ocorrer secundariamente ao tumor. Derrame pleural de quase qualquer tipo, pode formar-se. Sinais não específicos em cães e gatos com neoplasma pulmonar incluem perda de peso, anorexia, depressão e febre. A presença de massas mediastínicas pode causar stress inspiratório como resultado do deslocamento de tecido pulmonar pela massa em si, ou pelo derrame pleural secundário que se pode desenvolver. Um linfoma envolvendo o mediastino é frequente, particularmente em gatos. A situação de um edema pulmonar, ou de um derrame pleural, embora não sejam considerados diagnósticos definitivos, aparecem nos diagnósticos diferenciais por serem situações que provocam dispneia (principalmente inspiratória, como no caso da Sparkles) e cuja causa pode não estar diretamente relacionada com os SC’s presentes. Os edemas pulmonares podem ser divididos em dois grandes grupos: de origem cardíaca e não cardíaca e, independentemente do mecanismo, o fluido de edema que infiltra os espaços intersticial e alveolar é rico em proteína (igual à concentração plasmática) em contraste com o edema de origem cardíaca, que é caracterizado por fluido baixo em proteína (Nelson, 2011). O edema pulmonar de origem cardíaca surge, mais frequentemente, por aumento da pressão hidrostática venosa pulmonar secundária a ICCE. Algumas causas de derrame pleural foram já sendo referidas ao longo da discussão, mas completando e relacionando com a apresentação clínica do caso em estudo, pode ter origem em situações como: doenças que originem hipoalbuminemia (neoplasia), aumento da pressão hidrostática capilar (ICC, neoplasia torácica ou mediastínica), diminuição/obstrução da drenagem linfática (neoplasia torácica ou pulmonar), rutura de integridade vascular – hemotórax (traumatismo) (Swinney, 2011). A ingestão, inalação ou absorção percutânea de um tóxico parece pouco provável, pois a Sparkles não tem acesso à rua e os tóxicos que, geralmente, os animais podem encontrar por casa,
8
costumam apresentar um quadro com sinais clínicos um pouco diferentes daqueles em causa, como com veneno para ratos, veneno para caracóis ou até de plantas (como existe nos gatos o caso específico dos lírios). Uma vez que a Sparkles tem vindo a manifestar alterações notadas pelo proprietário há pelo menos um mês, com perda crónica de peso, e desde há duas semanas com dificuldade respiratória, há que considerar a suspeita de este, mesmo tendo afirmado ainda não lhe ter dado qualquer medicação, lhe poder ter dado algo. Estas situações são, muitas vezes, complicadas de abordar pois há uma tendência, por parte dos donos, em não admitir ter dado algo, principalmente se perceberem que foi isso que despoletou sinais mais graves. O fármaco para uso humano mais recorrentemente utilizado pelos proprietários nos seus animais, são os que contêm o princípio ativo paracetamol. Este princípio ativo, em gatos, tem uma dose terapêutica de apenas 10mg/kg e os comprimidos para humanos são geralmente comercializados com 500mg a 1g do princípio (Almeida, 2013). Os SC’s agudos de intoxicação por paracetamol mais frequentes em gatos são de cianose progressiva, taquicardia, taquipneia e dispneia, todos eles dependentes do grau de metahemoglobinemia, depressão, vómito, inapetência, anorexia, edema das extremidades e face (principalmente a região submandibular), mucosas pálidas, prurido e hipotermia (Campbell & Chapman, 2000). Dados os sinais respiratórios, outro grupo de doenças a considerar, são as pneumonias. A pneumonia é caracterizada por inflamação nos pulmões e/ou vias aéreas e a sua etiologia é variável, desde bacteriana, a viral, fúngica, parasitária, por aspiração e corpo estranho (Hawkins, 2009). Tendo em conta o historial e anamnese da Sparkles, dentro destas causas, a que poderá vir a ter uma maior relevância será, provavelmente, uma pneumonia por corpo estranho, em todo o caso, seria de esperar uma apresentação de SC’s relativamente diferente, como, por exemplo, presença de secreções pelas cavidades nasais e bocal. De seguida, como diagnósticos diferenciais, aparecem pneumotórax e traumatismo. Apesar de a Sparkles ser um animal sem acesso à rua, nem sempre os seus proprietários estão em casa, existindo alguma possibilidade de esta ter caído e/ou batido em alguma estrutura com forte impacto e conduzir a um pneumotórax. Dentro do mesmo panorama, por traumatismo, pode ocorrer uma rutura diafragmática, que provoque herniação de estruturas e consequente stress respiratório. Um dos casos também seguido no Panorama Veterinary Clinic & Specialist Centre, foi precisamente de um gato que deu entrada de urgência, com grave dispneia, resultante de uma hérnia diafragmática (na Fig.11 pode observar-se a radiografia referente a esse caso, onde se observam ansas de intestino na cavidade torácica). Em último na lista, pela baixa probabilidade de ocorrer neste caso, vem referida uma causa parasitária (nomeadamente, por Dirofilaria immitis).
9
Embora as desparasitações internas na Sparkles sejam irregulares, segundo um estudo realizado por Atkins et al. (2000), o facto de a Sparkles ser um animal estritamente indoor, diminui esta possibilidade, ainda mais aliado ao facto de no hemograma não ter sido registada eosinofilia (embora não seja fator eliminatório); a dispneia é um dos sinais clínicos que pode estar presente.
Partindo para os exames complementares, o primeiro a ser realizado foi uma radiografia torácica, na qual foi observada radiopacidade aumentada dos tecidos moles, ausência da silhueta cardíaca, pulmões comprimidos caudo-dorsalmente, ligeira denotação de fissuras interlobulares e má delimitação do diafragma, sinais estes compatíveis com a presença de líquido a nível pleural. A traqueia apresentava-se deslocada dorsalmente, que pode tanto ser uma fonte de suspeita para uma massa mediastínica como para cardiomegalia, que, uma vez dada a ausência de silhueta cardíaca, é de difícil diagnóstico com base numa radiografia (Hawkins, 2009). Pelo facto de existir líquido excessivo a nível pleural, os pulmões encontram-se assim comprimidos, com impossibilidade de expansão total (daí o parênquima mais denso na radiografia), o que leva à manifestação do principal, ou mais proeminente, sinal clínico: a dispneia inspiratória. A expansão incompleta dos pulmões (atelectasia) faz com que a oxigenação sanguínea tenha um défice (hipoventilação), o que justifica a cianose presente. A presença de derrame pleural justifica também os sons cardíacos abafados à auscultação e a localização onde os sons respiratórios eram mais audíveis (dorsalmente). Um derrame pleural tende a torna-se visível radiograficamente quando já ocorreu uma acumulação de líquido entre 50 a 100mL no espaço pleural, dependendo do tamanho do animal (Hawkins, 2009). É ainda afirmado que, 30mL/Kg de derrame pleural causa dispneia subtil e que 60mL/Kg resulta em dispneia evidente (Beatty & Barrs, 2010).
Uma vez confirmada a presença de líquido a nível torácico, tornou-se impreterível a necessidade de realizar uma drenagem do mesmo, por forma a aliviar o stress respiratório da Sparkles. A drenagem do líquido, por toracocentese, foi efetuada pela técnica já descrita e a quantidade a drenar deve ser tanta quanto possível. Na maioria dos casos, um acesso unilateral é suficiente para aliviar significativamente o paciente, pois tanto nos gatos, como nos cães, o mediastino é fenestrado, pelo que, geralmente, o fluido se acumula bilateralmente, a menos que se acumule em lóculos derivado de uma inflamação, pelo facto de esta causar um espessamento da pleura e assim encerramento das fenestras, ou por o derrame ser constituído por um líquido muito espesso ou viscoso, nestes casos o lado colateral deve também ser drenado (Sherding & Bichard, 2006; Ellison, 2009; Beatty & Barrs, 2010). Como no caso da Sparkles o drenado era
10
bastante aquoso, significando que, à partida, a distribuição do mesmo era uniforme, pela comunicação entre os dois hemitórax, apenas foi feito acesso unilateral (direito). Com base na Tabela 1, o líquido colhido é classificado como transudado modificado, por características como: densidade específica de 1,017, PT 2,8g/dL e contagem de células nucleadas 3200/μL.
A causa do derrame pleural é, nesta fase, ainda desconhecida. Qualquer processo que interfira com as pressões hidrostática ou oncótica (intersticial ou capilar), drenagem linfática ou integridade de vasos, pode resultar em acumulação de fluido (Beatty & Barrs, 2010). No estudo realizado por Beatty & Barrs (2010), são referidas como etiologias mais frequentes de derrame pleural, no gato, as seguintes: piotórax/pleurite infeciosa, ICC esquerda ou direita, peritonite infeciosa felina, neoplasia e quilotórax idiopático (Tabela 2) e no período mais recente (2002-2003) referido no estudo, a etiologia isolada com maior percentagem de incidência foi a ICC (Tabela 3).
Nesta fase, com a Sparkles mais estável e com melhor perfusão sanguínea, já foi possível fazer colheita de sangue para mais análises. Testar para coagulopatias, antes de realizar uma toracocentese, é importante, no entanto, é uma abordagem tida em animais que se encontram minimamente estáveis e não em estado urgente de abordagem terapêutica (Ellison, 2009). Nos dados obtidos a partir do hemograma registou-se uma trombocitopenia, depois contestada pela contagem manual de plaquetas. A pseudotrombocitopenia é uma ocorrência relativamente frequente em gatos, uma vez que estes possuem acentuada anisocitose plaquetária, com plaquetas grandes e eritrócitos moderadamente pequenos, o que faz com que tenham tamanhos aproximados e, assim, induzam contagens erradas pela máquina. Outro achado frequente em gatos que pode levar a uma contagem baixa do número de plaquetas, é a presença de agregação plaquetária (que se registou neste caso), pois as suas plaquetas têm um tempo de ativação muito curto, pelo que uma colheita difícil/demorada, contaminada, ou mesmo dentro de tempos aceitáveis, é o suficiente para levar à sua formação (Harvey, 2012). A Sparkles tinha também um número de linfócitos próximo do limite baixo, que não chegava a ser linfopenia, mas que em todo o caso pode ser um sinal inespecífico de stress e é frequente na presença de quilotórax (já excluído como hipótese pela análise do líquido do derrame pleural) (Sherding & Bichard, 2006).
Com os exames até aqui realizados, muitos dos diagnósticos diferenciais foram sendo excluídos. Restando assim determinar a causa subjacente ao derrame pleural. Optou-se por colocar a Sparkles numa jaula, em repouso, durante a noite, e na manhã seguinte prosseguir-se com mais exames. Nestas situações deve iniciar-se terapia farmacológica com um diurético (no
11
caso da Sparkles utilizou-se furosemida) e não ser feita fluidoterapia pelo alto risco de sobrecarga nos pulmões, podendo, em casos que seja necessário, realizar-se sim fluidoterapia mas com administração lenta e ao longo de 24h (Bonagura et al., 2012; Davis et al., 2013).
Na manhã seguinte ao dia de entrada, prosseguiu-se com a realização de uma ecografia torácica, pela forte suspeita de uma massa mediastínica ou de alguma doença cardíaca como causa do derrame pleural. Não se detetaram massas mediastínicas nem derrame pericárdico e foi possível observar ainda algum líquido no espaço pleural. Na ecocardiografia foram registados valores indicativos de CMHE, nomeadamente: espessamento da parede livre do VE, dilatação do respetivo átrio, diminuição do volume da câmara do VE, presença de movimento anterior sistólico (MAS) da válvula mitral. No MAS, o que acontece é um movimento do folheto septal da válvula mitral, que é deslocado anteriormente no TSVE, originando uma obstrução dinâmica sub-aórtica durante a sístole (Kienle, 2008).
Foi assim estabelecido o diagnóstico de derrame pleural por CMHE.
Epidemiologicamente, a cardiomiopatia hipertrófica é a doença cardíaca adquirida mais frequente em gatos. Côté et al. (2011) caracteriza a CMH como hipertrofia concêntrica do VE na ausência de outras causas para a mesma, nomeadamente: hipertensão, estenose aórtica, hipertiroidismo ou acromegalia. A fisiopatologia subjacente à CMH é um defeito primário nas células musculares cardíacas, que provoca espessamento da parede do ventrículo, com desenvolvimento de fibrose em excesso, o que faz com que este não seja capaz de relaxar normalmente (Côté et al., 2011). No caso da Sparkles verificou-se espessamento da PLVE sem espessamento do SIV, que, segundo a classificação desenvolvida por Brizard et al. (2009), é considerado um fenótipo E. Consequentemente há uma diminuição da DIVE, que por sua vez origina uma disfunção diastólica, pela menor capacidade do coração em encher normalmente durante a diástole (enchimento passivo) (Côté et al., 2011). A presença de MAS na válvula mitral, registado com auxílio do efeito de Doppler, surge por consequência da hipertrofia dos músculos papilares que puxam as cúspides da válvula durante a sístole, gerando fluxo regurgitante. Nestes casos em que o MAS está presente, MacDonald (2011a) atribui a denominação de CMH congestiva, pela obstrução da via de saída do VE. O volume de sangue regurgitado ao nível da válvula mitral faz aumentar a pressão no AE, o que contribui para a sua dilatação, também exibida pela Sparkles (Côté et al., 2011). Além da medição da câmara do AE, o seu aumento pode também ser estabelecido pela relação do seu diâmetro com o da aorta (AE/Ao), na Sparkles de 1,95 (acima do valor considerado normal). Esta ICCE resulta num aumento da pressão capilar hidrostática nas circulações sistémica e/ou pulmonar; como a pleura
12
visceral drena para as veias pulmonares ocorre uma consequente derrame pleural, exibida pela Sparkles (Beatty & Barrs, 2010). Por outro lado, as veias da pleura parietal drenam para a circulação venosa sistémica, o que pode também originar derrame pleural, mas com origem numa ICD (causa frequente de quilotórax no gato) (Beatty & Barrs, 2010). Finalmente, foi ainda avaliada a FE (índice utilizado para avaliar a função sistólica), cujos valores se encontravam dentro do intervalo de referência, segundo a bibliografia consultada. Um deficiente relaxamento do miocárdio faz aumentar a pressão diastólica final do ventrículo, que é transmitida a nível venoso e capilar, cujas pressões são aumentadas por retenção de fluído a nível renal para expandir o volume plasmático de forma compensatória, esta retenção de água e Na é um fator crítico no desenvolvimento de edemas e derrames (Bonagura et al., 2012).
Apesar de todos os dados já analisados, o diagnóstico de CMH na Sparkles não deixa de ser presuntivo, uma vez que não foi feito qualquer teste para descartar as doenças que podem originar estas características cardíacas. Na presença de uma destas doenças, o diagnóstico de CMH deve ser excluído e então ser atribuída a designação de hipertrofia ventricular secundária à doença em causa (Kittleson & Kienle, 1998).
Dada a condição da Sparkles foi assim iniciada terapia para suporte cardíaco (Fortekor®). O tratamento de gatos sintomáticos com IC diastólica causada por CMH, ou por outras causas de rigidez no miocárdio, é direcionado para reduzir acumulação de fluido (edema pulmonar e/ou derrame pleural) com furosemida e terapia crónica adicional com um IECA (Côté et al., 2011). O benazepril é um IECA, ou seja, impede a conversão da angiotensina I em II (potente vasoconstritor) e assim produz um efeito hipotensivo e vasodilatador (Papich, 2011). Os IECAs são vasodilatadores que diminuem a regurgitação mitral e os níveis de aldosterona, o que protege o miocárdio, são também considerados os vasodilatadores de eleição para ICC, pois atenuam os sinais clínicos e aumentam a longevidade (Bonagura, 2007). Nos casos de administração conjunta de benazepril com furosemida há que considerar reduzir a dose desta, pois em associação têm um potencial hipotensivo (Plumb, 2008).
A Sparkles teve alta no dia 16/11/2014 (Fig.12) pela sua satisfatória evolução, levando como medicação para continuar em casa a furosemida.
Durante a sua hospitalização teria sido aconselhável fazer outras análises complementares para descartar, ou detetar, a presença de doenças (já referidas) que possam originar um espessamento da parede do VE (entre outros), para, em caso positivo, proporcionar a adequada terapia.
13
Finalmente, mas não menos relevante, uma dieta adequada poderia/deveria ter sido ponderada. Uma nutrição adequada pode não só modular a doença, como abrandar a sua evolução e minimizar a terapia farmacológica necessária, melhorando a qualidade de vida. Antes de mais a manutenção de uma CC adequada é muito importante, sendo que em animais com ICC a tendência é de evolução para um estado caquético. Embora existam dietas comerciais preparadas para doentes cardíacos não quer dizer que seja a ideal para todos os casos e assim, exames complementares, nomeadamente com recurso a bioquímicas sanguíneas (não realizadas na Sparkles), permitem melhor escolher e adaptar a dieta. Os principais elementos a ter em consideração em doentes cardíacos são: calorias (adaptar às necessidades do animal); proteína (deve ser de alta qualidade); taurina (a sua deficiência, em gatos está muito associada a CMD, hoje em dia já não representando um problema pela sua presença nas dietas comerciais; importante suplementar em caso de dieta caseira); arginina (pela incapacidade de sintetizar quantidades suficientes de forma endógena; parece ajudar a decrescer a probabilidade de formação de trombos em gatos com CMH); gordura (ácidos gordos de cadeia longa ω-3); Na (geralmente faz-se restrição, principalmente se na presença de derrames/edemas e quanto mais avançada se encontrar a doença); K (uso de furosemida pode contribuir para hipocalemia e o do IECA’s para hipercalemia, devendo fazer-se controlo com análises); Mg (furosemida pode causar hipomagnesiemia); vitamina B12 (deve estar presente na dieta em boa quantidade);
L-carnitina (importante no metabolismo de ácidos gordos e produção de energia); coenzima Q10 (importante na produção de energia e também função antioxidante); antioxidantes (importante em casos de stress oxidativo) (Freemann, 2000; Freemann & Rush, 2012).
PROGNÓSTICO E ACOMPANHAMENTO DE CASO
A condição da Sparkles exige suporte terapêutico constante e a sua esperança média de vida é menor.
Um prognóstico a longo termo, nestes animais, é difícil de estabelecer, sendo por isso reservado e muito variável consoante a apresentação clínica e resposta ao tratamento (Bonagura & Lehmkuhl, 2006). Rush et al. (2002) realizou um estudo onde foi avaliado o tempo médio de sobrevivência em gatos com CMH, consoante a sua apresentação clínica e, no grupo que apresentava ICC, a média obtida foi de 563 dias de sobrevivência.
A Sparkles voltou no dia 26/11/2015 para uma consulta de acompanhamento. Foi realizada uma radiografia torácica em projeção ventrodorsal, com confirmação da, já
14
observada, cardiomegalia, ausência de sinais compatíveis com presença de líquido e parênquima pulmonar limpo. À auscultação pulmonar, não foram detetadas crepitações e a nível cardíaco detetou-se alguma arritmia sinusal e foi auscultado um sopro holosistólico de grau IV/VI, pelo menos. Um sopro holosistólico, também denominado de pansistólico, é um sopro típico de regurgitação mitral (geralmente grave) e não permite auscultar o segundo som cardíaco (MacDonald, 2011b). Na ecocardiografia mantêm-se as características morfológicas observadas anteriormente, no entanto, no AE foi detetada a presença de contraste espontâneo (“smoke effect”) (Fig.13 e Fig.14). A presença deste sinal é uma indicação de fluxo sanguíneo turbulento, que origina uma região de estase sanguínea e, por isso, uma maior pré-disposição para agregação eritrocitária (formação de trombo), que pode migrar, entrando na circulação sanguínea arterial e, à posterior, provocar um tromboembolismo arterial, cujas manifestações variam com o local em que o mesmo se aloje (Hogan, 2006). Posto isto, é importante atuar a nível profilático para prevenir a ocorrência de um tromboembolismo arterial. Além disso, Côté et al. (2011), afirma que gatos com evidência ecocardiográfica de contraste espontâneo e com moderada a grave dilatação atrial esquerda (AE/Ao > 1,9 e/ou evidência de estase sanguínea arterial) devem fazer terapia anticoagulante.
Pela melhora apresentada nesta consulta de acompanhamento foi interrompida a furosemida e estabelecido um novo plano terapêutico ad eternum: Aspirina (PA: ácido acetilsalicílico) com efeito antitrombótico na dose de 5mg PO a cada 3 dias (Tobias, 2000); Cibacen® (PA: cloridrato de benazepril) 0.25-0.5mg PO SID ou BID para gatos com CMH ou hipertensão (Plumb, 2008). Dada a condição estável da Sparkles, foi agendada nova consulta de acompanhamento ao fim de 6 meses.
15
Fig.1 – Sparkles, posição ortopneica Fig.2 – Mucosas cianóticas, pálidas, húmidas
Fig.3 – Radiografia torácica, vista latero-lateral (em decúbito direito)
Fig.4 – Líquido pleural Fig.5 – Citologia líquido pleural; observação de linfócitos (setas). (Diff-Quick, 400x)
16
Fig.6 – Citologia líquido pleural; observação de neutrófilo hipersegmentado (seta) e macrófago (cabeça seta). (Diff-Quick, 400x)
Fig.7 – Citologia líquido pleural; observação de eritrócitos (setas). (Diff-Quick, 400x)
Fig.9 – Ecocardiograma em modo B, plano longitudinal: evidenciação de regurgitação na válvula mitral, num gato com CMH, registado com efeito de Doppler a cores (Adaptado de Kittleson, 2008)
Fig.10 – Técnica de toracocentese, utilizando uma torneira de três vias (Adaptado de Crowe & Devey, 2014)
Fig.8 – Esquema a demonstrar o mecanismo do MAS da válvula mitral para o TSVE (Adaptado de UFAW, 2011)
Fig.11 – Radiografia torácica: herniação diafragmática de ansas intestinais
17
Caraterísticas de causas frequentes de derrame pleural em gatos
Etiologia ou doença em progresso
Epidemiologia Historial SC’s não relacionados com
o derrame pleural Caraterísticas do fluido
Piotórax/ Pleurite infeciosa
Geralmente jovem (4-6 anos)
Qualquer idade ou raça pode ser afetada
Variável
Duração SC’s 1-2 semanas Agudamente podem apresentar dispneia, tosse, letargia, apetite reduzido, perda de CC
História de infeção do trato respiratório superior (25%)
Pirexia, desidratação, baixa CC
Se com sepsis: hipoglicemia, hipotermia, icterícia, bradicardia Exsudado ICCD ou ICCE Qualquer idade ou raça, dependendo da cardiopatia subjacente Variável, depende da etiologia da cardiopatia. Com cardiomiopatias secundárias podem observar-se sinais de doença primária
Congénita: pode ter pequeno porte
Taquicardia, sopro, “galope”, arritmia, distensão
jugular/pulso, cianose, ascite/hepatomegalia Pode não ter outros sinais de disfunção cardiovascular Variável: transudado, transudado modificado quilo PIF efusiva 70% <1 ano. Maior risco em algumas raças e em gatos inteiros Frequente em raças cruzadas
Stress ambiental recente. Letargia não específica, apetite reduzido, perda de CC. Distensão abdominal
Pirexia, baixa CC, derrame peritoneal, alterações oculares, sinais neurológicos
Proteína alta (>35g/L), baixa celularidade Neoplasia Broncopulmonar e timoma: geralmente >10 anos Linfoma mediastínico: siameses jovens
Variável, não específica, tosse, dispneia
Metástases distantes (dígitos, olhos, músculo esquelético) Baixa CC Diminuição da compressibilidade torácica Síndromes paraneoplásicas Variável: transudado modificado, exsudado, quilo Quilotórax idiopático
Qualquer idade e raça Siameses podem ter maior risco
Tosse, dispneia Nenhuns Triglicerídeos do fluido >100mg/dL Tipo de derrame Cor/ transparência Densidade específica PT (g/dL) Células/ μL Tipos celulares predominantes Transudado* Incolor, transparente < 1,014 < 2,5 < 1000 Células mononucleares Transudado modificado* Amarelo transparente ou ± opaco 1,014 – 1,020 2,5 – 3,5 > 1000 Células mononucleares
Exsudado*2 Amarelo/opaco > 1,020 > 3,0 > 5000 Neutrófilos
(>80%) * Derrames não inflamatórias
*2 Derrame inflamatória. Pode ser séptico ou asséptico
Nota: alguns autores, nomeadamente Sherding & Bichard (2006), fazem a classificação do derrame pleural mediantes cinco tipos: transudado, transudado modificado, exsudado, quilo e hemorrágica. Tabela 1 – Classificação do tipo de derrame pleural com base na cor/transparência, densidade específica, PT, contagem celular e tipo de células predominantes (Adaptado de Beatty & Barrs, 2010; Santos & Marcos, 2011)
Tabela 2 – Características das causas frequentes de derrame pleural no gato (Adaptado de Beatty & Barrs, 2010)
18
Resumo de estudos publicados sobre gatos com derrame pleural
Data de colheita (e publicação) Número de casos com diagnóstico definitivo PIF (% do nº total) ICC (% do nº total) Piotórax (% do nº total) Neoplasia (% do nº total) % do total devida a PIF, ICC, piotórax ou neoplasia combinadas 2002-03 19 5 47 11 26 100 1989-92 65 25 23 12 34 94 1987-95 63 13 14 24 37 88 1975-77 54 4 17 17 61 99 1972-74 64 10 44 4 34 92
Tabela 3 – Resumo de estudos publicados sobre gatos com presença de derrame pleural, demonstrando as principais etiologias (Adaptado de Beatty & Barrs, 2010)
Fig.12 – Sparkles no dia 16/11/2014, antes de ter alta
Fig.13 – Ecocardiograma em modo B, plano transversal: contraste espontâneo em AE dilatado, num gato com CMH (Adaptado de WVR, 2014)
Fig.14 – Ecocardiograma em modo B, plano longitunial: contraste espontâneo em AE dilatado, num gato com CMH (Adaptado de WVR, 2014)
19
Referências Bibliográficas
Almeida, J. M. (2013). Paracetamol em Gatos - Toxicologia. Comunicação apresentada em aula. UTAD, Vila Real, Portugal.
Atkins, C. E., DeFrancesco, T. C., Coats, J. R., Sidley, J. A. & Keene, B. W. (2000). Heartworm infection in cats: 50 cases (1985–1997). JAVMA, 217 (3): 355-358.
Beatty, J. & Barrs, V. (2010). Pleural Effusion in the Cat: a practical approach to determining aetiology. J Feline Med Surg, 12, 693-707.
Bonagura, J. D. (2007). Drugs used in the management of cardiovascular disease. Comunicação apresentada na TNAVC, Orlando, Florida.
Bonagura, J. D. & Lehmkuhl, L. B. (2006). Cardiomyopathy. In: S. J. Bichard & R. G. Sherding (Eds.), Saunders Manual of Small Animal Practice (3ª Ed., pp. 1527-1548). St. Louis, Missouri: Saunders, Elsevier Inc.
Bonagura, J. D., Lehmkuhl, L. B. & Morais, H. A. (2012). Fluid and Diuretic Therapy in Heart Failure. In: S. P. DiBartola (Ed.), Fluid, Electrolyte, and Acid-Base Disorders in Small Animal Practice (4ª Ed., pp. 514-543). St. Louis, Missouri: Saunders, Elsevier Inc. Brizard, D., Amberger, C., Hartnack, S., Doherr, M. & Lombard, C. (2009). Phenotypes and
echocardiographic characteristics of a European population of domestic shorthair cats with idiopathic hypertrophic cardiomyopathy. Schweizer Archiv Für Tierheilkunde, 151(11): 529-538.
Campbell, A. & Chapman, M. (2000). Paracetamol. In: Handbook of Poisoning in dogs and cats (1ª Ed., pp. 31-38). Osney Mead, Oxford: Blackwell Science Ltd.
Côté, E., MacDonald, K. A., Meurs, K. M. & Sleeper, M. M. (2011). Hypertrophic Cardiomyopathy. In: Feline Cardiology (1ª Ed., pp. 118-197). West Sussex, UK: Willey-Blackwell.
Crowe, D. & Devey, J. (2014). Thoracic Drainage. In: M.J. Bojard, D. R. Waldron, J. P. Toombs (Eds.), Current Techniques In Small Animal Surgery (5ª Ed., pp. 419-421). Jackson, Wyoming: Teton NewMedia.
Davis, H., Jensen, T., Johnson, A., Knowles, P., Meyer, R., Rucinsky, R. & Shafford, H. (2013). Fluid Therapy Guidelines for Dogs and Cats. JAAHA, 49 (3): 149-159.
Ellison, G. W. (2009). The patient with thoracic effusion: presentation and first aid, clinical assessment, oxygen therapy, thoracocentesis and thoracic drainage. Comunicação apresentada no 62° Congresso Internazionale Multisala SCIVAC, Rimini, Italy.
20
Freemann, L. M (2000). Nutritional modulation of cardiac disease. Veterinary Focus, 10 (2): 19-24.
Freemann, L. M. & Rush, J. E. (2012). Nutritional Management of Cardiovascular Diseases. In: A. J. Fascetti & S. J. Delaney (Eds.), Applied Veterinary Clinical Nutrition (1ª Ed., pp. 301-313). West Sussex, UK: Wiley-Blackwell.
Goggs, R., Benigni, L., Fuentes, V. L. & Chan, D. L. (2009). Pulmonary thromboembolism. J Vet Emerg Crit Care, 19(1): 30-52.
Harvey, J. W. (2012). Hematology procedures. In: J. W. Harvey (Ed.), Veterinary Hematology: A Diagnostic Guide and Color Atlas (1ª Ed., pp. 11-32). St. Louis, Missouri: Saunders, Elsevier Inc.
Hawkins, E. C. (2009). Disorders of the Pulmonary Parenchyma and Vasculature – Respiratory System Disorders. In: R. W. Nelson & C. G. Couto (Eds.), Small Animal Internal Medicine (4ª Ed., pp. 302-322). St. Louis, Missouri: Mosby, Elsevier Inc.
Hogan, D. F. (2006). Prevention and Management of Thromboembolism. In: J. R. August (Ed.), Consultations in Feline Internal Medicine (5ª Ed., pp. 331-345). St. Louis, Missouri: Saunders, Elsevier Inc.
Kienle, R. D. (2008). Feline Cardiomyopathy. In: L. P. Tilley, J. F. W. K. Smith, M. A. Oyama & M. M. Sleeper (Eds.), Manual of Canine and Feline Cardiology (1ª Ed., pp. 151-172). St. Louis, Missouri: Saunders, Elsevier Inc.
Kittleson, M. D. & Kienle, R. D. (1998). Hypertrophic Cardiomyopathy. In: Small Animal Cardiovascular Medicine (1ª Ed., pp. 347-362). Davis, California: Mosby Inc.
Kittleson, M. D. (2008). Feline Hypertrophic Cardiomyopathy – SAM. Acedido em 14 de Abril de 2015 em https://www.youtube.com/watch?v=9RRBpT_8P3s
MacDonald, K. (2011a). Hypertrophic Cardiomyopathy. In: E. Côté (Ed.), Clinical Veterinary Advisor – Dogs and Cats (2ª Ed., pp. 565-569). St. Louis, Missouri: Elsevier Inc. MacDonald, K. (2011b). Back to basis. Comunicação apresentada no Pacific Veterinary
Conference, Sacramento, Califórnia.
Nelson, O. L. (2011). Pulmonary Edema, Noncardiogenic. In: E. Côté (Ed.), Clinical Veterinary Advisor – Dogs and Cats (2ª Ed., pp. 933-937). St. Louis, Missouri: Elsevier Inc. Papich, M. G. (2011). Benazepril Hydrochloride. In: Saunders Handbook Of Veterinary Drugs:
Small And Large Animal (3ª Ed., pp. 68-69). St. Louis, Missouri: Saunders, Elsevier Inc.
21
Plumb, D. C. (2008). Cloridrato de Benazepril. In: D. C. Plumb (Ed.), Plumb’s Veterinary Drug Handbook (6ª Ed., pp. 96-97). Ames, Iowa: Blackwell Publishing.
Rush, J. E., Freeman, L. M., Fenollosa, N. K. & Brown, D. J. (2002). Population and survival characteristics of cats with hypertrophic cardiomyopathy: 260 cases (1990 – 1999). J Am Vet Med Assoc, 220: 202-207.
Santos, M. & Marcos, R. (2011). Derrames Cavitários. In: M. C. Peleteiro, R. Marcos, M. Santos, J. Correia, H. Pissarra & T. Carvalho (Eds.), Atlas de Citologia Veterinária (1ª Ed., pp. 233-248). Lisboa, Portugal: Lidel
Sherding, R. G. & Bichard, S. J. (2006). Pleural Effusion. In: S. J. Bichard & R. G. Sherding (Eds.), Saunders Manual of Small Animal Practice (3ª Ed., pp. 1696-1707). St. Louis, Missouri: Saunders, Elsevier Inc.
Smith, S. A. (2006). Thromboembolic Disease: Diagnosis And Treatment. In: August, J. R. (Ed.), Consultations in Feline Internal Medicine (5ª Ed., pp. 553-563). St. Louis, Missouri: Saunders, Elsevier Inc.
Swinney, G. (2011). Pleural Effusion. In: E. Côté (Ed.), Clinical Veterinary Advisor – Dogs and Cats (2ª Ed., pp. 882-887). St. Louis, Missouri: Elsevier Inc.
Tobias, A. (2000). What do we really know about feline cardiomyopathy?. Comunicação apresentada na Mather Lecture Series, St Paul, Brazil.
UFAW – Universities Federation for Animal Welfare (2011). Hypertrophic Cardiomyopathy. In: Genetic welfare problems of companion animals. Acedido em 14 de Abril de 2015 em http://www.ufaw.org.uk/HYPERTROPHICCARDIOMYOPATHYRAGDOLL .php
Warmerdam Veterinaire Radiologie (WVR) (2014). Spontaneous contrast in a cat with HCM. Acedido em 14 de Abril de 2015 em https:/www.youtube.com/watch?v=tb9zP1jDmEI
23
CASO CLÍNICO Nº2 – ONCOLOGIA
IDENTIFICAÇÃO DO PACIENTE
Nome do animal: Zibadee Espécie: cão Raça: Wippet
Sexo: masculino Data de nascimento: 02/11/2002 (12 anos) Peso: 14,850Kg
Castrado: sim Data de consulta: 27/10/2014
MOTIVO DA CONSULTA
Massa na região inguinal esquerda e escrotal.
ANAMNESE E HISTÓRIA CLÍNICA
No dia 27/10/2014 o Zibadee veio para uma consulta, como caso reencaminhado de outro hospital veterinário. Na carta redigida pelo médico responsável pelo Zibadee refere que há três meses foi removida uma pequena massa na região inguinal (mais detalhes sobre localização exata, tamanho e caraterísticas não vêm especificadas). O diagnóstico apresentado foi de mastocitoma e, nesta fase, o médico que reencaminhou o caso, suspeita de recorrência da neoplasia no atual tumor. Vem ainda a informação de que o Zibadee tem um sopro de origem cardíaca (não está a fazer medicação).
O Zibadee é o único animal que os proprietários têm, vai à rua acompanhado (com trela) e tem os planos de vacinação e desparasitação em dia. A sua alimentação consiste em ração seca (ad libitum) de marca genérica e tem sempre água à disposição. Os proprietários não têm notado alterações no apetite, micção, fezes, nem quaisquer outros hábitos.
EXAME FÍSICO
Ao exame físico o Zibadee demonstrou-se muito assustado, mas com estado mental alerta. Temperatura rectal de 38,5°C (N). Estado de hidratação superior a 95% (N), avaliado pela prega de pele. Condição corporal 5/9 (N). Mucosas rosadas e húmidas/brilhantes, com um TRC entre 1 e 2s (N). Pele e faneras sem alterações dignas de registo (à exceção do tumor). FC