Universidade Trás-os-Montes e Alto Douro
Extratos de plantas da família Lamiaceae ricos em
polifenóis: estudos in vitro perspetivando aplicações
biomédicas
Dissertação de mestrado em Engenharia Biomédica
Isabel Cristina Marinho Teixeira
Orientadora: Professora Doutora Amélia M. Lopes Dias da Silva
Coorientador: Doutor Luís Manuel Lourenço Félix
II
Universidade Trás-os-Montes e Alto Douro
Extratos de plantas da família Lamiaceae ricos em
polifenóis: estudos in vitro perspetivando aplicações
biomédicas
Dissertação de mestrado em Engenharia Biomédica
Isabel Cristina Marinho Teixeira
Orientadora: Professora Doutora Amélia M. Lopes Dias da Silva
Coorientador: Doutor Luís Manuel Lourenço Félix
Composição do júri:
Presidente: Prof. Luís Torres Pereira (ECT; UTAD);
Vogar, arguente: Prof. Fernando M. Nunes (ECVA, UTAD);
Vogar, arguente: Prof. Dario J. L. Santos (ECVA, UTAD);
Vogar, orientador: Prof. Amélia M. Lopes Dias da Silva (ECVA, UTAD).
Data: 9 de Fevereiro de 2018
III
Agradecimentos
A execução deste trabalho não teria sido possível sem o apoio e a ajuda de algumas pessoas.
Para começar, queria agradecer à Professora Doutora Amélia Silva e ao Doutor Luís Félix por aceitarem orientar-me neste trabalho e por toda a ajuda e por todos os ensinamentos. Agradeço também por toda a paciência que sempre tiveram comigo e por estarem sempre disponíveis para me ajudar.
A todos os docentes e colegas com quem tive a oportunidade de me cruzar e de trabalhar por de alguma forma contribuírem para o meu percurso académico.
Agradeço à Filipa Carvalho por todos os momentos passados, por toda a ajuda, por toda a paciência, pelo companheirismo e pela amizade.
Ao Sérgio Teixeira que com a sua paciência me incentivou a trabalhar, a fazer mais e melhor e a concluir esta dissertação.
A todos os amigos que levo de Vila Real, por todos os bons momentos passados. Para terminar, não podia deixar de agradecer à minha família, em especial aos meus país e irmãos pelo apoio incondicional e por me terem dado todas as oportunidades para continuar o meu percurso académico.
IV
Resumo
As plantas medicinais têm sido utilizadas, com fins curativos e terapêuticos, desde a antiguidade. Os seus compostos químicos ativos, com múltiplas atividades biológicas, permitiram a sua utilização na medicina tradicional e têm promovido a descoberta de novos fármacos com elevado valor terapêutico.
O género Thymus L., família Lamiaceae, engloba um conjunto de plantas aromáticas com propriedades medicinais distribuídas por cerca de 350 espécies. De entre as várias espécies de Thymus, o Thymus vulgaris L. (tomilho vulgar) tem demonstrado possuir elevado potencial medicinal devido à sua composição química e respetivas propriedades biológicas.
O Thymus fragantissimus (tomilho laranja), indicado por alguns autores como Thymus vulgaris spp. Fragantissimus, surge devido à elevada taxa de hibridação do tomilho, é, portanto, considerado um hibrido do tomilho vulgar. Por este motivo presume-se que possa também aprepresume-sentar elevado potencial medicinal, no entanto, a sua composição química bem como as suas propriedades biológicas e terapêuticas continuam por elucidar.
O principal objetivo deste trabalho foi analisar o efeito bioativo de diferentes extratos de tomilho laranja nas linhas celulares Caco-2, HepG2 e Raw 264.7 (ensaios in vitro) ao nível da sua citotoxicidade e potencial anti-inflamatório. Para tal, usaram-se três extratos de T. fragantissimus, um hidro-etanólicos e dois aquosos (obtidos por decocção e infusão), preparados a partir das partes aéreas liofilizadas e moídas.
A viabilidade celular foi estudada utilizando o indicador de viabilidade celular Alamar Blue que avalia a atividade metabólica celular e o indicador de morte celular Trypan Blue que avalia a integridade membranar. As células foram expostas a 50, 100, 200 e 500 µg/mL de cada extrato, durante 24 ou 48 h.
A atividade anti-inflamatória foi estudada em macrófagos (células Raw 264.7), expostos a concentrações não tóxicas de cada extrato, nomeadamente 10, 20 e 30 µg/mL, na presença e na ausência de lipopolissacarídeo (LPS), e o óxido nítrico (NO) libertado foi quantificado utilizando o reagente de Griess.
Verificou-se que a viabilidade celular diminui em função do tempo de exposição e da concentração aplicada, podendo indicar um potencial anti-proliferativo. E, concentrações não-tóxicas de extratos demonstraram que o tomilho laranja apresenta propriedades anti-inflamatórias. Os resultados permitiram concluir que a planta em
V
estudo apresenta valor medicinal e que, após um estudo mais rigoroso da sua composição química pode ser uma boa fonte de moléculas para aplicação biomédica.
Palavras Chave: Biologia celular; Aplicações Biomédicas; Thymus vulgaris L. (tomilho
vulgar); Thymus fragantissimus (tomilho laranja); Viabilidade celular; Atividade anti-inflamatória;
VI
Abstract
Medicinal plants have been used for curative and therapeutic purposes since antiquity. Its chemical compounds, with multiple biological activities, allowed their use in traditional medicine and have been promoting the discovery of new drugs with high therapeutic value.
The genus Thymus L. belongs to the Lamiaceae family and comprises a set of aromatic plants with medicinal properties. Among the about 350 Thymus species, Thymus vulgaris L. (thyme) has demonstrated to have high medicinal potential due to its chemical composition and respective biological properties.
Thymus fragantissimus (orange thyme), indicated by some authors as Thymus vulgaris spp. Fragantissimus, originated due to the high hybridization rate of thyme, it is a common thyme (Thymus vulgaris) hybrid. Thus, it is presumed that this sub-species also has medicinal potential, however, its chemical compositions as well as its biological and therapeutic properties remain to be elucidated.
The main aim of this work was to analyze the biological effect of different orange thyme extracts using Caco-2, HepG2 and Raw 264.7 cell lines (in vitro assays), assessing their cytotoxicity and anti-inflammatory potential.
Three plant extracts were used, one hydro-ethanolic and two aqueous extracts (decoction and infusion) which were obtained from aerial parts of the plant that were lyophilized and grounded.
The cell viability was performed using metabolic Alamar Blue assay and the Trypan Blue cell exclusion assay. Cells were exposed to 50, 100, 200 and 500 μg / mL of each extract during 24 or 48 h.
The anti-inflammatory activity was performed exposing macrophages (Raw 264.7 cells) to non-toxic concentrations of extract (at 10, 20 and 30 μg / mL) in the presence and in the absence of lipopolyssacharyde (LPS), and released nitric oxide (NO) was quantified using Griess's reagent.
Results showed that the extracts induce a dose- and time-dependent decrease in cellular viability, indicating a potential action as anti-proliferative, which deserves future studies. And, at non-cytotoxic concentrations, the extracts presented anti-inflammatory activity, reducing the NO production by LPS-stimulated Raw 264.7 cells. The results allowed us to conclude that orange thyme has medicinal value and that, after a deeper
VII
study concerning to the molecular composition, it can be a good source of molecules for biomedical applications.
Keywords: Cell Biology; Biomedical applications; Thymus vulgaris L.; Thymus fragantissimus (orange thyme); cell viability; anti-inflammatory activity;
VIII
Índice
Agradecimentos ... III Resumo ... IV Abstract ... VI Índice ... VIII Índice de figuras ... X Índice de tabelas ... XII Índice de equações ... XIII Abreviaturas... XIV1 Introdução... 2
1.1 Uso de plantas na medicina... 2
1.1.1 Efeito das plantas medicinais na inflamação ... 3
1.2 Plantas da família Lamiaceae, género Thymus L. ... 5
1.2.1 Caracterização do género Thymus L. ... 5
1.2.2 Caracterização do Thymus vulgaris L. ... 6
1.2.3 Thymus fragantissimus, um hibrido do Thymus vulgaris L. ... 7
1.3 Objetivos ... 9
2 Material e Métodos... 11
2.1 Origem do material vegetal ... 11
2.2 Obtenção dos extratos ... 11
2.2.1 Decocção ... 11 2.2.2 Infusão ... 12 2.2.3 Hidro-etanólico (HE) ... 12 2.3 Cultura de células ... 13 2.3.1 Linhas celulares ... 13 2.3.2 Meios de cultura ... 13
2.4 Testes de viabilidade celular – Método de Alamar Blue (AB) ... 14
2.4.1 Princípio teórico ... 14
2.4.2 Procedimento realizado ... 15
2.5 Indicador de morte celular – Método Trypan Blue (TB) ... 16
2.5.1 Principio teórico ... 16
2.5.2 Procedimento realizado ... 16
IX
2.6.1 Princípio teórico ... 17
2.6.2 Procedimento realizado ... 17
2.7 Análise de dados ... 19
3 Resultados e Discussão ... 21
3.1 Efeito dos extratos de tomilho laranja na viabilidade celular ... 21
3.1.1 Efeito da dose e do tempo de exposição em células HepG2 ... 21
3.1.2 Efeito da dose e do tempo de exposição em células Raw 264.7 ... 24
3.1.3 Efeito da dose e do tempo de exposição em células Caco-2 ... 27
3.2 Avaliação da morte celular usando o corante Trypan Blue ... 30
3.2.1 Avaliação da integridade membrana das células Raw 264.7 ... 31
3.2.2 Avaliação da integridade membrana das células Caco-2 ... 36
3.3 Efeito dos extratos de Tomilho Laranja na atividade anti-inflamatória ... 40
4 Conclusão ... 44
4.1 Conclusões gerais ... 44
4.2 Perspetivas futuras ... 45
X
Índice de figuras
Figura 1.1: Fotografia da espécie Thymus fragantissimus ... 8 Figura 2.1: Avaliação da atividade anti-inflamatória. Esquema representativo da adição
das soluções contendo os vários extratos, na ausência (sem LPS) e na presença de LPS (com LPS) às células. ... 18
Figura 3.1: Efeito dos extratos de tomilho laranja na viabilidade e proliferação das
células HepG2. Percentagem de redução de AB nas células HepG2, em função do tempo de exposição e da concentração de extrato. ... 22
Figura 3.2: Efeito dos extratos de tomilho laranja na viabilidade e proliferação das
células Raw 264.7. Percentagem de redução de AB nas células Raw 264.7, em função do tempo de exposição e da concentração de extrato. ... 25
Figura 3.3: Efeito dos extratos de tomilho laranja na viabilidade e proliferação das
células Caco-2. Percentagem de redução de AB nas células Caco-2, em função do tempo de exposição e da concentração de extrato. ... 28
Figura 3.4: Avaliação da morte celular pelo método de azul de tripano. Células Raw
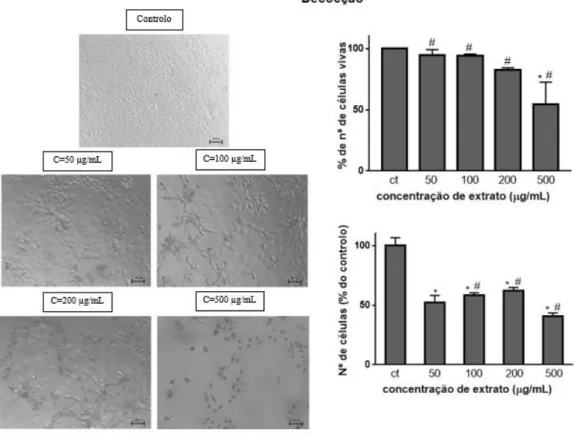
264.7 após a ação do extrato decocção por 24 h, aplicado em várias concentrações (painel da esquerda). Viabilidade celular, avaliada pelo nº de células coradas a azul e nº de células vivas em função da concentração de extrato. ... 32
Figura 3.5: Avaliação da morte celular pelo método de azul de tripano. Células Raw
264.7 após a ação do extrato infusão por 24 h, aplicado em várias concentrações (painel da esquerda). Viabilidade celular, avaliada pelo nº de células coradas a azul e nº de células vivas em função da concentração de extrato. ... 33
Figura 3.6: Avaliação da morte celular pelo método de azul de tripano. Células Raw
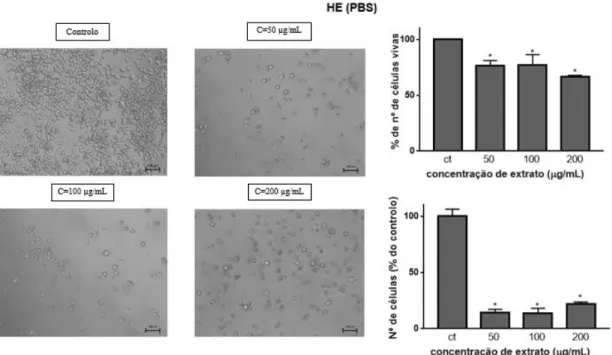
264.7 após a ação do extrato HE (PBS) por 24 h, aplicado em várias concentrações (painel da esquerda). Viabilidade celular, avaliada pelo nº de células coradas a azul e nº de células vivas em função da concentração de extrato. ... 34
Figura 3.7: Avaliação da morte celular pelo método de azul de tripano. Células Raw
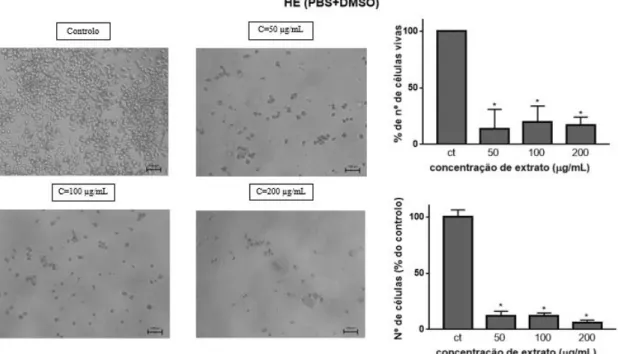
264.7 após a ação do extrato HE (PBS+DMSO) por 24 h, aplicado em várias concentrações (painel da esquerda). Viabilidade celular, avaliada pelo nº de células coradas a azul e nº de células vivas em função da concentração de extrato. ... 35
Figura 3.8: Avaliação da morte celular pelo método de azul de tripano. Células Caco-2
XI
esquerda). Viabilidade celular, avaliada pelo nº de células coradas a azul e nº de células vivas em função da concentração de extrato. ... 36
Figura 3.9 Avaliação da morte celular pelo método de azul de tripano. Células Caco-2
após a ação do extrato infusão por 24 h, aplicado em várias concentrações (painel da esquerda). Viabilidade celular, avaliada pelo nº de células coradas a azul e nº de células vivas em função da concentração de extrato. ... 37
Figura 3.10: Avaliação da morte celular pelo método de azul de tripano. Células
Caco-2 após a ação do extrato HE (PBS) por Caco-24 h, aplicado em várias concentrações (painel da esquerda). Viabilidade celular, avaliada pelo nº de células coradas a azul e nº de células vivas em função da concentração de extrato. ... 39
Figura 3.11: Avaliação da morte celular pelo método de azul de tripano. Células
Caco-2 após a ação do extrato HE (PBS+DMSO) por Caco-24 h, aplicado em várias concentrações (painel da esquerda). Viabilidade celular, avaliada pelo nº de células coradas a azul e nº de células vivas em função da concentração de extrato. ... 40
Figura 3.12: Ação inflamatória dos extratos. Células Raw 264.7 foram expostas a 3
concentrações dos extratos e calculou-se a quantidade de NO libertado pelo método de Griess. Os resultados estão apresentados como % de produção de NO, normalizado para o controlo em função da concentração de extrato. ... 41
XII
Índice de tabelas
Tabela 3.1: Valores de IC50 obtidos para as células HepG2, nas várias condições
indicadas ... 24
Tabela 3.2: Valores de IC50 obtidos para as células Raw 264.7, nas várias condições
indicadas ... 27
Tabela 3.3: Valores de IC50 obtidos para as células Caco-2, nas várias condições
XIII
Índice de equações
Equação 2.1: Fórmula de cálculo do rendimento (%) dos extratos secos ... 11 Equação 2.2: Percentagem de redução do Alamar Blue... 14 Equação 2.3: Cálculo dos valores de IC50 ... 16
XIV
Abreviaturas
AB Alamar Blue
Caco-2 Linha celular de adenocarcinoma do epitélio colon-retal humano (do inglês, human epethelial colorectal adenocarcinoma cell)
COX-2 Ciclo-oxigenase 2
DMEM Meio de cultura, Meio de Eagle modificado por Dulbecco (do inglês, Dulbecco's Modified Eagle Medium)
DMSO Dimetilsulfóxido (do inglês, dimethyl sulfoxide) FBS Soro fetal bovino (do inglês, fetal bovine serum)
HE Hidro-etanólico
HepG2 Linha celular derivada de um adenoma hepatocelular (do inglês human caucasian hepatocyte carcinoma)
IC50 Concentração que inibe 50% do crescimento celular
IL-1β Interleucina 1β
iNOS Sintase do óxido nítrico induzível (do inglês, Inducible nitric oxide synthase)
LPS Lipopolissacarídeo
NED N-(1-naftil)-etilenodiamina
NF-κB Fator nuclear kappa B (do inglês, nuclear factor kappa-light-chain-enchancer of activated B cells)
NO Óxido nítrico
OMS Organização Mundial de Saúde
PBS Tampão fosfato salino (do inglês, phosphate buffer saline)
Raw 264.7 Linha celular de macrófagos (do inglês, Mouse leukaemic monocyte macrophage cell line)
XV
TA Temperatura ambiente
TB Azul de tripano (do inglês, Trypan Blue)
TNF-α Fator de Necrose Tumoral Alfa (do inglês, tumor necrosis factor alpha)
Capítulo 1
2
1 Introdução
1.1 Uso de plantas na medicina
As plantas medicinais têm sido utilizadas desde há muito tempo na medicina tradicional e os seus efeitos curativos são reconhecidos desde a antiguidade (Amaral, Mira et al. 2009). Dados bibliográficos indicam que o uso terapêutico de plantas é muito antigo havendo relatos que remontam aos anos 4000 - 5000 a.C. (Hosseinzadeh, Jafarikukhdan et al. 2015). São um componente fundamental da evolução da investigação da indústria farmacêutica, que se centra no isolamento dos constituintes das plantas medicinais, como princípios bioativos para o posterior desenvolvimento de fármacos semissintéticos, sendo assim um recurso para novos fármacos e para muitos medicamentos da atualidade (Hoareau e Da Silva 1999, Hosseinzadeh, Jafarikukhdan et al. 2015).
A medicina tradicional, com recurso a plantas aromáticas, ainda hoje permanece como a fonte de tratamento mais facilmente acessível no sistema de prestação de cuidados primários de saúde de comunidades com poucos recursos, o que faz com que as pessoas locais tenham uma longa história de uso tradicional de plantas com fins medicinais. Em muitos países em desenvolvimento, uma grande proporção da população depende de práticas tradicionais à base de plantas medicinais para atender às necessidades de cuidados de saúde (Hosseinzadeh, Jafarikukhdan et al. 2015). A importância da pesquisa de medicamentos a partir de matrizes vegetais tradicionais foi reafirmada pela Organização Mundial de Saúde (OMS). Reconhecendo o facto de que os curandeiros tradicionais e sua farmacopeia constituem o núcleo básico dos cuidados de saúde primários em 90% das populações rurais nos países em desenvolvimento, a OMS tem vindo a promover investigações laboratoriais sobre as propriedades farmacológicas de plantas (Etkin 1981). Nos países desenvolvidos, o uso de plantas medicinais aumentou consideravelmente na segunda metade do século XX. Embora a medicina moderna possa existir lado a lado com a prática tradicional, os medicamentos à base de plantas mantiveram a sua popularidade por razões históricas e culturais (Hosseinzadeh, Jafarikukhdan et al. 2015). Desta forma, as plantas medicinais são a principal fonte natural de medicamentos utilizados quer em medicina tradicional quer por entidades químicas para a produção de medicamentos da atualidade (Tabassum and Ameen 2013).
De facto, os usos industriais das plantas medicinais são muitos e podem variar desde medicamentos tradicionais a chás de plantas bem como produtos farmacêuticos
3
produzidos industrialmente (Hoareau e Da Silva 1999). Isto deve-se ao facto de as plantas medicinais conterem combinações de vários compostos químicos com múltiplas atividades biológicas e de permitirem a síntese de compostos com base na composição e propriedades das plantas medicinais que permitem a sua extração e a caracterização para a descoberta de novos fármacos com alto valor terapêutico (Huie 2002, Tabassum e Ameen 2013). Assim, os produtos naturais descobertos a partir de plantas medicinais (e seus derivados) constituem a base química de numerosos medicamentos clinicamente utilizados (Balunas e Kinghorn 2005).O valor medicinal da planta depende da presença de diferentes componentes fitoquímicos (taninos, alcaloides, terpenóides e compostos fenólicos) que produzem um efeito fisiológico particular no corpo humano (Tabassum e Ameen 2013).
O processo geralmente começa com a identificação da planta de interesse e sua colheita. A partir do material vegetal são preparados extratos, que são submetidos a rastreio biológico em ensaios farmacologicamente relevantes, tais como ensaios de toxicidade, ação farmacológica, ação antimicrobiana, entre outras (Baker e Baker 1992, Balunas e Kinghorn 2005).
Algumas características desejáveis das plantas medicinais são a sua eficácia e baixo risco de uso, além de fatores económicos, com fácil disponibilidade e com menos efeitos colaterais do que os compostos sintéticos (Arnous, Santos et al. 2005, Srancikova, Horvathova et al. 2013, Hosseinzadeh, Jafarikukhdan et al. 2015).
Mesmo com todos os desafios que enfrentam, a descoberta de compostos ativos a partir de plantas medicinais e seus produtos isolados podem continuar a ser um componente essencial no desenvolvimento de novos medicamentos (Balunas e Kinghorn 2005).
1.1.1 Efeito das plantas medicinais na inflamação
Desde a antiguidade, em várias comunidades, países e culturas de todo o mundo, distúrbios inflamatórios e doenças relacionadas têm sido tratados com plantas ou extratos derivados de plantas. No entanto, embora a atividade anti-inflamatória de vários extratos de plantas e compostos isolados já se encontre vastamente descrita na literatura (e.g. ácido acetilsalicílico, comercializado sob o nome de Aspirina, foi inicialmente extraído do salgueiro Salix alba L.), para muitas das plantas em uso, a eficácia real e os princípios ativos relevantes são desconhecidos. Consequentemente, estudos experimentais
4
destinados a demonstrar as propriedades farmacológicas dessas plantas e a identificação dos princípios ativos relevantes são necessários (Mueller, Hobiger et al. 2010, Falcão, Lima et al. 2005).
A inflamação (ou processo inflamatório) é uma resposta protetora normal induzida por lesão tecidual ou infeção, para combater invasores no corpo e para remover células hospedeiras mortas ou danificadas (Miguel 2010). É, por isso, um mecanismo de defesa crucial dos organismos contra agentes patogénicos invasores e lesões teciduais, desempenhando um papel importante em várias doenças (Ghosh, Hong et al. 2014, Mueller, Hobiger et al. 2010). Durante o processo inflamatório as células libertam vários mediadores de inflamação com o objetivo de sinalização nas células do sistema imunitário e de reparação tecidular.
O óxido nítrico (NO) é libertado por vários tipos de células em várias situações, nomeadamente durante processos inflamatórios. O NO medeia muitas funções fisiológicas, nomeadamente a inflamação e, por isso, é comum ser investigado sob muitas condições fisiopatológicas diferentes (Giustarini, Rossi et al. 2008). É um agente oxidante altamente reativo, uma molécula com tempo de meia-vida curto, que reage rapidamente com oxigénio livre, radicais de oxigénio, metais redox e hemoglobina oxigenada. O NO é produzido enzimaticamente pela sintase do óxido nítrico (NOS), havendo várias isoformas desta enzima, estando a iNOS (óxido nítrico sintase induzida) expressa nas células do sistema imunitário, participando em diversos mecanismos biológicos sendo um potente mediador pró-inflamatório (Guevara, Iwanejko et al. 1998, Jang, Choi et al. 2016). Desta forma, ensaios que indicam/quantificam a presença de NO (direta ou indiretamente) são muito utilizados, em particular, ensaios que avaliem a acumulação dos produtos estáveis de degradação de NO, tais como nitrito (NO2-) e nitrato (NO3-), uma
vez que o NO é um gás altamente instável (Giustarini, Rossi et al. 2008, Ghosh, Hong et al. 2014). Estes compostos representam os produtos finais das vias de oxidação do NO e, consequentemente, a sua concentração nos fluidos corporais humanos depende da própria produção de NO (Giustarini, Rossi et al. 2008). A produção excessiva de NO, especialmente por macrófagos, está associada à patogénese de diversas doenças que têm a inflamação como fator comum, tais como citotoxicidade, tumores e doenças autoimunes.
O NO é sintetizado através da desaminação oxidativa da ʟ-arginina pela enzima iNOS (Ghosh, Hong et al. 2014). A iNOS está presente em níveis reduzidos em condições
5
fisiológicas, no entanto, é rapidamente induzida por estímulos pró-inflamatórios, incluindo LPS (lipopolissacarídeo) (Jang, Choi et al. 2016).
Assim, o modelo normalmente usado para investigar a inflamação induzida é a estimulação de macrófagos por LPS (Jang, Choi et al. 2016). O LPS, uma endotoxina sintetizada por bactérias Gram negativas, é capaz de ativar macrófagos, estimulando a produção de citocinas inflamatórias (Miguel 2010). A ligação do LPS aos seus recetores, ativa várias cascatas de sinalização que impulsionam a expressão e libertação de mediadores e citocinas pró-inflamatórias, incluindo o NO (Jang, Choi et al. 2016).
Os macrófagos estão distribuídos por todo o corpo e desempenham um papel crucial em ambos os mecanismos de defesa do hospedeiro e inflamação (Ghosh, Hong et al. 2014). São células importantes do sistema imunitário que desempenham um papel importante na resposta inflamatória. O LPS liga-se a um recetor na superfície dos macrófagos (o toll-like receptor 4), que induz a ativação da via de sinalização NF-κB. NF-κB é um fator de transcrição nuclear (génica) importante e a sua ativação desempenha um papel vital na indução de várias enzimas e secreção de vários mediadores pró-inflamatórios tais como iNOS, COX-2, TNF-α e IL-1β (Ghosh, Hong et al. 2014).
1.2 Plantas da família Lamiaceae, género Thymus L.
1.2.1 Caracterização do género Thymus L.
A família Lamiaceae engloba um grande grupo de géneros de plantas que contêm quantidades substanciais de compostos fenólicos. A evidência experimental sugere que a maioria das plantas aromáticas e especiarias, especialmente as pertencentes a esta família, possuem uma ampla gama de atividades biológicas e farmacológicas (Aherne, Kerry et al. 2007).
Dentro da família Lamiaceae, o género Thymus L. (tomilhos) encontra-se amplamente distribuído no Mundo sendo a região mediterrânica descrita como o centro de ocorrência do género. O género Thymus L. engloba mais de trezentas espécies. Na Península Ibérica encontram-se 35 espécies, das quais 24 são endémicas da região. (Stahl-Biskup e Sáez 2003, Figueiredo, Barroso et al. 2008). Onze espécies de Thymus, totalizando catorze taxa, ocorrem em Portugal. Estes taxa pertencem a cinco das oito secções deste género (Figueiredo, Barroso et al. 2008).
As numerosas atividades farmacológicas descritas e atribuídas aos tomilhos são devidas a uma variedade de compostos, produtos do seu metabolismo secundário que se
6
acumulam em várias zonas das plantas. Os óleos essenciais, têm como constituintes principais os terpenos como timol, carvacrol, ƿ-cimeno, γ-terpineno, cariofileno, linalol e borneol. Alguns dos seus efeitos foram descritos como antibacterianos, antivirais, antifúngicos, inflamatórios, anticancerígenos, hipertensivos, antioxidantes, anti-tumorais, pró-apoptóticos e anti-proliferativos (de Oliveira, de Jesus Viegas et al. 2017).
Além dos terpenos extraídos nos óleos essenciais, este género é também caracterizado pela presença de diversos compostos fenólicos cuja atividade biológica tem vindo a ser descrita. Estes compostos fenólicos podem ser extraídos usando diversos solventes, sendo os de uso mais tradicional a água (extratos aquosos), na forma de infusões e decocções. Muitas das propriedades biomédicas são atribuídas a infusões, decocções e aos óleos essenciais preparados e obtidos a partir das partes aéreas dos Thymus, devido às suas atividades tónicas, digestivas, antiespasmódicas, carminativas, sedativos, antimicrobianas, antioxidantes, antivirais, anti-mutagénicas, anti-tumorais anti-inflamatórias e expetorantes (Aherne, Kerry et al. 2007, Nikolić, Glamočlija et al. 2014). Desta forma, ao longo da história, as partes aéreas e os componentes voláteis das espécies de Thymus foram altamente recomendados (Nikolić, Glamočlija et al. 2014).
Assim, os tomilhos têm uma longa história de uso na medicina tradicional para o tratamento de várias doenças, como por exemplo, para tratar doenças respiratórias (tosse convulsa, bronquite e asma), usados na forma de chá, pomada, tintura, xarope ou por inalação de vapor. Também são usados para prevenir o endurecimento das artérias, no tratamento de dor de dentes, infeções do trato urinário e dispepsia (Tabassum e Ameen 2013).
De um modo geral, o tomilho é uma planta aromática utilizada para fins medicinais e condimentares em quase todo o mundo (Stahl-Biskup and Sáez 2003). As propriedades aromáticas e medicinais do tomilho tornaram-no uma das plantas mais populares (Nikolić, Glamočlija et al. 2014).
1.2.2 Caracterização do Thymus vulgaris L.
Thymus vulgaris L. é uma planta oriunda da Europa, África e Ásia pertencente à família Lamiaceae, (Tabassum e Ameen 2013, Nikolić, Glamočlija et al. 2014). É uma planta com folhas pequenas, altamente aromáticas, cinza-esverdeado e cachos de flores roxas ou cor-de-rosa no início do verão (Hosseinzadeh, Jafarikukhdan et al. 2015).
7
O tomilho vulgar é vastamente utilizado na medicina popular no tratamento de várias doenças, além disso, é uma espécie bem conhecida do género Thymus, amplamente estudada pelas suas propriedades químicas e biológicas (Nikolić, Glamočlija et al. 2014). O potencial medicinal do tomilho vulgar é devido à presença de diversos compostos fenólicos e seus derivados, como por exemplo o ácido rosmarínico e a luteolina, e óleos essenciais, contendo várias moléculas bioativas, tais como timol, carvacrol, eugenol, o que lhe permite ter inúmeros efeitos valiosos, tais como antiespasmódicos, bactericidas, antissépticos, antioxidantes e recentemente foi recomendado como agente de prevenção do cancro (Tabassum e Ameen 2013). Estudos mostram que os óleos essenciais analisados de T. vulgaris L. eram ricos em timol (cerca de 22,11% a 38,45%) acompanhados dos seus precursores biogénicos γ-terpineno e pimínio, tendo baixo conteúdo de carvacrol que variou entre 1,13% e 1,87% (Zambonelli, D'Aulerio et al. 2004).
A capacidade desta planta para conferir resultados farmacológicos/ microbiológicos é principalmente devida à presença de compostos fenólicos como taninos, flavonoides e saponinas (Amirghofran, Hashemzadeh et al. 2011).
1.2.3 Thymus fragantissimus, um hibrido do Thymus vulgaris L.
Thymus L. é um género com elevada taxa de hibridação. A hibridação é comum quando duas ou mais espécies coabitam o mesmo habitat (Stahl-Biskup and Sáez 2003, Figueiredo, Barroso et al. 2008). De mais de cinquenta híbridos descritos na Península Ibérica, cinco deles ocorrem em Portugal (Figueiredo, Barroso et al. 2008). De entre estes híbridos, encontra-se o Thymus fragantissimus, um híbrido do Thymus vulgaris L., caracterizado pelo seu aroma a laranja, também classificado como Thymus vulgaris ssp. fragantissimus ou Thymus vulgaris cv. fragantissimus, e sobre o qual existe muito pouca informação relativa a composição química e bioatividades.
O tomilho laranja é uma planta perene de baixa estatura (20 a 30 cm de altura), resistente à seca e de fácil cuidado. As folhas cinza-esverdeadas são extremamente perfumadas com um odor a laranja. É popular pelas suas propriedades antibacterianas e antissépticas. É usado na preparação de infusão, utilizadas para tratar dor de garganta e tosse, bem como para melhorar as funções gerais do sistema imunológico. É usado em
8
preparações na forma de loção antisséptica, ou pomada para infeções cutâneas e queimaduras1 .
No entanto, as propriedades biológicas e terapêuticas desta planta ainda não se encontram extensamente descritas na literatura, sendo muito escassas. Contudo, dado o grande potencial de outras espécies de Thymus, prevê-se que apresente propriedades semelhantes às restantes espécies da mesma família, nomeadamente potencial anti-proliferativo e anti-inflamatório e consequentemente um elevado potencial biomédico. Além disso, dado que esta espécie, pelo seu aroma a laranja, tem sido introduzida na culinária e na preparação de infusões, o estudo da sua bioatividade torna-se prioritário.
Assim, neste trabalho, foram utilizadas duas linhas celulares humanas (Caco-2 e HepG2) e uma linha celular de murino (Raw 264.7) com o objetivo de explorar o efeito bioativo de extratos de tomilho laranja, nomeadamente avaliar o efeito anti-proliferativo e/ou citotóxico de extratos aquosos e hidro-etanólicos e posteriormente avaliar o potencial anti-inflamatório dos extratos usando macrófagos (células Raw 264.7).
Nome Comum: Tomilho laranja
Espécie: Thymus vulgaris ssp. fragantissimus Género: Thymus L.
Família: Labiatae (Lamiaceae) Ordem: Lamiales
Classe: Magnoliopsida Subclasse: Lamiidae Divisão: Spermatophyta
Subdivisão: Magnoliophytina (Angiospermae) Reino: Plantae
Domínio: Eucária
1 http://www.seedaholic.com/thymus-fragrantissimus-orange-thyme.html
Figura 1.1: Fotografia da espécie Thymus
9 1.3 Objetivos
O principal objetivo deste trabalho foi explorar o efeito bioativo de extratos de tomilho laranja, obtidos a partir das partes aéreas (essencialmente folhas, flores e pequenos ramos das extremidades) da planta liofilizada e moída. Neste trabalho usaram-se:
• extratos aquosos (decocção e infusão), • extratos hidro-etanólicos.
Em particular, pretendeu-se:
1) Avaliar o efeito anti-proliferativo e/ou citotóxico de extratos aquosos e hidro-etanólicos, usando:
• os métodos de viabilidade celular: Alamar Blue e Azul de Tripano • as linhas celulares humanas: Caco-2 e HepG2; e de murino: Raw 264.7; 2) Avaliar o potencial anti-inflamatório dos extratos, usando macrófagos (células Raw 264.7);
3) Correlacionar os efeitos observados com a dose, tempo de exposição e tipo de células;
4) Perspetivar potenciais aplicações biomédicas para esta variedade de planta medicinal;
Capítulo 2
11
2 Material e Métodos
2.1 Origem do material vegetal
As partes aéreas da planta de Thymus vulgaris spp. fragantissimus foram fornecidos pela ERVITAL (Mezio, Castro Daire, Portugal). A planta foi cultivada por meio de agricultura biológica e foi colhida aleatoriamente em Julho de 2016. A identidade da planta foi confirmada pelo Prof. Dr. J. Paiva (Departamento de Botânica, Universidade de Coimbra, Portugal) e pelo Prof. Dr. António Crespi (Departamento de Biologia e Ambiente, UTAD).
2.2 Obtenção dos extratos
Para a realização deste trabalho foi necessário, a partir das partes aéreas da planta tomilho laranja (folhas e pequenos caules), proceder à obtenção de extratos. O material recolhido foi congelado durante 3 dias e liofilizado (modelo do sistema FTS Dura-Dry MP, Stone Ridge, EUA). Cada amostra foi então reduzida a um pó seco e fino. O material (em pó) resultante foi armazenado num recipiente hermético e mantido em local fresco, escuro e seco até a preparação dos extratos hidro-etanólicos e aquosos (decocção e infusão).
As preparações obtidas foram liofilizadas e armazenadas à temperatura ambiente (TA) até serem dissolvidas para serem utilizadas nos ensaios de bioatividade.
O rendimento (R; %) dos extratos secos foi calculado utilizando a seguinte fórmula:
R(extrato) =P1 x 100 P2
Equação 2.1: Fórmula de cálculo do rendimento (%) dos extratos secos
Em que P1 refere-se ao peso do extrato após liofilização, para remoção do solvente, e P2 é o peso do material vegetal (pó da planta) usado para realizar o extrato, tal como descrito na literatura (Guimarães, Barros et al. 2013).
2.2.1 Decocção
A 0,5 g de material vegetal liofilizado foi adicionado 150 mL de água destilada à TA. Levou-se à ebulição e deixou-se ferver durante 10 minutos e de seguida foi deixada
12
em repouso a arrefecer à TA. A preparação foi posteriormente filtrada através de um filtro Watmann nº 4 antes da filtração com um filtro de fibra de vidro. A preparação foi então evaporada sob pressão reduzida (Guimarães, Barros et al. 2013).
Aquando a utilização do extrato para a realização do trabalho este foi pesado e dissolvido em PBS, num microtubo de centrífuga, com uma concentração final de 10 mg/mL.
2.2.2 Infusão
A 0,5 g de material liofilizado foi adicionado 150 mL de água destilada a ferver. A mistura foi deixada em repouso a arrefecer à TA. A preparação foi filtrada através de um filtro Watmann nº 4 e, de seguida, filtrada num filtro de fibra de vidro. A preparação foi então evaporada sob pressão reduzida (Guimarães, Barros et al. 2013).
Aquando a utilização do extrato para a realização do trabalho este foi pesado e dissolvido em PBS, num microtubo de centrífuga, com uma concentração final de 10 mg/mL.
2.2.3 Hidro-etanólico (HE)
O extrato HE foi obtido a partir do material vegetal liofilizado. A amostra de 0,5 g foi extraída três vezes por agitação a 150 rpm durante 1 h com 50 mL de etanol (EtOH) e H2O (80:20 v/v) a 25 °C. As amostras foram então centrifugadas a 7000 g (centrifuga
Sigma 3-30K, Osterode, Germany) durante 5 minutos à TA. Subsequentemente, as amostras foram filtradas através de um filtro Watmann nº 4 e, em seguida, num filtro de fibra de vidro. Os extratos combinados foram evaporados a 40 °C num evaporador rotativo até à secura, tal como descrito por Guimarães, Barros et al (2013).
Inicialmente, o extrato, quando utilizado, foi pesado e armazenado num microtubo de centrífuga dissolvido em PBS com uma concentração final de 10 mg/mL. Após se verificar que havia formação de precipitados, optou-se por dissolver o extrato de duas formas: numa solução de PBS e numa solução de PBS com DMSO (50:50 v/v), ambos com uma concentração final de 20 mg/mL.
O rendimento (em %, m/m) da decocção, infusão e dos extratos hidro-etanólicos foi de 21,00 ± 1,54 %, 24,54 ± 0,53 % e 22,92 ± 1,10 %, respetivamente.
13 2.3 Cultura de células
2.3.1 Linhas celulares
Neste trabalho foram utilizadas três linhas celulares, HepG2 (linha derivada do carcinoma hepatocelular humano; ATCC, Rockville, MD, USA), a Caco-2 (linha derivada de adenocarcinoma do colon humano; CLS, Eppelheim, Alemanha) e a Raw 264.7 (mouse leukaemic monocyte macrophage cell line, CLS, Eppelheim, Alemanha). As linhas celulares foram mantidas em meio de cultura completo (ver secção 2.3.2), numa incubadora (Binder) a 37 °C com 5 % de CO2 / 95 % de ar, no Laboratório de Bioquímica
e Biologia Celular do Departamento de Biologia e Ambiente da Universidade Trás-os-Montes e Alto Douro (DeBA-UTAD). Para prevenir qualquer contaminação bacteriana, fúngica ou viral, as células foram manipuladas em condições assépticas numa câmara de fluxo laminar, classe I (Faster, BH-En 2004), tal como previamente descrito em Andreani, Kiill et al (2014) e Severino, Andreani et al (2014).
2.3.2 Meios de cultura
O meio de cultura celular destina-se à manutenção e crescimento das células, é composto por uma solução base definida, que inclui sais, açúcares, aminoácidos, vitaminas e por uma variedade de suplementos, tais como: soros (havendo disponíveis comercialmente de várias espécies animais) e fatores de crescimento, de forma a permitir o crescimento adequado dos modelos celulares, e antibióticos de forma a impedir o crescimento de microrganismos que destroem as culturas celulares (Hartung, Balls et al. 2002).
Uma vez que foram utilizadas linhas celulares diferentes, foi necessário utilizar dois meios de cultura também diferentes. O meio de cultura completo era composto pelo meio base DMEM (Dulbecco's Modified, Eagle Medium, no caso das células Caco-2 e HepG2) ou RPMI (Roswell Park Memorial Institute Medium, no caso das células Raw 264.7), aos quais foi adicionado 10 % (v/v) de soro fetal bovino, FBS (Gibco, Life Technologies), 2,0 mM de L-glutamina (Gibco, Life Technologies) e antibióticos (200 U/mL de penicilina e 200 μg/mL de estreptomicina, (Gibco, Life Technologies)). O meio de cultura sem soro (FBS-free) tinha composição idêntica ao acima descrito, mas não teve adição de FBS. Os meios de cultura foram preparados sempre que necessário e foram armazenados no frigorífico a 4°C.
14 2.4 Testes de viabilidade celular – Método de Alamar Blue (AB)
2.4.1 Princípio teórico
O corante Alamar Blue (AB) tem sido amplamente utilizado como um indicador de viabilidade celular em vários tipos de ensaios de proliferação e citotoxicidade. A quantificação da viabilidade celular baseia-se na redução da resazurina (7-hidroxi-3H-fenoxazin-3-ona 10-óxido) e está correlacionada com o número de organismos vivos (Borra, Lotufo et al. 2009).
Este método apresenta várias vantagens, tais como rapidez, confiabilidade, sensibilidade, segurança e custo. Além disso, mantém as células intactas, uma vez que não é tóxico para as células e não requer a morte celular, permitindo assim outras análises paralelas (O'brien, Wilson et al. 2000, Borra, Lotufo et al. 2009). Além do referido, este é permeável através da membrana celular, permitindo assim monitorização contínua das células em cultura (Rampersad 2012).
A resazurina é um corante azul não fluorescente que é reduzido a resorufina, cor-de-rosa e fluorescente (Rampersad 2012). Quando adicionado às células, a forma oxidada do AB entra no citosol e é convertida na sua forma reduzida pela atividade enzimática mitocondrial, aceitando eletrões. Esta reação é acompanhada pela mudança de cor do meio de cultura (Al-Nasiry, Geusens et al. 2007).
A mudança do estado oxidado para o reduzido permite uma fácil deteção, onde as medições podem ser quantitativas ou qualitativas, como uma mudança visível na cor indicando presença ou ausência de células viáveis (Rampersad 2012). O nível de redução pode ser quantificado por absorção no visível utilizando filtros apropriados, uma vez que a resazurina apresenta um pico de absorção a 620 nm e a resorufina a 570 nm (Borra, Lotufo et al. 2009).
Assim, o número de células viáveis correlaciona-se com a magnitude da redução do corante e é expresso como percentagem da redução de AB. Este cálculo, de acordo com o protocolo do fabricante, é realizado da seguinte forma:
% 𝑑𝑒 𝑟𝑒𝑑𝑢çã𝑜 𝑑𝑒 𝐴𝐵 = (𝜀𝑜𝑥𝜆2)(𝐴𝜆1) − (𝜀𝑜𝑥𝜆1)(𝐴𝜆2)
(𝜀𝑟𝑒𝑑𝜆1)(𝐴´𝜆2) − (𝜀𝑟𝑒𝑑𝜆2)(𝐴´𝜆1)× 100
Equação 2.2: Percentagem de redução do Alamar Blue
Na fórmula, ελ1 e ελ2 são constantes que representam o coeficiente de extinção
15
Aλ1 e Aλ2 representam a absorvência das amostras de teste a 570 e 620 nm,
respetivamente. A'λ1 e A'λ2 representam a absorvência das amostras do controlo negativo
a 570 e 620 nm, respetivamente. Os valores de percentagem de redução de AB foram corrigidos para valores de fundo de controlo negativo contendo meio sem células (Al-Nasiry, Geusens et al. 2007, Andreani, Kiill et al. 2014).
2.4.2 Procedimento realizado
Para a análise da viabilidade celular foram utilizadas células HepG2, Caco-2 e Raw 264.7 preparadas como descrito na literatura (Andreani, Kiill et al. 2014, Severino, Andreani et al. 2014). Sumariamente, as células HepG2 e Caco-2, que crescem aderentes, foram expostas a tripsina e as células Raw 264.7 foram removidas dos frascos com o auxílio de um raspador de células, de forma a colocar as células em suspensão. As suspensões de células foram contadas, com o auxílio de um contador automático (TC10 automated cell counter; BIO-RAD, Portugal). As células foram diluídas em meio de cultura com soro e depositadas em caixas de cultura de 96 poços com densidade de 5×104 células/mL (100 μL/ poço = 5x103 células /poço).
As células foram deixadas na incubadora a 37 °C com 5 % CO2 / 95 % de ar,
durante cerca de 24 horas para estabilizarem e aderirem às placas. Ao fim deste tempo, prepararam-se as soluções a testar, a partir de soluções stock, com concentrações finais de 50, 100, 200 e 500 µg/mL. Retirou-se o meio de cultura e 100 µL das soluções preparadas anteriormente, foram adicionados por poço. As células foram expostas ao extrato durante 24 e 48 horas (em quadriplicados) e cada ensaio foi realizado em triplicado. Ao fim deste tempo, as soluções dos extratos foram removidas e foram adicionados 100 µL de solução de Alamar Blue (Invitrogen, Alfagene, Portugal). Esta solução foi preparada previamente adicionando resazurina ao meio de cultura sem soro (10% v/v). Após um período de cerca de 4 horas foi medida a absorvência a 570 e 620 nm num espetrofotómetro de microplacas (LabSystems original Multiskan EX) e os resultados analisados utilizado o software Microsoft ® Excel 2016.
Para completar os resultados obtidos, foi também realizado o cálculo dos valores de IC50 (concentração que inibe 50% do crescimento celular), através da equação da curva
de tendência (logarítmica), obtida a partir de um gráfico em que ao eixo dos xx correspondem as concentrações de extrato testadas e ao eixo dos yy correspondem os respetivos valores de percentagem de redução de AB.
16
𝑦 = 𝑚𝑙𝑛𝑥+ 𝑏
Equação 2.3: Cálculo dos valores de IC50
Em que m e b são obtidos a partir da equação da curva de tendência, y é o valor da % de redução pretendida, ou seja 50%, e lnx é o logaritmo do valor de concentração que se
pretende calcular.
2.5 Indicador de morte celular – Método Trypan Blue (TB)
2.5.1 Principio teórico
A análise da viabilidade celular é uma ferramenta útil em vários procedimentos experimentais, incluindo quando se pretende analisar a morte celular espontânea após a submissão a determinadas condições experimentais.
Foi estabelecido que a integridade da membrana celular é um critério básico para distinguir células mortas de células vivas. Assim, corantes capazes de penetrar seletivamente o citoplasma de células mortas têm sido amplamente utilizados como corantes vitais e de morte celular espontânea após submissão a diferentes condições experimentais.
O método do Trypan Blue (TB) é um teste muito comum para avaliar a citotoxicidade em investigações experimentais, onde as células mortas absorvem TB no citoplasma devido à perda de seletividade da membrana, enquanto as células vivas permanecem não coradas.
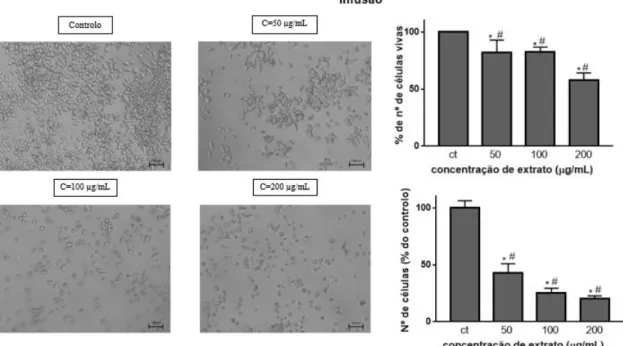
Assim, o número relativo de células mortas e vivas é obtido por microscopia ótica contando o número de células coradas (mortas) e não coradas (vivas) usando uma câmara de Neubauer (Avelar-Freitas, Almeida et al. 2014).
2.5.2 Procedimento realizado
Uma vez que uma reduzida percentagem de redução de AB pode dever-se a vários fatores, como inibição do crescimento celular ou alteração do seu metabolismo, e não apenas a morte celular, foi realizada a análise da morte celular utilizando o corante Trypan Blue (TB) (Trypan Blue 0.4% Solution – Lonza)
Para preparar o reagente, ao TB foi adicionado PBS (4% v/v). Após a análise da viabilidade celular, descrita anteriormente, apenas numa linha da placa, foram retirados
17
os 100 µL de solução contendo AB e foram adicionados 60 µL/poço de solução de TB. Ao fim de cerca de 7 minutos, e com o objetivo de facilitar a visualização das células que se encontram coradas ao microscópio, foram retirados os 60 µL de solução de TB e foram adicionados 100 µL/poço de PBS. Procedeu-se à visualização e captura de imagens das células, utilizando o microscópio e com recurso a uma câmara. Para a contagem celular escolheram-se campos homogéneos, de forma a garantir uma uniformidade, e contou-se o número total de células e o número de células coradas de azul (positivas para o Azul de tripano), e calculou-se a diferença entre estas duas contagens (números de células vivas).
2.6 Atividade Anti-Inflamatória – Reagente de Griess
2.6.1 Princípio teórico
A inflamação é uma resposta protetora, normal no organismo, importante em várias doenças (Ghosh, Hong et al. 2014). O NO é um mediador de muitas funções fisiológicas, sendo, ensaios que indicam a sua presença muito utilizados (Giustarini, Rossi et al. 2008).
Os métodos colorimétricos baseados na reação de Griess visam, fundamentalmente, detetar NO2- que, em condições ácidas, reage com sulfanilamida e
NED (N-(1-naftil)-etilenodiamina) para produzir um composto azo, que absorve fortemente na região visível com um pico em torno de 545 nm (Giustarini, Rossi et al. 2008).
2.6.2 Procedimento realizado
Para a análise da atividade anti-inflamatória foram utilizadas células Raw 264.7. Estas células foram depositadas em placas de cultura de 96 poços, à densidade de 5×104 células/mL (100 μL/ poço = 5x103 células/poço). As células foram deixadas na
incubadora a 37 °C com 5 % CO2 / 95 % de ar, durante cerca de 24 horas para
estabilizarem e aderirem à placa. ao fim deste tempo, foram expostas aos extratos. Foram adicionados 100 µL/poço das soluções que contém o extrato com e sem LPS de acordo com o esquema representado na Figura 2.1. As células foram incubadas durante 24 h.
18
Figura 2.1: Avaliação da atividade anti-inflamatória. Esquema representativo da adição das
soluções contendo os vários extratos, na ausência (sem LPS) e na presença de LPS (com LPS) às células. A, B e C correspondem aos extratos obtidos por Decocção, extração HE e Infusão, respetivamente. CT corresponde ao controlo. 1, 2 e 3 correspondem às concentrações de 10, 20 e 30 µg/mL, respetivamente.
As soluções foram preparadas do seguinte modo. A solução de LPS foi preparada por diluição de LPS (concentração final: 1 µg/mL) em DMEM sem soro. Várias soluções contendo os extratos, à concentração final de 10, 20 e 30 µg/mL (apenas foram analisados os extratos aquosos e o extrato HE (PBS+DMSO)) foram preparadas em DMEM sem soro, na presença e na ausência de LPS. A escolha das concentrações utilizadas resultou da análise da viabilidade celular, tendo-se verificado que estas concentrações não são toxicas para as células.
Para a quantificação do NO utilizou-se o método de Griess. O reagente de Griess é uma junção de duas soluções: solução de sulfanilamida e solução de NED na proporção 1:1. A solução de sulfanilamida é composta por 1% de sulfanilamida e ácido fosfórico a 5%. A solução de NED é composta por 0,1% de NED e H2O (Queiroz, Oppolzer et al.
2017).
Construiu-se uma curva de calibração de nitrito, diluindo NaNO2 (0,1 M) em
DMEM a várias concentrações. As diferentes concentrações foram preparadas numa placa de 96 poços, adicionando 100 µL da solução de NaNO2 + DMEM na primeira linha.
Deste poço, foram retirados 50 µL da solução e adicionados 50 µL de DMEM. O processo repetiu-se de forma que a concentração de NaNO2 de cada linha fosse metade da
concentração de NaNO2 da linha anterior. No final, na última linha, apenas foi colocado
19
volume de reagente de Griess, deixou-se incubar no escuro durante 15 minutos, e leu-se a absorvência.
No final da incubação das células com os extratos (na presença e na ausência de LPS), que durou 24 h, quantificou-se o NO libertado para o sobrenadante. Com o auxílio de uma pipeta multicanal, retirou-se 50 µL do sobrenadante de cada poço para uma nova placa de 96 poços, e adicionou-se 50 µL de reagente de Griess a cada poço. Agitou-se e deixou-se incubar 15 minutos no escuro, ao fim deste tempo, leu-se a absorvência a 540 nm num leitor de microplacas (LabSystems original Multiskan EX). Os valores de NO foram calculados por interpolação à reta de calibração calculada anteriormente.
2.7 Análise de dados
A análise estatística foi realizada com recurso ao software GraphPad Prism® (versão 7.00, GraphPad Software, San Diego, CA, EUA). As comparações entre diferentes grupos de exposições experimentais, foram realizados com uma ANOVA bidirecional seguido do teste de comparação múltipla (Tukey´s). Cada valor experimental foi comparado ao seu controlo e às restantes concentrações, com o mesmo tempo de exposição, bem como com a respetiva concentração a tempo diferente de exposição. A significância dos testes foi aceite quando a probabilidade do resultado assumindo a hipótese nula (p) foi inferior a 0,05. Contudo, de acordo com os resultados da análise estatística outros níveis de significância podem ser indicados, tais como 99% (p<0,01) ou 99,9% (p<0,001). Com recurso ao software Microsoft ® Excel 2016 também foram calculados os valores de toxicidade de IC50.
Capítulo 3
Resultados e
Discussão
21
3 Resultados e Discussão
3.1 Efeito dos extratos de tomilho laranja na viabilidade celular
Um dos objetivos do trabalho foi determinar o efeito dos três extratos de tomilho laranja na viabilidade celular de células HepG2, Caco-2 e Raw 264.7, em função do tempo de exposição (24 e 48 horas) e da concentração de extrato utilizado (50, 100, 200 e 500 µg/mL), utilizando o indicador de viabilidade Alamar Blue. Assim, procedeu-se à exposição destas células às várias concentrações de extratos durante 24 ou 48 h, seguindo-se a determinação da viabilidade celular. Em todos os ensaios, células não expostas a extratos mas manuseadas do mesmo modo forma usadas como controlo. Os resultados de viabilidade celular serão apresentados em termos de percentagem do controlo, isto é, tomando a viabilidade das células não expostas a extrato (e sujeitas às mesmas condições de crescimento) como sendo 100%.
Pretendeu-se aferir, através da percentagem da redução do Alamar Blue (AB), se a exposição das células às diferentes concentrações de extrato altera o seu crescimento, em comparação com células não expostas (controlo).
3.1.1 Efeito da dose e do tempo de exposição em células HepG2
Os resultados obtidos após exposição das células HepG2 aos três extratos encontram-se na Figura 3.1. Embora as diferenças sejam pouco notórias, é possível verificar que, de um modo geral, a percentagem de redução de AB diminui em função da concentração de extrato e em função do tempo de exposição ao mesmo.
Em termos de análise estatística, em relação aos dados obtidos ao fim de 24 horas de exposição ao extrato, na decocção, nenhuma das concentrações aplicadas apresentam diferenças significativas entre si (p>0,05). Após exposição ao extrato HE (PBS) existem diferenças significativas entre 50 e 500 µg/mL (p=0,0006) e 100 e 500 µg/mL (p=0,0052). Nos resultados de exposição ao extrato HE (PBS+DMSO) existem diferenças significativas entre 50 e 200 µg/mL (p<0,0001), 50 e 500 µg/mL (p<0,0001), 100 e 200 µg/mL (p=0,0218), 100 e 500 (p<0,00019 e 200 e 500 µg/mL (p<0,0001). Nos resultados da infusão existem diferenças entre 50 e 500 µg/mL (p<0,0001) e 100 e 500 µg/mL
22
(p<0,0001). Entre as restantes concentrações as diferenças não são estatisticamente significativas (p>0,05).
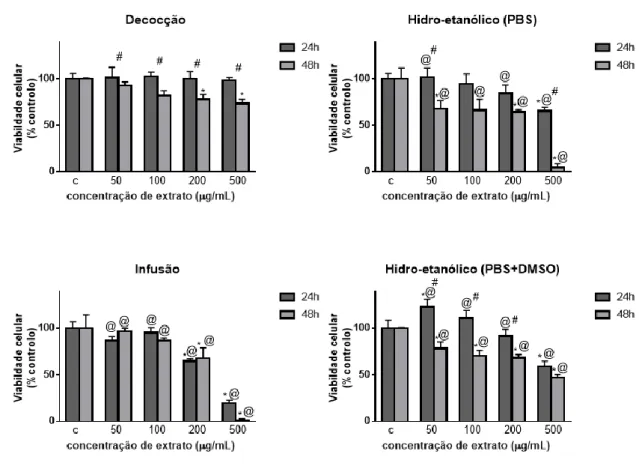
Figura 3.1: Efeito dos extratos de tomilho laranja na viabilidade e proliferação das células HepG2.
Percentagem de redução de AB nas células HepG2, em função do tempo de exposição e da concentração de extrato. “*” indica diferenças estatisticamente significativas em relação ao efeito da concentração, em relação ao controlo. “#” indica diferenças estatisticamente significativas em relação ao tempo de exposição, entre a mesma concentração. “@” indica diferenças estatisticamente significativas em relação a diferentes concentrações com o mesmo tempo de exposição. Todos os dados foram normalizados para o respetivo controlo (100%); os resultados representam média ± S.D. de 3 ensaios independentes, cada um realizado em quadriplicado.
Em comparação com o controlo, na decocção, nenhuma concentração se apresenta estatisticamente diferente (p>0,05). Após exposição ao extrato HE (PBS) apenas a concentração mais elevada se apresenta estatisticamente diferente do controlo (p=0,0037). Na exposição ao extrato HE (PBS+DMSO) apenas as concentrações de 50 e 500 µg/mL apresentam diferenças estatisticamente relevantes comparando com o controlo (p=0,0004 e p<0,0001, respetivamente). Nos resultados obtidos com a infusão, apenas as duas concentrações mais elevadas são estatisticamente diferentes em relação ao controlo (p=0,0148 e p<0,0001, respetivamente).
23
Ao fim de 48 horas de exposição das células aos extratos, verificou-se que para a decocção, apenas as concentrações mais elevadas produziram diferenças significativas na redução da viabilidade em relação ao controlo (p=0,013 e p=0,018, respetivamente) e não existem diferenças significativas entre diferentes concentrações. Na exposição ao extrato HE (PBS), a redução da viabilidade apresentou diferenças significativas entre 50 e 500 µg/mL, 100 e 500 µg/mL e 200 e 500 µg/mL (p<0,0001). Em comparação com o controlo, as concentrações apresentam diferenças significativas (p<0,05), à exceção de 100 µg/mL (p>0,05). Na exposição ao extrato HE (PBS+DMSO) todas as concentrações apresentam diferenças significativas em comparação com o controlo (p=0,007 para 50 µg/mL e p<0,0001 para as restantes concentrações). Existem diferenças entre 50 e 500 µg/mL (p=0,0005), 100 e 500 µg/mL (p=0,0180) e 200 e 500 µg/mL (p=0,0094). Na exposição ao extrato obtido por infusão observa-se redução da viabilidade celular com diferenças significativas entre 50 e 200 µg/mL (p=0,0097), 50 e 500 µg/mL (p<0,0001), 100 e 500 µg/mL (p<0,0001) e 200 e 500 µg/mL (p<0,0001). Na exposição a 200 e 500 µg/mL existem diferenças significativas comparativamente com o controlo (p=0,0004 e p<0,0001, respetivamente)
Em relação ao efeito do tempo de exposição dos extratos na viabilidade das células (24 versus 48 horas), observou-se que a decocção produziu diferenças significativas em todas as concentrações (p<0,05), ao contrário do que aconteceu na infusão, que não existem diferenças significativas nas concentrações (p>0,05). No extrato HE (PBS+DMSO) verificam-se diferenças para 50 µg/mL (p<0,0001), para 100 µg/mL (p<0,0001) e 200 µg/mL (p=0,003). Na exposição ao extrato HE (PBS) verificam-se diferenças para as concentrações de 50 (p=0,0034) e 500 µg/mL (p<0,0001).
Como forma de melhor comparar o efeito dos diferentes extratos na viabilidade das células, atendendo ao tempo de exposição e à concentração, calcularam-se os valores de IC50 (Tabela 3.1). O valor de IC50 indica a concentração de extrato, que quando
aplicado nas células, inibe o crescimento celular (ou reduz a viabilidade celular) em 50%. Pela análise da tabela 3.1, é possível verificar que o extrato decocção é o que menos afeta a viabilidade celular, produzindo reduções de viabilidade ténues (relativamente ao controlo), tendo valores de IC50 muito elevados. No caso do extrato HE
(PBS+DMSO), aplicado a concentrações baixas é promovido um ligeiro crescimento celular, no entanto, com o aumento da concentração a viabilidade celular tende a diminuir.
24
O extrato onde mais se nota o efeito na redução da viabilidade é a infusão, apresentando valores de IC50 mais reduzidos.
Tabela 3.1: Valores de IC50 obtidos para as células HepG2, nas várias condições indicadas
Tipo de extrato IC50 24 h exposição (µg/mL) IC50 48 h exposição (µg/mL)
Decocção >1000 >1000
Infusão 268,15 ± 15,22 200,5496 ± 52,39
HE(PBS) 1017,72 ± 105,23 179,5063 ± 71,81
HE(PBS+DMSO) 744,787 ± 90,67 508,8744 ± 168,95
3.1.2 Efeito da dose e do tempo de exposição em células Raw 264.7
As células Raw 264.7 foram expostas aos 3 diferentes extratos, a várias concentrações e por dois períodos de exposição, como referido anteriormente. Os resultados obtidos para esta linha celular, encontram-se na Figura 3.2.
De um modo geral, é possível verificar que a percentagem (%) de redução de AB diminui em função da concentração de extrato utilizada e diminui em função do tempo de exposição.
Em termos de análise estatística, em relação aos dados obtidos ao fim de 24 horas de exposição ao extrato, na decocção, todas as concentrações aplicadas apresentam diferenças significativas entre si (p=0,0177 entre 50 e 100 µg/mL e p<0,0001 entre as restantes concentrações). No extrato HE (PBS) existem diferenças significativas entre 50 e 200 µg/mL (p=0,0030), 50 e 500 µg/mL (p<0,0001), 100 e 500 µg/mL (p<0,0001) e 200 e 500 µg/mL (p=0,0032). Nos resultados de exposição ao extrato HE (PBS+DMSO) existem diferenças significativas entre todas as concentrações (p<0,0001). Nos resultados da infusão existem diferenças entre todas as concentrações (p<0,0001), à exceção, de entre 50 e 100 µg/mL, em que as diferenças não são significativas (p=0,9961).
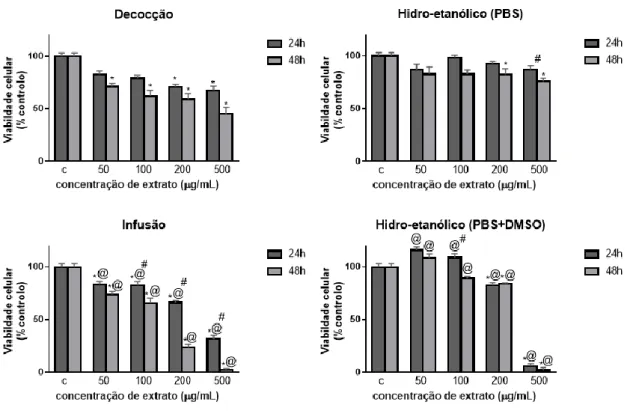
25 Figura 3.2: Efeito dos extratos de tomilho laranja na viabilidade e proliferação das células Raw
264.7. Percentagem de redução de AB nas células Raw 264.7, em função do tempo de exposição e da concentração de extrato. “*” indica diferenças estatisticamente significativas em relação ao efeito da concentração, em relação ao controlo. “#” indica diferenças estatisticamente significativas em relação ao tempo de exposição, entre a mesma concentração. “@” indica diferenças estatisticamente significativas em relação a diferentes concentrações com o mesmo tempo de exposição. Todos os dados foram normalizados para o respetivo controlo (100%); os resultados representam média ± S.D. de 3 ensaios independentes, cada um realizado em quadriplicado
Em comparação com o controlo, na decocção, todas as concentrações se apresentam estatisticamente diferentes (p<0,0001). Após exposição ao extrato HE (PBS) apenas a concentração mais elevada se apresenta estatisticamente diferente do controlo (p<0,0001), ao contrário do que acontece no extrato HE (PBS+DMSO), em que todas as concentrações reduziram significativamente a viabilidade, comparando com o controlo (p<0,0001). Este facto deve refletir a solubilidade dos componentes dos extratos HE em água, isto é, usando DMSO conseguiu-se aumentar a solubilidade e assim observar efeitos significativos na redução da viabilidade, o que não acontece usando PBS, onde eventualmente alguns componentes formaram agregados/aglomerados reduzindo a concentração efetiva da solução. Nos resultados obtidos com a infusão, também se observou redução significativa da viabilidade em relação ao controlo (p=0,011 para 50 µg/mL, p=0,001 para 100 µg/mL e p<0,0001 para 200 e 500 µg/mL).
26
Ao fim de 48 horas de exposição das células aos extratos, verificou-se que para a decocção, todas as concentrações aplicadas produziram diferenças significativas na redução da viabilidade em relação ao controlo (p<0,0001) e entre si (p=0,0013 entre as concentrações de 100 e 200 µg/mL e p<0,0001 entre as restantes concentrações). Na exposição ao extrato HE (PBS), a redução da viabilidade apresentou diferenças significativas entre todas as concentrações (p=0,0002 entre 100 e 200 µg/mL e p<0,0001 entre as restantes concentrações), à exceção de entre 50 e 100 µg/mL, que não apresentam diferenças significativas (p>0,05). Em comparação com o controlo, apenas as concentrações mais elevadas se mostraram estatisticamente diferentes (p<0,0001). Na exposição ao extrato HE (PBS+DMSO), todas as concentrações aplicadas produziram diferenças significativas em comparação com o controlo (p<0,0001) entre diferentes concentrações existem diferenças entre 50 e 200 µg/mL (p<0,0001), 50 e 500 µg/mL (p<0,0001), 100 e 200 µg/mL (p=0,0004), 100 e 500 µg/mL (p<0,0001) e 200 e 500 µg/mL (p<0,0001). Na exposição ao extrato obtido por infusão observa-se redução da viabilidade celular com diferenças significativas entre todas as concentrações (p<0,0001) e entre todas as concentrações e o controlo (p=0,0034 para 50 µg/mL e p<0,0001 para as restantes concentrações.)
Em relação ao efeito do tempo de exposição dos extratos na viabilidade das células (24 versus 48 horas), observou-se que a decocção produziu diferenças significativas em todas as concentrações (p<0,0001), mesmo aconteceu no extrato HE ((PBS+DMSO) (p=0,0004 para 500 µg/mL e p<0,0001 nas restantes concentrações). Na infusão existem diferenças significativas para 100,200 e 500 µg/mL (p<0,0001). Na exposição ao extrato HE (PBS) verificam-se diferenças para as concentrações de 200 (p=0,0210) e 500 µg/mL (p<0,0001).
Através da análise da Tabela 3.2, é possível verificar que todos os extratos apresentam efeito dependente do tempo de exposição, dado que o valor de IC50 é maior
ao fim de 24 h de exposição que ao fim de 48 h. O extrato que apresenta maiores valores de IC50 é o HE (PBS) mas quando este extrato é dissolvido numa mistura de PBS:DMSO
((1:1) HE (PBS+DMSO)) os valores de IC50 são os menores. Torna-se assim possível de
constatar que o extrato quando dissolvido apenas em PBS não surte a totalidade do efeito dos seus componentes nas células, não sendo, portanto, o solvente desejado para estes extratos.
27 Tabela 3.2: Valores de IC50 obtidos para as células Raw 264.7, nas várias condições indicadas
Tipo de extrato IC50 24 h exposição (µg/mL) IC50 48 h exposição (µg/mL)
Decocção 239,82 ± 13,45 84,87 ± 5,66
Infusão 359,23 ± 47,39 140,45 ± 5,97
HE(PBS) 921,84 ± 52,00 243,32 ± 4,73
HE(PBS+DMSO) 155,25 ± 13,71 3,13 ± 2,25
Com estes resultados constata-se que o extrato que produz uma maior redução de viabilidade é o extrato HE dissolvido na mistura PBS:DMSO. Também é possível verificar na Figura 3.2 que, no extrato HE (PBS), nas concentrações mais baixas ocorre um ligeiro aumento da viabilidade celular em relação ao controlo (aumento da % de redução de AB, que pode ser indicativo que este extrato, em concentrações mais reduzidas, induz o crescimento celular. Em todos os extratos, a % de redução de AB diminui com o aumento da concentração.
3.1.3 Efeito da dose e do tempo de exposição em células Caco-2
Os resultados obtidos após exposição das células Caco-2 aos vários extratos encontram-se na Figura 3.3. Embora as diferenças não sejam tão notórias, também é possível verificar que a % de redução de AB diminui em função da concentração de extrato e em função do tempo de exposição ao mesmo.
Em termos de análise estatística, em relação aos dados obtidos ao fim de 24 horas de exposição das células Caco-2 aos extratos, na decocção apenas as concentrações mais elevadas apresentam diferenças significativas em relação ao controlo (p=0,0454 e p=0,0096, respetivamente) e no extrato HE (PBS) verifica-se não existir diferenças significativas entre todas as diferentes concentrações e o controlo (p>0,05). Entre diferentes concentrações, entes dois extratos não apresentam diferenças significativas na redução da viabilidade. Contudo, na exposição ao extrato HE (PBS+DMSO) existem diferenças significativas entre as concentrações de 100 e 200 µg/mL (p=0,0004) e entre 50 e 200 µg/mL, 50 e 500 µg/mL, 100 e 500 µg/mL e 200 e500 µg/mL (p<0,0001), mas, entre 50 e 100 µg/mL as diferenças não são significativas (p>0,05). Em comparação com o controlo, apenas as concentrações mais elevadas apresentam diferenças significativas (p=0,0433 e p<0,0001, respetivamente). Na exposição das células à infusão, todas as concentrações reduziram a viabilidade celular relativamente ao controlo (p<0.05), e, entre