Je remercie très sincèrement M. Rabah Boukherroub, mon directeur de thèse, de m'avoir encadré et de m'avoir accueilli dans son équipe. Merci à Oleg Melnyk, directeur de recherche, pour sa participation au jury de ma thèse et pour m'avoir accueilli dans son groupe de chimie. Aussi l'architecture du bâtiment qui accueille les chercheurs de l'IRI vise à favoriser la communication et la création de collaborations diverses.
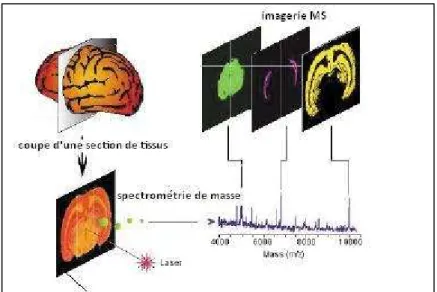
Les chercheurs de l'IRI ont également accès au pôle de haute technologie situé à quelques pas : l'Institut d'Electronique, de Microélectronique et de Nanotechnologies (IEMN). Le chapitre 3 concerne l'optimisation (sensibilité, adaptabilité, précision de masse) du support nanofils de silicium pour l'analyse de biomolécules par désorption/ionisation laser en spectrométrie de masse (LDI-MS).
LA SPECTROMETRIE DE MASSE, LA DESORPTION/IONISATION LASER ASSISTEE PAR
I NTRODUCTION
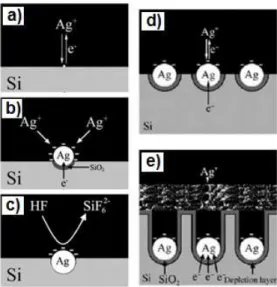
Schéma de principe de la fabrication de nanofils de silicium par gravure chimique HF/AgNO3.75. C'est donc la surface des nanofils de silicium synthétisés chimiquement qui présente des plots superhydrophobes (silanisation par OTS) et superhydrophiles (réalisés par lithographie optique). Les cellules prolifèrent sur les zones de nanofils de silicium superhydrophiles de 50 µm2 (groupements silanol à la surface des nanofils) et sont repoussées par les zones superhydrophobes (chaînes carbonées à la surface des nanofils).
S OURCES D ’ IONISATION POUR LA SPECTROMETRIE DE MASSE
- Rapide historique des sources d’ionisations dédiées à l’analyse de biomolécules
- Procédés d’ionisation d’une molécule
- Les sources d’ionisation dure
- L’ionisation électronique (EI)
- L’ionisation chimique (CI)
- Désorption/ionisation par bombardement rapide d’atomes (FAB)
- Les sources d’ionisation douce
- Désorption/Ionisation par ElectroSpray (ESI)
- NanoESI
- L’Ionisation Chimique à Pression Atmosphérique (APCI)
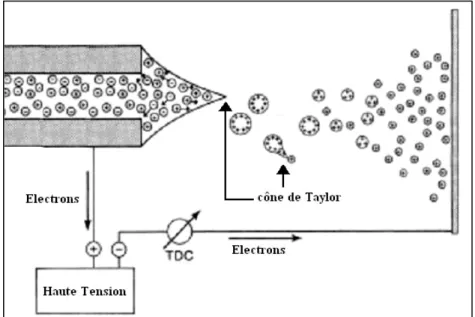
- La Désorption Ionisation Laser Assistée par Matrice (MALDI)
- La Désorption Ionisation sur Silicium poreux (DIOS)
- Conclusion
L ES ANALYSEURS EN SPECTROMETRIE DE MASSE
- L’analyseur quadripolaire (Q)
- L’analyseur à trappe ionique (IT)
- L’analyseur à résonnance cyclotronique des ions à transformée de Fourier (FT-ICR ou FT-MS)
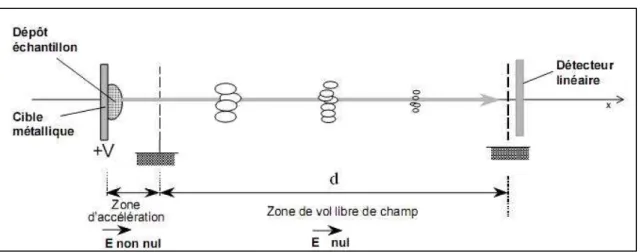
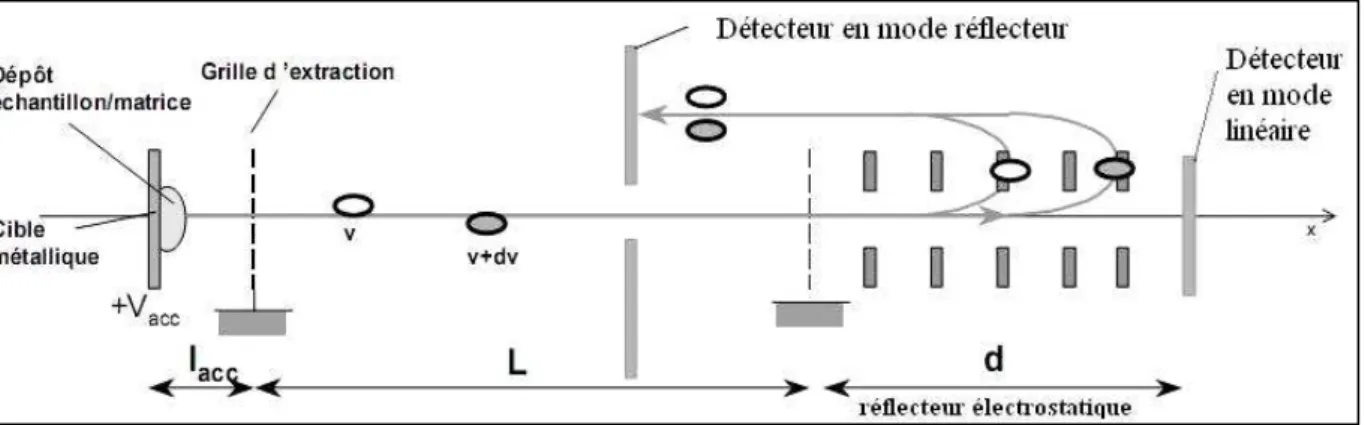
- L’analyseur à temps de vol (TOF)
O PTIMISATION DES ANALYSES MALDI-TOF ET TECHNIQUES ALTERNATIVES LDI-MS SANS MATRICE
- Evolution de l’instrumentation du MALDI-TOF
- Le mécanisme complexe et encore occulte du MALDI
- Le protocole de préparation des échantillons
- L’irradiation laser
- Ejection des molécules
- L’ionisation
- La dynamique de la « plume »
- Limitations du MALDI et techniques alternatives de LDI-MS sans matrice
- Applications et enjeux des techniques alternatives de LDI-MS vs MALDI
- Mécanisme des analyses LDI-MS sans matrice sur nanostructures
Ce terme correspond au nuage formé par les analytes une fois désorbés de la cible métallique. Les méthodes de dépôt d’échantillons les plus couramment utilisées sont la méthode des gouttes séchées et la méthode sandwich. La relation entre la longueur d'onde du laser et la longueur d'onde d'absorption de la matrice a été étudiée par de nombreux groupes.48,49 Par exemple, pour la gamme UV, il apparaît quantitativement que la performance de l'analyse culmine.
Les études expérimentales et les deux simulations de la dynamique moléculaire du panache (ou « plume » en anglais) en phase gazeuse sont très importantes et ont contribué à l'optimisation de l'instrumentation MALDI. Malgré les tendances mondiales, les études montrent également que la dynamique moléculaire dépend fortement du type d’analytes et de la matrice qui leur est associée.
C ONCLUSION
B IBLIOGRAPHIE
Matrix-assisted laser desorption mass spectrometer on a magnetic sector instrument equipped with an array detector”. Is incorporation of analytes into matrix crystals a prerequisite for matrix-assisted laser desorption ionization mass spectrometry. The influence of laser fluence on ion yield in matrix-assisted laser desorption ionization mass spectrometry.
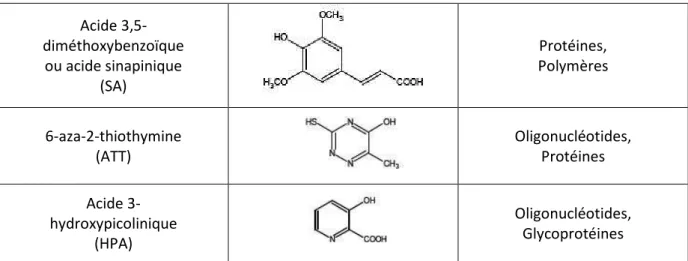
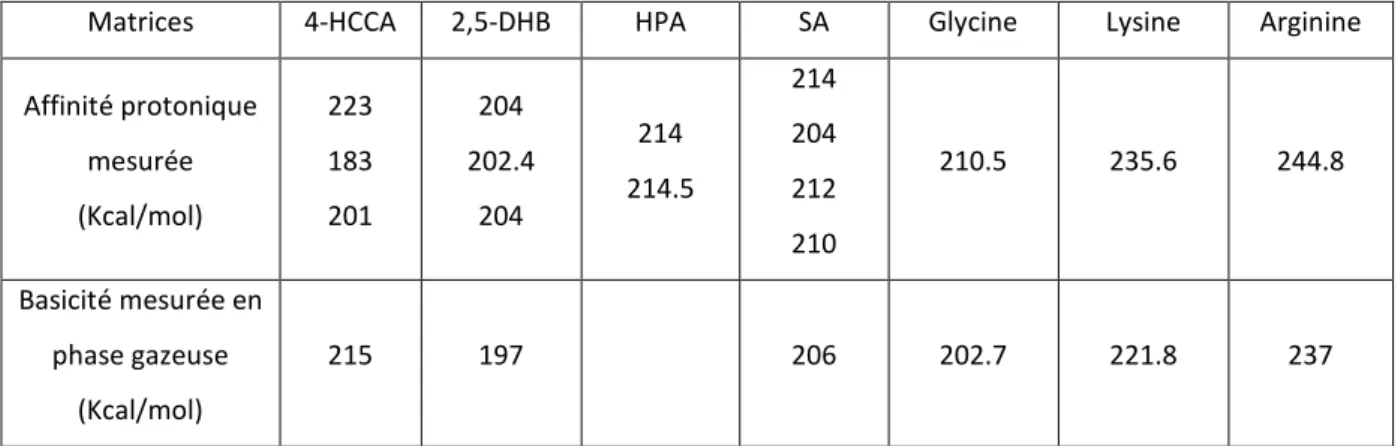
Basic matrices in the analysis of non-covalent complexes by matrix-assisted laser desorption ionization mass spectrometry". Influence of co-matrix proton affinity on oligonucleotide ion stability in matrix-assisted laser desorption/ionization time-mass spectrometry" J.
SYNTHESE/FABRICATION DE NANOSTRUCTURES DE SILICIUM ET PROPRIETES
S YNTHESE DE NANOSTRUCTURES DE SILICIUM
- Croissance de nanofils de silicium par voie Vapeur-Liquide-Solide (VLS)
- Fabrication de nanofils de silicium par gravure chimique sans électrode
- Formation de nanofils de silicium par procédé Solide-Liquide-Solide (SLS)
C HIMIE DE SURFACE
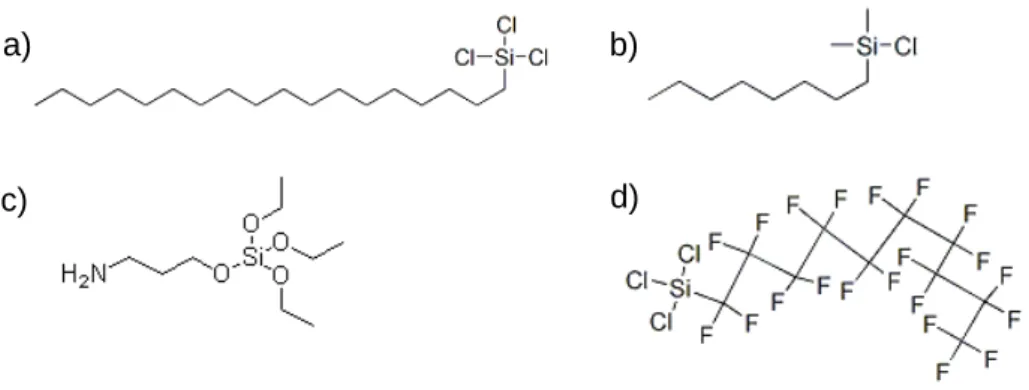
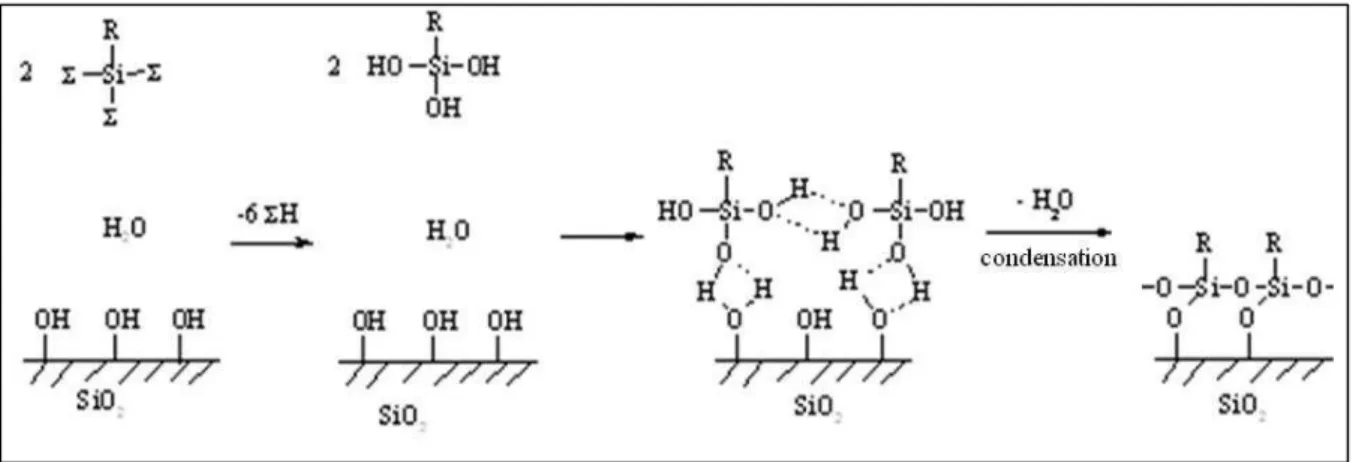
- Modification chimique des surfaces par silanisation
- Les organosilanes
- Principe de la silanisation
- Les liaisons non-covalentes
- La liaison ionique
- La liaison hydrogène (interactions polaires)
- Les forces de Van Der Waals
- Les interactions hydrophobes (ou interactions apolaires)
Images SEM (vues de dessus pour a1, b1 et c1 et vues en coupe pour a2, b2, c2) de supports de nanofils de silicium de différentes longueurs et densités. Analyses LDI-MS sur nanofils de silicium pour les applications de biopuces et de laboratoire sur puce. Pour cela, la surface des nanofils de silicium a été fonctionnalisée avec un octyldiméthylchlorosilane (ODMCS) (Chapitre 2.3.1).
P ROPRIETES DE MOUILLAGE DES NANOFILS DE SILICIUM
- Angle de contact
- L’effet de superhydrophobicité : nanostructures et chimie de surface
P ROPRIETES OPTIQUES ET THERMIQUE DES NANOSTRUCTURES DE SILICIUM
- Introduction
- Les électrons et les photons à l’échelle d’un nanofil
- La masse effective des électrons
- Confinement quantique des électrons dans un nanofil
- Structure de bande d’un nanofil de silicium et photoluminescence
- Mesures de photoluminescence d’échantillons de silicium poreux et de nanofils de silicium
- Les phonons et les propriétés thermiques des nanofils de silicium
- Le rôle des phonons
- Conductivité thermique des nanofils de silicium
- Dissipation de la chaleur
C ONCLUSION
Nous avons donc présenté dans cette partie différentes méthodes physiques et chimiques de nanostructuration du silicium ainsi que les principes de fonctionnalisation chimique du silicium. Nous avons vu que certains protocoles de modification chimique de surface sont les mêmes pour une surface de silicium micro/nanostructurée que pour une surface de silicium plane. Nous avons également souligné que cette chimie de surface se traduit par des propriétés de tension superficielle solide/liquide complètement différentes, qui ne doivent pas être négligées.
Enfin, nous avons présenté les propriétés optiques et thermiques des nanofils de silicium, propriétés qui seront abordées au chapitre 3.
B IBLIOGRAPHIE
Preuve de l'adhésion de van der Waals chez les soies de gecko. " Actes de l'Académie nationale des sciences des États-Unis. 34 ; Nouvelles morphologies du silicium nanostructuré résultant de l'anodisation électrochimique : développement, propriétés physicochimiques et applications " Thèse de l'Institut national des sciences appliquées , Lyon, 2006. Etude prospective des dispositifs de blocage coulombien au silicium du point de vue de l'application en microélectronique", Thèse de l'Université Joseph Fourier - Grenoble I.
34;Théorie de l'effet de confinement quantique sur les excitons dans les boîtes quantiques de matériaux à gap indirect". Etude optique et électrique des propriétés électroniques des nanocristaux de silicium pour composants monoélectroniques", Thèse de l'INSA Lyon, 2001. Fabrication de fils quantiques de silicium par fabrication électromécanique et décomposition chimique des plaquettes »Lettres de physique appliquée.
Highly efficient and stable illumination of nanocrystalline porous silicon treated by high-pressure water vapor annealing”, Applied Physics Letters. Growth mechanism of silicon nanowires and their quantum confinement effect”, Journal of Crystal Growth. Solid-state electroluminescent devices based on silicon nanowires fabricated using lithography and etching techniques”, Thin Solid Films.
Synthesis and photoluminescence properties of silicon nanowires treated by high-pressure water vapor annealing,” Phys. Monte Carlo simulation of phonon isolation in silicon nanostructures: Application to the determination of thermal conductivity of silicon nanowires. Effect of substrate thermal conductivity on nanowire temperature for current-induced domain wall motion,” Phys Stat Sol (a).
SPECTROMETRIE DE MASSE PAR DESORPTION/IONISATION LASER SUR NANOFILS DE SILICIUM ET
O PTIMISATION DE LA LDI-MS SUR NANOFILS DE SILICIUM
- Mouillabilité de surface
- Influence de la fonctionnalisation chimique des nanofils de silicium
- Terminaison chimique et tension de surface
- Résultats et discussion
- Influence de la morphologie des nanofils de silicium
- Etat de l’art
- Résultats
- Discussion
- Désorption/Ionisation, transfert d’énergie aux analytes
- Propriétés optiques des nanofils de silicium
- Propriétés thermiques des nanofils de silicium
- Confinement de la chaleur dans les nanofils
- Réduction de la taille du cœur de silicium : oxydation partielle
- Densité des nanofils de silicium, infiltration des peptides et transfert d’énergie
- Nature du substrat des nanofils de silicium
- Dopage et cristallinité des nanofils de silicium
- Conclusion et perspectives
Nous avons donc souhaité valider l'utilisation du support nanofils de silicium pour les études protéomiques. Suivi de la méthylation peptidique "in situ" sur des nanofils de silicium pour le développement d'une biopuce peptidique. Le support de nanofils de silicium permet de suivre les étapes de méthylation des peptides par analyses LDI-MS.
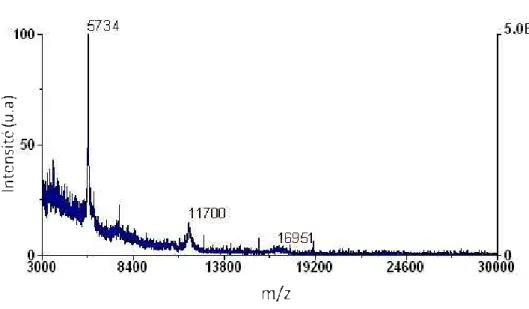
N ANOFILS DE SILICIUM ET PERFORMANCES EN LDI-MS
- Haute sensibilité de détection pour des composés de petites masses
- Validation à l’analyse protéomique
- Introduction à la protéomique
- Conclusion
- TiO 2 et MALDI
- Optimisation et performances de la LDI-MS sur nanotubes de TiO 2 sans matrice
- Préparation des nanotubes de TiO 2
- Résultats en LDI-MS sur nanotubes de TiO 2
ANALYSES LDI-MS SUR NANOFILS DE SILICIUM POUR DES APPLICATIONS BIOPUCE ET
S UIVI DE LA METHYLATION DE PEPTIDES « IN SITU » SUR NANOFILS DE SILICIUM POUR LE DEVELOPPEMENT D ’ UNE BIOPUCE A
- Principe de la biopuce
- La méthylation
- Biopuces à peptides méthylés
- Principe des biopuces à peptides méthylés
- Préparation des biopuces à peptides méthylés
- Suivi de la méthylation de peptides adsorbés sur nanofils de silicium par LDI-MS
- Immobilisation des peptides sur les nanofils de silicium
- Méthylation des peptides in situ: protocole expérimental
- Analyse par spectrométrie de masse de la cinétique de méthylation des peptides
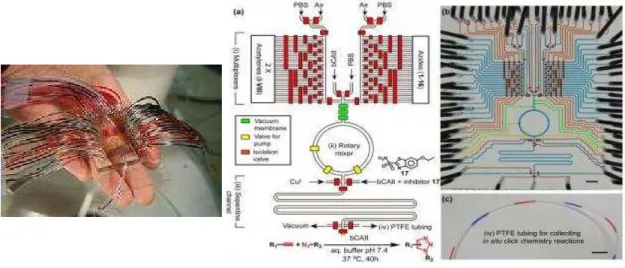
L ABORATOIRE SUR PUCE POUR UN DEPLACEMENT DE LIQUIDES BIOLOGIQUES PAR EWOD ET UNE ANALYSE PAR LDI-MS
- Déplacement de goutte par électromouillage sur diélectrique : EWOD
- Le microsystème EWOD
- Capot de nanofils de silicium pour analyses LDI-MS
- Instrumentation
- Déplacement de goutte et taille des plots
- Validation du dépôt spécifique dans les plots
- Paramètres de réduction de l’adsorption non spécifique
- Analyse fluorescence
- Résultats en LDI-MS sur nanofils de silicium
- Conclusion et perspectives
C ONCLUSION
De même, les performances des analyses LDI-MS sur supports silicium micro/nanostructurés sont difficiles à interpréter. Nous avons approfondi le mécanisme du LDI-MS sur les nanofils de silicium en étudiant l'effet de plusieurs paramètres : la morphologie des nanofils de silicium, leur chimie de surface, leurs propriétés optiques et thermiques. La modification des nanofils de silicium par des silanes hydrophobes aurait permis de limiter l'infiltration des analytes et favorisé leur répartition au-dessus des nanofils.
Nos résultats montrent que plusieurs types de revêtements « hydrophobes » conviennent, tandis que la variation de la morphologie nous a permis de déterminer un support optimal pour les analyses LDI-MS. En fait, nos résultats sont en accord avec la littérature selon laquelle la morphologie des nanofils de silicium est un paramètre critique et semblent également indiquer un rôle prédominant pour le facteur de densité des nanofils. De plus, les propriétés de réflectivité et de photoluminescence proches de zéro des nanofils de silicium nous amènent à considérer le mécanisme photothermique de transfert d'énergie des nanofils de silicium vers les analytes, potentiellement induit par le confinement des phonons dans les nanofils de silicium.
Nous décrivons quelques études qui pourraient étayer davantage cet effet, ainsi que les perspectives de progrès dans la compréhension de l'effet de la morphologie des nanofils de silicium sur les performances des analyses LDI-MS. Les applications du LDI-MS sans matrice sont de plus en plus nombreuses et avantageuses. Le support optimal des nanofils de silicium provient de la synthèse chimique des nanofils, qui présente l'avantage d'être très simple, peu coûteuse et rapide.
Le support optimal s’est avéré légèrement moins efficace que le support des nanofils de silicium, et il serait intéressant d’étudier d’autres types de morphologies de nanotubes. Enfin, il est nécessaire d'évaluer les capacités et les limites de chaque structure pour choisir la meilleure combinaison d'outils pour une analyse rapide et qualitative. Nous verrons que dans notre cas, le support optimal des nanofils de silicium pour l’analyse LDI-MS est utile car sa production est simple, rapide et peu coûteuse et ouvre des perspectives dans le développement de laboratoires sur puce.
B IBLIOGRAPHIE
Le support permet plus spécifiquement de suivre la cinétique de méthylation (qui fait partie des PTM) de peptides immobilisés sur des nanofils de silicium par analyse LDI-MS. Cependant, les nanofils de silicium ainsi fonctionnalisés avec des amines ont montré une force d'interaction avec les peptides insuffisante : un simple rinçage suffit alors pour détacher les peptides de la surface. Les solutions 2 et 3 sont ensuite mélangées par volume 9:1 et ce mélange est déposé directement sur le support de nanofils de silicium puis recouvert par le couvercle de la chambre d'incubation (Figure 4.5).
Le mélange de méthylation est « piégé » entre le support de nanofils de silicium et le capuchon. Après différents temps de réaction, le support de nanofils de silicium est retiré de la chambre d'incubation, rincé 3 fois dans une solution aqueuse de citrate d'ammonium 1 mM, puis séché sous courant d'air. La figure 4.6 montre que le support de nanofils de silicium permet la surveillance de la méthylation des peptides déposés sur un réseau par des analyses LDI-MS sans modèle.
Par conséquent, la réaction de méthylation peptidique in situ sur des nanofils de silicium est réalisée avec succès. L'avantage d'intégrer le support de nanofils de silicium dans le dispositif est de pouvoir coupler le laboratoire sur puce avec l'analyse LDI-MS et d'éviter les mouvements microfluidiques de la matrice, particulièrement difficiles compte tenu de la viscosité des matrices utilisées dans MALDI. . Le revêtement de nanofils de silicium est posé sur un support spécifique en Téflon (Figure 4.9.5).
Cependant, le peptide est également détecté en LDI-MS sur les nanofils de silicium à l'extérieur (régions superhydrophobes) des plots fluorescents. Dans la deuxième partie, nous avons montré que le support de nanofils de silicium est adapté aux opérations microfluidiques et qu'il permet, entre autres, de déplacer des mélanges de peptides à une concentration de l'ordre des picomoles par microlitre. D'une part, il permet le suivi de la méthylation, réalisée in situ sur les nanofils.
IMMOBILISATION LOCALISEE DE CELLULES ET DE SPORES SUR NANOFILS DE SILICIUM
I MMOBILISATION LOCALISEE DE CELLULES SUR NANOFILS DE SILICIUM ET VIABILITE DES CELLULES
- Etat de l’art
- Les techniques d’immobilisation de cellules
- Interaction cellules/nanofils
- Immobilisation localisée de cellules ovariennnes d’hamster chinois sur nanofils de silicium
- Immobilisation par voie chimique des cellules sur nanofils de silicium
- Interface cellules/ nanofils de silicium
- Discussion et interprétation des résultats
- Viabilité des cellules et processus passif d’interaction avec les nanofils de silicium
- Perspective : localisation de cellules sur surface plane à l’aide de nanofils de silicium
A NTI - ADHESION DE SPORES HYDROPHOBES SUR DES NANOFILS DE SILICIUM SUPERHYDROPHILES
- Adhésion de spores sur l’acier
- Adhésion sélective de spores Bacillus Cereus sur nanofils de silicium dans des zones hydrophobes et
- Influence de la micro/nano structuration de surface sur la rétention de spores soumises à la pression
HYSTERESIS, SUPERHYDROPHOBICITE, SUPEROLEOPHOBICITE
REALISATION DE MOTIFS HYDROPHILES/HYDROPHOBES OU DE PLOTS DE NANOFILS DE SILICIUM
PROTOCOLE POUR L’IMAGERIE MEB/TEM DE CELLULES ADHEREES SUR SURFACE