L'étude d'une souche mutante d'Adénovirus type 5 en complexe avec à la fois une souche Fab et une souche canine a permis de localiser précisément l'extrémité C-terminale de la protéine IX. Je tiens ensuite à remercier toutes les personnes avec qui nous avons collaboré pour réaliser ce projet final sur l'étude de la structure des adénovirus.
La symétrie, un aspect fascinant de la nature
Les opérateurs de symétrie élémentaires
Une simple symétrie de rotation est obtenue autour d'un axe Δ d'ordre N où N est un nombre entier. L'axe est défini par un vecteur unitaire ur qui donne son orientation dans l'espace ainsi qu'un angle de rotation θ.

Les Solides de Platon
- Le cube
- Le tétraèdre
- L’octaèdre
- L’icosaèdre
- Le dodécaèdre
Enfin, un axe d'ordre 2 est présent au milieu de chaque arête et coupe deux arêtes opposées. L'axe d'ordre 3 présent à chaque sommet et au centre de chaque face est coloré en rouge, les axes 2 au milieu de chaque arête sont en jaune.

La Symétrie dans les macromolécules biologiques et les virus
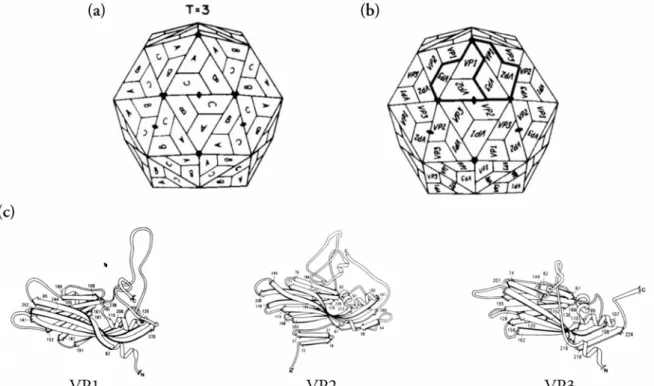
Premièrement, dans certains virus, le nombre d’environnements différents est inférieur au nombre de triangulations de capsides. La capside des papillomavirus présente en effet une symétrie icosaédrique T = 7d, mais ne contient que six environnements différents (Baker et al., 1999).
La combinaison des données issues de la Microscopie Electronique et de la cristallographie aux
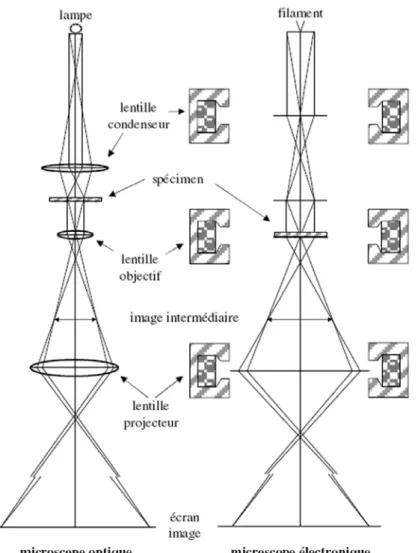
La Microscopie Electronique
- Le principe de la Microscopie Electronique en transmission
- Le microscope électronique produit une image déformée de l’objet
- La préparation des échantillons biologiques et la prise d’images en MET
- La correction, l’analyse des images et le calcul d’une reconstruction 3D
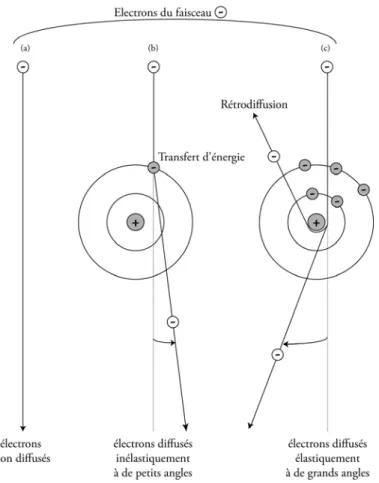
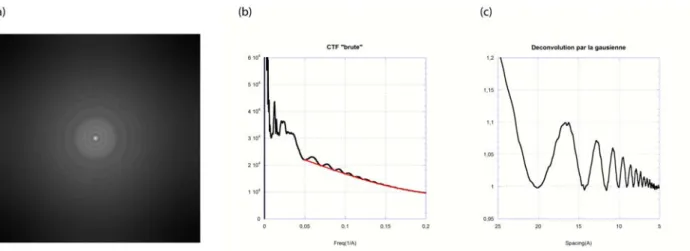
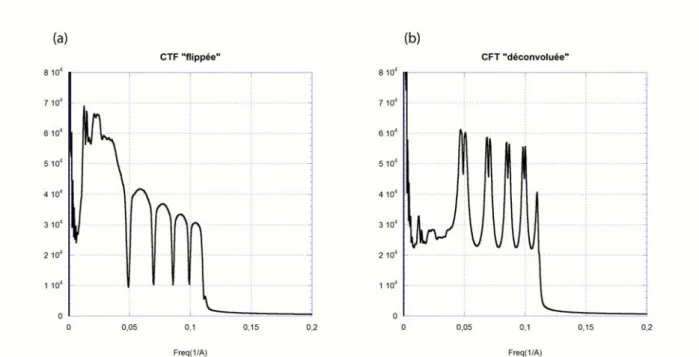
La nature sinusoïdale du CTF a un impact significatif sur la qualité de l'image. Le changement de contraste de phase est représenté en fonction de la résolution de l'image.
La Cristallographie aux rayons X
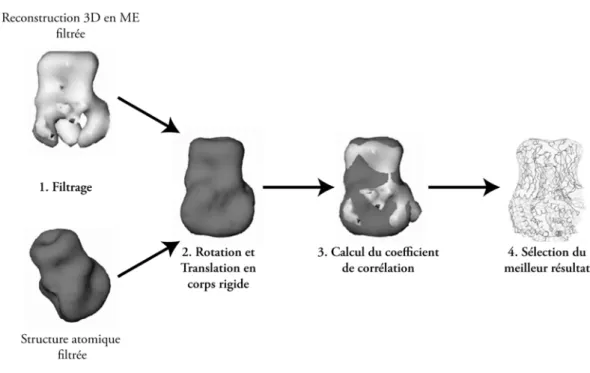
Obtention d’un modèle quasi-atomique par « fitting »
- En corps rigide
- Les modes normaux et le « fitting » flexible
La structure atomique dans ce cas est considérée comme invariante et se déplace sans déformation au sein de la reconstruction 3D dérivée du ME. Le principe du processus « d'installation », illustré à la figure 21, reste le même quel que soit le programme utilisé.
Objet du travail de thèse
Introduction
La famille des Adenoviridae
La forte proportion de bases A et T au sein de leur génome leur doit le nom d’Atadenovirus. Ce genre présente une diversité d'hôtes assez importante similaire à celle des Mastadénovirus et des Aviadenovirus, mais se distingue par l'organisation atypique de leur génome par rapport aux deux premiers genres, notamment dans la région E4 (Figure 29) (Davison et al., 2003) .

Un peu d’épidémiologie
Le syndrome de la coqueluche représente un état caractéristique de symptômes associés à une infection par la bactérie Bordetella pertussis, l'agent infectieux responsable de la coqueluche. Chez les bovins et les ovins, les adénovirus provoquent de légères maladies respiratoires.
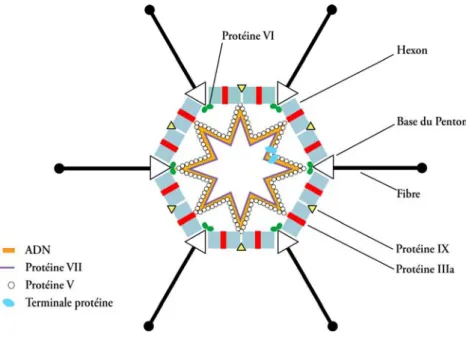
Structure et organisation générale de la capside
- La symétrie de la capside
- L’Hexon
- La Base du Penton
- La Fibre
- Les protéines structurales mineures
La base de Penton ou protéine III est la deuxième protéine majeure de la capside de l'adénovirus. Stewart et ses collègues ont proposé une localisation péripentonale interne de la protéine VI en 1993 (en vert sur la figure 28).
Structure et Organisation du génome des Adénovirus
- Structure du nucléoïde
- Unités transcriptionnelles et organisation du génome
La forme mature de la protéine VI résulte du clivage d'un précurseur d'environ 27 kDa au niveau de deux sites identifiés. L'ADN viral est entièrement recouvert par la protéine VII, permettant sa compaction au sein de la capside (Figure 29).

Le cycle viral
- Entrée du virus dans la cellule et phase précoce d’infection
- Réplication du génome viral
- Phase tardive d’infection et Lyse de la cellule infectée
- Conclusion sur le cycle virale de l’Adénovirus
La réplication de l'ADN viral indique donc le début de la phase tardive (9. sur la figure 30). Les capsides vont ensuite subir une maturation par dégradation protéolytique par la protéase virale et s'accumuler dans le noyau de la cellule infectée (13. sur la figure 30).

Structure du dodécaèdre et particularités du dodécaèdre de type 3
Une sous-particule virale semble se comporter différemment de la particule virale dont elle est issue. En fait, le dodécaèdre aurait également la capacité de lier les héparanes sulfates à la surface cellulaire via une base de Penton (Vives et al., 2004). Les héparanesulfates sont des sucres présents sur les glycoprotéines de la surface cellulaire.
Les Adénovirus Aviaires
Penton est formé à partir de la base de Penton reliée aux deux types de fibres. En effet, les observations ME montrent que la fibre-1 (longue) et la fibre-2 (courte) sont toutes deux présentes à chacun des sommets de la capside (voir III.2). En effet, il est capable d'infecter les cellules humaines via la fibre-1, mais le mécanisme d'internalisation n'a pas encore été élucidé (Tan et al., 2001).
Les Adénovirus Canins
L'étude structurale de cette capside, en comparaison avec les adénovirus humains, pourrait permettre la localisation plus précise des protéines IX et IIIa. La structure de la tête de la fibre 1 a été résolue en 2007 par une équipe espagnole et la structure de la fibre 2 a été déterminée dans notre laboratoire (Guardado-Calvo et al., 2007, El Bakkouri et al., 2008). J'ai donc pu utiliser cette structure à la fin de ma thèse pour tenter de reconstruire un modèle quasi-atomique de la capside CELO par « ajustement » (voir IV.2).
Les Adénovirus, vecteurs pour la thérapie génique et anti-cancer
La mort du jeune homme après une forte activation immunitaire suggère également un problème de ciblage lié au tropisme des adénovirus. Ce n’est pas le cas des adénovirus, dont le transgène ne peut pas s’intégrer dans le génome. Ces dernières années, de nombreux efforts ont été consacrés au développement d’adénovirus comme vecteurs de thérapie contre le cancer.
Le modèle quasi atomique de la capside de l’Adénovirus humain de type 5
Article 1
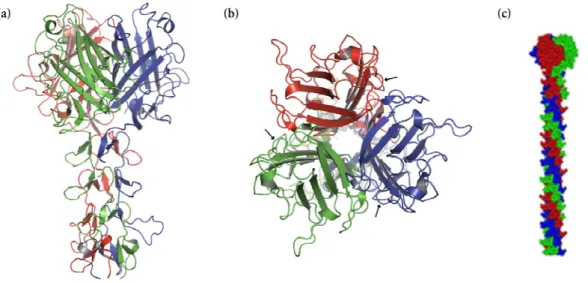
The atomic structure of the hexon of human adenovirus type 5 (Ad5) (Rux and Burnett, 2000) is available, as is that of the penton base of human adenovirus type 2 (Ad2) (Zubietaet al, 2005). Similarly, in the crystal structure of the penton base, most of the RGD loop is missing due to flexibility (Zubietaet al, 2005). The crystal structure of the penton base without the fiber peptide, when superimposed on the EM map (not shown), does not account for the bond between the fiber and the penton base (colored pink in the EM density in Figure 2A ).

Matériel et Méthodes complémentaires
- Informations supplémentaires à l’article 1
- La microscopie électronique et l’analyse d’images
Le processus d'analyse d'images est basé sur le théorème de projection centrale (Bragg, 1929). Le principe de la reconstruction 3D repose également sur le théorème de projection centrale (Figure 35). L'échantillonnage de l'espace réciproque en coordonnées cylindriques permet la décomposition du total TF(Sr, Sz, Sφ) en un ensemble de fonctions Gn(Sr, Sz), indépendantes de l'angle φ.

Conclusion
Etude structurale de la capside de l’Adénovirus Aviaire de type 1
Matériel et Méthodes
- Purification du virus CELO
- La microscopie électronique et l’analyse d’images
- Le fitting
Le virus étant dense, il forme une bande opalescente concentrée juste au-dessus de la deuxième couche. La dernière étape de purification est le dessalage et la concentration de la solution virale. Le virus CELO semble être beaucoup moins stable pendant la dialyse que l'adénovirus humain de type 5.
Résultats et discussion
J'ai utilisé le programme URO (Navaza et al., 2002) pour reconstruire un modèle quasi-atomique de la capside CELO en inscrivant la structure de l'Hexon de HAdV-5 dans la reconstruction 3D que nous avions obtenue. Vue selon l'axe 3 de l'icosaèdre d'un côté de la reconstruction 3D du CELO (réalisée avec CHIMERA, Pettersen et al., 2004). Nous ne constatons pas de différences majeures dans l'organisation globale de la structure (Figure 42 a et b).

Conclusion
En effet, il apparaît que la présence de trous de densité artéfactuels au centre de certains Hexons dans la reconstruction 3D empêche un recalage correct des structures cristallographiques. C'est donc principalement la qualité de la reconstruction 3D que nous avons obtenue qui semble être à l'origine des problèmes que nous avons rencontrés lors du processus de modification des structures atomiques de l'Hexon et de notre tentative de création d'un modèle atomique de quasi-reconstruction.
Etude Structurale de la Capside de l’Adénovirus Canin de type 2
Article 2
This could easily explain the smoother pentagonal shape of the CAV-2 base (slightly larger on the center of the edge and smaller on the pentagonal vertex). The currently unresolved N-terminal portion of the penton base (amino acids 1 to 49) contains two highly conserved PPXY (where X is any residue) motifs implicated in interactions with host cell WW domain-containing ubiquitin ligases (21, 22) . Recently, the crystal structure of the homotrimeric C-terminal CAV-2 fiber head (residues 361 to 542) was determined (47).

Conclusion
Etude structurale des Complexes Fab - Adénovirus Humain de type 5 pour la localisation de
Matériel et Méthodes
- Les échantillons
- Préparation et Purification des Fab
- Préparation des complexes Virus – Fab
- CryoME
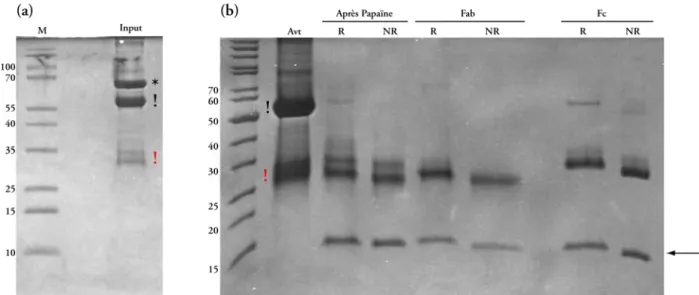
Etude structurale des Complexes Fab - Adénovirus Humain type 5 pour la localisation de l'extrémité C-terminale de la protéine IX. La résine est lavée avec 3 volumes de colonne de PBS 1x puis l'anticorps est élué de la résine avec 3 volumes de colonne de tampon d'élution (fourni dans le kit). Les fragments Fab sont récupérés lors du lavage de la résine, et les fragments Fc, ainsi que les anticorps partiellement ou non digérés, sont éliminés selon le protocole.

Résultats et discussion
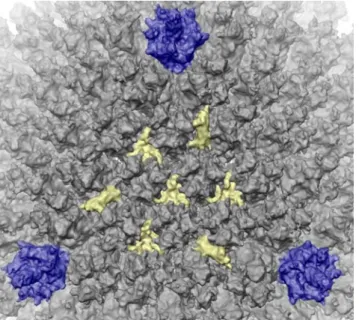
La seule modification externe observée de la capside se situe au niveau de densité précédemment attribué à la protéine IIIa. Les auteurs ont attribué la densité de la protéine IIIa à l’extrémité C-terminale de la protéine IX. La partie N-terminale de la protéine IX est clairement présente sur le GON (en jaune sur la Figure 50).
Conclusion
La fixation du Fab au niveau peptidique dans cette région semble conduire à une déstabilisation complète des hélices alpha présentes à l'extrémité C de la protéine IX. La liaison Fab provoque également une flexibilité considérable dans cette région de la capside, nous empêchant de visualiser l'anticorps plus précisément à ce niveau. La forme que nous observons pour l'extrémité C de la protéine IX attachée au Fab est le résultat de la moyenne effectuée lors du processus d'analyse d'image et de reconstruction 3D entre les capsides dépourvues d'anticorps et les capsides où l'anticorps est attaché.
Etude structurale d’un mutant immature de l’Adénovirus Humain de type 2
Matériel et Méthodes
- La CryoME
- Le « fitting » en corps rigide
L'enregistrement de la structure atomique de Penton et Hexon Base a été effectué avec URO. Les structures atomiques utilisées sont celle de la Base de Penton en complexe avec le peptide N-terminal de la fibre (Code PDB : 1X9T) et celle de l'Hexon de HAdV-5 (Code PDB : 1P30). Ensuite, la procédure d'ajustement a permis d'ajuster l'échelle de la carte ME.
Résultats et discussion
La seule différence représentative se situe au niveau de la partie externe du C-terminal de la protéine IX. Greber a montré la présence sous forme inactive de la protéase virale dans la capside. La pose de la base du Penton et des Hexons s'effectue de manière satisfaisante.
Conclusion
Le modèle quasi atomique du dodécaèdre de l’Adénovirus Humain de type3
Article 3
Electron cryomicroscopy and image analysis yielded models of a dodecahedron made of penton base only (Bs-Dd) and a dodecahedron made of complete pentons (Pt-Dd) (Figure 4). The atomic structure of the Ad2 penton base was fitted to EM density maps of Ad3 Bs-Dd and. Attaching the atomic structure of the penton base Ad2 to the dodecahedron of the penton base Ad3.
Conclusion
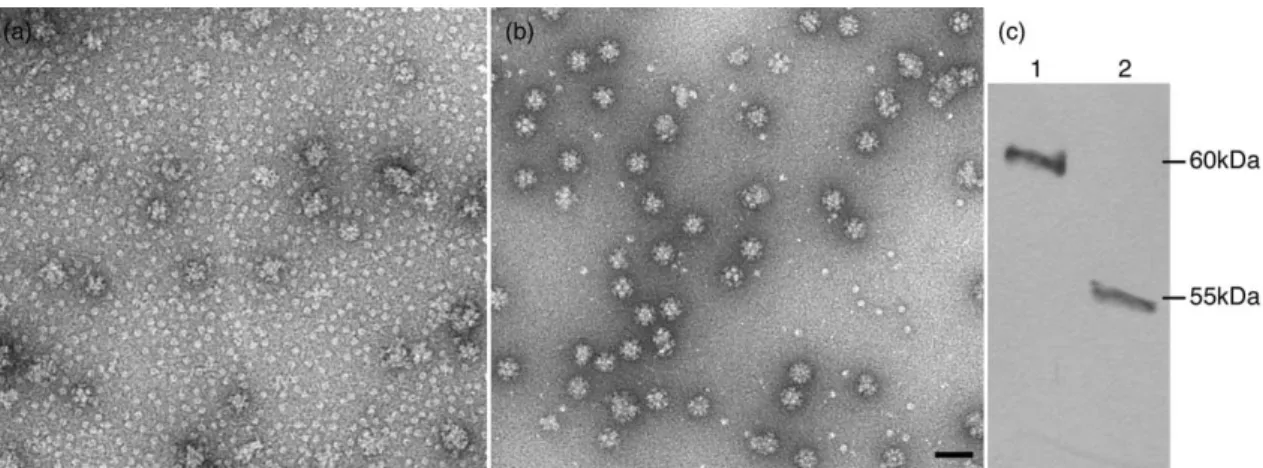
The junction found in each trimer bounds the smaller of the two types of holes found in the particle (Fig. 3A, right). The PhTET1 Tetrahedral and Octahedral Particles Define a Network of Access Channels and Catalytic Chambers—Examination of the interior of the PhTET1-12 revealed a complex compartmentalization. Both versions of the building (PhTET1-12s and PhTET1-24s) are structured in a related manner with two types of subcompartments: the access channels (4 and 8, respectively) and the proteolytic chambers (4 and 6, respectively).
In contrast, the catalytic chambers, with the exception of the active sites, are strongly positively charged. Wade (Laboratoire de Microscopie Electronique Structurale-Institut de Biologie Structurale) for critical reading of the manuscript.