KC et IC montrent une transition boule-hélice en dessous d'une température critique qui dépend du type et de la concentration des cations. Le quatrième chapitre traite de la gélification de mélanges monophasiques caséinate de sodium/kappa carraghénane.
Etude bibliographique
Les caséines
La composition en acides aminés leur confère une certaine hydrophobie, ce qui leur permet de se lier facilement. Dans le lait, ces molécules sont présentes sous forme de grosses particules, communément appelées micelles de caséine.
Les micelles de caséines : la composition, la structure
- La composition
- La structure
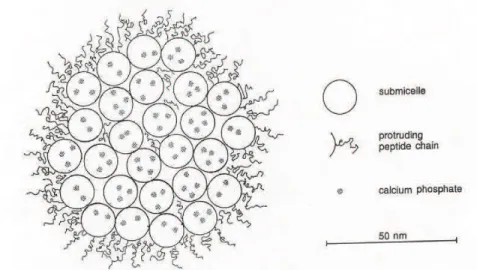
Il existe 2 types de submicelles dans la micelle : la première, constituée des caséines as1 et b, est principalement localisée dans la micelle. La seconde, composée des caséines as1, as2 et k, est située en périphérie de la micelle.
Dissociation par précipitation acide
Cette couronne, souvent appelée « couche poilue », est chargée négativement et a une épaisseur d'environ 10 nm. La K-caséine est principalement localisée en surface et la partie hydrophile des chaînes peptidiques, longue d'environ 12 nm, permet de stabiliser stériquement la micelle.
Les caséinates de sodium
- Caractérisation structurale
- Comportement en suspension
- Influence du pH et de la température
- Influence de la force ionique
La viscosité diminue avec l'augmentation de la température (Guo, Fox, Flynn et Mohammad, 1989) mais augmente avec la diminution du pH (Baretto et al., 2003 ; Carr, Munro et Campanella, 2002). La quantité de caséine dans les agrégats augmente avec la concentration en calcium, mais ne dépend pas de la concentration en caséine.
Les carraghénanes
- Structure chimique des différents types de carraghénane
- Les propriétés structurales et rhéologiques
- Conformation en solution et transition pelote - hélice
- Gélification
- Les mélanges iota et kappa carraghénane
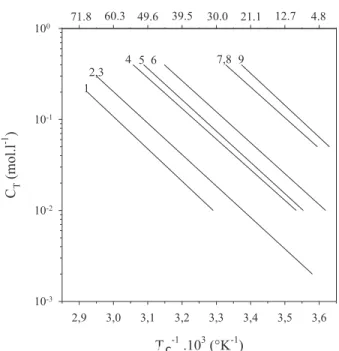
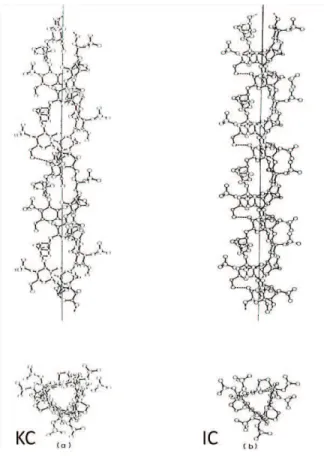
9:Tc (obtenu au refroidissement) en fonction de la concentration totale CT en ions libres pour KC (Rochas et al., 1980). Plusieurs auteurs ont montré que le module élastique des gels KC varie avec le carré de la concentration en KC (Baussay, 2005 ; Meunier et al., 1999).
Mélange caséines et polysaccharides
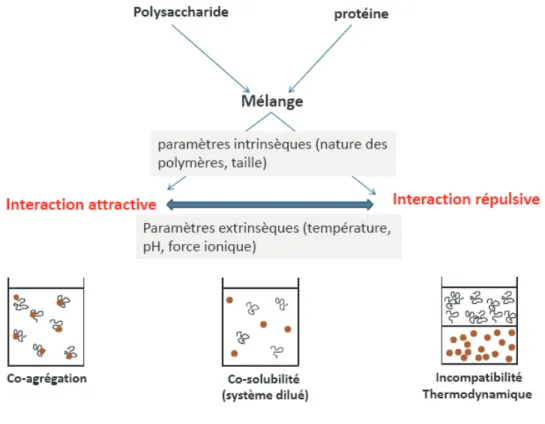
- Comportement et structure des mélanges polysaccharides -
- Nature des interactions dans les systèmes polysaccharides-protéines
- Mécanismes
- 1.2.2.1. Incompatibilité thermodynamique
- 1.2.2.2. Phénomène de déplétion- floculation
- 1.2.2.3. Diagramme de phase
- Co-agrégation
- Mélanges carraghénanes et caséines
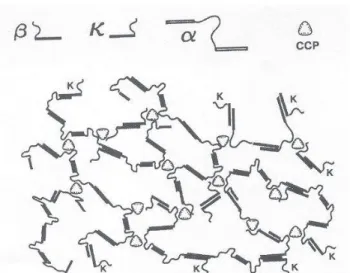
La microscopie électronique montre que le kappa-carraghénane se lie à diverses micelles de caséine (Martin et al., 2006). Langendorff et al., 1999) ont montré que la carraghénane interagit avec les micelles de caséine dans un état ordonné.
Matériels et méthodes
Préparation des échantillons
- Caséinate de sodium
- Submicelles de caséines
- Carraghénanes
La poudre de caséinate de sodium (SC) utilisée dans cette étude a été fournie par DMV international-France. Cette phase protéique est dialysée plusieurs fois contre de l'eau ultra pure Millipore contenant 200 ppm d'azoture de sodium pour éliminer les impuretés (sels). La poudre de carraghénane Kappa (KC) a été fournie par Cargill (emplacement HMRXZ), tout comme la carraghénane iota (IC) (emplacement HMRXSI).
Préparation des mélanges caséines/ carraghénanes
Le pH de la solution est ensuite ajusté à 9 pour éviter tout risque d'hydrolyse lors du traitement thermique. La solution à 100 mM de NaCl et à pH 7 ou 6 est dialysée plusieurs fois contre de l'eau millipore à pH 7 ou 6 respectivement contenant 200 ppm d'azoture de sodium et 100 mM de NaCl, pour éliminer toute trace de sels parasites résiduels (notamment potassium et calcium). ).
Méthodes
- Protocole
- Dosage des caséines
- Dosage des carraghénanes
- Marquage des caséines
- Marquage des carraghénanes
- Techniques expérimentales
- Techniques de diffusion de la lumière
Le marquage est réalisé en ajoutant la solution RITC directement au mélange de caséine et de KC afin que la concentration en RITC soit de 5 ppm dans l'échantillon. Pour déterminer la concentration en carraghénane dans le mélange, nous avons également utilisé des mesures viscosimétriques puisque la viscosité du carraghénane est directement corrélée à sa concentration (Croguennoc, Meunier, Nicolai et Durand, 2000). La diffusion classique de la lumière (diffusion statique et dynamique) nécessite que les échantillons observés soient transparents pour éviter les phénomènes de diffusion multiple.
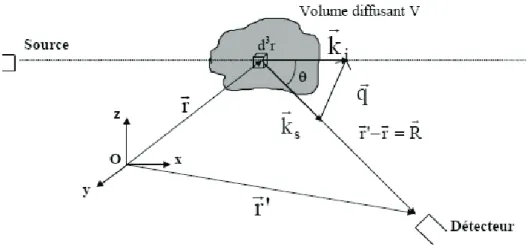
2.2.1.1. Diffusion statique de la lumière classique
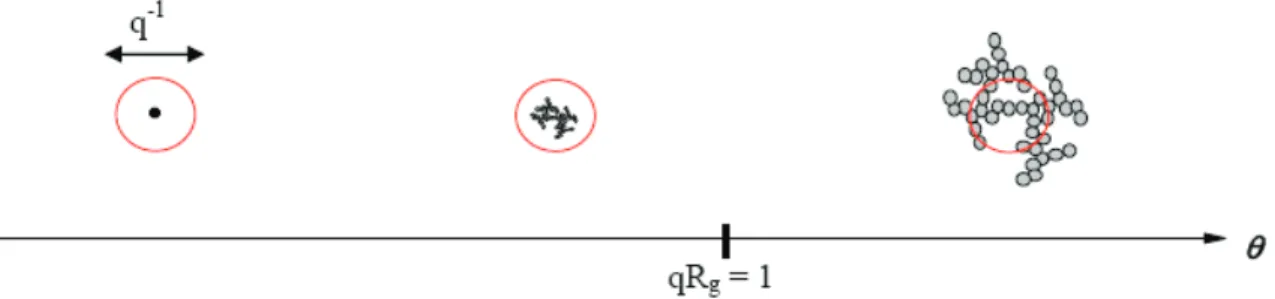
Le vecteur d'onde de lumière diffusée dans la direction q (angle d'observation), à la distance R de l'échantillon est krs. Les fluctuations de l'intensité de la lumière diffusée résultent principalement des fluctuations de la densité et de la température. Rref : rapport de référence de Rayleigh qui permet d'obtenir des valeurs absolues de l'intensité diffusée.
2.2.1.2. Diffusion dynamique de la lumière
Dans le cas où les particules sont polydispersées ou s'il existe plusieurs populations de particules, les fonctions de corrélation expérimentales peuvent être décrites par une distribution de temps de relaxation. Le programme GEX permet d'ajuster les distributions de temps de relaxation larges et continues que REPES a tendance à diviser en plusieurs pics. 17 où p, s et ta sont des paramètres réglables, ta détermine la position de la distribution sur l'axe des temps de relaxation, p et s déterminent la largeur de la distribution et l'asymétrie de la courbe.
2.2.1.3. Diffusion statique de la lumière en milieu turbide (3DLS)
- Microscopie confocale à balayage laser en mode fluorescence
- Rhéologie
L'appareil utilisé est une version commerciale d'un instrument de corrélation croisée 3D (LS Instrument, Fribourg, Suisse). Le principe de la microscopie confocale à ligne laser (MCBL en français et CLSM pour Confocal Laser Line Microscopy en anglais) est d'éliminer la lumière provenant des plans défocalisés qui parasite le plan focal. Lors d'un impact optique, des rayons lumineux sont émis depuis différents plans de la préparation.
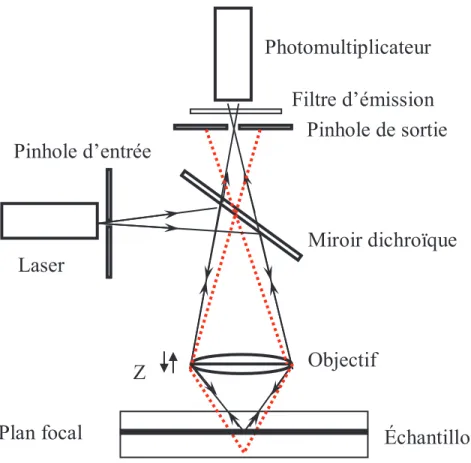
2.2.3.1. Etude en régime permanent
Pour nos observations, l'objectif à immersion dans l'huile ne convient pas car la différence d'indice de réfraction entre le milieu d'immersion et la préparation est trop importante. De manière générale, pour les mesures quantitatives, il faut se positionner en xyz afin d'éviter les effets d'interface sur la structure (il faut regarder le cœur de l'échantillon). La protéine marquée est observée à l'aide d'un laser à une longueur d'onde de 543 nm (PMT : émission enregistrée entre 555 et 700 nm).
2.2.3.2. Etude en régime oscillant
2.2.3.3. Appareillage et protocole expérimental
En comparant l'évolution de G' obtenue pour chacune des géométries (cône-plan (27 mm), plan-plan (espacement de 1 mm) et couverture (espacement de 10 mm) (voir Figure II.6), on constate que derrière la géométrie cône-plan, au lieu d'une augmentation constante de G', on observe une chute brutale de G'. Par contre, dans la géométrie plan-plan et couverture, le pic disparaît complètement car l'entrefer est plus grand, ce qui fait que permet de réduire les effets des interfaces.Le même type de rampe de température est réalisé sur le mélange avec la géométrie plan-plan en choisissant des fentes différentes.

1956), colorimetric method for the determination of sugars and related substances, analytical chemistry, characterization of sodium caseinate as a function of ionic strength, pH and temperature using static and dynamic light scattering, food hydrocolloids, fluorescent cellulose microfibrils as a substrate for the detection of cellulase activity, Biomacromolecules. 2001), A comparative study of protein molecular weights by size exclusion chromatography and laser light scattering, Journal of Pharmaceutical and Biomedical Analysis. Processus de gelification des caseines en présence de polyphosphates. 2007), Confocal microscopy of colloids, JOURNAL OF PHYSICS: CONDENSE MATTER, 19, 5.
Etude des mélanges SC et KC sous forme pelote
- Observation des images prises immédiatement après mélange (t 0 )
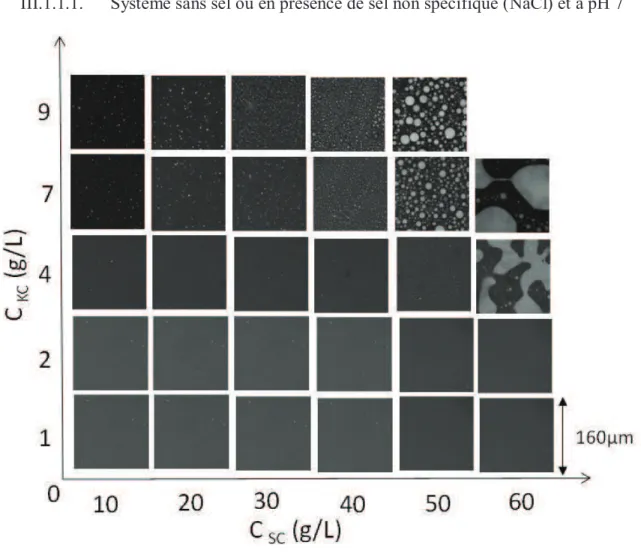
- Système sans sel ou en présence de sel non spécifique (NaCl) et à pH 7
- Etude du contraste
- Système en présence de sel spécifique (KCl) et à pH 7
- Observation au cours du vieillissement
- Domaine monophasique
- Domaine biphasique
- Analyse des agrégats
- Influence du vieillissement
- Influence de la dilution
- Influence de la force ionique et du pH
- Diagramme de phase
- Système en présence de NaCl et pH 7
- Système sans sel et à pH 7
- Conclusion
Figure 11 : Fraction de SC dans les granulats en fonction de la concentration en KC pour différentes concentrations totales de SC, à NaCl 0,1M et pH 7. Cette fraction augmente linéairement avec l'augmentation de la concentration en KC, mais ne dépend pas de la concentration totale de SC (figure III.11). L'évolution de la fraction de SC dans les agrégats a été mesurée en fonction de la force ionique (Figure III.
Gélification des mélanges monophasiques de SC et
- Température critique de gélification
- Etude cinétique
- Température critique de fonte
- Dépendance en fréquence des modules à 2°C
- Système avec un sel non spécifique du KC : sodium
- Influence de la température et dépendance en fréquence des modules à
- Influence de la concentration de SC et de KC
- Système avec un sel spécifique du KC : le potassium
- Système mixte en présence d’iodure de sodium
- Structure du gel mixte
- Conclusion
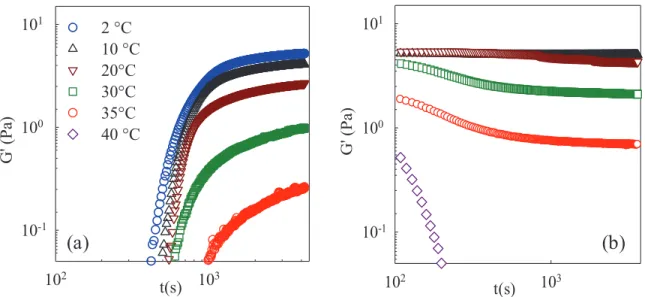
Pour toutes les concentrations de KC (1,5 g/l, 4 g/l et 7 g/l), le module d'élasticité à 2°C augmente avec l'augmentation de la concentration de SC. Pour une concentration de SC donnée, elle augmente avec l'augmentation de la concentration de KC (Fig. IV. 8). L'augmentation de la concentration de SC et de la concentration de KC conduit à des gels plus homogènes.

Etude comparative des SC et des submicelles de
Morphologie
Deux mélanges mixtes avec la même concentration de kappa-carraghénane (KC) 4g/L et à différentes concentrations en protéines ont été comparés : l'un avec des caséinates de sodium (SC) en présence de NaCl 0,1 M et l'autre avec des submicelles de caséine en présence de Tripolyphosphate de sodium 0, 1 M (NaTPP). Pour ces conditions, la séparation des phases des systèmes se produit simultanément et conduit à une phase riche en protéines et une phase riche en kappa carraghénane (Figure V. 1). Cependant, le système avec SC reste co-continu plus longtemps que celui avec les submicelles de caséine, pour lesquelles on passe rapidement à un milieu protéique continu.
Séparation de phase
Le contraste se développe de manière linéaire et identique pour les deux types de systèmes, indiquant que la séparation de phases se produit de manière identique pour les deux systèmes.
Formation des agrégats
Gélification des mélanges submicelles de caséines et KC
- Etude de la solution de KC
- Etude des mélanges homogènes
- Influence de la nature du sel
- Influence de la nature de la caséine
- Systèmes submicelles de caséine et KC
Les systèmes à différentes concentrations de submicelles de caséine (0-40 g/l) et à 4 g/l de KC, 0,5% de tripolyphosphate (conditions limites de dissociation) et à pH 6 ont été étudiés. Nous avons examiné l'effet de la concentration en submicelles de caséine sur les températures et modules critiques des gels. En revanche, les températures critiques de fusion augmentent brusquement lorsque des submicelles de caséine sont ajoutées (Figure V. 10), car la température critique de fusion dans le mélange est déterminée par les protéines.

Conclusion
- Etude cinétique
- Effet du type de sel
- Effet de la concentration de IC
- Effet de la force ionique
- Comparaison KC et IC
L'influence de la concentration de IC sur l'évolution du module G' en fonction de la température a été étudiée lors du refroidissement et du chauffage. L'évolution des températures critiques en fonction de la force ionique pour une solution IC ou KC à 2 g/L est donnée sur la Figure VI. Comme indiqué précédemment, les températures critiques pour IC et KC augmentent avec l’augmentation de la force ionique.
Etude des mélanges SC et IC sous forme pelote
- Morphologie
- Diagramme de phase
En présence de KCl 0,1 M, la dépendance en fréquence des modules d'élasticité à 2°C montre que les 2 solutions forment des gels et que le module du gel KC est 104 fois supérieur à celui de IC (figure VI. 8b). Deux types de mélanges sont observés : un mélange homogène (figure VI. 9a) et un mélange hétérogène (figure VI. 9b). La séparation de phase se déplace vers des concentrations élevées de SC car la chaîne IC est plus chargée que celle de KC.

Gélification des mélanges monophasiques SC et IC
- Influence de la concentration de SC
- Influence de la force ionique
Les modules G' en fonction de la température pendant le refroidissement et la fusion sont donnés sur la figure VI. Les modules de stockage G' à 1 Hz et 2 °C et les températures critiques ont été mesurés en fonction de la concentration de SC pour 2 g/L de IC. La figure 14a montre qu'à faible concentration totale de NaCl, la température critique de gélification du mélange est la même que la température critique de la solution IC pure.

Conclusion
The samples were mixed and heated at 60!C for 5 minutes and immediately observed at 20!C. Light areas are rich in protein. The frequency dependence of G0 and G00 showed that the system is still a viscous liquid at 2°C. The shear moduli at 2!C increased greatly with increasing SC concentration, and measurements of the frequency dependence of G0 and G00 indicated that the systems were gels when the amount of SC added was 3 g/L or more. The effect of SC inclusion in the KC network therefore depends on the strength of the latter.