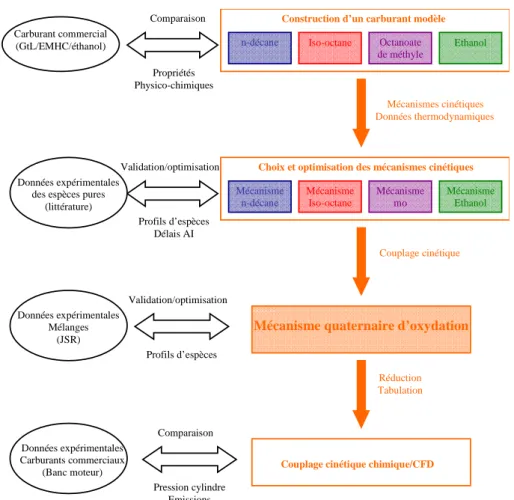
L’objectif principal de cette thèse est de mieux comprendre l’influence de la composition chimique du carburant sur la combustion du diesel. Le réacteur à agitation automatique a permis d'étudier l'oxydation d'espèces modèles représentatives des mélanges GtL/FAME/éthanol en fonction de la richesse, de la température et de la pression.
Contexte de l'étude
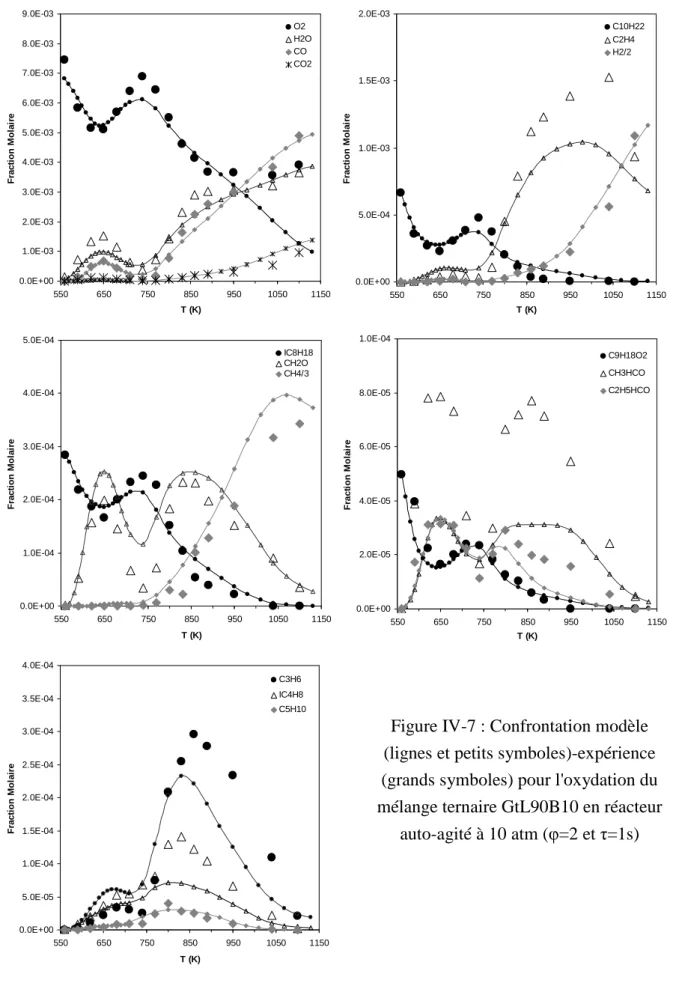
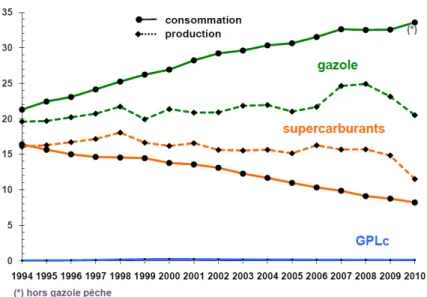
Biocarburant : les enjeux
- Épuisement des ressources fossiles
- Dérèglement climatique
- Une réglementation de plus en plus stricte
Cette augmentation de la concentration atmosphérique de CO2, connue sous le nom d'« effet de serre supplémentaire », est considérée comme le principal acteur de la récente augmentation de la température moyenne terrestre [4]. Alors que les conséquences annoncées de ce réchauffement climatique sont inquiétantes (élévation du niveau de la mer, extinction accrue des espèces animales, réduction des ressources en eau, etc.), de nombreux pays ont décidé de réduire leurs émissions de gaz à effet de serre [5] .
Les différentes filières de production des biocarburants
- Filière bioéthanol
- Production d'éthanol à partir des plantes sucrières
- Production d'éthanol à partir des plantes amylacées
- Limites à l'utilisation de l'éthanol carburant
- Filière des huiles végétales et leurs dérivés
- Production d'ester méthylique d'huile végétale
- Production d'huile végétale hydrotraitée
- Limites au développement de cette filière
- Biocarburants de deuxième génération
- Biomasse lignocellulosique
- Voie biochimique
- Voie thermochimique
Les sucres issus de l'hydrolyse de la biomasse lignocellulosique doivent ensuite être transformés en éthanol dans des fermenteurs. En l’absence d’oxygène et sous l’influence de la chaleur, les composants de la biomasse se transforment en trois phases valorisables : solide (charbon), liquide (pétrole de pyrolyse) et gazeuse (principalement CO, H2, CO2 et CH4).
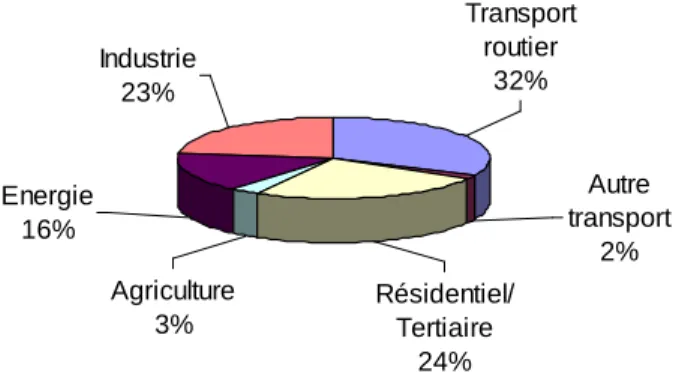
Identification de mélanges carburants alternatifs pour moteur Diesel
- Intérêt de l'ajout d'éthanol dans le pool gazole
- Techniques de mélange gazole/éthanol
- Propriétés des mélanges gazole/éthanol
- Stabilité
- Viscosité
- Pouvoir lubrifiant
- Masse volumique
- Indice de cétane
- Pouvoir calorifique
Il est donc essentiel de quantifier l’impact de l’ajout d’éthanol sur les caractéristiques du diesel afin de garantir la viabilité des mélanges diesel/éthanol comme carburants. Le principal obstacle à l’utilisation de l’éthanol dans les moteurs diesel est sa faible solubilité dans le diesel.
Impact des mélange gazole/éthanol sur les performances du moteur
- Effet sur la combustion
- Consommation
- Rendement thermique
- Émissions polluantes
- Monoxyde de carbone
- Hydrocarbures imbrûlés
- Oxydes d'azote
- Particules
- Optimisation
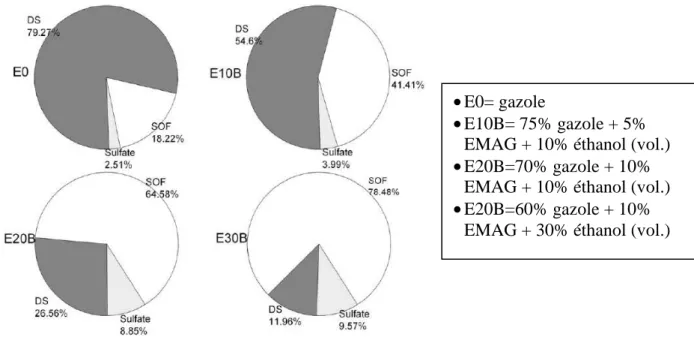
La majorité des études s'accordent sur le fait que l'augmentation de la fraction d'éthanol dans le carburant réduit considérablement les émissions de particules. L’incorporation de composés oxygénés dans le carburant diesel influence fortement la composition des particules formées lors de la combustion.
Conclusion
Ce type de carburant permet donc d'établir un taux EGR élevé sans altérer les émissions de particules. Cet excellent compromis entre émissions de NOx et de particules est l'un des principaux avantages des mélanges diesel/éthanol [33,66].
Choix d’un carburant modèle pour la combustion de biocarburants
- Introduction
- Méthodologie de construction d'un carburant modèle
- Choix d’espèces modèles représentatives du GtL
- Choix d’espèces modèles représentatives de l’EMHC
- Mise au point du carburant modèle
- État de l'art sur l'oxydation des hydrocarbures
- Mécanisme d'oxydation à basse température
- Coefficient négatif de température
- Mécanisme d'oxydation a haute température
- État de l'art sur l'oxydation des esters méthyliques
- État de l'art sur l'oxydation de l'éthanol
- Démarche globale de modélisation
- Conclusion
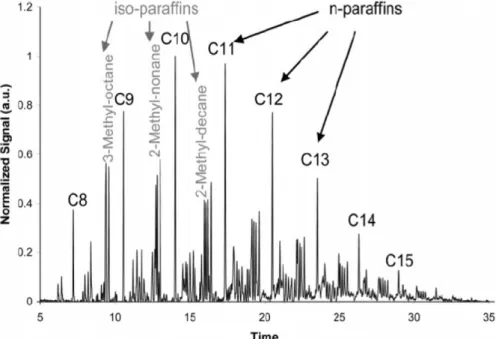
De plus, la réactivité des esters méthyliques plus longue que l'octanoate de méthyle est presque identique sauf à basses températures (voir Figure II-4). Nous comparerons les prédictions de ce mécanisme avec nos résultats expérimentaux obtenus dans un réacteur auto-agité lors de l'oxydation de mélanges n-décane/isooctane/octanoate de méthyle/éthanol à différentes richesses.
Développement et validation du mécanisme cinétique
Base C0-C4
- Choix du sous-mécanisme initial
- Modifications apportées
Les réactions impliquées dans l'oxydation d'un hydrocarbure peuvent être classées selon 2 catégories. Certaines réactions pseudo-bimoléculaires ou unimoléculaires de la base C0-C4 de Le Cong [144] ont été expliquées à plusieurs reprises, à une pression donnée (1, 10 ou 100 atm). Les nouvelles constantes de taux adoptées ont été déterminées par la méthode des moindres carrés.

Sous-mécanisme d'oxydation du n-décane
- Choix du sous-mécanisme initial
- Modifications apportées
- Confrontations modèle/expériences
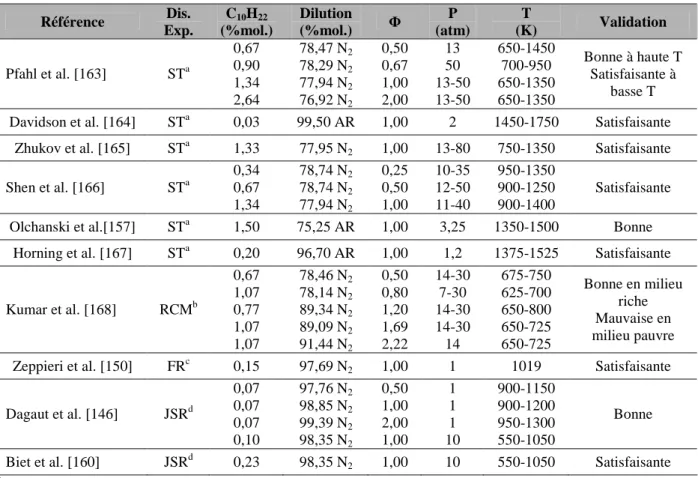
La figure III-1 illustre l'influence de la richesse sur les temps d'auto-inflammation du n-décane. La figure III-2 illustre l'influence de la pression sur l'auto-inflammation du n-décane dans un tube à choc. Les résultats expérimentaux suggèrent que les temps d'auto-inflammation du n-décane diminuent avec l'augmentation de la température.
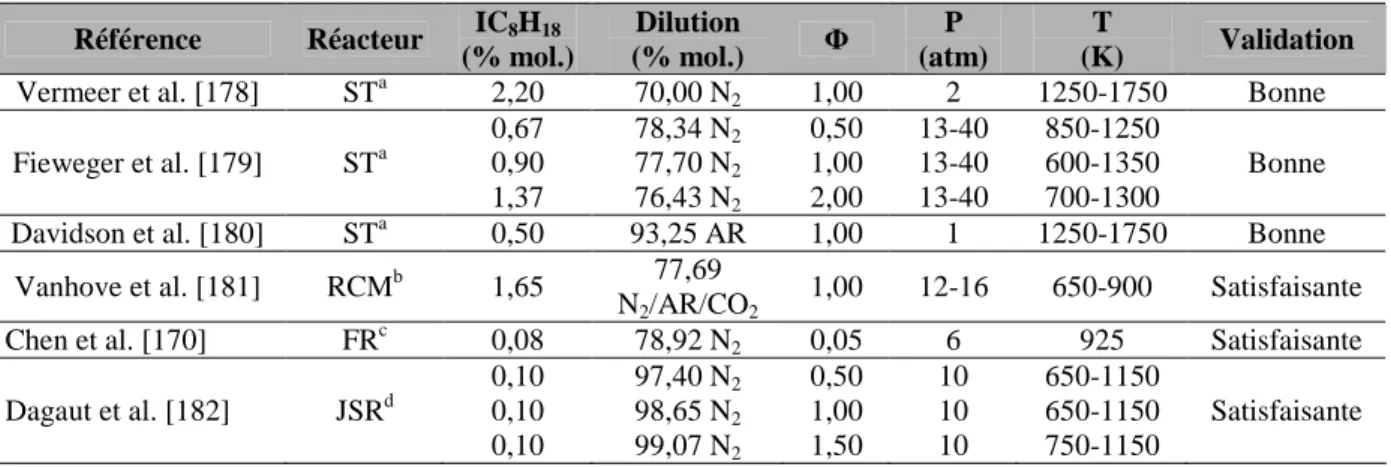
Sous-mécanisme d'oxydation de l'iso-octane
- Mécanisme initial
- Modifications apportées
- Confrontations modèle/expérience
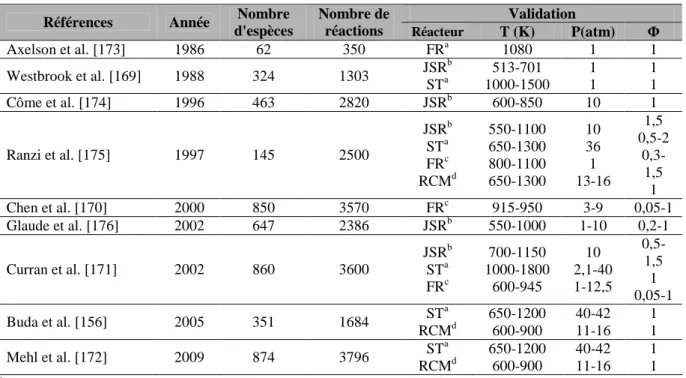
Les constantes de vitesse des réactions en question ont donc été ajustées pour mieux prédire les temps d'auto-inflammation de l'iso-octane. Les prédictions du sous-mécanisme de l'isooctane ont été comparées aux données expérimentales disponibles dans la littérature. Toutes les conditions expérimentales utilisées pour la validation du sous-mécanisme d'oxydation de l'isooctane sont résumées dans le tableau III-6.
Sous-mécanisme d'oxydation de l'octanoate de méthyle
- Mécanisme initial
- Modifications apportées
- Confrontations modèle/expérience
Les prédictions de notre sous-mécanisme d'oxydation de l'octanoate de méthyle ont été comparées aux rares données expérimentales disponibles dans la littérature. La figure III-7 montre les temps d'auto-inflammation expérimentaux et simulés de l'octanoate de méthyle pour une pression de 10 atm et 3 richesses différentes (0,5 ; 1 et 2). Les données expérimentales limitées disponibles concernant l'oxydation de l'octanoate de méthyle n'ont pas permis de valider notre sous-mécanisme sur une plage expérimentale aussi diversifiée que pour d'autres composés.
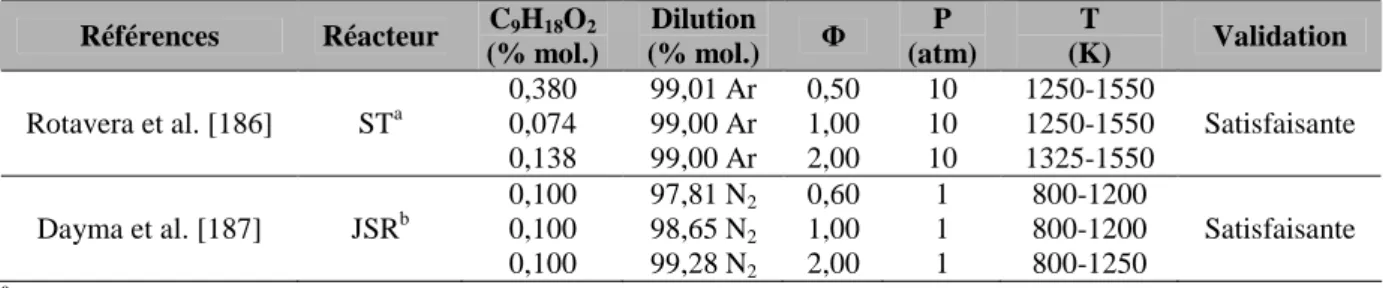
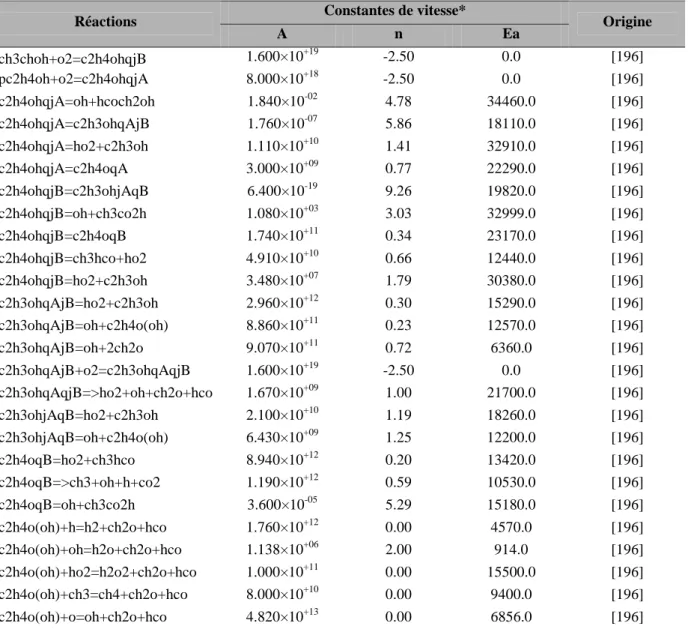
Sous-mécanisme d'oxydation de l'éthanol
- Mécanisme initial
- Modifications apportées
- Confrontation modèle/expérience
Comme expliqué dans la section précédente, le mécanisme de Marinov a servi de base aux simulations numériques de l'oxydation de l'éthanol. Les prédictions du modèle cinétique ont été comparées à plusieurs résultats expérimentaux disponibles dans la littérature sur l'oxydation de l'éthanol pur. 193] ont étudié l'oxydation stoechiométrique de l'éthanol dans un réacteur à flux à une température de 830 K et une pression de 9 atm.
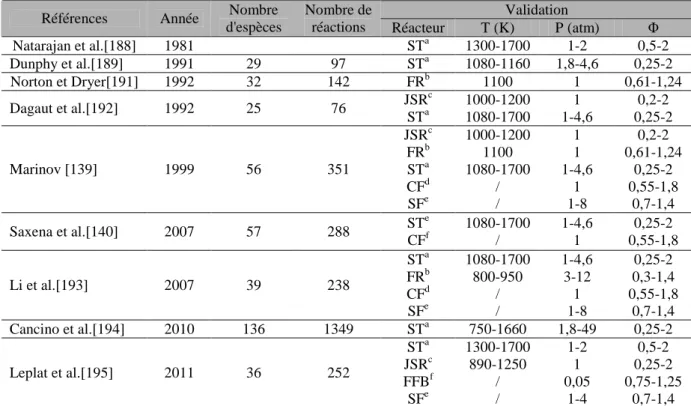
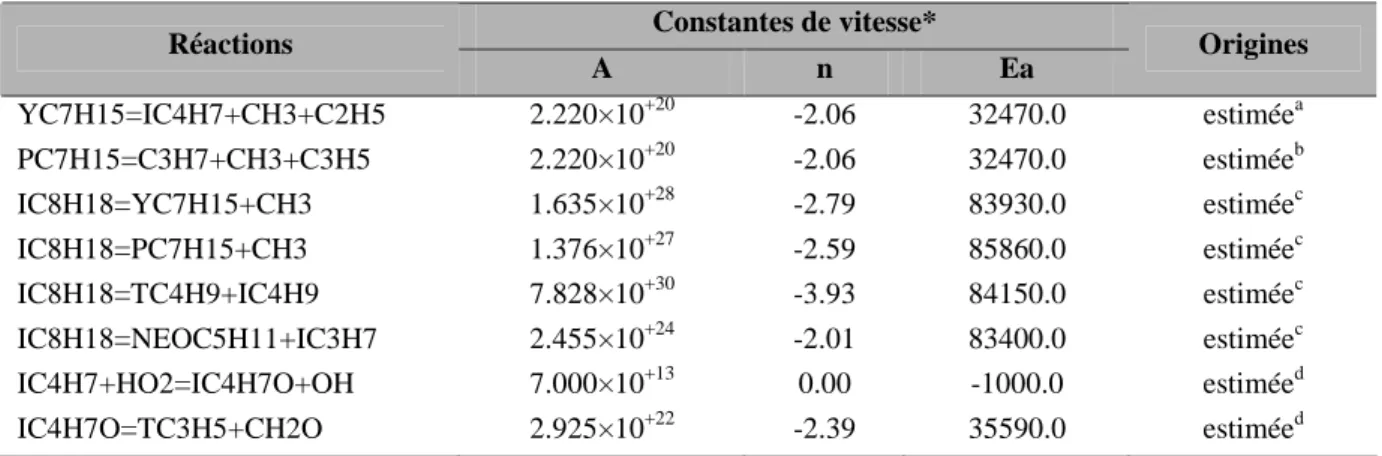
Mise au point du mécanisme quaternaire
- Elaboration du mécanisme global
- Validation
Les prédictions du modèle ont également été testées par rapport à des données expérimentales liées à l'étude de l'oxydation de mélanges binaires simples constitués de 2 des 4 espèces décrites dans notre mécanisme cinétique quaternaire. Ces tests garantissent que le couplage des 4 sous-mécanismes a bien fonctionné et que les réactions d'interaction entre les différents blocs sont suffisantes pour décrire la cinétique d'oxydation des mélanges. La figure III-13 représente les profils expérimentaux ainsi que les prédictions du modèle lors de l'oxydation d'un mélange octanoate de méthyle/éthanol (80/20%mol.) à la stœchiométrie pour une pression de 10 atm.
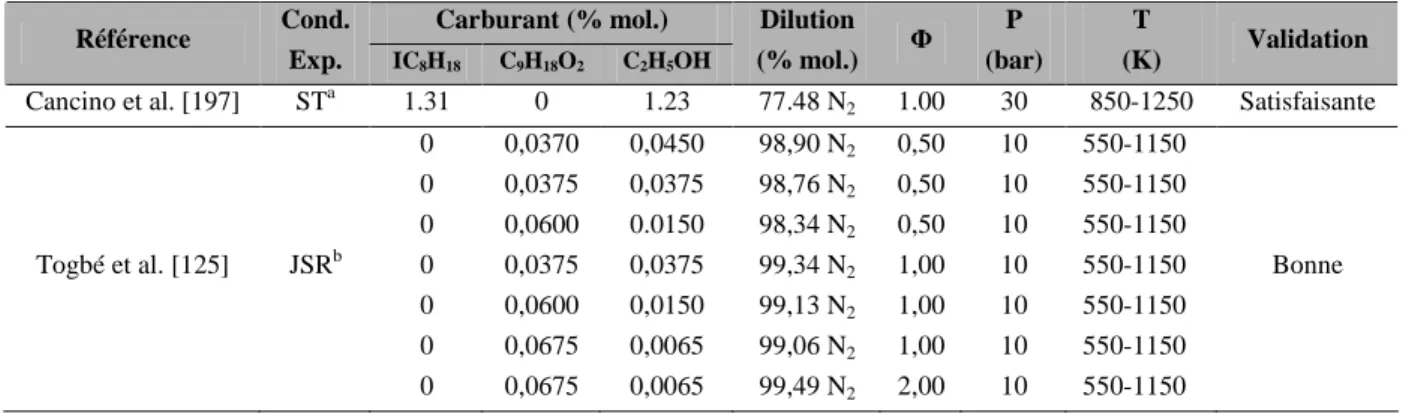
Conclusion
2009): Experimental and computational study of methyl ester degradation pathways using shock tubes, Proceedings of the Combustion Institute, vol. 2007). Wide range modeling of isooctane oxidation, Combustion and Flame, vol. 2002): Modeling the oxidation of primary reference automotive fuel mixtures, Energy & Fuels, vol. 2005): Chemical kinetic modeling of dimethyl carbonate in an opposed-flow diffusion flame, Proceedings of the Combustion Institute, vol. 2000): A shock tube study and modeling of the pyrolysis and oxidation of acetone, Combustion and Flame, vol.
Étude expérimentale de l'oxydation de constituants de biocarburant en JSR
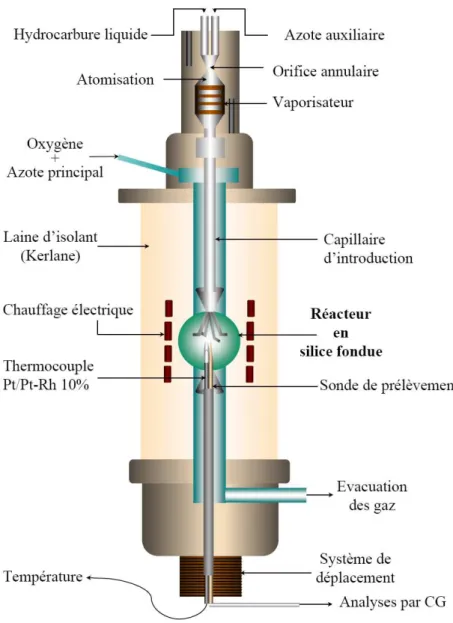
Présentation du réacteur auto-agité par jet gazeux
- Principe de fonctionnement
- Description du réacteur auto-agité
- Calcul des débits
- Analyse des échantillons
- Analyse FTIR
- Analyse par chromatographie en phase gazeuse
- Analyse par spectrométrie de masse
- Répétabilité et incertitude de mesure
- Répétabilité des essais
- Estimation de l’incertitude de mesure
Les produits formés lors de la combustion ont été échantillonnés à l'aide d'une sonde sonique à quartz. Le maintien d'une différence de pression significative entre les gaz dans le réacteur (10 atm) et la sonde de prélèvement (50 mbar) permet de figer la réaction et ainsi d'obtenir un mélange gazeux contenant les produits de combustion. La répétabilité des tests dans un réacteur à jet de gaz auto-agité a été évaluée dans une étude de Dagaut et al.
Étude de l'oxydation de mélanges binaires
- Protocole expérimental
- Résultats expérimentaux et validation du mécanisme
Dans un environnement pauvre, on observe que l'oxydation des deux réactifs augmente à basse température (voir Figure IV-2). Cependant, le modèle sous-estime encore une fois les quantités d’acétaldéhyde formées sur toute la plage de température. Dans le milieu riche, la réactivité à basse température des deux réactifs est légèrement réduite (voir Figure IV-4).
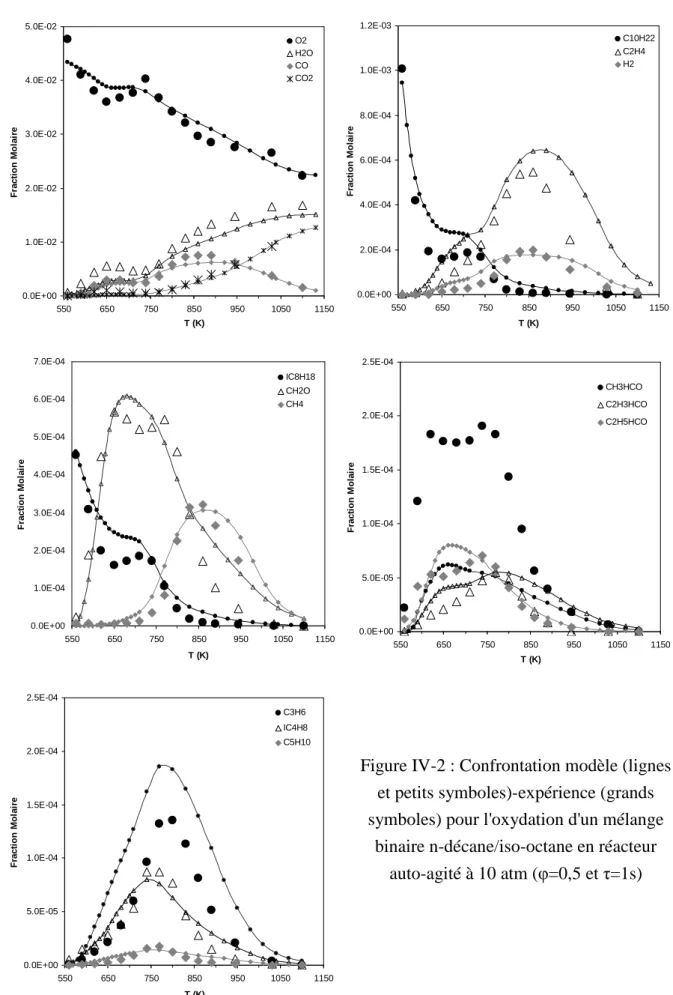
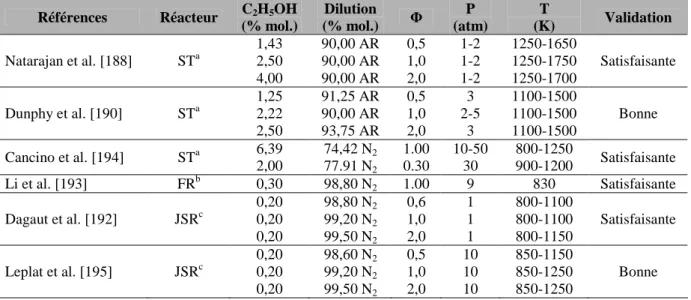
Étude de l'oxydation de mélanges ternaires
- Protocole expérimental
- Résultats expérimentaux et validation du mécanisme
- Oxydation du mélange GtL90B10
- Oxydation du mélange GtL40B60
- Analyse de voies réactionnelles et de sensibilité
Dans des environnements pauvres, la réactivité à basse température est supérieure à celle à la stœchiométrie (voir Figure IV-5). La figure IV-9 montre la comparaison entre les prédictions du modèle et les résultats expérimentaux pour l'oxydation du mélange GtL40B60 dans un réacteur à agitation automatique à stoechiométrie. La figure IV-10 présente les résultats expérimentaux et les prédictions du mécanisme cinétique obtenu lors de l'oxydation du mélange GtL40B60 dans un réacteur à agitation automatique en milieu riche.
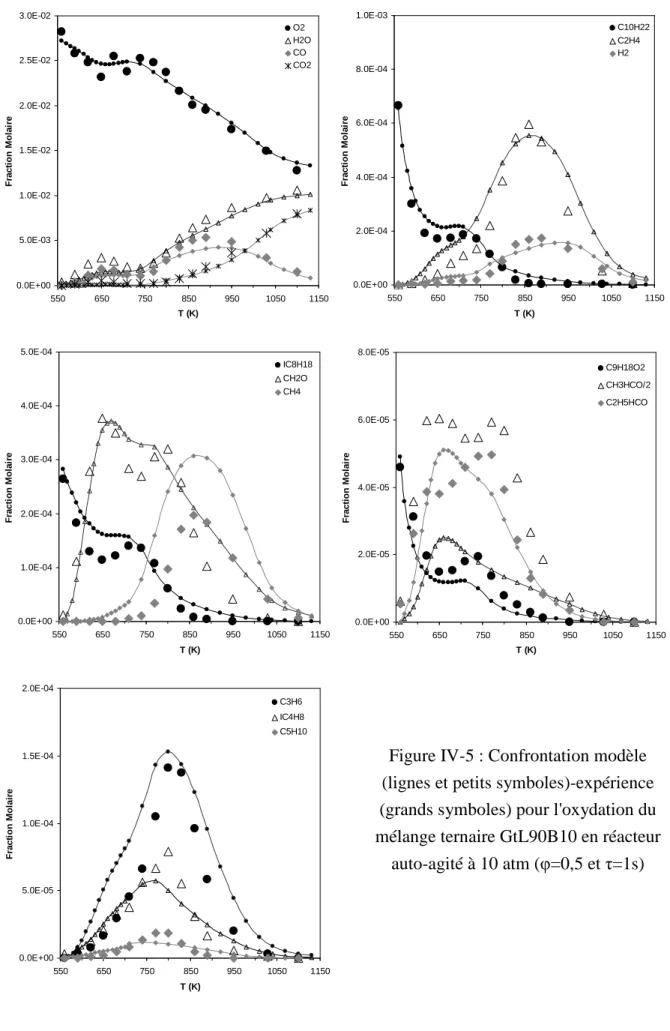
Étude de l'oxydation de mélanges quaternaires
- Protocole expérimental
- Résultats expérimentaux et validation du mécanisme
- Oxydation du mélange GtL80B10E10
- Oxydation du mélange GtL60B20E20
- Oxydation du mélange GtL40B30E30
- Impact de l’éthanol sur la réactivité du mélange
Dans un environnement pauvre, la plus grande quantité d'oxygène disponible limite l'effet inhibiteur de l'éthanol (voir Figure IV-23). En milieu riche, l'effet de l'éthanol sur la réactivité est le plus visible (voir Figure IV-25). Néanmoins, l’effet le plus prononcé de l’éthanol sur la réactivité est observé dans le milieu riche.
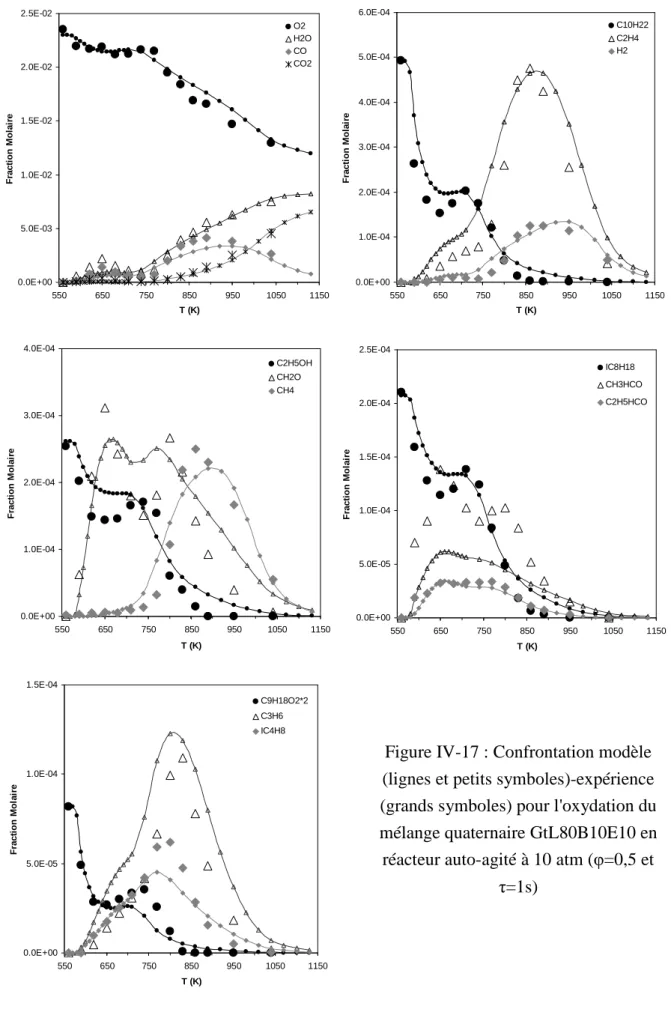
Conclusion
2008): Detailed chemical kinetic oxidation mechanism for a biodiesel surrogate, Combustion and Flame, vol. 2007): Rapeseed oil methyl ester oxidation over extended ranges of pressure, temperature and equivalence ratio: experimental and modeling kinetic studies, Proceedings of the Combustion Institute, vol. 2009): Experimental and kinetic modeling of methyl decanoate extinction and ignition in laminar non-premixed flows, Proceedings of the Combustion Institute, vol. 2010): Detailed chemical kinetic mechanism for the oxidation of biodiesel fuels, surrogate blend, Combustion and Flame, vol. A detailed chemical kinetic model for ethanol oxidation at high temperatures, International Journal of Chemical Kinetics, vol. 2007): Numerical and experimental studies of ethanol flames, Proceedings of the Combustion Institute, vol.
Étude expérimentale de la combustion de biocarburants en moteur
Présentation des moyens d’essais
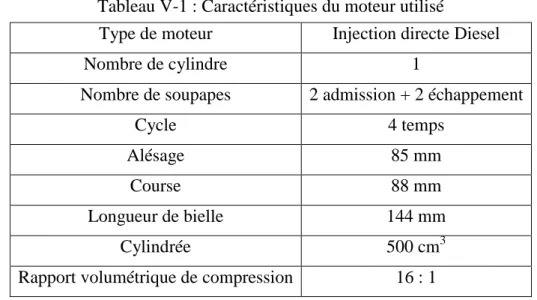
- Caractéristiques du moteur utilisé
- Configuration du circuit EGR
- Méthodes de prélèvement et d'analyse
- Prélèvement et analyse des polluants réglementés
- Prélèvement et analyse des HC légers C 1 -C 9
- Prélèvement et analyse des aldéhydes et des cétones
- Répétabilité des essais et incertitude de mesure
Le moteur est équipé d'un circuit de recirculation des gaz d'échappement avec deux échangeurs qui permettent de réguler la température des gaz brûlés avant leur réadmission. Des mesures de fumée ont été effectuées tout au long de notre expérience avec un fumimètre AVL 415S. Les HC de type C1-C9 sont séparés par une colonne Al2O3KCl et détectés individuellement par un détecteur à ionisation de flamme (FID).
Méthodologie
- Matrice carburant
- Conditions expérimentales
- Présentation des résultats
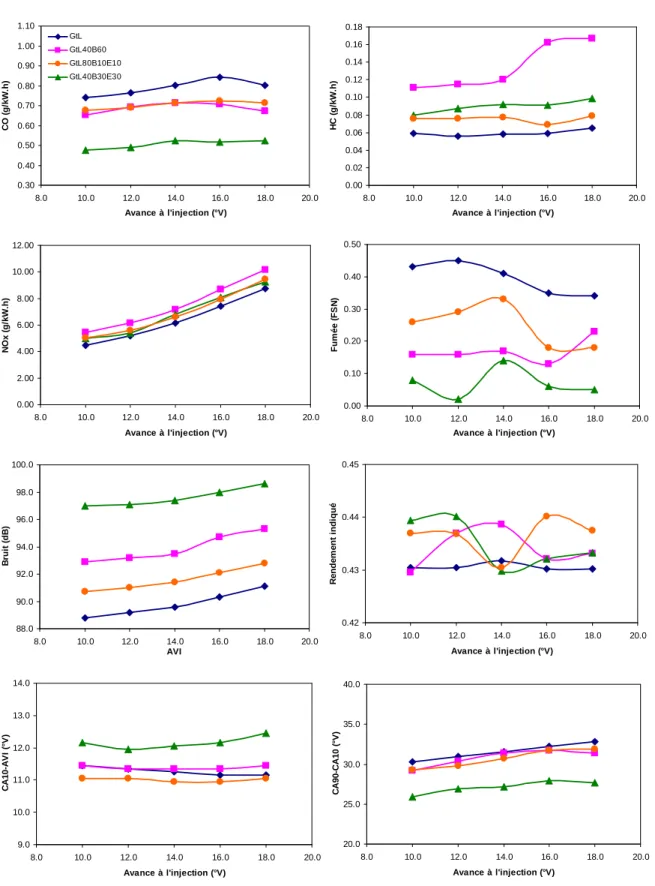
Pour assurer la répétabilité des mesures, des analyses de polluants ont été réalisées avec le carburant de référence en trois points du moteur testé en début et en fin d'essais. La comparaison des résultats obtenus avec ces deux mélanges permet d'étudier l'influence spécifique de l'éthanol sur la combustion du pétrole. Pour cela, le CSI a été minimisé pour chacun des carburants en ajustant l'avance à l'injection.
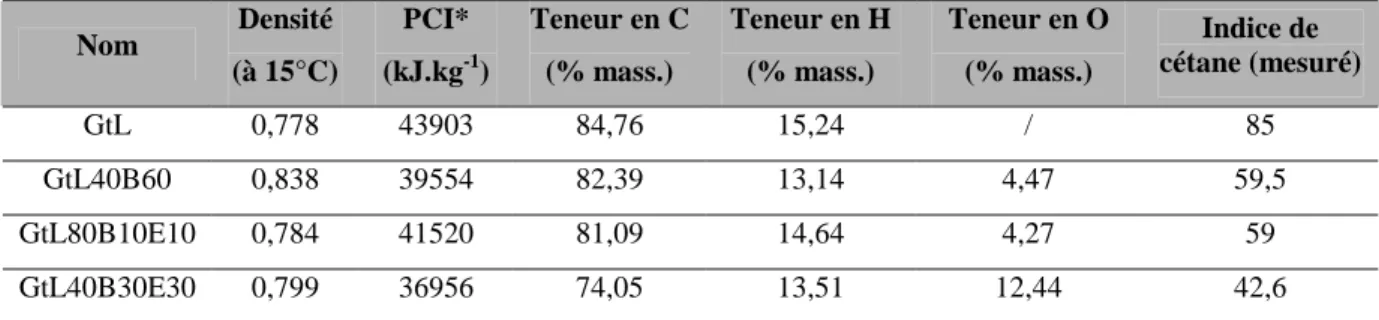
Point de fonctionnement 1500 tr/min - 3 bar
- Iso-réglages
- Variation AVI
- Variation EGR
- Optimisation
- Polluants réglementés
- Polluants non-réglementés
On constate que l'ajout de composés oxygénés au mélange entraîne une augmentation du CSI par rapport au GtL. Cela est dû à la chaleur latente élevée de vaporisation de l’éthanol qui provoque une baisse de température dans la chambre de combustion. Les principaux aldéhydes et cétones identifiés lors de la combustion des quatre carburants étudiés sont présentés sur la figure V-13.

Point de fonctionnement 2500 tr/min - 6 bar
- Iso-réglages
- Variation AVI
- Variation EGR
- Optimisation
- Polluants réglementés
- Polluants non réglementés
Comme nous l'avons vu dans les figures précédentes, les émissions de NOx sont à peu près équivalentes pour les quatre carburants testés à ce point de fonctionnement (voir Figure V-18). Une fois optimisées, les émissions de CO des quatre combustibles pour ce point de fonctionnement sont du même ordre de grandeur (voir Figure V-20). Les émissions de HC mesurées à ce point de fonctionnement sont très faibles, quel que soit le carburant (voir Figure V-21).
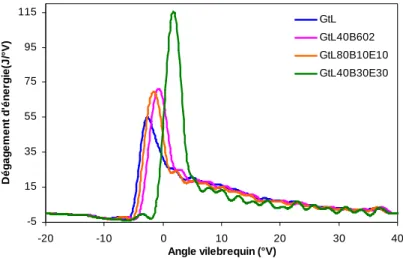
Point de fonctionnement 2000 tr/min - 11 bar
- Iso-réglages
- Variation AVI
- Variation EGR
- Optimisation
- Polluants réglementés
- Polluants non réglementés
2008): Thermochemistry of C-O, (CO)-O and (CO)-C bond breaking in fatty acid methyl esters, Combustion and Flame, vol. 2010): Biodiesel combustion: advances in chemical kinetic modeling, Advances in Energy and Combustion Science. 2009): An experimental investigation of structural effects on the autoignition properties of two C5 esters, Proceedings of the Combustion Institute, vol. 2010): Oxidation of methyl and ethyl butanoates, International Journal of Chemical Kinetics, vol. 1995): Experimental study of the oxidation of n-heptane in a jet-stirred reactor from low to high temperature and pressures up to 40 atm, Combustion and Flame, vol. 2002): Ethanol oxidation and its interaction with nitric oxide, Energy & Fuels, vol.
![Figure I-7 : (a) micelle gazole/EMAG/ethanol (b) complexe moléculaire formé par coalescence [29]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465566.70711/30.892.153.750.107.311/figure-micelle-gazole-ethanol-complexe-moléculaire-formé-coalescence.webp)
![Figure II-5 : Voies réactionnelles d’une flamme laminaire d’éthanol pré-mélangé [140]](https://thumb-eu.123doks.com/thumbv2/1bibliocom/465566.70711/61.892.274.663.536.940/figure-voies-réactionnelles-flamme-laminaire-éthanol-pré-mélangé.webp)