TRIAGEM NEONATAL PARA TOXOPLASMOSE
CONGÊNITA NO ESTADO DE MINAS GERAIS:
RESULTADOS DO PRIMEIRO EXAME OFTALMOLÓGICO.
Belo Horizonte
Minas Gerais – Brasil
TRIAGEM NEONATAL PARA TOXOPLASMOSE
CONGÊNITA NO ESTADO DE MINAS GERAIS:
RESULTADOS DO PRIMEIRO EXAME OFTALMOLÓGICO.
Tese apresentada ao Programa de Pós-Graduação em medicina da
Universidade Federal de Minas Gerais, com requisito parcial para a
obtenção do título de Doutor.
Área de Concentração: Oftalmologia
Orientador: Prof. Dr. Fernando Oréfice
Co - Orientador: Prof. Dr. Wesley Ribeiro Campos
Faculdade de Medicina da UFMG
Belo Horizonte – Minas Gerais – Brasil
2008
Magnífico Reitor
Prof. Ronaldo Tadêu Pena
Pró-Reitor de Pós-Graduação
Prof. Jaime Arturo Ramirez
Pró-Reitor de Pesquisa
Prof. Carlos Alberto Pereira Tavares
Diretor da Faculdade de Medicina
Prof. Francisco José Penna
Diretora do Hospital das Clínicas
Profª. Tânia Mara Assis Lima
Coordenador do Centro de Pós-Graduação da Faculdade de Medicina
Prof. Carlos Faria Santos Amaral
Coordenador do Curso de Pós-Graduação em Oftalmologia
Prof. Joel Edmur Boteon
Profª. Ana Rosa Pimentel de Figueiredo
Membros do Colegiado do Curso de Pós-Graduação em Oftalmologia
Prof. Joel Edmur Boteon Prof. Márcio Bittar Nehemy
Prof. Marco Aurélio Lana Peixoto
Prof. Sebastião Cronemberger Sobrinho
Prof. Evaldo Nascimento Prof. Fernando Oréfice
Prof. Henderson Celestino de Almeida
Prof. Homero Gusmão de Almeida
Representante discente: Leonardo Rodrigues Pereira
ESTADO DE MINAS GERAIS: RESULTADOS DO PRIMEIRO EXAME OFTALMOLÓGICO”, apresentada e defendida em sessão pública, por Danuza de
Oliveira Machado Azevedo, para a obtenção do grau de Doutor em Medicina, pelo curso de pós-graduação em Medicina, área de Oftalmologia, Faculdade de Medicina da Universidade Federal de Minas Gerais.
_________________________________________________________________ Prof. Dr. Fernando Oréfice
_________________________________________________________________ Prof. Dr. Wesley Ribeiro Campos
_________________________________________________________________ Prof. Dr. André Luiz Land Curi
_________________________________________________________________ Prof. Dr. Francisco Max Damico
_________________________________________________________________ Prof. Dr. Rogério Alves Costa
_________________________________________________________________ Dra Edilaine Márcia Fernandes Camargo
Suplentes:
_________________________________________________________________ Dr. Daniel Vítor de Vasconcelos Santos
_________________________________________________________________ Dr. Rafael Ernani Almeida Andrade
Belo Horizonte, 27 de março de 2008.
Eu dedico esta tese a pessoas muito especiais e que sempre estiveram ao meu lado:
Ao meu pai Gilberto, pela educação e dedicação ilimitada durante toda a vida. À minha mãe Shirley, pelo amor e apoio incondicional.
As minhas irmãs Alessandra e Daniela, que são minhas melhores amigas e tornam
minha vida mais alegre.
Ao Daniel, meu marido, pela ajuda, paciência e carinho. Sempre com idéias
inteligentes e palavras tranqüilizadoras.
Ao Professor Dr. Fernando Oréfice, Titular do Departamento de Oftalmologia da Faculdade de Medicina de Minas Gerais que, além de orientar, mostrou o
caminho a ser seguido, sempre seguro, preciso e determinado. Exemplo de profissional dedicado ao estudo e ensino das uveítes. Um mestre.
Ao Professor Dr. Wesley Ribeiro Campos, Chefe do Serviço de Uveítes do
Hospital São Geraldo, pela disponibilidade e dedicação dispensadas a execução deste trabalho. Exemplo de profissional dedicado e que esteve ao meu lado em todos os momentos sempre com boas idéias e, principalmente com uma palavra
amiga.
Ao Dr. Daniel Vítor pela ajuda fundamental na execução e revisão deste
trabalho, e pela oportunidade de convivência e aprendizado durante todos esses meses. Além de amigo, exemplo de pesquisador e médico.
À Dra. Gláucia M. Queiroz de Andrade pelo carinho, atenção e esclarecimentos em todos os momentos que precisei além da oportunidade de participar deste projeto.
Ao Dr. José Nélio (NUPAD) pela oportunidade de participar deste projeto tão importante.
À Dra. Éricka Carelos pela convivência, alegria, disposição e por dividir seus conhecimentos em pediatria conosco.
Ao Dr. André Curi, grande amigo e grande incentivador.
Anna Cristina Higino e Dra. Thais F. Bessa pela amizade e ajuda enquanto estive afastada das minhas atividades.
À Bernadete, pela dedicação, amizade e profissionalismo durante todos esses anos. Sempre com uma palavra de apoio e incentivo, principalmente nas horas difíceis.
As meninas do NUPAD pelo auxílio durante o exame dos recém-nascidos. Aos recém-nascidos e suas mães pela disponibilidade em ajudar na melhor
compreensão da toxoplasmose congênita, participando deste trabalho.
“Fui mudando minha angústia numa força heróica de asa.
Para construir cada músculo houve universos de lágrimas.
Devo-te o modelo justo: sonho, dor, vitória e graça.”
Cecília Meireles
Introdução: A infecção pelo Toxoplasma gondii quando adquirida durante a gravidez, pode atravessar a placenta e resultar na infecção congênita do feto. A retinocoroidite é
considerada a principal manifestação clínica e seqüela dessa doença. Estudos de prevalência da toxoplasmose congênita no Brasil são raros. É importante conhecermos a verdadeira dimensão da infecção em Minas Gerais para a elaboração
de medidas preventivas e assim tentar diminuir a sua ocorrência.
Objetivos: determinar a prevalência dos recém-nascidos com toxoplasmose
congênita no Estado de Minas Gerais. Descrever as características clínicas das lesões oculares observadas no primeiro exame oftalmológico dos recém-nascidos triados pelo programa de triagem neonatal para a toxoplasmose congênita no Estado.
Metodologia: 146.237 recém-nascidos foram triados pelo programa de triagem neonatal para a toxoplasmose congênita, realizado no Estado de Minas Gerais, no
período de novembro de 2006 a maio de 2007. A triagem neonatal, através da pesquisa de IgM anti-toxoplasma, identificou 221 recém-nascidos positivos que foram encaminhados para sorologia confirmatória pareada da mãe e do
recém-nascido, exame pediátrico, auditivo, neurológico e avaliação oftalmológica (oftalmoscopia binocular indireta). Desses, 183 foram confirmados para a
toxoplasmose congênita através de critérios clínicos e laboratoriais. As lesões de retinocoroidite observadas foram classificadas como presentes e ausentes. Quando presentes analisaram-se os seguintes itens: lateralidade, distribuição topográfica, e
atividade da lesão. Outros achados oculares tais como estrabismo, embainhamento vascular, opacidades vítreas e microftalmia, também foram descritos. Os dados
Resultados: a prevalência estimada da toxoplasmose congênita no estado de Minas Gerais, no momento do primeiro exame oftalmológico, foi de: 1/799 nascidos vivos.
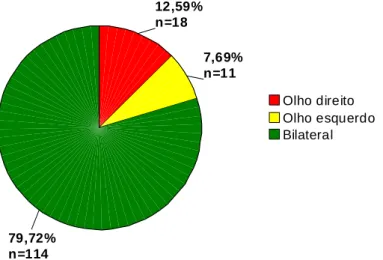
A prevalência de lesão ocular observada no primeiro exame de fundo de olho destes recém-nascidos foi de 78,1% (143/183). O quadro ocular foi bilateral em 79,7% (114/143) e a mácula afetada em 79% (113/143) dos casos. A cicatriz de
retinocoroidite foi a principal lesão ocular observada em 77,7% (111/143) dos RN. O estrabismo foi a principal alteração ocular associada à retinocoroidite e ocorreu em
19,6% (28/143) dos casos. Dos 41 pacientes com alteração neurológica detectadas pelos exames de imagem, 92,7% (38/41) apresentou lesão de retinocoroidite e 82,5% (33/40), envolvimento macular.
Conclusões: O presente trabalho confirmou que a toxoplasmose congênita apresenta alta prevalência no Estado de Minas Gerais e identificou recém-nascidos
infectados aparentemente normais ao exame de rotina neonatal, mas com alta prevalência de doença retiniana e neurológica ao exame específico. Portanto, esta doença merece especial atenção das autoridades de saúde e sua inclusão em
programas de triagem deveria ser levada em consideração.
Palavras-chave: toxoplasmose congênita, triagem neonatal, retinocoroidite, calcificações intracranianas.
Introduction: Acquired toxoplasmosis during pregnancy can cause a congenital infection of the fetus. Retinochoroiditis is the most common ocular finding and the most frequent sequel of congenital toxoplasmosis. Prevalence studies of disease in Brazil
are scarce. It is important to know the real dimension of infection in the state of Minas Gerais to elaborate strategies for preventing and controlling congenital toxoplasmosis.
Objectives: The purpose of this study is to determine the prevalence of congenital toxoplasmosis in the state of Minas Gerais. Another aim is to describe clinical characteristics of ocular lesions noticed at the first ophthalmologic exam in infected
newborns from the neonatal screening program for congenital toxoplasmosis in Minas Gerais.
Methods: 146,237 newborns were identified by the neonatal screening program of congenital toxoplasmosis in Minas Gerais from November 2006 until May 2007. This program identified 221 newborns suspected of congenital toxoplasmosis. All of them
were submitted to confirmatory assays, pediatric, auditive, neurological and ophthalmological exam. 183 newborns were confirmed for the congenital toxoplasmosis. Retinochoroiditis lesions were described and classified according to
their laterality, topographic distribution and inflammatory activity. Other ocular findings such as strabismus, vitreous haze, retinal hemorrhage, and punctata lesion
were described. The data were analyzed and correlated with maternal and newborns assays and with neurological findings.
detectable in 18,9% of the newborns (27/143). Among 41 patients with neurological alterations 92.7% (38/41) had retinochoroiditis and 82.5% (33/40) macular
involvement.
Conclusions: This study confirmed a high prevalence of the disease in the Minas Gerais state and identified asymptomatic newborns on the neonatal routine exams
but with a high prevalence of neurological and retina’s disease. Congenital toxoplasmosis deserves especial attention from health authorities and should be
considered for future inclusion in screenings programs.
Key Words: congenital toxoplasmosis, neonatal screening, retinochoroiditis, cerebral calcifications.
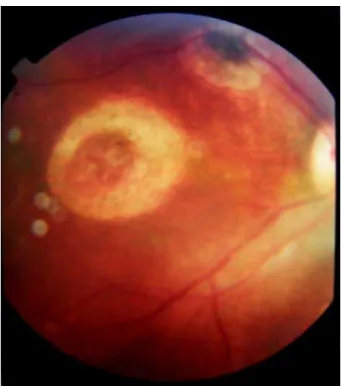
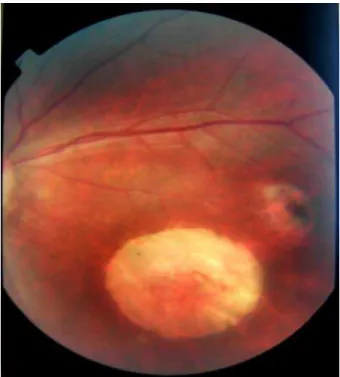
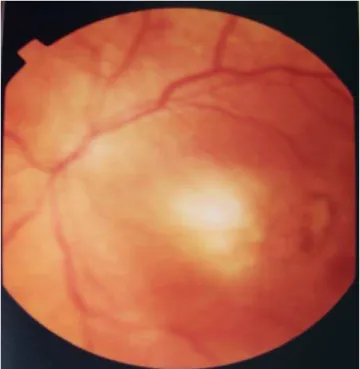
Figura1 – Retinografia mostrando cicatrizes de retinocoroidite em zona 1 do olho direito de um RN com toxoplasmose congênita. Registro feito com o RN em decúbito lateral esquerdo... 71
Figura 2 – Retinografia mostrando cicatrizes de retinocoroidite na zona 1 do olho esquerdo de um RN com toxoplasmose congênita. Registro feito com o RN em decúbito lateral esquerdo... 72
Figura 3 – Retinografia mostrando cicatriz de retinocoroidite na Zona 1 do olho esquerdo de um RN com toxoplasmose congênita. Registro feito com o RN em decúbito lateral esquerdo... 72
Figura 4 – Retinografia mostrando foco de retinocoroidite necrosante na zona 1 do olho esquerdo do lado de uma lesão cicatrizada já iniciando pigmentação. Registro feito com o RN em decúbito lateral esquerdo... 73
Figura 5 – Retinografia mostrando presença de dois focos de retinocoroidite necrosante e hemorragia, localizadas no olho esquerdo de um RN com toxoplasmose congênita. Registro feito com o RN em decúbito lateral esquerdo... 74
Figura 6 – Retinografia mostrando foco de retinocoroidite necrosante na região da mácula do olho direito de um RN com toxoplasmose congênita. Registro feito com o RN decúbito lateral esquerdo... 74
Figura 7 – Retinografia mostrando lesões puntiformes, branco-acinzentadas, no setor temporal da retina do olho esquerdo de um RN com toxoplasmose congênita e embainhamento vascular no local. Registro feito com o RN em decúbito lateral direito... 75
Figura 8 – Retinografia mostrando lesões puntiformes, branco-acinzentadas na retina nasal do olho direito de um RN com toxoplasmose congênita e embainhamento vascular no local. Registro feito com o RN em decúbito lateral direito... 76
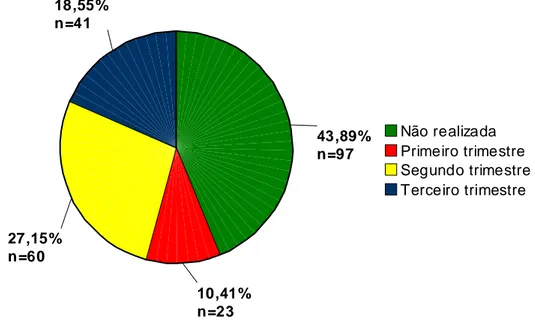
Gráfico 1–Trimestre da gestação em que foi realizada a sorologia para a
toxoplasmose... 66
Gráfico 2 – Lateralidade da lesão ocular... 70
Gráfico 3 – Envolvimento da mácula nos RN com toxoplasmose congênita... 77
Gráfico 4 – Envolvimento macular unilateral e bilateral... 78
Gráfico 5 - Freqüência de alterações neurológicas (calcificações intracranianas e/ou dilatação ventricular) nos RN confirmados para a toxoplasmose congênita... 80
Tabela 1 – Resultados da triagem neonatal para a toxoplasmose congênita... 61
Tabela 2 – Resultado da triagem neonatal nos casos confirmados ou não confirmados para a toxoplasmose congênita...
62
Tabela 3 – IgM anti-toxoplasma da triagem neonatal X IgM confirmatório nos 183 RNs confirmados (ELFA)...
63
Tabela 4 – IgM anti-toxoplasma da triagem neonatal X IgM confirmatório nos 38 RNs não confirmados (ELFA)...
64
Tabela 5 – IgM x IgG materno durante a gestação... 65
Tabela 6 - Freqüência de mães tratadas na gestação X RN confirmados ou não para a toxoplasmose congênita...
67
Tabela 7 – IgM anti-toxoplasma materno após o parto (ELFA)... 67
Tabela 8 - IgM anti-toxoplasma materno durante a gestação e após o parto... 68
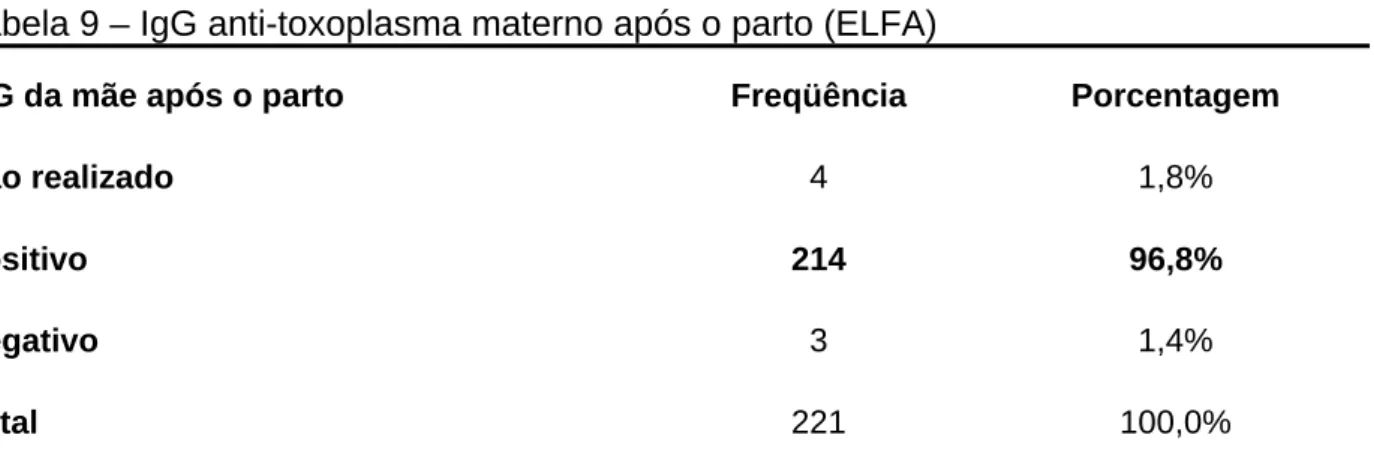
Tabela 9 – IgG anti-toxoplasma materno após o parto (ELFA)... 69
Tabela 10 – Atividade inflamatória da lesão ocular observada na oftalmoscopia binocular indireta...
71
Tabela 11 – Distribuição geográfica das lesões oculares na retina... 77
Tabela 12 – Estrabismo associado à lesão de retinocoroidite macular... 79
Tabela 13 - Associação entre retinocoroidite e calcificação craniana nos RN com toxoplasmose congênita...
81
Tabela 14 – Associação entre alterações neurológicas e lesão de retinocoroidite
nos pacientes que foram submetidos à avaliação neurológica... 82
Tabela 16– Associação entre alterações neurológicas e retinocoroidite macular... 83
UFMG - Universidade Federal de Minas Gerais HC - Hospital das Clínicas
HSG - Hospital São Geraldo
COEP - Comitê de Ética em Pesquisa
SAME - Serviço de Arquivo Médico e Estatística
SUS - Sistema Único de Saúde
T. gondii - Toxoplasma gondii
OD - Olho direito OE - Olho esquerdo IgM - Imunoglobulina M
IgG - Imunoglobulina G IgA - Imunoglobulina A
IgE - Imunoglobulina E
EUA - Estados Unidos da América MG - Minas Gerais
NK - Natural Killer
IL - Interleucinas
INF - Interferon gama
TNGα - Fator de necrose tumoral alfa TGF - Fator de crescimento tumoral beta
Th1 - T helper 1
LT - Linfócitos T
PCR - Reação de Cadeia da Polimerase
ISAGA - Imunosorbent Agglutination Assay RIF - Reação de Imunofluorescência Indireta
CSF - Corante de Sabin-Feldmann
RFC - Reação de Fixação de Complemento RHA - Reação de Hemaglutinação Indireta
Ag S - Antígeno S
n - Número de participantes da amostra
p- Nível de significância estatística IC - Intervalo de Confiança
OR - Odds Ratio
OCT - Tomografia de Coerência Óptica
TCLE - Termo de Consentimento Livre e Esclarecido
TAA - Teste de Avidez de Anticorpos DD - Diâmetro de disco
< - Menor que
RN – Recém-nascido
RESUMO
...
.xABSTRACT
...
.xiiLISTA DE ILUSTRAÇÕES
...
xivLISTA DE GRÁFICOS
...
xvLISTA DE TABELAS
...
xviLISTA DE ABREVIATURAS E SIGLAS
...
.xvii1- INTRODUÇÃO
...
12- REVISÃO DE LITERATURA
...
42.1 HISTÓRICO...4
2.2 AGENTE ETIOLÓGICO...6
2.3 GENÓTIPOS E PATOGÊNESE...8
2.4 FONTES DE INFECÇÃO...10
2.5 PREVALÊNCIA...12
2.6 MANIFESTAÇÕES OCULARES...15
2.7 MANIFESTAÇÕES CLÍNICAS DA TOXOPLASMOSE CONGÊNITA...18
2.8 A RESPOSTA IMUNE AO TOXOPLASMA GONDII...25
2.8.1 Imunidade inespecífica
...
252.8.2 Imunidade específica
...
262.8.2.1 Imunidade celular.
...
262.8.2.2 Imunidade humoral.
...
302.9 DIAGNÓSTICO...31
2.9.1 Detecção Direta
...
312.9.2 Detecção indireta
...
322.10 DIAGNÓSTICO PRÉ-NATAL...36
xxi
2.13 TRATAMENTO PRÉ E PÓS NATAL...47
3- OBJETIVOS...52
4- MATERIAL E MÉTODOS...53
4.1 SELEÇÃO DOS PACIENTES...53
4.2 AVALIAÇÃO COMPLEMENTAR DA MÃE E RECÉM-NASCIDO....54
4.3 EXAME OFTALMOLÓGICO DOS RECÉM-NASCIDOS TRIADOS...57
4.4 ANÁLISE ESTATÍSTICA...59
4.5 ASPECTOS ÉTICOS...60
5- RESULTADOS...61
5.1 POPULAÇÃO ESTUDADA...61
5.2 TRIAGEM NEONATAL E SOROLOGIA CONFIRMATÓRIA PAREADA (MÃE E RN)...62
5.3 ACHADOS OFTALMOLÓGICOS NO PRIEMEIRO EXAME DO RN...69
5.4 ACHADOS NEUROLÓGICOS NO PRIEMEIRO EXAME DO RN...80
6- DISCUSSÃO
...
847-CONCLUSÕES
...
998- REFERÊNCIAS BIBLIOGRÁFICA
S...
1001- INTRODUÇÃO
A infecção pelo Toxoplasma gondii é uma zoonose de distribuição mundial
que afeta homens e animais. Essa infecção, se adquirida durante a gravidez, pode
atravessar a placenta e resultar na infecção congênita do feto. A taxa de
transmissão materno-fetal varia de menos de 2% na quarta semana de gestação
para mais de 80% se a infecção ocorrer na trigésima sexta semana (Dunn et al.,
1999). Quanto mais precoce for a idade gestacional no momento da infecção mais
graves serão as manifestações clínicas da doença ao nascimento (Dunn et al.,
1999; Many & Koren, 2006; Lopes et al., 2007). Contudo, crianças com
toxoplasmose congênita, quando nascem, são assintomáticas em 70 a 90% dos
casos (Wilson et al., 1980; Koppe et al., 1986; Gratzl et al., 1998; O'Neill, 1998;
Foulon et al., 1999; Lebech et al., 1999; Safadi et al., 2003; Remington et al., 2005;
Many & Koren, 2006; Rorman et al., 2006) e só poderiam ser identificadas através
de programas de triagem.
As manifestações clínicas da toxoplasmose congênita, quando presentes,
incluem a retinocoroidite, calcificações intracranianas e em casos graves,
hidrocefalia (Remington et al., 2005). Ao longo do tempo, a infecção ocular pode
sofrer reativação causando retinocoroidite, embaçamento visual ou mesmo
cegueira em indivíduos que inicialmente não possuíam qualquer sinal clínico da
doença. A reativação pode ocorrer na infância, adolescência e vida adulta (Wilson
et al., 1980; Koppe et al., 1986; O'Neill, 1998). A retinocoroidite é considerada a
principal manifestação clínica e seqüela da toxoplasmose congênita.
As principais rotas de infecção pós-natal são a ingestão de carnes cruas ou
fezes de gato, espalhados no meio ambiente (Cook et al., 2000; Holland, 2003).
Observações recentes mostram que a água contaminada também pode ser uma
importante fonte de infecção (Bahia-Oliveira et al., 2003; de Moura et al., 2006).
Na teoria, é possível prevenir a toxoplasmose através de medidas de saúde
educacional, mas na prática, muito ainda precisa ser feito (Foulon et al., 2000).
O diagnóstico precoce da toxoplasmose congênita, através dos programas
de triagem pré-natal e neonatal (triagem do recém-nascido), seguido de
tratamento adequado parece reduzir a incidência de manifestações clínicas da
doença ao nascimento além de prevenir complicações secundárias e recorrências
tardias. Essa é a razão para a adoção dos programas de triagem pré-natal na
França (Jeannel et al., 1988b) e Áustria (Aspock & Pollak, 1992) e programas de
triagem neonatal nos EUA (Guerina et al., 1994) e Dinamarca (Schmidt et al.,
2006).
Existe uma incerteza do melhor programa de triagem a ser instituído em
cada país ou região: se pré-natal ou neonatal. Os programas de triagem pré-natal
são dispendiosos e se baseiam na repetição de testes sorológicos ao longo da
gestação. A triagem neonatal tem a vantagem de ser mais facilmente realizada e
ter um custo menor. Um programa de triagem neonatal é oferecido em
Massachusetts, EUA, desde 1988 e tem se mostrado muito eficiente (Guerina et
al., 1994).
Estudos de prevalência da toxoplasmose congênita no Brasil são raros. É
importante conhecermos a verdadeira dimensão da infecção em Minas Gerais
para a elaboração de propostas profiláticas adequadas e assim, diminuir sua
ocorrência. No período de setembro de 2003 a outubro de 2004 foram triadas
Minas Gerais – “Teste do Pezinho”. Essas crianças foram testadas para
toxoplasmose, além das outras doenças (como fenilcetonúria e hipotireoidismo
congênito) já incluídas no programa. O objetivo da realização do teste para a
toxoplasmose foi o de avaliar as possibilidades desse teste, identificar
precocemente a infecção congênita permitindo o tratamento adequado das
crianças infectadas. Das 30.808 crianças triadas, 20 foram diagnosticadas com
toxoplasmose congênita, resultando numa proporção de 1/1590 infectados por
nascidos vivos. Somente quatro das vinte crianças apresentavam sintomas ao
nascimento. Esses dados mostram a elevada prevalência da toxoplasmose
congênita em Belo Horizonte e, provavelmente, em todo o Estado de Minas Gerais
(dados ainda não publicados).
Pretendeu-se neste estudo: descrever as características clínicas das lesões
oculares, observadas no primeiro exame oftalmológico dos recém-nascidos triados
pelo programa de triagem neonatal para a toxoplasmose congênita no Estado de
Minas Gerais; estimar a prevalência de recém-nascidos com toxoplasmose
congênita no estado e com isso, avaliar a necessidade da implantação definitiva de
um programa de triagem para a doença visando o diagnóstico e tratamento precoce
das crianças infectadas. A iniciativa é considerada inovadora em termos de serviço
2-REVISÃO DE LITERATURA
2.1 Histórico
A primeira descrição do Toxoplasma gondii foi realizada em 1908, por
Alfonso Splendore (Brasil) que, após observar a morte de coelhos por paralisia,
necropsiou vários animais e encontrou corpúsculos parasitários císticos. Esses,
inoculados em cães, reproduziram a mesma doença. Na mesma época, os
franceses Nicolle e Manceaux identificaram parasitas idênticos em um roedor
norte-africano Gondii, identificando-o como Leishmania gondii. Entretanto, no ano
seguinte, após a captura de outros roedores Gondiis na mesma área, verificaram
que se tratava de um novo protozoário: o toxoplasma.
A primeira descrição da toxoplasmose em humanos foi feita pelo
oftalmologista Janku, em 1923, na cidade de Praga, e tratava-se de um caso de
toxoplasmose congênita. Ao realizar a necropsia de uma criança de 11 meses de
idade que foi ao óbito em decorrência de uma doença grave e disseminada
(hidrocefalia, microftalmia e coloboma na mácula), notou que o organismo presente
no bulbo ocular constituindo um cisto parasitário era, provavelmente, o Toxoplasma
gondii. No Brasil, o primeiro caso de toxoplasmose foi diagnosticado por Margarino
Torres em 1926, em um recém-nascido com meningoencefalite congênita (Oréfice
& Bahia-Oliveira, 2005).
Porém, somente após 1937, com os estudos de Wolf e Cowen (1939), a
toxoplasmose passou a ser reconhecida por sua importância médica. Esses
autores descreveram um caso grave e fatal de encefalite granulomatosa em uma
primeiramente descrita em 1940, em um adulto jovem com doença generalizada
que o levou ao óbito (Pinkerton & Weinman, 1940).
Em 1942, Sabin descreveu a tétrade de sinais clínicos da doença congênita,
caracterizada por hidrocefalia ou microcefalia, retardo psicomotor, calcificações
intracranianas e retinocoroidite, podendo ocorrer também microftalmia. Essa é a
descrição clássica da doença ficando até hoje consagrada com o seu nome (Sabin,
1942).
Em 1948, os estudos sobre a toxoplasmose receberam a relevante
contribuição de Sabin e Feldman com o desenvolvimento de um teste sorológico
específico: a reação de Sabin-Feldman ou ‘‘dye-test’’. Com isso, iniciaram-se os
primeiros estudos epidemiológicos da toxoplasmose (Sabin & Feldman, 1948).
Em 1952, Helenor Campbell Wilder demonstrou, pela primeira vez, a
presença do parasita no olho confirmando esse agente como causa de uveíte
(Wilder, 1952b).
No Brasil, Bussaca e Nóbrega (1950) relataram que 23% dos casos de
uveíte posterior tinham como agente etiológico o T.gondii (Bussaca & Nobrega,
1950). Posteriormente, Abreu Fialho (1953), Pereira et al (1965) e Martins et al
(1969) verificaram que 38, 30 e 68%, respectivamente, das uveítes no Brasil
configuravam toxoplasmose (Orefice & Bonfioli, 2000).
Em 1957, Goldman desenvolveu o teste de imunofluorecência para o
T.gondii (Goldman, 1957) e a partir de 1960, a toxoplasmose passou a ser
considerada a maior causa de uveíte no mundo.
A toxoplasmose congênita, como causa de doença ocular, se tornou mais
Em 1988, foi apresentada no Simpósio Mundial de Uveítes em São Paulo,
Brasil, uma alta prevalência de uveíte por toxoplasmose adquirida no estado do Rio
Grande do Sul e esse tem sido o exemplo clássico de toxoplasmose ocular
adquirida citado em todo o mundo (Glasner et al., 1992).
2.2 Agente etiológico
Reino: Protista; reino: Protozoa; Filo: Apicomplexa; Classe: Sporozoa;
Sub-classe: Coccidia; Ordem: Eucoccidia; Sub-ordem: Eumeriidae; Família:
Sarcocystidae; Gênero: Toxoplasma; Espécie: Toxoplasma gondii.
A espécie Toxoplasma gondii é membro da família Sarcocystidae, que tem
como hospedeiro definitivo membros da família Felidae, sendo o gato doméstico
(Felis catus) o de maior importância epidemiológica (Kawazoe, 1995). Tem como
hospedeiros intermediários animais homeotérmicos incluindo o homem. Por ser um
parasita intracelular obrigatório, o T.gondii pode ser encontrado em vários tecidos
tais como a placenta, músculos estriados, esqueléticos e cardíacos, cérebro, retina
e leucócitos. Líquidos orgânicos como peritoneal, a saliva, o leite materno, o
esperma e a urina também podem exibir o parasita (Frenkel, 1971). As formas
livres são encontradas circulando por um curto período de tempo. Apresenta
morfologias múltiplas dependendo do seu habitat e do estado evolutivo (Oréfice
and Bahia-Oliveira, 2005).
As principais formas de apresentação do parasita são:
Taquizoíto: também denominada forma livre, trofozoíta ou forma proliferativa.
Trata-se de uma forma obrigatoriamente intracelular, que se prolifera na fase
capacidade de invadir ativamente uma célula e se multiplicar em vacúolos
citoplasmáticos, denominados vacúolos parasitófagos. A proliferação exacerbada
conduz ao rompimento da célula hospedeira liberando os múltiplos taquizoítos que,
livres, penetram em células adjacentes ou caem na circulação. Provocam uma
resposta inflamatória importante e destruição tecidual. São responsáveis pelas
manifestações clínicas da doença. Sua forma em arco (toxon = arco) deu o nome
ao gênero toxoplasma.
Bradizoíto e cisto: forma encistada decorrente da resposta imune ante a presença
do taquizoíto (Frenkel, 1997). Os bradizoítos apresentam multiplicação lenta e
iniciam a sua formação seis a oito dias após a infecção (Oréfice & Bahia-Oliveira,
2005). Os cistos formados apresentam tamanho variável com milhares de
bradizoítos no seu interior, alcançando 3000 parasitas. Podem ser destruídos por
digestão péptica e ao serem ingeridos, liberam os bradizoítos que permanecem
viáveis, os quais, por sua vez, circularão provocando a formação de grupos
teciduais de cistos e se transformarão em taquizoítos. As localizações mais
prevalentes da forma cística do toxoplasma são os tecidos musculares, nervoso e
retina. Encontrar cistos em órgãos viscerais como pulmões, fígado e rins é mais
raro. Os cistos teciduais intactos geralmente não causam danos ao hospedeiro e
podem persistir por toda a vida do infectado (Lynfield & Guerina, 1997). Os cistos
são muito resistentes às condições ambientais e permanecem viáveis em
temperatura ambiente e em refrigerador (Dubey & Beattie, 1988). É a principal
forma encontrada na fase crônica da doença.
Oocisto: os oocistos apresentam forma ovalada e, quando esporulados,
caracterizam-se por conter dois esporocistos, cada um deles contendo no seu
conseqüência do processo sexuado que ocorre nas células epiteliais de sua
mucosa intestinal. Podem sobreviver fora do corpo por pelo menos um ano, em
solo quente e úmido (Frenkel et al., 1975; Lynfield & Guerina, 1997) e assim, se
tornarem infectantes.
2.3 Genótipos e Patogênese
O Toxoplasma gondii pode ser dividido em três principais genótipos (Sibley
& Boothroyd, 1992). A diferença nos genótipos pode ser parcialmente responsável
pela diferença de patogênese observada na infecção. Na Europa, há um
predomínio do genótipo II (Grigg et al., 2001), mas no Brasil, o genótipo
predominante é do tipo I que apresenta alta virulência (Khan et al., 2005; Vallochi
et al., 2005; Peyron et al., 2006). Em um estudo recente realizado no Brasil, a
análise de lesão ocular provocada pelo T. gondii demonstrou apenas espécies do
tipo I e III e nenhuma do tipo II (Ferreira et al., 2006). Essa observação tem
implicações importantes na epidemiologia, gravidade da doença, manifestações
clínicas e eficácia ao tratamento (Boothroyd & Grigg, 2002).
A multiplicação do parasita é o fator primário na patogênese da doença,
tanto na forma sistêmica quanto na ocular. Durante o estágio agudo da doença, o
parasita atravessa a parede intestinal e cai na circulação sanguínea provocando
uma parasitemia. O T.gondii atinge o olho através do sangue como parasitas livres
ou dentro de leucócitos circulantes. A identificação de parasitas em vasos das
camadas internas da retina dá suporte à rota hematogênica (Roberts et al., 2001).
Com o desenvolvimento da imunidade ao parasita, a fase de multiplicação rápida
dos taquizoítos cessa e ocorre a formação de cistos tissulares contendo os
vários anos no tecido do hospedeiro. Os ataques recorrentes são secundários a
multiplicação dos parasitas após sua liberação dos cistos retinianos (Roberts &
McLeod,1999).
Alguns autores estudaram a possibilidade de que os danos retinianos na
toxoplasmose poderiam ser causados por mecanismos auto-imunes. Trinta e seis
pacientes foram estudados, sendo 18 com a primeira recorrência e 18 com
múltiplas recorrências. Concluíram que a extensão da reatividade anti-retina na
retinocoroidite toxoplásmica não é causada apenas por anticorpos anti-antígeno S,
mas a alta prevalência de anticorpos antifotorreceptor na retinocoroidite
toxoplásmica, em comparação aos controles saudáveis, sugere que esses
anticorpos podem ser copatogênicos na retinocoroidite (Whittle et al., 1998).
Não se sabe ao certos os fatores que levam à recorrência da lesão, uma
série de situações foram propostas: trauma, alterações hormonais, cirurgias,
exposição aos raios ultravioletas, baixa da imunidade, mas nenhum deles tem sido
amplamente aceito (Rothova, 2003). A taxa de recorrência da lesão varia de
acordo com o tempo: o risco é maior no primeiro ano após o episódio de atividade
e menor nos anos subseqüentes (Bosch-Driessen et al., 2002; Holland, 2003).
Este declínio pode estar relacionado com fatores do hospedeiro, seqüestro de
cistos, ou melhora do controle imunológico da doença. Outra possibilidade, seria a
vida do cisto ser finita e com isso o hospedeiro poderia não ter cistos viáveis após
determinado tempo. Taxas de recorrências na forma adquirida ou congênita da
doença parecem ser similares (8 -40%) (Koppe & Rothova, 1989; Guerina, 1994;
Reinfecção com outras cepas do parasita podem ocorrer, mas a
importância clínica desse fato ainda não foi bem estabelecida (Aspinall et al.,
2003).
2.4 Fontes de infecção
A transmissão transplacentária ou congênita foi a primeira forma a ser
reconhecida como causa de toxoplasmose no homem. Depois da aquisição do
T.gondii, pela primeira vez, durante a gestação, ele atinge a circulação fetal pela
infecção da placenta. Após terem atravessado a placenta, os taquizoítos se
transformam em bradizoítos em poucos dias (Luder et al., 1999). A taxa de
transmissão vertical é variável e para alguns autores, parece não ser influenciada
pelo tratamento durante a gestação (Dunn et al., 1999; Gilbert et al., 2001b). A
gravidade da infecção congênita também depende do período da gestação no qual
a mãe se tornou infectada. O risco de transmissão materno-fetal da toxoplasmose
congênita é menor se a infecção ocorrer durante o primeiro trimestre da gestação
(10 a 25%) em comparação com o último trimestre (60 a 90%), mas a gravidade
clínica da doença é substancialmente maior quando adquirida no primeiro (Dunn et
al., 1999; Many & Koren, 2006; Lopes et al., 2007).
Após o desenvolvimento da imunidade materna à infecção, acredita-se que
as outras gestações estarão protegidas; entretanto, existem relatos de mães
soropositivas para a toxoplasmose que transmitiram a infecção para seus filhos
durante a gravidez (Hennequin et al., 1997; Dollfus et al., 1998; Many & Koren,
2006). Em um relato de caso, os autores descreveram uma criança com
toxoplasmose congênita cuja mãe imunocompetente apresentava cicatriz de
sorologia positiva para a toxoplasmose logo após o nascimento e foi tratada ao
longo de todo o primeiro ano de vida. Aos noves meses de idade, o exame
oftalmológico revelou uma cicatriz macular no olho direito (Silveira et al., 2003).
Outro caso similar foi descrito, no qual o terceiro filho de uma mãe
imunocompetente e previamente infectada apresentou toxoplasmose congênita
diagnosticada logo após o nascimento. Com três semanas de vida pós-natal, o
exame oftalmológico constatou cicatriz macular bilateral (Kodjikian et al., 2004).
Esses dois casos podem ser explicados pela re-infecção por espécies do parasita
diferentes da infecção original ou reativação de uma infecção latente induzida por
imunidade celular associada a gravidez.
Mulheres imunodeficientes, cronicamente infectadas, podem transmitir a
infecção para o feto, mas a probabilidade de que isso ocorra é baixa (Lebech et
al., 1996; Rorman e tal., 2006).
Até 1950, as fontes de infecção pós-natal pelo T.gondii ainda não eram
conhecidas. Em 1951, Hogan especulou que alguns vetores poderiam transmitir a
doença (Hogan, 1951), mas em 1958 ele cita evidências de que a transmissão
oral teria importância (Hogan, 1958). Desde aquele tempo, a infecção pós-natal
tem sido atribuída à ingestão de cistos em carnes cruas e mal passadas ou a
ingestão de oocistos presentes no solo, contaminando verduras e frutas (Cook et
al., 2000). Observações recentes mostram que a água contaminada também pode
ser uma importante fonte de infecção. Em 1979, uma epidemia de toxoplasmose
entre soldados das forças armadas dos EUA, no Panamá, foi atribuída à ingestão
de água contaminada com oocistos (Benenson et al., 1982). Em 1995, uma
epidemia de toxoplasmose em Vitória, no Canadá, foi atribuída à contaminação de
al., 1998). Em 2001, uma epidemia semelhante ocorreu em Santa Isabel do Ivaí
no sul do Brasil e foi também atribuída a um reservatório de água não filtrada
contaminada com oocistos (de Moura et al., 2006). A água tem sido considerada
um veículo de disseminação da toxoplasmose não só em epidemias, mas também
em áreas endêmicas no Brasil (Bahia-Oliveira et al., 2003; Dodds, 2006).
Outras vias de infecção foram descritas tais como o leite e saliva
contaminada, perdigotos ou lambedura, acidentes de laboratório e após
transplante (Oréfice&Bahia-Oliveira,2005).
2.5 Prevalência
A toxoplasmose é uma das zoonoses mais difundidas no mundo e
apresenta-se com alta prevalência nas diversas regiões, de acordo com fatores
climáticos, geográficos, profissionais, etários, alimentares e outros (Rothova, 2003).
Sua incidência é maior nas áreas tropicais e vai diminuindo com o aumento da
latitude. Estima-se que o parasita infecte aproximadamente 13 a 50% da população
mundial (Jones et al., 2001a).
A toxoplasmose é uma infecção comum na América do Sul. No Brasil, a
prevalência sorológica do T. gondii varia de 50-80% na população adulta sadia,
com valores mais altos encontrados em algumas regiões do norte e do sul (Orefice
& Bonfioli, 2000) e em pessoas de classe sócio-econômicas mais baixas
(Bahia-Oliveira et al., 2003). A soropositividade para a toxoplasmose aumenta com a
idade, obtendo-se valores máximos após os sessenta anos (Melamed, 1991). Em
um estudo realizado no sul do Brasil, a prevalência de sorologia positiva para a
toxoplasmose entre crianças de 10 a 15 anos foi muito alta, chegando a atingir
A prevalência estimada da toxoplasmose congênita no mundo varia de
1-10/10.000 nascidos vivos. No Brasil, a prevalência é maior: 3-8/10.000 nascidos
vivos. (Neto et al., 2000; Evengard et al., 2001; Jones et al., 2001b; McLeod et al.,
2006).
Alguns autores, no Rio Grande do Sul, reportaram 47 casos de
toxoplasmose congênita dentre 140.914 amostras de sangue periférico obtidas de
recém-nascidos originados de várias cidades brasileiras, no período entre
setembro de 1995 e dezembro de 1998. Este trabalho mostrou uma prevalência da
toxoplasmose congênita de 1/3000 nascidos vivos e essa foi a maior prevalência
da doença registrada na literatura até o ano 2000 (Neto et al., 2000).
Em Passo Fundo, também no Rio Grande do Sul, foi realizado um estudo
para se determinar a prevalência da infecção congênita pelo Toxoplasma gondii em
recém-nascidos atendidos no Hospital Universitário de Passo Fundo. Foram
analisadas amostras de sangue do cordão umbilical de 1250 recém-nascidos vivos.
O diagnóstico laboratorial foi realizado através da detecção de IgM pelo método
ELFA (Enzyme Linked Fluorescent Assay). A incidência da toxoplasmose
congênita ao nascimento foi de 8/10.000 (Mozzatto & Procianoy, 2003).
Na cidade de Uberlândia, Minas Gerais, um estudo avaliou 805 amostras de
soro obtidas do sangue do cordão umbilical de recém-nascidos. Dessas, 305 foram
coletadas em um hospital privado e 500 em um hospital público, entre janeiro e
agosto de 2002. Todas as amostras foram analisadas utilizando-se o ELISA
(Enzyme Linked Immuno Sorbent Assay) para a detecção de anticorpos IgG. As
amostras positivas foram testadas para os anticorpos IgM e IgA. A prevalência de
anticorpos IgG positivos nas amostras foi de 51,6% e da toxoplasmose congênita
Em outro trabalho realizado no Brasil (áreas não especificadas), os autores
estimaram a prevalência da toxoplasmose congênita, doença de chagas,
citomegalovírus e rubéola através da triagem neonatal pelo “teste do pezinho”. A
prevalência estimada para a toxoplasmose congênita foi de 1/1.867 nascidos vivos
(Neto et al., 2004).
Em Ribeirão Preto, interior de São Paulo também foi conduzido um estudo
para se determinar a prevalência da infecção congênita na região. Amostras de
sangue foram obtidas de 15.162 neonatos e testadas para o IgM anti-toxoplasma
em papel filtro. Quinze amostras foram positivas. O diagnóstico definitivo foi
confirmado em cinco das 13 crianças que completaram o seguimento e a
prevalência da doença foi estimada em 3,3/10.000 nascidos vivos (Carvalheiro et
al., 2005).
Estima-se que a infecção seja ainda mais freqüente em algumas regiões
brasileiras. Em Campos dos Goytacazes, Rio de Janeiro, um inquérito sorológico
com 2500 recém-nascidos mostrou uma proporção de um recém-nascido infectado
para 500 nascidos vivos (20/10.000) (Bahia-Oliveira et al., 2001).
Nos EUA, 85% das mulheres são soronegativas e suscetíveis a adquirir a
infecção primária durante a gravidez (Jones et al., 2001b). No Brasil, em um estudo
realizado no Paraná, 66% das mulheres testadas mostraram-se reagentes à
toxoplasmose IgG, com 70% de soropositividade entre aquelas em idade fértil
(Garcia et al., 1999). Outro estudo, realizado em Recife, constatou uma prevalência
de 51,6% de anticorpos IgG entre mulheres com 18 a 40 anos (Coelho et al.,
2003). A soropositividade para toxoplasmose em gestantes foi de 14% em
Estocolmo (Petersson et al., 2000), 20,3% na Finlândia (Lappalainen et al., 1995b)
grávidas foi de 67% no Paraná (Reiche et al., 2000), 51,6% em Minas Gerais
(Segundo et al., 2004), 77,1% no Rio de Janeiro (Meireles, 1985), 32,7% em São
Paulo (Vaz et al., 1990), 74,5% no noroeste do Rio Grande do Sul (Spalding et al.,
2003) e 59,8% na cidade de Porto Alegre (Varella et al., 2003).
A toxoplasmose ocular é a causa mais comum de uveíte posterior em várias
partes do mundo, incluindo a América do norte, América do Sul e Europa (Holland,
2003). Entretanto, pouco se sabe sobre o número total de indivíduos com doença
ocular inativa (muitos podem ser assintomáticos). O envolvimento é mais grave nos
pacientes com sistema imune deficiente, ou seja, neonatos e adultos
imunocomprometidos (Bosch-Driessen et al., 2002; Hovakimyan & Cunningham,
2002; Smith & Cunningham, 2002).
A toxoplasmose ocular pode ser dividida em congênita (pré-natal) ou
adquirida (pós-natal). A exata contribuição de cada uma dessas formas na
prevalência da doença não é bem esclarecida (Wilson & Remington, 1980; Koppe
& Rothova, 1989; Burnett et al., 1998). Ela é comumente atribuída à infecção
congênita. Entretanto, recentemente, vários estudos têm discutido que a infecção
adquirida possa ser uma importante causa de toxoplasmose ocular (Bowie et al.,
1997; Burnett et al., 1998; Silveira et al., 2001; Bahia-Oliveira et al., 2003) e que
essa, seja mais freqüente do que se pensava. Em um artigo de revisão, os autores
concluem que pelo menos 2/3 dos pacientes com toxoplasmose ocular na
Inglaterra, adquiriram a infecção no período pós-natal e não pré-natal (Gilbert &
Stanford, 2000).
A manifestação ocular característica da toxoplasmose consiste em uma
retinocoroidite focal necrosante, frequentemente associada a uma lesão satélite já
cicatrizada indicativa de recorrência. Em uma série de 154 pacientes, as lesões
satélites ocorreram em 80% dos casos (Bosch-Driessen et al., 2002). A lesão
satélite é considerada padrão ouro para diagnóstico da toxoplasmose ocular. O
exame do olho contralateral também pode mostrar antigas cicatrizes de
retinocoroidite.
O tamanho da lesão varia de 1/10 de diâmetro de disco (DD) até dois
quadrantes. Alguns estudos observaram uma relação positiva entre o tamanho da
lesão, o risco aumentado de complicações e um maior tempo de duração da
doença ativa (Holland, 2004). É nítida a predileção do parasita pela região
máculo-discal. Já em outros locais da retina, a distribuição é homogênea. Diferenças
anatômicas e da microvasculatura entre a macula e a retina periférica, podem criar
um ambiente que influencie a localização da lesão, além disso, macrófagos estão
em menor quantidade na região macular (Yang et al., 2000).
O acometimento do corpo vítreo é constante na toxoplasmose ocular e
responsável por seqüelas importantes da doença. A opacificação vítrea tem
resolução lenta podendo, nos casos graves, demorar, às vezes, mais de um ano
após total cicatrização da lesão ou ser necessário tratamento cirúrgico. Pode
haver contração e descolamento do corpo vítreo posterior (Oréfice &
Bahia-Oliveira, 2005).
Vasculite retiniana venosa é comum em pacientes com toxoplasmose
ocular e pode ocorrer na vizinhança ou distante do foco ativo da retinocoroidite
A redução da acuidade visual na toxoplasmose ocular ativa pode resultar da
turvação ou opacificação dos meios e do acometimento foveal diretamente
causado pela lesão. Pode, ainda, ocorrer em conseqüência de formação de
edema retiniano, secundário às lesões retinianas localizadas fora da região
macular (Orefice et al., 2006; Orefice et al., 2007).
O processo evolutivo da lesão na toxoplasmose ocular revela que a
cicatrização ocorre da periferia para o centro, ou seja, de maneira centrípeta.
Nesses casos, observa-se que, progressivamente, as margens da lesão vão
ficando mais nítidas, o exsudato e a vitreíte diminuem, até que resta uma zona
central amorfa, elevada, de cor cinza ou marrom. Depois de um período variável
de tempo, ocorre a pigmentação, sobretudo nas margens da lesão. A intensidade
da pigmentação dentro ou ao redor da lesão pode refletir a extensão do dano ao
estrato pigmentoso da retina (EPR) durante a fase ativa da doença (Smith &
Cunningham, 2002; Holland, 2004). A área de cicatriz frequentemente é menor do
que a área de retina inflamada durante o estágio agudo da doença (Holland,
2004).
Manifestações atípicas compreendem lesões largas, eventualmente
múltiplas e ou bilaterais simulando necrose retiniana aguda. Essa forma de
apresentação é mais comum em pacientes idosos ou imunocomprometidos
(Holland et al., 1988). Outras apresentações atípicas incluem: forma punctata
externa; neurorretinite; neurite; forma pseudomúltipla; esclerite; reação vítrea
intensa sem lesão focal em atividade; uveíte anterior isolada (Bosch-Driessen et
al., 2002; Hovakimyan & Cunningham, 2002; Labalette et al., 2002; Smith &
Cunningham, 2002; Oréfice & Bahia-Oliveira, 2005). Na infecção adquirida, uma
e pode representar a infecção intra-ocular inicial do parasita que pode ser
acompanhada, posteriormente, de acometimento da retina (Holland, 1999).
As diferentes manifestações da doença, provavelmente, se devem a
combinação de fatores do hospedeiro, parasita e meio ambiente. Pacientes
imunocomprometidos têm risco maior de doença mais grave. A idade influencia,
pois tanto a prevalência quanto a gravidade da doença aumentam com a idade. O
genótipo do parasita também pode ser um fator determinante, particularmente, nos
pacientes imunocomprometidos.
Complicações como irite granulomatosa, pressão intra-ocular elevada,
oclusões vasculares, descolamento de retina seroso ou regmatogênico, entre
outras, podem dificultar o diagnóstico correto da toxoplasmose ocular (Rothova,
2003).
2.7 Manifestações clínicas da Toxoplasmose congênita
A toxoplasmose congênita pode apresentar-se como uma entre quatro
formas clínico-evolutivas: infecção subclínica (assintomática), doença sistêmica ou
neurológica ao nascimento, doença grave ou leve nos primeiros meses de vida e
seqüelas ou recidivas de infecção prévia não diagnosticada. As manifestações
clínicas são variadas, podendo ocorrer hidrocefalia, microcefalia,
hepatoesplenomegalia, icterícia, surdez, exantema petequial, calcificações
intracranianas, microftalmia, retinocoroidite, estrabismo, nistagmo, catarata e
glaucoma (Remington et al., 2005)
A tétrade de Sabin é caracterizada por hidrocefalia ou microcefalia, retardo
psicomotor, calcificações intracranianas e retinocoroidite. Como o retardo
tétrade de Sabin de tríade de Sabin que é caracterizada por hidrocefalia,
calcificações intracranianas e retinocoroidite (Remington et al., 2005). Ela ocorre
em apenas 10 a 15% dos casos. Nas formas mais graves é habitual o
envolvimento de outros órgãos podendo ocorrer pneumonia, miocardite, colestase,
anemia, trombocitopenia, meningoencefalite e anormalidades liquóricas (Lynfield
& Guerina, 1997).
A maioria das crianças com toxoplasmose congênita é assintomática ao
nascimento (70 a 90%) e a maior parte delas (65 a 85%), vai desenvolver
seqüelas durante a infância, adolescência e início da vida adulta (Wilson et al.,
1980; Koppe et al., 1986; Gratzl et al., 1998; O'Neill, 1998; Foulon et al., 1999;
Lebech et al., 1999; Brezin et al., 2003; Safadi et al., 2003; Many & Koren, 2006).
A retinocoroidite é a manifestação mais comum da doença e sua principal
seqüela. Estima-se que em países da Europa, a lesão de retinocoroidite é
observada logo após o nascimento em 10% das crianças infectadas e novas
lesões poderão aparecer em qualquer idade (Gilbert et al., 2007; Tan et al., 2007).
Mesmo crianças tratadas adequadamente com medicação específica durante todo
o primeiro ano de vida poderão desenvolver lesão ocular tardia (McAuley et al.,
1994; Gras et al., 2001). Na América do Sul as lesões de retinocoroidite são mais
comuns e mais graves devido à maior virulência dos parasitas (Gilbert &
Dezateux, 2006; Gomez-Marin & dela Torre, 2007).
Estudos com modelos experimentais para a toxoplasmose ocular têm
demonstrado a presença de cistos intra-retinianos de T.gondii com potencial para
lesão ocular tardia e recorrência (Gazzinelli et al., 1994; Pavesio et al., 1995). Os
cistos de T. gondii podem estar presentes até mesmo em retinas aparentemente
Koppe et al (1986) seguiram de maneira prospectiva 11 recém-nascidos
com toxoplasmose congênita. Desses, quatro (36,6%) apresentavam doença
retiniana ao nascimento. Depois de 20 anos de seguimento, 82% dos infectados
tinham evidência de retinocoroidite (Koppe et al., 1986). Achados similares foram,
anteriormente, observados por Wilson et al (1980) que seguiram 13 crianças com
infecção sub-clínica ao nascimento e no período de seguimento ao longo dos
anos, 11 (84,6%) apresentaram retinocoroidite (Wilson et al., 1980).
Apesar dos autores acima ressaltarem o aparecimento de lesão ocular
tardia nas crianças com toxoplasmose congênita, evidências obtidas á partir de
alguns estudos mostram, de maneira consistente, que o aparecimento da lesão
ocular após os dois anos de idade, em crianças sem lesão prévia descrita, é
incomum e pode representar uma falha na detecção dessas lesões nos exames
anteriores: 1/20 crianças após dois anos de idade em alguns estudos de coorte
(Guerina 1994; Lappalainen et al. 1995a; Lebech et al. 1999); 3/9 crianças após
seis anos de idade por Koppe et al (1986); 2/54 pacientes seguidos por 1-5 anos
por Mets et al (1997); 2/49 crianças depois de dois anos de idade e seguidas por
2-11 anos por Couvreur et al (1984) e 2/37 crianças depois dos 10 anos de idade
por Peyron et al (1996).
Recentemente, um estudo experimental para a toxoplasmose congênita
realizado em fêmeas grávidas de camundongos C57BL/6 mostrou que os
embriões infectados pelo T.gondii desenvolveram retinocoroidite antes mesmo do
nascimento. Os autores desse trabalho sugerem que a lesão ocular da
toxoplasmose congênita não é uma manifestação tão tardia da doença e que o
Na retina, a infecção congênita pode levar a formação de áreas brancas de
retinocoroidite focal necrótica, uni ou bilaterais, localizadas principalmente na
mácula (Bosch-Driessen et al., 2002). A predileção do parasita pelo polo posterior
na toxoplasmose congênita está associada ao fato de que essa região se torna
vascularizada muito cedo no processo de desenvolvimento ocular e apesar da
mácula ser avascular, ela obtém seu suprimento sanguíneo de arteríolas terminais
que formam um grande plexo capilar em torno dela. Como o T. gondii atinge o
olho, provavelmente, pela rota hematogênica, a presença do parasita nos
capilares terminais poderia facilitar o estabelecimento da infecção nessa delicada
região do olho (Fiona et al., 2001).
As áreas de retinocoroidite ativas podem ser pequenas ou grandes, simples
ou múltiplas, associadas ao edema retiniano ou a cicatrizes de retinocoroidite
adjacentes. Altas taxas de acometimento bilateral são descritas na toxoplasmose
congênita (Peyron et al., 1996; Mets et al., 1997; Wallon et al., 2004; Kodjikian et
al., 2006) e o envolvimento ocular é mais freqüente em associação à doença
neurológica (95%) do que à doença disseminada (66%) (Remington et al., 2005).
Outras alterações oculares podem estar presentes tais como o estrabismo,
catarata, glaucoma e nistagmo, geralmente associados à retinocoroidite macular
bilateral.
Devido à imaturidade do sistema imunológico do recém-nascido, a vitreíte e
a presença de sinais inflamatórios no segmento anterior do olho podem ser
discretas ou até mesmo estar ausentes (Velilla et al., 2006; Levy, 2007; Petrova &
Mehta, 2007)
Guerina et al (1994) identificaram pela triagem neonatal em Massachusetts
1992), 50 crianças com toxoplasmose congênita. O exame oftalmológico foi
realizado no período neonatal em 48 delas. Lesão ocular ativa foi constatada em
2/48 (4%) e cicatriz de retinocoroidite em 7/48 (15%). Das nove crianças com
retinocoroidite, sete apresentavam lesão macular. O seguimento ocular de 39
crianças, tratadas no primeiro ano de vida, até seis anos de idade mostrou o
aparecimento de nova lesão ocular, em quatro (10%) (lesão macular em uma e
cicatrizes retinianas pequenas em três).
Um estudo prospectivo longitudinal de 76 recém-nascidos com
toxoplasmose congênita tratados com pirimetamina e sulfadiazina por
aproximadamente um ano e, 18 indivíduos não tratados durante o primeiro ano de
vida mostrou que a cicatriz de retinocoroidite foi o achado mais comum, com
predomínio de lesões na mácula. A cicatriz macular estava presente em 54% dos
pacientes tratados (41% bilaterais) e em 76% dos pacientes não tratados (23%
bilaterais). Estrabismo ocorreu em 34% dos casos, microftalmia em 13%, catarata
em 9% e nistagmo em 26% (Mets et al., 1997).
Sáfadi et al (2003), acompanharam por um período de cinco anos, 43
crianças com toxoplasmose congênita, no Hospital da Santa Casa de São Paulo.
Eles observaram uma prevalência de infecção subclínica ao nascimento de 88%.
Das 43 crianças, 22 (51%) desenvolveram manifestações neurológicas e 41 (95%)
apresentaram retinocoroidite. Das alterações oculares associadas, o estrabismo
foi a mais freqüente (49%). Microftalmia ocorreu em apenas 9,3% dos casos
(Safadi et al., 2003).
Wallon et al (2004) seguiram por um período de 14 anos, em um hospital
de Lyon na França, 327 crianças diagnosticadas com toxoplasmose congênita. A
(3%) apresentavam lesão ocular no primeiro mês de vida e 38 (12%)
desenvolveram pelo menos uma lesão durante o primeiro ano. Metade das lesões
oculares iniciais foi diagnosticada ao longo do primeiro ano de vida. A
retinocoroidite foi a principal seqüela da toxoplasmose congênita nessas crianças.
Schmidt et al (2006) avaliaram os resultados dos primeiros quatro anos do
programa nacional de triagem neonatal para a toxoplasmose congênita realizado
na Dinamarca. Foram identificadas 55 crianças com a doença e 47 foram
submetidas ao exame oftalmológico. Aproximadamente 14,9% (7/47) possuíam
lesões retinianas ao nascimento (todas na região macular); 23,5% (8/34) com um
ano de idade e 25% (4/16) com três anos de idade. Calcificação intracraniana foi o
principal achado neurológico (10/47) e em metade dos casos, ela estava
associada à lesão de retinocoroidite.
Em outro estudo prospectivo longitudinal, 430 crianças com sorologia
positiva para a toxoplasmose congênita foram acompanhadas por
aproximadamente 12 anos. A lesão de retinocoroidite foi detectada em 130
crianças (30,2%), sendo 22 focos de retinocoroidite diagnosticados ao nascimento
(18 crianças) e 264 durante o seguimento. As lesões detectadas ao nascimento
estavam localizadas principalmente na região macular e a alteração ocular mais
frequentemente associada à retinocoroidite, nesses casos, foi o estrabismo.
Manifestações neurológicas foram observadas em 16 crianças sem lesão ocular e
em 25 com lesão ocular (Kodjikian et al., 2006).
Outros estudos, também evidenciaram a retinocoroidite como principal
manifestação da toxoplasmose congênita e o estrabismo com principal alteração
ocular associada (Bahia, 1991; Meenken et al., 1995; Peyron et al., 1996; Villena
Na toxoplasmose congênita, o espectro das manifestações neurológicas é
variado, e como já foi dito, é mais freqüente nas crianças com lesão ocular. Na
doença com predomínio de manifestações neurológicas, a freqüência de
retinocoroidite é de 94,4%, quando as lesões neurológicas são discretas ou
ausentes, a incidência de retinocoroidite cai para 65,9% (Remington et al., 2005).
Os sinais neurológicos freqüentemente aparecem entre três e 12 meses de vida e
os sintomas neurológicos raramente se desenvolvem após o primeiro ano.
As lesões cerebrais causadas pelo toxoplasma são: inflamação de
meninges e áreas de necrose cerebral e meníngea. Os locais geralmente mais
acometidos pela necrose são: o parênquima cerebral, os gânglios da base e a
região do aqueduto de Sylvius (Diebler et al., 1985). Ao nascimento, é possível a
detecção de calcificações das áreas de necrose e isso ocorre, provavelmente,
pelo número insuficiente de fagócitos capazes de remover os debris inflamatórios
(Mussbichler, 1968; Patel et al., 1996).
A forma e a localização das calcificações intracranianas podem variar de
acordo com o tempo da infecção materna: massas grandes e densas no gânglio
basal se a infecção ocorrer antes da vigésima semana de gestação, pequenas e
redondas em torno dos ventrículos laterais se a infecção ocorrer entre a vigésima
e trigésima semana e calcificações pequenas e disseminadas no parênquima
cerebral (mais freqüentes) se a infecção ocorrer em qualquer época da gestação,
mas principalmente a partir da trigésima semana (Diebler et al., 1985).
A presença de calcificações intracranianas não tem mostrado
associação com deficiência de aprendizagem (Figueiredo et al., 1989) e a
um pior prognóstico e podem melhorar ou até mesmo desaparecer com o
tratamento específico para a toxoplasmose (Patel et al., 1996).
Entre as mais comuns manifestações do sistema nervoso central está a
hidrocefalia que pode aparecer ao nascimento ou logo após. Geralmente é
progressiva, por isso a importância do monitoramento do crescimento cefálico.
A microcefalia reflete dano cerebral grave e pode resultar em retardo
mental, mas crianças com microcefalia também podem se desenvolver
normalmente (Remington et al., 2001; Remington et al., 2005)
Em um estudo, foi avaliada a freqüência e o tipo de alterações tomográficas
cerebrais em pacientes com diagnóstico de toxoplasmose congênita, que
apresentavam alterações oftalmológicas. As lesões cerebrais radiologicamente
mais freqüentes foram as calcificações intracranianas, presentes em 16 pacientes
(72,7%). Dentre esses, nove (56,2%) possuíam apenas calcificações e sete
(43,75%) apresentavam-nas em conjunto com outro tipo de alteração neurológica.
A dilatação ventricular foi a segunda alteração mais freqüentemente encontrada
(11,7%) (Melamed et al., 2001).
2.8 A resposta imune ao Toxoplasma gondii
2.8.1 Imunidade inespecífica
As respostas imunes de um hospedeiro ao T. gondii são complexas e
envolvem precocemente a ativação de mecanismos de imunidade inespecífica.
Estudos em camundongos sugerem que o controle da infecção aguda causada
pelo toxoplasma, deflagra inicialmente uma resposta inata, seguida por uma
resolução da infecção por taquizoítos (Johnson & Sayles, 1997; Alexander &
Hunter, 1998).
Os taquizoítos ativam células como macrófagos e “natural killer” (NK). Os
macrófagos humanos são fagócitos com função, não só de apresentação de
antígenos, através do HLA classe II, mas também de secretar mediadores como o
interferon-gama (IFN-y), o fator de necrose tumoral alfa (TNF-alfa, “Tumor Necrosis
Factor- alfa”), o fator estimulador de colônia de granulócitos-macrófagos (GM-CSF,
“grnulocyte-monocyte colony-stimulating factor”), a interleucina-12 (IL-12) e a
interleucina-15 (IL-15). Já as células “natural killer” (NK) representam um
subconjunto de células derivadas da linhagem linfocitária com função citotóxica e
que secretam citocinas, principalmente o IFN-Y, sendo de grande importância na
defesa contra vírus e outros patógenos intracelulares.
A ativação inicial das células NK e dos macrófagos pelo T. gondii é
importante para o estabelecimento da resistência inespecífica que atuará
rapidamente no sentido de reduzir o número de taquizoítos, mesmo antes do
desenvolvimento da resposta imune específica. Ao mesmo tempo, a ativação das
células NK une a atividade dos mecanismos imunes inatos com mecanismos
antígeno- específicos (Bliss et al., 1999), pelo estabelecimento de uma rede de
citocinas necessárias para responder à infecção pelo T. gondii associada à ação de
apresentação de antígenos, a ser realizada por macrófagos, células dendríticas (as
células dendríticas, derivadas da medula óssea, são as células apresentadoras de
antígenos mais eficientes e para isso, expressam moléculas dos antígenos
leucocitários humanos –HLA tanto da classe I quanto da II) e células hospedeiras
2.8.2 Imunidade específica
2.8.2.1 Imunidade celular
A imunidade mediada por células ou imunidade específica é desenvolvida
por linfócitos T originados no timo, responsáveis principalmente pela defesa contra
patógenos intracelulares obrigatórios, com a função de promover a sua destruição
ou a lise das células infectadas (Haynes & Heinly, 1995). Essas ações são
realizadas tanto da forma direta quanto da forma indireta, por secreção de
citocinas. Os linfócitos T se subdividem em linfócitos T alfa-beta e linfócitos T
gama-delta (Robey & Fowlkes, 1998).
Apenas 5% do total dos linfócitos T no organismo são representados pelos
linfócitos T gama-delta que são encontrados em maior concentração em regiões
específicas, como a mucosa intestinal e placenta (Scalise et al., 1992). Uma
hipótese bem fundamentada para a ação desses linfócitos T propõe que eles
poderiam reconhecer antígenos encontrados nos limites epiteliais, entre o
hospedeiro e o ambiente externo. Neste caso, eles iniciariam uma primeira linha de
defesa contra patógenos invasores, antes mesmo do recrutamento dos linfócitos T
alfa-beta mais específicos. A resposta das células T gama-delta, observadas em
certas infecções, inclusive contra patógenos intracelulares, como T. gondii, em
humanos e em camundongos poderiam acontecer independentemente do
reconhecimento dos patógenos (Wilson & Lewis, 1990).
Os linfócitos T alfa-beta são mais numerosos, representando
aproximadamente 95% do total de linfócitos e seus receptores estão envolvidos no
reconhecimento de antígenos (Tanchot et al., 1997). Para a sua ativação, outros
sinais são requeridos, envolvendo moléculas acessórias que facilitam as interações
dessas moléculas são denominadas de co-receptoras, CD4 e o CD8, que
subdividem, respectivamente, os linfócitos T em dois conjuntos: as células T CD4+,
que representam 65% dos linfócitos T alfa-beta e as células T CD8+, que
representam 35% dos linfócitos T alfa-beta (Tanchot et al., 1997).
Ambos os linfócitos T alfa-beta CD4+ e CD8+ participam de forma
associativa e complementar na imunidade celular específica contra os patógenos
intracelulares incluindo o T. gondii e outros (De Paoli et al., 1992). Células T CD8+
efetoras citotóxicas (CTL) são capazes de lisar células alvos infectadas, mas para
a geração das células T CD8+ efetoras é requerida a participação de células T
CD4+ auxiliares ou “helper” (Gazzinelli et al., 1991). Dessa reação específica,
formam-se células de memória, tanto para as células T CD4+, quanto para as
células T CD8+.
De acordo com o ambiente propiciado por citocinas produzidas logo após o
contato com o antígeno, os linfócitos T CD4+ ainda não estimulados são
influenciados por essas citocinas diferenciando-se em células Th1 (T “helper”1) ou
em células Th2 (T “helper”2), com cada subconjunto passando a produzir um perfil
diferente de citocinas (Mosmann et al., 1986). Os linfócitos T CD4+ Th1 induzem a
imunidade celular protetora contra patógenos intracelulares e produzem citocinas
IL-12 e IFN-gama, importantes para a diferenciação e proliferação de macrófagos e
células NK, mas também para estimular o aumento de produção de
imunoglobulinas IgG2a/IgG em camundongos. Os linfócitos T CD4+ Th2 são mais
eficientes em induzir a imunidade humoral (Mosmann, 1991) e produzem
principalmente as citocinas IL-4, IL-5, IL-6 e IL-10, que irão coordenar funções
como a regulação da produção de IgE, da eosinofilia e da mastocitose (Toellner et