POLYANA DAS GRAÇAS FIGUEIREDO VILELA
AVALIAÇÃO DA LIBERAÇÃO DE METALOPROTEINASES
DA MATRIZ (MMP-3 E MMP-8) POR MACRÓFAGOS
ATIVADOS POR DIFERENTES CONCENTRAÇÕES DE
ENDOTOXINAS (LPS) EM VARIADOS PERÍODOS DE
AVALIAÇÃO DA LIBERAÇÃO DE METALOPROTEINASES DA MATRIZ (MMP-3 E MMP-8) POR MACRÓFAGOS ATIVADOS POR DIFERENTES
CONCENTRAÇÕES DE ENDOTOXINAS (LPS) EM VARIADOS PERÍODOS DE TEMPO
Dissertação apresentada à Faculdade de Odontologia, Campus de São
José dos Campos, Universidade Estadual Paulista “Júlio de Mesquita
Filho”, como parte dos requisitos para obtenção do título de MESTRE,
pelo Programa de Pós-graduação em BIOPATOLOGIA BUCAL, Área
Microbiologia / Imunologia.
Orientador: Prof. Tit. Antonio Olavo Cardoso Jorge Co-orientador: Profa. Dra. Luciane Dias de Oliveira
Apresentação gráfica e normalização de acordo com:
Alvarez S, Coelho DCAG, Couto RAO, Durante APM. Guia prático para Normalização de Trabalhos Acadêmicos da FOSJC. São José dos Campos: FOSJC/UNESP; 2008.
V618a Vilela, Polyana das Graças Figueiredo.
Avaliação da liberação de metaloproteinases da matriz (MMP-3 e MMP-8) por macrófagos ativados por diferentes concentrações de endotoxinas (LPS) em variados períodos de tempo / Polyana das Graças Figueiredo Vilela. __ São José dos Campos : [s.n.], 2009.
74.f. : il.
Dissertação (Mestrado em Biopatologia Bucal) – Faculdade de Odontologia de São José dos Campos,Universidade Estadual Paulista, 2009.
Orientador: Prof. Dr. Antonio Olavo Cardoso Jorge
1. Metaloproteinases da Matriz. 2. Endotoxinas. 3. Macrófagos. I. Jorge, Antonio Olavo Cardoso. II. Universidade Estadual Paulista. Faculdade de Odontologia de São José dos Campos. III. Título
tD24 Ficha catalográfica elaborada pelo Serviço Técnico de Biblioteca e Documentação da
Faculdade de Odontologia de São José dos Campos – UNESP
AUTORIZAÇÃO
Autorizo a reprodução e divulgação total ou parcial deste trabalho, por qualquer meio convencional ou eletrônico, desde que citada a fonte.
São José dos Campos, 20 de Agosto de 2009 . Assinatura :
Faculdade de Odontologia de São José dos Campos
Universidade Estadual Paulista – UNESP
Profa. Adj. Cristiane Yumi Koga Ito Faculdade de Odontologia de São José dos Campos
Universidade Estadual Paulista – UNESP
Profa. Dra. Mariella Vieira Pereira Leão Instituto Básico de Biociências
Universidade de Taubaté - UNITAU
DEDICATÓRIA
A meu pai e minha mãe do céu, por abençoarem cada dia de
minha vida.
Aos meus amados pais, Dércio Afonso Maria Vilela e Celma
Figueiredo Vilela. Vocês são meus maiores exemplos de dignidade,
bom caráter, perseverança, responsabilidade, sabedoria, força e
humildade. Obrigada por tudo que fazem por mim. Minha família é
o maior presente que Deus me deu.
À minha amada irmã Luciana Figueiredo Vilela, por ser
minha eterna e grande amiga. Por estar sempre ao meu lado, me
dando um pouco de sua força e sabedoria.
Aos meus queridos sobrinhos Álvaro, João Pedro e Luís
Henrique e ao meu afilhado Luan, por nos darem o prazer e a
alegria da convivência.
Ao Eder, por seu amor, seu companheirismo, sua paciência
e por todos os momentos simples e felizes que tivemos. Sua
presença neste momento foi muito importante.
A todos de minha grande e maravilhosa família, que mesmo
À Universidade Estadual Paulista “Júlio de Mesquita Filho”, na pessoa do
diretor da Faculdade de Odontologia de São José dos Campos, Prof. Adj.
José Roberto Rodrigues e do vice-diretor Prof. Dr. Carlos Augusto
Pavanelli.
Ao Programa de Pós-graduação em Biopatologia Bucal, na coordenação
da Profa. Adj. Cristiane Yumi Koga Ito e Profa. Adj. Rosilene Fernandes
da Rocha.
Aos docentes do Programa de Pós-graduação em Biopatologia Bucal.
Às secretárias da Seção de Pós-Graduação Rosemary de Fátima
Salgado, Erena Michie Hasegawa, Lílian Faris das Graças e Maria
Aparecida Consíglio de Souza, pelos auxílios prestados.
À Fundação de Amparo à Pesquisa de São Paulo (FAPESP) pela
concessão da bolsa de mestrado (Processo 2007/57552-4) e do Auxílio à
Pesquisa (Processo 2008/55780-2) que possibilitaram a realização deste
trabalho.
Ao Prof. Tit. Antonio Olavo Cardoso Jorge, pelo conhecimento
compartilhado, pelo apoio, pela confiança e por suas sábias
considerações. Seu senso de justiça, equilíbrio, sabedoria e ponderação
À Profa. Dra. Luciane Dias de Oliveira. Agradeço especialmente e muito
carinhosamente por sua amizade, compreensão, paciência, preocupação,
dedicação, por suas orações, seu carinho, seus ensinamentos científicos
e pessoais e pelo apoio de sempre.
À Profa. Adj. Cristiane Yumi Koga Ito. Muito obrigada por sua amizade,
seu apoio, ensinamento, carinho, preocupação e disposição em todos os
momentos, principalmente nos mais difíceis.
À Profa. Dra. Juliana Campos Junqueira, pelo convívio fraterno e pelos
ensinamentos compartilhados.
À minha querida amiga Emanuele Gonçalves Brito, que muito me ajudou
e ensinou neste ano. Muito brigada por tudo que fez por mim.
Aos amigos da Pós-graduação, Rogério de Lima Romeiro, Pietro
Mainenti, Joyce da Silva Martins, Bruno Mello de Matos, Alessandra
Sverberi Carvalho, Marta Majewski, Rosilene Batista de Aguiar Almeida,
Flávio Pires Molina, Ana Carolina Salvia, Daniel Freitas Alves Pereira, Ana
Paula de Lima, Karina Bortolin Lodi e Mary Anne Moreira Bárbara pelo
convívio fraterno e pelas parcerias, em especial agradeço Cristiane
Aparecida Pereira, Fernanda Lourenção Brighenti, Graziella Nuremberg
Back Brito, Simone Vilela e Guilherme Rodrigues Teodoro, que me deram
apoio em todos os momentos. Muito obrigada pelo carinho, pela amizade
e preocupação nos momentos difíceis.
Ao Sérgio Giovanny Alves, Domingos Gonçalves Pontes e Ana Paula
Simão Correa Matos, pela convivência e por tudo que fazem por nós da
Pós-graduação.
Marta Rampani, pelo apoio e pela convivência enriquecedora e agradável.
Aos amigos José Márcio Nacur de Almeida e Aldo Ivan Pereira Paiva e às
amigas Patrícia Almeida Grunewald, Aneíse Gomes de Moura, Liliam
Gazolla, Ana Carolina Nogueira, Patrícia Reis, Luciana Caetano, Michele
Cardoso, Ana Paula Ferreira, Isabela Oliveira, Gleyce Oliveira Silva, que
mesmo longe ou perto sempre me deram apoio. À Lívia Maria Serpa
Gregorio, Lo Ruana Pereira de Freitas e Lígia Tiaki Yamamoto, pela
“Tão misericordioso é Deus, que nos dá oportunidade de corrigir erros,
começar de novo, fazer o dia de hoje melhor que o dia de ontem.”
RESUMO... 10
LISTA DE ABREVIATURAS E SIGLAS... 11
1 INTRODUÇÃO... 12
2 REVISÃO DA LITERATURA... 17
2.1 Endotoxina (LPS): participação nas alterações pulpares e periapicais... 17
2.2 Envolvimento das metaloproteinases da matriz (MMP) nas alterações pulpares e periapicais... 20
3 PROPOSIÇÃO... 31
4 MATERIAL E MÉTODO... 32
4.1 Cultura celular... 32
4.2 Diferenciação celular... 33
4.3 Viabilidade da cultura de células... 35
4.4 Endotoxinas (LPS)... 36
4.5 Ativação celular pela endotoxina (LPS)... 37
4.6 Análise da liberação de metaloproteinases da matriz extracelular (MMP-3 e MMP-8) pelos monócitos/macrófagos (U937)... 38
5 RESULTADOS... 41
5.1 Produção de MMP-3... 41
5.2 Produção de MMP-8... 46
6 DISCUSSÃO... 52
6.1 Da metodologia... 52
6.2 Dos resultados... 55
7 CONCLUSÃO... 62
ANEXO ... 73
RESUMO
A proposta desta pesquisa foi avaliar a capacidade de diferentes concentrações de endotoxinas (LPS) de Escherichia coli induzir secreção de MMP-3 e MMP-8 por macrófagos in vitro, em diferentes períodos de tempo. Para tanto, monócitos humanos da linhagem U937, diferenciados em macrófagos maduros com phorbol-12-myristate-13-acetate (PMA), foram ativados com 0 (controle), 5, 10 e 20 EU/mL e a produção de MMP-3 e MMP-8 foi avaliada em três períodos de tempo (24, 48 e 72 h) por ensaios imunoenzimáticos (ELISA). Os resultados foram analisados estatisticamente (ANOVA e teste de Tukey, 5%). Pode-se verificar que houve significativo aumento da produção de MMP-3 (p<0,05) e redução da produção de MMP-8 após ativação com diferentes concentrações de LPS em relação ao controle, nos períodos de 24, 48 e 72 h. Em praticamente todos os grupos (incluindo os controles), pode-se verificar que a produção de MMP-3 ou MMP-8 aumentou significativamente em relação ao aumento do tempo. Pode-se concluir que: a) diferentes concentrações de endotoxinas apresentaram capacidade de induzir aumento significativo da produção de MMP-3 nos períodos de 24, 48 e 72 h, independente da concentração utilizada, sugerindo que esta ativação é dependente da presença de endotoxina e não da dose; b) a presença de diferentes concentrações de endotoxinas induziu significativa redução da produção de MMP-8 em relação ao controle, em todos os períodos de tempo avaliados.
LISTA DE ABREVIATURAS E SIGLAS
AMPc = Adenosina Monofosfato Cíclico
CMT = Tetraciclina Quimicamente Modificada
COX = Cicloxigenase
cPLA2 = Fosfolipase A2 citosólica
DO = Densidade Óptica
ELISA = Ensaio Imunossorbente Ligado à Enzima
EU = Unidade de Endotoxina
FGF = Fator de Crescimento para Fibroblatos
IL = Interleucina
ICAM 1 = Molécula de Adesão Intercelular-1
LPS = Lipopolissacarídeo
MEC = Matriz Extracelular
MMP = Metaloproteinase da Matriz
MT-MMP = Metaloproteinase ligada à Membrana Plasmática
NO = Óxido Nítrico
(O2-) = Superóxido
PDGF = Fator de Crescimento Plaquetário
PGE2 = Prostaglandina E2
PMA = Phorbol-12-myristate-13-acetate
PMN = Polimorfonuclear Neutrófilo
RNAm = Ácido Ribonucléico mensageiro
TIMP = Inibidor de Metaloproteinase Tecidual
TNF = Fator de Necrose Tumoral
TGF = Fator de Crescimento e Transformação
Microrganismos e seus produtos são os principais responsáveis pela indução e manutenção das alterações pulpares e periapicais, promovendo reação inflamatória e reabsorção óssea periapical (Hong et al., 2004). A inflamação pulpar geralmente é causada por uma extensão da cárie dentária, permitindo que as células da polpa entrem em contato com bactérias ou seus produtos, o que pode resultar em pulpite (Hahn; Liewehr, 2007; Lee et al., 2008). Em dentes com necrose pulpar e periodontite apical, a infecção é causada por combinações específicas de bactérias anaeróbias facultativas e estritas, principalmente Gram-negativas (Sundqvist et al., 1989).
O principal fator de virulência das bactérias Gram-negativas é representado pela liberação de endotoxinas, que são complexos lipopolissacarídicos presentes na membrana externa da parede celular bacteriana (Petsch; Anspach, 2000). O acúmulo destes componentes bacterianos na polpa dentária ou na região periapical pode estimular macrófagos presentes na área a produzirem citocinas. A secreção de citocinas pode estimular as células da polpa a produzirem enzimas que degradam a matriz extracelular (Panagakos et al., 1996). Desta forma, as bactérias Gram-negativas têm papel central na inflamação pulpar e periapical (Lee et al., 2008).
13
da estimulação da produção e secreção de metaloproteinases da matriz (MMP) pelas células presentes no local da inflamação (O’Boskey; Panagakos, 1998).
Em 1997, Wang et al. demonstraram em modelo
experimental de reabsorção óssea em ratos, que IL-1D e TNF-D são importantes mediadores da reabsorção óssea na patogênese da lesão. Entretanto, existe pouca informação sobre o efeito das citocinas e do LPS na produção de MMP por células da polpa in vitro (Panagakos et al.,
1996) e o mecanismo patológico preciso, envolvido na lesão periapical, ainda não está totalmente esclarecido (Takahashi, 1998).
Estudos relataram que a inoculação de LPS no interior dos canais radiculares de cães produziu reação inflamatória e reabsorção óssea periapical (Nelson-Filho et al., 2002; Silva et al., 2002), demonstrando a correlação positiva entre endotoxinas e presença de lesões periapicais (Sundqvist, 1992).
Hong et al. (2004) sugeriram que a presença de endotoxinas em canais radiculares infectados estimula macrófagos a
liberar IL-1D e TNF-D, as quais induzem a síntese de metaloproteinase da matriz (MMP-1) e, conseqüentemente, reabsorção óssea periapical. De
acordo com os autores, IL-1D e TNF-D apresentam papel significante na patogênese das alterações pulpares e periapicais. Os autores verificaram ainda, em modelo experimental de lesão periapical em ratos, que a administração de polimixina B (antibiótico catiônico com potente atividade sobre LPS) reduziu a extensão das lesões em 76% a 80% e, simultaneamente, reduziu o número de macrófagos produtores de MMP-1.
estromelisinas (MMP-3, 7, 10, 11 e 12) , enamelisina (MMP-20) e MMPs ligadas à membrana plasmática (MT-MMP), entre outras (Llano et al., 1997; Tjäderhane et al., 2001). O conhecimento detalhado das MMP é importante para o entendimento da patogênese da inflamação pulpar e periapical (Tsai et al., 2005).
As MMP são produzidas por diversos tipos de células incluindo neutrófilos, fibroblastos e macrófagos (Kumar et al., 2005) e sua atividade é controlada por alterações no delicado balanço entre a expressão e síntese das MMP e seus principais inibidores endógenos (Sorsa et al., 2004). A produção das MMP e dos inibidores de metaloproteinases teciduais (TIMP) pelas células é regulado por muitas citocinas, fatores de crescimento e hormônios. O desequilíbrio entre MMP e TIMP pode influenciar o processo de destruição tecidual (Takahashi, 1998).
Assim como em outros tecidos com inflamação, as MMP estão presentes no tecido pulpar inflamado e em lesões periapicais (Wahlgren et al., 2002). Entretanto, os dados sobre a presença e função das MMP nos tecidos dentários são limitados (Tjäderhane et al., 2001). De acordo com Takahashi (1998), são necessários mais estudos para determinar o mecanismo regulatório de MMP e TIMP nas lesões periapicais. Em 2001, Lin et al. sugeriram que a expressão gênica de MMP-1 e TIMP-1, estimulada por citocinas em fibroblastos da polpa, é mediada, em parte, por uma via dependente de prostaglandina. Outros autores têm demonstrado que a prostaglandina E2 (PGE2) tem sido
relatada como sinérgica ou antagônica com IL-1 ou TNF-D na modulação da expressão de MMP-1 e TIMP-1, dependendo do tipo de célula (Takahashi et al., 1997; Zhang et al., 1998).
15
de diferentes citocinas em estimular a secreção de MMP envolvidas nas alterações da polpa e periápice ainda não está bem esclarecida.
Shin et al. (2002) detectaram MMP-1, MMP-2 e MMP-3 em tecido pulpar inflamado e em lesões periapicais, sugerindo que as MMP têm importante papel na inflamação pulpar e periapical, especialmente em pulpites sintomáticas, o que poderia estar relacionado com o aumento do nível de prostaglandina E2 (PGE2) nestas situações. No entanto, esta interação entre MMP e prostaglandina em macrófagos deve ser melhor estudada.
As células do infiltrado inflamatório são as principais produtoras de MMP, e o efeito parácrino e autócrino do repertório de citocinas destas células inflamatórias é, provavelmente, o que causa o desequilíbrio na proporção entre MMP e TIMP, levando, por fim, à alteração da arquitetura da matriz extracelular (Kim et al., 2006).
Em 2007, Bodet et al. avaliaram a produção de MMP e de seus inibidores (TIMP) por fibroblastos gengivais estimulados por LPS de
Actinobacillus actinomycetemcomitans e verificaram que LPS pode
estimular a produção de MMP-2, MMP-3 e TIMP-1 e a atividade das MMP. É provável também que o aumento da expressão de TIMP não compense o aumento da expressão de MMP, causando um desequilíbrio na relação MMP/TIMP, o que pode contribuir para destruição do tecido conjuntivo periodontal.
LPS é um potente ativador de monócitos/macrófagos e pode, portanto, induzir a produção de diversos mediadores e citocinas
2 REVISÃO DA LITERATURA
2.1 Endotoxina (LPS): participação nas alterações pulpares e periapicais
A partir da década de 80, os avanços tecnológicos na cultura e identificação microbiológica demonstraram que, em canais radiculares de dentes com necrose pulpar e lesão periapical crônica, predominavam microrganismos anaeróbios, principalmente Gram-negativos (Leonardo et al., 2004). Quando a polpa dentária é exposta à cavidade bucal, ocorre contaminação inicial, predominantemente, de microrganismos aeróbios e facultativos. À medida que o processo infeccioso progride, o decréscimo de oxigênio e o desenvolvimento de um baixo potencial de óxido-redução favorecem a mudança desta microbiota que passa a ser, predominantemente, de microrganismos anaeróbios (Sundqvist; Sweden, 1994). Tani-Ishii et al., em 1994, verificaram que na fase ativa de destruição óssea periapical e expansão das lesões em ratos, havia predomínio de bactérias anaeróbias estritas Gram-negativas.
Segundo Takahashi (1998), os possíveis mecanismos patológicos da lesão periapical precisam ser discutidos, uma vez que, o mecanismo preciso envolvido nesta lesão ainda não está totalmente esclarecido. Existem poucos estudos que avaliaram, isoladamente, o efeito do LPS no tecido apical e periapical (Silva et al., 2002) e a relação entre LPS e o desenvolvimento de lesão periapical com concomitante reabsorção óssea, permanece controversa (Hong et al., 2004).
Lee et al. (2008) examinaram o papel do LPS de E. coli na
reação inflamatória em células da polpa dentária humana, para tanto, avaliaram a capacidade do mesmo induzir a expressão da molécula de adesão intercelular-1 (ICAM-1) e molécula de adesão celular vascular-1 (VCAM-1). Estas moléculas são expressas no tecido pulpar em resposta ao estímulo inflamatório e contribui para o recrutamento e migração das células inflamatórias. A expressão destas moléculas pelas células aumentaram, significativamente, de acordo com a dose e o tempo de tratamento com LPS. Com base neste resultado, os autores propuseram que LPS purificado de E. coli é um potente indutor da inflamação pulpar.
Estudos, realizando inoculação de LPS nos canais radiculares de cães, mostraram que, após 30 dias, a endotoxina presente nos canais induziu área de lesão periapical com extensa reabsorção óssea visível radiograficamente (Nelson-Filho et al., 2002) e um intenso infiltrado inflamatório, com predomínio de neutrófilos e macrófagos (Silva et al., 2002).
19
desenvolvimento de lesão periapical com concomitante reabsorção óssea. Pita et al. (2009), demonstraram que a aplicação de LPS de E. coli na
polpa dentária de ratos, induziu reação inflamatória, com produção de PGE2 e MMP-3 associadas com a alta atividade de óxido nítrico e sugeriram que NO induz a expressão de COX-2 e que a PGE2 produzida pela COX-2, induz a produção de MMP-3.
As endotoxinas, quando presentes, ligam-se ao receptor CD14 na superfície de monócitos e macrófagos, e estas células ativadas secretam interleucinas (IL-1, IL-6 e IL-8), fator de necrose tumoral-D
(TNF-D), superóxido (O2-), óxido nítrico, interferons D, E e J, e moléculas lipídicas como o fator ativador de plaquetas e as prostaglandinas, entre outros (Janeway et al., 2002). Assim, diversos estudos têm sugerido que as endotoxinas representam um dos principais fatores etiológicos envolvidos na patogênese da inflamação pulpar e periapical (Barthel et al., 1997; Nelson-Filho et al., 2002; Silva et al., 2002; Tanomaru et al., 2003; Hong et al., 2004; Silva et al., 2004).
O acúmulo de LPS na área infectada pode estimular a liberação de citocinas pró-inflamatórias de neutrófilos ou monócitos/macrófagos (Wilson et al., 1996; Lin et al., 2001). Citocinas
detalhado das MMP pode ser importante para o entendimento da patogênese da inflamação pulpar, uma vez que o mecanismo preciso desta patogênese ainda precisa ser elucidado (Tsai et al., 2005).
2.2 Envolvimento das metaloproteinases da matriz (MMP) nas alterações pulpares e periapicais
A lesão periapical geralmente é uma resposta à chegada de microrganismos pelo canal radicular (Itoh et al., 2009), consistindo em inflamação periapical com destruição do ligamento periodontal e reabsorção do osso alveolar e da raiz (de Paz, 2007; Morimoto et al., 2008).
O ligamento periodontal é um tecido conjuntivo denso, localizado entre o cemento e o osso alveolar, suportando o dente. A destruição do ligamento periapical é inicializada pela degradação da matriz extracelular (MEC), que é composta principalmente por fibras colágenas e elásticas, incluindo fibras oxitalânicas e fibras contendo elastina (Kielty et al., 2005;Morimoto et al., 2008).
21
explicar o fato da reabsorção óssea ser altamente sensível a citocinas como IL-1 e TNF-D (Birkedal-Hansen, 1993). Como as MMP são as principais enzimas responsáveis pela degradação da MEC (Takahashi, 1998; Massova et al.,1998), sugere-se que as mesmas apresentam importância em condições inflamatórias, como nas alterações pulpares e periapicais (Wahlgren et al., 2002; Shin et al., 2002), mas o mecanismo molecular envolvendo as MMP nestes processos ainda não é completamente conhecido (Carneiro et al., 2009).
As metaloproteinases da matriz são uma família de endopeptidases que inclui mais de 20 membros classificados de acordo com a especificidade ao substrato e estrutura molecular, em: a) colagenases (MMP-1, 8 e 13), que atuam em colágeno fibrilar dos tipo I, II e III; b) gelatinases (MMP-2 e 9), que degradam o colágeno amorfo, bem como a fibronectina; c) estromelisinas (MMP-3, 7, 10, 11 e 12), que atuam numa variedade de componentes da matriz extracelular, incluindo proteoglicanas, laminina, fibronectina e colágenos amorfos; d) enamelisina (MMP-20), que degrada enamelina; f) MMPs ligadas à membrana plasmática (MT-MMP) (MMP-14, 15, 16 e 17), entre outras (Llano et al., 1997; Tjäderhane et al., 2001).
As MMP estão envolvidas em processos fisiológicos, incluindo remodelamento, reparação e desenvolvimento tecidual (Massova et al., 1998; Uitto et al., 2003; Sorsa et al., 2004). Em tecidos adultos, a expressão e a atividade das MMP são normalmente baixas, mas aumentam significativamente em várias condições patológicas que podem levar à destruição tecidual, como doenças inflamatórias e neoplasias, assim como em doenças bucais como câncer e cárie (Sorsa et al., 2004). Podem atuar também na aterogênese, onde as MMP produzidas pelos macrófagos podem ser responsáveis pela ruptura da placa aterosclerótica (Hua et al., 2009). Como o papel das MMP na degradação tecidual tem se tornado evidente em muitas doenças, tentativas de controlar suas atividades por meios farmacológicos têm ganhado muita atenção (Sorsa et al., 2004). Em 2009, Hua et al. demonstraram que a aspirina pode inibir a expressão de MMP-2 e MMP-9 assim como pode potencializar a sua inibição pela indução da expressão de TIMP-1 e TIMP-2, resultado este que sugere um novo efeito farmacológico protetor da aspirina quanto à ruptura da placa aterosclerótica. No entanto, o exato papel das MMP nestas várias doenças ainda não está totalmente esclarecido (Uitto et al., 2003; Sorsa et al., 2004).
Em 1996, Panagakos et al. utilizando células da polpa dentária humana e células de ratos, avaliaram, in vitro, o papel do LPS e
23
desempenham um papel crítico na patogênese da inflamação pulpar e que, durante a fase crônica desta inflamação, o aumento dos níveis das citocinas potencializam as células pulpares quanto à secreção de MMP.
Existem indícios da ação das MMP na organização da matriz dentinária e na regulação da mineralização, mas os dados da presença e das funções das MMP nos tecidos dentários são limitados (Tjäderhane et al., 2001). A presença das formas pró e ativa da MMP-8, MMP-2 e MMP-9 foi demonstrada em lesões de cárie dentária humana. A presença da forma ativa serve como indicativo da atividade das MMP durante a degradação da matriz na dentina (Tjäderhane et al., 1998). Segundo Itoh et al. (2009), a lesão periapical, que é uma resposta à chegada de microrganismos do canal radicular e que está relacionada à destruição da MEC, pode estar associada à ativação de metaloproteinases da matriz como MMP-1, MMP-2 e MMP-9. Estes autores demonstraram que Prevotella nigrescens, que têm sido isoladas
de canal radicular e associadas com lesão periradicular, são capazes de ativar as formas proMMP-2 e proMMP-9 in vivo e esta ativação pode estar
relacionada à destruição do tecido periapical. Neste mesmo ano, Santos et al. (2009) investigaram a presença de MMP na dentina radicular por meio de zimografia e Western blotting. Os autores puderam confirmar a presença de MMP-2, MMP-8 e MMP-9 na dentina coronária, assim como demonstrar a sua existência também região radicular do dente.
durante o tratamento, seja usada como instrumento para avaliação da inflamação periapical (Wahlgren et al., 2002), assim como estudos sobre o mecanismo regulatório entre MMP e TIMP nas lesões periapicais (Takahashi, 1998). Acredita-se que inibidores de MMP em canais radiculares e em tecidos periapicais possam oferecer, no futuro, uma nova perspectiva para o tratamento endodôntico (Wahlgren et al., 2002).
Segundo Ramamurthy et al. (2002), nas últimas décadas, intensificou-se o interesse no desenvolvimento de inibidores de MMP para uso terapêutico em diversas doenças. Os autores demonstraram que o uso de inibidores de MMP reduziu a atividade de MMP e adicionalmente reduziu a margem de reabsorção óssea em periodontites induzidas em ratos pela injeção local de LPS.
As metaloproteinases da matriz são tradicionalmente vistas como enzimas destrutivas em doenças inflamatórias, no entanto, com base nos resultados do seu estudo, Tjäderhane et al. (2007) propõem uma nova visão do papel da MMP. Os autores avaliaram o efeito de inibidores de MMP (tetraciclina quimicamente modificada/CMT-3) na formação da lesão periapical em modelo experimental de ratos e, surpreendentemente, encontraram maior área de necrose pulpar e lesão periapical no grupo de ratos que receberam (CMT-3) do que no grupo controle (submetido somente à exposição pulpar). De acordo com os autores, estes resultados podem indicar que as MMP possuem propriedades anti-infecciosas e/ou anti-inflamatória na patologia pulpar e periapical. Desta forma, são necessários mais estudos para avaliar se o efeito anti-infeccioso e/ou anti-inflamatório das MMP é local, específico a um determinado tecido ou é geral e também verificar se este efeito está relacionado a uma MMP ou a vários membros da família de MMP.
25
maiores nos grupos com pulpite aguda do que no grupo controle (pacientes com polpa no seu estado normal), sugerindo o importante papel das MMP na progressão do processo inflamatório pulpar e na destruição tecidual periapical. Além disso, por análise imunohistoquímica, MMP-1 e MMP-3 foram localizadas na matriz extracelular ao redor das células inflamatórias, resultado este sugestivo de que MMP-1 e MMP-3 podem ser secretadas por células inflamatórias como neutrófilos, macrófagos e linfócitos (Shin et al., 2002) e que há uma fonte multicelular de MMP nas infecções endodônticas (Tjäderhane et al., 2007). Entretanto, a regulação da produção de MMP-3 durante a inflamação pulpar ainda é pouco entendida. Acredita-se que durante o processo inflamatório da polpa dentária há indução e ativação da síntese de óxido nítrico pelas células endoteliais, fibroblastos, macrófagos que então catalisam a síntese de NO. Este, por sua vez, induz a expressão de COX2 causando a liberação de PGE2. O acúmulo de PGE2 determina a secreção de MMP-3 (Pita et al., 2009).
A técnica de ensaio imunoenzimático (ELISA) adotada no estudo de Shin et al. (2002) também foi utilizada por Figueredo et al. (2003) para quantificar MMP-9 do fluido gengival de pacientes com gengivite e de pacientes com periodontite crônica. Segundo os autores, esta técnica consegue quantificar a MMP-9 ativa somada a proMMP-9, ou seja, ela não é capaz de analisar a atividade gelatinolítica total, nem as frações ativas e latentes separadamente, no entanto, ela é extremamente sensível. Os resultados deste estudo demostraram que a quantidade de MMP-9 nos sítios com perda de inserção foi maior do que nos sítios com inflamação mas sem destruição periodontal, sugerindo que esta enzima pode estar envolvida na destruição tecidual que ocorre na periodontite.
(Gusman et al., 2002). Em 2005, Tsai et al. demonstraram que o tecido pulpar humano pode expressar MMP-9, uma vez a mesma foi detectada em odontoblastos, fibroblastos, infiltrados inflamatórios e células endoteliais. Adicionalmente, o nível de MMP-9 nas polpas com inflamação foi, significativamente, maior do que nas polpas com aspectos clínicos saudáveis. Assim, estes autores relataram existir boa evidência para suspeitar que MMP-9 pode ter um papel importante na patogênese da inflamação pulpar.
Carneiro et al. (2009) demonstraram que a expressão de MMP-9 também foi significativamente maior em dentes com periodontite apical do que naqueles com ligamento periodontal normal, sugerindo que a MMP-9 pode estar diretamente envolvida na destruição da MEC nestas lesões e, portanto, pode estar associada ao desenvolvimento e progressão da lesão periapical. Os resultados deste estudo sugeriram a participação de várias células inflamatórias na expressão de MMP-9 em particular macrófagos, sugerindo que estas células são fonte de MMP-9 durante periodontite apical. A presença de macrófagos na periodontite periapical crônica é crucial devido ao seu papel na reposta protetora, assim como no desenvolvimento da lesão e na perpetuação da resposta inflamatória (Márton; Kiss, 2000; Carneiro et al., 2009).
Os macrófagos desempenham importante papel na regulação do turnover da MEC por meio da secreção de proteases,
incluindo MMP, inibidores de proteases e citocinas, tanto em condições normais como patológicas (Hong et al. 2000; Shin et al. 2002). Os macrófagos podem expressar várias MMP, incluindo colagenase I (1), gelatinases (2, 9), estromelisinas (3, 7, MMP-12), colagenase-3 (MMP-13) (Goetzl et al., 1996; Imai et al., 1998) e outra colagenase (MMP-8) (Wahlgren et al., 2002).
27
al. foram os primeiros a demonstrar que a produção de MMP-1 por monócitos pode ser induzida por citocinas e que MMP-1, MMP-9 e TIMP-1 são diferentemente regulados por combinações de citocinas, por de mecanismos dependentes (MMP-1) e independentes (MMP-9 e TIMP-1) de prostaglandina (PG). O primeiro mecanismo foi demonstrado pela inibição da produção de MMP-1 dos monócitos pela indometacina e a reversão desta inibição com o uso de agentes exógenos, como PGE2, que eleva o nível intracelular de AMPc. A produção de MMP-9 e TIMP, por sua vez, não apresentou alteração na presença de indometacina, sugerindo um mecanismo de regulação de MMP por via independente de PG. Estes autores (Zhang et al.,1998) relataram ainda que os mecanismos sinalizados por citocinas e que promovem a produção de MMP parecem ser, em parte, diferentes para diversos tipos de células.
que sugere um possível efeito protetor da PGE2 à excessiva destruição tecidual durante a pulpite.
Em modelos experimentais de lesão periapical em ratos, Lin et al. (2002) detectaram a expressão gênica de MMP-1, TIMP-1, IL-6 e COX-2, indicando, portanto, o envolvimento destes mediadores no desenvolvimento da lesão periapical associada à reabsorção óssea. Os macrófagos foram as principais fontes de MMP-1, IL-6 e COX-2, principalmente na fase inicial. Estas células se agregaram ao redor da área de reabsorção óssea e o número de células expressando MMP-1 aumentou consideravelmente à medida que a lesão progredia, implicando o envolvimento dos macrófagos no desenvolvimento da lesão periapical. Os autores observaram também uma redução característica da área de reabsorção óssea e na expressão de MMP-1 e IL-6 após uso de inibidores da COX-2, sugerindo a importância da COX-2 na patogênese da lesão periapical pela modulação indireta à expressão de MMP-1 e IL-6. Shin et al. (2002) relataram, entretanto, que são necessários novos estudos sobre a relação entre MMP e prostaglandinas em macrófagos.
A hipótese do envolvimento de citocinas como IL-1, IL-1 e TNF- na produção de MMP-1 foi verificada na estudo de Hojo et al. (2000), no qual anticorpos contra estes mediadores foram colocados em co-cultura de células endoteliais e monócitos o que resultou numa significativa inibição da produção de MMP-1 por estas células, quando na presença de anti-IL-1 e anti-TNF-.
Para avaliar o papel do LPS em lesões periapicais, Hong et al. (2004) investigaram in vitro o efeito do LPS na produção de IL-1 ,
29
vivo, dos modelos experimentais de ratos. Desta forma, os autores
sugeriram que o LPS desempenha um importante papel nas lesões periapicais, onde a reabsorção óssea é induzida pela liberação de citocinas pró-inflamatórias, que por sua vez modulam a produção de MMP-1 pelos macrófagos.
Durante o desenvolvimento da lesão periapical, induzida por exposição pulpar (7, 14, 21, 28 e 42 dias) em modelos experimentais de ratos, foi avaliada a presença de elastase (macrófago elastase), que é um membro da família de MMP produzida especificamente por macrófagos e de neutrófilo elastase, secretada por neutrófilos. A macrófago elastase, detectada após 7 dias, foi significativamente maior do que neutrófilo elastase entre 7º e 21º dias, enquanto neutrófilo elastase, detectada a partir do 14º dia, aumentou gradualmente entre 14º e 28º dias. Ambas elastases aumentaram durante o desenvolvimento da lesão, com destruição do osso alveolar. Estes resultados indicam que a atividade de macrófago elastase aumentou no início destruição do tecido periradicular e que a atividade de neutrófilo elastase pode estar relacionada com a expansão da destruição. Uma vez que os macrófagos foram mais ativos durante o estágio inicial da lesão periradicular, acredita-se que macrófago elastaacredita-se possa contribuir para o início da destruição da MEC do tecido periapical (Morimoto et al., 2008).
Monócitos/macrófagos humanos da linhagem U937, considerados úteis para estudar o comportamento dos macrófagos (Jiang et al., 2003; Lee et al., 2007), têm sido utilizados para quantificação, por ensaio imunoenzimático (ELISA), após ativação por LPS, da produção de citocinas (Bodet et al., 2006; Grenier; Grignon, 2006; Lee et al., 2007;
Tanabe; Grenier, 2008), PGE2 (Tanabe; Grenier, 2008) e de
metaloproteinases da matriz (Maldonado et al., 2004; Bodet et al., 2006; Grenier; Grignon, 2006; Tanabe; Grenier, 2008). Em 2006, Grenier e Grignon, utilizando monócitos/macrófagos humanos (U937),
significativo aumento da secreção de IL-1, IL-6, IL-8, TNF-, PGE2 e MMP-9 por estas células. Em 2008, Tanabe e Grenier também demonstraram significativa indução destes mediadores pelos macrófagos
(U937), após 24 horas de ativação por LPS de A.
actinomycetemcomitans. No entanto, são poucos os estudos na literatura
que avaliaram a relação específica das MMP produzidas por macrófagos com outros fatores liberados numa infecção endodôntica, como endotoxinas, citocinas e prostaglandinas.
3 PROPOSIÇÃO
O objetivo desta pesquisa foi avaliar a capacidade de
diferentes concentrações de endotoxinas (LPS) de Escherichia coli
induzirem a secreção de MMP-3 e MMP-8 por macrófagos in vitro, nos
Esta pesquisa foi submetida e aprovada pelo Comitê de
Ética em Pesquisa da Faculdade de Odontologia de São José dos
Campos (102/2007-PH/CEP – Anexo).
4.1 Cultura celular
Foi utilizada linhagem de monócitos humanos (U937)
obtida do banco de células da Associação Técnico Científica Paul Ehrlich
(APABCAM, Rio de Janeiro, RJ). As células foram mantidas em meio
RPMI-1640 (LGC Biotecnologia, Cotia, SP), enriquecido com 10% de soro
fetal bovino (GIBCO, Invitrogen, NY, USA), em incubadora a 37ºC com
5% de CO2 (Figura 4). O meio de cultura foi trocado (Figura 1) a cada dois
dias, mantendo uma concentração celular entre 1x105 e 2x106
monócitos/mL para garantir ótimo crescimento (Grenier; Grignon, 2006).
33
4.2 Diferenciação celular
Os monócitos humanos da linhagem (U937) foram
diferenciados em macrófagos aderentes por meio de tratamento com
phorbol-12-myristate 13-acetato (PMA; Sigma-Aldrich, St. Louis, MO,
USA) (Figura 2). Para isto 1 x 106 monócitos/mL foram mantidos por 48 h
em meio RPMI-1640, enriquecido com 10% de soro fetal bovino, na
presença de 1 Pg/mL de PMA (Figura 2). Este tratamento foi realizado
para induzir características de macrófagos maduros (Rovera et al., 1979;
Vogel et al., 2005; Bodet et al., 2006; Grenier; Grignon, 2006; Lee et al.,
2007; Tanabe; Grenier, 2008). Em seguida, o meio foi removido por
aspiração e as células foram incubadas novamente em meio RPMI-1640,
enriquecido com 10% de soro fetal bovino, livre de PMA, pelo período de
24 h.
A B
Figura 2 – a) frasco contendo phorbol-12-myristate 13-acetato (PMA; SIGMA- Aldrich); b) adição de 1Pg/mL de PMA à cultura celular.
Os macrófagos aderidos foram retirados com uso de cell
scrap (SPL Ciencor Scientific, São Paulo, SP) (Figura 3) e a solução foi
centrifugada (1200 Xg/ 10 min/ 250C) (Figura 4 e Figura 5) e
ressuspendida com meio RPMI-1640 enriquecido com 1% de soro fetal
Figura 3 – Uso de cell scrap (SPL Ciencor) para retirada de macrófagos aderidos.
A B
Figura 4 - a) incubadora de CO2 (Ultrasafe/Biosystems Ltda); b) centrífuga
microprocessada (MPW/Biosystems Ltda).
35
4.3 Viabilidade da cultura de células
A viabilidade celular foi avaliada pelo teste de exclusão
utilizando azul de tripan (0,5%; Sigma-Aldrich, St. Louis, MO, USA) e
contagem das células viáveis em câmara de Neubauer. Para tanto, em
uma alíquota de 50 PL da suspensão celular foi adicionado 5 PL de azul
de tripan 0,5% (Figura 6). Uma alíquota de 10 PL desta mistura foi
colocada na câmara de Neubauer (Figura 6) e visualizada em microscópio
óptico, para realizar a contagem das células viáveis (não coradas).
A B
Figura 6 – a) adição de 5 PL do azul de tripan 0,5% à suspensão celular; b) câmara de Neubauer sendo preenchida com uma alíquota da cultura celular acrescentada de azul de tripan.
Para realização dos testes, foram colocados 1 x 106
células viáveis em cada poço da placa de polistireno (apirogênica) de 24
poços (COSTAR, Corning Incorporated, NY, USA) acrescentado de meio
RPMI-1640 enriquecido com 1% de soro fetal bovino até obter volume
Figura 7 – Distribuição de 1 x 106 células viáveis em cada poço da placa de polistireno (apirogênica) de 24 poços.
4.4 Endotoxinas (LPS)
Foi utilizada neste estudo endotoxina padrão de
Escherichia coli (Cambrex), em diferentes concentrações (0, 5, 10 e 20
EU/mL) (Figura 8).
37
4.5 Ativação celular pela endotoxina (LPS)
Após distribuição das células nos poços, estas foram
ativadas com diferentes concentrações de LPS (0, 5, 10 e 20 EU/mL)
(Figura 9). Foram realizadas 30 repetições para cada concentração de
LPS, totalizando 120 amostras. A produção de metaloproteinases da
matriz foi avaliada em três diferentes períodos de tempo após ativação
celular: 24, 48 e 72 h, sendo utilizadas 10 repetições para cada tempo de
avaliação.
4.6 Análise da liberação de metaloproteinases da matriz extracelular (MMP-3 e MMP-8) pelos monócitos/macrófagos (U937)
A produção de metaloproteinases da matriz (MMP-3 e
MMP-8) foi avaliada por ensaios imunoenzimáticos (ELISA) utilizando os
Kits DuoSet® ELISA Development System (R&D Systems, Minneapolis,
USA) (Figura 10). Assim, microplacas de 96 poços (Nunc) foram
previamente sensibilizadas com anticorpos de captura anti-MMP-3 ou
anti-MMP-8 (R&D Systems). As placas foram mantidas overnight, em
temperatura ambiente e depois foi feita lavagem abundante com PBS
contendo Tween 20. (Figura 11). Após a lavagem, foi feito bloqueio
(Figura 11) com a adição de Reagente Diluente (PBS contendo 1% de
Soro Bovino Albumina–BSA) e a placa foi mantida em temperatura
ambiente por 1 h. Após uma nova lavagem, amostras dos sobrenadantes
de cada poço da cultura de células e os controles da reação
(curva-padrão) foram adicionados e as placas mantidas por 2 h em temperatura
ambiente (Figura 12). Os testes foram realizados em duplicata para cada
amostra. Após lavagem abundante com PBS contendo Tween 20 foi
acrescentado anticorpo de detecção anti-MMP-3 ou anti-MMP-8 marcado
com biotina (Figura 12). Após 2 h de incubação, as placas foram
novamente lavadas e foi adicionada estreptoavidina conjugada com
peroxidase (R&D Systems) e foram mantidas por 20 minutos ao abrigo da
luz. Repetiu-se a lavagem abundante com PBS contendo Tween 20 e a
reação foi revelada (Figura 13) com solução de substrato cromogênico
que contem Reagente A (peróxido de hidrogênio) e Reagente B
(tetrametilbenzidina) (R&D Systems) (Figura 10). A reação foi bloqueada
após os 20 minutos com ácido sulfúrico 2 N (Figura 14). As densidades
ópticas (DO) foram lidas no leitor de microplacas (Biotek) (Figura 15) com
comprimento de onda de 450 nm e os níveis de MMP-3 e MMP-8
39
resultados foram analisados estatisticamente, pela análise de variância
ANOVA, com nível de significância de 5%, e pelo teste de Tukey.
A B
Figura 10 - Kit e Reagentes utilizados para quantificação de MMP. a) Kit DuoSet® ELISA Development System (R&D Systems, Minneapolis, USA; b) Reagente A e Reagente B (R&D Systems, Minneapolis, USA).
A B
Figura 11 - Procedimentos realizados no ensaio imunoenzimático a) lavagem da placa com PBS contendo Tween 20; b) adição de Reagente Diluente (Bloqueio).
A B
A B
Figura 13 – Revelação da reação: a) adição da solução de substrato cromogênico que reage com a peroxidase; b) resultado da reação após 20 minutos.
Figura 14 - Procedimento realizado no ensaio imunoenzimático: bloqueio da reação anterior com ácido sulfúrico 2 N.
5. RESULTADOS
5.1 Produção de MMP-3
Os valores médios da quantidade de MMP-3 (pg/mL)
obtidos nos sobrenadantes das culturas celulares após ativação por
endotoxinas de E. coli nas concentrações 0 (controle), 5, 10 e 20 EU/mL,
em diferentes períodos de tempo (24, 48 e 72 h), estão apresentados nas
Tabelas 1 a 4, respectivamente.
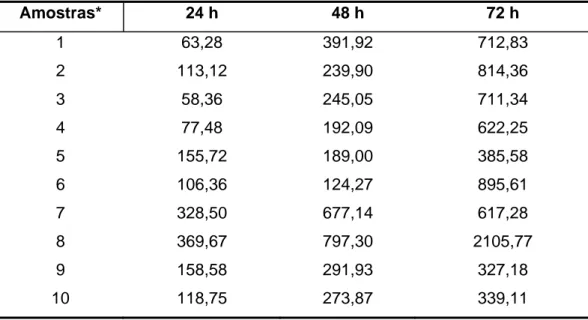
Tabela 1 – Valores médios da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares sem ativação por endotoxina de E. coli (controle), nos diferentes períodos de tempo
Amostras* 24 h 48 h 72 h
1 63,28 391,92 712,83
2 113,12 239,90 814,36
3 58,36 245,05 711,34
4 77,48 192,09 622,25
5 155,72 189,00 385,58
6 106,36 124,27 895,61
7 328,50 677,14 617,28
8 369,67 797,30 2105,77
9 158,58 291,93 327,18
10 118,75 273,87 339,11
Tabela 2 – Valores médios da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação por endotoxina de E. coli na concentração 5 EU/mL, nos diferentes períodos de tempo
Amostras* 24 h 48 h 72 h
1 913,33 1623,23 2629,09
2 879,72 2312,72 2589,09
3 1050,20 1157,65 2008,72
4 759,70 1503,54 2105,00
5 892,18 2521,21 1991,66
6 869,59 1988,33 2045,01
7 1095,62 2532,12 2268,33
8 1322,45 2185,46 2100,03
9 1191,53 2238,77 2126,39
10 1286,06 2119,75 2125,59
* grupo ativado com 5 EU/mL de endotoxina.
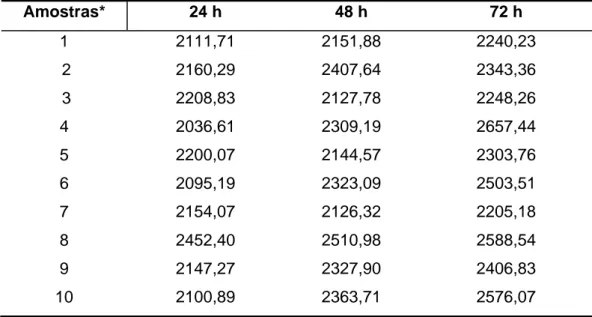
Tabela 3 – Valores médios da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação por endotoxina de E. coli na concentração 10 EU/mL nos diferentes períodos de tempo
Amostras* 24 h 48 h 72 h
1 2111,71 2151,88 2240,23
2 2160,29 2407,64 2343,36
3 2208,83 2127,78 2248,26
4 2036,61 2309,19 2657,44
5 2200,07 2144,57 2303,76
6 2095,19 2323,09 2503,51
7 2154,07 2126,32 2205,18
8 2452,40 2510,98 2588,54
9 2147,27 2327,90 2406,83
10 2100,89 2363,71 2576,07
43
Tabela 4 – Valores médios da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação por endotoxina de E. coli na concentração 20 EU/mL nos diferentes períodos de tempo
Amostras* 24 h 48 h 72 h
1 2092,73 2119,75 2174,51
2 2422,19 2514,55 2542,49
3 2515,32 2577,41 2589,83
4 2392,70 2474,19 2402,79
5 2396,58 2447,03 2561,11
6 1491,69 1527,82 1528,86
7 1621,40 1538,76 1624,82
8 1505,68 1555,76 1564,79
9 1449,82 1484,56 1482,80
10 1607,69 1516,43 1617,01
* grupo ativado com 20 EU/mL de endotoxina.
Após análise estatística, em relação ao tempo, pode-se
verificar que houve aumento significativo da produção de MMP-3 (24, 48 e
72 h), exceto no grupo ativado com endotoxina na concentração 20
EU/mL. Assim, no grupo controle houve aumento significativo da
produção de MMP-3 do tempo 24 ou 48 h para 72 h (p<0,05). No grupo
ativado com 5 EU/mL de endotoxinas, houve aumento significativo na
produção de MMP-3 do tempo de 24 h para os tempos de 48 ou 72 h. No
grupo ativado com 10 EU/mL de endotoxinas, no período de 24 h a
produção de MMP-3 foi significativamente inferior ao período de 72 h
(p<0,05). Já no grupo ativado com 20 EU/mL, os valores da produção de
MMP-3 foram similares em todos os períodos avaliados (p>0,05). As
tabelas 5 a 8 demonstram os valores médios ± desvios-padrão da
produção de MMP-3 em cada grupo, em função do tempo, e a formação
Tabela 5 – Valores médios ± desvio-padrão da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares sem ativação (controle)
Tempo média desvio-padrão Grupos homogêneos
24 154,98 108,21 A
48 342,25 221,70 A
72 753,13 514,30 B
Tabela 6 – Valores médios ± desvio-padrão da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 5 EU/mL
Tempo média desvio-padrão Grupos homogêneos
24 1026,00 193,14 A
48 2018,30 453,77 B
72 2198,90 229,53 B
Tabela 7 – Valores médios ± desvio-padrão da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 10 EU/mL
Tempo média desvio-padrão Grupos homogêneos
24 2166,70 112,78 A
48 2279,30 134,66 A B
72 2407,30 163,99 B
Tabela 8 – Valores médios ± desvio-padrão da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 20 EU/mL
Tempo média desvio-padrão Grupos homogêneos
24 1949,60 452,30 A
48 1975,60 490,33 A
45
Com relação à concentração de endotoxina utilizada na
ativação celular, pode-se verificar que, em relação ao controle, houve
significativo aumento na produção de MMP-3 (p<0,05) após ativação com
diferentes concentrações de endotoxina (5, 10 e 20 EU/mL).
Comparando-se as concentrações de endotoxinas, somente no tempo de
24 h houve diferença significante entre a concentração 5 EU/mL em
relação às concentrações 10 ou 20 EU/mL (p>0,05). Nos períodos de 48 e
72 h, não houve diferença significante entre as concentrações de
endotoxinas utilizadas (p>0,05) na ativação celular. Os valores médios e
desvios-padrão de cada grupo e a formação de grupos homogêneos, nos
tempos 24, 48 e 72 h, estão demonstrados nas tabelas 9 a 11.
Tabela 9 – Valores médios ± desvio-padrão da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 0, 5, 10 e 20 EU/mL nos período de 24 h
Concentrações de
endotoxina (EU/mL) média desvio-padrão Grupos homogêneos
0 (controle) 154,98 108,21 A
5 1026,00 193,14 B
10 2166,70 112,78 C
20 1949,60 452,30 C
Tabela 10 – Valores médios ± desvio-padrão da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 0, 5, 10 e 20 EU/mL nos período de 48 h
Concentrações de
endotoxina (EU/mL) média desvio-padrão Grupos homogêneos
0 (controle) 342,25 221,70 A
5 2018,30 453,77 B
10 2279,30 134,66 B
Tabela 11 – Valores médios ± desvio-padrão da quantidade de MMP-3 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 0, 5, 10 e 20 EU/mL nos período de 72 h
Concentrações de
endotoxina (EU/mL) média desvio-padrão Grupos homogêneos
0 (controle) 753,13 514,30 A
5 2198,90 229,53 B
10 2407,30 163,99 B
20 2008,90 484,80 B
5.2 Produção de MMP-8
Os valores médios da quantidade de MMP-8 (pg/mL)
obtidos nos sobrenadantes das culturas celulares após ativação por
endotoxinas de E. coli nas concentrações 0 (controle), 5, 10 e 20 EU/mL,
em diferentes períodos de tempo (24, 48 e 72 h), estão apresentados nas
47
Tabela 12 – Valores médios da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares sem ativação por endotoxina de E. coli (controle), nos diferentes períodos de tempo
Amostras* 24 h 48 h 72 h
1 1893,36 2295,33 2056,14
2 1490,35 1837,69 1999,26
3 1202,75 1568,78 3503,92
4 908,56 1801,75 3680,98
5 1625,70 1826,04 2617,54
6 1088,51 1847,46 2212,66
7 1325,37 2356,83 4029,48
8 1800,76 2735,03 3926,28
9 1436,96 2494,08 3421,77
10 1264,68 1990,22 3202,14
* grupo controle: sem ativação por endotoxina.
Tabela 13 – Valores médios da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação por endotoxina de E. coli na concentração 5 EU/mL nos diferentes períodos de tempo
Amostras* 24 h 48 h 72 h
1 554,88 797,98 1202,75
2 520,74 981,38 1084,02
3 418,99 1007,29 1068,09
4 754,30 1158,99 984,41
5 710,26 1010,36 1477,66
6 804,86 1313,26 1242,35
7 825,76 921,74 1084,02
8 1334,91 1371,17 1688,79
9 1282,31 1081,07 1693,72
10 1366,14 1445,86 1841,67
Tabela 14 – Valores médios da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação por endotoxina de E. coli na concentração 10 EU/mL nos diferentes períodos de tempo
Amostras* 24 h 48 h 72 h
1 622,91 1490,58 1047,05
2 369,17 1112,95 1171,23
3 907,36 1009,64 1069,04
4 792,59 1148,52 1297,52
5 416,68 1078,48 1048,38
6 691,65 1496,34 1376,12
7 496,07 676,15 582,46
8 867,17 1263,04 1378,82
9 485,77 464,04 513,58
10 953,97 1301,70 548,35
* grupo ativado com 10 EU/mL de endotoxina.
Tabela 15 – Valores médios da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação por endotoxina de E. coli na concentração 20 EU/mL nos diferentes períodos de tempo
Amostras* 24 h 48 h 72 h
1 445,01 568,91 605,20
2 393,78 543,01 543,50
3 380,74 670,54 608,82
4 326,77 594,32 681,01
5 237,82 521,04 704,31
6 177,11 435,92 942,13
7 269,19 294,60 618,68
8 192,80 356,85 593,80
9 208,01 554,41 590,70
10 210,23 844,24 684,32
49
Após análise estatística, em relação ao tempo, pode-se
verificar que houve aumento significativo da produção de MMP-8 (24, 48 e
72 h), independente da concentração de endotoxina utilizada na ativação
celular. Assim, em todas as amostras, incluindo o grupo controle, houve
aumento significativo da produção de MMP-8 do tempo de 24 até 72 h. No
grupo ativado com 5 EU/mL de endotoxinas, houve significativo aumento
da produção de MMP-8 do tempo 24 h para 72 h (p<0,05). Nos grupos
ativados com 10 ou 20 EU/mL, houve aumento significativo da produção
de MMP-8 do tempo 24 h para 48 h (p<0,05) e do tempo 24 para 72 h
(p<0,05), sendo que os períodos de 48 h e 72 h apresentaram valores
semelhantes (p>0,05). As tabelas 16 a 19 demonstram os valores médios
± desvios-padrão da produção de MMP-8 em cada grupo, em função do
tempo, e a formação de grupos homogêneos.
Tabela 16 – Valores médios ± desvio-padrão da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares sem ativação (controle)
Tempo média desvio-padrão Grupos homogêneos
24 1403,70 310,14 A
48 2075,30 372,29 B
72 3065,00 779,64 C
Tabela 17 – Valores médios ± desvio-padrão da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 5 EU/mL
Tempo média desvio-padrão Grupos homogêneos
24 857,31 349,68 A
48 1108,90 209,59 A B
Tabela 18 – Valores médios ± desvio-padrão da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 10 EU/mL
Tempo média desvio-padrão Grupos homogêneos
24 660,33 213,83 A
48 1104,10 328,63 B
72 1003,30 337,80 B
Tabela 19 – Valores médios ± desvio-padrão da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 20 EU/mL
Tempo média desvio-padrão Grupos homogêneos
24 284,15 95,72 A
48 538,38 155,83 B
72 657,25 111,86 B
Com relação à concentração de endotoxina utilizada na
ativação celular, pode-se verificar que, em relação ao controle, houve
significativa redução da produção de MMP-8 após ativação com
endotoxinas nas diferentes concentrações. A produção de MMP-8 nos
grupos ativados com 5 e 10 EU/mL foram semelhantes entre si (p>0,05) e
significativamente inferior ao grupo controle (p<0,05). A produção de
MMP-8 no grupo ativado com 20 EU/mL foi significativamente inferior a de
praticamente todos os grupos avaliados (p<0,05). Os valores médios e
desvios-padrão de cada grupo e a formação de grupos homogêneos, nos
51
Tabela 20 – Valores médios ± desvio-padrão da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 0, 5, 10 e 20 EU/mL nos período de 24 h
Concentrações de
endotoxina (EU/mL) média desvio-padrão Grupos homogêneos
0 (controle) 1403,7 310,14 A
5 857,3 349,68 B
10 660,3 313,83 B
20 284,1 95,72 C
Tabela 21 – Valores médios ± desvio-padrão da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 0, 5, 10 e 20 EU/mL nos período de 48 h
Concentrações de
endotoxina (EU/mL) média desvio-padrão Grupos homogêneos
0 (controle) 2075,3 372,29 A
5 1108,9 209,59 B
10 1104,1 328,63 B
20 538,4 155,83 C
Tabela 22 – Valores médios ± desvio-padrão da quantidade de MMP-8 (pg/mL) obtidos nos sobrenadantes das culturas celulares após ativação com 0, 5, 10 e 20 EU/mL nos período de 72 h
Concentrações de
endotoxina (EU/mL) média desvio-padrão Grupos homogêneos
0 (controle) 3065,0 779,64 A
5 1336,7 312,18 B
10 1003,3 337,80 B C
6.1 Da metodologia
Na presente pesquisa, para verificar os efeitos da endotoxina sobre a produção de metaloproteinases da matriz, foi selecionada a linhagem celular humana U937 (monócitos/macrófagos), pois os macrófagos têm importante papel no início e manutenção do processo inflamatório periapical, incluindo reabsorção óssea (Grenier; Grignon, 2006). Estudos têm demonstrado que endotoxinas (LPS) têm a capacidade de se ligar ao receptor CD14 na superfície de monócitos e macrófagos e induzir a liberação de citocinas envolvidas no processo inflamatório, incluindo metaloproteinases da matriz (MMP) (Hong et al., 2004; Grenier; Grignon, 2006; Lee et al., 2007; Tanabe; Grenier, 2008). A linhagem U937 foi selecionada, pois é muito utilizada em diversos estudos recentes que avaliam os efeitos de LPS em macrófagos, como a produção de diversas citocinas e também de MMP (Maldonado et al., 2004; Grenier; Grignon, 2006; Nareika et al., 2007; Lee et al., 2007; Tanabe; Grenier, 2008).
Como as células da linhagem U937 (monócitos) não são aderentes, foi preciso realizar a diferenciação celular para macrófagos maduros (Hojo et al., 2000; Jiang et al., 2003; Vogel et al., 2005; Grenier; Grignon, 2006; Lee et al., 2007; Tanabe; Grenier, 2008). Para obter esta diferenciação, foram realizados primeiramente dois pilotos: a) as células
foram mantidas em phorbol-12-myristate-13-acetate (PMA) na
53
ng/mL por 48 h para promover aderência celular (Tanabe; Grenier, 2008). Após a realização destes pilotos, um maior número de células aderidas viáveis foram obtidas com a metodologia proposta por Tanabe e Grenier (2008), entretanto, foi também realizado um terceiro piloto, utilizando concentração intermediária de PMA (1 Pg/mL) por 48 h, a qual promoveu um maior número de células viáveis aderidas, sendo este protocolo selecionado para a presente pesquisa.
Foi utilizado o teste de exclusão com azul de tripan (0,5%) para verificar a viabilidade celular, pois este é um método confiável, utilizado por vários autores (Chang et al., 2002; Vogel et al., 2005; Bodet et al., 2006; Bodet et al., 2007; Oliveira et al., 2007). A quantidade de células viáveis distribuídas em cada poço da placa foi padronizada em 1x106 células/mL, quantidade previamente relatada na literatura (Bodet et al., 2006; Lee et al., 2007; Tanabe; Grenier, 2008).
Para promover ativação celular foi utilizada endotoxina purificada de E. coli. Embora esta bactéria não seja comumente
encontrada no interior dos canais radiculares com polpa necrosada, sua endotoxina apresenta a estrutura básica do componente lipídico, que representa o centro ativo responsável pelas propriedades tóxicas do LPS (Yin et al., 2003). Além disso, endotoxina de E. coli é considerada padrão
e é utilizada na maioria dos trabalhos relatados na literatura (Jiang et al., 2004; Maldonado et al., 2004; Oliveira et al., 2005; Oliveira et al., 2007; Jiang et al., 2006; Lee et al., 2007; Nareika et al., 2007).
Tendo em vista que MMP-3 (Shin et al., 2002; Pita et al., 2009) e MMP-8 (Wahlgren et al., 2002; Sulkala et al., 2007) estão relacionadas com inflamação pulpar e periapical, no atual estudo, foram selecionados estas MMP (estromelisina: MMP-3 e colagenase: MMP-8) para verificar se a endotoxina apresenta capacidade de induzir a produção destas MMP na mesma linhagem celular.
Com relação às diferentes concentrações de endotoxinas utilizadas para ativação celular, foram padronizadas as concentrações de 5, 10 e 20 EU/mL, baseado no estudo de Hong et al. (2004), que utilizaram as concentrações de 1, 5 e 10 EU/mL de LPS por 24 h para verificar a expressão gênica de MMP-1 em macrófagos (linhagem J 774, camundongo). No presente estudo, foi acrescentada a concentração de 20 EU/mL para verificar se esta concentração promoveria maior ativação celular, sem causar efeitos citotóxicos (morte celular). A ativação por diferentes concentrações de endotoxinas é importante para verificar se a produção de MMP é dependente da dose de endotoxina ou apenas da sua presença (dose-independente).
Com relação ao tempo de ativação celular, foram avaliados na presente pesquisa três diferentes períodos de tempo: 24, 48 e 72 h. A maioria dos estudos que avaliam os diferentes efeitos de LPS em cultura de macrófagos, incluindo produção de citocinas e MMP, avaliam apenas no período de 24 h (Hong et al., 2004; Maldonado et al., 2004; Bodet et al., 2006; Grenier; Grignon, 2006; Nareika et al., 2007; Tanabe; Grenier, 2008). Em 2007, Bodet et al. avaliaram, em fibroblastos, os efeitos de LPS na produção de diferentes MMP e seus inibidores após estimulação por 6, 24 e 48 h. Assim, tornou-se interessante também verificar, em macrófagos, se a produção de MMP aumenta de acordo com o aumento do período de ativação.
A detecção de MMP na presente pesquisa foi realizada pelo ensaio imunoenzimático ELISA utilizando Kits específicos (R & D
55
humana, ou seja, conseguem detectar MMP-3 ativa somada a forma pró-MMP-3 ou MMP-8 ativa somada a forma pró-MMP-8. Estes kits foram
selecionados pois são os mais utilizados na literatura (Figueredo et al., 2003; Maldonado et al., 2004; Bodet et al., 2006; Grenier; Grignon, 2006; Nareika et al., 2007; Sundararaj et al., 2008; Tanabe; Grenier, 2008).
6.2 Dos resultados
Com relação aos resultados obtidos da produção das MMP em função do tempo, pode-se verificar que houve aumento significativo da produção de MMP-3 e MMP-8 em função do aumento de tempo, exceto no grupo MMP-3 ativado por 20 EU/mL, em que o aumento da produção de MMP-3 não foi significativo em relação ao tempo. Na maioria das amostras, incluindo o grupo controle (sem ativação por endotoxina), houve aumento da produção de MMP-3 e MMP-8 à medida que o tempo aumentou, de 24 até 72 h. Estes resultados concordaram com os estudos de Chang et al. (2002) e Bodet et al. (2007). Chang et al. (2002) verificaram que a produção de MMP-2, em fibroblastos do ligamento periodontal humano, aumentou significativamente de acordo com o tempo, sendo que para esta linhagem celular, o nível de MMP-2 começou a aumentar no 4º dia. Bodet et al. (2007) também demonstraram que a produção de MMP-2 e MMP-3 em fibroblastos aumentou em função do tempo tanto nas amostras do grupo controle (sem ativação) como nas ativadas por LPS.
os resultados da presente pesquisa, as células mesmo sem ativação por endotoxinas produziram MMP-3 e MMP-8. Isto pode ser atribuído à expressão gênica destas MMP nesta linhagem celular, pois a expressão da maioria das MMP é induzida, em pequeno número, a um nível constante (Palosaari et al., 2003).
Além disso, o tratamento com PMA pode ter induzido a liberação de MMP-3 e MMP-8 no grupo controle. Bodet et al. (2007) ativaram cultura de fibroblastos com LPS ou PMA por 6, 24 e 48 h e verificaram que no caso de MMP-2, a utilização de PMA não induziu aumento da produção de MMP-2 em relação ao controle (sem ativação), já com relação à MMP-3, a utilização de PMA promoveu produção de MMP-3 superior ao grupo controle. Grenier e Grignon (2006) e Tanabe e Grenier (2008) realizaram o tratamento da linhagem celular (U937) com
phorbol-12-myristate-13-acetate (PMA) e demonstraram que os
macrófagos diferenciados por este tratamento produziram MMP-9 na ausência de LPS (grupo controle). Este resultado corrobora com o presente estudo, no qual houve produção de MMP-8 também no grupo controle, mas diverge quanto à redução da produção de MMP-8 observada após ativação de LPS.
Esta significativa redução da produção de MMP-8, em relação ao controle, após ativação com diferentes concentrações de endotoxinas, também difere de Sundararaj et al. (2008) que, semelhante ao presente estudo, avaliaram a produção de MMP-8 por monócitos (U937) e, utilizando reação ELISA (Kits R & D) encontraram aumento
significativo, em relação ao grupo controle, da produção desta MMP após ativação com 100 ng/mL de LPS por 24 h.
57
Esta diferenciação celular utilizada na presente pesquisa e em diversos trabalhos (Hojo et al., 2000; Jiang et al., 2003; Vogel et al., 2005; Grenier; Grignon, 2006; Lee et al., 2007; Tanabe; Grenier, 2008) leva a alterações permanentes dos parâmetros celulares como na morfologia, na função, no metabolismo e no crescimento celular (Dini et al., 2009). Além disso, é alterada também a propriedade dos monócitos humanos em metabolizar ácido araquidônico e liberar prostaglandina após estimulação. Os macrófagos derivados de monócitos passam a ser mais responsivos ao LPS e, portanto, passam a liberar maior quantidade de PGE2, segundo Jiang et al. (2003). Estes autores compararam a produção de fosfofolipase A2 citosólica (cPLA2), cicloxigenase 1 e 2 (COX-1 e 2), ácido araquidônico e PGE2 entre monócitos (U937) ativados com LPS e PMA e macrófagos diferenciados de monócitos (U937) com uso de PMA, também ativados com LPS e PMA. Os macrófagos ativados com LPS apresentaram maior produção de ácido araquidônico e PGE2 do que os monócitos ativados com LPS. Os monócitos só produziram uma quantidade significativa de ácido araquidônico e PGE2 quando ativados por PMA, além disso, ao contrário dos macrófagos que expressaram COX-1 e COX-2, os monócitos expressaram somente COX-1.
na produção de TIMP e MMP podem variar de acordo com o tipo de célula estudada (Takahashi et al., 1997).
Takahashi et al. (1997), utilizando fibroblastos da sinóvia de pacientes com artrite reumatóide, observaram que a produção de pro-MMP-1 foi aumentada com a utilização de inibidores da cicloxigenase, mas, por outro lado, foi suprimida na presença de PGE2 exógena. Lin et al. (2001) também relataram que a expressão gênica de MMP-1 induzida em fibroblastos da polpa dental é, em parte, mediada por uma via dependente de PGE2. O uso concomitante de PGE2 e IL-1 ou TNF- suprimiu a indução de MMP-1 em comparação ao efeito destas citocinas utilizadas isoladamente. Por outro lado, Lin et al. (2002) demonstraram, em modelos experimentais de lesão periapical em ratos, o envolvimento MMP-1 e COX-2 no desenvolvimento da lesão. Os autores observaram uma redução característica na expressão de MMP-1 após uso de inibidores da COX-2, sugerindo a importância da COX-2 na modulação de MMP-1. Tendo em vista que há uma grande divergência quanto à relação entre MMP e PGE2 e/ou cicloxigenases, Shin et al. (2002) relatam que são necessários novos estudos sobre o papel das prostaglandinas na produção de MMP por macrófagos.
A maioria dos trabalhos encontrados na literatura envolvendo MMP-8, refere-se à quantificação desta MMP dos tecidos dentários humanos (Tjäderhane et al., 1998; Wahlgren et al., 2002; Palossari et al., 2003; Sulkala et al., 2007; Santos et al., 2009) e não de culturas de células (estudo in vitro), o que dificultou a comparação dos
resultados da presente pesquisa com as demais.