Mariele Iara Soares de Mello
Dessulfurização oxidativa em diesel utilizando catalisadores
à base de Vanádio ou Manganês
_______________________________________
Dissertação de Mestrado
Natal/RN, julho de 2012
INSTITUTO DE QUÍMICA
DESSULFURIZAÇÃO OXIDATIVA EM DIESEL UTILIZANDO CATALISADORES
À BASE DE VANÁDIO OU MANGANÊS
Dissertação apresentada ao Programa de Pós-Graduação em Química da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para obtenção do título de Mestre em Química.
Orientadora: Dra. Sibele B. C. Pergher
Co-orientador: Dr. Eledir V. Sobrinho
NATAL, RN
Catalogação da Publicação na Fonte. Bibliotecário / Edmilson Eugênio
Mello, Mariele Iara Soares de.
Dessulfurização oxidativa em diesel utilizando catalisadores à base de vanádio ou manganês / Mariele Iara Soares de Mello. – Natal, RN, 2012.
155 f. : il.
Orientadora: Sibele B. C. Pergher. Co-orientador: Eledir V. Sobrinho.
Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Ciências Exatas e da Terra. Programa de Pós-Graduação em Química.
1. Dessulfurização Oxidativa – Dissertação. 2. Vanádio – Dissertação. 3. Manganês – Dissertação. 4. Peróxido de hidrogênio – Dissertação. 5. Oxidação – Dissertação. 6. Extração – Dissertação. I. Pergher, Sibele B. C. II. Universidade Federal do Rio Grande do Norte. III. Título.
À minha família, por tornar tudo possível;
AGRADECIMENTOS
Deixo aqui um breve, mas sincero, lembrete:
“Meu enorme carinho, gratidão, respeito e admiração, a todos que me apoiaram quando decidi seguir a carreira acadêmica e vir tão longe. Incentivaram-me quando muitos não me deram crédito, e apostaram em mim enquanto outros me disseram para deixar assim... aos meus familiares pelo apoio emocional e financeiro.
A minha orientadora, Sibele B. C. Pergher, pela boa vontade de me aceitar como orientanda, e atenção no decorrer do trabalho; pelo companheirismo nos momentos de trabalho e descontração, por todo apoio e tempo disponível, que a mim rendeu uma grande amizade.
Ao meu co-orientador Eledir V. Sobrinho, pela amizade, por seu auxílio e conhecimento durante a realização desta pesquisa.
Aos amigos e colegas de laboratório do LABPEMOL e demais laboratórios, aos demais professores que não somam em quantidade, mas fizeram a diferença com suas particularidades durante o mestrado para o meu crescimento pessoal e profissional; que foram presentes nos momentos difíceis, nas horas de lazer e na elaboração deste trabalho.
Ao Programa de Pós-Graduação em Química, e ao Instituto de Química, pela oportunidade.
Ao Conselho Nacional de Desenvolvimento Científico e
"A mente que se abre a uma nova ideia jamais volta ao seu tamanho original"
RESUMO
O processo de Dessulfurização Oxidativa (ODS) de um diesel comercial foi realizado em condições suaves na presença de catalisadores à base de vanádio ou manganês, suportados em aluminas, argilas (comerciais, naturais e pilarizadas) e zeólitas (NaX, NaY, beta, mordenita, ZSM-5). Os catalisadores foram sintetizados via impregnação úmida e caracterizados por difração de raios-X, análise textural por adsorção e dessorção de nitrogênio e microscopia eletrônica de varredura. O dibenzotiofeno (DBT) foi utilizado como o composto de enxofre nos testes catalíticos. As reações foram realizadas usando como solvente acetonitrila e como oxidante o peróxido de hidrogênio a temperatura de 55°C. Os produtos de reação foram analisados por cromatografia gasosa (CG-FID). Nas condições estudadas o processo mostrou-se eficiente, o DBT foi convertido para sua respectiva sulfona. Ambos DBT e a sulfona foram extraídos pelo solvente. Remoções e oxidações de 100% do composto de enxofre foram alcançadas. Os catalisadores suportados na zeólita ZSM-5 mostraram-se mais efetivos para a reação de oxidação do composto sulfurado, apresentando os melhores resultados. Observa-se para a reação de oxidação que os catalisadores de vanádio foram mais efetivos, e os catalisadores de manganês apresentaram melhores resultados na extração dos compostos sulfurados.
ABSTRACT
The oxidative desulfurization process (ODS) of a commercial diesel fuel was performed under mild conditions in the presence of catalysts based on vanadium or manganese, supported on alumina, clays (commercial, natural and pillared) and zeolites (NaX, NaY, beta, mordenite and ZSM-5). The catalysts were synthesized by wet impregnation and characterized by X-ray diffraction, textural analysis by N2 adsorption and scanning electron
microscopy. The dibenzothiophene (DBT) was used as sulfur compound in catalytic evaluation. The reactions were performed using acetonitrile as solvent and the hydrogen peroxide as oxidant at 55°C. The reaction products were analized by gas chromatography (GC-FID). In the studied conditions, the process was efficient due to the DBT was converted to its corresponding sulfone. Both DBT and corresponding sulfone were extracted by the solvent. Removals and oxidations up to 100% of sulfur compound were achieved. The catalysts supported on ZSM-5 zeolite showed are more effective for oxidation reaction of sulfur compound, presenting the best results. It was observed for oxidation reaction, that vanadium catalysts were more effective and manganese catalysts showed best results for removal of sulfur compounds.
LISTA DE FIGURAS
Figura 3.1: Esquema de uma torre de destilação... 22
Figura 3.2: Esquema simplificado de uma refinaria... 23
Figura 3.3: Processo de formação da chuva ácida... 31
Figura 3.4: Compostos de enxofre presentes nos combustíveis... 32
Figura 3.5: Caminhos para o HDS de DBT em 300°C e 102 atm na presença de CoMo/Al2O3... 34
Figura 3.6: Exemplo de dessulfurização oxidativa: a) oxidação/extração, b) fluxograma da reação bifásica simultânea oxidação/extração numa unidade de ODS... 39
Figura 3.7: Efeito do catalisador na reação... 45
Figura 3.8: Processo do método de impregnação... 47
Figura 3.9: Ilustração do processo de produção da alumina... 50
Figura 3.10: Estrutura da α-alumina... 50
Figura 3.11: Transformações de aluminas hidratadas em alumina... 51
Figura 3.12: Unidades estruturais dos argilominerais... 54
Figura 3.13: Estrutura da esmectita... 55
Figura 3.14: Esquema do processo de pilarização... 57
Figura 3.15: Esquema de uma argila 2:1 expansível pilarizada... 58
Figura 3.16: Representação dos tetraedros de alumínio e silício presentes nas zeólitas... 60
Figura 3.17: Esquema de uma síntese hidrotermal... 63
Figura 3.18: Unidades de construção secundária... 64
Figura 3.19: Unidades poliédricas, caixas e cavidades... 65
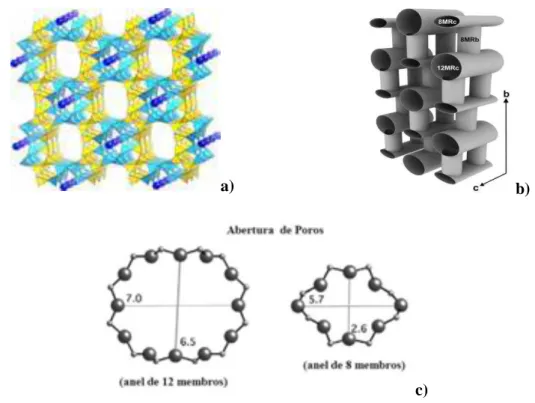
Figura 3.21: Estrutura da FAU, sistema de canais e sítios ativos... 66
Figura 3.22: Estrutura da mordenita, a) poliedros de silício (tetraedros em amarelo) e de alumínio (tetraedros em azul), b) sistemas de canais e c) abertura de poros... 67
Figura 3.23: Polimorfos formadores da estrutura da zeólita beta... 68
Figura 3.24: Sistema de canais da ZSM-5... 69
Figura 3.25: Estruturas formadoras da zeólita ZSM-5... 69
Figura 4.1: Foto do cromatógrafo Varian CP-3800... 76
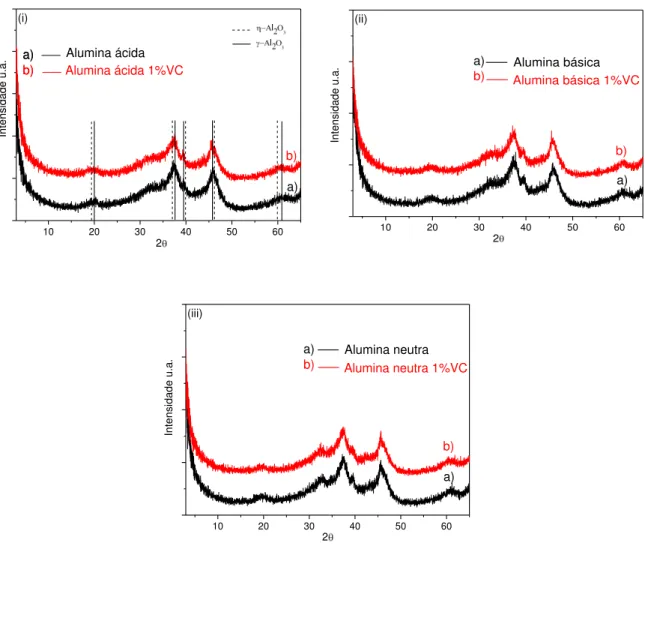
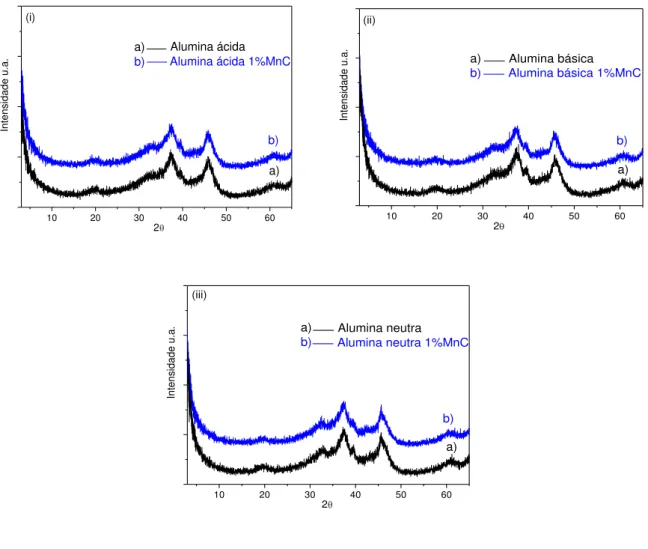
Figura 5.1: Difratograma de raios-X das aluminas antes e após a impregnação com vanádio: (i) ácida; (ii) básica e (iii) neutra... 79
Figura 5.2: Difratograma de raios-X das aluminas antes e após a impregnação com manganês: (i) ácida; (ii) básica e (iii) neutra... 80
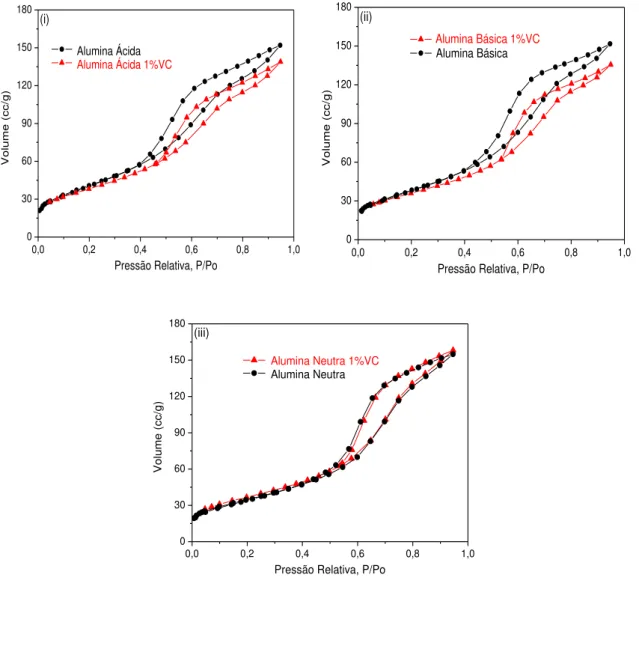
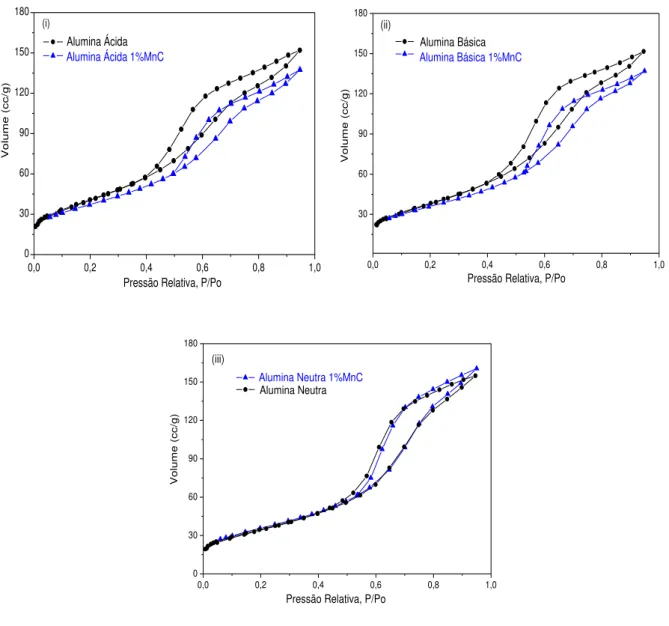
Figura 5.3: Isotermas de adsorção de N2 das aluminas antes e após a impregnação com vanádio: (i) ácida; (ii) básica e (iii) neutra... 82
Figura 5.4: Isotermas de adsorção de N2 das argilas antes e após a impregnação com manganês: (i) ácida; (ii) básica e (iii) neutra... 83
Figura 5.5: Microscopia eletrônica de varredura da alumina: ácida (a) suporte e (b) 1%V; básica (c) suporte e (d) 1%V e neutra (e) suporte e (f) 1%V, com ampliação de 500x... 84
Figura 5.6: Microscopia eletrônica de varredura da alumina: ácida (a) suporte e (b) 1%Mn; básica (c) suporte e (d) 1%Mn e neutra (e) suporte e (f) 1%Mn, com ampliação de 500x... 85
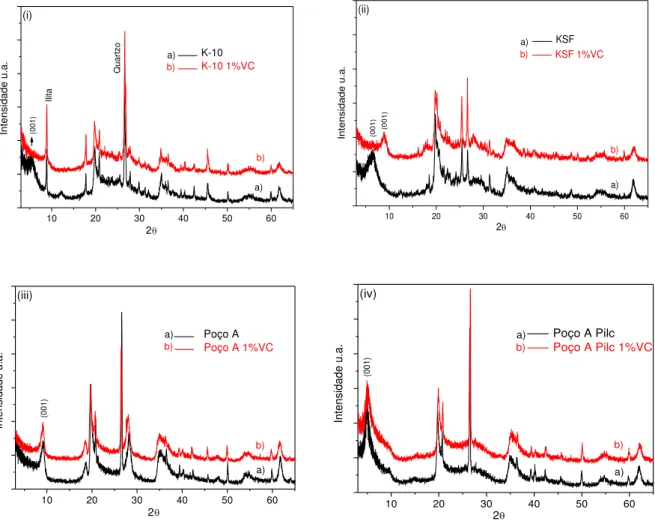
Figura 5.7: Difratograma de raios-X das argilas antes e após a impregnação com vanádio: i) K-10; (ii) KSF; (iii) Poço A e (iv) Poço A PILC... 87
Figura 5.9: Isotermas de adsorção de N2 das argilas antes e após a
impregnação com vanádio: (i) K-10; (ii) KSF; (iii) Poço A e
(iv) Poço A PILC... 90
Figura 5.10: Isotermas de adsorção de N2 das argilas antes e após a
impregnação com manganês: (i) K-10; (ii) KSF; (iii) Poço A e
(iv) Poço A PILC... 91
Figura 5.11: Microscopia eletrônica de varredura da argila com vanádio: KSF (a) suporte e (b) 1%V; K-10 (c) suporte e (d) 1%V; Poço A (e) suporte e (f) 1%V e Poço A PILC (g) suporte e (h) 1%V
com ampliação de 10.000x... 92
Figura 5.12: Microscopia eletrônica de varredura da argila com manganês: KSF (a) suporte e (b) 1%Mn; K-10 (c) suporte e (d) 1%Mn; Poço A (e) suporte e (f) 1%Mn e Poço A PILC (g) suporte e (h) 1%Mn com ampliação de 10.000x... 93
Figura 5.13: Difratogramas de raios-X das zeólitas antes e após a impregnação com vanádio: (i) ZSM-5 3020; (ii) ZSM-5 5020; (iii) ZSM-5 8020; (iv) beta; (v) mordenita; (vi) NaX e (vii) NaY... 94
Figura 5.14: Difratogramas de raios-X das zeólitas antes e após a impregnação com manganês: (i) ZSM-5 3020; (ii) ZSM-5 5020; (iii) ZSM-5-8020; (iv) beta; (v) mordenita;
(vi) NaX e (vii) NaY... 96
Figura 5.15: Isotermas de adsorção de N2 das zeólitas antes e após a
impregnação com vanádio: (i) ZSM-5 3020; (ii) ZSM-5 5020; (iii) ZSM-58020; (iv) beta; (v) mordenita; (vi) NaX e (vii) NaY... 98
Figura 5.16: Isotermas de adsorção de N2 das zeólitas antes e após a
impregnação com manganês: (i) ZSM-5 3020; (ii) ZSM-5 5020; (iii) ZSM-5 8020; (iv) beta; (v) mordenita; (vi) NaX e (vii) NaY... 99
Figura 5.17: Microscopia eletrônica de varredura das zeólitas: ZSM-5 3020 (a) suporte e (b) 1%V; ZSM-5 5020 (c) suporte e (d) 1%V e ZSM-5 8020 (e) suporte e (f) 1%V, com ampliação de
10.000x... 103
Figura 5.18: Microscopia eletrônica de varredura das zeólitas: NaX (a) suporte e (b) 1%V; NaY (c) suporte e (d) 1%V; Beta (e) suporte e (f) 1%V; Mordenita (g) suporte e (h) 1%V, com ampliação de
Figura 5.19: Microscopia eletrônica de varredura das zeólitas: ZSM-5 3020 (a) suporte e (b) 1%Mn; ZSM-5 5020 (c) suporte e (d) 1%Mn e ZSM-5 8020 (e) suporte e (f) 1%Mn, com ampliação de
10.000x... 105
Figura 5.20: Microscopia eletrônica de varredura das zeólitas: NaX (a) suporte e (b) 1%Mn; NaY (c) suporte e (d) 1%Mn; Beta (e) suporte e (f) 1%Mn; Mordenita (g) suporte e (h) 1%Mn,
com ampliação de 15.000x... 106
Figura 5.21: Cromatograma com o resultado da reação de diesel com
acetonitrila: a) fase acetonitrila, b) diesel... 108
Figura 5.22: Cromatograma com o resultado da reação com hexadecano: a) hexadecano com 1000 ppm de DBT; b) fase hexadecano; c) fase do solvente... 109
Figura 5.23: Cromatograma com o resultado da reação do diesel +
acetonitrila + H2O2... 111
Figura 5.24: Resultados da extração e da oxidação dos testes catalíticos: a) aluminas; b) argilas e c) zeólitas... 113
Figura 5.25: Área dos catalisadores versus quantidade de DBTO2:
a) aluminas; b) argilas e c) zeólitas... 115
Figura 5.26: Resultado das reações com a argila KSF com diferentes teores
LISTA DE TABELAS
Tabela 3.1: Grupos de hidrocarbonetos presentes no petróleo... 20
Tabela 3.2: Demais compostos presentes no petróleo... 20
Tabela 3.3: Frações típicas do petróleo... 22
Tabela 3.4: Processos de refino... 25
Tabela 3.5: Catalisadores empregados no processo de hidrodessulfurização... 34
Tabela 3.6: Exemplos de oxidantes e solventes ou adsorventes empregados nas reações de dessulfurização... 41
Tabela 3.7: Características das zeólitas... 60
Tabela 3.8: Classificação das zeólitas em relação ao tamanho dos poros... 61
Tabela 4.1: Reagentes utilizados para os experimentos... 71
Tabela 5.1: Área específica e volume de poros das aluminas puras e impregnadas com vanádio e manganês, calculados a partir dos dados de adsorção... 81
Tabela 5.2: Área específica e volume poros das argilas puras e impregnadas com vanádio e manganês, calculados a partir dos dados de adsorção... 89
Tabela 5.3: Área específica e volume de poros das zeólitas puras e impregnadas com vanádio e manganês, calculados a partir dos dados de adsorção... 101
LISTA DE SIGLAS
12MR Anéis de 12 membros 4-MDBT 4-metildibenzotiofeno 8MR Anéis de oito membros ANP Agência Nacional de Petróleo
ASTM American Society for Testing Materials
B.E.T. Método para calcular área específica (Brunauer, Emmett e Teller)
BT Benzotiofeno
C16 Hexadecano
DBT Dibenzotiofeno
DDS Dessulfurização por hidrogenólise (do inglês: hydrogenolysis)
DEA Di-etanol-amina
DNPM Departamento Nacional de Produção Mineral
DRX Difração de Raios-X
HDS Hidrodessulfurização (do inglês: hydrodesulfurization)
HYD Dessulfurização por hidrogenação (do inglês: hydrogenation desulfurization)
MEA Monoetanolamina
MTO Metiltrioxorênio (do inglês: methyltrioxorhenium)
ODS Dessulfurização oxidativa (do inglês: Oxidative desulfurization)
OTAB Brometo de octadeciltrimetilamônio (do inglês:
octadecyltrimethylammonium bromide)
TBHP Tert-Butil hidroperóxido (do inglês: t-butyl hydroperoxide)
TBAB Bissulfato de tetrabutilamônio (do inglês: tetrabutyl ammonium bisulfate)
S
UMÁRIO1–INTRODUÇÃO ... 16
2–OBJETIVOS ... 18
2.1–OBJETIVO GERAL ... 18
2.2–OBJETIVOS ESPECÍFICOS ... 18
3–REFERENCIALTEÓRICO ... 19
3.1–PETRÓLEO ... 19
3.1.1 – Refino do Petróleo e Processos ... 23
3.1.2– Diesel ... 27
3.2–PROBLEMAS AMBIENTAIS RELACIONADOS AO ENXOFRE ... 30
3.3–DESSULFURIZAÇÃO ... 31
3.3.1–HIDROTRATAMENTO (HDT) ... 32
3.3.2–DESSULFURIZAÇÃO POR ADSORÇÃO... 36
3.3.3–BIODESSULFURIZAÇÃO ... 37
3.3.4–DESSULFURIZAÇÃO OXIDATIVA (ODS) ... 38
3.4–CATÁLISE E CATALISADORES ... 45
3.5–SUPORTE DOS CATALISADORES... 47
3.5.1–ALUMINA ... 48
3.5.2–ARGILA ... 51
3.5.3–ZEÓLITA ... 59
4–MATERIAISEMÉTODOS ... 71
4.1–REAGENTES E SOLVENTES ... 71
4.2–SÍNTESES DOS CATALISADORES ... 72
4.2.1–SUPORTES UTILIZADOS... 72
4.2.2–IMPREGNAÇÃO DO VANÁDIO E MANGANÊS NOS SUPORTES ... 72
4.3.1–DIFRAÇÃO DE RAIOS-X(DRX) ... 73
4.3.2–ANÁLISE TEXTURAL POR ADSORÇÃO DE NITROGÊNIO ... 74
4.3.3–MICROSCOPIA ELETRÔNICA DE VARREDURA (MEV) ... 75
4.4–TESTES CATALÍTICOS DE OXIDAÇÃO ... 75
4.4.1–ANÁLISE DOS TESTES CATALÍTICOS ... 76
5–RESULTADOSEDISCUSSÃO ... 78
5.1–CATALISADORES IMPREGNADOS COM VANÁDIO E MANGANÊS ... 78
5.1.1–ALUMINAS ... 78
5.1.2–ARGILAS ... 86
5.1.3–ZEÓLITAS ... 94
5.2–TESTES CATALÍTICOS DE OXIDAÇÃO ... 107
5.2.1–TESTES PRELIMINARES ... 107
5.2.2–TRIAGEM DOS CATALISADORES ... 112
6–CONCLUSÃO ... 119
REFERÊNCIAS ... 120
1–INTRODUÇÃO
O petróleo possui uma importância fundamental em nossa sociedade, com uma composição complexa na qual se destacam os hidrocarbonetos e outros compostos orgânicos contendo átomos de oxigênio, nitrogênio ou enxofre na sua estrutura. Sendo uma fonte de energia e seus derivados são matéria-prima para vários bens de consumo, mas durante o processo de combustão os heteroátomos presentes nas cadeias carbônicas dão origem a perigosos poluentes atmosféricos como os óxidos de nitrogênio (NOx) e óxidos de enxofre (SOx) e por combustão incompleta ocorre a geração de monóxido de carbono (CO). Estes se destacam por possuírem difícil degradabilidade (KROPP; ANDERSON; FEDORAK, 1997; MARIANO, 2005).
O dióxido de enxofre, resultante da reação do enxofre com o oxigênio durante a queima dos combustíveis, é um dos principais poluentes do ar. Quando combinado com a umidade da atmosfera causam as chuvas ácidas, e nas frações de petróleo é altamente indesejável uma vez que resulta na corrosão dos equipamentos. Desta forma nos últimos anos, os problemas ambientais têm recebido atenção de pesquisadores do mundo inteiro.
A remoção de enxofre dos hidrocarbonetos é um grande problema para as refinarias. Um dos processos mais tradicionais de remoção de compostos organossulfurados das frações do petróleo são realizados por hidrotratamentos, como a hidrodessulfurização que utiliza elevadas temperaturas e pressões e consome uma grande quantidade de hidrogênio, necessitando de muitos investimentos. Devido às condições de operação do processo serem drásticas, novas tecnologias com a finalidade de dessulfurização têm sido estudadas.
2–OBJETIVOS
2.1–OBJETIVO GERAL
O objetivo geral da presente dissertaçãoéreduzir os compostos sulfurados em cargas de diesel por dessulfurização oxidativa, utilizando diferentes suportes impregnados com vanádio ou manganês.
2.2–OBJETIVOS ESPECÍFICOS
Os objetivos específicos da dissertação foram:
- Sintetizar os catalisadores a base de vanádio (V) e Manganês (Mn) empregando diferentes suportes, tais como: aluminas, argilas e zeólitas.
-Avaliar a efetividade da incorporação de V e Mn nos materiais preparados empregando diferentes técnicas de caracterização.
3–REFERENCIALTEÓRICO
Neste capítulo será apresentado um estudo bibliográfico referente ao diesel e sua problemática ambiental, alguns processos de dessulfurização, assim como os catalisadores utilizados para os processos.
3.1–PETRÓLEO
Segundo DNPM (Departamento Nacional de Produção Mineral), denomina-se petróleo como sendo uma substância oleosa, menos densa que a água e inflamável, seu uso comercial teve início em 1859, pela produção de um poço de 21 metros de profundidade. Consiste de uma mistura de hidrocarbonetos, incluindo os tipos saturados (parafínicos e naftênicos) e os aromáticos, Tabela 3.1. Em menor quantidade estão presentes os compostos inorgânicos como sulfurados (responsáveis pela corrosividade dos produtos), oxigenados (contribuem para a acidez das frações), nitrogenados (piridinas, quinolinas, pirróis), resinas e asfaltenos, bem como metais: ferro, zinco, cobre, etc., com teor variando de 1 a 1.200 ppm, conforme apresentado na Tabela 3.2.
A quantidade dos tipos de hidrocarbonetos varia de petróleo para petróleo, diferenciando assim suas propriedades físico-químicas. Dependendo desta composição o petróleo se mostra mais adequado para a produção de um ou outro derivado (SZKLO; ULLER, 2008).
Tabela 3.1: Grupos de hidrocarbonetos presentes no petróleo
Hidrocarbonetos parafínicos normais (alcanos) Formula geral CNH2N+2.
Exemplos: CH4 (metano), C2H6 (etano), C4H10 (butano). Hidrocarbonetos parafínicos ramificados (isoalcanos)
Apresentam ramificações em um ou mais átomos de carbono e são também denominados de isoparafinas. Tem a mesma fórmula geral dos alcanos normais. Exemplos: isobuteno e isopentano.
Hidrocarbonetos parafínicos cíclicos (naftênicos)
Os átomos de carbono dispõem-se na forma de anéis, podendo apresentar radicais parafínicos normais ou ramificados ligados ao anel ou, mesmo, outro hidrocarboneto cíclico. Os hidrocarbonetos naftênicos têm menos ligações carbono-hidrogênio do que do que os parafínicos. Exemplos: ciclopropano e ciclohexano.
Hidrocarbonetos aromáticos
São constituídos por ligações duplas e simples que se alteram em anéis com seis átomos de carbono. O composto mais simples é o benzeno, que é mais estável do que os hidrocarbonetos insaturados (olefinas, por exemplo). Tal como ocorre como os naftênicos, existem hidrocarbonetos formados por mais de um anel benzênico, e hidrocarbonetos mistos, compostos de anéis benzênicos e radicais parafínicos ou naftênicos.
Exemplos: benzeno, tolueno, xilenos, naftaleno, etc.
Fonte: Szklo; Uller (2008)
Tabela 3.2: Demais compostos presentes no petróleo
Tipos de Compostos Teor
Sulfurados 0,1 a 5 % como enxofre
Nitrogenados 0,05 a 15 % em volume
Oxigenados (não ácidos como resinas, cresóis etc.) 0 a 2 % como oxigênio
Oxigenados (ácidos naftênicos) 0,3 a 0,4 % em volume
Organometálicos (ferro, níquel, cobre, vanádio arsênio
etc.) até 400 ppm como metal
As propriedades e as principais características que influenciam o valor do petróleo bruto e o processo de refino são o teor de enxofre e o grau API (escala idealizada pelo American Petroleum Institute - API, juntamente com a National Bureau of Standards é
utilizada para medir a densidade relativa do petróleo, medindo a qualidade do petróleo). Embora teores de nitrogênio e metais estejam crescendo em importância, principalmente no petróleo brasileiro que apresenta altas quantidades de compostos nitrogenados. O teor de enxofre varia de menos de 0,1% a mais de 5%, sendo expresso como porcentagem de enxofre em massa. Quanto maior o teor de enxofre no petróleo mais extenso será o processamento em relação aos de menores teores. Óleos brutos com alto teor de enxofre denominam-se ácido (sour) e para teores baixos denominam-se doce (sweet). Os óleos chamados de doce normalmente possuem 0,5% de conteúdo de enxofre ou menos, e ácido 1,5% ou mais (LEFFLER, 2000; GARY; HANDWERK, 2001; MARTÍNEZ, 1999).
Figura 3.1: Esquema de uma torre de destilação.
Fonte: Marquardt Scherer(2012)
Tabela 3.3: Frações típicas do petróleo
Fonte: Adaptado publicações do site do Departamento Nacional de Produção Mineral
A remoção de enxofre dos hidrocarbonetos é um grande problema para as refinarias, pois não se encontra na sua forma elementar, mas geralmente em compostos de enxofre. Normalmente está ligado quimicamente a algumas das moléculas de hidrocarbonetos, de maneira a ser dificilmente separado dos compostos de carbono puro, até que ele seja queimado, causando assim mau cheiro ou vários compostos ambientalmente indesejáveis de enxofre/enxofre-oxigênio (LEFFLER, 2000).
Fração Temp. de
ebulição °C
Composição
aproximada Usos
Gás residual
Gás liquefeito de petróleo
Gasolina Querose Gasóleo leve Gasóleo pesado Lubrificantes Resíduo --- Até 40 40-175 175-235 235-305 305-400 400-510 Acima 510
C1-C2
C3-C4
C5-C10
C11-C12
C13-C17
C18-C25
C26-C38
C38+
Gás combustível
Gás comb. engarrafado, uso doméstico e ind.
Combustível de automóveis, solvente
Iluminação, combustível de aviões a jato
Diesel, fornos
Combustível, matéria-prima para lubrificantes
Óleos lubrificantes
3.1.1–REFINO DO PETRÓLEO E PROCESSOS
O petróleo bruto agrega pouco valor comercial, sendo necessária a etapa de refino do petróleo com a separação de seus produtos, esta fase é considerada como o coração da indústria petrolífera. Através dos processos físico-químicos ocorre o refino, ou seja, a separação dos produtos em frações de derivados, sendo estas frações processadas pelas passos de separação e conversão, fornecendo os produtos finais (Figura 3.2).
Figura 3.2: Esquema simplificado de uma refinaria.
Fonte: Adaptado de Júnior (2012)
O objetivo principal do refino é obter o máximo possível de derivados de alto valor comercial, com menores custos, ótima qualidade e geração mínima de produtos de baixo peso molecular. A refinaria é projetada para dois objetivos básicos: produção de produtos energéticos (combustíveis), produtos não-energéticos e petroquímicos (maximização de frações básicas como lubrificantes, nafta e parafinas) (MARIANO, 2005; SZKLO; ULLER, 2008).
Os processos de separação tem por finalidade a separação do petróleo cru em diferentes frações, são processos de natureza física por ação de energia (temperatura e pressão). Já os processos de conversão são de natureza química e pretendem modificar as frações, aumentando sua qualidade, nestes processos podem ser usados catalisadores, temperatura e pressão. Nos processos de tratamento, o objetivo é a remoção das impurezas para melhorar a qualidade e a estabilidade química das frações. E por fim os processos auxiliares tratam dos rejeitos dos processos acima citados (PETROBRAS, 2002).
O petróleo bruto é submetido à destilação para o desmembramento do petróleo em suas frações básicas de refino, tais como gás combustível, GLP, nafta, querosene, gasóleo atmosférico (óleo diesel), gasóleo de vácuo e resíduo de vácuo (Figura 3.2). Seus rendimentos são variáveis, em função do óleo processado. Normalmente as refinarias contam com duas unidades de processo para efetuar a destilação do petróleo: Destilação Atmosférica e Destilação à Vácuo.
A destilação atmosférica é um processo físico de separação, baseado na diferença entre os pontos de ebulição dos compostos coexistentes numa mistura líquida. Como os pontos de ebulição dos hidrocarbonetos presentes na mistura do petróleo aumentam com suas massas moleculares, ao se variarem as condições de aquecimento do petróleo, é possível vaporizar-se compostos leves, intermediários e pesados que, ao se condensarem, podem ser separados. Neste processo, ocorre, também, a formação de um resíduo bastante pesado que, nas condições de temperatura e pressão da destilação atmosférica, não se vaporiza. Por isso existe a necessidade de se submeter este resíduo a outro processo de separação denominado de destilação à vácuo.
Tabela 3.4: Processos de refino
1.Separação
1. Destilação atmosférica 2. Destilação a vácuo 3. Estabilização de naftas 4. Extração de aromáticos 5. Desasfaltação a propano 6. Desaromatização a furfural 7. Desparafinação a solvente 8. Adsorção de n-parafinas
2.Conversão
1. Visco-redução
2. Craqueamento térmico 3. Craqueamento retardado 4. Craqueamento catalítico
5. Hidrocraqueamento (severo, moderado) 6. Reformação catalítica
7. Isomerização catalítica 8. Alquilação catalítica 9. Polimerização catalítica
3.Tratamento
1. Dessalgação eletrostática 2. Tratamento cáustico 3. Tratamento Merox 4. Tratamento Bender 5. Tratamento DEA/MEA 6. Hidrotratamneto
4.Processos auxiliares
1. Geração de hidrogênio 2. Recuperação de enxofre 3. Utilidades
O gás natural combustível é normalmente um produto final, sendo queimado em fornos e caldeiras na própria refinaria. O gás liquefeito de petróleo (GLP) pode ser um produto final,destinado a armazenamento em tanques esféricos, ou ser um produto intermediário, sendo então submetido ao processo de tratamento cáustico.
As naftas podem ter destinos idênticos ao do GLP, segundo sua utilização como produtos finais, armazenados em tanques cilíndricos, ou intermediários, sofrendo tratamento cáustico subseqüente, ou ainda como corrente de alimentação à unidade de reforma catalítica, quando o objetivo é a obtenção de gasolina de melhor octanagem.
O querosene pode ser também um produto final, como querosene de aviação ou iluminação, ou produto intermediário quando submetido ao processo de hidrotratamento (HDT), podendo ser utilizado como óleo diesel ou como agente de correção da viscosidade de óleos combustíveis.
Os gasóleos atmosféricos, quando obtidos como produtos finais,são armazenados em tanques cilíndricos na forma de óleo diesel, ou podem ser submetidos a processamento na unidade de HDT e então armazenados também como óleo diesel. Os gasóleos de vácuo, no entanto, são sempre produtos intermediários, e compõem as correntes de alimentação de unidades de craqueamento catalítico (U-CC) ou formam frações lubrificantes, segundo esquemas de refinos para produção de combustíveis ou lubrificantes, respectivamente.
Os resíduos de vácuo são utilizados como asfalto quando caracterizados como produtos finais, podendo ainda ser usados como óleos combustíveis após diluição com correntes de menor viscosidade. Podem ainda ser empregados como produtos intermediários na forma de carga das unidades de coque ou desasfaltação usando solvente (propano).
O Craqueamento Catalítico (FCC - Fluid Catalytic Cracking) é um processo químico, que transforma frações mais pesadas em outras mais leves através da quebra de moléculas dos compostos reagentes, utilizando agentes facilitadores chamados catalisadores (LUNA, F.; SCHUCHARDT, 1999).O catalisador utilizado é composto basicamente de zeólita (poros pequenos e definidos).
O tratamento DEA é um processo específico para remoção de H2S de frações gasosas
capacidade de soluções de etanolaminas, como a dietilamina (DEA), de solubilizar seletivamente a H2S e CO2.
O tratamento MEROX é um processoque visa a economia do NaOH utilizado no tratamento cáustico, sendo adotado para que se obtenha uma regeneração da soda cáustica que retira o H2S.
O tratamento Bender é essencialmente um processo de adoçamento para redução de corrosividade, desenvolvido com o objetivo de melhorar a qualidade do querosene de aviação e aplicável a frações intermediárias do petróleo. Consiste na transformação de mercaptanas corrosivas em dissulfetos menos agressivos, através de oxidação catalítica em leito fixo em meio alcalino, com catalisador à base de óxido de chumbo convertido a sulfeto (PbS) na própria unidade (JÚNIOR, 2012).
3.1.2–DIESEL
O óleo diesel pode ser denominado como produto constituído de frações maiores que o querosene e menores que lubrificantes, contendo moléculas com 12 a acerca de 24 átomos de carbono. Sendo mais viscoso que a gasolina, menos inflamável, pois sua volatilização só se faz acima de 200°C (ponto de ebulição entre 200 e 300°C). Líquido fluido com coloração que varia de amarelo a marrom, possuindo fluorescência azul, utilizado como combustível em motores a Diesel (NEIVA, 1974). Composto basicamente por hidrocarbonetos, formado principalmente por átomos de carbono, hidrogênio e em baixas concentrações por enxofre, nitrogênio e oxigênio.
40 e 60 para motores a diesel. Para definir o número de cetano têm-se como parâmetro dois hidrocarbonetos (GARY; HANDWERK, 2001; VALLE, 2007; PETROBRAS, 2011):
n-cetano ou hexadecano (CH3– CH2), para NC = 100 e
α-metilnaftaleno com NC = 0.
Desenvolvida pela ASTM “American Society for Testing Materials” a fórmula utilizada para o calculo é representado pela expressão:
IC = 454,74 - 1641,416D + 774,74D2 - 0,554B + 97,803(logB)2 Sendo:
D = densidade a 15°C, (g/cm3);
B = temperatura da destilação de 50% do produto, (°C).
As restrições mais severas para melhorar a qualidade do ar, são para enxofre e conteúdo de aromáticos dos combustíveis diesel. A redução do conteúdo de enxofre e aromáticos também reduz as emissões de particulados pelos motores a diesel (GARY; HANDWERK, 2001).
Segundo a Resolução da ANP (Agência Nacional de Petróleo, Gás Natural e Biocombustível) nº 42, de 16.10.2009, Art. 2º os óleos diesel de uso rodoviário classificam-se em:
- óleo diesel A: combustível produzido por processos de refino de petróleo e processamento de gás natural destinado a veículos dotados de motores do ciclo Diesel, de uso rodoviário, sem adição de biodiesel.
- óleo diesel B: combustível produzido por processos de refino de petróleo e processamento de gás natural destinado a veículos dotados de motores do ciclo Diesel, de uso rodoviário, com adição de biodiesel no teor estabelecido pela legislação vigente.
Sendo que o óleo diesel A e B devem apresentar as seguintes nomenclaturas, conforme o teor máximo de enxofre:
b) óleo diesel A S500 e B S500: combustíveis com teor de enxofre, máximo, de 500 mg/kg.
c) óleo diesel A S1800 e B S1800: combustíveis com teor de enxofre, máximo, de 1800 mg/kg.
Há uma variedade de técnicas para reduzir e controlar a emissão de SO2. Elas se
encaixam nos três conceitos básicos para controle desses poluentes: prevenção de sua formação, retiradado enxofre do combustível antes da queima, processo conhecido como dessulfurização do combustível; atuação no processo de combustão de tal forma que um material absorvente reduza o SO2 formado ainda na câmara de combustão; limpeza do gás
após a combustão usando material absorvente, processo conhecido como dessulfurização dos produtos de queima (CARVALHO Jr; LACAVA, 2003).
Atendendo os esforços para o controle da poluição atmosférica de modo a promover a melhoria da qualidade ambiental e o bem-estar da população; e considerando as evoluções tecnológicas das metodologias de avaliação das propriedades dos combustíveis e a necessidade de contemplá-las nas respectivas especificações, faz-se necessário estabelecer regulamentações para controle da poluição.
A mais nova resolução para comercialização do Diesel foi a Resolução ANP 62/2011 que determina a comercialização do óleo diesel de baixo teor de enxofre (S50 em 2012 e S10 a partir de 2013). A partir dessa resolução fez-se necessário uma nova classificação para o diesel, então segundo a Resolução ANP 65/2011, Art. 2º o óleo diesel de uso rodoviário classificam-se em:
I - Óleo diesel A: combustível produzido por processos de refino de petróleo, centrais de matérias-primas petroquímicas ou autorizados nos termos do § 1º do art. 1º da Resolução, destinado a veículos dotados de motores do ciclo Diesel, de uso rodoviário, sem adição de biodiesel;
II - Óleo diesel B: óleo diesel A adicionado de biodiesel no teor estabelecido pela legislação vigente.
Art. 3º Fica estabelecido, para efeitos da Resolução, que os óleos diesel A e B deverão apresentar as seguintes nomenclaturas, conforme o teor máximo de enxofre:
II - Óleo diesel A S50 e B S50: combustíveis com teor de enxofre, máximo, de 50 mg/kg;
III - Óleo diesel A S500 e B S500: combustíveis com teor de enxofre, máximo, de 500 mg/kg;
IV - Óleo diesel A S1800 e B S1800: combustíveis com teor de enxofre, máximo, de 1800 mg/kg.
3.2–PROBLEMAS AMBIENTAIS RELACIONADOS AO ENXOFRE
As refinarias encontram-se em confronto com dois grandes desafios, devido a grande atenção que se tem dado em relação à degradação do meio ambiente, tornando-se nos últimos anos uma preocupação de interesse nacional e internacional. Seus desafios estão em produzir combustíveis de transporte atendendo a requisitos rigorosos e dentro dos regulamentos de emissão. Reconhecendo que parte da poluição atmosférica vem dos veículos de transportes (fontes móveis), sendo esta a principal fonte de CO2 enquanto as demais fontes (fontes
estacionarias) são as principais geradoras de partículas e compostos de enxofre (MAPLES, 2000). As atividades naturais e humanas introduzem dióxido de enxofre (SO2) na
atmosfera, mas além delas existem fontes não naturais, e como maior fonte está a combustão de combustíveis fósseis em processos industriais, pois praticamente todo o conteúdo de enxofre dos combustíveis durante a combustão se transforma em SO2. Os combustíveis
fósseis mais comuns são carvão com 0,1% a 6% de teor de enxofre, gasolina cerca de 0,04% e entre eles está o diesel com cerca de 0,22%. Do total de emissões de SO2 das fontes não
naturais a queima do diesel (óleo) contribui com 25% (CARVALHO Jr; LACAVA, 2003).
Sabe-se que os óxidos de enxofre são responsáveis pela chuva ácida (ver Figura 3.3), emissão de particulados, além de envenenar os motores. NO· e SO2 como poluentes primários
(MARTINS; ANDRADE, 2002; BAIRD, 2002). Quando lançado na atmosfera, parte do SO2
irá sofrer oxidação, a forma mais comum de oxidação na atmosfera é pela reação com radical hidroxila (OH-), além disso, parte do SO2 lançado para atmosfera se oxida para SO3 e este,
pela reação com vapor d'água, é convertido em H2SO4 (CARVALHO Jr; LACAVA, 2003). A
chuva ácida, além de poluir rios e lagos, destruindo a flora e a fauna aquática, se infiltra no solo, liberando metais potencialmente tóxicos tais como Al, Pb, Cd, que podem se inserir na cadeia alimentar. Além da formação da chuva ácida o SO2 pode formar aerossol de sulfato,
formando partículas de sais ou gotas de H2SO4, ocasionando problemas respiratórios, pois
penetram nos pulmões (MARTINS; ANDRADE, 2002).
Figura 3.3: Processo de formação da chuva ácida.
Fonte: Jesus (1996)
3.3–DESSULFURIZAÇÃO
preocupação ambiental e a remoção de enxofre dos combustíveis se tornou objeto de estudo no mundo inteiro.
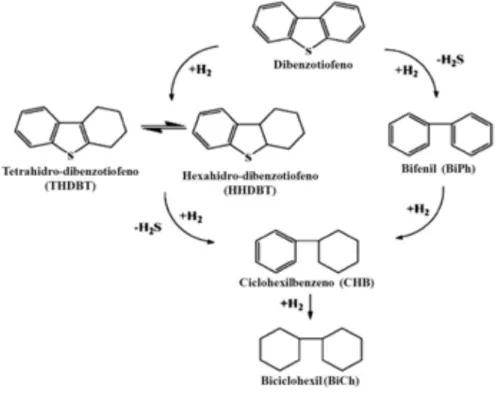
Os combustíveis fósseis possuem vários tipos de compostos sulfurados orgânicos, derivados de alquil como o tiofeno, benzotiofeno (BT) ou dibenzotiofeno (DBT) (ver Figura 3.4), estes compostos são quimicamente tão estáveis que a fissão da carbono-enxofre não ocorre facilmente (AINDA; YAMAMOTO; SAKATA, 1994).
Figura 3.4: Compostos de enxofre presentes nos combustíveis.
Fonte: Ruiz-Guerrero; Bertoncini (2010)
Em vista do exposto, vários processos vêm sendo desenvolvidos com o intuito de eliminar estes compostos de enxofre, processos como a hidrodessulfurização, dessulfurização por adsorção, dessulfurização por oxidação, dessulfurização enzimática, entre outros.
A seguir comentam-se os processos utilizados para eliminação de enxofre dos combustíveis.
3.3.1–HIDROTRATAMENTO (HDT)
oxigênio e aromáticos. HDT é um processo de refino com hidrogênio, cuja finalidade é remover contaminantes.
O primeiro processo de dessulfurização foi utilizando hidrogênio pelo processo chamado de Hidrodessulfurização (HDS), mas a eficiência do processo depende do composto sulfurado, para tiofenos há necessidade de altas temperaturas e pressões de hidrogênio. Assim em 1970 foi intensificada a busca por métodos de dessulfurização alternativos, que não necessitem de altas pressões e temperaturas e do uso de hidrogênio (ATTAR; CORCORAN, 1978).
O método empregado atualmente para a redução do enxofre que está contido noscombustíveis derivados do petróleo é a hidrodessulfurização catalítica (HDS), que remove o enxofre dos combustíveis, transformando-o em sulfeto de hidrogênio (ZANNIKOS; LOIS; STOURNAS, 1995), conforme equação:
R-S-R'+ H 2 R-R' + H2S
A Hidrodessulfurização é um processo no qual o óleo leve é aquecido, misturado com hidrogênio sob temperaturas elevadas e altas pressões, e alimentado a um reator embalado com um catalisador peletizado (CAMPOS-MARTIN, et al, 2010). Um exemplo para o mecanismo de HDS é a reação de DBT e 4,6-DMDBT (Figura 3.5), onde o processo pode ocorrer através de duas rotas principais. Uma das rotas é a hidrogenólise (DDS), em que o enxofre é removido sem o comprometimento aos anéis aromáticos. A outra rota é através de uma dessulfurização por hidrogenação (HYD), em que os anéis aromáticos de compostos de DBT são preferencialmente hidrogenados para intermediários 4H-ou 6H-DBT e são subsequentemente dessulfurizados (SRIVASTAVA, 2010).
Figura 3.5: Caminhos para o HDS de DBT em 300°C e 102 atm na presença de CoMo/Al2O3.
Fonte: Adaptado de Srivastava (2010)
Tabela 3.5: Catalisadores empregados no processo de Hidrodessulfurização
Catalisadores de HDS Artigos
CoMo/Al2O3
KORÁNYI; PAÁL, 1991; OKAMOTO et al, 2003
P e Ni/A12O3suportados em carbetos de
molibdênio
COSTA et al, 2002; MANOLI et al, 2004; COSTA et al, 2005; SUNDARAMURTHY et al, 2006
Co/Mo suportados em γ-A12O3, V2O5/γ
-A12O3, TiO2-ZrO2, V2O5/TiO2-ZrO2
WANG et al, 2009a; CHEN et al, 2010
MoP, Ni2P e Ni-Mo-P suportados em
sílica ou alumina
Catalisadores de HDS Artigos
Co-MoS2 e Co-WS2 OKAMOTO et al, 2009
Rh2P/SiO2 HAYES et al, 2010
CoMo a NiMo suportados em carbono,
alumina, titânia, sílica-alumina amorfa HENSEN et al, 2003
Rh(III)/zeólitas GIVENS; DILLARD, 1984
WS2/SBA-15 VRADMAN et al, 2003
CoxPy/SiO2 BURNSet al, 2008
Ni-B, Mo-O-B, e Ni-Mo-O-B suportados
em sílica PARKSet al, 2007
W/γ-A12O3e NiW/γ-A12O3 WANG et al, 2008
Sulfetos de Nb, Mo, Ru, Rh e Pd HERMANN; BRORSON; TOPSØE, 2000
Co-Mo/A12O3, Ni-Mo/A12O3,
Ru-Co-Mo/Al2O3.
MUHAMMAD et al, 2011
MoO3/MCM-41
3.3.2–DESSULFURIZAÇÃO POR ADSORÇÃO
Adsorção é o fenômeno que descreve a interação entre as fases gás-sólido. Técnica que determina a quantidade que um determinado adsorvente tem para formar uma monocamada sobre a superfície (MIKHAIL; ZAKI; KHALIL, 2002). Elucidada com base em dois tipos de interação: fisissorção e quimissorção, esta distinção pode ser atribuída à natureza e intensidadedas interações que ocorrem entre omaterial que adsorve e o material que é adsorvido (adsorvato). Na fisissorção, a interação ocorre por forças intermoleculares do tipo Vander Waals (interação de dispersão ou dipolo induzido, também chamado de forças de London, e interação dipolo-dipolo, por exemplo) e na quimissorção a união ocorre por meiode ligações químicas (normalmente covalentes), que tendem a um número de coordenação máximo como substrato (MIMURA; SALES; PINHEIRO, 2010).
As propriedades dos adsorventes como a seletividade a compostos sulfurados, resistência, capacidade de adsorção determinam a eficiência deste processo, mas também se confronta com alguns desafios, entre eles a elaboração de adsorventes com elevada capacidade e seletividade a compostos sulfurados (ALVES, 2010).
Vários materiais têm sido utilizados como adsorventes tanto para compostos sulfurados quanto para outros poluentes: aluminas (SHEN; LI; ZHAO, 2008; NAIR; TATARCHUK, 2011, JIAO et al, 2006), zeólitas (LIU et al, 2007; LI et al, 2007; LI et al, 2010; NG et al, 2005;. WANG et al, 2009b; TANG et al 2010; LAI et al, 2011; PERGHER; CAOVILLA; DETONI, 2005b), materiais mesoporosos (LI et al, 2007;
LI et al, 2010; YANG; HERNÁNDEZ-MALDONADO; YANG, 2003;
SUBHAN et al, 2012), óxidos e carvão ativo (ZHOU; MA; SONG, 2006; ISRAELSON, 2004; SHEN; LI; ZHAO, 2008; WANG et al, 2012) entre outros. Também muitos estudos foram realizados com impregnação de metais (ZHENG et al, 2012; WANG et al, 2009b; ZHENG et al, 2012; SHEN; LI; ZHAO, 2008; LIU et al, 2007; LI et al, 2007; TANG et al 2010) nestes adsorventes.
adsorventes à base de sílica pode torná-los adequados para diversas aplicações e sua capacidade pode ser melhorada atravésde modificações nos suportes.
YANG et al, (2003) obtiveram sucesso em estudos de adsorção realizados com zeólita Y complexadas por troca catiônica com Cu e Ag. Empregaram estes adsorventes na adsorção de compostos sulfurados em diesel e alcançaram redução de 430 para 0,2 ppm de teor de enxofre. MALVESTI et al, 2009 testaram as zeólitas NaY e beta impregnadas com Zn e verificaram sua eficiência para adsorver benzotiofeno e dibenzotiofeno. Obtiveram resultados de até 90% de remoção destes compostos sulfurados. Outra pesquisa foi realizada por LI et al, (2007) que estudaram 3 adsorventes impregnados com Cu, zeólita NaY, MCM-41 e MAS (NaY utilizada como precursor da MCM-41), e verificaram que o melhor adsorvente foi a MAS com remoção de 50% do valor inicial.
3.3.3–BIODESSULFURIZAÇÃO
Biodessulfurização é outra técnica utilizada para a dessulfurização, sendo uma alternativa ao tratamento químico. Técnica que usa bactérias para a remoção dos compostos químicos. O petróleo é um substrato complexo e o fato de um microrganismo ser capaz de metabolizar o DBT em condições laboratoriais não implica necessariamente que consiga remover o enxofre orgânico. Os microrganismos possuem um problema de acessibilidade ao enxofre, mesmo tendo acesso há a existência de impedimentos estéricos associados à estrutura desses mesmos compostos, que dificultam a atuação dos sistemas enzimáticos microbianos. Uma alternativa é a utilização de enzimas livres ou imobilizadas para aplicação em processos de biodessulfurização (ALVES; MESQUITA; GÍRIO, 2010).
Para o processo são necessárias cinco etapas:
- 1ª etapa: a produção de repouso ativo para as células (biocatalisadores) com uma atividade específica elevada;
- 2ª etapa: preparaçãode um sistema bifásico contendo fração de óleo, fase aquosa e biocatalisador;
- 4ª etapa: separação de óleo dessulfurizado, recuperação do biocatalisador e seu retorno para o bioreator e
- 5º etapa: tratamento de águas residuais (CAMPOS-MARTIN et al, 2010).
Alguns microrganismos empregados neste processo: Bacterium, strain RIPI-22; Pseudomonas stutzeri UP-1; Caldariomyces fumago; Rhodococcus erythropolis IGTS8
(SRIVASTAVA, 2011).
LI et al, (2009a) estudou o sistema adsorção/bioregeneração, utilizando diversos materiais para adsorver compostos sulfurados, após o processo empregou um microrganismo para a retirada destes compostos sulfurados dos adsorventes. Verificou a eficácia do processo pela regeneração dos materiais.
3.3.4–DESSULFURIZAÇÃO OXIDATIVA (ODS)
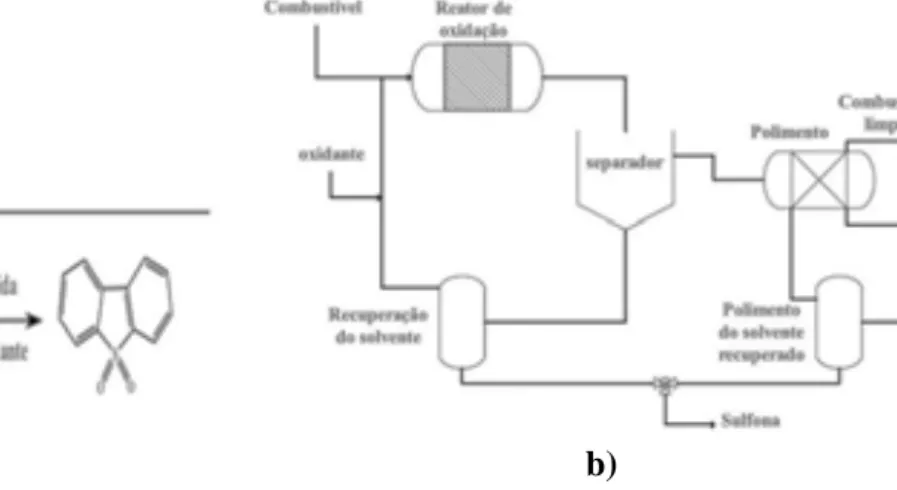
A dessulfurização oxidativa (ODS) está sendo consideradacomo um dos métodos promissores para dessulfurização de combustíveis, pois em comparação com HDS pode ser realizada sob condições muito suaves: temperatura ambiente e sob pressão atmosférica, não sendo necessário o uso de hidrogênio no processo (LIU et al, 2008; SRIVASTAVA, 2011). A dessulfurização oxidativa produz compostos oxidados, neste processo o enxofre passa do estado divalente para o estado hexavalente (sulfona), conforme ilustrado na Figura3.6a, podendo ser fisicamente separados dos demais compostos por meio de extração com solventes como o metanol (ZANNIKOS; LOIS; STOURNAS, 1995).
Figura 3.6: Exemplo de Dessulfurização oxidativa: a) oxidação/extração, b) fluxograma da reação bifásica simultânea oxidação/extração numa unidade de ODS.
a) b)
Fonte: Adaptado de Campos-Martin et al, (2010)
Os compostos de enxofre são conhecidos por serem mais polares que os hidrocarbonetos de estrutura semelhante, assim compostos de enxofre oxidado (sulfonas ou sulfóxidos) são mais polares do que sulfetos, permitindo remoção seletiva de compostos de enxofre a partir de hidrocarbonetos, por um processo combinado de oxidação e extração com solvente ou por meio de adsorção (JIAN, 2006).
Os processos de oxidação e extração têm sido investigados por vários pesquisadores, ZHAO et al, (2008) estudou oxidação do tiofeno, LAI; LUO, (2006) e HAO et al, (2006) dibenzotiofeno entre várias outras pesquisas e patentes (US 4,321,216; US 6,274,785; US6,160,193). Esses processos podem ser realizados com ultrason, radiação, foto-oxidação, fotoquímica entre outras técnicas.
Na presença de um catalisador sólido na ODS a reação é definida em duas etapas: oxidação de compostos de S em sulfonas e remoção ou extração do enxofre oxidado a partir dos combustíveis. Estudos sugerem que a primeira etapa é a remoçãode compostos de enxofre por extração do combustível, e aetapa seguinte é a sua oxidação para as sulfonas correspondentes na fase de solvente, uma vez que ter reagentes na fase polar facilita a sua reação (CEDEÑO-CAERO; NAVARRO; GUTIÉRREZ-ALEJANDRE, 2006).
secundárias indesejadas, e a escolha do solvente adequado, que podem remover compostos desejáveis dos combustíveis.
Seletividade da reação, segurança e custo são preocupações importantes para a seleção de catalisadores, oxidantes, e das condições operacionais para ODS. A eficiência do solvente extrator vai depender da sua polaridade, mas além da polaridade, outras propriedades devem ser analisadas, tais como ponto de ebulição, ponto de congelamento e tensão superficial (SRIVASTAVA, 2011).
Diante do exposto, a Tabela 3.6 apresenta alguns exemplos de oxidantes e dos solventes ou adsorventes utilizados para extração dos compostos oxidados.
O oxidante mais utilizado neste processo é o peróxido de hidrogênio, pois é um dos mais poderosos agentes oxidantes, com potencial de oxidação de 1,8 Ve apresenta-se como um reagente único, visto que seu produto de decomposição é a água. Possui vantagens como capacidade de oxidar diretamente alguns compostos, solubilidade em água, estabilidade térmica, inexistência de problemas de transferência de massa, mas também possui algumas desvantagens, sua taxa de oxidação está limitada pela taxa de formação de radicais hidroxila. Além disso, tem-se sugerido que o peróxido de hidrogênio funciona como um receptor de radicais hidroxila; assim, se ele estiver em excesso, vai diminuir a eficiência da reação (LEGRINI et al, 1993; RAGNINI;IGLIA; BERTAZZOLI, 2001).
Porém a água formada pela decomposição do peróxido de hidrogênio pode afetar os rendimentos a sulfona deste processo, como relatado na literatura, por GONZÁLEZ-GARCÍA; CEDEÑO-CAERO, (2009) que em cada novo ciclo do catalisador na reação contendo H2O2, o oxigênio participava da oxidação dos compostos DBTs, mas a água
Tabela 3.6: Exemplos de oxidantes e solventes ou adsorventes empregados nas reações de Dessulfurização
Oxidante Solvente ou adsorvente Referências
H2O2
ácido acético AL-SHAHRANI et al, 2007
acetonitrila
HAW et al, 2010a; VILLASENÕR et al, 2004; SHIRAISHI; NAITO; HIRAI, 2003; CEDEÑO-CAERO et al, 2008
--- MADEIRA; FERREIRA-LEITÃO; BON,
2008
t-buOH MONDAL et al, 2006
tolueno TE; FAIRBRIDGE; RING, 2001
ácido fórmico FILIPPIS et al, 2011; GUOXIAN et al, 2007
Líquido Iônico WANG; ZHAO; LI, 2009c; ZHAO et al, 2009b
MoO3/γ-Al2O3 JIA; LI; NING, 2011
Sílica gel UKKIRAPANDIAN et al, 2008; COLLINS; LUCY; SHARP, 1997
O3 e H2O2 Líquido Iônico WANG;ZHAO; LI, 2010
TBHP (tert-Butil hidroperóxido)
tolueno PRASAD et al, 2008
acetonitrila GONZÁLEZ-GARCÍA; CEDEÑO-CAERO,
2009; GUO et al, 2011
Um fator importante na reação é a quantidade mínima necessária para o processo de extração ocorrer. CEDENÕ-CAERO et al, (2005) em seu estudo realizou uma reação em razões diferentes de diesel/solvente e observou que a atividade ODS diminuiu cerca de 50% quando a razão é de 5 e até 90% de 4-MDBT para razão de 10. A atividade relativa de ODS em diferentes compostos de enxofre foi afetada pela relação diesel/solvente devido à relação de diferenças na solubilidade, com a diminuição da quantidade. Além disso, como a razão S/H2O2 foi mantida constante, a água (como produto de reação) em relação à razão de
solvente foi aumentada. Consequentemente, a água impediu o desempenho catalítico. Outra reação foi realizada utilizando misturas de água-acetonitrila com o solvente (para razão diesel/solvente = 1). Observaram que a produção de sulfona é fortemente afetada pela presença de água no sistema de reação, pois os compostos orgânicos de enxofre oxidados são totalmente solúveis em acetonitrila e apenas parcialmente solúveis em água. Assim, o desempenho dos solventes depende consideravelmente da solubilidadedos produtos da oxidação do enxofre na mistura reacional.
Os catalisadores sólidos para ODS são feitos à base de metais de transição e são utilizados os mesmos suportes empregados pelos demais métodos de dessulfurização: sílica, alumina, óxidos de titânio, zeólitas entre outros. O teor (%) dos metais pode variar assim como os resultados obtidos, ABDALLA et al, (2009) suportaram em Al2O3 10% de
tungstênio e variaram teores de 0-3% de fósforo e conseguiram remoção de enxofrede até 99%. LI, et al, (2009b) impregnaram tungstênio em SBA-15 e conseguiram redução de 91% dos compostos sulfurados. Já JOSE; SENGUPTA; BASU, (2011) impregnaram 0,59%, 1,05% e 1,44% de Cu em TS-1 e obtiveram conversão de 93%.
hidrofóbica do catalisador, incidindo em uma reação mais rápida, sendo que o catalisador que apresenta melhor reatividade foi o STAB.
Já os pesquisadores QIU et al, (2009) estudaram catalisadores de ácido fosfomolíbidênico modificado com vários sais de amônio quaternário e também verificaram que sais com cadeias mais curtas são eficientes para maiores taxas de conversão de BT e cadeias mais longas para as moléculas de DBT.
ZHAO et al, (2009b) analisaram o mecanismo de nove catalisadores de sais de amônio quaternário para a insolubilidade do sistema de fase binária de dessulfurização oxidativa, num sistema de reação com peróxido de hidrogênio, ácido fórmico, acido acético e ácido tungstico e n-heptano para a oxidação de BT ou DBT, e concluíram que o catalisador na fase de transferência no sistema de fase líquido-líquido realiza três papéis importantes como a aceleração da transferência de ânion oxidante à partir de solução aquosa para a fase orgânica, reduzindo assim a tensão interfacial e ativação a ânion, dos nove catalisadores testados obtiveram melhores resultados com tetrabutilamonio bisulfato (TBAB) e dos três sistemas oxidantes HCOOH/H2O2, e 97,45% foi a maior taxa para DBT.
DI GIUSEPPE et al, (2009) estudaram catalisadores homogêneos e heterogêneos a base de rênio (metiltrioxorênio - MTO) suportados em resinas, para a oxidação de derivados de benzotiofeno e dibenzotiofeno, usando peróxido de hidrogênio como agente oxidante em combustível modelo e óleo diesel real, verificaram que os catalisadores são excelentes ativadores para H2O2 durante o processo, com conversão maior que 90%.
Alguns parâmetros operacionais têm sido estudados para verificar o seu efeito, como foi realizado por DEHKORDI et al, (2009). Avaliaram a dessulfurização oxidativa de querosene não hidrogenada usando um sistema H2O2/ácido acético. Analisaram a razão molar
de ácido para enxofre (nacid/nS), razão molar de oxidante para enxofre (nO/nS) e temperatura,
além de examinar três tipos de álcool (etanol, metanol e propanool) para a extração de compostos de enxofre oxidado. Chegaram a conclusão que com acréscimo da temperatura, aumenta a remoção de S devido a um aumento na taxa de reação de oxidação de compostos sulfurados, a razão molar de oxidante para enxofre ótima para a oxidação de compostos sulfurados de querosene não tratada, dependente da temperatura de reação, com nO/nS= 8
obtiveram maior remoção de S com 25°C e para nO/nS = 23 obteve maior remoção de enxofre
(S) com temperatura de 60 °C. Observaram aumento da remoção pelo aumento da nacid/nS,
compostos oxidados no meio da reação, pois o ácido acético catalisa a oxidação de compostos sulfurados através da formação do ácido peracético que atua como um agente oxidante dando seu átomo de oxigênio para os compostos contendo enxofre, presentes no querosene. O propanol apresentou melhor capacidade de extração dos compostos oxidados, remoção de enxofre máximo observado no presente estudo foi de 83,3%.
Pesquisas utilizando líquidos iônicos ([(CH2)4SO3Hmim] [Tos], [Bmim]BF4 e
[(C4H9)4NBr . 2C6H11NO]) como solventes nas reações e H2O2 foram estudados por
LIU et al, (2011), XU et al, (2009) e ZHAO et al, (2009a) e verificaram eficiente extração de compostos sulfurados oxidados em quantidades maiores a 90% e a possibilidade de serem usados em mais de uma reação.
ABDALLA et al, (2009) avaliaram o efeito de teores de fosfato de um catalisador contendo 10% de tungstênio suportado em alumina (Na2WO4/Al2O3), os resultados
mostraram que o fosfato (até 2,5%) tem um efeito sobre o catalisador, sendo o catalisador altamente ativo para dessulfurização oxidativa tanto para cargas simuladas quanto para cargas reais, chegaram a resultados maiores de 92% de remoção usando peroxido de hidrogênio com ácido acético glacial, e acetonitrila.
ZAPATA et al, (2005) realizaram uma triagem de catalisadores para ODS usando paládio suportado em Cr2O3, Al2O3, ZrO2 e óxidos de manganês que são considerados
eficientes na decomposição de peróxido de hidrogênio. Verificaram que os catalisadores a base de Pd são mais eficientes que os demais catalisadores, as temperaturas de calcinação (110-950 °C) dos óxidos de manganês não tiveram efeito sobre a atividade catalítica e que o aumento da concentração de H2O2 (1-7 mL) favoreceu a conversão de compostos de enxofre.
Conversões de tiofeno em até 70%.
3.4–CATÁLISE E CATALISADORES
Catálise é conhecidacomo uma reação que ocorre na presença de um catalisador. O catalisador age diminuindo a energia de ativação da reação e consequentemente aumentando a sua velocidade (Figura 3.7). A catálise pode ser classificada como:
- Catálise homogênea: catalisador e reagentes compõem a mesma fase;
- Catálise heterogênea: catalisador e reagentes se encontram em fases diferentes;
Na catálise heterogênea normalmente o catalisador será um sólido, com a existência de centros ativos na sua superfície. Podem ser mássicos (constituídos apenas por substâncias ativas) ou suportados, onde a fase ativa estará dispersa sobre o suporte.
No catalisador sólido pode ocorrer adsorção dos reagentes nos centros ativos da superfície, desta forma deve-se considerar a transferência destes reagentes para a superfície do catalisador, onde ocorrera a reação. Os produtos formados devem ser dessorvidos.
Figura 3.7: Efeito do catalisador na reação.
Para catalisadores porosos uma reação catalítica segue algumas etapas, já para sólidos não porosos não é necessário considerar estas etapas de transferência de massas:
1) Difusão externa: transporte dos reagentes da fase fluida até a superfície das partículas do catalisador;
2) Difusão interna: transporte dos reagentes no interior dos poros;
3) Adsorção nos centros ativos;
4) Reação química das espécies adsorvidas;
5) Dessorção dos produtos
6) Transporte dos produtos até a superfície externa da partícula;
7) Transporte dos produtos da superfície externa da partícula do catalisador até a fase fluida.
As propriedades mais importantes dos catalisadores estão ligadas à sua composição e método de preparo, e são elas:
- atividade; - seletividade; - estabilidade;
- condutividade térmica e - resistência mecânica.
Figura 3.8: Processo do método de impregnação.
Fonte: Adaptado de Schmal (2011)
A impregnação pode ser realizada por via seca, quando o suporte é pré-moldado ou extrudado e a impregnação é realizada com uma solução para preenchimento dos poros, ou por impregnação úmida, quando o suporte é em pó e o volume será significativamente maior que o volume dos poros. Pode ocorrer durante a impregnação interação com o suporte (ocorre ligações covalentes e ligações iônicas), sem interação com o suporte (suporte inerte ou parcialmente ativo) ou troca iônica (troca de um íon A do sólido com o íon B da solução) (SCHMAL, 2011).
3.5–SUPORTE DOS CATALISADORES
3.5.1–ALUMINA
A alumina é obtida pela calcinação de hidróxidos de alumínio tri-hidratados ou mono-hidratados. O tratamento térmico dos hidróxidos de alumínio produz formas diferentes de óxidos. Sua estrutura depende das condições de processamento térmico, do tipo do hidróxido de alumínio, do resíduo de água, e da presença de óxidos de metais alcalinos e alcalino-terrosos. A alumina industrial ativa utilizada pode conter γ-Al2O3, às vezes, χ- Al2O3.
Essas modificações são variedades de estrutura dos defeitos do espinélio estabilizada por pequena quantidade de água. As partículas cristalinas primárias, de tamanho 3-8 nm, são empacotados de forma que os poros formados são ou tipo ranhura ou em forma de garrafa (FOMKIN, 2009).
Pode ser preparada por um grande número de processos químicos diferentes, seja para produção em pequena escala, no caso deprojetos especiais ou para produção em grande escala, utilizada pelas indústrias ou ainda no desenvolvimento de novas rotas de sínteses. O óxido de alumínio, por ser um material sintético, apresenta elevada consistência química e granulométrica, quando comparado com as fontes naturais de óxido de alumínio (ALCOA, 2012a).
A alumina é muito utilizada nas indústrias, como peças mecânicas e como catalisadores devido às suas propriedades de adsorção e de grande área específica. Igualmente por ser um suporte poroso inerte, atuando como meio para a difusão do catalisador ativo, fornecendo uma alta superfície de exposição para o material ativo, como material para enchimento das colunas cromatográficas, aditivo de toner xerográfico e próteses e implantes.
Pela alumina ser um dos principais constituintes da crosta terrestre, ela possui uma tendência a ser cada vez mais empregada em processos, sendo que a maior parte é na produção de alumínio metálico. (ALUMINA, 1962; ZHANG; KALIAGUINE, 2008; BERTAZZO; REZWAN, 2010; MYERS, 1971; ALI, 2012).
Os óxidos de alumínio são reprodutíveis em pureza química e estrutural, estáveis a altas temperaturas e têm uma elevada resistência à erosão. Para as aplicações é de interesse a sua carga superficial (SHIBATA et al, 2007; BERTAZZO; REZWAN, 2010).
diferentes meios e de refino de petróleo (reforma, hidrorefino, hidrocraqueamento), onde os catalisadores utilizados contêm 80 a 99% do óxido de alumínio.
As principais fases da produção do óxido (ver Figura 3.9) são: moagem, digestão, lavagem/espessagem/filtração, precipitação e calcinação.
A bauxita então é misturada a uma solução de soda cáustica e moída, essa mistura segue para os digestores para cozimento. Nessa fase ocorre a formação do aluminato de sódio (soda cáustica e o hidróxido de alumínio). Em seguida ocorre a decantação, filtragem e redução da temperatura da solução e então se sucede a precipitação ou cristalização do hidróxido de alumínio.
O hidróxido de alumínio segue, então, para o forno de calcinação, transformando-o em óxido de alumínio:
2Al(OH)3 Al2O3 + 3H2O
Este óxido de alumínio formado é então levado às cubas eletrolíticas, de onde se obtém o alumínio metálico, por meio do processo de redução, que consiste em extrair o metal do óxido. O alumínio metálico sai das cubas em estado líquido, a aproximadamente 800ºC, depois são ajustadas a sua composição química e forma física (ALCOA, 2012b). Quando
Figura 3.9: Ilustração do processo de Produção da Alumina.
Fonte: Alcoa (2012b)
Figura 3.10: Estrutura da α-alumina.
Fonte: Adaptado de Chawla (2003)
temperatura de calcinação. Ocorrem diversas transformações de fases cristalinas que podem ocorrerem função da temperatura de tratamento térmico e estas transformações podem ser observada resumidamente na Figura 3.11.
São denominadas aluminas de transição, as aluminas com estruturas cristalinas intermediárias que se formam na obtenção da alumina α, conforme a Figura 3.11. Para uso em catálise, as aluminas γ, , χ, são as mais estudadas devido as suas características superficiais e propriedadesestruturais (SILVA, 2010).
Figura 3.11: Transformações de aluminas hidratadas em alumina.
Fonte: Silva (2010)
3.5.2–ARGILA