Católica de
Brasília
PRÓ-REITORIA DE PÓS-GRADUAÇÃO E PESQUISA
STRICTO SENSO EM CIÊNCIAS GENÔMICAS E BIOTECNOLOGIA
Doutorado
Transformação genética de
Coffea arabica
para resistência a
broca-do-café.
Autor: Aulus Estevão Anjos de Deus Barbosa
Orientadora: Maria Fátima Grossi de Sa
TRANSFORMAÇÃO GENÉTICA DE COFFEA ARABICA PARA RESISTÊNCIA A BROCA-DO-CAFÉ.
Tese apresentada ao Programa de Pós-Graduação Stricto Senso em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília como requisito parcial para a obtenção do Título de Doutor em Ciências Genômicas e Biotecnologia
Orientadora: Dra. Maria Fátima Grossi de Sa
Brasília
Tese de autoria de Aulus Estevão Anjos de Deus Barbosa, intitulada “Transformação genética de Coffea arabica para resistência a broca-do-café”, apresentada como requisito parcial para obtenção do grau de Doutor em Ciências Genômicas e Biotecnologia da Universidade Católica de Brasília, em 20 de março de 2009, defendida e aprovada pela banca examinadora abaixo assinada:
______________________________________________________________________ Prof. Dra. Maria Fátima Grossi de Sa
Orientadora
Programa de Pós-Graduação em Ciências Genômicas e Biotecologia – UCB
______________________________________________________________________ Dra. Ana Cristina Miranda Brasileiro
Embrapa Recursos Genéticos e Biotecnologia – CENARGEN
______________________________________________________________________ Prof. Dra. Betânia Ferraz Quirino
Programa de Pós-Graduação em Ciências Genômicas e Biotecologia – UCB
______________________________________________________________________ Prof. Dr. Octavio Luiz Franco
Programa de Pós-Graduação em Ciências Genômicas e Biotecologia – UCB
______________________________________________________________________ Dr. Rodrigo da Rocha Fragoso
Emprapa Cerrados - CPAC
Referência: Barbosa, Aulus. Título: Transformação genética de Coffea arabica para o controle da broca-do-café. 2009. 132 páginas. Doutorado em Ciências Genômicas e Biotecnologia – Universidade Católica de Brasília, Brasília, 2009.
O café é consumido regularmente por cerca de 40% da população mundial, e sua comercialização gera anualmente US$ 70 bilhões, o que torna esta cultura a segunda maior “commodity” natural, atrás apenas do petróleo. Dentre os 49 países produtores de café, o Brasil é o principal, detendo 34% desta produção. No gênero Coffea são encontradas 104 espécies e subespécies; porém, somente as espécies Coffea arabica e Coffea canephora são comercializadas, ocupando 70% e 30% do mercado, respectivamente. A cultura do café é atacada por uma série de pragas agrícolas, com destaque para a broca-do-café (Hypothenemus
hampei), que acarreta anualmente US$ 500 milhões em perdas. O controle desta praga é
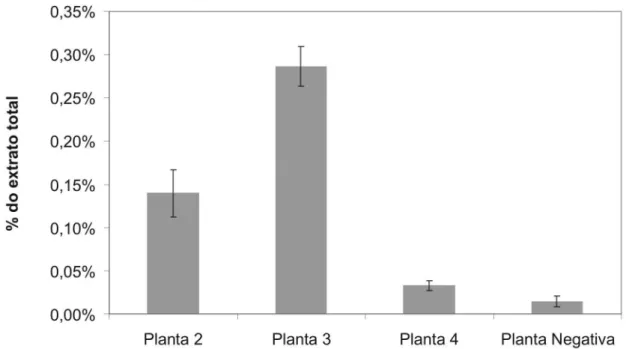
difícil, sendo baseado principalmente na aplicação de inseticidas organoclorados, os quais, além de caros, são carcinogênicos e tóxicos para o meio ambiente. Além disso, não existe resistência natural ao H. hampei em nenhuma das 104 espécies de café. Neste contexto, a aplicação da tecnologia do DNA recombinante pode proporcionar a inserção de genes de resistência contra a broca-do-café. Dentre os genes de resistência a insetos disponíveis, pode-se destacar os inibidores de -amilapode-se obtidos do feijão Phaseolus vulgaris, que foram eficientes em inibir as -amilases de vários insetos que atacam sementes armazenadas, bem como da broca-do-café. Assim, este trabalho teve como meta introduzir em plantas de Coffea arabica o gene para o inibidor -AI1, visando o controle do H. hampei. Para alcançar este objetivo, plantas de C. arabica foram transformadas pelo método de biobalística, bombardeando calos embriogênicos. Os calos transformados foram selecionados com o antibiótico canamicina e regenerados em meio de cultura. A inserção dos transgenes foi confirmada nas plantas de C. arabica com o uso das técnicas de PCR e Southern blot. A expressão do inibidor AI-1 nas plantas foi confirmada por Western blot, quantificada por ELISA e sua atividade foi avaliada em um ensaio in vitro pelo método DNS. Os resultados dos experimentos de PCR e Southern blot mostraram que seis plantas foram transformadas com o gene para o inibidor AI-1. O Western blot das sementes feito em 3 plantas mostrou bandas com massa molecular próxima a 19kDa, indicando a expressão do -AI1. A concentração do inibidor mensurada por ELISA nessas plantas mostrou que a expressão se deu em diferentes concentrações, que variaram de 0,03 a 0,29% do extrato total. No experimento de inibição in vitro, uma das plantas inibiu cerca de 88% das amilases do inseto. Com esses resultados, pode-se concluir que essas plantas transgênicas de café têm um alto potencial para o controle do H. hampei, e sua utilização trará vantagens como diminuição dos custos de produção e redução da poluição ambiental causada pelo uso de inseticidas.
Coffee is consumed daily by about 40% of the world population. Its commercialization generates around US$ 70 billions annually, making this crop the second greatest natural commodity, behind only of petrol. Amongst the 49 coffee producing countries, Brazil is the major one, accounting for 34% of the total world production. In the Coffea genus, there are 104 species and subspecies. However, only Coffea arabica and Coffea canephora are commercialized, corresponding to 70% and 30% of the market, respectively. These cultures are commonly attacked by several pests, and the coffee berry borer (Hypothenemus hampei) is the most destructive one, causing US$ 500 million in losses per year. The control of this insect is difficult, and based mainly on the application of organochloride insecticides, which are carcinogenic, toxic for the environment and expensive. Another aspect that hinders the control of this pest is the fact that there is not natural resistance to H. hampei in any of the 104 coffee species. In this context, the employment of recombinant DNA technology can provide transgenic coffee plants resistant to H. hampei. In the group of insect resistance genes,
-amylase inhibitors (-AIs) from Phaseolus vulgaris have been proven to be quite efficient, inhibiting the amylases from different insects, including the coffee berry borer. Therefore, the purpose of this work is to introduce the -AI1 inhibitor gene in C. arabica plants in order to confer resistance against H. hampei. To achieve this goal, C. arabica calli were transformed through biolistics. PCR and Southern blot results detected six transgenic coffee plants. Immunoblots results revealed 19-kDa bands indicating AI1 expression in 3 plants. The -AI1 concentration revealed by ELISA ranged from 0,03 to 0,29% in the analyzed plants. In the DNS assay, 88% of inhibition from H. hampei -amylases was observed for one of the
analyzed plants. These results clearly demonstrate that the coffee transgenic plants produced in this work have a high potential to control H. hampei.
Página
Figura 1. Fêmea de Hypothenemus hampei sobre um grão de café. 20
Figura 2. Estrutura tridimensional do inibidor AI-1 complexado com a -amilase do inseto
Tenebrio molitor. 26
Figura 3. Esquema do plasmídeo pBIN19α-AI1. 31
Figura 4. Estágios da transformação de plantas de Coffea arabica. 41
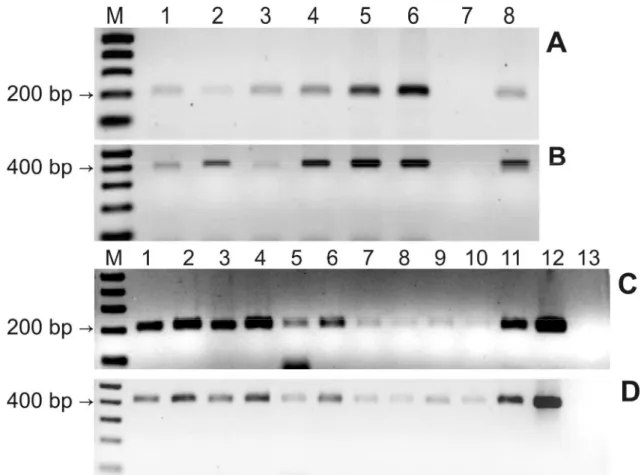
Figura 5. PCR das plantas T0 e T1. 42
Figura 6.Southern blot indicando a integração no genoma do gene AI1. 43
Figura 7. Detecção do inibidor -AI1 expresso em sementes de café. 44
Figura 8. Porcentagem de expressão do inibidor AI1 em extratos totais de sementes das
três plantas de café transgênicos. 45
Figura 9. Ensaio de inibição da alfa-amilase da broca-do-café contra extratos totais de
uma planta não transformada e 3 plantas transgênicas. 46
Figura 10. Quantidade de inibidor -AI1 no extrato das plantas transgênicas de café
Página
Tabela 1. Primers utilizados nas reações de PCR. 34
Bt – Bacillus thuringienses
-AI1 – Inibidor de alfa-amilase 1 de Phaseolus vulgaris
-AI2 – Inibidor de alfa-amilase 2 de Phaseolus vulgaris
d.C. – Depois de Cristo pb – Pares de base UV – Luz ultravioleta kDa – kilo Daltons Da – Daltons
Asn – Aminoácido asparagina Try – Aminoácido triptofano
RNAi – Interferência de ácido ribonucléico PCR – Reação em cadeia da polimerase PHA-L – Fitohemaglutinina
Nos – Nopalina sintase
LB – Borda esquerda do T-DNA RB – Borda direita do T-DNA
nptII – Neomicina fosfotransferase II WPM – “Wood Plant Medium” DNA – Ácido desoxirribonucleico PVP – Polivinilpolipirrolidona
CTAB – Hexadeciltrimetil Amônio Bromida RPM – Rotações por minuto
Tm – Temperatura de anelamento Min – Minutos
dCTP – Citosina tri-fosfato BSA – Albumina de soro bovina
ELISA – “Enzyme Linked Immuno Sorbent Assay” DNS – Ácido dinitrosalicílico
Página
1. Introdução e justificativa... 12
2. Revisão da literatura... 15
2.1. Importância econômica e características do café... 15
2.2. Insetos pragas e fitopatógenos na cultura do cafeeiro... 17
2.2.1. A broca-do-café... 19
2.3. Proteínas de defesa a insetos e transgenia... 23
2.4. Metodologias de transformação do café... 29
3. Materiais e Métodos... 31
3.1. Construção do plasmídeo para transformação de café... 31
3.2. Transformação de Coffea arabica por biobalística... 32
3.3. Avaliação da integração dos transgenes no genoma de C. arabica... 33
3.4. Confirmação da integração do transgene no genoma via Southern blot... 34
3.5. Detecção e quantificação da expressão do inibidor -AI1 nas plantas transgênicas de café... 36
3.6. Avaliação in vitro da atividade inibitória do extrato de sementes de café transgenico -AI1 sobre as -amilases da broca-do-café... 38
4. Resultados... 40
4.1. Transformação de Coffea arabica por biobalística... 40
4.2. Identificação por PCR das plantas transformadas... 41
4.3. Integração do gene -AI1 no genoma das plantas transformadas... 43
4.4. Análise da expressão do inibidor -AI1 nas sementes transgênicas... 44
4.5. Quantificação por ELISA do inibidor expresso... 45
4.6. Ensaio de inibição da amilase de H. hampei contra -AI1 expresso no café transgênico... 46
5. Discussão... 48
6. Conclusões e perspectivas... 52
7. Referencias bibliográficas... 53
Anexo 1. Seqüência de proteínas e de DNA do inibidor αAI-1 e do gene nptII... 67
Anexo 2. Soluções para Southern blot... 68
Anexo 3. Soluções para eletroforese de proteínas e Western blot... 69
Anexo 4. Método para calcular o qui-quadrado (x2) da geração T1... 70
1. INTRODUÇÃO E JUSTIFICATIVA
O café é um produto agrícola de extrema importância para a economia
mundial, gerando aproximadamente US$ 70 bilhões anualmente (PAVA-RIPOLL, M.
et al., 2008). Todo esse rendimento posiciona o grão de café como a segunda maior “commodity” natural, ficando atrás apenas do petróleo e seus derivados
(ENCARNAÇÃO, R. D. O.LIMA, D. R., 2003). O café é cultivado e exportado por 49
países, e o Brasil é o principal produtor mundial, tendo produzido em 2008 34% das
134 milhões de sacas de café colhidas (ICO, 2009). No território nacional, essa
cultura é cultivada, principalmente, nos estados de Minas Gerais, Espírito Santo, São
Paulo, Paraná e Bahia (IBGE, 2009).
Coffea arabica e Coffea canephora são as duas espécies de café exploradas comercialmente, correspondendo, respectivamente, a 70% e 30% do mercado
internacional (PRIVAT, I. et al., 2008). No entanto, no gênero Coffea encontram-se 104 espécies e subespécies (NCBI, 2009). Coffea arabica é uma espécie alotetraplóide (2n = 4x = 44) originada de dois ancestrais diplóides, C. canephora e C. eugenioides, e é caracterizada por uma baixa diversidade genética. Coffea canephora é uma espécie diplóide (2n = 2x = 22), a exemplo de todas as outras espécies conhecidas do gênero Coffea, e possui uma variabilidade genética considerável (BERTRAND, B. et al., 2003).
As duas espécies de café cultivadas são atacadas por uma série de insetos,
ácaros, fungos e nematóides, que, juntos, causam bilhões de dólares em prejuízos.
Dentre estes, o inseto que causa mais danos é a broca-do-café (Hypothenemus hampei). Esta praga ocorre em quase todos os países produtores (BENAVIDES, P. et al., 2005), e gera anualmente US$ 500 milhões em perdas (PAVA-RIPOLL, M. et al., 2008). No cafeeiro, este inseto ataca exclusivamente os frutos e grãos, acarretando
uma série de perfurações que levam à redução da quantidade e qualidade do café
produzido, e essas perfurações ainda favorecem o ataque de fungos e bactérias
(DAMON, A., 2000).
H. hampei é muito difícil de ser controlado, pois seu ciclo de vida é rápido, durando de 28 a 34 dias, e ocorre totalmente dentro do fruto do cafeeiro (DAMON, A.,
2000). Desse modo, o inseto fica protegido do ataque de predadores naturais e de
defensivos agrícolas. Atualmente, o principal método de controle da broca-do-café é
carcinogênico e altamente tóxico para o homem e o meio ambiente, tendo sido banido
de vários países (DAMON, A., 2000). Além disso, já foram identificadas populações de
H. hampei resistentes ao ENDOSULFAN (ORTIZ, A. et al., 2004).
Uma alternativa viável para o controle da broca-do-café pode ser alcançada com
a introdução de genes em plantas de café, via transformação genética. Vários
insetos-praga de plantas já foram controlados com a introdução de genes de resistência. As
toxinas Bt têm sido usadas para este fim em 98% dos casos (HAQ, S. K. et al., 2004), mas diversos genes, incluindo -1,3 glucanases, quitinases, lecitinas, arcelinas e
inibidores de enzimas digestivas, também têm sido usados para controlar
insetos-praga (CARLINI, C. R.GROSSI-DE-SA, M. F., 2002).
Os inibidores de -amilase pertencem à classe de inibidores de enzimas
digestivas e sua atividade consiste em inibir a atividade das -amilases
(MARSHALL, J. J.LAUDA, C. M., 1975), enzimas responsáveis pela hidrólise de
ligações glicosídicas -1,4 em amido, glicogênio e vários oligossacarídeos (PAYAN,
F., 2004). O bloqueio por um inibidor da atividade das -amilases de um inseto
provoca redução da assimilação de carboidratos, com consequências prejudiciais
para larvas em desenvolvimento, podendo levar à morte do inseto (KLUH, I. et al., 2005). Muitos inibidores de -amilase já foram isolados e caracterizados de diversas
fontes vegetais (FRANCO, O. L. et al., 2002); porém, dois deles, -AI1 e -AI2, foram caracterizados mais detalhadamente (LEE, S. C. et al., 2002). Estes dois inibidores, isolados do feijão Phaseolus vulgaris, se mostraram ativos contra vários insetos, como, por exemplo, Bruchus pisorum, Callosobruchus maculatus e Callosobruchus chinensis (FRANCO, O. L. et al., 2002).
Devido ao seu potencial em inibir -amilases de insetos-alvo, o inibidor -AI1
já foi utilizado no desenvolvimento de plantas geneticamente modificadas resistentes
a insetos. Várias plantas já foram transformadas: Vigna radiata (SONIA et al., 2007), V. unguiculata (SOLLETI, S. K. et al., 2008), feijão azuki (ISHIMOTO, M. et al., 1996), grão-de-bico (IGNACIMUTHU, S.PRAKASH, S., 2006) e ervilha
(SCHROEDER, H. E. et al., 1995). Esta última já foi avaliada de várias formas, sendo eficiente em controlar a broca-da-ervilha (MORTON, R. L. et al., 2000), mesmo em condições adversas de temperatura e irrigação (DE SOUSA-MAJER, M.
inibidor um excelente gene candidato para conferir resistência a H. hampei em plantas de café.
Assim sendo, o objetivo deste trabalho foi introduzir por biobalística o gene
para o inibidor -AI1 em plantas de Coffea arabica, visando o controle da broca-do-café. A caracterização molecular das plantas obtidas foi realizada, confirmando a
inserção do gene e a sua expressão dirigida para os grãos de café. Adicionalmente,
o inibidor expresso teve sua atividade avaliada por ensaios in vitro contra as - amilases de H. hampei.
Este trabalho se justifica porque a broca-do-café é o principal inseto-praga do
cafeeiro, causando anualmente centenas de milhões de dólares em prejuízos
(PAVA-RIPOLL, M. et al., 2008). Este inseto está presente em vários países produtores, incluindo o Brasil, o maior produtor mundial. Nenhum dos métodos usados para
controlar o H. hampei é eficiente, e o controle químico é feito mediante a aplicação de um inseticida tóxico para o homem e o meio ambiente (DAMON, A., 2000).
Adicionalmente, não se tem conhecimento de resistência natural à broca-do-café em
nenhuma das 104 espécies do gênero Coffea. Além disso, diferenças na ploidia entre Coffea arabica e as outras espécies dificultam a introdução de resistência por meio de cruzamentos (BERTRAND, B. et al., 2003). O desenvolvimento de plantas transgênicas de café resistentes à broca-do-café diminuirá os prejuízos causados
por esta praga, além de reduzir os custos com a utilização de inseticidas. Esta
medida poderá tornar o café brasileiro mais competitivo no mercado internacional e
diminuirá a poluição causada ao meio ambiente.
A realização deste trabalho foi possível graças à disponibilidade de técnicas
de transformação genética já desenvolvidas para o café (HATANAKA, T. et al., 1999; DUFOUR, M. et al., 2000; LEROY, T. et al., 2000; OGITA, S. et al., 2003), que permitiram o desenvolvimento de um protocolo de transformação de calos
embriogênicos via biobalística (ALBUQUERQUE, E. V. S.;CUNHA, W.
G.;BARBOSA, A. E. A. D.;COSTA, P. M. et al., 2009).
Durante o desenvolvimento deste trabalho, houve a oportunidade de
desenvolver outras linhas de pesquisa no Laboratório de Interação Molecular
Planta-Praga que resultaram em publicações não relacionadas com o tema da tese, as
2. REVISÃO DA LITERATURA
2.1 IMPORTÂNCIA ECONÔMICA E CARACTERÍSTICAS DO CAFÉ
O cafeeiro (Coffea spp.) é uma planta arbustiva cujos graõs são colhidos, torrados, moídos e utilizados para fazer uma infusão apreciada em todo o mundo. O
consumo deste grão tem origens muito antigas, datadas do ano 600 d.C. na região
da Etiópia. No princípio, o café era consumido in natura por pastores de cabras para aumentar a atenção durante o trabalho. Logo o seu uso se difundiu entre esses
trabalhadores, que passaram a usar os grãos secos e torrados no preparo de uma
bebida com água quente (ENCARNAÇÃO, R. D. O.LIMA, D. R., 2003). Por volta do
ano 900 d.C., o café já era consumido por muitas pessoas em todo o mundo árabe.
Até o profeta Maomé recomendava o uso da bebida a seus sacerdotes para que
permanecessem acordados durante as orações. O ocidente passou a conhecer o
café somente durante as cruzadas (1096-1244). Nesta época, os soldados turcos
consumiam a bebida para ficarem mais ativos durante as batalhas. Este fato fez
com que o caféfosse evitado por muito tempo pelos cristãos. O seu consumo só foi
permitido para estes depois do século XVI, quando o Papa Clemente VIII
(1478-1534) provou a bebida, que além de saborosa o permitia ficar acordado por mais
tempo durante as suas orações. Dessa forma, o Sumo Pontífice autorizou o
consumo de café, que logo passou a ser utilizado em larga escala por toda a Europa
(ENCARNAÇÃO, R. D. O.LIMA, D. R., 2003). Atualmente, o café é consumido em
todo o mundo, sendo a segunda maior “commodity” natural, atrás apenas do
petróleo. O café é também a segunda bebida mais consumida (ENCARNAÇÃO, R.
D. O.LIMA, D. R., 2003), sendo ingerido regularmente por mais de 40% da
população mundial (HENDRE, P. S. et al., 2008).
No ano de 2008, a produção mundial de café alcançou 134 milhões de sacas
(60 kg), e o Brasil foi o principal produtor, colhendo aproximadamente 46 milhões de
sacas (34% do total), seguido por Vietnã (14,5 %) e Colômbia (9,17%) (ICO, 2009).
Além desses, o café é produzido e exportado por mais 46 países, localizados na
África, Américas do Sul e Central, Ásia e Oceania (ICO, 2009). No Brasil, o café é
produzido em 15 estados, mas os principais produtores são MG, ES, SP e BA
O comércio mundial do grão de café gera um rendimento de US$ 70 bilhões
por ano (PAVA-RIPOLL, M. et al., 2008) e fornece emprego para 25 milhões de pessoas em todo o mundo (WATSON, K.ACHINELLI, M. L., 2008). Atualmente, o
maior consumidor mundial de café são os Estados Unidos da América e em segundo
lugar está o Brasil (ENCARNAÇÃO, R. D. O.LIMA, D. R., 2003). Adicionalmente,
países como Alemanha, Itália, Japão, Bélgica, França e Espanha destacam-se como
grandes importadores e consumidores de café (ICO, 2009).
O cafeeiro pertence à Ordem Gentianales, Família Rubiaceae e em seu
gênero (Coffea) podemos encontrar 104 espécies e subespécies (NCBI, 2009). Evolutivamente, o início da diversificação do gênero Coffea ocorreu entre 5 e 25 milhões de anos atrás (CUBRY, P. et al., 2008). No entanto, apenas duas espécies são plantadas comercialmente, C. arabica e C. canephora, correspondendo, respectivamente, a 70% e 30% do mercado internacional (PRIVAT, I. et al., 2008).
Coffea arabica é uma espécie alotetraplóide (2n = 4x = 44), originada de dois ancestrais diplóides, C. canephora e C. eugenioides (LASHERMES, P. et al., 1999). Devido à autopolinização de suas flores, a espécie é caracterizada por uma baixa
diversidade genética e alta sensibilidade a insetos e doenças (HATANAKA, T. et al., 1999). O tamanho do seu genoma foi calculado em 2,56 x 109 pb (CLARINDO, W.
R.CARVALHO, C. R., 2009). A origem de C. arabica, a partir de duas espécies com genomas muito parecidos, faz com que a meiose nessa planta tetraplóide seja como
uma meiose de planta diplóide, apresentando um pareamento regular dos bivalentes
cromossômicos (HERRERA, J. C. et al., 2004). As duas variedades de café arábica mais plantadas comercialmente são a Mundo Novo e a Catuaí. A variedade Mundo
novo é caracterizada por uma alta produtividade, mas o porte alto da planta dificulta
a colheita. A variedade catuaí foi desenvolvida objetivando-se plantas de menor
porte, sendo as duas variedades principais a Catuaí Vermelho e a Catuaí Amarelo
(CAFEZAL, O., 2010).
Coffea canephora é uma espécie diplóide (2n = 2x = 22), a exemplo de todas as outras espécies conhecidas do gênero Coffea, possuindo variabilidade genética considerável (BERTRAND, B. et al., 2003). Entretanto, produz um café de menor qualidade, mais adequado à produção de café solúvel (HATANAKA, T. et al., 1999). O seu genoma foi calculado em 1,38 x 109 pb (CLARINDO, W. R.CARVALHO, C. R.,
produtividade. O café conillon também é muito utilizado como porta enxerto, devido a
sua resistência ao nematóide Meloidogyne ingocnita (CAFEZAL, O., 2010).
Apesar das diferenças cromossômicas numéricas entre as duas espécies
cultivadas de cafeeiro, é possível a transferência de características de interesse
entre elas, principalmente relacionadas à defesa contra patógenos (HERRERA, J. C.
et al., 2002). Por exemplo, por meio de cruzamentos, já foram introduzidas em C. arabica resistência à ferrugem do cafeeiro, a nematóides e ao fungo Colletotrichum kahawae (BERTRAND, B. et al., 2003). Basicamente, esta transferência ocorre pela utilização de híbridos entre C. arabica e C. canephora. Uma variedade muito utilizada com esse fim é a arabusta, que é tetraplóide (HERRERA, J. C. et al., 2002), mas espécies triplóides e hexaplóides, produzidas artificialmente com a utilização de
colchicina, também estão disponíveis (HERRERA, J. C. et al., 2004). No entanto, essa transferência por cruzamentos é muito difícil e demorada, devido ao longo ciclo
de vida do cafeeiro, e aos elevados custos dos experimentos de campo e avaliação
da progênie (HERRERA, J. C. et al., 2007). Adicionalmente, a transferência de características genéticas relacionadas com a defesa está associada, também, com a
transferência de genes indesejáveis que podem diminuir a qualidade da bebida
(BERTRAND, B. et al., 2003).
2.2 INSETOS-PRAGA E FITOPATÓGENOS NA CULTURA DO CAFEEIRO
As espécies cultivadas de café, C. arabica e C. canephora, são atacadas por uma série de insetos-praga e patógenos como fungos, ácaros e nematóides
endoparasíticos, que causam bilhões de dólares em prejuízos anualmente. Os
principais patógenos e insetos-pragas do café estão descritos abaixo.
A ferrugem do café é causada pelo fungo Hemileia vastatrix. Este patógeno já causou perdas de até 30% no Brasil e 70% na índia, ocasionando em todo mundo
um prejuízo anual de US$ 1 bilhão. Devido a essas perdas, muitos trabalhos já
caracterizaram vários genes de resistência à ferrugem presente em diversas
Vários nematóides atacam as raízes do café, e a espécie que causa mais
prejuízos é o Meloidogyne exigua, patógeno presente em toda a América latina, e no Brasil já causou perdas de até 45% (ALPIZAR, E. et al., 2007). Outras espécies de nematóide do gênero Meloidogyne também causam danos ao café, como M. hapla (HANDOO, Z. A. et al., 2005), M. arabicida (BERTRAND, B. et al., 2000) e M. incognita (HERNANDEZ, A. et al., 2004).
Três espécies de ácaros são conhecidas por atacar o café: o
ácaro-vermelho-do-cafeeiro (Olgonychus ilicis), o ácaro-plano (Brevipalpus phoenicis) e o ácaro-branco (Polyphagotarsonemus latus). Esses aracnídeos atacam as folhas do cafeeiro, causando principalmente a queda delas (ZAMBOLIN, L., 2003).
Dentre os insetos que atacam o cafeeiro, podemos citar o bicho-mineiro
(Leucoptera coffeella), as cigarras (Quesada gigas, Fidicina pronoe e Carneta sp), as cochonilhas (Coccus viridis, Saissetia Coffeae e Planococus citri), a lagarta-dos-cafezais (Eacles imperiallis magnífica) e a broca-do-café (Hypothememus hampei), sendo o último considerado o inseto-praga de maior importância (ZAMBOLIN, L.,
2003).
O bicho-mineiro (Leucoptera coffeella) é considerado uma das principais pragas do cafeeiro. Este inseto ataca as folhas localizadas nas partes médias e
superiores da planta, causando perfurações em formato de minas que reduzem a
área fotossintética (ZAMBOLIN, L., 2003). Estes danos podem levar à queda
prematura das folhas atacadas, principalmente durante a estação seca, provocando
a diminuição da produtividade da planta. Seu controle é feito, principalmente, com o
uso de inseticidas organofosfatos (FRAGOSO, D. B. et al., 2002). Adicionalmente, o gene para a toxina cry1Ac foi introduzido em plantas de C. arabica e C. canephora com o objetivo de controlar essa praga (LEROY, T. et al., 2000; PERTHUIS, B. et al., 2005).
As cigarras (Quesada gigas, Fidicina pronoe e Carneta sp) causam dano ao cafeeiro sugando sua seiva. Esta ação dos insetos promove a clorose e a queda das
folhas apicais, bem como o enfraquecimento geral da planta (ZAMBOLIN, L., 2003).
As cochonilhas Coccus viridis, Saissetia Coffeae e Planococcus citri podem atacar várias partes da planta, sugando a seiva de folhas jovens, caule e frutos. A
secreção produzida por esse inseto favorece o crescimento do fungo fumagina
A lagarta-do-café, Eacles imperiallis magnífica, alimenta-se de folhas jovens e brotos terminais do cafeeiro, acarretando danos severos (ZAMBOLIN, L., 2003).
2.2.1 A broca-do-café
A broca-do-café, Hypothenemus hampei (Ferrari, 1867) (Coleoptera: Scolytidae) (Figura 1) é o inseto que mais causa prejuízos à cultura do cafeeiro,
estando presente em quase todos os países produtores (BENAVIDES, P. et al., 2005; JARAMILLO, J. et al., 2006). Essa praga causa perdas de até US$ 500 milhões por ano em todo o mundo (PAVA-RIPOLL, M. et al., 2008) e afeta a vida de mais de 20 milhões de famílias rurais (JARAMILLO, J. et al., 2006). Grandes infestações da broca-do-café já chegaram a causar prejuízos de até 60% na Colômbia, 85% na
Jamaica, 90% na Malásia e 60% no México (JARAMILLO, J. et al., 2008). No Brasil, particularmente no estado do Espírito Santo, a broca-do-café chegou a causar, em
termos quantitativos, a destruição anual de aproximadamente 154.000 sacas de
café, correspondendo a um valor aproximado de R$ 18 milhões, que, acrescidos de
R$ 22,0 milhões depreciados do valor do produto em função da perda de qualidade,
Figura 1. Fêmea de Hypothenemus hampei sobre um grão de café.
A broca-do-café causa danos somente aos frutos e grãos do café. No campo,
as fêmeas adultas são atraídas por liberações voláteis dos frutos maduros, que são
compostas principalmente por etanol, ésteres, outros alcoóis, cetonas e aldeídos
(ORTIZ, A. et al., 2004). Após alcançar o fruto, as fêmeas perfuram o exocarpo, o mesocarpo e o endocarpo da semente em até 8 horas. (DAMON, A., 2000; ORTIZ,
A. et al., 2004). Neste último, elas permanecem para alimentar-se e depositar seus ovos. Essas perfurações causam seis tipos de perdas econômicas (SOUZA, J.
C.REIS, P. R., 1997):
1) perda de peso do café beneficiado, devido à destruição causada pelas
larvas;
2) depreciação do produto devido à perda da qualidade causada pelos danos
físicos, que, além disso, tornam os frutos do café mais susceptíveis a infecções por
fungos e bactérias e ao ataque de outras pragas;
3) ataque de frutos verdes na ausência de frutos maduros, provocando a sua
a queda;
4) apodrecimento das sementes em frutos broqueados, que caem
5) inviabilidade de produção de sementes de café, já que os frutos atacados
não germinam;
6) perda de mercado externo, pois os países importadores não aceitam café
broqueado.
O H. hampei possui um ciclo de vida curto, passando da fase de ovo à fase adulta em um período de 28 a 34 dias (DAMON, A., 2000). Cada fêmea põe entre 31
e 119 ovos dentro de um único fruto de café, numa proporção de 9 fêmeas para
cada macho (BENAVIDES, P. et al., 2005). Essa proporção (9:1) ocorre em função da presença de uma proteobactéria do gênero Wolbachia, presente nos tecidos reprodutivos, que causa a morte dos machos e conversão de machos em fêmeas
funcionais. A ovoposição pode durar por até 20 dias, quando são postos, em média,
de 2 a 3 ovos por dia (JARAMILLO, J. et al., 2006). Essa longa ovoposição e o rápido ciclo de vida permitem, ao mesmo tempo, e em um mesmo grão, a presença
de todas as formas de vida deste inseto (DAMON, A., 2000).
Os ovos eclodem após 4 dias e passam pelos estágios de larva (15 dias),
pulpa (7 dias) e adulto. Os machos, que medem 1,18 mm de comprimento, 0,51 mm
largura e 0,55 mm de altura, são menores do que as fêmeas, não voam e podem
viver de 20 a 87 dias. As fêmeas medem 1,65 mm de comprimento, 0,67 mm de
largura e 0,73 mm de altura, e vivem mais, podendo alcançar até 157 dias (SOUZA,
J. C.REIS, P. R., 1997; DAMON, A., 2000; BENAVIDES, P. et al., 2005). Geralmente, antes de se dispersarem para infectar outros frutos, as novas fêmeas
cruzam com seus próprios irmãos (BENAVIDES, P. et al., 2005). Esses cruzamentos consanguíneos geram uma baixa variabilidade genética na espécie, mesmo
comparando-se insetos geograficamente distantes (BENAVIDES, P. et al., 2005). Ao iniciar a ovoposição em um novo grão, os músculos das asas da fêmea se
degeneram, prevenindo a colonização de frutos adicionais. Contudo, caso o grão
seja totalmente consumido, as fêmeas podem se deslocar para frutos adjacentes
(DAMON, A., 2000).
A espécie C. canephora é a mais susceptível ao ataque da broca, provavelmente porque apresenta uma floração irregular durante todo o ano, sempre
com frutos em diferentes estágios de desenvolvimento. Além disso, seu plantio é
realizado em regiões quentes, o que favorece o ciclo do inseto (GUERREIRO,
São utilizados três métodos de controle para a broca-do-café: cultural,
biológico e químico (SOUZA, J. C.REIS, P. R., 1997). Porém, o H. hampei é muito difícil de ser controlado, pois passa o ciclo inteiro dentro do fruto do café, ficando
protegido da ação de inseticidas e predadores. Mesmo venenos de contato não
conseguem atravessar a dura carapaça do inseto, estando o controle químico
restrito à aplicação do inseticida ENDOSULFAN (DAMON, A., 2000). Porém, em
alguns países das Américas do Sul e Central, onde as plantações de café são
adensadas e em topografia acidentada, a aplicação deste inseticida é mais difícil,
pois o terreno nesses locais não permite a mecanização da lavoura (SOUZA, J.
C.REIS, P. R., 1997). Adicionalmente, o ENDOSULFAN já foi banido em diversos
países por ser carcinogênico e altamente tóxico para o meio ambiente, além de
apresentar um efeito residual por 7,5 meses, o que sugere uma possível
contaminação dos grãos de café armazenados (DAMON, A., 2000). Para agravar
ainda mais a situação, já foram encontrados H. hampei resistentes ao inseticida ENDOSULFAN (ORTIZ, A. et al., 2004).
O controle cultural da broca-do-café consiste, basicamente, em apanhar os
frutos caídos no chão, evitando a reprodução do inseto durante a entressafra. No
entanto, esse método é difícil, principalmente em cafezais muito adensados, pois
exige uma grande quantidade de mão-de-obra. É aconselhável eliminar do cafezal
os cafeeiros não explorados comercialmente, como, por exemplo, plantas
improdutivas e lavouras abandonadas, evitando, assim, a reprodução descontrolada
do inseto. Também podem ser usadas armadilhas contendo feromônios ou etanol
(SOUZA, J. C.REIS, P. R., 1997).
O controle biológico da broca-do-café tem baixa eficiência. As tentativas feitas
com as vespas parasitóides Prorops nasuta e Cephalonomia stephanoderis mostraram pouca eficácia. Liberações em massa do parasitóide Phymastichus coffea, durante a fase de emergência de H. hampei, alcança resultados mais satisfatórios (JARAMILLO, J. et al., 2006), mas apenas em pequenas propriedades.
Outros fatores dificultam ainda mais o controle da broca. A fêmea, por
exemplo, permanece semi-inativa na estação seca, esperando pelas chuvas que a
estimulam a sair dos frutos velhos e procurar novos frutos para reiniciar o ciclo. A
broca também pode atacar outras famílias de plantas, o que torna difícil a sua total
eliminação caso exista, por exemplo, algum remanescente de mata próximo à
2.3. PROTEÍNAS DE DEFESA A INSETOS E TRANSGENIA
Atualmente, vários genes vêm sendo utilizados com sucesso no
desenvolvimento de plantas geneticamente modificadas resistentes a insetos, entre
eles as toxinas Bt, -1,3 glucanases, quitinases, lecitinas, arcelinas e inibidores de
enzimas digestivas, hormônios de insetos, neuropeptídios, toxinas de artrópodes e
metabólitos secundários (BURGESS, E. P. J. et al., 1994; GROSSI-DE-SÁ, M. F. et al., 1997; BISHOP, J. G. et al., 2000; SALES, M. P. et al., 2000; CARLINI, C. R.GROSSI-DE-SA, M. F., 2002; BELLINCAMPI, D. et al., 2004; WHETSTONE, P. A.HAMMOCK, B. D., 2007). Um levantamento feito em 2005 catalogou 30 plantas
transgênicas com toxinas Bt, 18 com inibidores de proteinase serínicas, 3 com
inibidores de proteinase cisteínicas, 8 com lectinas, e uma planta de cada
transformadas com as proteínas “Avidin”, “Enhancin”, colesterol oxidase, “germin”,
proteinase cisteínica de milho e peptídeo inseticida de aranha (O’CALLAGHAN, M.
et al., 2005).
O desenvolvimento de plantas transgênicas com resistência a insetos
apresenta inúmeras vantagens sobre os métodos tradicionais de controle. Por
exemplo, a planta produz continuamente a molécula inseticida, eliminando a
necessidade de várias aplicações de inseticidas; as substâncias ativas estão
protegidas contra degradação por fatores ambientais, como UV, calor e chuvas; e o
inseto entra em contato com as toxinas logo no início do ataque (WHETSTONE, P.
A.HAMMOCK, B. D., 2007).
Atualmente, os genes cry, que codificam as toxinas Bt, são amplamente utilizados para conferir resistência a insetos em plantas, sendo empregados em 98%
dos casos (HAQ, S. K. et al., 2004). Depois de plantas com resistência a herbicidas, as plantas transgênicas que expressm toxinas Bt são as mais usadas
comercialmente (O’CALLAGHAN, M. et al., 2005). No ano de 2007, foram plantados 42 milhões de hectares somente com plantas de algodão e milho contendo genes
cry (TABASHNIK, B. E., 2008). As toxinas Bt apresentam 54 tipos e muitos subtipos; no entanto, cada toxina é específica para um pequeno número de insetos.
Atualmente, apenas 12 toxinas têm sido usadas comercialmente (BRAVO,
A.SOBERON, M., 2008). Apesar do grande número de trabalhos sobre toxinas Bt,
não se sabe exatamente o modo de ação delas. Basicamente, essas proteínas são
et al., 2007). Estas são clivadas por proteases do intestino, tornando-se ativas. Após a ativação, elas são capazes de se ligar a receptores caderina nas microvilosidades
do intestino delgado dos insetos (ZHUANG, M. B. et al., 2002). A partir desse ponto, dois modos de ação são descritos. O primeiro, que é o mais aceito, envolve a
formação de poros na membrana do intestino delgado dos insetos por meio da ação
das caderinas e outros receptores de membrana que promovem clivagens
proteolíticas e oligomerização das moléculas de toxina, levando à formação dos
poros e, consequentemente, à morte do inseto (BRAVO, A.SOBERON, M., 2008). O
segundo modo de ação envolve a ligação das toxinas aos receptores caderina, e
estes disparam uma cascata de sinalização que leva à morte celular (ZHANG, X. B.
et al., 2006). Este complexo modo de ação em vários passos pode facilitar o aparecimento de insetos resistentes a toxinas Bt, e muitos já foram identificados.
Recentemente, este fato levou à busca de formas de manejo que minimizassem o
aparecimento de insetos resistentes a plantas transgênicas com Bt (TABASHNIK, B.
E., 2008).
Os inibidores de enzimas digestivas apresentam diversas vantagens para
conferir resistência a insetos. Estes inibidores são produtos genéticos primários, o
que facilita o uso deles em experimentos de transformação. A disponibilidade de
diversos genes obtidos de origens diferentes é outra vantagem que torna possível o
desenvolvimento de plantas transgênicas com dois ou mais genes de resistência. Os
inibores possuem um amplo espectro de ação, já tendo sido observados inibidores
de proteinases ativos contra nematóides, vírus, bactérias e fungos patogênicos,
tendo cada inibidor sua especificidade característica (HAQ, S. K. et al., 2004; O’CALLAGHAN, M. et al., 2005).
Dentro da classe de inibidores de enzimas digestivas, podemos encontrar os
inibidores de -amilases (MARSHALL, J. J.LAUDA, C. M., 1975). As -amilases (
-1,4-glucan-4-glucanohidrolase, EC 3.2.1.1) são um grupo de enzimas largamente
distribuídas em secreções de microorganismos, animais e plantas, e que catalisam,
principalmente, a hidrólise de ligações glicosídicas -1,4 em amido, glicogênio e
vários oligosacarídeos (PAYAN, F., 2004). Outras -amilases podem quebrar
exclusivamente ligações glicosídicas -1,6 ou -1,4/-1,6, podendo também clivar
resíduos de sacarose, ou podem hidrolisar uma forma de glicose ligada a trealose
constitui o primeiro passo da degradação enzimática de polissacarídeos, que é
essencial na assimilação de carboidratos (PAYAN, F., 2004). Nos insetos, o bloqueio
desta atividade das amilases por inibidores causa uma redução na assimilação de
carboidratos, provocando uma diminuição do crescimento larval e,
consequentemente, prejudicando todo o seu ciclo de vida (KLUH, I. et al., 2005). Vários inibidores de -amilases já tiveram suas estruturas tridimensionais
caracterizadas, tanto isoladamente quanto complexada com -amilases, como, por
exemplo, o inibidor de Amaranthus hypochondriacus (LU, S. et al., 1999; MARTINS, J. C. et al., 2001) e o inibidor de centeio (IULEK, J. et al., 2004). O inibidor AI-1 de Phaseolus vulgaris foi analisado complexado com a -amilase do inseto Tenebrio molitor (Figura 2) (NAHOUM, V. et al., 1999).
Com relação à estrutura terciária dos inibidores de -amilases, pode-se
dividi-los em seis classes (tipo lectina, knotina, cereal, Kunitz, γ-purotionina e thaumatina),
e todas podem ser utilizadas no controle de insetos-praga em plantas. Estas classes
de inibidores mostram notável variedade estrutural, apresentando diferentes tipos de
inibição, assim como especificidade variável contra diferentes fontes de α-amilases
(FRANCO, O. L. et al., 2002; BELLINCAMPI, D. et al., 2004). Por exemplo, foi isolado em batata doce (Ipomoea batatas) um inibidor de α-amilase que se mostrou eficiente contra 4 pragas que atacam raízes: Araecerus fasciculatus, Sitophilus oryzae, Cylas formicarius elegantulus e Tribolium castaneum (REKHA, M. R. et al., 2004). Foi isolado um inibidor das sementes da planta Amaranthus hypocondriacus com atividade contra Tribolium castaneum e Prostephanus truncatus, e que não inibia α-amilases de mamíferos (CHAGOLLA-LOPEZ, A. et al., 1994). Do centeio foi isolado um inibidor com atividade contra Acanthoscelides obtectus e Zabrotes subfasciatus (IULEK, J. et al., 2000). A planta Pterodon pubescens possui um inibidor ativo contra Callosobruchus maculatus (SILVA, D. P. et al., 2007). Do feijão Phaseolus coccineus foi caracterizado um inibidor ativo contra a broca-do-café (DE AZEVEDO PEREIRA, R. et al., 2006; VALENCIA-JIMENEZ, A. et al., 2008). Podemos citar, também, a atividade contra α-amilases de fungos, observada num
Figura 2. (A) Estrutura tridimensional do inibidor -AI1, de Phaseolus vulgaris, complexado com (B) a
-amilase do inseto Tenebrio molitor. Esta estrutura foi obtida no “Protein Data Bank” (PDB, 2009), possui o número de acesso 1VIW, e a imagem foi gerada usando o programa VMD.
Da mesma forma, inibidores de -amilases têm sido isolados de diferentes
acessos e variedades de feijão Phaseolus vulgaris (FRANCO, O. L. et al., 2002; LEE, S. C. et al., 2002). Duas formas são bem caracterizadas, -AI1 e -AI2. Estas duas variantes apresentam especificidades inibitórias diferentes, inibindo -amilases
de diferentes organismos (MORENO, J.CHRISPEELS, M. J., 1989; SUZUKI, K. et al., 1994; GROSSI-DE-SÁ, M. F. et al., 1997). Elas são 78% idênticas (SUZUKI, K. et al., 1994), e essas diferenças nas seqüências de resíduos de aminoácidos, formadas por deleções e mutações, provocaram mudanças no número de ligações
ponte de hidrogênio entre o inibidor e as -amilases alvo. Isto é o que ocasiona as
O inibidor -AI1 é sintetizado no retículo endoplasmático, na forma de uma
pró-proteína inativa, com peso de 28 kDa. No complexo de golgi, essa proteína tem
o peptídeo sinal retirado e é glicosilada, deixando-a com um peso aproximado de 32
kDa (PUEYO, J. J. et al., 1993). Este inibidor torna-se ativo após um processamento proteolítico que ocorre no interior dos vacúolos de armazenamento da planta, onde
acontece a remoção de um pequeno fragmento na extremidade carboxílica e uma
digestão no aminoácido Asn77, liberando duas subunidades, e (PUEYO, J. J. et al., 1993).
Observou-se que uma molécula do inibidor -AI1 é capaz de inibir duas
moléculas de -amilase pancreática de porco (KASAHARA, K. et al., 1996). O peso molecular dessas duas subunidades foi determinado precisamente por MALDI-TOF,
tendo a subunidade 11.761 Da, e a subunidade 17.319 Da (YOUNG, N. M. et al., 1999). Da mesma forma, esse processamento proteolítico ocorre no inibidor -AI2,
conferindo às subunidades e os pesos de 11.010 Da e 15.353 Da,
respectivamente (YOUNG, N. M. et al., 1999). No entanto, a forma ativa desses dois inibidores é composta de duas subunidades e duas , o que explica o fato da
inibição simultânea de duas -amilases (KASAHARA, K. et al., 1996). O peso molecular desse tetrâmero ativo foi calculado em 56,7 kDa para o inibidor -AI1
(LEE, S. C. et al., 2002).
O mecanismo de inibição do -AI1 foi estudado por difração de raios-X,
juntamente com a -amilase de T. molitor (Figura 2), e até o momento esta foi a única interação com amilase de inseto estuda por essa abordagem (NAHOUM, V. et al., 1999). Esta análise indicou que fortes contatos ocorrem entre o inibidor e o sítio catalítico de T. molitor. Dois “loops” do inibidor (Resíduos 29-46 e 171-189) se projetam para dentro do sítio ativo da -amilase, estabelecendo uma rede de pontes
de hidrogênio (Figura 2). Os resíduos de aminoácidos do sítio ativo da -amilase se
ligam fortemente aos resíduos Try 186 e Tyr 37 do inibidor -AI1, que bloqueiam o
seu sítio ativo (PAYAN, F., 2004). As pontes de hidrogênio são formadas
diretamente com o sítio ativo do inibidor ou por intermédio de moléculas de H2O.
Interações hidrofóbicas e interações proteína-proteína aumentam a força de ligação
entre o inibidor e a -amilase fora da região do sítio ativo. Essas ligações provocam
na área próxima ao sítio ativo. Essas mudanças aumentam a força de ligação do
inibidor (BOMPARD-GILLES, C. et al., 1996; OBIRO, W. C. et al., 2008).
As interações do inibidor -AI1 também já foram estudadas para a -amilase
pancreática de porco (SANTIMONE, M. et al., 2004) e humana (NAHOUM, V. et al., 2000), e o mecanismo de inibição é muito similar. Um estudo das interações do
inibidor -AI2 com a -amilase de Zabrotes subfasciatus foi feito por modelagem molecular e demonstrou algumas similaridades (DA SILVA, M. C. et al., 2000).
A atividade desses inibidores de α-amilases do feijão comum tem-se
mostrado bastante eficiente, por exemplo, contra bruquídeos que infestam sementes
armazenadas. Demonstrou-se que o inibidor -AI1 inibe as -amilases de três
bruquídeos do velho mundo: a broca da ervilha (Bruchus pisorum), a broca do feijão-de-corda (Callosobruchus maculatus) e da broca do feijão azuki (Callosobruchus chinensis) (FRANCO, O. L. et al., 2002). O inibidor -AI2 inibe as α-amilases de Zabrotes subfasciatus (GROSSI-DE-SÁ, M. F. et al., 1997). Experimentos in vitro demonstraram que o inibidor -AI1 de Phaseolus vulgaris inibe a atividade das duas
-amilases presentes na broca-do-café (H. hampei) (VALENCIA, A. et al., 2000). Devido à alta eficiência dos inibidores de α-amilase de P. vulgaris, eles foram utilizados no desenvolvimento de diversas plantas transgênicas para o controle de
insetos-praga. A mais bem caracterizada até o momento foi a planta de ervilha
(Pisum sativum L.) transformada com o inibidor -AI1 para o controle da broca-da-ervilha (Bruchus pisorum) (SCHROEDER, H. E. et al., 1995). Esta planta foi transformada por Agrobacterium tumefasciens usando o inibidor -AI1 sob o controle do promotor da fitohemaglutinina. A expressão do inibidor alcançou concentrações
entre 1 e 2%, o que controlou a broca da ervilha com extrema eficiência. Essas
plantas foram avaliadas até a geração T5, confirmando a integração estável do
transgene no genoma (SCHROEDER, H. E. et al., 1995). Uma avaliação nutricional mostrou a ausência de efeitos nocivos em ratos alimentados com 30% de ervilhas
transgênicas (PUSZTAI, A. et al., 1999). Experimentos realizados em campo demonstraram que plantas transformadas com o inibidor AI-1 foram eficientes em
eliminar a broca-da-ervilha, causando a morte dos insetos no segundo instar. Ao
mesmo tempo, plantas transformadas com o inibidor -AI2 não foram tão eficientes
resultados mostraram que a concentração expressa do inibidor nessas raízes não
diminuiu quando expostas a estresse hídrico. No entanto, ocorreu uma redução de
36,6% do inibidor nas plantas transgênicas em condições de estresse de
temperatura (DE SOUSA-MAJER, M. J. et al., 2004). Um recente trabalho mostrou que essas plantas chegam a eliminar de 93 a 98% dos insetos (DE SOUSA-MAJER,
M. J. et al., 2007).
Adicionalmente, foram desenvolvidas plantas transgênicas de Vigna radiata (SONIA et al., 2007), V. unguiculata (SOLLETI, S. K. et al., 2008), feijão azuki (ISHIMOTO, M. et al., 1996) e grão-de-bico (Cicer arietinum) (IGNACIMUTHU, S.PRAKASH, S., 2006) expressando o inibidor -AI1, com o intuito de controlar
insetos-praga nessas plantas. Estes trabalhos atestam a eficiência do uso de
inibidores de α-amilases em plantas transgênicas com o objetivo de controlar insetos
praga.
2.4. METODOLOGIAS DE TRANSFORMAÇÃO DO CAFÉ
Os procedimentos de cultivo in vitro e transformação do cafeeiro são tecnicamente complicados, visto que a regeneração dos explantes demora vários
meses. Da mesma forma, o crescimento das mudas obtidas dura alguns anos até a
primeira frutificação. No entanto, essas desvantagens são pequenas perto das
dificuldades do melhoramento convencional do cafeeiro, que pode prolongar-se por
até 30 anos (RIBAS, A. F. et al., 2005). A despeito dessas dificuldades, vários protocolos de transformação e regeneração para C. arabica e C. canephora já foram publicados, utilizando diversas metodologias.
O primeiro protocolo para transformação de plantas do gênero Coffea consistiu em transformar plantas de C. canephora por Agrobacterium rhizogenes (SPIRAL, J. et al., 1993). No entanto, este protocolo obteve uma baixa eficiência de transformação. Outro protocolo para transformar plantas de C. canephora por A. tumefaciens foi publicado anos depois, sendo mais eficiente do que o primeiro (HATANAKA, T. et al., 1999).
um gene de interesse em plantas de café e ainda conseguiu controlar o inseto-alvo.
Uma avaliação experimental em campo da planta de café com o gene cry1Ac durante 4 anos mostrou que a taxa de plantas infectadas foi reduzida de 70%, nas
plantas controle negativo, para menos de 10% nas plantas transgênicas. O número
de insetos encontrados nas plantas transgênicas foi consideravelmente menor do
que nas plantas controle (PERTHUIS, B. et al., 2005).
Outro uso aplicado da transformação genética de café foi usado no
desenvolvimento de plantas de C. arabica e C. canephora com uma menor concentração de cafeína (OGITA, S. et al., 2003; OGITA, S. et al., 2004). Estas plantas foram transformadas via A. tumefaciens usando construções que produziam RNAi para genes da via de biossíntese da cafeína. Elas apresentaram uma redução
de 70% do conteúdo de cafeína (OGITA, S. et al., 2003; OGITA, S. et al., 2004). O primeiro protocolo relatando uma transformação estável de café por
bombardeamento de micropartículas foi publicado para a planta C. canephora (RIBAS, A. F. et al., 2005).
Plantas de C. canephora transgênicas resistentes ao herbicida glufosinato de amônio foram desenvolvidas usando um protocolo de transformação via A. tumefasciens (RIBAS, A. F. et al., 2006).
No ano de 2006, um protocolo de transformação e regeneração direta de C. canephora foi elaborado usando A. rhizogenes (KUMAR, V. et al., 2006). Este protocolo tem uma vantagem em relação aos outros, pois a obtenção das plantas
ocorre em 8 meses. Entrentanto, a eficiência de transformação foi de apenas 3%
(KUMAR, V. et al., 2006).
Recentemente, a eficiência na transformação de cafeeiro via A. tumefaciens foi aumentada com o desenvolvimento de um protocolo que usa infiltração por vácuo
3. MATERIAIS E MÉTODOS
3.1 CONSTRUÇÃO DO PLASMÍDEO PARA TRANSFORMAÇÃO DE CAFÉ
Construiu-se um plasmídeo tendo como base o vetor pBIN19 (HOEKEMA, A.
et al., 1983). Nele foi clonado o gene que codifica para o inibidor de -amilase 1 do feijão Phaseolus vulgaris (-AI1), flanqueado pelo promotor e terminador da fitohemaglutinina (PHA-L). Este fragmento, contendo o -AI1, o promotor e o terminador PHA-L, foi retirado do vetor pTA3 (ALTABELIA, T.CHRISPEELS, M. J.,
1990) por digestão dos sítios HindIII. Os fragmentos resultantes do plasmídeo digerido foram separados em um gel de agarose 1%, corado com brometo de etídio
(SAMBROOK, J.RUSSELL, D. W., 2001). O fragmento correspondente ao promotor
de fitohemaglutinina, -AI1, terminador da fitohemaglitinina (4830 pb), foi retirado do gel e purificado com o kit “High Pure PCR Product Purification” da Roche, seguindo
as instruções do fabricante.
Uma digestão com a enzima HindIII foi usada para linearizar o pBIN19. Este plasmídeo aberto foi ligado ao fragmento purificado do pTA3 usando-se a enzima
“T4 DNA Ligase” (Invitrogen). Esta ligação gerou um plasmídeo com 16607 pb, que
foi chamado pBIN19αAI-1 (Figura 3). O promotor da fitohemaglutinina direciona a expressão do inibidor para a semente do café (VOELKER, T. et al., 1987), que é o sítio de ataque do H. hampei. Este mesmo promotor já foi usado no desenvolvimento de outras plantas transgênicas (SCHROEDER, H. E. et al., 1995; IGNACIMUTHU, S.PRAKASH, S., 2006; SOLLETI, S. K. et al., 2008).
3.2 TRANSFORMAÇÃO DE Coffea arabica POR BIOBALÍSTICA
As plantas de C. arabica foram transformadas por bombardeamento de calos embriogênicos. Esses calos foram obtidos a partir da cultura de fragmentos foliares
no meio C (BOXTEL, J. V.BERTHOULY, M., 1996), modificado pela adição de 20
M 2,4-D e nomeado meio C20. Folhas de C. arábica, variedade catuaí-vermelho, foram coletadas em casa de vegetação 28 da Embrapa Cenargen, sendo coletadas
folhas do terceiro par. As folhas foram desinfetadas durante 5 min em uma solução
de hipoclorito de sódio 2%, e lavadas com água destilada estéril 3 vezes, cada
lavagem com duração de 5 min. Após a desinfecção, as folhas foram cortadas em
fragmentos de aproximadamente 0,5 x 0,5 cm, usando-se lâminas de bisturi estéreis,
e incubadas em placas de Petri contendo o meio C20. Todo o procedimento foi
realizado em fluxo laminar.
Após um mês de incubação no escuro a temperarura de 25ºC ± 2, os calos
crescidos das bordas das folhas foram subcultivados em um novo meio C20 e
cultivados por mais 5 meses, com subistituição dos meios a cada mês. Após esse
período, e 7 dias antes do bombardeamento, os calos embriogênicos foram
dispostos sobre um filtro Membranfilter 0,45 m e colocados em placas de Petri
contendo o meio C adicionado de 10 M 2,4-D, chamado de meio C10. As
membranas contendo os calos foram transferidas 24 horas antes do
bombardeamento para o meio C10 contendo 0,5 M de manitol e 8 g/L de fitagel
(Qual o objetivo?). Após esse tratamento osmótico, os calos foram bombardeados
com micropartículas de tungstênio cobertas com o plasmídeo pBIN19α-AI1 e transferidos para o meio C10 (ARAGÃO, F. J. L. et al., 1996; ALBUQUERQUE, E. V. S.;CUNHA, W. G.;BARBOSA, A. E. A. D.;TEIXEIRA, J. B. et al., 2009). Duas semanas após o bombardeamento, os calos foram transferidos para o meio C10
contendo 200 mg/L de canamicina, que foi o agente seletivo. Uma semana depois,
os calos foram submetidos a um aumento do agente seletivo para 300 mg/L, e
novamente, após 1 semana a canamicina foi aumentada para 400 mg/L. Em
seguida, esses calos foram subcultivados mensalmente no meio C10 contendo 400
mg/L de canamicina por um período de 6 meses até o desenvolvimento dos
embriões. Após esse período, os embriões foram transferidos para o meio WPM
(temperatura de 27ºC ± 3, umidade de 75% ± 10), onde cresceram durante 2 anos
até o desenvolvimento dos primeiros frutos. Estas primeiras sementes produzidas
foram usadas nos testes de expressão do inibidor e para a produção da geração T1
de plantas de café transgênico. Dez sementes provenientes de duas plantas de café
transformadas foram plantadas para a produção da geração T1.
3.3 AVALIAÇÃO DA INTEGRAÇÃO DOS TRANSGENES NO GENOMA DE C.
arabica
As plantas de café obtidas pela regeneração dos calos bombardeados foram
submetidas à PCRs para identificar a presença dos genes nptII e -AI1 em seus genomas. Inicialmente, o DNA das folhas de 26 plantas foi extraído usando-se o
método CTAB (DOYLE, J. J.DOYLE, J. L., 1987), modificado pela adição no tampão
de 2% PVP e 2% de metabissulfito de sódio. O DNA extraído foi quantificado no
espectrofotômetro NanoDropTM ND-1000 (Thermo Scientific).
Antes da PCR, 2 g do DNA das plantas foram digeridos com a enzima
EcoRI. Esta enzima não clivou os genes da canamicina nem do inibidor, apenas fragmentou o DNA para facilitar o alinhamento dos primers (SAMBROOK,
J.RUSSELL, D. W., 2001). Duas microgramas do DNA foram digeridos com 12
unidades de EcoRI, 2 L do tampão 10X, em um volume final de 20 L, completado com água bi-destilada. A reação foi executada durante 1 h, a 37ºC, usando-se um
“Thermomixer” (Eppendorf), com agitações (800 RPM) de 30 segundos a cada 5
minutos.
Nas PCRs foram utilizados 0,6 g do DNA digerido como molde para todas as
plantas avaliadas. Os primers utilizados estão na tabela 1. Eles foram desenhados
com o uso das seqüências contidas no anexo 2 e escolhidos com o programa
PRIMER3 (http://frodo.wi.mit.edu/) (ROZEN, S.SKALETSKY, H. J., 2000). Os 4
Tabela 1. Primers utilizados nas reações de PCR para amplficação dos genes nptII e -AI1.
Nome do primer Seqüência
nptII Foward 5´ - GAGGCTATTCGGCTATGACTG - 3´
nptII Reverse 5´- TCGACAAGACCGGCTTCCATC – 3´
-AI1 Foward 5´- GCCTTGGGATGTACACGACT – 3´
-AI1 Reverse 5´- CTCCATTGATAAGCCCCTGA – 3´
As reações de PCR foram montadas como descrito na tabela 2. O DNA de
uma planta de café não transformada foi usado como controle negativo, enquanto
que 200 ng do plasmídeo pBIN19α-AI1 foi usado como controle positivo.
Tabela 2. Reação de PCR para os genes nptII e -AI1.
Reagente Volume (L)
H2O Milli-Q estéril 35,9
DNA das plantas digerido (0,1 g/L) 6
Tampão Taq DNA polimerase 10X (Pht) 5
Taq DNA polimerase 5U/L (Pht) 0,5
Primer Foward 10 M (Invitrogen) 0,8
Primer Reverse 10 M (Invitrogen) 0,8
dNTPS (10 mM) (Invitrogen) 1
Volume total 50
O programa de amplificação utilizado foi o seguinte: desnaturação inicial a
94ºC durante 5 min, seguida por 30 ciclos de desnaturação a 94ºC durante 1 min;
anelamento a 60ºC durante 1 min e extensão a 72ºC durante 30 seg; ao final dos
ciclos foi feita uma extensão de 10 min a 72ºC. A reação foi executada no
termociclador “Mastercycler gradient” (Eppendorf) em tubos de 200 L (Axygen). Os
produtos da amplificação foram analisados por eletroforese em gel de agarose 1%,
corado com brometo de etídio (SAMBROOK, J.RUSSELL, D. W., 2001). O DNA de
11 plantas da geração T1 foi avaliado da mesma forma que foi descrita para as
plantas T0, sendo 4 plantas descendentes da planta “2” e 7 plantas descendentes da
planta “4”.
3.4 CONFIRMAÇÃO DA INTEGRAÇÃO DO TRASGENE NO GENOMA VIA
SOUTHERN BLOT
A técnica de Southern blot foi utilizada para confirmar a integração do gene
6 plantas transformadas (plantas positivas por PCR) e do controle negativo (planta
não transformada) foram digeridos simultaneamente com as enzimas ClaI, PvuII e EcoRI. A enzima ClaI cortou no nucleotídeo 86 do gene -AI1, a enzima EcoRI cortou no final do terminador da fitohemaglutinina (Figura 6) e a enzima PvuII não possuia sítios dentro da construção pBIN19α-AI1. A reação de digestão foi preparada da seguinte forma: Tampão NEB 4 10X, 40 L; BSA 100 X, 4 L; enzima
PvuII 10 L (10 U/L); enzima ClaI 10 L (5 U/L); enzima EcoRI 5 L (12 U/L); espermidina 16 L e água bi-destilada q.s.p. 400 L. As enzimas foram adicionadas
individualmente, separadas por intervalos de 5 horas após a adição da primeira. A
reação foi feita a temperatura constante de 37ºC no “Thermomixer” (Eppendorf), com
agitações sucessivas de 800 RPM por 30 segundos a cada 5 minutos sem agitação.
Como controle positivo foram usados 5 ng de DNA correspondendo ao fragmento do
inibidor -AI1 (735 pb).
Os fragmentos obtidos dessas digestões foram separados em gel de agarose
0,8% e transferidos por capilaridade para a membrana de nitrocelulose Hybond-N
(Amersham biosciences). Neste procedimento, o gel foi incubado na solução de
desnaturação (Anexo 3), sob leve agitação, durante 30 min. Após uma rápida
lavagem com água destilada, o gel foi transferido para a solução de neutralização
(Anexo 3) durante 30 min, sob leve agitação. Em seguida, o gel foi colocado sobre
uma ponte de papel filtro dentro em um recipiente contendo a solução SSC 20X
(Anexo 3). A membrana de nitrocelulose foi colocada sob o gel, e sobre esta foram
colocadas 3 folhas de papel filtro pressionadas por, aproximadamente, 10 cm de
folhas de papel toalha. No topo de todo o aparato, sobre as folhas de papel toalha,
foi colocada uma placa de vidro, e sobre ela um peso de 1 kg. Esta transferência por
capilaridade foi realizada durante 16 horas a temperatura ambiente (BRASILEIRO,
A. C. M., 1998). Após a transferência, o DNA foi fixado à membrana por exposição à
luz UV durante 25 seg, utilizando-se o forno “Stratalinker 2400” (Stratagene).
O DNA correspondente ao gene -AI1 (735 pb) (100 ng), isolado por digestão com a HindIII do plasmídeo pBIN19α-AI1, foi usado como sonda após ser radioativamente marcado com 5 L de [-32P] dCTP (GE Healthcare). Na marcação
foi utilizado o kit Ready-To-GoTM DNA Labeling Beads (-dCTP) (GE Helthcare),
A membrana foi bloqueada com a solução de pré-hibridização (Anexo 3)
dentro de um frasco de vidro (Shel Lab), sob agitação lenta, durante duas horas, a
65ºC, utilizando-se o forno de hibridização (Modelo 1012, Shel Lab).
Após o bloqueio, a sonda marcada foi desnaturada por uma incubação a
100ºC, durante 5 min, e adicionada à solução de pré-hibridização, que foi mantida a
65ºC, durante 16 horas. O DNA do gene -AI1 marcado radioativamente foi incubado durante 5 min, a 100ºC, para desnaturação, e adicionado ao frasco
contendo a membrana. A hibridização ocorreu a 65ºC, durante 16 horas
(BRASILEIRO, A. C. M., 1998).
Após a etapa de hibridização, a membrana foi lavada 2 vezes com a solução
de lavagem 1 (Anexo 3), durante 15 min, a 65ºC, e 2 vezes com a solução de
lavagem 2 a 65ºC, durante 15 min (Anexo 3). Em seguida, para a detecção, a
membrana foi colocada sobre papel filtro e exposta ao filme “BioMax MS” (Kodak)
dentro de um cassete (Hypercassette, Amersham pharmacia biotech) (BRASILEIRO,
A. C. M., 1998). O cassete de exposição foi mantido a -80ºC durante 6 dias. O filme
foi revelado na sala escura, usando-se as soluções de revelação e fixação (Kodak).
3.5 DETECÇÃO E QUANTIFICAÇÃO DA EXPRESSÃO DO INIBIDOR -AI1 NAS
PLANTAS TRANSGENICAS DE CAFÉ
A presença do inibidor -AI1 nas plantas de café transgênico da geração T0
foi detectada pela aplicação da técnica de Western blot (BURNETTE, W. N., 1981) e quantificada por ELISA. Proteínas totais das sementes de 3 plantas transgênicas de
café (Plantas 2, 3 e 4) e de uma planta de café não transformada foram extraídas
com o uso de tampão de extração contendo ácido succínico (C4H6O4) (0,15 M),
NaCl (0,06 M), CaCl2 (0,02 M), metabissulfito de sódio (Na2S2O5) (0,01 M), pH 5,0.
A composição desse tampão é essencial para o funcionamento correto do inibidor,
pois o íon cloro é importante para que o inibidor alcance sua atividade máxima, e o
íon cálcio aumenta a taxa inicial de ligação do inibidor na amilase alvo (GIBBS, B.
F.ALLI, I., 1998). O ácido succínico foi ajustado para tamponar a solução em pH 5,0,
que é o pH ótimo para o funcionamento do inibidor (OBIRO, W. C. et al., 2008). O metabissultifo de sódio foi adicionado com o objetivo de neutralizar compostos
As sementes foram maceradas em nitrogênio líquido, e o pó homogeneizado
em tampão de extração na proporção de 1:4 (pó:tampão), sob leve agitação, a 4oC,
durante 1 hora. Posteriormente, o extrato foi centrifugado a 12.000 g durante 30 min,
e o sobrenadante coletado. O extrato protéico foi quantificado com o uso do
reagente “Bradford protein assay” (Bio-Rad), seguindo-se as instruções do
fabricante.
Visando a separação das proteínas, 5 g do extrato total de cada planta foram
solubilizados em tampão de amostra (Anexo 4) e aplicados em um gel de
poliacrilamida 15% (Anexo 4). A eletroforese foi realizada durante aproximadamente
90 min, a 20 mA, usando-se o sistema “Mini-Protean III” (BioRad) contendo tampão
de corrida (Anexo 4). Como controle positivo foram usados 400 ng do inibidor
semipurificado, extraído do feijão Phaseolus vulgaris. Paralelamente, um segundo gel foi feito, contendo 10 g de proteínas totais, corado com coomassie brilliant blue
R-250 (Anexo 4) e descorado com solução descorante (Anexo 4) até a visualização
das bandas (REISNER, A. H. et al., 1975; ROCHA, T. L. et al., 2005).
A transferência das proteínas separadas no gel SDS-PAGE para a membrana
de nitrocelulose Hybond-C Extra (Amersham Biosciences) foi feita com a aplicação
de 10 V, durante 20 min, usando-se o sistema “Trans-Blot® SD Semi-Dry” (Bio-Rad)
e o tampão de transferência (Anexo 4). Dentro do sistema “Trans-Blot®” foram
colocadas 3 folhas de papel filtro embebidas em tampão de transferência. Sobre
estas foi colocado o gel de poliacrilamida, e por sobre este foi adicionada a
membrana de nitrocelulose e mais três folhas de papel filtro. O sistema foi fechado e
a voltagem aplicada.
Após a transferência, a membrana foi bloqueada com uma solução de TBS
(Anexo 4) contendo BSA 3% (SIGMA), durante 2 horas, a temperatura ambiente.
Depois do bloqueio, a membrana foi incubada em TBS contendo BSA 1%, e o
anticorpo anti-α-AI1 produzido em coelho (1:900). A hibridização foi realizada a 4oC,
sob leve agitação, durante 16 horas. Posteriormente, a membrana foi lavada 3 vezes
com uma solução TBS + BSA 1%, durante 15 min, e incubada com o anti-anticorpo
conjugado com fosfatase alcalina (Anti-Rabbit IgG – Alkaline phosphatase conjugate,
SIGMA), durante 1 hora, a temperatura ambiente, na diluição 1:1000, em tampão
TBS contendo BSA 1%. Seguiram-se 4 lavagens de 5 min em solução TBS contendo
tween-20 0,05%. Na reação de detecção, foi utilizado o Kit “AP Conjugate Substrat”