Mestrado Integrado em Medicina Veterinária Ciências Veterinárias
DIAGNÓSTICO DE MICOBACTERIOSES
EM SUÍNOS ABATIDOS PARA CONSUMO
POR TÉCNICAS HISTOPATOLÓGICAS E
DE BIOLOGIA MOLECULAR
Carla Isabel Silva Miranda
Orientadora: Prof. Doutora Ana Cláudia Correia Coelho Co-orientadora: Prof. Doutora Maria Madalena Vieira-Pinto
UNIVERSIDADE DE TRÁS-OS-MONTES E ALTO DOURO VILA REAL, 2010
ii
Pedras no caminho? Guardo todas. Um dia vou construir um castelo…
iii
Resumo
As micobacterioses dos suínos são infecções crónicas provocadas por bactérias do género Mycobacterium, caracterizadas por lesões tipo linfadenite granulomatosa, localizadas, principalmente, nos gânglios linfáticos mesentéricos e submaxilares. Nos últimos anos observou-se um aumento da incidência desta infecção, detectada no exame post mortem em matadouros. As micobactérias pertencentes ao Complexo Mycobacterium avium são as principais responsáveis pelas linfadenites granulomatosas de suínos, detectadas em matadouro, e as oportunistas mais comuns, detectadas nas infecções bacterianas em humanos, principalmente, imunodeprimidos.
Este estudo teve como objectivo caracterizar as lesões granulomatosas e, a detecção e identificação de micobactérias de gânglios linfáticos de suínos abatidos para consumo. No decurso da inspecção post mortem de suínos, em 4 matadouros da região norte, foram recolhidos gânglios linfáticos emparelhados (submaxilares e mesentéricos) de 50 animais. Os gânglios lingáticos com lesões de linfadenite granulomatosa foram avaliados a nível histopatológico, incluindo a coloração de rotina e a técnica de Ziehl-Neelsen para pesquisa de bactérias álcool-ácido resistentes, assim como por técnicas de biologia molecular, efectuadas directamente do tecido.
No exame histopatológico, observou-se a presença de granulomas em 92% das amostras. Na sua maioria, apresentaram necrose central de caseificação/liquefacção (78%), associada a um infiltrado inflamatório por células epitelióides, linfócitos, neutrófilos (92%), eosinófilos (60%) e, células gigantes multinucledas do tipo Langhans (70%). Em 64% das lesões era evidente uma cápsula de tecido conjuntivo e 46% apresentaram calcificação distrófica. Na técnica de Ziehl-Neelsen observaram-se bacilos álcool-ácido resistentes em todos os casos.
Na técnica de PCR, obtiveram-se resultados positivos para o género Mycobacterium em 82% dos órgãos. Para o Complexo Mycobacterium avium obtiveram-se 48% positivos, para a subespécie M. avium avium/M. avium silvaticum 32% e, para M. avium paratuberculosis 8% de casos positivos. Os resultados obtidos no exame histopatológico com as técnicas moleculares aplicadas, apresentaram algumas discordâncias.
Os resultados deste estudo demonstraram a possibilidade de detecção do Complexo Mycobacterium avium, através da técnica de PCR a partir de tecidos, no entanto, a nível da subespécie a técnica necessita de optimização.
iv
Abstract
Swine mycobacteriosis is a chronic infection caused by bacteria belonging to the genus Mycobacterium characterized by granulomatous lymphadenitis in the lymph nodes mesenteric and submaxillary. In recent years the incidence of this infection, detected by post mortem examination at slaughterhouses, had increased. The Mycobacterium avium complex members are frequently associated the granulomatous lymphadenitis in swine. Opportunistic human infections have been reported, especially in immunocompromised patients.
The aim of this study was to characterize the granulomatous lesions and to detect of mycobacteriosis in the lymph nodes of swine slaughtered for consumption. During the post mortem inspection of pigs slaughtered in 4 slaughterhouses in northern Portugal, lymph nodes (submaxillary and mesenteric) in 50 animals were collected. Histopathological examination of the samples with lesions of granulomatous lymphadenitis were performed (including routine staining and the method of Ziehl-Neelsen for detection of bacterial acid-fast bacilli) and polymerase chain reaction (PCR) was applied to the tissues.
Histopathologically, the presence of granulomatous lesions were detected in 92% of the samples mostly consisted of central caseous/liquefaction necrosis (78%), associated with inflammatory infiltration by epithelioid cells, lymphocytes, neutrophils (92%), eosinophils (60%) and Langhans multinucleated giant (70%). In 64% lesions, a capsule of connective tissue was observed and 46% presented dystrophic calcification. By the method of Ziehl-Neelsen was observed acid-fast bacilli in all cases.
PCR in lymph nodes samples to detect Mycobacterium was positive in 82%. Mycobacterium avium complex were detected in 48% samples, M. avium avium/M. avium silvaticum subspecies was detected in 32% and 8% were positive for M. avium paratuberculosis. Compared with polymerase chain reaction, histopathological examination revealed some disagreements.
The results of this study showed a method for detection of Mycobacterium avium complex, from tissues, however at subspecies level, it requires optimization.
v
Índice
Índice de figuras ... vii
Índice de tabelas ... viii
Lista de abreviaturas ... ix Agradecimentos ... xi 1. INTRODUÇÃO ... 1 1.1. INSPECÇÃO SANITÁRIA ... 1 1.2. DECISÃO SANITÁRIA ... 2 2. REVISÃO BIBLIOGRÁFICA ... 3
2.1. CARACTERIZAÇÃO DAS MICOBACTERIOSES EM SUÍNOS ... 3
2.1.1. Referência histórica ... 3
2.1.2. Etiologia ... 3
2.1.2.1. Complexo Mycobacterium avium (MAC) ... 4
2.1.2.2. Características gerais ... 5 2.1.3. Epidemiologia ... 6 2.1.3.1. Espécies susceptíveis ... 6 2.1.3.2. Fontes de infecção... 7 2.1.3.3. Factores de risco ... 8 2.1.3.4. Transmissão ... 9
2.1.3.5. Prevalência e distribuição mundial ... 10
2.1.3.6. Importância económica ... 11 2.1.4. Patogenia ... 12 2.1.5. Quadro lesional ... 13 2.1.5.1. Lesões macroscópicas ... 14 2.1.5.2. Lesões microscópicas... 15 2.1.6. Diagnóstico ... 16 2.1.6.1. Diagnóstico in vivo ... 16 2.1.6.2. Diagnóstico histopatológico ... 17
2.1.6.3. Diagnóstico por exame microscópico ... 18
2.1.6.4. Diagnóstico por cultura ... 18
2.1.6.5. Diagnóstico molecular ... 19
2.1.7. Diagnóstico diferencial ... 20
2.1.8. Controlo e profilaxia ... 20
vi 2.2. POTENCIAL ZOONÓTICO ... 22 3. OBJECTIVOS ... 25 4. MATERIAL E MÉTODOS ... 26 4.1. RECOLHA DE AMOSTRAS ... 26 4.2. TÉCNICAS DE DIAGNÓSTICO ... 27 4.2.1. Técnicas histológicas ... 27
4.2.2. Técnicas de biologia molecular ... 28
4.2.2.1. Reacção em cadeia da polimerase – PCR ... 28
4.2.2.1.1. Extracção de DNA ... 28 4.2.2.1.2. Quantificação de DNA ... 29 4.2.2.1.3. Amplificação ... 29 4.2.2.1.4. Eletroforese ... 31 4.3. ANÁLISE DE DADOS ... 32 5. RESULTADOS ... 33 5.1. AMOSTRAS ... 33 5.2. EXAME HISTOPATOLÓGICO ... 34 5.2.1. Técnica de Ziehl-Neelsen ... 36
5.3. TÉCNICAS DE BIOLOGIA MOLECULAR ... 36
5.3.1. Quantificação de DNA ... 36
5.3.2. Reacção em cadeia da polimerase ... 37
5.4. COMPARAÇÃO DOS RESULTADOS OBTIDOS NAS DIFERENTES TÉCNICAS ... 39
5.4.1. Comparação dos resultados obtidos no exame histopatológico com outras técnicas microbiológicas ... 39
5.4.2. Comparação dos resultados obtidos na PCR para a detecção do género Mycobacterium com outras técnicas microbiológicas ... 41
6. DISCUSSÃO ... 43
7. CONSIDERAÇÕES FINAIS ... 50
8. REFERÊNCIAS BIBLIOGRÁFICAS ... 51
ANEXO I ... xiii
vii
Índice de figuras
2. REVISÃO BIBLIOGRÁFICA
Figura 2.1. Árvore filogenética de micobactérias, com base na sequência 16S rRNA, mostra
que o Complexo M. tuberculosis difere genotipicamente do Complexo M. avium ... 4
Figura 2.2. Divisão do Complexo M. avium ... 5
4. MATERIAL E MÉTODOS Figura 4.1. Localização da área de recolha das amostras ... 26
5. RESULTADOS Figura 5.1. Gânglios linfáticos submaxilares com lesões compatíveis com infecção por Mycobacterium spp ... 34
Figura 5.2. Gânglios linfáticos mesentéricos com lesões compatíveis com infecção por Mycobacterium spp ... 34
Figura 5.3. Lesão com necrose de liquefacção a nível central, calcificação e delimitada por uma cápsula ... 35
Figura 5.4. Presença de células gigantes de Langhans. ... 35
Figura 5.5. Granuloma do tipo I: lesão com células inflamatórias ... 35
Figura 5.6. Granuloma do tipo II: necrose a nível central, calcificação, células gigantes e delimitada por uma cápsula ... 35
Figura 5.7. Presença de bacilos álcool-ácido resistentes pelo método de Ziehl-Neelsen ... 36
Figura 5.8. DNA extraído de algumas amostras... 37
viii
Índice de tabelas
4. MATERIAL E MÉTODOS
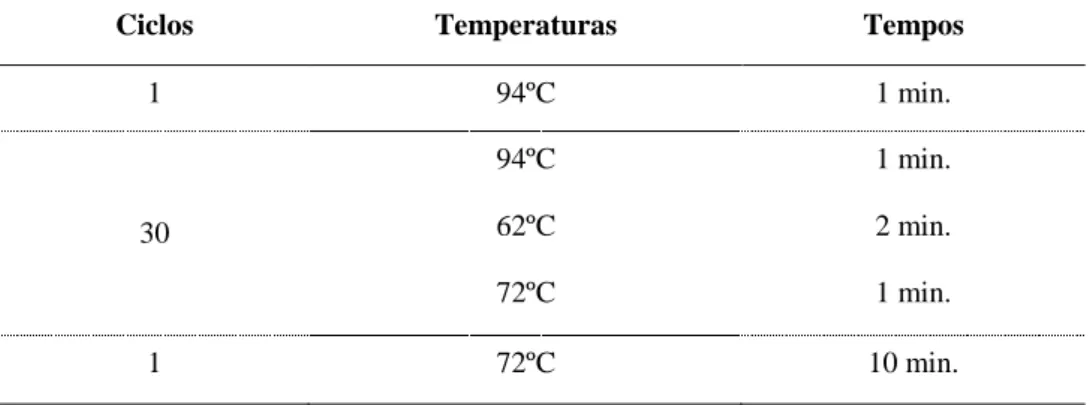
Tabela 4.1. Ciclos, temperaturas e tempos utilizados no ensaio 16S rDNA ... 29
Tabela 4.2. Primers e respectivas sequências utilizados no ensaio 16S rDNA ... 30
Tabela 4.3. Reagentes e concentrações utilizados no ensaio PCR “multiplex” ... 30
Tabela 4.4. Ciclos, temperaturas e tempos utilizados no ensaio PCR “multiplex” ... 31
Tabela 4.5. Primers e respectivas sequências utilizados no ensaio PCR “multiplex” ... 31
5. RESULTADOS Tabela 5.1. Número de amostras recolhidas com lesão granulomatosa ... 33
Tabela 5.2. Numero de amostras recolhidas por matadouro ... 33
Tabela 5.3. Caracterização das lesões a nível histopatológico ... 35
Tabela 5.4. Caracterização das lesões a nível histopatológicoico e classificação dos granulomas ... 35
Tabela 5.5. Componentes celulares nos diferentes tipos de granulomas ... 36
Tabela 5.6. Resultados obtidos pelas técnicas de PCR (16S rDNA e PCR “multiplex”)... 38
Tabela 5.7. Associação entre a técnica de PCR e as variáveis estudadas no exame histopatológico ... 39
Tabela 5.8. Comparação dos resultados obtidos no exame histopatológico em relação a PCR do género Mycobacterium ... 40
Tabela 5.9. Comparação dos resultados obtidos no exame histopatológico em relação a PCR do Complexo Mycobacterium avium ... 40
Tabela 5.10. Comparação dos resultados obtidos no exame histopatológico em relação a PCR da subespécie Mycobacterium avium avium ... 41
Tabela 5.11. Comparação dos resultados obtidos pela técnica de PCR do género Mycobacterium com outras técnicas microbiológicas. ... 41
ix
Lista de abreviaturas
BAAR – Bacilos álcool-ácido resistentes cm2 – Centímetros quadrados
DNA – Ácido desoxirribonucleico, do inglês “Deoxyribonucleic acid” ELISA – “Enzyme-linked immunosorbent assay”
G.l. – Gânglio linfático
HIV – Vírus da Imunodeficiência Humana IS – Sequência de Inserção
M. – Mycobacterium
M.a.a. – Mycobacterium avium subespécie avium MAC – Complexo Mycobacterium avium
M.a.h. – Mycobacterium avium subespécie hominissuis M.a.p. – Mycobacterium avium subespécie paratuberculosis M.i. – Mycobacterium intracellulare
min. – Minutos mg – Miligramas ml – Mililitros mm – Milimetros mM – Milimolar
MTC – Complexo Mycobacterium tuberculosis Neg – Negativo
Lnn. – Linfonodos pb – Pares de bases
PCR – Reacção em cadeia da polimerase, do inglês “Polymerase chain reaction” pmol – Picomole
Pos – Positivo
PPD – Derivados Proteicos Purificados, do inglês “Purified Protein Derivative” R. – Rhodococcus
RFLP – Polimorfismo no comprimento de fragmentos de restrição, do inglês “Restriction Fragment Lenght Polymorphism”
seg. – Segundos
SIDA – Síndrome da Imunodeficiência Adquirida TBE – Tampão Tris-Borato-EDTA
x μl – Microlitros μM – Micromolar μm – Micrómetros ºC – Graus Celsius ® - Marca Registada % – Percentagem
xi
Agradecimentos
Este trabalho resulta de um grande número de contribuições, apoios e sugestões de várias pessoas e instituições. Como tal, não posso, deixar de expressar os meus sinceros agradecimentos:
Ao magnífico Reitor da Universidade de Trás-os-Montes e Alto Douro.
À Prof.ª Doutora Ana Cláudia Coelho, por aceitar orientar, pelo constante encorajamento, pela ajuda e amizade que sempre manifestou.
À Prof.ª Doutora Madalena Vieira-Pinto, pelo tema, pela orientação e apoio, por toda a sua disponibilidade. Pelas indicações e sugestões que foi fornecendo e por toda amizade.
Ao Dr. Paulo Ribeiro, pela cooperação na realização deste trabalho. Pelo profissionalismo e dedicação à profissão demonstrado, pelos valores transmitidos. Pela amizade e confiança depositada.
À Prof.ª Doutora Isabel Pires, pela partilha de conhecimentos e pelo apoio constante e imprescindível ao longo deste trabalho.
À Prof.ª Doutora Maria Manuela Matos, pelos ensinamentos proporcionados na área de biologia molecular, pelas condições proporcionadas e disponibilidade.
À Prof.ª Doutora Margarida Correia-Neves pela oportunidade de conhecer uma nova realidade e de enriquecer a nível profissional, pelos conhecimentos transmitidos e apoio prestado.
À Dr.ª Cláudia Nobrega pela maneira como me acompanhou, pela paciência e por toda a ajuda que me deu.
Ao laboratório de Biologia Molecular do Departamento de Genética e Biotecnologia, pelas condições de trabalho proporcionadas.
Às técnicas do laboratório de Histologia e Anatomia Patológica do Departamento de Ciências Veterinárias: D.a Ana, D.a Glória e Eng.a Lígia Lourenço, pelo apoio na realização deste trabalho.
Ao Dr. José Rui Cachim pela paciência, pelos conhecimentos transmitidos e pela disponibilidade na recolha das amostras, assim como à Dr.ª Maria João Fernandes, Dr.ª Maria João Magno, Dr. José Carlos Silva, à Eng.a Benvinda e à D.a Maria do Céu.
À Alice Miranda pela confiança depositada e por toda a disponibilidade que sempre demonstrou.
À Sofia Álvares, pela ajuda e cumplicidade no laboratório.
À Rafaela Rodrigues e à sua mãe, pela amizade e apoio demonstrado.
xii
Aos meus tios e primos, especialmente, ao tio José Gonçalves e à prima Liliana, pelo estímulo e apoio imprescindível.
À minha irmã Sílvia, por estar sempre comigo.
Aos meus pais, pelo carinho, pelos valores transmitidos, pela confiança e por sempre me apoiarem.
1
1. INTRODUÇÃO
1.1. INSPECÇÃO SANITÁRIA
A inspecção da carne, como a de outros alimentos, tem como finalidade garantir que só chega ao consumidor aquela que reúna as condições de sanidade, com qualidade higiénica e nutritiva adequada (García, 2006).
A carne suína é incluída como uma das principais fontes de proteína de origem animal para os humanos. Representa cerca de 44% do consumo de carne de origem animal em todo o mundo, seguida da carne bovina (29%) e de aves (23%). E, sendo os animais produtores de carne e semelhantes ao Homem, partilham certas infecções que podem ser transmitidas daqueles a este por diversas vias, como a digestiva. Neste contexto, o alto consumo de carne de origem animal exige padrões rígidos de controlo de infecções nas diferentes fases da cadeia produtiva, como sejam: produção, abate, industrialização e comercialização dos produtos. A inspecção sanitária dos animais no momento do abate desempenha um papel fundamental na identificação de infecções (García, 2006; Roppa, 2008).
A infecção por Mycobacterium avium em suínos tem sido diagnosticada em muitos países. Nos últimos anos observou-se uma alta ocorrência da infecção, detectada pelo serviço de inspecção de carnes em matadouros (Morés et al., 1997; Morés e Silva, 2001).
A possibilidade de transmissão de várias zoonoses, através do consumo de produtos de origem animal, permite reflectir sobre o diagnóstico post mortem de tuberculose conferido pelo Serviço de Inspecção Sanitária, baseados nas lesões caseosas macroscópicas observadas nos animais abatidos (Souza et al., 1998).
Segundo o Regulamento 854/2004, é obrigatório a incisão e o exame dos gânglios linfáticos submaxilares (Lnn. mandibulares) e a inspecção visual, palpação e, se necessário, incisão dos gânglios linfáticos mesentéricos (Lnn. mesenterici craniales e caudales) nos suínos domésticos, durante a inspecção post mortem. O abate de animais suspeitos deverá ser efectuado de acordo com medidas de protecção do operador: utilização de luvas, máscara naso-bucal e luvas de malha de aço. Deve ser tomado extremo cuidado na relação carcaça/partes da carcaça. Está preconizada intolerância absoluta para a ausência de sistemas de facas múltiplas e equipamento de esterilização (água a 82ºC). A desinfecção das instalações deve ser efectuada com desinfectantes próprios, como o hipoclorito de sódio (Vilela, 2005).
2
1.2. DECISÃO SANITÁRIA
Os critérios de decisão sanitária de suínos com lesões compatíveis de micobacteriose na inspecção post mortem, deverão ser realizados de acordo com a Circular nº232/G de 2005:
- Lesões apenas nos gânglios linfáticos submaxilares: reprovação da cabeça.
- Lesões apenas nos gânglios linfáticos mesentéricos: reprovação das vísceras brancas. - Alterações extensas nos gânglios linfáticos (em regiões anatómicas diferentes) ou em outros órgãos afectados: reprovação total da carcaça e vísceras.
- Animais muito jovens com lesões caseocalcáreas em qualquer gânglio linfático: reprovação total da carcaça e vísceras.
Relativamente a esta matéria o Codex Alimentarius apresenta as seguintes recomendações:
- As lesões localizadas na garganta ou nos gânglios linfáticos mesentéricos (tipo bovino ou aviário) requerem tratamento térmico para a carcaça e vísceras e, reprovação dos órgãos ou partes da carcaça afectados, inclusive o intestino.
- Nas lesões localizadas nos gânglios linfáticos submaxilares (tipo aviário), apenas a cabeça é declarada imprópria para consumo humano.
- Alterações extensas nos gânglios linfáticos ou em outros órgãos afectados recomenda a reprovação total, quer das vísceras quer da carcaça.
Quanto ao Regulamento 854/2004, este apenas refere os critérios de decisão sanitária relativos à tuberculose:
- Quando os animais tiverem reagido positiva ou inconclusivamente à tuberculina, ou houver outros motivos para suspeitar infecção, devem ser abatidos separadamente dos outros animais, tomando-se precauções no sentido de evitar o risco de contaminação de outras carcaças, da cadeia de abate e do pessoal presente no matadouro.
- Toda a carne de animais cuja inspecção post mortem tenha revelado lesões tuberculosas localizadas em vários órgãos ou em várias partes da carcaça deve ser declarada imprópria para consumo humano. Todavia, sempre que se encontre uma lesão tuberculosa nos gânglios linfáticos de um único órgão ou parte de carcaça, só o órgão atingido ou a parte de carcaça atingida e os respectivos gânglios linfáticos serão declarados impróprios para consumo humano.
3
2. REVISÃO BIBLIOGRÁFICA
2.1. CARACTERIZAÇÃO DAS MICOBACTERIOSES EM SUÍNOS
2.1.1. Referência histórica
Há milhares de anos que a infecção por Mycobacterium é conhecida em Humanos. Em 460 a.C., a tuberculose foi considerada por Hipócrates como uma infecção com elevada prevalência e mortalidade. Embora descrita em detalhe desde o século XVI, a tuberculose permanece como um importante problema de saúde a nível mundial, que requer uma estratégia para a busca de soluções. Em Portugal, esta é uma doença de declaração obrigatória, a nível nacional, desde 1953 (Decreto-Lei 39:209 de 14 de Maio de 1953). No início de Novembro de 2004, verificou-se um aumento brusco de casos de tuberculose suína, em matadouros portugueses, sendo Mycobacterium avium hominissuis o principal agente isolado (Vilela, 2005; Domingos et al., 2009).
2.1.2. Etiologia
As micobacterioses dos suínos são infecções crónicas provocadas por bactérias do género Mycobacterium (Sobestiansky et al., 1999; Herenda et al., 1994). Cerca de, 10 a 20% da ocorrência em suínos é causada por M. bovis e 70 a 80% por M. avium (Perestrelo-Vieira et al., 2000). Os suínos são susceptíveis a infecções por M. bovis, M. tuberculosis e por micobactérias do Complexo Mycobacterium avium (MAC). Quanto à terminologia convencionou-se, neste trabalho, adoptar o termo “tuberculose” para as infecções causadas por M. bovis e M. tuberculosis. As demais condições serão referidas como “micobacterioses” seguidas da espécie do agente implicada ou “micobacterioses atípicas” (Jubb et al., 1992). Nestas últimas incluem-se as espécies M. avium, M. intracellulare, M. fortuitum, M. scrofulaceum e M. silvaticum (Sobestiansky et al., 1999).
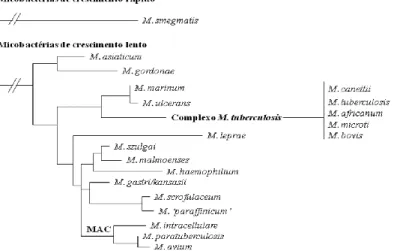
Os agentes causadores de linfadenites presentes em suínos são fundamentalmente, membros do Complexo Mycobacterium tuberculosis (MTC) e M. avium (MAC). O primeiro inclui principalmente M. tuberculosis e M. bovis (Komijn et al., 1999; Pavlik et al., 2007). As micobactérias pertencentes ao MAC são consideradas as principais responsáveis pelas linfadenites granulomatosas de suínos, detectadas em matadouros (Balianet al., 1997;Morés e Silva, 2001). Este é considerado o mais importante em todo o mundo, nas explorações intensivas de suínos (Sobestiansky et al., 1999) (Figura 2.1).
4
As lesões granulomatosas são frequentemente observadas durante a inspecção sanitária de suínos abatidos. Apesar de M. tuberculosis, M. bovis, M. avium (MAC), M. fortuitum, M. chelonae e Rhodococcus equi terem sido relatados como agentes causadores, a frequência de identificação corresponde na maioria dos casos por MAC, que é um Complexo que inclui M. avium e M. intracellulare, um organismo ubíquo e potencial zoonótico (Pavlik et al., 2003; Matlova et al., 2004; Oliveira et al., 2006; Komijn et al., 2007; Hibiya et al., 2009).
No entanto, outras espécies de micobactérias, também conhecidas como atípicas oportunistas (M. fortuitum, M. gordonae, M. terrae, M. chelonae, M. smegmatis, M. phlei e M. scrofulaceum), podem participar na formação de lesões granulomatosas no porco doméstico e selvagem(Horvathova et al., 1997; Pavlik et al., 2003; 2007; Trcka et al., 2006).
2.1.2.1. Complexo Mycobacterium avium (MAC)
Mycobacterium avium e M. intracellulare são membros do Complexo Mycobacterium avium (MAC). De entre os isolados de M. avium, já foram identificados 28 serótipos, distribuídos por diferentes subespécies. As características bioquímicas e a análise genética, por polimorfismo no comprimento de fragmentos de restrição (RFLP) e, através da análise de sequências de inserção (IS) estão na base da taxonomia actual. Em 1990, Mycobacterium avium (M.a.) foi dividido em 3 subespécies: a primeira subespécie, M. avium avium (serótipos 1 a 3), possui o genótipo dnaJ+, IS900-, IS901+ e IS1245+, provém de aves e é virulenta para as mesmas. A segunda subespécie, M. avium paratuberculosis, é responsável pela paratuberculose, uma infecção crónica intestinal que afecta principalmente ruminantes, mas
Figura 2.1. Árvore filogenética de micobactérias, com base na sequência 16S rDNA, mostra que o Complexo M. tuberculosis difere genotipicamente do Complexo M. avium (Fonte: adaptado de Biet et al., 2005).
5
que pode atingir outros animais. Os isolados desta subespécie possuem apenas a sequência de inserção IS900. A terceira subespécie, M. avium silvaticum, possui a sequência de inserção IS901 e, embora raramente identificada, pode ser virulenta para aves, possuindo ainda a IS1245. Mais recentemente, em 2002, foi proposta a quarta subespécie, M. avium hominissuis (serótipos 4 a 6, 8 a 11 e 21), com o genótipo dnaJ+, IS900-, IS901- e IS1245+. Esta é menos patogénica para aves, sendo frequentemente isolada a partir de suínos com linfadenites e também de pessoas com infecções respiratórias e/ou disseminadas. As principais fontes de infecção são ambientais (Thorel et al., 1990; Mijs et al., 2002; Pavlik et al., 2003; Dvorska et al., 2004; Biet et al., 2005; Bartos et al., 2006; Möbius et al., 2006).
M. intracellulare (serótipos 7, 12 a 20 e 22 a 28), com genótipos dnaJ+, IS901- e IS1245- (Fischer et al., 2001;Matlova et al., 2005; Pavlik et al., 2007), causa principalmente infecções respiratórias em seres humanos, e resulta na formação de lesões granulomatosas nos pulmões e no sistema brônquico (Griffith et al., 2007).
Mycobacterium avium avium causa graves problemas de saúde em pacientes com SIDA e M. avium paratuberculosis (M.a.p.), o agente etiológico da doença de Johne em bovinos é identificado em pacientes com a infecção de Crohn (Biet et al., 2005). M. avium silvaticum é isolado de órgãos parenquimatosos em pombos com patologia tuberculosa
(Mcdiarmid et al., 1964; Hibiya et al., 2009). M. avium hominissuis é isolado a partir de animais e representa uma potencial fonte de infecção para o homem, sendo o agente oportunista mais comum em suínos e seres humanos (Mijs et al., 2002; Matlova et al., 2004; Johansen et al., 2007) (Figura 2.2).
2.1.2.2. Características gerais
Como se tratam de agentes pertencentes ao género Mycobacterium são bacilos álcool-ácido resistentes, aeróbios e imóveis, não formam esporos e adquirem a forma de bastões, que provocam processos infecciosos crónicos, com o desenvolvimento de reacções
Figura 2.2. Divisão do Complexo M. avium (Fonte: adaptado de Biet et al., 2005).
6
granulomatosas típicas denominadas de “tubérculos” (Corrêa e Corrêa, 1992; Acha e Szyfres, 2001; Quinn et al., 2005).
O complexo caracteriza-se por possuir uma parede celular rica em ácidos micólicos. Este elevado teor em lípidos é responsável pela hidrofobicidade, crescimento lento, capacidade de sobreviver em condições ambientais adversas sem redução do seu poder patogénico e, resistência a muitos desinfectantes. São microrganismos euritérmicos, podendo desenvolver-se numa vasta gama de temperaturas; são igualmente capazes de se desenvolver numa gama alargada de pH. MAC cresce bem com pH do meio entre 4,0 e 7,5, idealmente entre 5,4 e 6,5. A sua resistência à escassez de nutrientes e de adaptação a diferentes substratos constitui uma vantagem em termos de sobrevivência. A sua adaptação no meio ambiente está relacionada com características fisiológicas da micobactéria, como a parede celular impermeável e o lento crescimento (Chapman et al., 1962; Portaels et al., 1982; Vilela, 2005; Lara et al., 2009).
As micobactérias são extremamente resistentes ao álcool, aos ácidos e à dessecação, podendo sobreviver vários meses nas instalações dos animais e, durante anos, no solo. Entretanto, são destruídas pelo calor quando sujeitas a 65,5ºC por 10 minutos. M. avium pode sobreviver no material da cama por mais de um ano e em sacos mantidos no ambiente com temperaturas variando de -20º a +30ºC (Morés et al., 1997; Sobestiansky et al., 1999).
2.1.3. Epidemiologia
2.1.3.1. Espécies susceptíveis
A espécie suína é susceptível à infecção por M. bovis, M. tuberculosis e às micobactérias não tuberculosas, das quais se destacam as pertencentes ao Complexo M. avium (MAC). As espécies M. bovis e M. tuberculosis são consideradas as mais patogénicas, frequentemente diagnosticadas nos bovinos e em humanos, respectivamente (Corrêa e Corrêa, 1992; Acha e Szyfres, 2001).
As micobactérias de MAC encontram-se dispersas no ambiente e causam infecções numa ampla gama de diferentes espécies animais. As bactérias pertencentes a este complexo são descritas como responsáveis por infecções em muitas espécies agrícolas e animais domésticos. A variedade de animais domésticos infectados por MAC inclui aves domésticas, bovinos, suínos, cervos, ovinos, cabras e cavalos, mas também cães e gatos.As micobactérias do MAC já foram isoladas em cangurus, macacos e noutros mamíferos, incluindo o Homem
7
(Mcdiarmid et al., 1964; Ristola et al., 1999; Beard et al., 2001; Thorel et al., 2001; Machackova et al., 2003; Biet et al., 2005; Möbius et al., 2006).
Mycobacterium avium tem sido isolado a partir de um amplo espectro de espécies animais como aves domésticas, aves exóticas mantidas em cativeiro, silvestres e ruminantes domésticos e selvagens (Dvorska et al., 2004; Matlova et al., 2005; Möbius et al., 2006). Os suínos, coelhos e martas são animais considerados altamente susceptíveis a M. avium, enquanto que os cães parecem ser bastantes resistentes à tuberculose aviária (Thorel et al., 1997; Friend e Franson, 1999; Harris e Barletta, 2001; Jordan, 2001). Estes bacilos também podem provocar infecção em humanos, principalmente, em indivíduos imunodeprimidos (Komijn et al., 1999; Mijs et al., 2002; Dvorska et al., 2004).
No javali, a patogenia pode ser causada por MAC (M.a.a. e M.a.p.). As lesões, raramente observadas, estão localizadas nos gânglios linfáticos da cabeça. O número de javalis com lesões aumenta com a idade (Beard et al., 2001; Machackova et al., 2003).
Infecções adquiridas com M.a.a. e M. intracellulare foram relatados em espécies de mamíferos não domésticos e não humanos. Em muitos países, a infecção causada M.a.a. principalmente pelo serótipo 1 a 3, ocorre em aves domésticas e selvagens, bem como numa variedade de aves de caça e aquáticas. M.a.p. foi isolado em raposas, arminhos, doninhas, texugos, ratos, lebres, coelhos e corvos (Thorel et al., 1997; 2001; Beard et al., 2001; Biet et al., 2005).
2.1.3.2. Fontes de infecção
São diversas as possibilidades de fontes de infecção micobacteriana para o suíno. A ocorrência de infecção nestes animais está relacionada com a possibilidade de contacto directo ou indirecto com bovinos, pessoas, aves ou outros suínos infectados por micobactérias. Como se trata de um agente patogénico oportunista e ubiquitário, encontra-se na água de beber, efluentes, solo e ração contaminada, urina e fezes do próprio suíno infectado e de outras espécies animais infectadas como aves domésticas e silvestres, roedores e, material de cama contaminado (Sobestiansky et al., 1999; Perestrelo-Vieira et al., 2000; Morés e Silva, 2001; Vilela, 2005).
As infecções por MAC em suínos estão associadas ao meio ambiente, principalmente à utilização de cama de serrim ou aparas de madeira, água e alimentos contaminados e/ou maneio como a má qualidade da higiene das instalações e/ou a presença de reservatórios silvestres, principalmente aves (Gardner e Hird, 1989; Silva et al., 2001). Num estudo, verificou-se que o sistema de cama sobreposta, principalmente quando constituída por aparas
8
de madeira, favorece um maior desenvolvimento de linfadenite granulomatosa nos suínos, relativamente ao sistema convencional, em que se utiliza piso semi-ripado. Os suínos infectados podem eliminar micobactérias nas fezes infectando a cama, ficando os animais em constante contacto com o agente, aumentando a oportunidade de infecção. Sabe-se que os suínos criados em cama sobreposta apresentam maior percentagem de fibra bruta nas fezes. Isto, indica que os suínos criados em sistema de cama ingerem mais substrato e, consequentemente, têm maior probabilidade de infecção por MAC. Por outro lado, a ingestão de material de cama provoca lesões físicas no tracto digestivo, podendo servir de porta de entrada para o agente (Amaral et al., 2006). O solo contaminado por fezes de aves, bem como a serradura ou aparas contaminadas por M. avium, são importantes fontes de infecção para os suínos. Também foi demonstrado a presença de micobactérias nas amígdalas de suínos, podendo ser igualmente fonte de infecção (Perestrelo-Vieira et al., 2000).
As infecções com o bacilo aviário são geralmente provenientes de aves de capoeira, ou de contaminação de alimentadores com excrementos que contém o bacilo (Taylor, 1986). As aves infectadas foram identificadas como a fonte mais comum de M. avium avium. Em contraste, os isolados de M. avium hominissuis foram mais frequentemente isoladas a partir do meio ambiente (Mijs et al., 2002; Matlova et al., 2004; 2005). Ou seja, a primeira subespécie está mais associada a infecções por aves e pequenos roedores, enquanto que a segunda é mais ao ambiente (água, solo, cama, poeiras e invertebrados). A água pode não só ser um meio de transporte, mas também o principal reservatório da maioria das espécies de micobactérias (Horvathova et al., 1997; Fischer et al., 2001; 2006; Matlova et al., 2005; Pavlik et al., 2005; 2007). O outro membro de MAC, M. intracellulare é menos virulento para aves e é encontrado frequentemente no meio ambiente (Horvathova et al., 1997).
2.1.3.3. Factores de risco
O maneio em sistema contínuo, sem vazio sanitário, higiene deficiente de comedouros e bebedouros, a utilização de água não tratada, o transporte de animais e de ração no mesmo veículo, o armazenamento de ração em sacos ou caixas e a má conservação das instalações são importantes factores de risco para esta infecção. Por outro lado, aspectos como a produção de ração na própria exploração de criação de suínos e, o acesso de animais à fábrica potencializam o risco de infecção. Os principais factores de risco a prevenir prendem-se, assim, com regras deficientes de higiene e com a segurança do alimento (Amaral et al., 2004; Vilela, 2005).
9
Silva et al. (2001), identificaram como factores de risco associados à ocorrência de micobacterioses nos suínos, a má qualidade de higiene praticada, principalmente, na fase de recria; a ausência de piso ripado ou parcialmente ripado nas instalações, este associado também à higiene, já que o ripado impede o contacto directo com as fezes, urina e restos de ração que se acumulam; e ao tamanho do efectivo, pois em explorações de maiores dimensões, a aplicação das medidas de higiene às instalações são mais trabalhosas, estando mais sujeitas a falhas.
Outros factores de risco também foram associados à ocorrência de linfadenites granulomatosa em suínos como: produção de suínos em ciclo completo, presença de pássaros nas instalações, uso de cama de serrim ou aparas de madeira na maternidade e aumento da incidência de rinite atrófica e pneumonia por pasteurelas (Sobestiansky et al., 1999).
2.1.3.4. Transmissão
A frequência com que ocorrem as lesões nos gânglios linfáticos da cabeça e mesentéricos de suínos, indica que a transmissão é na maioria dos casos horizontal, por via oral, através da ingestão de água/alimentos e cama contaminada ou mesmo o contacto com matadouro de aves. Acredita-se que a cama não seja a fonte principal de infecção mas, provavelmente, um meio que facilita a disseminação da infecção entre os suínos mantidos no mesmo espaço. Após a ingestão, as micobactérias invadem a mucosa do tracto digestivo e são drenadas para os gânglios linfáticos regionais, onde se multiplicam e desenvolvem a lesão, que geralmente, ficam limitadas a estes gânglios. A transmissão de micobactérias, também é possível, de suíno para suíno, mantidos em grupo, pois devido às lesões intestinais, as micobactérias são eliminadas pelas fezes. No entanto, esta forma de transmissão não é muito expressiva (considerando-se de pouca importância), originando lesões intestinais hiperplásicas, sem formação de úlceras que facilitem a eliminação do agente para o exterior. Contudo, a comercialização de suínos de reposição contaminados, pode representar uma importante forma de disseminação da infecção entre explorações (Balian et al., 1997; Morés et al., 1997; Sobestiansky et al., 1999; Perestrelo-Vieira et al., 2000; Silva et al., 2000;Acha e Szyfres, 2001).
A excreção activa das micobactérias (entre 35 a 42 dias após a infecção) pelas fezes e dos suínos infectados constitui uma importante via de eliminação do microrganismo e perpetuação da infecção nas explorações. As fezes de animais de produção contendo o género Mycobacterium podem permanecer entre 6 a 8 semanas no ambiente, e o microrganismo pode-se manter viável até 18 dias em águas estagnadas (Pavlas, 1987). As porcas gestantes,
10
quando infectadas por M. avium, são responsáveis pela infecção dos fetos (Perestrelo-Vieira et al., 2000). Ocasionalmente, o leite de porcas infectadas pode servir como forma de transmissão da micobactéria para os leitões (Oliveira et al., 1995).
É ainda de considerar a possibilidade de infecção ambiental para suínos e humanos que partilhem fontes de infecção. Estas micobactérias já foram isoladas a partir do solo, água (efluentes, de bebida, da rede municipal), aerossóis, protozoários, lixeiras, vegetação tropical, animais e Homem (expectoração e lavagem gástrica) (Fischer et al., 2001; 2006; Matlova et al., 2005; Pavlik et al., 2005). A componente ambiental tem um papel preponderante na dinâmica das infecções micobacterianas dos suínos (Oliveira et al., 2006).
Postula-se que a transmissão de Mycobacterium spp. e R. equi para o homem possa ocorrer pelo tratador, bem como pelo consumo de produtos e derivados de origem suína (Hoffner et al., 1990).
Segundo vários estudos efectuados, consideram que as micobacterioses suínas apresentam um comportamento sazonal, e que o período de maior transmissibilidade caracteriza-se por temperatura e humidade ambiental elevada (Martins et al., 2004).
2.1.3.5. Prevalência e distribuição mundial
A micobacteriose suína não é um problema mundial, no entanto, a incidência em regiões com grandes populações de suínos é elevada (Hines II et al., 1998).
A existência da infecção nos porcos, em Portugal, foi reconhecida aquando do surto que teve início em Novembro de 2004, sendo a linfadenite granulomatosa/tuberculosa em suínos uma infecção de comunicação obrigatória (Circular nº232/G).Desde o final de 2004, houve um número crescente de lesões granulomatosas que foram detectadas pela inspecção de suínos nos matadouros regionais. Mycobacterium avium hominissuis (M.a.h.) foi identificado como a causa principal deste surto de linfadenites através da técnica de PCR duplex (IS1245 e IS901), com cerca de 86% dos isolados. Parece que as aves não foram a fonte mais comum de infecção para os suínos em Portugal, porque apenas 10,8% dos isolados foram M.a.a. Em Portugal, os elevados valores de M.a.h. observados podem ter sido devido ao ano 2004 ser considerado um dos mais quentes desde 1861. As altas temperaturas favorecem o crescimento de M.a.h. e os efeitos do stresse térmico sobre os suínos poderiam explicar o aumento repentino do número de lesões granulomatosas observadas nos matadouros em todo o país (Domingos et al., 2009). A confirmação de diversos focos de infecção de suínos por M.a.h. em Portugal e o potencial zoonótico desta infecção requer a realização de estudos
11
epidemiológicos que permitam identificar a incidência real da infecção e os factores de risco presentes (Vilela, 2005).
Entre os agentes infecciosos envolvidos nas linfadenites granulomatosas de suínos, MAC tem sido o mais frequentemente isolado no Brasil (Balian et al., 1997). A micobacteriose suína é um problema significativo em vários países europeus, com uma prevalência de 0,34% na Finlândia, 0,5% na Holanda e 10% na Alemanha (von Dürrling et al., 1998; Komijn et al., 1999; Ali-Vehmas et al., 2004).Na República Checa, os exames aos gânglios linfáticos de suínos com lesões granulomatosas antes do ano de 1989, mostraram que MAC foi o Complexo detectado com maior frequência. Entre os anos de 1990 e 1999, a incidência de lesões nos gânglios linfáticos de suínos aumentou (Pavlik et al., 2003; Matlova et al., 2004).
Na ilha de Okinawa, no Japão, entre 1997 e 2003, a prevalência de MAC permaneceu estável em menos de 0,3%, embora tenha havido um pico em Abril de 1999 aumentando para 1% e a partir de Dezembro de 2003 tem vindo a aumentar com valores superiores a este (Hibiya et al., 2009).
Um estudo realizado em Espanha, referente ao ano 2004, relata como agente causal do surto de micobactérias, M. a. hominissuis, tendo-se observado que os gânglios linfáticos afectados foram, principalmente, os mesentéricos seguidos dos submaxilares (Estrada, 2006).
2.1.3.6. Importância económica
A linfadenite granulomatosa em suínos, causada por micobactérias de MAC, é uma infecção que não altera o desempenho dos animais, mas é de importância económica devido à rejeição ou destino condicionado das carcaças afectadas (Martins et al., 2002). A infecção de suínos por bactérias de MAC acarreta elevadas perdas económicas tanto para os produtores quanto para as agro-indústrias, devido a restrições de movimentos de animais provenientes de explorações infectadas e à rejeição total ou parcial de carcaças, no matadouro (Martins et al., 2002; Vilela, 2005; Oliveira et al., 2006). As micobacterioses em suínos provocam grandes perdas económicas aos agricultores de todo o mundo. As perdas são causadas sobretudo pela restrição no transporte de animais de explorações infectadas (com excepção do matadouro), abate de animais positivos durante o teste da tuberculina e do preço da carne e de órgãos de animais infectados (Balian et al., 1997; Komijn et al., 1999; Pavlik et al., 2003).
A reprovação justifica-se pelo potencial zoonótico destas infecções e também pela impossibilidade de se distinguir no matadouro as micobacterioses da tuberculose clássica, causada por Mycobacterium bovis ou Mycobacterium tuberculosis (Thoen, 1992; Acha e
12
Szyfres, 2001, Balian et al., 1997; Morés e Silva, 2001). Tais reprovações têm comportamento sazonal, uma vez que a viabilidade do agente pode ser influenciado por factores ambientais, como a temperatura e a humidade. Se, não houver influência de factores ambientais, espera-se um padrão constante de lesões observadas em matadouro ao longo do ano (Martins et al., 2004; Oliveira et al., 2006). As linfadenites granulomatosas dos suínos determinam prejuízos económicos e oferecem riscos para a Saúde Pública (Pinto, 2003).
Como a linfadenite granulomatosa não causa sintomatologia clínica nos suínos, o produtor só vem a saber que o seu efectivo está infectado quando começa a receber um valor inferior pelos seus animais, quando as carcaças ou parte destas são rejeitadas no abate por apresentarem lesões. A estimativa dos prejuízos causados pelas micobacterioses varia de acordo com o preço de mercado do suíno e com os custos do processamento (Rossi, 2003).
2.1.4. Patogenia
A virulência das micobactérias reside nos constituintes da parede celular. Os micosídeos, fosfolipídeos e sulfolipídeos protegem o bacilo frente aos fagócitos. Os glicolipídeos são responsáveis pela formação granulomatosa e favorecem a sobrevivência da micobactéria fagocitada por impedirem a fusão do fagolisossoma. A cera D e várias tubérculo-proteínas induzem a reacção de hipersensibilidade retardada detectada no teste da tuberculina. Não produzem qualquer toxina ou enzima conhecida que lesione directamente os tecidos infectados, sendo a resposta imune do hospedeiro, a principal causa de injúria nos tecidos (Abbas et al., 1995; Quinn et al., 1994).
Após a adesão, os bacilos são fagocitados pelos macrófagos e produzem uma inflamação granulomatosa composta por células. O tubérculo é formado, principalmente, pela proliferação de células inflamatórias no local. Estes nódulos iniciais podem permanecer estacionários ou evoluir para lesões inflamatórias progressivas, cujo centro apresenta necrose com material caseoso. Podem ser disseminadas em vários órgãos metástases, principalmente, quando o agente etiológico é M. bovis (Sobestiansky et al., 1999).
A infecção por MAC em suínos ocorre, principalmente, por via oral, levando ao aparecimento de lesões em gânglios linfáticos que drenam o tracto digestivo, sendo raros os casos de generalização. A infecção nesta espécie não é acompanhada por sinais clínicos, sendo detectada somente ao abate. O complexo primário é dificilmente detectável pela inspecção macroscópica, mas microscopicamente podem observar-se tubérculos na mucosa da faringe e intestino delgado, enquanto as lesões macroscópicas são vistas, mais frequentemente nos gânglios linfáticos cervicais e mesentéricos, embora outros órgãos também possam ser
13
atingidos. Os gânglios linfáticos mediastínicos são ocasionalmente afectados (Jubb et al., 1992; Thoen, 1992; Morés e Silva, 2001). O complexo principal é incompleto, quando só se desenvolve nos gânglios linfáticos faríngeos da cabeça. Nesse caso, o local de entrada do agente encontra-se nas amígdalas. Quando a bactéria penetra através da parede do intestino (placas de Peyer), o complexo primário inclui os gânglios linfáticos mesentéricos (Herenda et al., 1994).
Em geral, as lesões por micobactérias estão limitadas aos gânglios linfáticos da região mesentérica e mandibular.Mesmo em fêmeas, embora com lesões maiores, estão localizadas nos gânglios linfáticos da cabeça (Huitema, 1992). Isto indica que, a disseminação da infecção para outros gânglios linfáticos ou órgãos, é pouco frequente e que o complexo primário, por norma contem a infecção. A propagação de micobactérias ocorre quando a resposta do sistema imunológico diminui, existem infecções concomitantes, deficiências nutricionais, stresse permanente e idade avançada (Estrada, 2006).
2.1.5. Quadro lesional
As linfadenites granulomatosas dos suínos causadas por micobactérias atípicas, principalmente, as de MAC, são destituídas de sinais clínicos, sendo detectados somente ao abate, pelo serviço de inspecção sanitária (Acland e Whitlock, 1986; Acha e Szyfres, 2001; Rossi, 2003). É uma infecção de importância económica, mas não provoca mortalidade, sinais clínicos nem atraso no crescimento dos animais (Thoen, 1992; Rossi, 2003).
As infecções por micobactérias em suínos são assintomáticas, detectadas geralmente nos matadouros, visto que os animais são abatidos relativamente jovens (Silva et al., 2000), com cerca de 120-150 dias, não havendo tempo necessário para o desenvolvimento de grandes áreas lesionais (Oliveira et al., 2006, Lara et al., 2009). A linfadenite granulomatosa causada por MAC é de evolução crónica, podendo levar até quatro meses para o aparecimento das lesões macroscópicas (Thoen, 1992). Estas infecções, normalmente, não são importantes para a vida produtiva do animal, pois raramente se verificam quadros generalizados. Isto é, principalmente, devido à vida produtiva curta da espécie, que não permite que as condições de uma infecção generalizada se desenvolvam (Estrada, 2006).
Mycobacterium avium hominissuis é um agente saprófita e oportunista presente no ambiente (Nichols et al., 2004), portanto, os suínos estão em contacto permanente com o microrganismo sem apresentarem sinais clínicos (Domingos et al., 2009). O stresse devido a condições meteorológicas extremas, como calor e seca, pode afectar o sistema imunológico dos suínos e levar ao desenvolvimento da infecção (Sutherland et al., 2006).
14
A localização das lesões nos tecidos dos suínos afectados é importante e define o destino das carcaças nos matadouros (Morés et al., 2007). As lesões nos suínos localizam-se geralmente nos gânglios linfáticos da cabeça, pescoço (cervicais) e mesentéricos, pois em 94% das vezes a porta de entrada é oral (Brown e Neuman, 1979; Janetschke et al., 1963; Morés et al., 1997; Matlova et al., 2004; Domingos et al., 2009) e, secundariamente, nos mediastínicos (Balian et al., 1997; Silva et al., 2000; Lara et al., 2009). A ocorrência exclusiva de lesões nestes gânglios, da cadeia digestiva, sugere fortemente o envolvimento de micobactérias de MAC (Pavlik et al., 2003; Matlova et al., 2004).
Um estudo de inoculação experimental de M. avium em suínos, por via oral, demonstrou que o foco primário de lesão ocorre nas amígdalas, seguido dos gânglios linfáticos submaxilares, tendo-se detectado lesões nos gânglios linfáticos mesentéricos, que se tornaram macroscópicas após 3 a 4 meses (Ellsworth et al., 1980; Acland e Whitlock, 1986).
As lesões provocadas por MAC, na maioria das vezes, ficam limitadas aos gânglios linfáticos do sistema digestivo (Matlova et al., 2004). Mycobacterium avium, geralmente, provoca linfadenites localizadas (gânglios linfáticos submaxilares ou mesentéricos) no porco (Hibiya et al., 2009). Em contraste, as lesões causadas por M. bovis ou M. tuberculosis, provocam lesões disseminadas em outros órgãos como no fígado, baço e pulmão. No entanto, estas diferenças não podem ser generalizadas (Sobestiansky et al., 1999).
O agente causal mais comum encontrado em lesões nos gânglios linfáticos mesentéricos (jejunal e ileocecal) e submaxillares e, ocasionalmente, no inguinal dos animais é M.a.h. (Matlova et al., 2005; Pavlik et al., 2007). Os animais infectados com M.a.h. podem desenvolver lesões localizadas nos gânglios linfáticos submaxilares, retrofaríngeos, cervicais e mesentéricos, podendo assumir a forma granulomatosa ou necrosante difusa (Vilela, 2005; Tirkkonen et al., 2007). Segundo os trabalhos de Brown e Neuman (1979), 79-91% das lesões granulomatosas de suínos revelam presença de micobactérias. Estes microrganismos podem ainda estar presentes no tecido muscular, estando também descrito na bibliografia o seu isolamento a partir de gânglios linfáticos de suínos sem lesões visíveis (Balian et al., 1997; Vilela, 2005; Tirkkonen et al., 2007).
2.1.5.1. Lesões macroscópicas
O Complexo Mycobacterium avium produz lesões granulomatosas de natureza proliferativa. Em termos macroscópicos apresentam-se como áreas caseosas, de coloração branco-amarelada que variam desde pequenos focos com poucos milímetros até lesões maiores, podendo atingir todo o gânglio. Os gânglios linfáticos apresentam-se aumentados de
15
tamanho e de consistência firme (Morés e Silva, 2001). As lesões granulomatosas são muito frequentes em suínos e caracterizam-se por apresentarem pequenas dimensões, variando de caseosas, do tamanho da ponta de um alfinete, a caseo-calcáreas do tamanho de uma ervilha. Estas lesões são consideradas patognomónicas (Brown eNeuman, 1979; Balian et al., 1997; Pinto, 2003; Hibiya et al., 2009). Segundo Balian et al. (1997), as linfadenites caracterizam-se por lesões puntiformes até 2 cm de diâmetro, contendo material caseo-purulento, granuloso ao corte e de fácil remoção. E podem-se apresentar como abcessos e/ou granulomas (Balian et al., 1997). Ao corte apresentam lesões necrótico-purulentas focais, de diâmetro variável e tonalidade branco-amarelada (Lara et al., 2009).
Não é possível uma diferenciação consistente entre as lesões causadas por M. bovis, M. tuberculosis e M. avium e demais micobactérias baseada nas lesões macroscópicas e histopatológicas (Morés e Silva, 2001; Silva et al., 2001).
2.1.5.2. Lesões microscópicas
A nível microscópico, as lesões variam desde pequenos focos de macrófagos, com proliferação de células epitelióides e células gigantes a lesões com predomínio de áreas de necrose de caseificação e calcificação distrófica, delimitadas por uma espessa cápsula fibrosa, especialmente em lesões mais antigas, podendo também ocorrer fibrose paracortical e hiperplasia folicular (Morés e Silva, 2001; Balian et al., 1997, Morés et al., 2007). Silva et al. (2000), nos exames histopatológicos observaram lesões granulomatosas do tipo proliferativo, com acumulação de macrófagos, células epitelióides e células gigantes, com carácter infiltrativo, que evoluíram para fibroplasia. Em estádios mais avançados, os granulomas apresentaram-se demarcados por uma cápsula fibrosa, que continham necrose de caseificação e, em muitos casos, calcificação.
É difícil, a nível microscópico, estabelecer a diferença entre lesões causadas pelo bacilo aviário e pelo bovino nos gânglios linfáticos. Existem, contudo, algumas características que podem servir como parâmetros: em infecções pelo bacilo aviário raramente existe calcificação; não há tendência à formação de cápsula em torno das lesões e, estas são de difícil destacamento dos tecidos vizinhos (Perestrelo-Vieira et al., 2000). Jubb et al. (1992), afirmaram haver uma pequena tendência de encapsulamento da lesão decorrente de infecção por M. avium. Em contraste, as lesões causadas por M. bovis ou M. tuberculosis (bacilos do tipo mamífero) são geralmente encapsuladas e fáceis de separar dos tecidos adjacentes. Geralmente, em infecções por bacilos do tipo mamífero há formação de calcificação nas
16
lesões. No entanto, estas diferenças não podem ser tomadas como regra geral (Perestrelo-Vieira et al., 2000).
2.1.6. Diagnóstico
O estabelecimento do diagnóstico da infecção por micobactérias de MAC, em suínos vivos, é complicado, não existindo ainda um único teste completamente eficaz (Sobestiansky et al., 1999).
A presença de lesões granulomatosas limitadas aos gânglios linfáticos da cadeia digestiva em suínos de uma exploração fechada, sem contacto com outros mamíferos, e a ausência de produtos lácteos na dieta são sugestivos de infecção por MAC (Morés et al., 2007).
A micobacteriose suína é diagnosticada em matadouros por uma detecção visual de lesões granulomatosas nos órgãos (Tirkkonen et al., 2007). Quer as lesões macroscópicas quer microscópicas são características, permitindo um diagnóstico presuntivo. No entanto, este deve ser confirmado por outros métodos, como o isolamento e identificação do agente etiológico. O facto das provas culturais e bioquímicas nem sempre serem eficazes para a identificação do MAC, levou ao desenvolvimento de métodos serológicos (seroaglutinação ou ELISA) e de biologia molecular, mais rápidos e específicos (Vilela, 2005; Morés et al., 2006; 2007).
As lesões ganglionares causadas por Rhodococcus equi em suínos são difíceis de distinguir tanto macroscópica como microscopicamente, de lesões causadas por micobactérias, dificultando o diagnóstico a nível da inspecção nos matadouros (Perestrelo-Vieira et al., 2000).
2.1.6.1. Diagnóstico in vivo
Nos suínos, o diagnóstico presuntivo da infecção por MAC in vivo conta apenas com o teste da tuberculina por comparação (intradérmico comparado), utilizando-se tuberculina PPD (derivados proteicos purificados) aviária e bovina, o que permite distinguir tuberculose clássica por M. bovis das infecções causadas por MAC. Este teste apresenta baixa sensibilidade e especificidade para identificar animais infectados, mas é útil para ser aplicado com o objectivo de identificar efectivos positivos. Porém existem, divergências entre diferentes autores quanto aos critérios de aplicação, leitura e interpretação do teste em suínos, dificultando a sua utilização. O local mais utilizado para a aplicação intradérmica é o bordo
17
anterior da orelha, próximo da base. Utilizam-se tuberculinas do tipo aviária e bovina, uma em cada orelha, em simultâneo, uma vez que os suínos infectam-se e desenvolvem lesões perante os dois bacilos. A dose recomendada é 0,1 ml e a leitura deve ser feita em 48 a 72 horas (Thoen, 1992; Sobestiansky et al., 1999; Morés et al., 2006). O teste de tuberculinização comparada pode fornecer informação importante sobre o grupo de micobactérias envolvido (Morés et al., 2007).
As micobactérias ambientais podem sensibilizar os suínos e outros animais domésticos, originando reacções inespecíficas em testes da tuberculina e serológicos. Esta interferência imunológica pode complicar o diagnóstico da tuberculose animal (Vilela, 2005; Pavlik et al., 2007). Existe uma grande percentagem de erro no teste com tuberculina nos suínos devido à sensibilidade inespecífica ou ainda resposta alérgica a infecções passadas. As reacções negativas à tuberculina em animais nos quais existem lesões, podem ser devidas à capacidade do sistema imunitário do suíno em controlar as lesões existentes, tornando-as estéreis (Perestrelo-Vieira et al., 2000). Mycobacterium avium hominissuis e outras micobactérias atípicas que estão presentes em alguns dos componentes do ambiente, podem complicar o diagnóstico de tuberculose pelo teste cutâneo com tuberculina aviária (Pavlik et al., 2007).
As lesões macroscópicas podem levar cerca de 90 dias a aparecerem. Há indicações de que as lesões podem regredir em animais adultos e embora estes animais, geralmente, reajam à tuberculina. Alguns estudos recentes estão a avaliar a especificidade do teste serológico de ELISA (Sobestiansky et al., 1999).
Segundo um estudo de Faldyna et al. (2008), a detecção do antigénio específico induzida por interferon-γ podem ser muito útil como método de diagnóstico de micobacterioses em suínos vivos. Pavlik et al. (2007), realizaram um exame serológico através do teste de aglutinação rápida em lâminas com antígenos fabricados a partir de três membros de MAC: M.a.a (serótipo 2), M.a.h. (serótipo 8) e M.i. (serótipo 19), de sangue de animais positivos ao teste da tuberculina, com bons resultados.
O diagnóstico clínico é praticamente impossível de ser realizado, sendo necessário o exame macroscópico e histopatológico das lesões (Perestrelo-Vieira et al., 2000).
2.1.6.2. Diagnóstico histopatológico
A suspeita de micobacteriose surge com a observação de granulomas, principalmente, a nível dos gânglios linfáticos do tracto digestivo (Morés et al., 2007). Um diagnóstico
18
presuntivo de micobacteriose é suportado pelas características microscópicas do granuloma e pela observação microscópica de pequenos bacilos álcool-ácido resistentes (Miranda, 2009).
2.1.6.3. Diagnóstico por exame microscópico
As micobactérias são identificadas pela coloração de Ziehl-Neelsen, na qual a fucsina se liga fortemente aos lipídios da parede celular e não é removida por descoloração pelo álcool-ácido, mostrando-se o agente com tonalidade avermelhada: os denominados bacilos álcool-ácido resistentes (BAAR). Não coram adequadamente pela coloração clássica de Gram, quando corados são do tipo Gram positivos (Acha e Szyfres, 2001; Quinn et al., 2005).
2.1.6.4. Diagnóstico por cultura
Há dificuldades para o diagnóstico microbiológico por isolamento do agente; pois exige procedimentos especiais de laboratórios, devido ao prolongado tempo de incubação requerido, entre 6 e 8 semanas, que tem baixa sensibilidade e custo elevado de execução (Thoen, 1992; Vilela, 2005). Deve-se recorrer ao isolamento e tipificação dos agentes etiológicos, a partir das lesões macroscópicas, mas o isolamento das micobactérias é extremamente trabalhoso e dispendioso (Sobestiansky et al., 1999).
O género Mycobacterium é altamente exigente no que se refere a nutrientes, quando comparados com outras bactérias patogénicas como Staphylococcus aureus, Salmonella spp, Escherichia coli e outras enterobactérias. Tais características facilitam a multiplicação anterior de contaminantes menos exigentes, tornando indispensável a aplicação de um tratamento das amostras previamente à tentativa de isolamento de micobactérias. Sendo assim, a descontaminação é um procedimento indispensável para amostras consideradas não esterilizadas ou contaminadas, tais como: urina, suco gástrico, lavagens brônquicas, secreções purulentas e fezes, entre outras. Isto tem como objectivo a máxima inactivação dos microrganismos das amostras, tendo consequência mínima para as micobactérias presentes. Para a descontaminação, tem sido utilizado o método de Petroff (hidróxido de sódio a 4%), para gânglios linfáticos, conteúdo de lesões granulomatosas, fígado, baço, pulmão, entre outras e, o método de Löewenstein-Jensen modificado (ácido sulfúrico a 4%) (Balian et al., 2002; Morés et al., 2006).
Mycobacterium multiplica-se em meios específicos compostos por gema de ovo e amido, enriquecidos por asparagina, contendo verde malaquite como descontaminante. (Corrêa e Corrêa, 1992). Quanto às características das colónias de MAC em meio sólido, as
19
variantes lisas transparentes são as mais frequentes em isolados clínicos, enquanto que, as lisas-opacas e as rugosas-opacas são frequentemente isoladas do meio ambiente. Porém, a variação na morfologia da colónia é transitória e reversível (Pavlik et al., 2000). Komijn et al. (1999), utilizaram para inocular o meio Löewenstein-Jensen®, “Stonenbrink egg medium” e Middlebrook® 7H10 agar, seguido de incubação por 4 semanas a 37ºC e identificaram as bactérias de MAC das subculturas pelas seguintes características: crescimento após 2 a 4 semanas de incubação, negativo ou duvidoso a reacção da fosfatase ácida, reacção negativa de nitrato redutase, fracamente positivos a reacção da catalase (<45 mm) à temperatura ambiente, reacção variável à catalase a 68°C, reacção negativa a β-d-galactosidase, nicotinamidase positiva e actividade pirazinamidase, e a actividade da urease negativa. M. avium cresce em meios como Löwenstein-Jensen®, “Herrold’s Egg Yolk Medium” (HEYM), Middlebrook® 7H10 e 7H11 ou Coletsos, com 1% de piruvato de sódio adicionado. As culturas devem ser incubadas pelo menos durante 8 semanas (Cousins, 2008). Glawisching et al. (2006), utilizaram o meio Middlebrook® 7H11 agar enriquecido com OADC para o cultivo de M.a.a. e M.a.h. Contudo, utilizam-se outros meios de cultura como o BACTEC® 9000 líquido e o Stonebrink (Domingos et al., 2009)
Em suínos com lesões limitadas aos gânglios linfáticos do tracto digestivo, não ocorre bacteriemia, sugerindo que, este tipo de infecção localizada, não proporciona risco de contaminação da carne. Nestes casos, as tentativas de isolamento de micobactérias no fígado e na carne não tiveram sucesso (Sobestiansky et al., 1999).
Para o diagnóstico de micobactérias, requer-se um laboratório especializado que atenda as normas de biossegurança de nível 2 a 3 (van Coppenraet, 2009).
2.1.6.5. Diagnóstico molecular
A introdução da reacção em cadeia da polimerase (PCR) e polimorfismo no comprimento de fragmentos de restrição (RFLP) no diagnóstico destas infecções, tornou-se possível devido à descoberta de sequências de inserção (IS) específicas para micobactérias patogénicas. As IS são pequenos fragmentos de DNA que podem ser específicos da espécie, específicos da estirpe ou específicos para um determinado grupo de estirpes, representando uma ferramenta muito útil como marcador genético (van Soolingen et al., 1998; Dvorska et al., 2004).
A técnica de PCR tem sido usada com sucesso para identificar as micobactérias, a partir do isolamento primário (Sobestiansky et al., 1999). A PCR é utilizada para a detecção de dnaJ, um gene específico para o género Mycobacterium, através do uso de primers
20
específicos. Estes permitem a detecção de espécies de sequências de inserção específicas (Matlova et al., 2004; Pavlik et al., 2007). Segundo Domingos et al. (2009), IS1245 RFLP mostrou-se um método adequado para a tipagem de estirpes de M. a. hominissuis com grande poder discriminatório.
2.1.7. Diagnóstico diferencial
A linfadenite em suínos é caracterizada pela pluralidade de agentes infecciosos, predominantemente de origem bacteriana, muitos dos quais com potencial zoonótico. As lesões são causadas principalmente pelo género Mycobacterium e, em menor frequência, por Rhodococcus equi (Dvorska et al., 1999; Silva et al., 2000). O diagnóstico diferencial deve incluir outras linfadenites ou abcessos de etiologia bacteriana, como as provocadas por R. equi e agentes de actinogranulomas (Vilela, 2005).
Ocasionalmente, é determinada por outras bactérias que incluem Arcanobacterium pyogenes, enterobactérias, os géneros Staphylococcus spp. e Nocardia. As lesões de origem granulomatosa ou piogranulomatosa causadas por estes agentes são indistinguíveis macroscopicamente na linha de abate, necessitando de suporte laboratorial para confirmação do diagnóstico (Acha e Szyfres, 2001; Lara et al., 2009). Outras bactérias como R. equi e Arcanobacterium beta-hemolíticos podem provocar lesões semelhantes às do grupo denominado por MAC (Ginsberg e Fitzpatrick, 1950; Balian et al., 1997).
O diagnóstico diferencial também deve incluir: tumores, abcessos e lesões parasitárias. Os últimos são muitas vezes esverdeados. Rhodococcus equi, afecta o gânglio linfático submaxilar, lesão que pode ser facilmente enucleada de uma cápsula, ao contrário da lesão granulomatosa que é difícil de extirpar (Herenda et al., 1994)
2.1.8. Controlo e profilaxia
A eliminação das fontes de infecção, o abate dos animais positivos, o acompanhamento em matadouro e os testes periódicos com tuberculina e desinfecção das instalações, possibilitam o controlo da infecção (Sobestiansky et al., 1999). O estudo epidemiológico, quando bem executado, revela possíveis fontes de infecção (bovinos, aves domésticas/silvestres, material usado como cama) (Perestrelo-Vieira et al., 2000). Quando uma infecção está estabelecida num efectivo suíno é difícil prevenir ou eliminar a infecção (Hines II et al., 1998). As medidas de controlo baseadas apenas na identificação e eliminação de animais positivos pelo teste da tuberculina não garantem o controlo da infecção, pois o