D
ESENVOLVIMENTO DE
D
OCE DE
K
IWI
A
VALIAÇÃO DAS
P
ROPRIEDADES
F
ÍSICO
-Q
UÍMICAS
,
M
ICROBIOLÓGICAS E
S
ENSORIAIS DE DOCE DE KIWI AO LONGO DO TEMPO DE
ARMAZENAMENTO
Dissertação de Mestrado em Segurança Alimentar
Célia Maria Araújo Gonçalves Magalhães Pimenta
Sob Orientação:
Professora Doutora Rita Pinheiro e Professor Doutor Luís Patarata
D
ESENVOLVIMENTO DE
D
OCE DE
K
IWI
A
VALIAÇÃO DAS
P
ROPRIEDADES
F
ÍSICO
-Q
UÍMICAS
,
M
ICROBIOLÓGICAS E
S
ENSORIAIS DE DOCE DE KIWI AO LONGO DO TEMPO DE
ARMAZENAMENTO
Dissertação de Mestrado em Segurança Alimentar
Célia Maria Araújo Gonçalves Magalhães Pimenta
Sob Orientação:
Professora Doutora Rita Pinheiro e Professor Doutor Luís Patarata
Composição do Júri:
Presidente: Professor Doutor José António Oliveira e Silva
Vogais: Professora Doutora Fernanda Cosme Martins
Professora Doutora Rita Pinheiro
apoiaram e ajudaram a concretizar esta dissertação de mestrado:
Aos meus Orientadores à Professora Doutora Rita Pinheiro (ESTG) e ao Professor Doutor Luís Patarata, pelo incentivo e motivação constante, pelo apoio científico e tecnológico, pelo rigor e exigência, pelo interesse demonstrado pelo tema da dissertação, pela atenção, pela ajuda fundamental a todos os níveis. Sem eles a realização deste trabalho não seria possível.
À Escola Superior de Tecnologia e Gestão (ESTG) do Instituto Politécnico de Viana do Castelo, pela oportunidade e pela disponibilidade dos meios concedidos durante a execução do desenvolvimento experimental.
À Engenheira Susana, pela sua disponibilidade e simpatia durante todos estes meses de trabalho, pela transmissão dos seus conhecimentos nas técnicas de laboratório e pelo apoio e incentivo durante a execução do trabalho laboratorial.
À Técnica Isabel Alves pela sua simpatia e incentivo ao longo da elaboração da minha dissertação.
Aos funcionários e Professores da ESTG que pertenciam ao meu painel de provadores toda a disponibilidade e simpatia ao longo das diversas provas sensoriais.
Aos meus amigos de longa data e àqueles que fui ganhando ao longo da minha vida académica, pela amizade sincera e pela paciência que tem tido. Em especial às amigas Cátia, Andreia, Marlene, Joana, Marisa, Brigitte e Helena, pelo companheirismo, pela amizade, pelo apoio total e pela motivação.
À minha maravilhosa Família, não há palavras para descrever toda a gratidão que tenho por eles, mas sem o amor, a força, a muita paciência e o incentivo incondicional, nada disto seria possível. O meu especial agradecimento é para o meu Pai, pelo lutador que foi durante a sua vida, e para a minha Mãe, pela guerreira que é, pelo amor, força e determinação que ambos me transmitiram ao longo da minha vida.
Apresentação em poster:
Pimenta, C., Vaz Velho, M., Patarata, L. and Pinheiro, R. (2014) Evaluation of the effect of two antioxidants formulations on chemical, and physical properties of a Kiwi jam during twenty weeks of storage. 8th International Conference on Water in Food, 25-27 Maio, Polytechnic University of Timişoara, Roménia.
Pimenta, C., Vaz Velho, M., Patarata, L. and Pinheiro, R. (2014) Production and consumer acceptability of a Kiwi jam. Eurosense 2014: 6th European Conference on Sensory and Consumer Research 'A Sense of Life', 7-10 Setembro, Bella Center, Copenhaga, Dinamarca.
para aplicação industrial. A sua utilização é possível em produtos como doces, geleias, sumos, fruta desidratada, entre outras. Trata-se de um fruto sazonal e nem todas as variedades de kiwi estão disponíveis durante todo ano. Os doces podem ser considerados como um dos produtos com maior destaque comercial para a indústria de conservas de frutas. A transformação de frutas em doces possibilita aproveitar as colheitas e produção agrícolas, favorecendo o consumo de fruta e a sua disponibilidade durante todo o ano. Este trabalho teve como objetivo a otimização e estudo de um doce de kiwi com elevado teor de vitamina C ao longo do tempo de armazenamento. Para tal, realizaram-se três formulações base com 45% de kiwi, 40% de açúcar e ≈15% de água, à qual se adicionou 0,1% de ácido cítrico ou 0,05% de ácido ascórbico e sem qualquer adição de antioxidante (controlo). Estas formulações foram armazenadas durante 20 semanas à temperatura ambiente e ao abrigo da luz. Ao longo do tempo de armazenamento foram avaliadas as características físico-químicas, microbiológicas e sensoriais das diferentes formulações. Os resultados mostraram que alguns dos parâmetros analisados permanecem constantes ao longo do tempo de armazenamento, tais como: o teor de sólidos solúveis, o valor de pH, a acidez, a atividade de água e o teor de açúcares totais. Verificou-se que, no final do tempo de armazenamento, a formulação com a adição de 0,1% de ácido cítrico apresentou uma diminuição de 35% de ácido ascórbico, enquanto que a formulação com ácido ascórbico e o ensaio controlo apresentaram um decréscimo de 48% e 44%, respetivamente. Relativamente à atividade antioxidante, o ácido ascórbico revelou ter maior potencial antioxidante do que o ácido cítrico, de facto a atividade antioxidante promovida pelo ácido ascórbico manteve-se inalterada até à 16ª semana de armazenamento. Relativamente aos parâmetros físicos, verificou-se que a cor de todas as formulações varia ao longo do tempo de armazenamento. Quanto à textura, observou-se que a formulação com a adição de 0,1% de ácido cítrico apresenta uma consistência inferior às restantes. Em termos microbiológicos, o doce de kiwi apresentou contagens de microrganismos totais a 30ºC e bolores e leveduras a 25oC abaixo do limite de deteção. Concluiu-se ainda que, de uma forma geral, as características sensoriais mantiveram-se inalteradas ao longo das 20 semanas de armazenamento.
application. Its use is possible in products such as jams, jellies, juices, dried fruit, among other uses. This is a seasonal fruit and not all varieties of kiwi fruit are available throughout the year. Jams are considered as one of the largest commercial products with emphasis on canned fruits. The processing of fruit in jams and marmalades allows the valorization of agriculture products and allows the consumption of fruit and its availability throughout the year. This study aimed to optimize a kiwi jam with a high content of vitamin C during storage time. It was prepared three basic formulations with 45% Kiwi, 40 % sugar and ≈ 15 % water, to which it was added 0.1 % citric acid, 0.05 % ascorbic acid and a control test. These formulations were stored for 20 weeks at room temperature protected from light. During the storage it was evaluated physico-chemical, physical, microbiological and sensory characteristics of the jams with different formulations. It was observed that some parameters remain more or less constant throughout the storage period (20 weeks), including soluble solids, pH, acidity, water activity and total sugar content. It was found that, at the end of the storage time, the formulation with 0,1% of citric acid showed a reduction of 35% of ascorbic acid, while the formulation with 0,05% of ascorbic acid and the control formulation presented a decreased of 48% and 44%, respectively. The antioxidant activity of ascorbic acid was higher than that observed with citric acid. The antioxidant activity promoted by ascorbic acid (CAA formulation) remained unchanged until 16 weeks of storage. Regarding the physical parameters, it was found that the color of all formulations varies over storage time. Concerning the texture, it was observed that the formulation with the addition of 0.1 % citric acid had a lower consistency. The counts of total microflora at 30oC and yeasts and molds at 25oC were below the detection limit during all the experiment. The most part of the sensory characteristics were maintained throughout the 20 weeks of storage.
Keywords: jam, kiwi, microbiological profile, sensory parameters, ascorbic acid and
A
BSTRACT ... VÍ
NDICE DEQ
UADROS ... IXÍ
NDICE DEF
IGURAS ... XIL
ISTA DE ABREVIATURAS E SIGLAS ... XIIICapítulo 1.
I
NTRODUÇÃO ... 11.1. Objetivos ... 2
Capítulo 2.
R
EVISÃOB
IBLIOGRÁFICA ... 32.1. O Fruto Kiwi ... 4
2.1.1. Composição Nutricional ... 5
2.1.2. Sabor e aroma do kiwi ... 7
2.1.3. Propriedades funcionais do kiwi ... 7
2.1.4. Agentes alergénios ... 8
2.2. Processo produtivo de doce de fruta ... 9
2.3. Enquadramento legal para os doces... 10
2.4. Aditivos alimentares ... 11
2.4.1. Antioxidantes ... 11
2.4.2. Agente gelificante – Pectina ... 12
2.4.2.1. Características da pectina ... 12
2.4.2.2. Condição para a formação do gel num doce de fruta... 13
2.4.2.3. Influência do pH na formação do gel de pectina ... 14
2.4.3. Enquadramento legal para o uso de aditivos alimentares ... 15
2.5. Caracterização dos Doces de Fruta ... 16
2.5.1. Parâmetros Físico-químicos... 16
2.5.1.1. Teor de Sólidos solúveis ... 16
2.5.1.2. Atividade antioxidante ... 17
2.5.1.3. Ácido Ascórbico (vitamina C) ... 17
2.6. Degradação dos doces de fruta ... 20
2.6.1. Degradação microbiológica ... 20
2.6.2. Degradação da cor ... 21
2.6.3. Degradação do gel ... 22
2.6.4. Degradação da Vitamina C ... 23
2.7.Referência a alguns estudos realizados em produtos transformados à base de fruta ... 24
Capítulo 3.
M
ATERIAL EM
ÉTODOS ...283.1. Ensaios preliminares ... 29
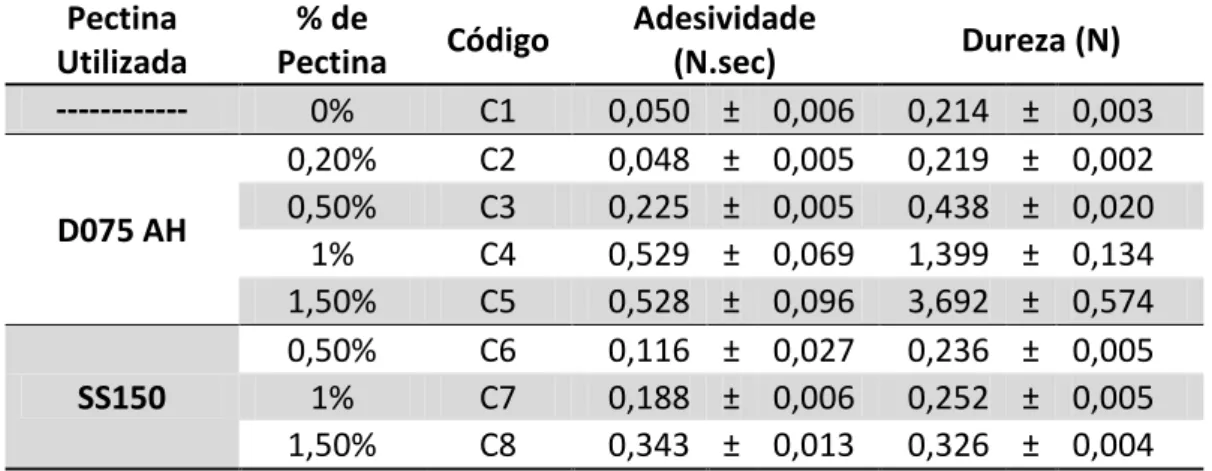
3.1.1. Seleção do tipo de pectina ... 29
3.1.1.1. Seleção da percentagem de pectina ... 30
3.1.2. Seleção do binómio tempo/temperatura do processo térmico ... 30
3.2. Desenvolvimento do Doce de Kiwi ... 32
3.2.1. Seleção da matéria-prima: Kiwi... 32
3.2.2. Formulação do Doce de Kiwi ... 33
3.2.3. Processo de produção ... 33
3.2.4. Ensaios realizados ... 34
3.3. Métodos analíticos ... 36
3.3.1. Análises físico-químicas ... 36
3.3.1.1. Determinação da humidade ... 36
3.3.1.2. Determinação das cinzas... 36
3.3.1.3. Determinação da Atividade da água ... 36
3.3.1.4. Determinação do pH ... 36
3.3.1.5. Determinação do teor de sólidos solúveis (oBrix) por refratometria ... 37
3.3.1.6. Determinação do teor de ácido ascórbico ... 37
3.3.1.7.Determinação da atividade antioxidante pela captura do radical livre DPPH ... 37
3.3.1.8. Determinação do teor de açúcares totais, redutores e não redutores ... 37
3.3.1.9. Determinação da acidez ... 38
3.3.3. Análises microbiológicas ... 39
3.3.3.1. Preparação da suspensão-mãe e das respetivas diluições ... 39
3.3.3.2. Contagem de Bolores e Leveduras a 25oC ... 39
3.3.3.3. Contagem de microrganismos totais a 30oC ... 40
3.3.4. Caracterização sensorial ... 40
3.3.5. Análise estatística ... 41
Capítulo 4.
R
ESULTADOS ED
ISCUSSÃO DER
ESULTADOS ...424.1. Análises físico-químicas ... 43
4.2. Análises físicas ... 53
4.3. Análises microbiológicas ... 59
4.4. Caracterização sensorial ... 59
Capítulo 5.
C
ONCLUSÃO E SUGESTÕES PARA TRABALHOS FUTUROS ...65Capítulo 6.
R
EFERÊNCIASB
IBLIOGRÁFICAS ...68 Capítulo 7.A
NEXOS ... LXXVIIAnexo 1: Resultados adquiridos durante a seleção do agente gelificante ... LXXVIII Anexo 2: Ficha de prova entregue aos consumidores, a fim de verificar a aceitabilidade do produto em estudo – Doce de Kiwi. ... LXXIX Anexo 3: Resultados obtidos aquando a seleção do binómio tempo/temperatura do tratamento térmico, em função do teor de ácido ascórbico presente no produto e da sua cor. ... LXXX Anexo 4: Ficha de prova entregue ao painel semi-treinado. ... LXXXIII Anexo 5: Resultado da análise físico-química do teor de ácido ascórbico e atividade antioxidante ... LXXXIV Anexo 6: Resultados da análise à textura (dureza e adesividade) ... LXXXV
Quadro 2-2: Comparação das quantidades mínimas necessárias para a produção de 1000g de “Doce” e 1000g de “Doce Extra” ... 11 Quadro 2-3: Esquematização das condições ótimas de gelificação relacionadas com o tipo de
pectina (Obipektin, 2012) ... 14 Quadro 2-4: Aditivos autorizados no género alimentício “Doce e geleia de qualidade ‘extra’,
referidos no Decreto-Lei no. 230/2003”, segundo o Decreto-Lei no. 64/2011 ... 15 Quadro 2-5: Comparação de alguns parâmetros físico-químicos de diferentes
doces/compotas de fruta (INSA, 2013a) ... 16 Quadro 2-6: Referência a estudos efetuados em produtos transformados à base de fruta ... 25 Quadro 3-1: Codificação dos diversos doces produzidos com a respetiva percentagem de
pectina utilizada ... 29 Quadro 3-2: Codificação das amostras e o respetivo tempo de amostragem em que foi
retirada a amostra ... 31 Quadro 3-3: Apresentação dos resultados obtidos na determinação do teor de ácido
ascórbico (mg/100g de Produto) no doce de kiwi - controlo (CC), no doce de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), para a seleção do binómio tempo/temperatura do tratamento térmico. ... 32 Quadro 3-4: Formulação final do doce de kiwi – controlo (CC), do doce de kiwi com adição de
0,1% de ácido cítrico (CAC) e do doce de kiwi com adição de 0,05% de ácido ascórbico (CAA). ... 33 Quadro 4-1: Análise físico-química da atividade de água, da humidade e da cinza no doce de
kiwi - controlo (CC), no doce de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 45 Quadro 4-2: Análise físico-química do teor de sólidos solúveis (oBrix), dos açúcares redutores,
não redutores e totais no doce de kiwi - controlo (CC), no doce de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 47 Quadro 4-3: Análise físico-química do pH e da percentagem de acidez no doce de kiwi -
controlo (CC), no doce de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 49
(CAA), ao longo de 20 semanas de armazenamento (TA). ... 55 Quadro 4-5: Caracterização sensorial da aparência do doce de kiwi - controlo (CC), do doce
de kiwi com adição de 0,1% de ácido cítrico (CAC) e do doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 61 Quadro 4-6: Caracterização sensorial do cheiro do doce de kiwi - controlo (CC), do doce de
kiwi com adição de 0,1% de ácido cítrico (CAC) e do doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 62 Quadro 4-7: Caracterização sensorial da textura do doce de kiwi - controlo (CC), do doce de
kiwi com adição de 0,1% de ácido cítrico (CAC) e do doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 63 Quadro 4-8: Caracterização sensorial do sabor do doce de kiwi - controlo (CC), do doce de
kiwi com adição de 0,1% de ácido cítrico (CAC) e do doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 64 Quadro 7-1: Apresentação dos resultados obtidos durante a seleção do agente gelificante em
3.1.1. ... LXXVIII Quadro 7-2: Apresentação dos resultados obtidos na determinação da cor no doce de kiwi -
controlo (CC), no doce de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), para a seleção do binómio tempo/temperatura em 3.1.2. (conforme descrito em 3.3.2.1.) ... LXXX Quadro 7-3: Análise físico-química do teor de ácido ascórbico e da capacidade antioxidante
no doce de kiwi - controlo (CC), no doce de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... LXXXIV Quadro 7-4: Análise à textura (dureza e adesividade) do doce de kiwi - controlo (CC), no doce
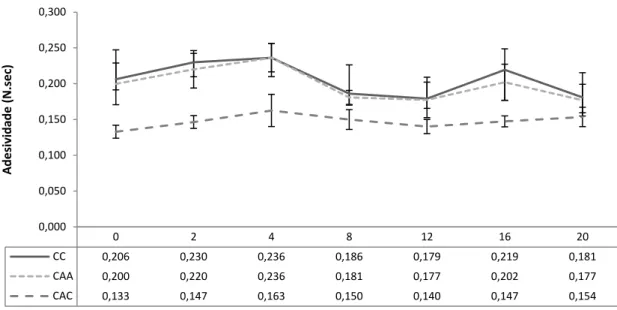
de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). LXXXV
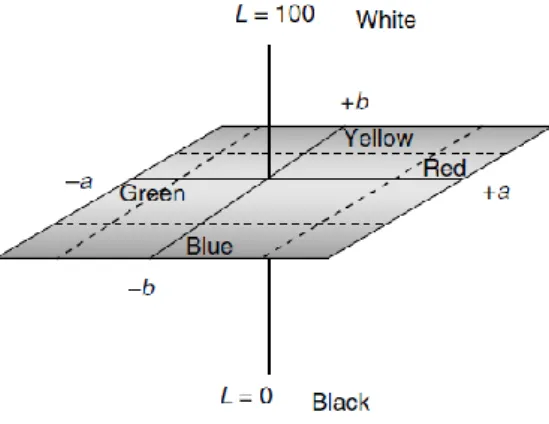
Figura 3-1: Fluxograma do processo de fabrico do Doce de kiwi ... 35 Figura 3-2: Representação tridimensional do sistema CIE L*a*b* (Lozano, 2006a) ... 38 Figura 4-1: Análise ao teor de ácido ascórbico no doce de kiwi - controlo (CC), no doce de
kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 50 Figura 4-2: Análise à atividade antioxidante (EC 50) no doce de kiwi - controlo (CC), no doce
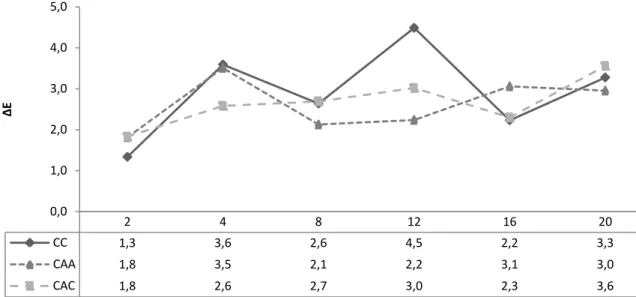
de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 52 Figura 4-3: Análise da diferença total entre duas cores (E), para cada dado em termos de L*,
a* e b* (Quadro 4-5) no doce de kiwi - controlo (CC), no doce de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 56 Figura 4-4: Análise à dureza (N) do doce de kiwi - controlo (CC), no doce de kiwi com adição
de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 57 Figura 4-5: Análise à dureza (N) do doce de kiwi - controlo (CC), no doce de kiwi com adição
de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), ao longo de 20 semanas de armazenamento (TA). ... 58 Figura 7-1: Representação gráfica dos resultados de Dureza das diferentes amostras para a
seleção do agente gelificante ... LXXVIII Figura 7-2: Representação gráfica dos resultados de Adesividade das diferentes amostras
para a seleção do agente gelificante ... LXXVIII Figura 7-3: Representação gráfica dos valores obtidos da cor no doce de kiwi - controlo (CC),
no doce de kiwi com adição de 0,1% de ácido cítrico (CAC) e no doce de kiwi com adição de 0,05% de ácido ascórbico (CAA), segundo o sistema CIE L*a*b* (conforme descrito em 3.3.2.1.) ... LXXXI Figura 7-4: Representação gráfica dos resultados obtidos (apresentados no Quadro 7-3) na
determinação do teor de ácido ascórbico para a seleção do binómio tempo/temperatura do tratamento térmico ... LXXXII
AO - Ascorbato oxidase APX - Ascorbato peroxidase
Aw - Atividade de água
CAA - Doce de kiwi com adição de
0,01% de ácido ascórbico
CAC - Doce de kiwi com adição de
0,1% de ácido cítrico
CC - Doce de kiwi – controlo
CGA - Chloramphenicol Glucose Agar DA - Grupo amida
DE - Grau de esterificação DFIF 2,6-diclorofenolindolfenol DHA - Ácido L-desidroascórbico
g - Grama h - Hora
HM - Alta metoxilação Ig E - Imoglubina E
ISO - International Organization for
Standardization
kDa Quilodalton Kg - Quilograma LM - Baixa metoxilação
LMA - Baixa metoxilação amidada mg - Miligrama
min - Minuto mL - Mililitro
N - Newton
N.sec - Newton por segundo
nm - Nanómetro
NP - Norma Portuguesa o
C - Grau Celcius PCA - Plate Count Agar
PG - Poligalacturase
pH - Potencial de hidrogénio PME - Pectinametilesterase POD - Peroxidase
PPO - Polifenolxidase rpm Rotação por minuto
T - Temperatura
TA - Tempo de armazenamento t/T- Tempo/ temperatura
UFC - Unidade formadora de colónia
g - Micrograma Vit.- C Vitamina C
O consumo de fruta é essencial, uma vez que contém compostos que não são sintetizados pelo organismo humano, tal como algumas vitaminas (Lozano, 2006c). O kiwi pode ser considerado um alimento altamente nutritivo e benéfico para a saúde devido ao elevado teor de Vitamina C e à sua atividade antioxidante. Estas características fazem do kiwi um fruto com elevado potencial para a exploração industrial no desenvolvimento de novos produtos (Figoli et al., 2010).
No passado, a produção de doces e/ou geleias surgiu da necessidade de conservar a fruta, com o objetivo de poder consumir esta mesma fruta fora de época (Baker et al., 2005), tornando-se um produto tradicional. Atualmente, os consumidores são cada vez mais exigentes com os produtos transformados à base de fruta, tanto ao nível da aparência, como ao nível da segurança dos mesmos. É fundamental obter produtos de elevada qualidade, sendo que os principais aspetos valorizados são o valor nutricional (teor de vitaminas, antioxidantes, entre outros), a coloração natural e fresca (alcançar uma coloração mais próxima quanto possível do fruto que deu origem ao produto), bem como o sabor e a textura característica do produto. Estas exigências colocam novos desafios à indústria transformadora de frutas e vegetais, tais como a procura de novas tecnologias e/ou a melhoria das tecnologias utilizadas para conservar a qualidade nutricional e sensorial exigida pelos consumidores (Jongen, 2002).
No mercado existem poucas marcas que utilizam o kiwi para a sua transformação em doce, as existentes são essencialmente dietéticas, mas como se trata de um fruto rico em vitamina C e com elevada atividade antioxidante, pode-se tornar um desafio interessante para haver um desenvolvimento de novos produtos.
1.1.
O
BJETIVOSO objetivo essencial do presente trabalho é o desenvolvimento de um doce de kiwi e a avaliação do efeito da utilização de ácido ascórbico e ácido cítrico nas características químicas, físicas, microbiológicas e sensoriais do produto ao longo do tempo de armazenamento (20 semanas).
2.1.
O
F
RUTOK
IWIO kiwi pertence à família das Actinidiáceas, do género Actinidia e é de origem asiática, mais precisamente da China. O género Actinidia tem diversas espécies que produzem frutos comestíveis, tais como A. chinensis, A. arguta, A. kolomikta, A. Polygama,
A. eriantha e A. deliciosa. A espécie A. deliciosa foi a única explorada comercialmente em
grande escala e existem várias variedades (cultivares), sendo a mais conhecida e eleita pelos consumidores, a ‘Hayward’(Barros, 2007).Esta é a variedade mais comum em Portugal, pois produz frutos de bom calibre e com boa capacidade de conservação, em condições adequadas (GPP, 2013).
As actinídeas são plantas diónicas, isto é, para se produzirem frutos provenientes deste tipo de plantas são necessárias duas variedades (cultivares), a feminina e a masculina, flores femininas e flores masculinas, respetivamente, para que o pólen seja transferido das flores masculinas para as femininas. Contudo, todas as variedades possuem ovários e estames, mas nas flores masculinas os ovários estão atrofiados e o pólen, nas flores femininas, é estéril. A variedade feminina habitualmente usada é a ‘Hayward’, enquanto existem várias variedades masculinas utilizadas, por exemplo ‘Tomuri’, ‘Matua’ e ‘Autari’, entre outras (DISQUAL, 2013).
A produção de kiwis, em Portugal, é relativamente recente quando comparado com o resto da Europa, as primeiras plantações ocorreram nos anos 80. O primeiro país a produzir kiwis, com exceção da China, foi a Nova Zelândia, no início do século XX e, na década de 20, desenvolveram a variedade ‘Hayward’ que atualmente se encontra no mercado (Barros, 2007; Garcia et al., 2012). A produção de kiwi está a aumentar e atualmente existem vários países a produzir este fruto, tais como: Itália, Grécia, Chile, Israel, Espanha, França, EUA (Califórnia) e Portugal (Rodet, 2012; GPP, 2013).
O período de colheita é, geralmente, em Outubro/Novembro e, por norma, a sua comercialização inicia-se em Novembro e termina em Maio do ano seguinte. Nesse período de tempo, o fruto é conservado em câmaras de refrigeração (GPP, 2013).
Os kiwis que, geralmente, se encontram no mercado nacional, pertencem à espécie
castanha coberta com pêlo e possuem numerosas e pequenas sementes negras comestíveis. Porém, existem outros frutos da mesma espécie com variedades diferentes, onde o aspeto morfológico também é diferente, por exemplo, a espécie Actinidia chinensis com variedade ‘Hort 16A’ e ‘Chinabelle’ produzem frutos de polpa amarela, a variedade ‘Top Star’ produzem frutos isentos de pêlo, enquanto a espécie A. arguta produz frutos com pele comestível, ou seja, podem ser ingeridos inteiros (Krupa et al., 2011).
A nível comercial, o kiwi é um fruto bastante apreciado pelos consumidores, devido ao seu sabor e aroma, à sua aparência diferente e à sua qualidade nutricional (Garcia et al., 2012).
O Regulamento (CEE) nº 410/90 da Comissão de 16 de Fevereiro de 1990, estabelece normas de qualidade para os kiwis destinados ao consumidor no estado fresco, com exclusão dos kiwis destinados à transformação industrial, e tem como principal objetivo definir os requisitos de qualidade que os kiwis devemapresentar após acondicionamento e embalagem. Esta norma não se aplica aos preparados à base de fruta, como é o caso dos doces.
2.1.1. Composição Nutricional
Segundo o Instituto Nacional de Saúde Doutor Ricardo Jorge, 81% do kiwi é comestível e a porção unitária recomendada é de 160 g. O Quadro 2-1 apresenta a composição nutricional do kiwi, por 100 g de produto (parte comestível) (INSA, 2013b). Através da análise do Quadro 2-1 é possível verificar que em 100 g de parte comestível do Kiwi, existe 77% de hidratos de carbono totais, 8% de gordura total, 8% de proteína, 7% de ácidos orgânicos. O kiwi é o fruto que possui maior teor de Vitamina C, 72mg/100g de parte comestível, quando comparado com a laranja a qual possui, em média, 57mg Vit.C/100g de parte comestível.
A dose diária de Vitamina C (ácido ascórbico) na ordem dos 100-200mg tem sido altamente recomendada por nutricionistas, uma vez que ajuda a prevenir diversas doenças associadas ao stress oxidativo, incluindo o cancro, os diabetes e o AVC (acidente vascular cerebral) (Barberis et al., 2012).
Quadro 2-1: Composição nutricional do kiwi, em 100g de parte comestível (INSA, 2013b)
Componente Por 100g de
parte comestível
Energia Energia, kcal 53
Energia, kJ 223
Macronutrientes
Água, g 82,9
Proteína, g 1,1
Gordura total, g 0,5
Total de hidratos de carbono
disponíveis, g 10,9
Total de hidratos de carbono
expresso em monossacáridos, g 10,9 Mono+dissacáridos, g 10,9 Ácidos orgânicos, g 1,20 Amido, g 0 Oligossacáridos, g 0 Fibra alimentar, g 1,9 Álcool, g 0 Ácidos Gordos
Ácidos gordos saturados, g 0,1 Ácidos gordos monoinsaturados, g 0,1 Ácidos gordos polinsaturados, g 0,2 Ácidos gordos trans, g 0
Ácido linoleico, g 0,1 Colesterol, mg 0 Vitaminas Vitamina A total, ug 7,0 Caroteno, mg 42 Vitamina D, ug 0 -tocofenol, mg 0,40 Tiamina, mg 0,020 Riboflavina, mg 0,050 Equivalentes de niacina, mg 0,50 Niacina, mg 0,30 Triptofano/60, mg 0,20 Vitamina B6, mg 0,020 Vitamina B12, ug 0 Vitamina C, mg 72 Folatos, ug 42 Minerais Cinza, g 0,72 Sódio, mg 9,0 Potássio, mg 302 Cálcio, mg 19 Fósforo, mg 28 Magnésio, mg 18 Ferro, mg 0,4 Zinco, mg 0,2
2.1.2. Sabor e aroma do kiwi
O aroma do kiwi resulta de uma mistura de compostos voláteis e é um dos principais fatores para a sua aceitabilidade por parte do consumidor, em simultâneo com a doçura e acidez. Comparando, os frutos da variedade ‘Hayward’ e ‘Hort16A’ (frutos com aparência distinta, polpa verde e polpa amarela, respetivamente) ao nível do sabor também são diferenciáveis, pois o kiwi ‘Hayward’ tem um sabor mais ácido, enquanto o kiwi 'Hort 16 A’ é doce e tem um sabor tropical intenso (Garcia et al., 2012).
Atualmente, foram relatados mais de 80 compostos voláteis para caracterizar o aroma do kiwi. O kiwi processado, geralmente, tem odores fortes e são considerados defeitos, como é o caso dos cheiros identificados: “erva cortada”, “feno” e “cozido”. Nos sumos de fruta, o composto que é responsável pelo aroma desagradável a “feno” é o (E)-3-Hexenal. No puré de kiwi ultracongelado (para aplicação em gelados e doces) identificaram vários compostos como sendo responsáveis pelo aroma desagradável a “maduro excessivo” (Garcia et al., 2012).
2.1.3. Propriedades funcionais do kiwi
O kiwi é considerado um fruto altamente nutritivo, devido ao seu elevado teor de Vitamina C (ácido ascórbico) e à sua capacidade antioxidante, devido à presença de carotenoides, compostos fenólicos (flavonoides e não flavonoides) e clorofila (Lespinard et
al., 2012). Os antioxidantes têm efeitos benéficos para a saúde, pois retardam o
envelhecimento e podem reduzir o risco de doenças crónicas, como as doenças cardiovasculares, cancerígenas e degenerativas (Tavarini et al., 2008; Bursal e Gulçin, 2011). A clorofila e os carotenoides são os principais pigmentos responsáveis pela cor, mas é a clorofila que fornece a cor verde ao kiwi (Tavarini et al., 2008). Para além destes compostos, o kiwi possui elevada atividade enzimática de proteases, Actinidina, as quais contribuem para a digestão e efeito laxativo (Kim et al., 2009).
A quantidade de compostos fenólicos totais e de vitamina C (ácido ascórbico) varia entre espécies e variedades, comparando diferentes espécies e variedades de kiwi, o que contribui para a maior atividade antioxidante observada nos frutos do género Actinidia (Du
Nas diferentes variedades de kiwi, torna-se mais vantajoso consumir a variedade A.
arguta, pois possui uma pele macia e comestível, ou seja, não é necessário descascar a fruta
para o seu consumo ou para o seu processamento. Assim, é possível ingerir os compostos funcionais que estão contidos na pele do kiwi, pois a pele possui mais compostos fenólicos do que a respetiva polpa. Num sumo de kiwi “Mitsuko” (A. arguta) a quantidade de fenóis é superior 1,4 e 8,8 vezes, do que um sumo de kiwi “Hayward” (A. deliciosa) e um sumo de maçã “Fuji”, respetivamente (Kim et al., 2009).
2.1.4. Agentes alergénios
Existem alguns estudos que têm como objetivo identificar e/ou caracterizar os alergénios do kiwi, pois o kiwi é um alimento que frequentemente provoca alergias (Pastorello et al., 1996; Le et al., 2013). Há diversos alergénios associados ao kiwi (diferem no peso molecular), mas o alergénio específico do kiwi é denominado de Actinidina com peso molecular 30kDa (Pastorello et al., 1996). Este alergénio é uma enzima proteolítica, com elevado peso molecular, mas existem outros alergénios importantes, com peso molecular inferior, 28 e 24 kd (Pastorello et al., 1998).
As reações alérgicas aos alimentos (por exemplo, ao Kiwi) podem variar bastante.Os principais sintomas deste tipo de alergias nos adultos são o ardor na boca, urticária, eczema e, por vezes, rinorreia e asma, mas também pode desencadear uma reação grave, a qual pode provocar o inchamento das vias aéreas, o que dificulta a respiração. Esta reação, por vezes, é uma reação anafilática (ou anafilaxia) com risco letal. Contudo, a anafilaxia não costuma após na primeira exposição a um determinado alergénio, tal como acontece nas restantes reações alérgicas, mas acontece quando há um contacto direto com esse mesmo alergénio pela segunda vez (Erwin e Platts-Mills, 2008; Le et al., 2013). Uma reação alérgica inicia-se quando o sistema imunitário é exposto pela primeira vez ao alergénio e produz um anticorpo da classe imunoglobulina E (IgE). Normalmente, na primeira exposição, a pessoa não manifesta sintomas, mas pode tornar-se sensível ao alergénio. Assim, numa exposição posterior, as células que têm IgE são levadas a libertar histamina e outras substâncias, que levam o organismo a manifestar os sintomas já mencionados (Erwin e Platts-Mills, 2008).
é alérgica ao kiwi, mas este tipo de alergia é frequentemente associada à alergia ao polén de bétula e de erva, bem como à alergia ao latex (Bublin, 2013), pois há uma reação cruzada entre os alergénios, isto é, o kiwi possui alergénios com estruturas semelhantes aos alergénios do látex, do pólen de bétula e de erva. Assim, os anticorpos específicos para os alergénios do kiwi, também, podem reagir aos alergénios do pólen (Pastorello et al., 1996). Todavia a alergia isolada ao kiwi é relativamente comum e muitas vezes grave (Bublin, 2013).
2.2.
P
ROCESSO PRODUTIVO DE DOCE DE FRUTAA maioria dos frutos e vegetais são sazonais e perecíveis, por isso a qualidade máxima deste tipo de produto, tanto ao nível nutricional como organolético, geralmente, depende da fase da sua colheita, como a sua qualidade diminui ao longo do tempo de armazenamento, tornando necessário a aplicação de técnicas de conservação que preservem as respetivas características (Renna et al., 2013).
Existem diversas tecnologias de conservação de fruta, entre elas está a transformação da fruta em doce e/ou geleia, bem como a conservação da fruta em calda (conservas), a desidrataçãoe a congelação. Para produzir doces à base de fruta é necessário respeitar diversas etapas fundamentais do processamento, tais como a seleção da fruta, o processo de estabilização, o enchimento e selamento da embalagem, bem como o armazenamento do produto final (Vibhakara e Bawa, 2006).
A qualidade da matéria-prima utilizada no processo produtivo de doces, nomeadamente à base de fruta, tem influência nos atributos organoléticos do produto final. As características do fruto variam com o clima, práticas agrícolas, altura da colheita, manuseamento pré e pós colheita (Kader e Barrett, 2005). É necessário garantir que o fruto utilizado possui as características adequadas para a sua transformação, ou seja, o estado de maturação, o teor de açúcares (oBrix) e a integridade física têm que estar adequadas, a fim de garantir um produto final com qualidade.
Tem sido demonstrado que o processo de conservação utilizado nos doces de fruta, por norma, implica um tratamento térmico a elevadas temperaturas durante um longo
período de tempo (vários minutos), a fim de reduzir a atividade enzimática e microbiológica. Contudo, o tratamento térmico danifica algumas propriedades organoléticas da matéria-prima (a fruta), podendo o doce de fruta adquirir características organoléticas indesejáveis, ao nível da cor, do sabor e do valor nutricional. Para impedir a formação destas características é necessário adaptar e monitorizar corretamente o tratamento térmico (Igual
et al., 2013). No entanto, existem tratamentos alternativos possíveis de aplicar no
processamento dos doces de fruta, por exemplo a utilização de altas pressões a baixas temperaturas (Dervisi et al., 2001), a desidratação osmótica sem tratamento térmico e a tecnologia micro-ondas (Igual et al., 2010). A utilização de altas pressões torna possível minimizar as perdas organoléticas associadas ao uso de temperaturas elevadas e é igualmente eficaz da inativação dos microrganismos e das enzimas responsáveis pela deterioração organolética dos doces de fruta (Dervisi et al., 2001).
As condições de enchimento dependem do tipo de tratamento térmico aplicado ao doce de fruta, ou seja, se o enchimento for efetuado após o tratamento térmico é necessário manter a temperatura do doce de fruta superior a 80oC durante esta última etapa (Grigelmo e Martín, 1999), contudo o enchimento pode ser efetuado antes do tratamento térmico, caso se trate de uma esterilização (Besbes et al., 2009).
Em termos microbiológicos, a temperatura de armazenamento deste tipo de produto não é um fator decisivo, porém é necessário armazenar o produto ao abrigo da luz e num local fresco e seco. Desta forma, o armazenamento ideal do doce de fruta é a temperatura refrigerada, sem exposição à luz para minimizar a perda da qualidade organolética (Melgarejo et al., 2011).
2.3.
E
NQUADRAMENTO LEGAL PARA OS DOCESO Decreto-Lei no. 230/2003, de 27 de Setembro, estabelece definições e características dos doces e geleias de frutos, citrinadas e creme de castanha destinados à alimentação humana e, ainda, as regras a que deve obedecer a sua rotulagem, fixando igualmente os ingredientes e as matérias-primas que podem ser utilizados no seu fabrico. Assim, o Anexo I, deste mesmo Decreto-lei, define o termo doce como um “produto, levado
a consistência gelificada apropriada, resultante da mistura de açucares, polpa e/ou polme de um ou mais tipos de frutos e água”. A diferença entre “Doce” e “Doce extra” reside na quantidade mínima necessária de polpa e/ou polme utilizadas no fabrico de 1000g de produto acabado. No Quadro 2-2 é possível comparar “Doce” com “Doce Extra”.
Quadro 2-2: Comparação das quantidades mínimas necessárias para a produção de 1000g de “Doce” e 1000g de “Doce Extra”
“Doce” “Doce Extra”
As quantidades de polpa e/ou polme utilizadas no fabrico de 1000 g de produto acabado não poderão ser inferiores a:
350 g, em geral 450 g, em geral
250 g, no caso das groselhas vermelhas, das sorvas, dos frutos da espinheira das areias, das groselhas negras, dos frutos da roseira brava e dos marmelos
350 g, no caso das groselhas vermelhas, das sorvas, dos frutos da espinheira das areias, das groselhas negras, dos frutos da roseira brava e dos marmelos
150 g, no caso do gengibre 250 g, no caso do gengibre
130 g, no caso das castanhas de caju 230 g, no caso das castanhas de caju 60 g, no caso dos maracujás 80 g, no caso dos maracujás
O Quadro 2-2 mostra que, para o fabrico de 1000 g de “Doce” (produto acabado), são necessárias quantidades mínimas sempre inferiores às necessárias para o fabrico “Doce Extra” (1000g de produto acabado).
2.4.
A
DITIVOS ALIMENTARES2.4.1. Antioxidantes
Segundo o Decreto-Lei no. 64/2011 é possível adicionar o ácido cítrico (E330) e ácido ascórbico (E300) como agentes antioxidantes.
A percentagem geralmente utilizada de ácido cítrico é de 1% (mas esta percentagem pode variar, dependendo da finalidade e do produto). Este aditivo é utilizado em diversos produtos alimentares, tais como, bebidas não-alcoólicas, doces e geleias, produtos de panificação, queijos e legumes e frutas em conserva (Ray, 2004a).
A adição do ácido cítrico pode ter diversos objetivos, tais como intensificar a capacidade antioxidante de outros aditivos, evitar a descoloração do fruto e o
desenvolvimento de sabores estranhos, contribuir para a retenção da vitamina C, regular o pH e é também considerado um sequestrante, ou seja, complexa os iões metálicos (ASAE, 2012).
O Ácido Cítrico, como regulador de pH dos doces de fruta, pode ser adicionado no final do processamento, tal como aconteceu num estudo realizado com doce de tâmaras (Besbes et al., 2009), ou durante o processamento, num estudo realizado com doce de morango, no qual foi adicionado a 2minutos do fim do tratamento térmico (Grigelmo e Martín, 1999), ou pode ser ainda adicionado no início do processamento, como aconteceu num estudo com doce de manga (Basu e Shivhare, 2010).
O ácido ascórbico, também designado por Vitamina C, é um nutriente hidrossolúvel e é utilizado na indústria farmacêutica e alimentar como antioxidante, com o objetivo de melhorar a saúde e prolongar o tempo de vida dos produtos alimentares, respetivamente (Juhász et al., 2011), pois evita o escurecimento dos frutos e sumos. Tanto o ácido cítrico como o ácido ascórbico podem ter origem biológica como química (ASAE, 2012).
2.4.2. Agente gelificante – Pectina
O termo pectina deriva do grego “Pektikos”, que significa congelar ou solidificar (Willats et al., 2006). Apesar da disponibilidade de outros agentes gelificantes, a pectina continua a ser referida na produção de doces e geleias, por ser um aditivo naturalmente presente na fruta e, também, devido à consistência de gel formado (Baker et al., 2005).
A qualidade da pectina depende da origem/hora de colheita da matéria-prima e das condições de extração, por isso é necessário produzi-la a partir de matérias-primas rigorosamente selecionadas, sendo estas, por norma, subprodutos de maçã (bagaço da maça) ou de citrinos (casca dos citrinos) (Obipektin, 2012).
2.4.2.1. Características da pectina
A pectina é um polissacarídeo de cadeia molecular longa, que está disponível nas paredes celulares de origem vegetal, é constituída por ácidos D-galacturónico parcialmente esterificados com grupos metoxílicos e estão unidos por ligações glicosídicas 1→ 4, com pequenas frações de ramoses e pequenas cadeias laterais constituídas por outros açúcares
(Capel et al., 2006; Jolie et al., 2010). Estas moléculas estão presentes nas paredes celulares da fruta, especialmente dos citrinos e das maçãs (Morris et al., 2010).
O grau de esterificação (DE) de uma pectina é a razão entre as unidades de ácido galactúricos esterificados e o total de ácido galactúrico, ou seja, quando uma pectina apresenta um DE de 50%, significa que 50% dos ácidos galactúricos estão esterificados (grupos éster). Assim, as pectinas que possuem mais do que 50% de grupos éster (DE > 50%) são denominadas de pectinas de alta metoxilação (HM); pectinas que possuem menos do que 50% de grupos éster (DE < 50%) são as pectinas de baixa metoxilação (LM) e, ainda, existem pectinas de baixa metoxilação amidadas (LMA) que geralmente são pectinas LM (DE < 50%), mas possuem até 25% de grupos amida (DA ≤ 25%). Os grupos amida estão presentes neste tipo de pectina devido ao processo de extração no qual é utilizado amónia, e consequentemente estes grupos são introduzindo na molécula (Kopjar et al., 2009).
2.4.2.2. Condição para a formação do gel num doce de fruta
A capacidade da pectina formar um gel depende do tamanho da cadeia de ácido galactúrico e do grau de esterificação, sendo que estas características variam segundo a matéria-prima utilizada para a sua extração (Barrera et al., 2002).
Devido ao seu carater hidrofóbico (devido aos grupos éster), a pectina tende a agregar, quando entra em contacto com a água, a fim de minimizar a superfície de contacto para formar um gel (Willats et al., 2006). Para formarem um gel, as pectinas HM têm que estar na presença de um valor de pH baixo (<3,5) e de elevadas concentrações de açúcar (>55%) e são reguladas por pontes de hidrogénio e interações hidrofóbicas (Fu e Rao, 2001; Li et al., 2013). Ao contrário das pectinas HM, as pectinas LM não são tão exigentes quanto à quantidade de açúcar (sólidos solúveis) e ao valor de pH do meio, pois as pectinas LM são caracterizadas por gelificarem na presença de iões cálcio (Ca2+) ou outro catião divalente. Assim, o cálcio (ião metálico) reage com as cadeias de pectina, formando um gel, sendo que este tipo de ligação (pectina-cálcio) pode ser explicado pelo modelo “egg-box”. Este modelo descreve a formação do gel com a pectina LM como consequência da interação entre os iões cálcio (Ca2+) e os grupos carboxilos da cadeia linear da pectina. Como a pectina LM não necessita de elevado teor de açúcar, esta é utilizada na produção de alimentos dietéticos
e/ou de baixo valor calórico (Fu e Rao, 2001; Morris et al., 2010). As pontes de hidrogénio e as interações eletrostáticas desempenham um papel de destaque na gelificação das pectinas LM.
As pectinas de baixa metoxilação amidada (LMA) reagem como as pectinas LM, mas requerem um teor de cálcio inferior para ocorrer a gelificação. Geralmente não é necessário adicionar cálcio, pois o cálcio presente na fruta é suficiente (Obipektin, 2012). No entanto, existem no mercado pectinas amidadas com suplementos de cálcio para assegurar uma gelificação do produto.
Por norma, a percentagem de pectina utilizada na produção de doce de fruta varia entre 0,5% e 1% (Obipektin, 2012).
O Quadro 2-3 resume as condições ótimas para a gelificação das diferentes pectinas (HM, LM e LMA), relativamente ao teor de sólidos solúveis, ao valor de pH e ao teor de iões cálcio necessários para uma gelificação adequada.
Quadro 2-3: Esquematização das condições ótimas de gelificação relacionadas com o tipo de pectina (Obipektin, 2012)
Pectina Estrutura
Condições de gelificação Teor de Sólidos
solúveis (TSS) pH
Teor de iões cálcio [Ca2+] HM >50% de grupos éster > 60% pH 2,8 – 3,6 Não exige Ca2+ LM <50% de grupos éster > 10% pH 3,0 – 3,5 40-60mg de Ca
2+
/g de pectina LMA <50% de grupos éster
<25% de grupos amida > 10% pH 3,0 – 3,5
15-25mg de Ca2+/g de pectina
2.4.2.3. Influência do pH na formação do gel de pectina
A força das interações do gel é influenciada por fatores intrínsecos (peso molecular, a distribuição dos grupos éster, cadeias laterais, DE) e extrínsecos (pH, força iónica, a concentração dos iões divalentes e temperatura). O pH do meio é o fator que mais afeta a gelificação da pectina LM, apesar de não possuir um intervalo de pH restrito para a sua gelificação. Para valores de pH>4,5 as interações eletrostáticas são mais fortes, pois a pectina está quase na totalidade carregada. Assim, quanto menor for o valor de pH, menor
será a densidade da carga da pectina e, consequentemente, haverá uma diminuição da sensibilidade do ião divalente (ião Ca2+). Com um valor de pH inferior a 2,0, as interações eletrostáticas tornam-se nulas, pois os grupos carboxilos da pectina não estarão carregados, tornando a cadeia da pectina insensível ao cálcio (Li et al., 2013). Contudo, a diminuição do valor de pH<3,5 permite aos grupos carboxilo formarem pontes de hidrogénio e favorecendo a formação dos géis induzidos pelas pontes de hidrogénio.
2.4.3. Enquadramento legal para o uso de aditivos alimentares
O Decreto-Lei no. 64/2011, de 9 de Maio, aprova a aplicação de novos aditivos alimentares, com exceção, dos corantes e edulcorantes, e altera os critérios de pureza específicos desses aditivos, procedendo à adoção de especificações para os novos aditivos alimentares, bem como à atualização das especificações para aditivos já autorizados. O Anexo I, deste Decreto-Lei, apresenta uma lista relativa aos aditivos alimentares, com exceção dos corantes e dos edulcorantes, autorizados em cada género alimentício, bem como o teor máximo autorizado.
Para o género alimentício “Doces e geleias de qualidade ‘extra’, referidos no Decreto-Lei no. 230/2003, de 27 de Setembro”, os aditivos autorizados e o teor máximo permitido estão descritos no Quadro 2-4.
Quadro 2-4: Aditivos autorizados no género alimentício “Doce e geleia de qualidade ‘extra’, referidos no
Decreto-Lei no. 230/2003”, segundo o Decreto-Lei no. 64/2011
Função
(ASAE, 2012) Código Aditivo Alimentar Teor máximo
Emulsionante, estabilizador, espessante e gelificante E440 E 471 Pectina Mono e diglicerídeos de Ácido gordo Quantum satis. Antioxidante E 300 E 327 E 330 E 331 E 333 Ácido Ascórbico Lactato de cálcio Ácido Cítrico Citratos de sódio Citratos de cálcio Outros E270 E 296 E 334 E 335 E 350 Ácido láctico Ácido málico Ácido tartárico Tartaratos de sódio Malatos de sódio
Através do Quadro 2-4 é possível verificar que não existe limite no teor máximo permitido para estes aditivos alimentares, nos doces e geleias de qualidade “extra”.
2.5.
C
ARACTERIZAÇÃO DOSD
OCES DEF
RUTAA qualidade de um doce de fruta pode ser caraterizada segundo diversos atributos: físico-químicos, microbiológicos e sensoriais.
2.5.1. Parâmetros Físico-químicos
As características físico-químicas de um doce de fruta mudam conforme o tipo de fruta utilizado para a confeção, bem como a tecnologia utilizada.
O Instituto Nacional Doutor Ricardo Jorge fornece a composição nutricional de alguns doces/compotas de fruta (Quadro 2-5) e pode-se observar que os parâmetros físico-químicos variam de acordo com o tipo de doce e depende do respetivo fruto (INSA, 2013a).
Quadro 2-5: Comparação de alguns parâmetros físico-químicos de diferentes doces/compotas de fruta (INSA, 2013a) Produto Vitamina C (mg/100g) Cinzas (g/100g) Água (g/100g) Hidrato de carbono total (g/100g) Compota de ameixa 0 0,22 49,6 49,2 Compota de laranja 11 0,29 38,7 59,5 Compota de Damasco 2 0,35 39,5 58,9 Compota de Ananás 0 0,49 46,8 50,8 Doce de Pêssego 4 0,29 47,0 51,3 Doce de morango 0 0,29 38,0 60,5 Doce de Maçã 0 0,26 39,6 59,0
2.5.1.1. Teor de Sólidos solúveis
O teor de sólidos solúveis depende do tipo de doce de fruta que se pretende. Segundo o Anexo I do Decreto-Lei nº230/2003, o resíduo seco solúvel, determinados por refratometria, deve ser, no mínimo, 60%, exceto no caso dos produtos em que os açúcares tenham sido substituídos, na sua totalidade ou em parte, por edulcorantes, mas no mercado nacional poderão ainda ser produzidos e comercializados os produtos com um resíduo seco
solúvel inferior a 60%, mas superior a 30%, desde que sejam observadas as restantes regras fixadas no Decreto-Lei referido.
Os valores de sólidos solúveis variam segundo o tipo de processamento aplicado ao produto, ou seja, quanto maior for a taxa de evaporação do tratamento térmico, maior será o teor de sólidos solúveis presente no produto. Assim, é possível relacionar a atividade de água, a temperatura e o teor de sólidos solúveis de um produto (Guerrero e Alzamora, 1998).
2.5.1.2. Atividade antioxidante
Os antioxidantes são substâncias que retardam a velocidade da oxidação, através de um ou mais mecanismos, tais como inibição de radicais livres e complexação de metais (Pietta, 2000).
Ao longo dos anos, a atividade antioxidante dos frutos e vegetais tem sido valorizada, devido ao seu efeito benéfico para a saúde, mas durante o processamento e armazenamento, as propriedades antioxidantes de um produto podem diminuir, devido à exposição ao oxigénio (promovendo a atividade enzimática), à luz e ao calor. A temperatura de armazenamento dos doces de fruta influencia a atividade antioxidante, ou seja, quanto maior a temperatura de armazenamento menor será a atividade antioxidante. Para minimizar a perda da atividade antioxidante, deve-se armazenar o doce de fruta em refrigeração (4oC) (Wicklund et al., 2005).
Os compostos fenólicos e a Vitamina C contribuem para a atividade antioxidante, do kiwi, existindo uma correlação entre eles. Estes valores variam segundo a espécie e variedade do kiwi (Du et al., 2009).
2.5.1.3. Ácido Ascórbico (vitamina C)
O teor de vitamina C depende da variedade, do tipo de cultivo, do estado de maturação, do clima, bem como das condições pós-colheita da fruta. Geralmente, o teor de vitamina C diminui durante o armazenamento e/ou durante o processamento dos alimentos (Barberis et al., 2012). Os mecanismos que podem degradar a vitamina C são a desidratação (Uddin et al., 2002) e os tratamentos térmicos a elevadas temperaturas (Blasco et al., 2004).
O teor de sólidos solúveis não influência o teor de vitamina C dos produtos derivados da fruta (Al-Zubaidy e Khalil, 2007).
Existem duas enzimas que estão envolvidas na oxidação metabólica do ácido ascórbico, a enzima ascorbato oxidase (AO) e a enzima ascorbato peroxidase (APX). A enzima AO catalisa a oxidação do ácido ascórbico principalmente durante o crescimento do tecido, enquanto a enzima APX está mais relacionada com a modificação do teor de ácido ascórbico durante a maturação, o armazenamento ou o corte da fruta. Devido ao seu poder antioxidante, o ácido ascórbico desempenha uma função crucial na estabilidade oxidativa da fruta. A perda de ácido ascórbico limita a qualidade nutricional, portanto, é considerado como um indicador da qualidade da fruta e dos seus derivados (Barberis et al., 2012).
2.5.1.4. Humidade e atividade da água
O processamento térmico dos doces de fruta promove a evaporação da água e, consequentemente, a concentração dos açúcares. Assim, os doces de fruta estão incluídos nos produtos com atividade da água (aw) intermédia, ou seja, estes produto tem uma aw
entre 0,60 e 0,90 e teor de humidade relativa entre 10 e 50% (Roos, 2001). Todavia, existem doces de fruta que podem atingir uma atividade da água superior (até 0,94) (Brackett, 1997).
2.5.1.5. Cor
Quando um produto é embalado em frasco de vidro, a primeira característica a ser avaliada pelo consumidor é a aparência do produto. No caso dos doces, os consumidores associam a cor do produto com a cor da fruta fresca que deu origem ao produto (Lespinard
et al., 2012).
A quantidade de pigmentos que estão naturalmente presentes na fruta influência a cor dos produtos derivados de fruta, como a clorofila, carotenoides e antocianinas, ou no teor de pigmentos resultantes das reações de escurecimento durante a transformação das frutas (Lozano, 2006b). Por isso, a manutenção da cor após o processamento dos alimentos é um grande desafio, pois existem vários parâmetros que estão envolvidos na sua estabilidade, tais como o pH, temperatura, luz, reações enzimáticas e não enzimáticas e o ácido L-ascórbico (Bodelón et al., 2013).
A clorofila é o principal pigmento responsável pela coloração verde de diversas frutas e vegetais, nomeadamente do kiwi. Existem vários tipos clorofila, mas a clorofila presente nas plantas verdes é a clorofila a e b, numa proporção de 3:1 (Koca et al., 2007).
O estado de maturação da fruta interfere na quantidade de pigmentos da fruta, por exemplo, com o aumento do estado de maturação do kiwi, o teor de clorofila diminui e, consequentemente, a cor verde característica diminuiu (Zhang et al., 2012).
2.5.2. Parâmetros Microbiológicos
Algumas plantas produzem metabólitos antimicrobianos naturais que podem impedir o desenvolvimento microbiano. Contudo, à superfície do alimento, devido à exposição ao oxigénio, podem existir diversos tipos de microrganismos, tais como bolores e leveduras, bactérias lácticas e bactérias dos gêneros Pseudomonas, Alcaligenes, Micrococcus, Erwinia,
Bacillus, Clostridium e Enterobacter. A quantidade e o tipo de microrganismos que podem
aparecer nos doces depende das condições do solo, tipo de fertilizantes e água utilizadas na produção agrícola e na qualidade do ar (Ray, 2004b).
O pH é um dos parâmetros que influência a multiplicação e o desenvolvimento dos microrganismos. De uma forma geral valores de pH próximo do neutro (6,5 e 7,5) promove o desenvolvimento de bactérias, tolerando também valores entre 4 e 9 (Doores, 1993).
Todavia, os diversos microrganismos que provocam doenças de origem alimentar não estão associados aos produtos derivados de fruta, pois grande parte destes microrganismos não toleram valores baixos de pH da fruta e/ou derivados, como por exemplo os doces de fruta (pH próximo de 3). Assim, os microrganismos que predominam nos produtos de fruta são os bolores e as leveduras, porque conseguem multiplicar-se em meios ácidos (Worobo e Splittstoesser, 2005).
A redução da atividade da água, por norma, inibe o desenvolvimento dos microrganismos, pois a água disponível para o seu desenvolvimento é menor e, consequentemente, é possível aumentar o tempo de vida de um produto. A maioria das bactérias patogénicas necessita de uma atividade de água elevada para se desenvolver, por exemplo, tanto o microrganismo Clostridium botulinum como Salmonella spp. precisam de
um meio com aw superior a 0,94; o microrganismo Listeria monocytogenes necessita de um
meio com aw superior a 0,92. Contudo, as exigências dos bolores e leveduras quanto à aw do
meio são menores, ou seja, desenvolvem-se em produtos com aw inferiores (aw mínima é
0,62), mas os valores mínimos variam segundo a espécie (Roos, 2001).
Nos doces de fruta, a temperatura de armazenamento prévia à abertura da embalagem não é um fator decisivo, pois o doce de fruta sofre um tratamento térmico e, a seguir, é embalado a quente (T ≥ 80oC) e o produto final é hermeticamente fechado, ou seja, a embalagem impede a entrada de ar (Grigelmo e Martín, 1999). Nestas condições é possível minimizar o desenvolvimento e multiplicação da maior parte dos microrganismos, podendo ser utilizado outro método de conservação para aumentar o tempo de vida, através da esterilização após o embalamento (Besbes et al., 2009). Para conseguir controlar e minimizar o desenvolvimento microbiano e, consequente, deterioração dos doces de fruta é necessário controlar eficazmente a atividade da água, o pH e a temperatura de processamento do mesmo.
2.6.
D
EGRADAÇÃO DOS DOCES DE FRUTAOs atributos do controlo da qualidade podem sofrer alterações indesejáveis ao longo do tempo de armazenamento do produto, bem como durante o processamento deste tipo de produto, por isso é necessário otimizar o processo a fim de minimizar as perdas dos atributos de qualidade (Lespinard et al., 2012).Com o objetivo de garantir a segurança e qualidade do produto à base de fruta é essencial controlar a atividade enzimática e microbiológica.
2.6.1. Degradação microbiológica
Como os doces de fruta sofrem tratamento térmico e possuem atividade da água reduzida, devido à adição de açúcar, a probabilidade dos bolores e leveduras se multiplicarem é reduzida. Consequentemente, a deterioração ocorre quando as embalagens não estão devidamente seladas ou após a abertura da embalagem pelo consumidor final (Brackett, 1997).
Caso exista contaminação devido aos bolores e leveduras é possível observá-la a olho nu quando existem valores na ordem dos 105 UFC/mL ou grama (Worobo e Splittstoesser, 2005). No caso dos sumos, a multiplicação de leveduras pode produzir turvação e sedimentação (Worobo e Splittstoesser, 2005).
2.6.2. Degradação da cor
Durante o processamento pode ocorrer diversas reações não enzimáticas tais como as reações de Maillard, de Strecker e a caramelização (Castro, 2003). Na reação de Maillard pode ser dividida em três fases onde intervém os aminoácidos e açucares redutores (van Boekel, 2006). Esta reação afeta a cor, pois induz o escurecimento dos alimentos processados, afeta o valor nutritivo, pois pode ter implicações toxicológicas (tais como a formação de acrilamida), tem um grande efeito no sabor, contudo é capaz de produzir substâncias antioxidantes, antimicrobianas, mutagénicas ou cancerígenas (van Boekel, 2006; Jaeger et al., 2010). A reação de Strecker afeta essencialmente o sabor do produto através da degradação de aminoácidos por produtos resultantes da reação de Maillard. A caramelização é a reação da degradação do açúcar na ausência de aminoácidos e conduz a produtos similares (van Boekel, 2006). A reação de Maillard pode ainda provocar a diminuição da atividade antioxidante dos produtos processados devido ao consumo do ácido ascórbico e polifenois como reagentes da reação (Nicoli et al., 1999)
A degradação da cor devido às reações enzimáticas é mais visível nas frutas claras, tais como maçã e pêra. As principais enzimas responsáveis por estas reações são a polifenolxidase (PPO) e a peroxidase (POD). Estas enzimas catalisam a oxidação dos compostos fenólicos e, consequentemente, as propriedades funcionais do produto são reduzidas. Os pigmentos castanhos produzidos na oxidação dos compostos fenólicos são denominados de melaninas e têm propriedades antimicrobianas (Lozano, 2006b).
A alteração da cor, no kiwi minimamente processado (sem tratamento térmico), pode ocorrer devido à degradação da clorofila (o que leva à descoloração do produto) e ao aparecimento de pigmentos castanhos que envolvem reações enzimáticas e/ou não enzimáticas, que provocam o escurecimento do kiwi (Lespinard et al., 2012). A clorofila pode ser degradada por vários mecanismos, resultando numa diminuição da intensidade da cor.
Durante o processamento e armazenamento do kiwi são libertados ácidos e enzimas (clorofilase) intercelulares, as quais podem entrar em contato com o complexo clorofila-proteína (Leunda et al., 2000; Lespinard et al., 2012).
Com a análise da cor do kiwi com o sistema de cor CIE L*a*b* é possível verificar que o valor a* e o teor de clorofila tem uma correlação negativa, ou seja, quanto maior o valor de a* menor será o teor de clorofila. Sendo que a perda de clorofila resulta principalmente da atividade da clorofilase e do estado de maturação (Zhang et al., 2012). Contudo, num estudo efetuado em ervilhas verdes, verificou-se a existência de uma correlação entre valor de pH e a degradação da clorofila, onde se conclui que a perda de cor verde e a degradação da clorofila diminui com o aumento do valor de pH, ou seja, a cor verde é mantida em condições de pH superiores e ainda se verificou que a clorofila a é mais suscetível do que a clorofila b à degradação térmica em condições ácidas (Koca et al., 2007).
Em kiwi minimamente processado, observou-se uma mudança de cor à medida que se aumentava a temperatura e o tempo de armazenamento. Neste estudo, também se verificou a influência do branqueamento e do processo a vácuo (Leunda et al., 2000). Assim, é necessário ter em consideração as condições operacionais, a fim de minimizar as mudanças de cor do kiwi e seus derivados.
2.6.3. Degradação do gel
As enzimas pectinolíticas são responsáveis pela degradação da pectina. A origem destas enzimas pode ser vegetal ou microbiológica, pois os fungos filamentosos, bactérias e algumas leveduras conseguem sintetiza-las (Silva et al., 2005; Jolie et al., 2010). As enzimas pectinolíticas utilizadas na indústria alimentar são produzidas pelo fungo Aspergillus niger. Esta espécie produz diversas enzimas pectinolíticas, tais como a enzima pectinametilesterase (PME) e a poligalacturonase (PG). Por exemplo, na indústria de bebidas, mais especificamente dos sumos, é usual adicionar enzimas pectinolíticas, pois resulta na degradação da pectina e outros componentes de alto peso molecular, o que leva à diminuição da viscosidade do produto (Silva et al., 2005). A enzima PME catalisa a hidrólise das ligações éster na molécula de pectina e liberta metanol, consequentemente a estrutura do gel degrada-se (Jolie et al., 2010).
As condições de armazenamento, em particular a temperatura e tempo de armazenamento, podem levar à diminuição da resistência do gel. Assim, quanto maior é a temperatura de armazenamento, menor é a resistência do gel (Morris et al., 2010).
2.6.4. Degradação da Vitamina C
A diminuição do teor de ácido ascórbico de um produto derivado de fruta influência a composição nutricional deste. Como esta vitamina é um antioxidante natural está correlacionado positivamente com a atividade antioxidante, quanto menor for o teor de vitamina C, menor será a atividade antioxidante (Du et al., 2009).
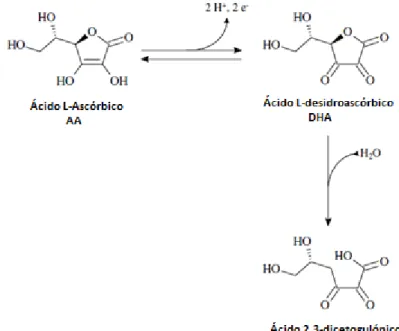
O ácido L-ascórbico (AA) é a principal forma biológica ativa da vitamina C e é reversivelmente oxidado para formar o ácido L-desidroascórbico (DHA), que também exibe atividade biológica. Mas, se ocorrer a oxidação do DHA, forma-se o ácido dicetogulónico (Figura 2-1), que não possui qualquer função biológica, esta degradação do DHA é irreversível (Shephard et al., 1999b; Hernández et al., 2006). Como o DHA pode ser convertido em AA nos organismos vivos, a vitamina C pode ser considerada a soma do teor de DHA e AA (Adrian et al., 2000; Hernández et al., 2006)
Figura 2-1:Oxidação do ácido L-ascórbico (Hernández et al., 2006)
O ácido ascórbico é uma molécula sensível a diversos fatores, assim a sua oxidação pode ser provocada pela exposição ao oxigénio, à luz, à variação de pH e humidade, à
presença de metais (em particular o cobre e o ferro) (Borenstien, 2000; Juhász et al., 2011), à temperatura e tempo de processamento térmico, ao tempo e temperatura de armazenamento (Adrian et al., 2000; Poiana et al., 2012). A degradação da vitamina C provoca uma alteração da cor original do produto (coloração acastanhada) (Shephard et al., 1999a).
2.7.
R
EFERÊNCIA A ALGUNS ESTUDOS REALIZADOS EM PRODUTOS TRANSFORMADOS À BASEDE FRUTA
O quadro 2-6 resume alguns estudos realizados em produtos transformados à base de fruta, indicando os objetivos do estudo, bem como as suas principais conclusões. De uma maneira geral, verifica-se que a maior parte dos trabalhos focam-se na utilização de pectina e no controlo dos parâmetros de qualidade sensoriais e físico-químicos.