NANOCÁPSULAS DE POLI-
-CAPROLACTONA
CONTENDO HALOFANTRINO:
DESENVOLVIMENTO, CARACTERIZAÇÃO E
ESTUDO DA CARDIOTOXICIDADE
.
Autora: Elaine Amaral Leite
Orientadora: Profa. Dra. Vanessa Carla Furtado Mosqueira Co-Orientadora: Profa. Dra. Andréa Grabe Guimarães
Dissertação apresentada ao Programa de Pós-Graduação de Ciências Biológicas do Núcleo de Pesquisas em Ciências Biológicas da Universidade Federal de Ouro Preto, como parte integrante dos requisitos para a obtenção do Título de Mestre em Ciências Biológicas, área de concentração Imunobiologia de Protozoários.
Catalogação: sisbin@sisbin.ufop.br
L533n Leite, Elaine Amaral
Nanocápsulas de Poli--caprolactona contendo Halofantrino: desenvolvimento, caracterização e estudo da cardiotoxicidade [manuscrito] / \ Elaine Amaral Leite. – 2006.
xxxiii, 140f.: il., color; graf., tabs., mapas.
Orientador: Dra. Vanessa Carla Furtado Mosqueira. Co-orientadora: Prof. Dra. Andréa Grabe Guimarães. Área de concentração: Imunobiologia de protozoários.
Dissertação (Mestrado) – Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas.
1. Liberação controlada - fármacos - Teses. 2. Nanopartículas – caracterização - Teses. 3. Malária – Teses. 4. Sistema cardiovascular – efeito das drogas - Teses. 5. Polímeros na medicina – Teses. I.Universidade Federal de Ouro Preto. Instituto de Ciências Exatas e Biológicas. Núcleo de Pesquisas em Ciências Biológicas. II. Título.
Este trabalho contou com a colaboração de:
Prof. Dr. Homero Nogueira Guimarães
Departamento de Engenharia Elétrica, UFMG
Dr. José Mário Carneiro Vilela
Fundação Centro Tecnológico de Minas Gerais, CETEC-MG
Dra. Margareth Spangler de Andrade
Fundação Centro Tecnológico de Minas Gerais, CETEC-MG
Prof. Dr. George Luiz Lins Machado-Coelho
Dedico esse trabalho:
Aos meus pais, Lázaro e Diná, pelo apoio constante e amor incondicional.
“
A única limitação real em suas
habilidades está no nível de seus desejos.
Se desejar algo com a força suficiente,
não haverá limites para o que possa conseguir.”
Às Professoras:
Vanessa e Andréa
Orgulho-me pela oportunidade que tive de trabalhar com grandes e admiráveis pessoas. Obrigada pela atenção e presença marcantes no decorrer desse projeto. Durante todos esses anos de convivência sempre me incentivaram, transmitiram ensinamentos e sobretudo, concederam-me diversas oportunidades.
Saibam que:
Com simplicidade, me ensinaram a gostar da ciência e acima de tudo a agir com a ética, a ter senso crítico...
No dia-a-dia, aprendi com vocês a arte de planejar, de coordenar, de desenvolver o trabalho com persistência e coragem.
Em muitos momentos, quando a falta de confiança persistia, me incentivaram e fizeram com que eu acreditasse em meu potencial,
ensinando-me que ensinar era possível, que arriscar muitas vezes valia a pena...
Agradeço de maneira especial pela confiança, por terem me recebido com respeito e profissionalismo em seus laboratórios, pela amizade, companheirismo,
Agradeço a todos que direta ou indiretamente colaboraram para a realização desse trabalho, em especial:
Ao Prof. Homero Nogueira Guimarães pela valiosa colaboração, pelas importantes conversas e ensinamentos transmitidos no decorrer desse trabalho. Agradeço de maneira especial, pelo desenvolvimento do sistema de aquisição e de análise de dados.
Ao Prof. George Lins Machado-Coelho pelo grande auxílio nas análises estatísticas.
À Margareth Spangler pela grande receptividade no Centro Tecnológico de Minas gerais (CETEC), pela disponibilização dos equipamentos para realização das análises de microscopia de força atômica.
Ao Vilela, pela execução dos ensaios de MFA, pela convivência e disponibilidade em ajudar. Suas sugestões, idéias, nossas conversas, o apoio nas
“loucuras” em tentar identificar minhas partículas, muito contribuíram para o
desenvolvimento desse trabalho.
À Prof. Mônica de Oliveira por disponibilizar o laboratório de Tecnologia Farmacêutica e o Zetasizer para realização das análises de tamanho e medidas de potencial zeta das partículas.
parasitas, diferentes espécies de Plasmodium.
Aos professores do Curso de Pós-Graduação em Ciências Biológicas pelos ensinamentos dispensados.
Aos técnicos administrativos da Escola de Farmácia, em especial, ao Wilson pela responsabilidade em transportar os animais do Biotério Central para a Escola e pela manutenção e cuidado dispensado com os animais na Escola de Fármacia.
Aos amigos do Laboratório de Tecnologia Farmacêutica da UFMG, em especial, ao Guilherme, pela atenção, amizade e ajuda na execução dos ensaios no Zetasizer.
Aos amigos do Laboratório de Desenvolvimento Galênico e Nanotecnologia: Cristina, Polly, Carina, Diego e Juliana pela ótima convivência, amizade, companheirismo, confiança, pela colaboração em algum momento de realização desse trabalho e pelos bons momentos vividos no dia-a-dia.
Às amigas do Laboratório de Farmacologia Experimental: Luciana, Náira, Alessandra, Lorena, Suzana, Jóice, Mariana, Patrícia, Priscila, Francielle, Ariane, Gabriela e Daniele pelo companheirismo, amizade, respeito, ótima convivência e pelas valiosas contribuições em todos os momentos.
Aos colegas de Pós-graduação, pela amizade e aprendizado.
Às amigas Helen, Ju e Valéria, pela grande amizade, pelo apoio, companheirismo, pelas horas e horas de conversas, desabafos... e acima de tudo pelos bons e cômicos momentos vividos. Saudades...
(Projeto CDS 217/02).
À Rede NANOBIOTEC pelo apoio financeiro e pelos encontros patrocinados.
.
Malaria is one of the world’s most important parasitic infections. Severe malaria is
Figura 1: Distribuição global da Malária……….. 4
Figura 2:Mapas de risco de transmissão da malária na Amazônia Legal……… 5
Figura 3: Ciclo biológico do Plasmodium……… 7
Figura 4:Fórmula estrutural do cloridrato de halofantrino………..10
5: Figura 5: Registro eletrocardiográfico normal, mostrando todos os seus componentes e suas respectivas designações (A). Potencial de ação de uma célula miocárdica ventricular (B) registrado simultaneamente...……….……….…..14
Figura 6: Diagrama mostrando o efeito induzido por um fármaco bloqueador de canais de potássio na duração do potencial de ação e no eletrocardiograma …...16
Figura 7: Representação esquemática de nanoesferas com presença da matriz polimérica, e nanocápsulas, constituídas por um núcleo óleo envolvido por uma membrana polimérica……...20
Figura 8: Representação das condições em uma superfície negativa com uma camada de íons positivos adsorvidos na camada de Stern.……….…………26
Figura 9: Esquema de funcionamento da técnica de MFA, mostrando os componentes gerais do microscópio e suas respectivas funções………...…………29
Figura 10: Preparação de Halofantrino base livre a partir de Hf.HCl………….…….34
Figura 11: Etapas de Preparação de Nanocápsulas……….….35
Figura 12: Representação esquemática da metodologia para separação do Hf encapsulado nas NCs do Hf não encapsulado...38
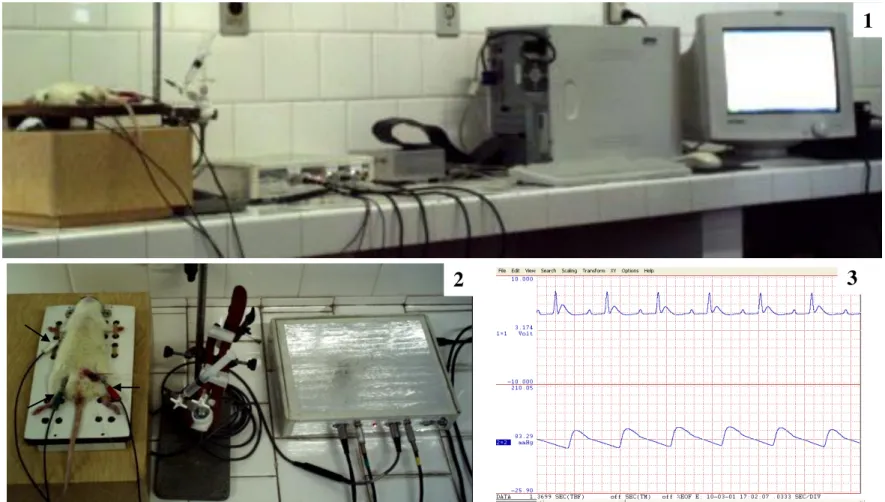
Figura 13: Sistema de Aquisição de ECG e PA...41
Figura 14: Espectro na região do UV apresentando o pico de absorção máxima do Hf em acetonitrila (20 g/mL)...52
distintos. A a D: Zetasizer 3000 HS; E e F: Nanosizer N4 plus...56
Figura 17: Nanocápsulas obtidas como suspensão coloidal de aspecto leitoso, pelo método de nanoprecipitação...58
Figura 18: Imagens de nanocápsulas não carregadas obtidas por MFA...59
Figura 19: Imagem topográfica (A) e fase (B) obtidas por MFA e perfil topográfico (C) de nanocápsulas brancas...61
Figura 20: Imagem de altura (A) e fase (B) de poloxamer188 obtidas por MFA...62
Figura 21: Imagens topográficas (A e B) e perfis topográficos (C e D) de nanocápsulas brancas de PCL...63
Figura 22: Imagens topográficas (A e B) e perfis topográficos (C e D) de nanoesferas brancas de PLA...64
Figura 23: Imagens topográficas (A e B) de nanoemulsão obtidas em diferentes campos por MFA. ...65
Figura 24: Esquema representativo dos possíveis fenômenos que contribuem para o aumento do diâmetro das partículas...66
Figura 25: Imagens topográficas (A) e de contraste de fase (B) de nanocápsulas brancas mostrando diferentes formas: antes (1 e 3) e após (2 e 4) variação da força de interação sonda-amostra (set point = 0)...68
Figura 26: Imagem tridimensional de NC contendo 0,1mg de Hf/mL de suspensão coloidal...69
Figura 27: Imagens de nanocápsulas contendo halofantrino 0,1 mg/mL (A) e 1,0 mg/mL (B) mostrando presença de material ao redor das partículas...71
Figura 28: Dose letal aguda (DL50) determinada após administração i.v. de halofantrino livre (Hf.HCl) e encapsulado (NC-Hf) em ratos Wistar machos...75
receberam 150 mg/kg de Hf.HCl (A) e NC-Hf (B), obtidos antes e após administração do fármaco....77
Figura 31: Cinética de variação do intervalo QT (A) do ECG e do QT corrigido pelo intervalo RR (QTc) (B) de ratos Wistar machos anestesiados com tiopental sódico, após administração i.v. Hf.HCl e NC-Hf nas doses de 100 e 150 mg/kg e dos veículos (NC branca e DMA/PEG) em volumes correspondentes à dose de 150 mg/kg...81
Figura 32:Cinética de variação do intervalo PR (A) e do complexo QRS (B) de ratos Wistar machos anestesiados com tiopental sódico, após administração i.v. Hf.HCl e NC-Hf nas doses de 100 e 150 mg/kg e dos veículos (NC branca e DMA/PEG) em volumes correspondentes à dose de 150 mg/kg...85
Figura 33: Cinética de variação da pressão arterial sistólica (A) e diastólica (B) e da freqüência cardíaca (C) de ratos Wistar machos anestesiados com tiopental sódico, após administração i.v. Hf.HCl e NC-Hf nas doses de 100 e 150 mg/kg e dos veículos (NC branca e DMA/PEG) em volumes correspondentes à dose de 150 mg/kg...88
Figura 34:Comparação da porcentagem de variação máxima dos intervalos QT, PR, QRS e QTc (A), PAS, PAD e FC (B) até 30 min após a administração de 100 ou 150 mg/kg de halofantrino livre e encapsulado, em ratos Wistar machos anestesiados com tiopental sódico...89
Figura 35:Cinética de variação do intervalo QT de ratos Wistar machos anestesiados pelo éter etílico, após injeção i.v. de 150 mg/kg de NC-Hf (A), ou 150 mg/kg de Hf.HCl (B)...94
Figura 36: Cinética de variação do intervalo QT corrigido pelo intervalo RR (QTc) de ratos Wistar machos anestesiados pelo éter etílico, após injeção i.v. de 150 mg/kg de NC-Hf (A), ou 150 mg/kg de Hf.HCl (B)...95
Figura 37:Cinética de variação do intervalo PR de ratos Wistar machos anestesiados pelo éter etílico, após injeção i.v. de 150 mg/kg de NC-Hf (A), ou 150 mg/kg de Hf.HCl (B)...96
Wistar machos anestesiados pelo éter etílico, após injeção i.v. de 150 mg/kg de NC-Hf (A), ou 150 mg/kg de Hf.HCl (B)...98
Figura 40: Cinética de variação da freqüência cardíaca de ratos Wistar machos anestesiados pelo éter etílico, após injeção i.v. de 150 mg/kg de NC-Hf (A), ou 150 mg/kg de Hf.HCl (B)...100
Figura 41: Curva de parasitemia média (A) e acompanhamento do peso médio (B) corporal de ratos Wistar macho após imunossupressão com ciclofosfamida e infecção pelo P. berghei...106
Figura 42: Cinética de variação do intervalo QT (A) e do QTc (B) de ratos Wistar machos infectados pelo P. berghei e anestesiados pelo éter etílico, após injeção i.v. de 100 mg/kg de Hf.HCl ou NC-Hf...109
Figura 43: Cinética de variação do intervalo PR (A) e QRS (B) de ratos Wistar machos infectados pelo P. berghei e anestesiados pelo éter etílico, após injeção i.v. de 100 mg/kg de Hf.HCl ou NC-Hf...111
Quadro 1: Classe e Mecanismo de Ação dos Agentes Antimaláricos………...8
Quadro 2: Principais antimaláricos associados a sistemas vetorizados e testados in vivo.………... 22
Quadro 3: Padronização dos protocolos de imunossupressão...42
L
ISTAD
ET
ABELASTabela 1: Valores de Absorbância utilizados para a construção da curva de calibração da solução de Hf em acetonitrila...52
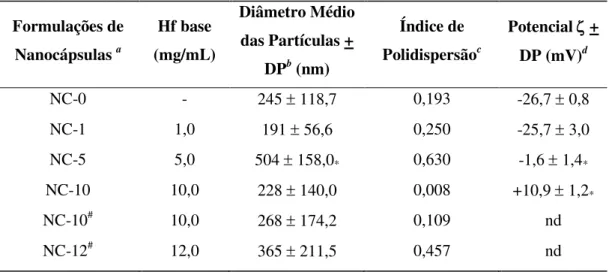
Tabela 2: Características físico-químicas de formulações de NC contendo diferentes concentrações de halofantrino...54
Tabela 3: Alterações comportamentais e morte observadas nos animais tratados com as diferentes formulações de Halofantrino...74
Tabela 4: Médias dos valores absolutos de pressão arterial, freqüência cardíaca e parâmetros eletrocardiográficos avaliados, em diferentes tempos, antes e após a administração i.v. de halofantrino livre ou encapsulado...79
Tabela 5: Variação percentual dos parâmetros do ECG e PA 30 min após a administração de NC-Hf (150 mg/kg) em animais anestesiados pelo tiopental sódico ou pelo éter etílico...91
Tabela 6: Médias dos valores absolutos de pressão arterial, freqüência cardíaca e parâmetros eletrocardiográficos avaliados, em diferentes tempos, antes e após a administração i.v. de150 mg/kg de halofantrino encapsulado...93
Tabela 7: Resultados dos protocolos de imunossupressão...105
Tabela 8: Médias dos valores absolutos de pressão arterial, freqüência cardíaca e parâmetros eletrocardiográficos avaliados, em diferentes tempos, antes e após a administração i.v. de100 mg/kg de Hf.HCl ou NC-Hf em ratos Wistar infectados pelo
Potencial zeta
Da Dalton
DL100 Dose letal para 100% dos animais
DL50 Dose letal para 50% dos animais
DMA dimetilacetamida
DMT Dose Máxima Tolerada
ECG Eletrocardiograma
HDL Lipoproteína de alta densidade
HERG Human Ether a-go-go Related Gene
Hf Halofantrino base
Hf.HCl Cloridrato de Halofantrino
i.v. intravenosa
ICa Corrente de cálcio
IKr Corrente de potássio
INa Corrente de sódio
Ito Correntes transientes de potássio
LDL Lipoproteínas de baixa densidade
MFA Microscopia de força atômica
NC Nanocápsulas
NC-Hf Nanocápsulas de Halofantrino
PAD Pressão Arterial Diastólica
PAS Pressão Arterial Sistólica
PCL Poli--caprolactona
PCS Espectroscopia de Correlação de Fótons
PEG Polietilenoglicol
PLA Poli(ácido-lático)
PLG Poli(ácido-glicólico)
PLGA Poli(ácido-lático-co-glicólico)
QTc Intervalo QT corrigido pelo intervalo RR
RESUMO ABSTRACT
LISTA DE FIGURAS
LISTA DE TABELAS E QUADROS LISTA DE ABREVIATURAS
INTRODUÇÃO...1
1. INTRODUÇÃO GERAL...2
2. REVISÃO BIBLIOGRÁFICA...4
2.1. Malária ...4 2.2. Halofantrino ...10 2.3. Eletrofisiologia Cardíaca ...12 2.4. Cardiotoxicidade de Fármacos ...17 2.5. Sistemas Nanoestruturados para a Vetorização de Fármacos ...19 2.6. Nanocápsulas...23 2.6.1. Características Físico-Químicas das Nanocápsulas...24 2.6.1.1. Distribuição do Tamanho das Nanocápsulas...24 2.6.1.2. Potencial Zeta () das Nanocápsulas ...25 2.6.1.3. Avaliação Morfológica...27 3. JUSTIFICATIVA DO TRABALHO...30
OBJETIVOS...31
1. OBJETIVO GERAL...32 2. OBJETIVOS ESPECÍFICOS...32
MATERIAIS E MÉTODOS ...33
1. METODOLOGIA DE OBTENÇÃO DE NANOCÁPSULAS ...34
1.1. Preparação do Halofantrino Base ...34 1.2. Preparação das Nanocápsulas...34
2. CARACTERIZAÇÃO FÍSICO-QUÍMICA DAS NANOCÁPSULAS...36
2.1. Distribuição de Tamanho e Potencial Zeta ...36 2.2. Determinação do Teor de Halofantrino por Espectrofotometria no Ultravioleta36 2.3. Teste da Porcentagem de Encapsulação ...37 2.4. Análise da Morfologia das Nanocápsulas...38
3. EXPERIMENTAÇÃO “IN VIVO”...39
3.3. Procedimentos Cirúrgicos ...39 3.4. Obtenção dos Sinais de Eletrocardiograma e Pressão Arterial ...40 3.5. Preparo das Soluções de Halofantrino para Administração Endovenosa ...42 3.6. Infecção dos Animais...42 3.7. Avaliação da Parasitemia ...43 3.8. Protocolos Experimentais ...44 3.9. Análise dos Registros ...46 4. ANÁLISE ESTATÍSTICA...47 5. MATERIAIS...48
RESULTADOS E DISCUSSÃO ...49
PARTE 1: CARACTERIZAÇÃO DAS NANOCÁPSULAS ...50 1. Caracterização Fisico-Química ...51 2. Análise Morfológica...Erro! Indicador não definido.59
PARTE 2: AVALIAÇÃO DA CARDIOTOXICIDADE A CURTO PRAZO ...72 1. Determinação da Dose Letal Aguda (DL50) ...73 2. Avaliação da Cardiotoxicidade até 30 minutos após a Administração das Formulações de
Halofantrino ...75
PARTE 3: AVALIAÇÃO DA CARDIOTOXICIDADE A LONGO PRAZO ...90 PARTE 4: AVALIAÇÃO DA CARDIOTOXICIDADE EM ANIMAIS INFECTADOS
PELO Plasmodium berghei...103
DISCUSSÃO GERAL...115 CONCLUSÃO ...122 REFERÊNCIAS BIBLIOGRÁFICAS ...125
ANEXOS………...136
de
INFECTADOS PELO Plasmodium berghei
A malária é a infecção parasitária que mais acomete o ser humano, sendo considerada a segunda causa de mortalidade no mundo, principalmente em países de clima tropical e subtropical, com índice de mortalidade superior a um milhão de pessoas por ano (Greenwood et al., 2005). A malária humana é causada por quatro espécies do parasita do gênero Plasmodium. Altos índices de morbi-mortalidade são detectados em decorrência da infecção pelo Plasmodium falciparum (Guerin et al., 2002). Essa mesma espécie é responsável pelo desenvolvimento da forma complicada da malária, conhecida como malária severa, a qual é caracterizada por falência renal aguda, comprometimento do sistema cardiovascular, seguida por coma e morte (Warrel et al., 1990). Na malária severa, observa-se um quadro de anóxia cerebral, a qual é provocada pela adesão dos eritrócitos parasitados à parede endotelial dos capilares venosos cerebrais gerando bloqueio da circulação sanguínea nestes vasos (Deitsch & Wellems, 1996). Nesses casos, a administração intravenosa (i.v.) de um agente antimalárico é necessária e realizada em ambiente hospitalar.
utilizados no tratamento da malária, tais como o aumento dos índices terapêuticos, por meio de redução de seus efeitos adversos, precisam ser desenvolvidas. Uma delas consiste na modificação do perfil de distribuição do fármaco, sem contudo, alterar a estrutura química da molécula, transportando-a associada a um vetor nanométrico capsular como, por exemplo, as nanocápsulas (Barratt, 2000). As nanocápsulas (NCs) apresentam um núcleo oleoso, no qual drogas lipofílicas podem estar dissolvidas ou dispersas, sendo esse envolvido por um filme de polímero biodegradável. Elas fazem parte de uma família de dispositivos nanométricos capazes de controlar e modificar a distribuição de uma substância ativa para locais específicos do corpo, protegendo ao mesmo tempo, órgãos vitais de efeitos tóxicos (Lasic, 1998). Visando o tratamento da malária severa, o Hf base livre foi anteriormente encapsulado em NCs (Mosqueira et al., 2004). Desse modo, uma forma nanodispersa do fármaco insolúvel pode ser obtida em um meio aquoso e isotônico, adequada para a administração in bolus por via i.v. Estudos anteriores, utilizando uma formulação semelhante de nanocápsulas de Hf (NC-Hf) em camundongos, demonstraram melhoria da eficácia do antimalárico com redução concomitante da toxicidade geral (Mosqueira et al., 2004).
2. REVISÃO BIBLIOGRÁFICA
2.1. M
ALÁRIAEntre as doenças infecciosas, a malária é a segunda causa de mortalidade, atingindo principalmente países de clima tropical e subtropical (Figura 1). De acordo com a Organização Mundial de Saúde (OMS, 1999), estima-se que aproximadamente 300 milhões de pessoas são afetadas por malária e o índice de mortalidade da doença atinge cerca de um milhão de mortes a cada ano. Deste número alarmante, 90% se concentram na África Tropical e 10% estão distribuídos no Sudeste Asiático, Oceania e Américas Central e do Sul (OMS, 1999). Depois dos países africanos, Índia e Brasil são as regiões de mais alta endemicidade no mundo. Nos últimos anos, vários programas de saúde, como Roll Back Malaria, liderados pela OMS reafirmaram ser esta doença questão prioritária no mundo, reconhecendo que a sua situação na África ao sul do Saara deteriorou assustadoramente durante a última década (OMS, 1999).
FIGURA 1- Distribuição global da Malária. Nota do mapa: Este mapa mostra países com malária endêmica. Em muitos desses países, o risco de malária é limitado em determinadas áreas.
Fonte: Center for Disease Control and Prevention, 2003.
Ausência de Malária
No Brasil, segundo dados do Programa Nacional de Prevenção e Controle da Malária (FUNASA, 2005), 99,5% dos casos ocorrem na Amazônia Legal, destacando os estados do Amazonas, Pará, Maranhão e Rondônia. Isto reflete o declínio sócio-econômico com conseqüente migração de trabalhadores para minas e projetos agrícolas no norte do Brasil, expondo a população nestes locais ao maior risco de contrair a doença. Além disso, observa-se que a migração da população da região amazônica para outras regiões do Brasil levou ao surgimento de novos focos de transmissão, como por exemplo, 14 novos focos foram registrados nas últimas décadas no estado de Minas Gerais.
FIGURA 2 –Mapas de risco de transmissão da malária na Amazônia Legal em 1999 (A) e 2004 (B).
Fonte: FUNASA, 2005 <http://www.portal.saude.gov.br/portal/arquivos/pdf/bl_malaria_01_2005>.
Atualmente, são conhecidas cerca de 150 espécies causadoras de malária e dessas, somente quatro espécies infectam o homem: Plasmodium falciparum,
Plasmodium vivax, Plasmodium malariae e Plasmodium ovale (Greenwood et al.,
2005), os quais apresentam padrões morfológicos distintos em esfregaços sanguíneos, além de provocar infecções com periodicidade e patogenicidade também distintas. Estudos sócio-epidemiológicos mostraram que a malária está relacionada à redução da freqüência à escola e ao declínio da produtividade no trabalho, além de prejudicar o desenvolvimento intelectual, variando qualitativa e quantitativamente de lugar para
Incidência Parasitária Anual Por 1000 habitantes Estados da Amazônia Legal
Ausência de casos
> 0,1 – 9,9 (baixo risco)
> 9,9 – 49,9 (médio risco)
> 49,9 (alto risco)
A malária é considerada uma doença sistêmica que provoca alterações na maioria dos órgãos, variando desde formas benignas até as muito graves e fatais. De modo geral, o predomínio de casos graves ocorre com o P. falciparum, causador da malária severa ou cerebral (Winstanley, 2000), cujas formas complicadas são observadas em pessoas não-imunes, principalmente em crianças menores de cinco anos. A malária severa é caracterizada por convulsão evoluindo para um quadro de coma em decorrência da adesão de eritrócitos parasitados na rede capilar periférica (Deitsch & Wellems, 1996) e requer uma terapia imediata com a administração intravenosa (i.v.) de antimaláricos com alta atividade parasiticida.
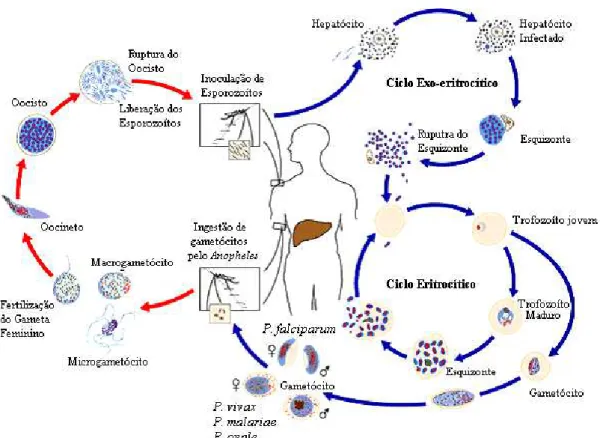
A infecção ocorre através da inoculação de esporozoítos no tecido subcutâneo e na circulação sanguínea do homem, em decorrência da picada do inseto vetor fêmea infectado (gênero Anopheles) durante o repasto sanguíneo. Os parasitas migram em direção ao fígado, por mecanismos ainda não identificados (Krettli & Miller, 2001) alcançando vários hepatócitos, onde alojam-se, multiplicam-se e transformam-se em esquizontes teciduais (ciclo exo-eritrocítico). Os esquizontes então se rompem, liberando milhares de merozoítos, muitos destes são fagocitados pelas células do sistema fagocítico mononuclear (SFM), enquanto outros chegam à circulação sanguínea e invadem os eritrócitos. Após o rompimento do esquizonte tissular, em infecções por
FIGURA 3– Ciclo biológico do Plasmodium, agente causador da malária. Fonte: Center for Disease Control and Prevention, 2003.
<http://www.cdc.gov/malaria/biology/life_cycle.htm>
A parasitemia é um fator determinante da mortalidade associada à doença. Durante o processo de invasão, fatores genéticos e idade celular têm papéis importantes na susceptibilidade do eritrócito à invasão pelo parasita, visto que P. vivax e P. ovale
infectam apenas células jovens, P. malarie infecta apenas eritrócitos maduros, e já o
Entre os agentes antimaláricos mais eficazes incluem a cloroquina (Nivaquina®), quinina (Quinimax®), mefloquina (Lariam®), artemisinina e seus derivados, pirimetamina combinada com sulfadoxina (Fansidar®), primaquina e halofantrino (Halfan®) (Winstanley, 2001), não sendo esse comercializado no Brasil. Estes podem ser classificados de acordo com o estágio do parasita em que atuam ou com o mecanismo de ação que apresentam (Quadro 1).
Quadro 1: Classe e Mecanismo de Ação dos Agentes Antimaláricos
Modo de
Ação Classe Sítio de Ação
A nt im et abó lit os
1) Sulfonamidas e Sulfonas:
sulfadoxina Esquizonticida sangüíneo de ação lenta. Inibidores da diidropteroato sintase.
2) Diaminopiridinas:Pirimetamina
Biguanidas: proganil, clorproganil
Ação esporonticida, esquizonticida tecidual e sangüíneo. Inibidores da diidrofolato
desidrogenase.
3) Hidroxinaftoquinonas:
atovaquona
Esquizonticida sangüíneo. Freqüentemente administrado em associação com o proguanil.
4) 8-Aminoquinoleínas:
Primaquina Ação atividade sobre os outros estágios do ciclo do gametocitocida, apresenta pequena parasita Lis os so m ot róp icos
1) Aminoálcoois: quinina, mefloquina, halofantrino, lumefantrine (co-artemeter®)
Esquizonticida sangüíneo. Concentram-se nos
vacúolos alimentares ácidos do Plasmodium,
inibindo a atividade enzimática.
2) 4-Aminoquinoleínas:
Cloroquina, hidroxicloroquina, amodiaquina
Esquizonticida sangüíneo de rápida ação. Alguma esporonticida. Atuam nos vacúolos digestivos inibindo a atividade enzimática.
3)Lactonas Sesquiterpênicas:
artemisinina e derivados (artesunato, artemeter, arteeter)
Esquizonticida sangüíneo de ação rápida. Atuam através da liberação de radicais livres nos vacúolos digestivos.
Em função do grande impacto causado pela malária no mundo, das dificuldades de obtenção de vacinas 100% eficazes e sendo a quimioterapia o principal meio de reduzir rapidamente a morbi-mortalidade relacionada à doença (Kremsner & Krishna, 2004), torna-se indispensável que medicamentos adequados para o tratamento estejam acessíveis à população atingida. No entanto, apesar do arsenal terapêutico existente hoje, é sabido que nem todas as espécies de plasmódios são igualmente sensíveis aos fármacos antimaláricos, já existindo relatos, para a malária falciparum, de resistência a cloroquina, mefloquina, quinina e sulfadoxina-pirimetamina (Wongrsichanalai et al., 2002; Hastings, 2004). Muitos dos compostos disponíveis tais como cloroquina e pirimetamina combinada com sulfadoxina são de fácil distribuição e eficazes, entretanto, devido ao problema da resistência, a sua utilização tem se mostrado ineficiente (Brockman et al., 2000). O mais preocupante é que em muitas áreas endêmicas, o P. falciparum apresenta fenótipos de resistência a dois ou mais fármacos simultaneamente, um fenômeno conhecido como multiresistência à drogas. A resistência parece ser ocasionada por mutações pontuais em genes codificadores de transportadores de membrana bem como por mutações em determinadas enzimas (Wongrsichanalai et al., 2002).
Atualmente, a ausência de um tratamento único e efetivo contra todas as espécies de plasmódio leva à necessidade de estabelecer um medicamento ou associações de medicamentos específicos em dosagens adequadas a cada situação em particular (FUNASA, 2001). Muitas vezes são requeridas altas doses dos fármacos utilizados, aumentando conseqüentemente o risco de toxicidade.
2.2. H
ALOFANTRINOO cloridrato de halofantrino é um 9-fenantrenometanol, avaliado, na década de 60, pelo Water Reed Institute e desenvolvido comercialmente como Halfan® pela Smith Kline Beecham (Inglaterra).
Quimicamente, o halofantrino (Figura 4) é o cloridrato de 1,3-dicloro- -[2(dibutilamino)etil]-6-(trifluorometil)-9-fenantrenometanol. Estudos prévios demonstraram que esse composto é altamente lipofílico e apresenta um coeficiente de partição octanol/água estimado de 8,5 (Humberstone et al., 1996). Sua solubilidade em diferentes solventes foi determinada por Babalola et al. (2003), sendo 0,67% p/v em metanol; 0,4% p/v em octanol e acetonitrila. A solubilidade do halofantrino em água a 50 °C foi menor que 0,02 g/mL sendo praticamente insolúvel em água à temperatura ambiente e PBS pH 7,4.
FIGURA 4 – Fórmula Estrutural do Cloridrato de Halofantrino. O asterisco(*) determina o centro quiral.
O halofantrino é um composto quiral, administrado como mistura racêmica e, segundo Bryson & Goa (1992) seus enantiômeros apresentaram atividade antimalárica
Estudos anteriores mostraram que o Hf sofre metabolização hepática convertendo-se no produto ativo N-desbutil-halofantrino, sugerindo que parte da atividade antimalárica ocorre por ação desse metabólito (Bryson & Goa, 1992; Karbwang & Bangchang, 1994). O Hf atua contra formas eritrocíticas assexuadas, porém o mecanismo de ação ainda não foi completamente elucidado (Karbwang & Bangchang, 1994). Acredita-se que, assim como a quinina, a cloroquina e a mefloquina, o halofantrino interfere no mecanismo de digestão da hemoglobina, formando complexos tóxicos com o grupo heme (ferriprotoporfirina IX), os quais danificam a membrana celular causando lise e morte do parasita (Karbwang & Bangchang, 1994). Entretanto, estudo recente demonstrou que o Hf provoca distúrbios na organização das bicamadas lipídicas, fato que poderia explicar parcialmente seu mecanismo de ação (Lim & Go, 1999).
Três formas farmacêuticas para administração oral do Hf estão disponíveis para uso humano em vários países do mundo: comprimidos, cápsulas e suspensão (Halfan®). Geralmente, o Hf é bem tolerado e apresenta meia vida de eliminação longa (1,3 a 6,6 dias), possibilitando intervalos maiores de administração e doses menores. No entanto, apresenta baixa e variável absorção por via oral, o que segundo ter-Kuile et al., (1993) pode estar associado às falhas observadas na terapêutica após utilização do Hf. Além disso, foi demonstrado por Brocks & Wasan (2002) que o Hf livre se associa a lipoproteínas plasmáticas de baixa (LDL) e alta (HDL) densidade, o que pode resultar em alteração da biodistribuição do fármaco, com conseqüente aumento da toxicidade, uma vez que o fármaco associado à LDL seria facilmente transportado ao tecido cardíaco via receptores de LDL.
Segundo Wesche et al. (2000), o mecanismo de cardiotoxicidade do halofantrino ocorre através de bloqueio de canais de potássio, os quais são responsáveis pelo início do processo de repolarização e determinam o intervalo QT do ECG. Esses achados estão de acordo com resultados obtidos por Tie et al. (2000) que sugerem que o bloqueio dos canais de potássio HERG (Human Ether a-go-go Related Gene) esteja predominantemente relacionado à alta afinidade do halofantrino em se ligar aos canais abertos, inativando-os, com uma pequena contribuição da ligação aos canais fechados de potássio. O prolongamento do intervalo QT tem sido significantivamente correlacionado aos níveis plasmáticos do fármaco livre, mais especificamente com o (+)-Hf, mas não com seu metabólito, N-desbutil-halofantrino (Touze et al., 1996). Essa diferença na resposta indica que o efeito eletrofisiológico do Hf é, portanto, estereoespecífico. Além disso, se comparado a outros fármacos potencialmente capazes de alterar o intervalo QT, o halofantrino é um inibidor pouco potente, uma vez que a concentração de Hf ou (+)-Hf necessária para bloquear aproximadamente 40% dos canais de potássio foi 100 vezes maior que a observada para quinidina e terfenadina (Wesche et al., 2000). Entretanto, o Hf é considerado o mais cardiotóxico dos antimaláricos utilizados (Touze et al., 2002).
2.3. E
LETROFISIOLOGIAC
ARDÍACAO eletrocardiograma é um exame importante em clínica médica, de fácil manuseio, reprodutível e de baixo custo operacional. O ECG convencional pode ser definido como um registro extracelular das variações do potencial elétrico do músculo cardíaco em atividade, evento que precede a atividade mecânica cardíaca, obtido por meio de eletrodos aplicados à superfície corporal.
A fase 0, ou limiar do potencial de ação, é gerada pelo influxo rápido de íons Na+ para o interior dos miócitos, através de canais de Na+ (INa). A fase 2, ou platô do potencial de ação, é causada essencialmente pela entrada de Ca++ extracelular para o interior das células cardíacas através de canais de Ca++ tipo L (ICa). As fases 1 e 3 descritas, respectivamente, como o início e o fim do processo de repolarização, são mediadas pelo efluxo de íons K+ para o exterior da célula através da abertura de vários e distintos canais de K+. A corrente transiente (Ito), presente em grande densidade no rato, apresenta um componente ativado por despolarização e inativação dependente de voltagem e de tempo, e contribui para o fim do limiar de ação, causando o início do processo de repolarização (fase 1). Canais de K+ distintos contribuem para a fase 3 ou fase final da repolarização, apresentando papel fundamental na determinação da duração do potencial de ação, sendo IKr , corrente retardada de efluxo de ativação rápida, a principal responsável pela condução adequada em condições de variações de freqüência cardíaca. Por fim, os canais IK1 têm um papel predominante na etapa final do processo de repolarização (fase 4) em muitas espécies, sendo responsáveis pela manutenção desse estágio. Todas as correntes descritas para o potencial de ação ventricular em humanos estão também presentes nos átrios, embora sua distribuição e amplitude sejam características específicas para cada tecido. A forma e a duração do potencial de ação cardíaco, também são específicas para cada espécie animal, refletindo diferenças no tipo, estrutura e distribuição celular (Crumb & Cavero, 1999; Silva, 1999).
que modificam seu traçado. A figura 5 apresenta os elementos de um eletrocardiograma em condições de normalidade ou em ritmo sinusal.
FIGURA 5 – Registro eletrocardiográfico normal, mostrando todos os seus componentes e suas respectivas designações (A). Potencial de ação de uma célula miocárdica ventricular (B) registrado simultaneamente.
Fonte: Adaptação de Tan et al., 1995, p.702.
A onda P representa a ativação elétrica dos átrios ou despolarização atrial, apresentando-se como uma onda arredondada, simétrica e de pequena amplitude. A ausência de onda P caracteriza a ocorrência de arritmias, como, por exemplo, bloqueio do ritmo juncional.
Fase 0
Fase 4
Fase 1 Fase 2
O intervalo RR é o intervalo entre duas ondas R consecutivas e permite determinar o ritmo cardíaco.
O intervalo PR representa o tempo entre o início da despolarização atrial, passando pela condução do impulso através do nódulo atrioventricular, potencial não detectado em derivações periféricas, e o início da despolarização ventricular. É o intervalo de tempo entre o início da onda P e o início do complexo QRS. Em geral, esse intervalo diminui com o aumento da freqüência cardíaca, aumentando com a diminuição da freqüência. O prolongamento desse parâmetro sugere bloqueio atrioventricular.
O complexo QRS representa a despolarização ventricular, processo contínuo, mas possível de ser dividido em momentos ou fases arbitrárias, de acordo com os pontos atingidos pela seqüência de ativação ventricular: septo, ápice direito, ápice esquerdo e paredes livres e finalmente as bases dos ventrículos. Alterações do QRS são geralmente associadas a hipertrofias ventriculares e bloqueio de ramo.
O segmento ST é o intervalo de registro isoelétrico que acompanha a fase de platô após o término da despolarização ventricular.
A onda T representa a repolarização ventricular.
O intervalo QT representa o tempo necessário para despolarização e repolarização dos ventrículos. É o intervalo medido entre o início do QRS e o final da onda T. O prolongamento do intervalo QT pode ser classificado como hereditário ou adquirido, ambos associados a um tipo característico de taquicardia ventricular polimórfica conhecida como torsade de pointes. A forma hereditária parece ocorrer como conseqüência de alterações genéticas nos canais iônicos ou resultar de uma resposta anormal à estimulação simpática ou adrenérgica; enquanto a forma adquirida pode ser causada por vários fármacos ou condições que reduzam a atividade das correntes de K+ no processo de repolarização ou aumentem o influxo de íons Na+ ou Ca++ durante o processo de despolarização (Tan et al., 1995).
ou sua interação com outros fármacos (Al-Khatib et al., 2003). A figura 6 mostra o efeito de fármacos bloqueadores de canais de K+ na duração do potencial de ação cardíaco e no eletrocardiograma.
FIGURA 6–Diagrama mostrando o efeito induzido por um fármaco bloqueador de canais de potássio (B) na duração do potencial de ação e no eletrocardiograma. Este fármaco pode produzir prolongamento do potencial de ação, prolongamento do intervalo QT e torsades de pointes.
Fonte: Crumb & Cavero, 1999, p.273.
Alterações do intervalo QT foram inicialmente observadas como efeito adverso da quinidina e estudos prévios relacionando os efeitos cardiotóxicos de agentes antimaláricos consideraram medidas do intervalo QT do ECG como um importante marcador para a avaliação de fatores e condições clínicas que predispõem à ocorrência de toxicidade. Entre os antimaláricos que agem diretamente bloqueando os canais de potássio encontra-se o halofantrino, objeto de estudo do nosso trabalho. Como
Bloqueador de Canais de K+
Prolongamento da Duração do Potencial de Ação (DPA)
Extracelular
Intracelular
Prolongamento do Intervalo QT
Intervalo QT Intervalo QT
Torsades de pointes Bloqueador de Canais de K+
Prolongamento da Duração do Potencial de Ação (DPA)
Extracelular
Intracelular
Prolongamento do Intervalo QT
Intervalo QT Intervalo QT
mencionado anteriormente, Wesche et al. (2000) demonstraram que o Hf bloqueia canais IK em miócitos isolados de felino, indicando que esse fármaco é similar aos antiarrítmicos pertencentes à classe III em sua capacidade de prolongar a repolarização de maneira dose-dependente. A freqüência de prolongamento do intervalo de QT varia com a classe de fármacos, sendo predominantemente mais alta com os antiarrítmicos da classe III. Entretanto, para fármacos não-cardíacos, a freqüência é desconhecida, podendo variar de 1:100 pessoas para o halofantrino à 1:50.000 para terfenadina, dependendo das circunstâncias clínicas (Shah, 2002).
2.4. C
ARDIOTOXICIDADEDEF
ÁRMACOSA cardiotoxicidade pode ser caracterizada pela presença de um ou mais fatores tais como hipertensão arterial, cardiomiopatia, bradiarritmia, além do prolongamento do intervalo QT do ECG (Youssef & Links, 2005). Efeitos cardiotóxicos são comumente descritos após a utilização de agentes quimioterápicos (Youssef & Links, 2005; Guerra
et al., 2005; Yeh et al., 2004), antipsicóticos (Testai et al., 2004; Brown et al., 2004, Harrigan et al., 2004), antidepressivos (Pohl et al., 2003), antiarrítmicos (Lin et al., 2005), antifúngicos (Owens, 2004) dentre outros. Além disso, efeitos adversos cardíacos têm sido reportados com fármacos utilizados no tratamento de malária falciparum tais como cloroquina (Bakshi et al., 2000), quinina (Martin et al., 1997), mefloquina (Fonteyne et al., 1996; Cooker et al., 2000; Touze et al., 2002) e Hf (Krishna et al., 1993). Estudos clínicos têm relatado a ocorrência de arritmia ventricular severa e morte súbita em pacientes tratados com Hf associado à alterações do intervalo QT (Nosten et al., 1993; Gundersen et al., 1997). Pacientes tratados com Hf após falha terapêutica da mefloquina apresentaram alterações mais significativas do ECG comparados àqueles que receberam o fármaco como tratamento primário (Nosten et al., 1993).
incluem medidas de freqüência cardíaca, pressão arterial e análise detalhada do ECG. Estudos in vitro utilizando fibras de Purkinje ou músculos papilares cardíacos de espécies como, coelho, guinea-pig e cão são considerados adequados, uma vez que as correntes iônicas responsáveis pelo potencial de ação dessas estruturas se assemelham ao ser humano.
Dados da literatura relatam o estudo da cardiotoxicidade do halofantrino tanto em modelos in vivo como em modelos in vitro. Batey et al. (1997) avaliaram o efeito do halofantrino in vivo e in vitro em guinea-pigs anestesiados através de análise do ECG. Esses autores verificaram a capacidade do Hf em prolongar o QTc in vivo sem alterar o período refratário, sugerindo que, provavelmente, os efeitos in vivo do Hf na repolarização cardíaca, são indiretos, uma vez que nenhuma alteração in vitro foi observada. Batey & Coker (2002), utilizando coelhos machos, demonstraram pela primeira vez no modelo in vivo, que o halofantrino pode causar torsade de pointes. Segundo tais autores, há uma correlação entre os efeitos do Hf nos IKr in vivo e os efeitos adversos cardíacos observados em humanos, sendo também verificado aumento do intervalo QT e redução da freqüência cardíaca após administração do Hf. Além desses, o estudo de avaliação do mecanismo de cardiotoxicidade do halofantrino descrito por Wesche et al. (2000) foi conduzido in vitro em miócitos de felino. Os autores utilizaram esse modelo com o objetivo de verificar se o Hf era o principal responsável pelo prolongamento do intervalo QT ou se esse efeito poderia ser decorrente de seu metabólito ativo. Foi demonstrado ainda que o Hf prolongou o intervalo QT de maneira dose-dependente, quando altas concentrações do fármaco foram avaliadas. Por outro lado, o N-desbutilhalofantrino provocou um efeito mínimo no intervalo QT. Entretanto, a cardiotoxicidade do halofantrino avaliada no modelo rato foi realizada pela primeira vez no presente trabalho.
2.5. S
ISTEMASN
ANOESTRUTURADOSP
ARAA V
ETORIZAÇÃOD
EF
ÁRMACOSA pesquisa científica que busca o direcionamento de fármacos especificamente para o seu alvo de ação é realizada há algumas décadas. Entretanto, a chamada vetorização de fármacos que consiste na associação de moléculas a vetores sintéticos específicos, permite que as propriedades físico-químicas da molécula sejam mascaradas e que as propriedades do vetor sejam então predominantes na determinação da distribuição do fármaco pelo organismo.
A utilização clínica de alguns agentes terapêuticos pode ser restrita em função de suas propriedades físico-químicas, bem como, de seus efeitos colaterais. Sabe-se que a resposta farmacológica está diretamente relacionada à concentração do fármaco no sítio de ação desejado. No entanto, a distribuição dos princípios ativos no organismo é, essencialmente, determinada por suas características físico-químicas. O fármaco livre por sua vez é, geralmente, distribuído indistintamente, entre as diversas células, tecidos ou órgãos do corpo, levando ao aparecimento de inúmeros efeitos adversos nos locais outros que não o sítio de ação desejado (Couvreur et al., 2002). Isto tem incentivado o desenvolvimento de diferentes estratégias capazes de otimizar a ação do fármaco como, por exemplo, modificar sua distribuição, através de sua associação a sistemas carreadores. Estes sistemas podem ser classificados em microparticulados quando possuem diâmetro superior a 1 m ou nanoparticulados se apresentarem diâmetro na ordem nanométrica (entre 10 a 1000 nm) (Couvreur et al., 2002). Dentre os principais sistemas nanoestruturados encontram-se os lipossomas e as nanopartículas (nanocápsulas e nanoesferas).
FIGURA 7–Representação esquemática de nanoesferas com presença da matriz polimérica, e nanocápsulas, constituídas por um núcleo óleo envolvido por uma membrana polimérica.
O desenvolvimento dos nanossistemas poliméricos tem visado diversas aplicações terapêuticas, sendo planejados principalmente para a administração parenteral (intravenosa, subcutânea ou intramuscular), oral ou oftálmica. As possíveis vantagens terapêuticas dos carreadores coloidais dependem de sua distribuição no organismo (Barratt, 2000). De modo geral, pode-se dizer que as principais vantagens dos sistemas nanoestruturados são: redução das dosagens empregadas, bem como da freqüência de administração, aumento do índice terapêutico de fármacos muito tóxicos, redução da toxicidade geral, proteção do fármaco contra inativação química ou enzimática e direcionamento para o alvo de ação.
Os polímeros utilizados na encapsulação consistem geralmente de materiais biocompatíveis e biodegradáveis, os quais são degradados in vivo em fragmentos menores, facilmente excretados pelo organismo, ou mesmo em metabólitos naturais do organismo. Podem ser de origem natural, semi-sintética ou, mais comumente, sintética, destacando-se os poliésteres como poli--caprolactona (PCL), poli(ácido-lático) (PLA), poli(ácido glicólico) (PLG) e seus co-polímeros (Laurencin & Elgendy, 1994).
Tensioativos de superfície
Polímeros
Tensioativos para dispersão de fases oleosas
nanoesferas nanocápsulas
Núcleo Oleoso Tensioativos de superfície
Polímeros
Tensioativos para dispersão de fases oleosas
nanoesferas nanocápsulas
Estudos recentes, realizados em modelos animais, têm demonstrado a utilização de vetores coloidais como carreadores de fármacos antimaláricos para o tratamento de malária (Quadro 2) e de vacinas. Chimanuka et al. (2002) prepararam lipossomas contendo arteméter, apresentando 100% de eficiência de encapsulação e 100% de eficácia no tratamento de camundongos infectados pelo Plasmodium chabaudi chabaudi. Mosqueira et al. (2004) avaliaram a eficácia e farmacocinética do halofantrino encapsulado em diferentes tipos de nanocápsulas em camundongos infectados pelo Plasmodium berghei, demonstrando que a atividade das NCs foi similar ou maior quando comparada ao fármaco livre administrado como solução.
Um vetor escolhido deve permitir a encapsulação de altas concentrações do fármaco como também permitir que o princípio ativo seja liberado de forma controlada em condições fisiológicas. As nanocápsulas foram os vetores utilizados na realização do presente estudo uma vez que as características do fármaco (alta lipofilia, log P = 8,5) e alta solubilidade em óleos (Mosqueira, 2000a) favorecem sua encapsulação no núcleo oleoso, objetivando-se um alto rendimento de encapsulação nas nanocápsulas. Além disso, Mosqueira et al. (2004) demonstraram que em camundongos infectados pelo
Quadro 2: Principais antimaláricos associados a sistemas vetorizados e testados in vivo.
Fármaco Vetor Eficácia Referência
Sulfato de Quinina
Microesferas Eficácia inferior ao fármaco livre, após administração subcutânea, em camundongos infectados pelo P. berghei.
Pimentel, 2004
Halofantrino Nanocápsulas Atividade antimalárica semelhante ou superior ao fármaco livre. Estudo realizado após a administração de dose única em animais severamente infectados pelo P. berghei.
Mosqueira et al., 2004
Arteméter Lipossomas Eficácia superior ao fármaco livre com 100% de cura dos animais infectados com Plasmodium chabaudi chabaudi
Chimanuka et al.,
2002
Arteeter Lipossomas Aumento da biodisponibilidade (97,91%) do arteeter comparado com a suspensão (31,38%) após administração oral em coelhos. Aumento do tempo de meia vida após administração i.v. do arteeter encapsulado em relação aos outros derivados de artemisinina.
Bayomi et al., 1998
Cloroquina Lipossomas modificados por anticorpos anti-eritrócitos
Cura de 75-90% dos animais infectados pelo P. berghei resistente a cloroquina, utilizando doses baixas do fármaco (5 mg/kg).
Owais et al., 1995
Primaquina Nanoesferas Aumento do tempo de sobrevida de camundongos infectados pelo P. berghei
se comparado ao fármaco livre.
Mbela et al., 1992
Pirimetamina Microesferas Atividade terapêutica não foi adequada para tratamentos por períodos prolongados.
Tsakala et al., 1990
Cloroquina Lipossomas Aumento na eficácia terapêutica e profilática com 100% de eficácia avaliada em camundongos infectados pelo P. berghei após administração de dose única de cloroquina encapsulada.
Peeters et al., 1989
Primaquina Lipossomas Aumento do tempo de meia vida da primaquina em lipossomas comparado ao fármaco livre, após administração i.v
2.6. N
ANOCÁPSULASAs nanocápsulas são nanopartículas poliméricas caracterizadas como reservatórios vesiculares constituídos por uma parede polimérica que envolve uma cavidade preenchida com óleo ou emulsão, na qual o princípio ativo encontra-se disperso (Kreuter, 1994). NCs são carreadores de escolha para a administração intravenosa de fármacos altamente lipofílicos, pois são constituídas por polímeros estáveis, com baixa toxicidade e capacidade de degradação no organismo. Consideradas vetores de segunda geração, as NCs possibilitam a aplicação sistêmica de injeções intravenosas in bolus, sem diluição prévia, direcionando o fármaco de forma passiva para células definidas do organismo.
Podem ser classificadas como convencionais ou furtivas. As NCs convencionais concentram os fármacos encapsulados nos órgãos e células do sistema fagocítico mononuclear (Juliano, 1988). Por outro lado, as NCs furtivas ou com a superfície modificada, representam um tipo especial de partículas com cadeias de polietilenoglicol (PEG) ligadas covalentemente à superfície. Essa modificação permite que as partículas, quando injetadas por via i.v., escapem do reconhecimento e da captura rápida pelas células do SFM, (Gref et al., 1994), prolongando assim o tempo de circulação sangüínea e liberando lentamente, no compartimento plasmático, os princípios ativos encapsulados no seu interior (Mosqueira et al., 1999). As NCs, em especial, as furtivas são potencialmente capazes de restringir a captação de fármacos por certos tecidos ou órgãos que apresentam epitélios endoteliais contínuos, como o coração e os rins, preservando-os da toxicidade do princípio ativo.
Segundo revisão feita por Schaffazick et al. (2003), existem vários métodos para preparação de nanopartículas poliméricas, que podem ser divididos em duas classes principais: a primeira engloba a maioria dos métodos, os quais são baseados em reação de polimerização, enquanto a segunda baseia-se na deposição interfacial de polímeros pré-formados, sendo também conhecida como nanoprecipitação (Fessi et al., 1989).
oleosa na qual o fármaco encontra-se disperso e revestida por uma camada polimérica em um ambiente externo aquoso. A técnica consiste na mistura de uma fase orgânica (contendo um solvente orgânico, óleo, tensioativo hidrofóbico e polímeros insolúveis no óleo e na água) miscível em uma fase aquosa (contendo tensioativos hidrofílicos). Após a mistura da fase orgânica com a fase aquosa, o polímero precipita na interface pela redução da sua solubilidade na mistura de solventes, sendo que a difusão mútua dos solventes fornece uma energia favorável para formação de nanogotas de óleo que servem como núcleo para a precipitação do polímero. Observa-se, imediatamente, o surgimento de uma suspensão leitosa, com elevada opalescência, resultado da formação das nanocápsulas. Em seguida, o solvente é removido sob pressão reduzida e a suspensão concentrada através da evaporação da água (Fessi et al., 1989). Os polímeros mais utilizados para a preparação de NCs por esse método são os poliésteres biodegradáveis, PLA, PLGA e PCL.
2.6.1. C
ARACTERÍSTICASF
ÍSICO-Q
UÍMICASD
ASN
ANOCÁPSULASEm função de sua natureza coloidal e da complexidade de constituintes que compõem as formulações de nanocápsulas, a caracterização dessas nanoestruturas é tecnicamente complexa de ser realizada. Geralmente, a avaliação físico-química envolve: análise morfológica, distribuição do tamanho das partículas, determinação do potencial zeta () ou carga superficial das partículas, determinação do pH, determinação da concentração de fármaco associado às nanopartículas e cinética de liberação do fármaco a partir das nanocápsulas (Legrand et al., 1999; Schaffazick et al., 2003).
2.6.1.1. D
ISTRIBUIÇÃOD
OT
AMANHOD
ASN
ANOCÁPSULASGeralmente, o diâmetro das NCs preparadas pela técnica de nanoprecipitação varia entre 100 e 500 nm, sendo influenciado por diversos fatores tais como: natureza e concentração do polímero e do fármaco, concentração de surfactantes, proporção entre solvente e água, concentração do óleo, além da velocidade de difusão da fase orgânica na aquosa (Legrand et al., 1999; Mosqueira et al., 2000 b; Schaffazick et al., 2003).
Os métodos mais comumente utilizados para determinar a distribuição de tamanho e o índice de polidispersão das amostras são espectroscopia de correlação de fótons (PCS), microscopia eletrônica de transmissão (MET) e microscopia eletrônica de varredura (MEV), sendo que as últimas permitem analisar a morfologia das nanoestruturas (Legrand et al., 1999). Recentemente, a microscopia de força atômica (MFA) também vem sendo utilizada para determinação de tamanho e estudo da morfologia das nanopartículas.
No presente trabalho, a técnica utilizada para avaliar a distribuição de tamanho foi a PCS e a MFA. A técnica de PCS baseia-se na análise do movimento browniano das partículas, ou seja, na capacidade de deslocamento constante das partículas presentes num determinado sistema fazendo com que a intensidade da luz espalhada por elas forme um padrão de movimento. Através da dispersão da luz torna-se possível determinar o diâmetro médio das partículas. Portanto, a adsorção de tensioativos e a camada de hidratação móvel podem afetar o diâmetro das nanopartículas, o qual é determinado como raio hidrodinâmico.
2.6.1.2. P
OTENCIALZ
ETA(
) D
ASN
ANOCÁPSULASgrandeza da carga elétrica através de medidas de mobilidade eletroforética das partículas submetidas à aplicação de um campo elétrico.
FIGURA 8 –Representação das condições em uma superfície negativa com uma camada de íons positivos adsorvidos na camada de Stern. São apresentados o potencial de superfície 0 e o potencial na camada de Stern .. No plano de cisalhamento é localizado o potencial zeta,
Fonte: Florence & Attwood, 2003, p.352.
As lecitinas, o poloxamer e os polímeros são os principais componentes que podem afetar o potencial , por estarem envolvidos na formação da cápsula e adsorvidos a ela. Enquanto polímeros e lecitinas favorecem uma carga negativa na interface, o poloxamer, um surfactante não-iônico tende a reduzir, em valor absoluto, o potencial
(Legrand et al., 1999). Como descrito por Benita & Levy (1993) é possível modular o
potencial pela escolha de lecitinas com diferentes graus de pureza, uma vez que a carga negativa é decorrente da presença de determinados tipos de fosfolípides.
Legrand et al., (1999) afirmam que formulações constituídas por partículas com altos valores de potencial zeta (acima de 30 mV) apresentam maior estabilidade, visto que grandes forças repulsivas tendem a evitar a agregação entre as partículas. O potencial de superfície também pode influenciar a resposta biológica do fármaco, portanto, após a administração i.v., as partículas convencionais são rapidamente capturadas pelas células do SFM quando o diâmetro e a carga superficial são aumentados (Juliano, 1988).
Além disso, alterações do potencial permitem elucidar mecanismos de associação fármaco-vetor e avaliar a influência da composição nas características físico-químicas da nanoestrutura. Calvo et al., (1996) observaram os efeitos da composição de diferentes carreadores nanoestruturados sobre os valores do potencial zeta e verificaram que a fase oleosa das nanocápsulas e nanoemulsões conferiu um potencial mais negativo (aproximadamente = -42 mV) quando comparado às nanoesferas (aproximadamente
= -16 mV). Em função da semelhança do potencial de nanocápsulas e nanoemulsões, os autores sugeriram que a camada polimérica ao redor da gotícula de óleo seria um filme delgado. Por outro lado, Mosqueira et al. (2000 b) sugeriram que o óleo constituinte das nanocápsulas está completamente encapsulado pelo polímero pois nenhuma alteração significativa no potencial de NC foi observada em formulações preparadas com óleos de diferente natureza.
2.6.1.3. A
VALIAÇÃOM
ORFOLÓGICAvalor estimado foi de 17 nm, permitindo elucidar e comprovar o modelo reservatório proposto para as NCs.
Entretanto, nos últimos anos, a MFA tem sido uma ferramenta muito utilizada para caracterização de nanossistemas, principalmente lipossomas (Li & Palmer, 2004) e nanoesferas (Gref et al., 1994). A MFA fornece informações com alta resolução em três dimensões, em escala nanométrica sendo capaz ainda de resolver detalhes de superfície ao nível atômico (Neves et al., 1998).
A análise morfológica das nanocápsulas no presente estudo foi realizada por MFA, cujo princípio básico envolve a força de interação entre a sonda utilizada e a amostra, fornecendo importantes informações tais como organização estrutural, distribuição de diâmetro, dentre outras. À medida que uma sonda extremamente fina (~100 Å de diâmetro), montada sob a extremidade de uma alavanca, se aproxima da superfície de uma determinada amostra, surgem forças de interação sonda-amostra as quais fazem a alavanca defletir. Essa deflexão é detectada por um sistema laser-fotodetector e todo o sistema monitorado digitalmente, convertendo os dados em um mapa topográfico da superfície da amostra (Neves et al., 1998). A figura 9 apresenta os componentes do microscópio de MFA e o esquema de funcionamento da técnica.
FIGURA 9 – Esquema de funcionamento da técnica de MFA, mostrando os componentes gerais do microscópio e suas respectivas funções.
Fonte:www.web.mit.Edu/cortiz/www/afm
Baseando nessas forças interativas, pode-se definir alguns modos de operação na técnica de MFA, a saber: 1) contato, onde a interação por forças repulsivas permite obter imagens com alta resolução, ao nível atômico. Neste modo, o atrito sonda-amostra pode danificar a superfície, produzindo imagem distorcida; 2) não contato, onde a interação é atrativa, apresenta resolução limitada apesar de apresentar a vantagem de não danificar a amostra; 3) contato intermitente, com regime alternando em atrativo e repulsivo; reúne vantagens dos dois modos, conseguindo altas resoluções sem deformação da amostra (Neves et al., 1998).
3. J
USTIFICATIVADOT
RABALHOEm trabalhos anteriores, os carreadores coloidais do tipo NCs, da ordem de 200 nm foram obtidos a partir de derivados anfifílicos de PLA, destinadas à administração i.v. de fármacos lipofílicos. Estes vetores permitiram um aumento da concentração plasmática x tempo da ordem de 16 vezes do halofantrino, quando comparado com a concentração plasmática do fármaco administrado como solução (Mosqueira et al., 2004). Entretanto, o efeito mais surpreendente foi à redução extremamente significativa da toxicidade em camundongos com um aumento da dose máxima tolerada de 30 para 100mg/kg/dose do halofantrino quando administrado por via i.v. sob forma vetorizada. O trabalho supracitado não permitiu, no entanto, verificar se a redução da toxicidade teria como foco o sistema cardiovascular, uma vez que diversos trabalhos na literatura descrevem efeitos cardiotóxicos em pacientes tratados com halofantrino (Nosten et al., 1993; Malvy et al., 2000; Abernethy et al., 2001).
Os carreadores coloidais nanoparticulados, particularmente as nanocápsulas, são potencialmente capazes de reduzir a toxicidade geral e também a dose eficaz de alguns fármacos, por alterarem sua farmacocinética e biodistribuição, considerando que a molécula associada ao vetor teria uma associação reduzida com órgãos vitais tais como coração, cérebro e rins.
1.
O
BJETIVOG
ERALEste trabalho tem como objetivo desenvolver e caracterizar uma formulação de nanocápsulas contendo halofantrino base e avaliar, experimentalmente, a redução da toxicidade geral, mais especificamente da cardiotoxicidade, obtida com o uso desse sistema em ratos Wistar sadios e infectados.
2. O
BJETIVOSE
SPECÍFICOSEm âmbito mais específico este trabalho tem como objetivos principais:
o desenvolvimento farmacotécnico (formulação e caracterização) de nanocápsulas de poli--caprolactona contendo halofantrino;
a caracterização físico-química das nanopartículas pela análise do tamanho e da carga superficial (potencial zeta) por espectroscopia de correlação de fótons e mobilidade eletroforética, respectivamente;
a análise da morfologia, estrutura, características de organização e da distribuição de tamanho das nanocápsulas por microscopia de força atômica (MFA);
a análise da associação do fármaco às NC por MFA;
a determinação da dose letal aguda (DL100 e DL50) após administração intrvaneosa do halofantrino livre (Hf.HCl) e encapsulado (NC-Hf) em ratos Wistar;
comparação das alterações dos intervalos QT, PR, QRS e QTc do ECG de ratos Wistar, indicativas de cardiotoxicidade, advindas da administração intravenosa de diferentes doses e formulações contendo halofantrino, a curto e a longo prazo;
a análise das alterações de pressão arterial e freqüência cardíaca em ratos Wistar tratados com Hf.HCl ou NC-Hf,
M
ATERIAIS E
1.1.
P
REPARAÇÃOD
OH
ALOFANTRINOB
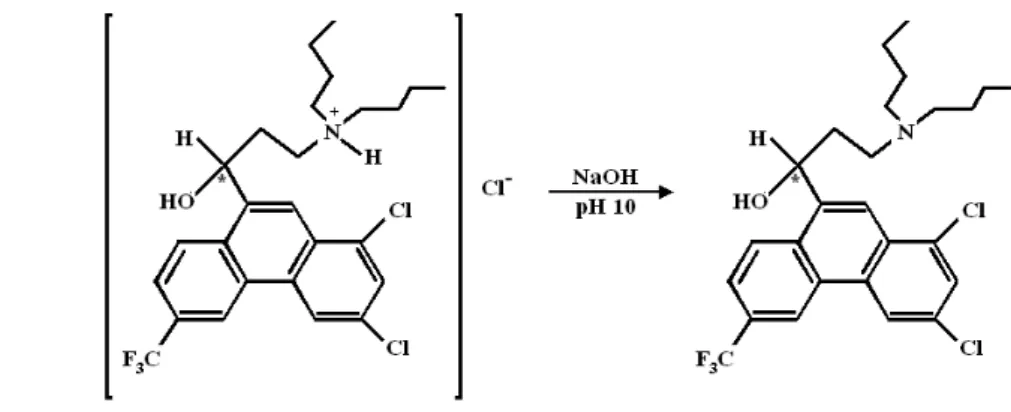
ASEEssa técnica consistiu em uma reação química de transformação do Hf.HCl, utilizado na produção do medicamento HALFAN®, em sua base livre mais solúvel na fase oleosa, posteriormente utilizada na preparação de nanocápsulas, como apresentado na figura 10.
FIGURA 10 –Preparação de Halofantrino base livre a partir de Hf.HCl, como descrito por
Porter et al., 1996.
A reação ocorreu a partir da dissolução de 1,0 g de Hf.HCl em 50 mL de álcool etílico, seguida pela alcalinização com hidróxido de sódio até obtenção de pH = 10. Foram adicionados 50 mL de água para precipitação da base livre e a extração da base livre foi feita num funil de separação com diclorometano. Foram realizadas duas extrações com 25 mL de diclorometano cada. À solução orgânica foi acrescentado sulfato de magnésio para remoção do restante de água, filtrada, e o solvente foi evaporado sob pressão reduzida em um rotavapor (Heidolph Instruments, Alemanha) até secura. O Hf base livre foi armazenado ao abrigo da luz em dessecador até o seu uso posterior ou dissolvido em Miglyol 810 (40 mg/mL) para posterior utilização.