PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIA ANIMAL
JULIO CESAR MORAES
DIAGNÓSTICO DE Eimeria spp EM FRANGOS DE CORTE NA MESORREGIÃO SUL DO ESTADO DE SANTA CATARINA,
POR MEIO DA MULTIPLEX PCR
DIAGNÓSTICO DE Eimeria spp EM FRANGOS DE CORTE NA MESORREGIÃO SUL DO ESTADO DE SANTA CATARINA,
POR MEIO DA MULTIPLEX PCR
Dissertação apresentada no programa de Pós-graduação em Ciência Animal do Centro de Ciências Agroveterinárias, da Universidade do Estado de Santa Catarina, como requisito parcial para obtenção do grau de Mestre em Ciência Animal.
Orientador: Prof. PhD. Antonio Pereira de Souza
Diagnóstico de Eimeria spp em frangos de corte
na mesorregião sul do estado de Santa Catarina, por meio da Multiplex PCR / Julio Cesar Moraes. – 2013.
110 p. : il. ; 21 cm
Orientador: Antonio Pereira de Souza Bibliografia: p. 85-101
Dissertação (mestrado) – Universidade do Estado de
Santa Catarina, Centro de Ciências Agroveterinárias, Programa de Pós-Graduação em Ciência Animal, Lages, 2013.
1. Eimeria spp. 2. Ocorrência. 3. Oocisto.
4. Frangos de corte. 5. Multiplex PCR. I. Moraes, Julio Cesar. II. Souza, Antonio Pereira de. III. Universidade do Estado de Santa Catarina. Programa de Pós-Graduação em Ciência Animal. IV. Título
– Ficha catalográfica elaborada pela Biblioteca Setorial do
Quero agradecer, em primeiro lugar, a Deus, pela força e coragem durante toda esta caminhada.
A minha mãe Idi, ao meu irmão Rafael que, com muito carinho e apoio, não mediram esforços para que eu concluísse mais esta etapa.
A minha namorada Gisele, pelo carinho, incentivo e compreensão que vem me prestando nesses últimos anos.
Ao Prof. Dr. Antonio Pereira de Souza, pelos ensinamentos e tempo dedicado em orientação.
Ao Prof. Dr. Luiz Claudio Miletti e Prof. Dra. Maria de Lourdes Borba Magalhães pela oportunidade, aprendizado e dedicação durante o período experimental.
Ao Prof. Dr. Valdomiro Bellato e Prof. Dr. Anderson Barbosa de Moura pela confiança e apoio nesta jornada.
A Prof. Dra. Amélia Aparecida Sartor pela amizade demonstrada ao longo destes anos de convívio.
A Dra. Sandra Fernandez e a Dra. Jane Fraga pelo fornecimento das amostras.
Ao amigo e bolsista, Marciel França pela boa vontade e apoio durante todo processamento do material e, pela amizade.
A Universidade do Estado de Santa Catarina, pela oportunidade de realização do Mestrado junto ao curso de Pós-Graduação em Ciências Veterinárias.
A CAPES, pela concessão da bolsa.
Aos meus colegas de laboratório pelo companheirismo e amizade.
“Tente ser uma pessoa de valor,
não de sucesso.”
Albert Einstein
“O mérito vale mais que a fama.”
MORAES, Julio Cesar. Diagnóstico de Eimeria spp em frangos de corte na mesorregião sul do estado de Santa Catarina, por meio da Multiplex PCR. 2013. 111 f. Dissertação (Mestrado em Ciência Animal). Universidade do Estado de Santa Catarina. Programa de Pós-graduação em Ciência Animal, Lages, 2013.
MORAES, Julio Cesar. Diagnosis of Eimeria spp in broilers in the southern state of Santa Catarina, by Multiplex PCR. 2013. 111 f. Dissertation (MSc in Animal Science). Universidade do Estado de Santa Catarina. Programa de Pós-graduação em Ciência Animal, Lages, 2013.
Figura-1 Ciclo biológico do gênero Eimeria ... 22
Figura-2 Período pré-patente (PPP) e tempo mínimo para esporulação (TME) a 30°C, em horas e, medidas dos oocistos por espécie de Eimeria em micrometros ... 23
Figura-3 Oocistos de E. maxima (a), E. brunetti (b), E. tenella (c), E. necatrix (d), E. praecox (e), E. acervulina (f) e E. mitis (g) ... 40
Figura-4 Mapa de Santa Catarina com a divisão das cinco mesorregiões do Estado ... 56
Figura-5 Locais de coleta de amostras de fezes de frangos de corte na mesorregião Sul do Estado ... 57
Figura-6 “PrimersForward (F) e Reverse (R)”, utilizados na técnica
de Multiplex PCR para a detecção das sete espécies de Eimeria de frangos de corte e o tamanho dos amplicons gerados... 61
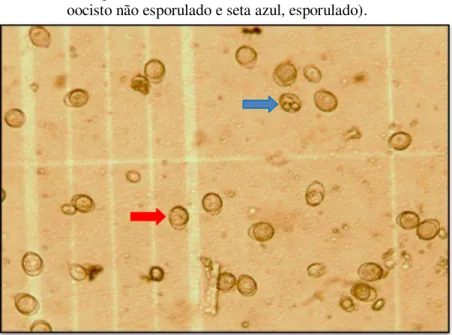
Figura-7 Oocistos não esporulado e esporulado, observados durante a contagem em câmara de Neubaeuer (seta vermelha indica oocisto não esporulado e seta azul, esporulado) ... 65
Figura-8 Oocistos com tamanhos e morfologias diferentes, observados durante a contagem em câmara de Neubaeuer (seta vermelha indica oocisto de menor tamanho e seta azul, de maior)... 66
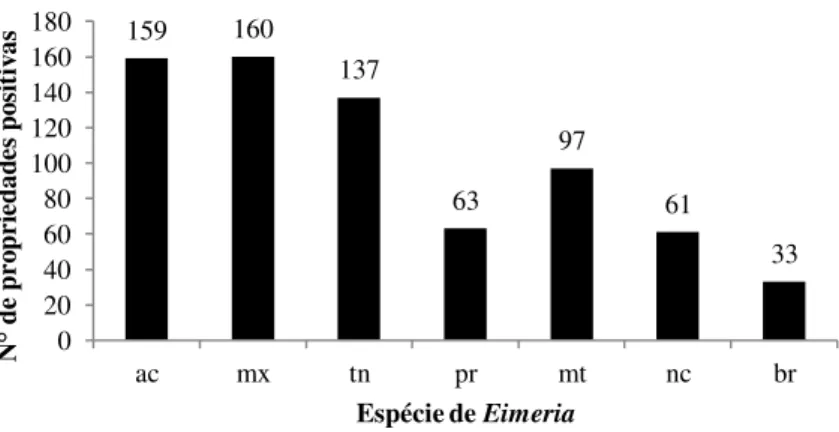
Figura-9 Número médio de oocistos por mL (+ Intervalo de confiança a 95%) em amostras de fezes de frangos de corte da mesorregião Sul de Santa Catarina, em três faixas etárias. Relacionado com o número de propriedades por faixa etária ... 66
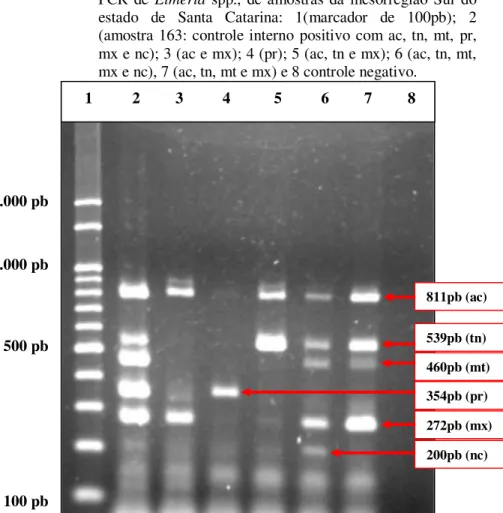
Figura-11 Eletroforese em gel de agarose dos produtos da Multiplex PCR de Eimeria spp., de amostras da mesorregião Sul do estado de Santa Catarina: 1(marcador de 100pb); 2 (amostra 163: controle interno positivo com ac, tn, mt, pr, mx e nc); 3 (ac e mx); 4 (pr); 5 (ac, tn e mx); 6 (ac, tn, mt, mx e nc), 7 (ac, tn, mt e mx) e 8 controle negativo ... 69
Figura-12 Eletroforese em gel de agarose dos produtos da Multiplex PCR de Eimeria spp., de amostras da mesorregião Sul do estado de Santa Catarina: 1(marcador de 100pb); 2 ( controle positivo - clones: ac, br, tn, mt, pr, mx e nc); 3 a 10 amostras negativas, 11 (br), 12 (ac, mt, pr e mx), 13 (tn, pr e mx) e 14 controle negativo ... 70
Figura-13 Eletroforese em gel de agarose dos produtos da Multiplex PCR de Eimeria spp.: 1 (marcador de 100 pb); 2 e 3 (clones dos SCAR de ac, br, tn, mt, pr, mx e nc) ... 71
Figura-14 Similaridade dos produtos do sequenciamento com as sequências dos marcadores SCAR das sete espécies de Eimeria depositados no “National Center for Biotechnology
Tabela-1 Comparação das médias de oocistos de Eimeria spp. por mL recuperados de fezes de frangos de corte em três intervalos de idades ... 67
Tabela-2 Espécies de Eimeria identificadas e numero de granjas amostradas, por município na mesorregião Sul do Estado ... 68
AFLP Amplified fragment length polymorphism. APGA Antígeno purificado de gametócito. BLAST Basic Local Alignment Search Tool.
°C Graus centígrados.
Ca++ Íon cálcio.
Cm Centímetros.
DH10 B Células de Escherichia coli cálcio-competentes. DNA Ácido desoxirribonucleico.
dNTP Deoxinucleotídeos trifosfatos.
DGGE Denaturing gradient-gel electrophoresis. DHFR-TS Diidrofolato redutase timidilato sintetase. EAMZ250 Antígeno de merozoítos de E. acervulina 250. EASZ240 Antígenos de esporozoítos E. acervulina 240. EDTA Ácido etilenodiamino tetra-acético.
FIGE Field inversion gel electrophoresis.
g Força da gravidade.
GPI Glucose phosphate isomerase. G6PD Glucose-6-phosphate dehydrogenase ITS Internal transcribed spacer.
IFNγ Interferon gama.
IL-2 Interleucina – 2.
IPTG Isopropyl β-D-1-thiogalactopyranoside.
K+ Íon potássio.
Kg Quilograma.
LB Meio de crescimento “Luria-Bertani”.
LDH Lactato de dehidrogenase.
Μ Molar ou molaridade (mol/l).
mM Milimolar
Mm Milímetros.
mL Mililitro.
m2 Métro quadrado
Mg++ Íon magnésio.
MgCl2 Cloreto de magnésio. PCR Polymerase chain reaction. PFGE Pulsed-field gel electrophoresis. PAGE Polyacrylamide gel electrophoresis.
PB Pares de base.
ng Nanograma.
Na+ Íon sódio.
NH4 Amônia.
SDS Dodecil sulfato de sódio.
SCAR Sequence-characterized amplified region. RAPD Random amplification of polymorphic DNA.
rDNA DNA ribossômico.
RFLP Restriction fragment length polymorphism. RNA Ácido ribonucleico.
RPM Rotações por minuto.
SOC Super optimal broth catabolic repressuion. Taq Thermus aquaticus.
TBE Tris-borato-EDTA.
T3SS Type 3 secretion system. T2SS Type 2 secretion system.
U Unidades.
V Volts.
µm Micrômetros
µg Micrograma
µL Microlitro.
6PGD Glucose-6-fosfato dehidrogenase.
1 INTRODUÇÃO ... 17
2 REVISÃO BIBLIOGRÁFICA... 20
2.1 GÊNERO Eimeria ... 20
2.1.1 Ciclo evolutivo ... 21
2.2 CARACTERÍSTICAS BIOLÓGICAS, MORFOLÓGICAS E ALTERAÇÕES CAUSADAS NO HOSPEDEIRO PELAS ESPÉCIES DE EIMERIAS QUE PARASITAM AVES DA ESPÉCIE Gallus gallus domesticus ... 21
2.2.1 Eimeria acervulina ... 21
2.2.2 Eimeria maxima ... 23
2.2.3 Eimeria tenella ... 23
2.2.4 Eimeria praecox ... 24
2.2.5 Eimeria mitis ... 24
2.2.6 Eimeria necatrix ... 25
2.2.7 Eimeria brunetti ... 25
2.3 CONTROLE DA COCCIDIOSE AVIÁRIA ... 25
2.3.1 Anticoccidianos ... 26
2.3.1.1 Resistência aos anticoccidianos ... 27
2.3.2 Vacinação ... 33
2.4 IDENTIFICAÇÃO DAS ESPÉCIES ... 38
2.4.1 Método de diagnóstico morfo-clínico ... 38
2.4.2 Diagnósticos bioquímicos e moleculares ... 41
2.4.2.1 Eletroforese de isoenzimas ... 41
2.4.2.2 Detecção de “Restriction Fragment Length Polymorphism RFLP” por hibridização “Southern Blot” ... 42
2.4.2.3 “Random Amplification of Polymorphic DNA – RAPD”. 43 2.4.2.4 Amplified Fragment Length Polymorphysm (AFLP)... 44
2.4.2.5 Polymerase Chain Reaction (PCR) ... 45
2.4.2.5.1 PCR utilizando o primeiro ou segundo “Internal Transcribed Spacer – ITS” do DNA ribossômico ... 46
2.4.2.6 Real-time PCR ... 49
2.4.2.7 Pirosequenciamento ... 51
3.1 OBJETIVO GERAL ... 55
3.2 OBJETIVO ESPECÍFICO ... 55
4 MATERIAL E MÉTODOS ... 56
4.1 CARACTERÍSTICAS DA REGIÃO ... 56
4.2 COLETA DAS AMOSTRAS DE FEZES DE FRANGOS DE CORTE ... 57
4.3 PROCESSAMENTO DAS AMOSTRAS DE FEZES DE FRANGOS DE CORTE ... 58
4.3.1 Purificação e quantificação dos oocistos de Eimeria spp. 58 4.3.1.2 Análise estatística das médias de oocistos recuperados das fezes de frangos de corte por intervalos de faixa etária ... 59
4.3.2 Limpeza dos oocistos ... 59
4.3.3 Purificação do DNA de oocistos de Eimeria spp. ... 59
4.3.3.1 Ruptura dos oocistos ... 60
4.3.3.2 Digestão com RNAse e Proteinase K ... 60
4.3.3.3 Extração com fenol-clorofórmio ... 60
4.3.3.4 Precipitação e lavagem do DNA ... 60
4.3.4 Multiplex PCR ... 61
4.3.5 Eletroforese ... 62
4.3.6 Clonagem dos marcadores de “Sequence-characterized Amplified Region – SCAR” de Eimeria spp. ... 62
4.3.7 Sequenciamento dos clones de Eimeria spp.... 64
5 RESULTADOS ... 65
5.1 CONTAGEM DOS OOCISTOS DE Eimeria spp. OBTIDOS DAS AMOSTRAS DE FEZES DE FRANGOS DE CORTE 65 5.2 IDENTIFICAÇÃO DAS ESPÉCIES DE Eimeria PELA PCR MULTIPLEX ... 67
8 CONCLUSÕES ... 83
9 CONSIDERAÇÕES FINAIS ... 84
REFERÊNCIAS ... 85
O Brasil produziu em 2012 aproximadamente 12.645.000 toneladas de carne de frango e exportou 3.508.000t. (UNITED STATES DEPARTMENT OF AGRICULTURE, 2013). Com esse quadro figura no cenário mundial como o primeiro País em exportação e terceiro em produção e consumo.
Santa Catarina é o segundo maior produtor, ficando atrás apenas do Paraná e primeiro em exportação no cenário Nacional (EMPRESA DE PESQUISA AGROPECUÁRIA E EXTENSÃO RURAL DE
SANTA CATARINA/CENTRO DE SOCIOECONOMIA E
PLANEJAMENTO AGRÍCOLA, 2012). Segundo a Associação de produtores de pintos de corte (APINCO) o alojamento brasileiro de frangos de corte, acumulado no período de janeiro a julho de 2012, foi de 3.516.529.964 cabeças, desses, 16,76% em Santa Catarina (AVICULTURA INDUSTRIAL, 2012). A mesorregião Sul do estado de Santa Catarina é a segunda maior mesorregião produtora de frangos de corte do Estado, ficando atrás apenas da mesorregião Oeste (INSTITUTO BRASILEIRO DE GEOGRAFIA E ESTATÍSTICA, 2013).
A coccidiose aviária é reconhecidamente a doença parasitária que causa o maior impacto econômico na produção de frangos em todo o mundo (ALLEN; FETTERER, 2002). Os custos globais com a eimeriose aviária chegam a U$ 3 bilhões (SHIRLEY et al., 2004). No Brasil, no ano de 1993 a perda foi estimada em 30 milhões de dólares (KAWAZOE, 2000) e dez anos depois essas perdas dobraram (BRITO, 2003).
Os protozoários do gênero Eimeria multiplicam-se nas células intestinais, destruindo o tecido, o que resulta em uma redução nos processos digestivos e absortivos, levando a uma perda produtiva (MCDOUGALD, 2003). O parasito possui um ciclo de vida homoxeno e curto, associado a um grande potencial reprodutivo (MORRIS; GASSER, 2006). A transmissão é facilitada pelo modelo industrial de criação de frangos de corte, realizado sob alta densidade (MCDOUGALD, 2003; SHIRLEY et al., 2007).
A forma mais difundida de controle dessa enfermidade é a utilização dos anticoccidianos, porém, o uso profilático dessas drogas tem propiciado o aparecimento de cepas de Eimeria spp. resistentes ao longo dos anos (ALLEN; FETTERER, 2002; CHAPMAN, 1997; MARTIN et al., 1997; MCDOUGALD, 2003; MCDOUGALD et al., 1986, 1987). Recentemente a proibição das drogas de uso contínuo na produção animal tem sido debatida, sob a alegação de que possam estar envolvidas no desenvolvimento da resistência em micro-organismos de importância para a saúde pública (JORNAL OFICIAL DA UNIÃO EUROPEIA, 2003; SHIRLEY et al., 2007).
Atualmente o controle com vacinas com oocistos vivos parece ser a melhor alternativa dentre as possibilidades de substituição dos anticoccidianos (CHAPMAN et al., 2002) e tem se tornado uma opção crescente (ALLEN; FETTERER, 2002; CHAPMAN et al., 2002; SHIRLEY et al., 2007). São compostas de oocistos vivos de Eimeria spp. do tipo selvagem ou atenuadas, e possuem formulações variadas com uma ou mais espécies (SHIRLEY; BEDRNÍK, 1997). As espécies do gênero Eimeria são altamente imunogênicas, sendo que a partir de uma infecção primária pode ser construída uma sólida imunidade para desafios homólogos, porém, não ocorre imunidade cruzada entre as sete espécies que acometem aves da espécie G. gallus domesticus (ALLEN; FETTERER, 2002; MCDOUGALD, 2003). Assim, a correta identificação das espécies e os estudos de ocorrência são importantes para uma adequada compreensão da epidemiologia e, para o controle, porque as espécies causam doenças diferentes, são imunologicamente distintas e podem responder de forma desigual a algumas das drogas anticoccidianas (JOYNER; LONG, 1974). A identificação das espécies circulantes e qual sua relevância, possibilita que autoridades governamentais, veterinários e produtores possam tomar decisões com relação à composição e o uso de vacinas vivas para o controle da coccidiose (MCDOUGALD et al., 1997), fundamentar a tomada de decisão de organismos responsáveis pelo registro de vacinas (CHAPMAN et al., 2005), diminuir o risco de introdução de espécies de Eimeria não desejáveis em um determinado local (ALLEN; FETTERER, 2002) e, alcançar a máxima eficácia da vacina (MORRIS et al., 2007).
patente em infecções experimentais. Para isto, depende de pessoal altamente treinado para que se evitem os erros de diagnóstico (LONG; JOYNER, 1984), consomem bastante tempo e exigem o uso de animais para experimentação (CONWAY; MCKENZIE, 2007; LONG; REID, 1982). Segundo Macpherson e Gajadhar (1993), a identificação das espécies do gênero Eimeria que parasitam galinhas não pode ser feita de forma segura utilizando-se apenas critérios de morfometria e as características estruturais dos oocistos. Segundo Joyner e Long (1974), na maioria das vezes, é necessária a análise de uma combinação de características.
As técnicas moleculares têm se destacado na identificação de Eimeira spp. (ALLEN; FETTERER, 2002; MORGAN et al, 2009). A primeira técnica utilizada foi a eletroforese de isoenzimas (SHIRLEY, 1975). Em seguida outras técnicas foram utilizadas, como por exemplo: Restriction fragment length polymorphism – RFLP (análise de polimorfismos de comprimento de fragmentos de restrição), Southern Blot (transferência de Southern), Pulsed-field gel electrophoresis – PFGE (eletroforese em gel de campo pulsado), Field inversion gel electrophoresis – FIGE (eletroforese em gel de campo de inversão), Amplified fragment length polymorphism – AFLP (polimorfismo do comprimento do fragmento amplificado), Random amplification of polymorphic DNA – RAPD (amplificação aleatória do DNA polimórfico), Sequence-characterized amplified region – SCAR (amplificação de regiões de sequência caracterizada) e Polymerase chain reaction – PCR (reação em cadeia da polimerase) (MORRIS; GASSER, 2006).
Fernandez et. al., (2003a), desenvolveram uma Multiplex PCR,
baseado em SCAR’s, obtidos a partir da técnica de RAPD e padronizaram a utilização desses “primers” de modo a permitir a execução de um diagnóstico simultâneo das sete espécies de Eimeria em uma reação.
2 REVISÃO BIBLIOGRÁFICA
2.1 GÊNERO Eimeria
O gênero Eimeria pertence ao filo Apicomplexa; classe Sporozoea; subclasse Coccidia; ordem Eucoccidiorida; subordem Eimeriorina; família Eimeriidae (KAWAZOE, 2000).
A primeira descrição desse protozoário ocorreu na Itália em 1873 por Rivolta e Silvestrini que relataram a presença de um parasito no ceco de aves, o denominaram de Gregarina avium intestinalis e afirmaram que os oocistos deste parasito, após liberados com as fezes, passavam por um processo (esporulação) que alterava suas características morfológicas (CHAPMAN, 2003). Em 1875, Schneider descreveu o gênero Eimeria com o propósito de abrigar um parasito encontrado no intestino de camundongos (COSTA; PAIVA, 2009). Raillet e Lucet, em 1891 descreveram uma nova espécie denominada por eles de Coccidium tenellum, a identificação foi baseada nas medidas dos oocistos recuperados do ceco de galinhas (CHAPMAN, 2003; COSTA; PAIVA, 2009). Em 1909, o Coccidium tenellum foi redenominado E. tenella por Fantham (KAWAZOE, 2000), que em 1910 descreveu detalhadamente o ciclo de vida de um parasito de aves do gênero Eimeria (CHAPMAN, 2003). Apesar de renomeada a espécie, a denominação Coccidium tenellum foi amplamente utilizada,
E. mivati, pois, segundo esse autor, as técnicas demonstraram tratar-se de uma amostra mista, composta de E. mitis e E. acervulina (KAWAZOE, 2000).
2.1.1 Ciclo evolutivo
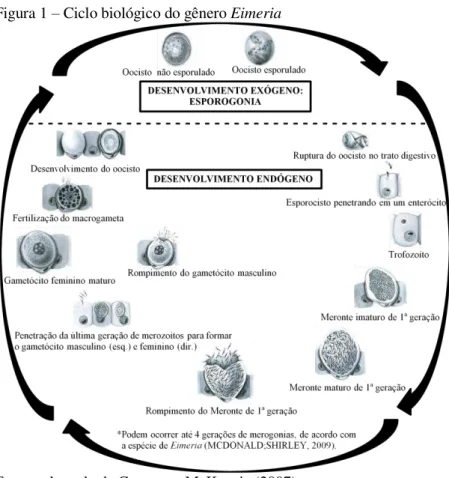
O ciclo evolutivo das espécies do gênero Eimeria que parasitam galinhas é complexo, passando por várias etapas (Figura 1). Inicia com a ingestão do oocisto esporulado, forma infecciosa do parasito que contém quatro esporocistos, cada um com dois esporozoítos. O oocisito e esporocistos são rompidos, liberando no trato intestinal os esporozoítos, que penetram nos enterócitos, sendo que cada espécie tem predileção por um determinado local no intestino das aves. O esporozoíto, depois de penetrar na célula intestinal, inicia a fase de reprodução assexuada ou merogonia dando origem a um grande número de novas formas conhecidas por merozoítos (CONWAY; MCKENZIE, 2007). Segundo McDonald e Shirley (2009), dependendo da espécie e/ou cepa ocorrem de três a quatro merogonias. A última geração de merozoítos diferencia-se em macrogamontes e microgamontes que originam os gametas femininos e masculinos, respectivamente, e esses se unem para formar o zigoto e em seguida o oocisto, que é excretado junto com as fezes (KAWAZOE, 2000). “Cada evento de fertilização pode envolver gametas da mesma população parental (autofertilização) ou gametas de populações geneticamente diferentes (fecundação cruzada).”
(SHIRLEY; HARVEY, 2000). No ambiente ocorre a esporogonia, que é uma forma de reprodução assexuada, e inicia-se com uma meiose seguida de duas mitoses, gerando um oocisto esporulado (FORTES, 2004).
2.2 CARACTERÍSTICAS BIOLÓGICAS, MORFOLÓGICAS E
ALTERAÇÕES CAUSADAS NO HOSPEDEIRO PELAS ESPÉCIES DE Eimerias QUE PARASITAM AVES DA ESPÉCIE Gallus gallus domesticus.
2.2.1 Eimeria acervulina
compostas de esquizontes, gametócitos e oocistos (MCDOUGALD, 2003). Segundo Conway e McKenzie (2007), em esfregaços do local das lesões são visualizados gametócitos e oocistos não esporulados. Bordin (1999) citou que essa espécie localiza-se superficialmente no epitélio da mucosa intestinal, sobre as vilosidades. Kawazoe (2000) citou que essa espécie geralmente não causa mortalidade, porém, causa uma profunda depressão no ganho de peso e aumento na taxa de conversão alimentar das aves acometidas. Os oocistos dessa espécie são ovóides. Segundo Long e Reid (1982) o período pré-patente, o tempo mínimo de esporulação, a forma e as medidas dos oocistos variam entre as espécies de Eimeria (Figura 2).
Figura 1 – Ciclo biológico do gênero Eimeria
2.2.2 Eimeria maxima
Localiza-se na região média do intestino delgado (jejuno e íleo), próximo ao divertículo do saco da gema, mas em infecções severas pode ser ascendente, alcançando o duodeno e/ou descendente até a junção ileocecal (CONWAY; MCKENZIE, 2007). Causa lesões hemorrágicas associadas a um espessamento da mucosa intestinal, petéquias podem ser vistas na serosa e o intestino pode apresentar uma dilatação na região
afetada, chamada de “balonamento”, estando repleto de conteúdo
mucoso de coloração amarela ou laranja, podendo conter sangue. É responsável pela perda de peso, aumento na taxa de conversão alimentar e despigmentação das aves acometidas (CONWAY; MCKENZIE, 2007; MCDOUGALD, 2003). Nessa espécie o maior dano tecidual ocorre na fase de reprodução sexual, pois, possui grandes macrogametócitos de localização subepitelial (MCDOUGALD, 2003). Pode causar mortalidade de até 20% (SCHNITZLER; SHIRLEY, 1999). Os oocistos de E.maxima são ovóides de coloração característica, marrom dourada e, com superfície irregular, são os maiores oocistos dentre as espécies de Eimeria que parasitam aves da espécie G. gallus domesticus (LONG; REID, 1982).
Figura 2 – Período pré-patente (PPP) e tempo mínimo para esporulação (TME) a 30°C, em horas e, medidas dos oocistos por espécie de Eimeria em micrometros.
ESPÉCIE PPP (h) TME (h) MEDIDAS (μm) E. acervulina 97 17 17,7 a 20,2 X 13,7 a 16,3
E. maxima 121 30 21,5 a 42,5 X 16,5 a 29,8 E. tenella 115 18 19,5 a 26,0 X 16,5 a 22,8 E. mitis 93 15 11,7 a 18,7 X 11,0 a 18,0 E. praecox 83 12 19,8 a 24,7 X 15,7 a 19,8 E. necatrix 138 18 13,2 a 22,7 X 11,3 a 18,3 E. brunetti 120 18 20,7 a 30,3 X 18,1 a 24,2 Fonte: adaptado de Long e Reid (1982).
2.2.3 Eimeria tenella
ciclo (assexuado e sexuado) ocorre nos cecos causando uma tiflíte. Os esquizontes desenvolvem-se na lâmina própria do intestino e os maiores danos são causados durante a reprodução assexuada, pela segunda geração de grandes esquizontes contendo centenas de merozoítos (BORDIN, 1999; MCDOUGALD, 2003). O mecanismo que causa a morte das aves não está completamente elucidado. Segundo Kawazoe (2000), acredita-se que o parasito interfere no mecanismo de coagulação sanguínea devido a falhas no metabolismo da vitamina K, agravando o quadro hemorrágico. Porém, a hemorragia por si só não é responsável pela morte, provavelmente ocorre interação de fatores tóxicos e bacterianos durante a infecção (MCDOUGALD, 2003). Os oocistos de E.tenella são ovóides (LONG; REID, 1982).
2.2.4 Eimeria praecox
Desenvolve-se no terço superior do intestino delgado, principalmente na alça duodenal, possui localização epitelial. O conteúdo intestinal pode apresentar-se aquoso, com presença de muco, e algumas vezes, petéquias podem ser visualizadas na mucosa. Essa espécie pode causar uma diminuição no ganho de peso e aumento na taxa de conversão alimentar nas aves (MCDOUGALD, 2003). Os oocistos são ovóides (LONG; REID, 1982).
2.2.5 Eimeria mitis
Seu desenvolvimento ocorre no intestino delgado desde o divertículo do saco da gema até a junção ileocecal, não formam colônias e localizam-se superficialmente no epitélio da mucosa do intestino delgado. Desta forma causam poucas alterações visíveis como, intestino pálido e flácido (MCDOUGALD, 2003) e com espesso exsudato (LONG; REID, 1982). Pode causar queda de peso, palidez das aves e piora na conversão alimentar (LONG; REID, 1982; MCDOUGALD, 2003). Essa espécie apresenta oocistos subesféricos que são menores entre as Eimerias spp. que parasitam frangos (LONG; REID, 1982).
2.2.6 Eimeria necatrix
Essa espécie desenvolve-se inicialmente no intestino delgado (jejuno e íleo, próximo ao divertículo do saco da gema), onde ocorrem as merogonias (reprodução assexuada), e em seguida, a terceira geração de esquizontes migra para o ceco onde acontece a reprodução sexuada e a formação dos oocistos. As lesões que ocorrem no intestino delgado são causadas principalmente pela segunda geração de esquizontes, de localização subepitelial, que alcançam a camada muscular e os vasos sanguíneos, causando um dano extenso no tecido. Podem ser visualizadas alterações como uma acentuada dilatação ou
“balonamento”, com um aumento de até duas vezes o tamanho normal do intestino na região afetada. Na serosa se observam placas brancas formadas pela aglomeração de esquizontes e petéquias, o interior do intestino pode estar repleto de sangue, fluídos e muco. É altamente patogênica e causa alta morbidade e mortalidade, queda no ganho de peso e aumento na taxa de conversão alimentar. Porém, é pouco prolífera e, devido à competição com outras espécies, é responsável por surtos tardios, acometendo principalmente, aves de vida longa ao redor de 9 a 14 semanas de idade, como por exemplo, reprodutoras, sendo rara a ocorrência de quadros clínicos em frangos devido ao curto ciclo dessas aves (MCDOUGALD, 2003). Os oocistos de E. necatrix são ovóides oblongos (LONG; REID, 1982).
2.2.7 Eimeria brunetti
Essa espécie geralmente desenvolve-se na porção inferior do intestino delgado, entre o divertículo do saco da gema e a junção ileocecal, podendo se estender por todo o intestino delgado e grosso em infecções massivas, a localização da segunda geração de esquizontes é subepitelial. É considerada uma espécie altamente patogênica, causa lesões que variam desde um engrossamento da mucosa com a presença de petéquias, em infecções leves, até uma necrose e descamação do epitélio com a formação de uma membrana diftérica cobrindo a superfície intestinal (BORDIN, 1999; MCDOUGALD, 2003). Pode causar mortalidade, diminuição no ganho de peso e aumento na taxa de conversão alimentar (MCDOUGALD, 2003). E. brunetti possui oocistos ovoides (LONG; REID, 1982).
2.3.1 Anticoccidianos
No passado a quimioterapia com a finalidade de controlar a coccidiose nas produções avícolas era feita apenas de forma curativa. Atualmente, quase que a totalidade dos lotes de frangos recebe uma medicação preventiva, enquanto que os tratamentos ficaram relegados a um último recurso (MCDOUGALD, 2003).
Segundo Ferreira e Revolledo (2005) há relatos de que a primeira substância empregada para o tratamento da coccidiose, por volta de 1935, foi o enxofre. Na década seguinte foram introduzidas as sulfonamidas e a nicarbazina, e na década de 1970 a monensina. A nicarbazina e a monensina continuam sendo muito utilizadas.
Os anticoccidianos são classificados em dois grupos: os sintéticos e os ionóforos de poliéter. Esses últimos são produzidos a partir da fermentação de micélios, principalmente do gênero Streptomyces (BUTAYE et al., 2003) e são considerados drogas mais eficientes no controle da eimeriose, pois, devido ao seu intrincado modo de ação, são menos susceptíveis ao desenvolvimento da resistência pelas espécies de Eimeria (CHAPMAN, 1997; KAWAZOE, 2000). Formam complexos com íons, facilitando a entrada de Na+ e a grande quantidade desse íon no meio intracelular provoca um aumento de líquido no interior da célula do parasito, causando a parada da função mitocondrial e posteriormente a ruptura da membrana celular (CHAPMAN, 1997; CHAPMAM et al., 2010; DANFORTH; RUFF, 1999; FERREIRA; REVOLLEDO, 2005; MCDOUGALD, 2003). Segundo Danforth e Ruff (1999), o grupo dos ionóforos permanece sendo o esteio principal no controle da coccidiose.
Os anticoccidianos sintéticos possuem um mecanismo de ação mais simples, que os tornam mais susceptíveis ao desenvolvimento de resistência pelos parasitos (KAWAZOE, 2000). As sulfonamidas são análogas e competidoras do ácido p-aminobenzóico (PABA) que é essencial para o metabolismo do ácido fólico, rota importante para a síntese de RNA e DNA do parasito (CHAPMAM, 1997; FERREIRA; REVOLLEDO, 2005; MCDOUGALD, 2003). Agem impedindo a redução do diidrofolato para tetraidrofolato pela enzima diidrofolato redutase timidilato sintetase (DHFR-TS) (CHAPMAM, 1997).
O amprólio é um antagonista da tiamina, impede a absorção desse aminoácido inibindo, com isso, a síntese do ácido fólico (FERREIRA; REVOLLEDO, 2005; MCDOUGALD, 2003).
decoquinato, clopidol, robenidina e, apesar do mecanismo de ação da nicarbazina não estar completamente elucidado acredita-se que, esta também atue na mitocôndria (DANFORTH; RUFF, 1999; CHAPMAM, 1997). Supõe-se que a robenidina impeça a fosforilação oxidativa (CHAPMAM, 1997; FERREIRA; REVOLLEDO, 2005). O decoquinato atua bloqueando o transporte de elétrons próximo ao citocromo b na mitocôndria do parasito, e o clopidol possui o mesmo mecanismo, mas em um local diferente da mitocôndria, impossibilitando a resistência cruzada entre estas drogas (CHAPMAM, 1997). Anticoccidianos mais recentes como o diclazuril e o toltrazuril atuam na cadeia respiratória do parasito (FERREIRA; REVOLLEDO, 2005).
2.3.1.1 Resistência aos anticoccidianos
O desenvolvimento da resistência pelo parasito pode ser definido como um decréscimo da sensibilidade a uma droga ao longo do tempo e pode ser parcial ou completa (CHAPMAN, 1997). A ampla utilização dos anticoccidanos para o controle da eimeriose aviária permite a exposição frequente de populações de Eimeria spp. a uma determinada classe de drogas, podendo induzir à resistência (CHAPMAN, 1997; DANFORTH; RUFF, 1999; MCDOUGALD, 2003; ZHANG et al., 2013). McDougald (2003) citou que a resistência às drogas é um fenômeno genético, e quando estabelecido em uma população de Eimeria spp., pode permanecer por muitos anos. Porém, segundo Champan (1997) há relatos de reversão da resistência em populações de parasitos para uma determinada droga, após um período administrando uma droga não relacionada.
relatou que a resistência severa a maduramicina estava associada a uma maior dose fornecida da droga. O complexo modo de ação dos ionóforos torna o processo de resistência mais difícil e, portanto, mais demorado para acontecer, mesmo assim, essa classe de anticoccidianos tem-se demonstrado vulnerável (CHAPMAN, 1997; CHAPMAM et al., 2010; KAWAZOE, 2000).
O processo de disseminação da resistência em populações de Eimeria spp. se da por meio de seleções, as populações que sobrevivem a utilização de um determinado anticoccidiano, sofrem uma pressão de seleção e podem desenvolver resistência a droga, que é uma característica estável, podendo ser transmitida para as próximas gerações e permanecendo por vários anos em uma população de Eimeria spp., mesmo que a população siga sem a pressão daquela droga (CHAPMAN, 1997; MCDOUGALD, 2003). A maioria das drogas atua na fase de reprodução assexuada, quando o parasito é haploide (esporozoítos, esquizontes e merozoítos). Estes compostos podem eliminar facilmente da população os indivíduos sensíveis à droga, e em consequência permitir a multiplicação de indivíduos mais resistentes, durante a reprodução assexuada. A difusão dessa característica ocorre na fase de reprodução sexuada, com os cruzamentos das características de resistência a uma ou múltiplas drogas, gerando novas populações com fenótipos de resistência para um ou vários anticoccidianos (CHAPMAN, 1997; DANFORTH; RUFF, 1999). A resistência também pode ocorrer de forma cruzada, acontece quando uma cepa portadora de um fenótipo de resistência a uma droga pode ser totalmente ou parcialmente resistente a outro anticoccidiano que possua o mesmo ou semelhante mecanismo de ação. Acredita-se que a resistência cruzada possa ocorrer entre o grupo dos ionóforos, mas isso não foi devidamente comprovado e, entre diclazuril e toltrazuril, indicando que exibem o mesmo modo de ação (CHAPMAN, 1997). A velocidade com que ocorre o estabelecimento da resistência a um anticoccidiano está relacionada com o modo de ação da droga, quanto mais simples, mais rápida é a instauração da resistência (MCDOUGALD, 2003). Segundo Ferreira e Revolledo (2005) de acordo a velocidade de aparecimento da resistência, os anticoccidianos podem ser classificados como: muito rápido (glicosaminas); rápido (buquinolato, decoquinato e diclazuril); menos rápido (clopidol); moderado (sulfonamida e robenidina); lento (amprolium, zoalene e nitrobenzamidas) e muito lento (nicarbazina e ionóforos).
substâncias, como por exemplo, a rotação de drogas, que consiste em se utilizar um anticoccidiano por alguns ciclos de criação e posteriormente substituí-lo. Outra forma de uso dos anticoccidianos são os programas duais, onde se utiliza um determinado anticoccidiano na fase inicial e de crescimento do frango (01-21 dias), que é substituído por outro na fase de terminação (22-42 dias) (KAWAZOE, 2000).
frequente entre as cepas de E. maxima, 38% e 50% de resistência total ou parcial ao diclazuril e monensina, respectivamente e, cepas de E. tenella, 23% e 38% de resistência total ou parcial ao diclazuril e monensina, respectivamente. Na comparação estatística dos resultados obtidos com cepas provenientes de granjas que utilizavam um programa de controle baseado em anticoccidianos com aquelas de granjas que utilizavam a vacinação houve diferença significativa. Foram encontrados os seguintes percentuais de cepas que apresentavam sensibilidade total ao diclazuril em lotes que utilizavam vacinas (VAC), comparado com lotes que utilizavam anticoccidianos (ANT): E. acervulina (50% VAC e 9% ANT), E. maxima (89% VAC e 14% ANT), E. tenella (100% VAC e 20% ANT) e, sensíveis a monensina: E. acervulina (50% VAC e 0% ANT), E. maxima (55% VAC e 14% ANT), E. tenella (50% VAC e 20% ANT). Jenkins et al. (2010), a partir de testes de sensibilidade a drogas, comparando o ganho de peso e a conversão alimentar, concluíram que os oocistos de Eimeria spp. obtidos de operações que utilizavam vacinas exibiram maior sensibilidade a salinomicina em comparação com oocistos de granjas que utilizavam anticoccidianos. O ganho de peso em frangos medicados com salinomicina e infectados com oocistos provenientes de granjas que utilizavam anticoccidianos foi 3% maior em relação ao controle desafiado não medicado, enquanto que nos frangos desafiados com oocistos provenientes de granjas que utilizavam Coccivac B ou Inovocox, o controle com a salinomicina promoveu um maior ganho de peso, 25% e 33%, respectivamente, em relação ao controle desafiado não medicado. Também foi observada uma melhoria, estatisticamente significativa, na taxa de conversão alimentar de frangos de corte utilizando salinomicina e desafiados com oocistos obtidos durante o uso de Coccivac B ou Inovocox, que não ocorreu em frangos utilizando salinomicina e infectados com oocistos obtidos de operações durante o uso de anticoccidianos. Long et al. (1976) tem sugerido que as cepas de parasitas sensíveis as drogas tendem a dominar na ausência de medicação, as cepas resistentes, possivelmente devido a uma vantagem reprodutiva.
lesão, taxa de excreção de oocistos. Como resultado, observaram que isolados expostos a 2 – 5 mg/kg maduramicina desenvolveram resistência leve, a 5 mg/kg resistência severa e, isolados de granjas em que não se utilizaram maduramicina eram sensíveis, sugerindo que a aquisição de resistência está relacionada a dose de anticoccidiano utilizada. Arabkhazaeli et al. (2013) avaliaram a resistência a anticoccidianos em três isolados de campo de Eimeria spp. Foram registrados dados como, o ganho de peso, consumo de ração, escore de lesão, Oopg, mortalidade e conversão alimentar e, utilizados três índices para avaliar a eficácia: Atividade anticoccidiana ótima (AAO), onde são utilizados os parâmetros como as taxa de crescimento e sobrevivência; TSA, calculada com base na redução do escore médio de lesão e; o IG que utiliza para a avaliação o ganho de peso, a conversão alimentar, Oopg, o escore de lesão e a mortalidade. Segundo os autores, tanto a IG e AAO deram resultados semelhantes e, mesmo sendo o primeiro teste mais preciso, porém, considerando a facilidade de pesagem das aves, em comparação com a avaliação do escore de lesão e Oopg, também, porque o peso é o principal fator de rentabilidade na indústria, concluíram que pode ser aconselhável propor a utilização do AAO como um índice único, para avaliação da resistência a fármacos de modo que as pesquisas com base em um método comum possam ser comparadas. Quanto à resistência, foi relatada resistência total ao amprolio + etopabato, resistência parcial a salinomicina e; resistência parcial a total para o diclazuril. A última droga disponibilizada para uso foi o diclazuril em 1990 e o primeiro relato de cepas resistentes para essa droga ocorreu no Brasil em 1994 (CHAPMAN, 1997). Chapman (1997) citou que um dos motivos da escassez de novos produtos é o fato de que o método tradicional para o desenvolvimento de novas drogas é um processo difícil, executado a partir de testes aleatórios com vários compostos. Danfort e Ruff (1999) citaram que o alto custo para o desenvolvimento de novos anticoccidianos tem desestimulado muitas empresas farmacêuticas a desenvolverem novos compostos. Williams (1998) citou que o investimento para o desenvolvimento de uma nova molécula varia de 50 a 100 milhões de dólares.
2.3.2 Vacinação
Lillehoj (1999) e Kawazoe, (2000) citaram que frangos infectados com Eimeria produzem anticorpos parasito-específicos, por meio de linfócitos B ativados (células T dependentes). Essas imunoglobulinas estão presentes na circulação e nas secreções mucosas, e atuam somente na fase extracelular do parasito. Lillehoj (2005) e, McDonald e Shirley (2009) citaram que foi constatado o carater secundário da imunidade humoral em aves imunes, que após bursectomizadas, permaneceram resistentes as infecções.
Segundo Lillehoj (1999) o controle da coccidiose é desempenhado, principalmente, pela imunidade celular, tanto por mecanismos de citotoxidade, desencadeados pelos linfócitos T nas células parasitadas, como pela produção de citoquinas como o interferon
gama (IFNγ). A importância da imunidade celular foi comprovada em experimentos com o fornecimento, para aves imunes contra Eimeria spp., de drogas que causam imunodepressão, como ciclosporina, betametasona e dexametasona e, por meio de timectomia. Ambos os tratamentos tornaram essas aves susceptíveis as infecções com Eimeria spp.
As vacinas contendo oocistos vivos permanecem sendo a única alternativa prática para a substituição dos anticoccidianos no controle da coccidiose em criações industriais de frangos de corte, conforme relataram Chapman et al. (2002) e Williams (1998). Existem dois grupos de vacinas, contendo parasitos vivos do tipo selvagem ou atenuados, ambas com formulações variadas, contendo uma ou mais espécies de Eimeria que parasitam galinhas (SHIRLEY; BEDRNIK, 1997).
A vacinação com oocistos vivos requer um eficiente e prático sistema de distribuição das doses de oocistos aos frangos, para uma exposição sincronizada de todas as aves de um lote a um pequeno e uniforme número de parasitos (DANFORTH, 1998). As vacinas são aplicadas via spray em incubatório ou via água de bebida, ração ou gel comestível na granja. Atualmente tem sido introduzida a vacinação “in ovo”, executada no 18° dia de incubação.
Segundo Chapman et al. (2002) espécies menos patogênicas presentes no ambiente, mas que não estejam inclusas na vacina, podem afetar o desempenho do lote, e terem sua incidência aumentada, resultado da seleção imunológica.
desafios homólogos, protegeu apenas 3% e 47% contra isolados de Maryland e Flórida (Estados Unidos), respectivamente. A vacina foi reformulada, com a adição das duas cepas de E. maxima e, dessa forma foi capaz de conferir proteção aos desafios de campo.
McDonald e Shirley (2009) citaram que com o propósito de ampliar o espectro de proteção algumas vacinas, têm incluído em sua formulação duas cepas de E. maxima com propriedades imunogênicas distintas e, para o controle mais eficiente de variantes regionais, têm surgido alternativas de vacinas formuladas com cepas autóctones como, por exemplo, na Austrália e China (MCDONALD; SHIRLEY, 2009).
Segundo Danforth (1998) antes da utilização de uma vacina o ideal e que se faça um estudo de proteção contra as cepas locais (DANFORTH, 1998). Chapman et al. (2002) relataram que uma vantagem é que as vacinas podem ser moldadas às necessidades regionais, apenas com a inclusão de cepas autóctones e, isso a um baixo custo, diferente do processo de desenvolvimento de uma nova droga.
Chapman et al. (2002) e Williams (1998) citaram que a rotação de programas utilizando vacinas e anticoccidianos podem trazer benefícios como: repovoação do campo com cepas sensíveis a anticoccidianos, transferência dessa característica para as cepas locais, sendo que essa medida pode auxiliar a estender a vida útil dos anticoccidianos. Também, a precocidade das cepas vacinais que as tornam menos patogênicas é uma característica herdável.
Entretanto, a utilização de vacinas compostas de oocistos vivos não tem sido muito aceita para o uso em frangos de corte, sob a alegação de que poderiam piorar o desempenho zootécnico (DANFORTH, 1998), portanto, novas alternativas têm sido pesquisadas, como por exemplo, vacinas de subunidades, tecnologias baseadas em DNA e vacinas vivas recombinantes vetoriadas.
Xu et al. (2008) utilizaram um método para imunização de frangos contra E. tenella a partir de um DNA quimérico, clonado para codificar os genes que expressam o antígeno TA4 de E. tenella e a citoquina interleucina - 2 (IL-2) de frangos. A partir de testes controlados foram encontrado os seguintes resultados: o grupo controle desafiado exibiu uma redução no ganho de peso (68,1%) quando comparado com o grupo controle não desafiado e, essa diferença foi estatisticamente significativa. Já, imunização com o TA4, DNA-TA4-IL-2 e DNA-IL-2, obtiveram 90,4%; 97,3% e 93,7% de ganho de peso relativo (em comparação com o grupo controle não desafiado), respectivamente. Frangos imunizados com DNA-TA4-IL-2 obtiveram um ganho de peso maior e, houve diferença estatisticamente significativa com os tratamentos DNA-TA4 e DNA-IL-2. A imunização com o DNA-TA4-IL-2 resultou em uma maior queda na taxa de excreção de oocistos (75,1%) quando comparado com o grupo controle desafiado e, com os outros dois grupos (DNA-TA4 = 68,7% e DNA-IL-2 = 66%). Também, foi observada uma diminuição no escore de lesão em aves imunizadas (TA4 = 0,6; TA4-IL-2 = 0,4 e DNA-IL-2 = 1,6), quando comparado com o controle não imunizado e desafiado (3,5) e, essa diferença foi estatisticamente significativa. Em frangos imunizados com DNA-TA4-IL-2, também houve uma diferença estatisticamente significativa no escore de lesões, quando comparado com os outros grupos vacinados. O Índice Anticoccidial encontrado para cada grupo foi: DNA-TA4 = 183, DNA-TA4-IL-2 = 192, DNA-IL-2 = 176, grupo controle não imunizado e não desafiado = 200 e grupo controle não imunizado e desafiado = 123.
deprimido como ocorreu no grupo controle desafiado. Já, os frangos imunizados com o VRSA expressando o antígeno de merozoíto EAMZ250 obtiveram um aumento no ganho de peso (147g) e menor escore de lesão (1,5) quando comparado com o controle não imunizado e desafiado, sendo que, houve diferença estatisticamente significativa entre esses grupos, porém, para o ganho de peso entre o grupo imunizado com o EAMZ250 e desafiado e, o não imunizado não desafiado, não houve diferença estatisticamente significativa. A coadministração dos VRSA expressando ambos os antígenos, não promoveu nenhum efeito aditivo em relação ao VRSA expressando somente o EAMZ250. Konjufca et al. (2008) em outro estudo utilizaram o T3SS e o T2SS da S. enterica Sorovar Typhimurium para expressar e entregar os antígenos SO7 de E. tenella e EAMZ250 de E. acervulina. O menor ganho de peso foi observado em um grupo controle imunizado com o VRSA não expressando antígenos, e desafiados com E. acervulina (127g) ou E. tenella (92g). Os frangos imunizados com o VRSA expressando os antígenos EAMZ250 e SO7 via T3SS e, desafiados com E. acervulina, obtiveram um maior ganho de peso (140g) que o controle imunizado com o VRSA não expressando antígenos e desafiado com E. acervulina, sendo que, houve uma diferença estatisticamente significativa entre estes grupos. Também, o ganho de peso para o VRSA expressando ambos os antígenos foi maior que nos outros grupos imunizados com VRSA expressando apenas um dos antígenos e, similar ao ganho de peso (141g) do controle não desafiado, indicando que houve uma proteção significativa contra desafios. Segundo os autores esses resultados sugerem que a indução de resposta imune mediada por células a múltiplos antígenos (EAMZ250 e SO7) conduziu a uma proteção superior contra E. acervulina. Em um segundo estudo de desafio para verificar a proteção contra E. tenella, todos os grupos foram imunizados com o VRSA expressando o antígeno SO7. Os animais imunizados e desafiados com E. tenella obtiveram um maior ganho de peso que o controle imunizado com o VRSA não expressando antígenos e desafiado e, verificou-se uma diferença estatisticamente significativa. Segundo os autores a imunização com o VRSA que entregou o antígeno SO7 via o T2SS pareceu conferir uma maior proteção, pois esse grupo obteve o maior ganho de peso (124g) e, não houve diferença estatisticamente significativa com a taxa de conversão alimentar desse grupo com o grupo controle e não desafiado.
invasão da célula hospedeira. A organela conhecida como micronema é responsável pela adesão e reconhecimento da célula hospedeira (KAWAZOE, 2000). Aplicado por via subcutânea, o Pox vírus recombinante, induziu uma resposta imune humoral e estimulou a proliferação de linfócitos no sangue periférico. Foi elaborado um experimento para testar diferentes diluições do rPVA-rombóide, conforme segue: G1 (102 PFU), G2 (104 PFU) e G3 (106 PFU). Duas semanas depois, as aves foram desafiadas com E. tenella e, foi observada uma diminuição do número de oocistos excretados pelos frangos imunizados com o rPVA-rombóide, G1 (6,12x107), G2 (5,94x107) e G3 (5,91x107), quando comparada com o grupo controle não imunizado e desafiado (10,13x107), essa diferença foi estatisticamente significativa. No grupo controle foi observado um escore médio de lesão de 3,9, enquanto que nos grupos G1, G2 e G3 os escores médios de lesão foram de 1,73, 1,49 e 1,40, respectivamente, sendo que, entre os dois últimos não houve diferença estatisticamente significativa. O ganho de peso dos grupos vacinados (G1 = 65g, 2 = 68,3g e 3 = 68,9g) foi significativamente maior que o controle (50g). Os autores concluíram que as eficácias para as diferente diluições do rPVA-rombóide foram: G1 = 39,6%, G2 = 41,1% e 3 = 41,7%.
McDonald e Shirley (2009) citaram que uma das dificuldades para o desenvolvimento dessas vacinas está em identificar antígenos protetores e diferenciá-los de moléculas apenas imunogênicas e, que estudos têm demonstrado que somente a inclusão de antígenos referentes a cada uma das sete espécies de Eimeria talvez não seja suficiente, pois, verificou-se a existência de uma variação na composição antigênica do primeiro e segundo estágios de merogonias em E. tenella. Lillehoj (2005) citou que outro desafio reside em como veicular esses antígenos de forma a mimetizar os estímulos causados pelo parasito, durante o seu ciclo no hospedeiro. Shirley et al. (2007) citaram que a elaboração de uma vacina que não necessite da passagem do parasito vivo pelo hospedeiro, ainda está longe de se tornar uma realidade.
2.4 IDENTIFICAÇÃO DAS ESPÉCIES
2.4.1 Método de diagnóstico morfo-clínico
macroscópicas das lesões muitas vezes fornecem um indicativo da espécie envolvida (LONG e JOYNER, 1984). As sobreposições de características para a identificação das espécies, muitas vezes inviabiliza a sua utilização de forma isolada (KUČERA, 1990). Assim, o diagnóstico morfo-clínico torna-se laborioso, demorado e oneroso, pois exige o uso de animais para experimentação (CONWAY; MCKENZIE, 2007; LONG; REID, 1982) e de técnicos que possuam ampla experiência para que se evitem os erros de diagnóstico (LONG; JOYNER 1984).
Segundo Long e Joyner (1984) a crença de que o ciclo de vida das espécies de Eimeria seguia um padrão quase imutável foi abandonada após vários estudos provarem que características como a morfologia, localização e tempo para a geração dos esquizontes podem ser modificados pela seleção de populações de Eimeria spp. Long (1972) descreveu uma variação nos estágios endógenos de desenvolvimento quando comparou uma amostra de E. tenella adaptada para passagem em embriões de pinto, que difere da E. tenella não adaptada, por possuir esquizontes de segunda geração aproximadamente um quinto menor. Este fato restringe seu desenvolvimento no epitélio, não mais alcançando a lâmina própria do ceco, que é característico dessa espécie.
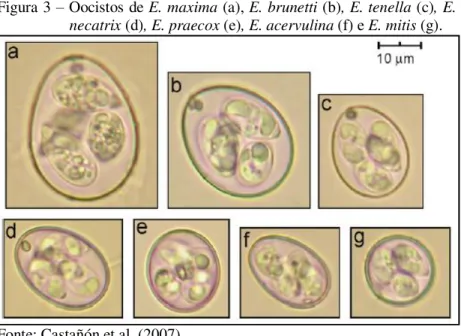
Utilizando a morfologia e o tamanho dos oocistos (Figura 3) algumas vezes pode-se chegar à identificação da E. maxima, que produz os maiores oocistos, de parede irregular e com uma coloração castanha característica que difere das demais espécies de Eimeria que parasitam galinhas (JOYNER; LONG, 1974). Schnitzler e Shirley (1999) relataram que os oocistos de E. brunetti possuem uma faixa de tamanho próximo da E. maxima e podem ser confundidos. Para todas as outras espécies a identificação utilizando somente a morfologia e tamanho dos oocistos é ainda mais complexa (LONG; JOYNER, 1984; LONG; REID, 1982; SUN et al., 2009).
Segundo Long e Reid (1982), o tempo de esporulação pode ser utilizado como um parâmetro para auxiliar na identificação das espécies de Eimeria. Os oocistos devem ser suspendidos em solução de dicromato de K+ a 2%, com constante aeração e em temperatura de 30° C. Long e Joyner (1984) citaram que a esporulação deve ser conduzida em condições controladas para que esta medida tenha validade sistemática, pois, a variação temporal para a esporulação parece ter uma grande dependência da temperatura. A verificação da esporulação pode ser feita de forma empírica (com a infecção de aves susceptíveis e a observação da excreção ou não de oocistos) ou por microscopia para a visualização das alterações morfológicas dos oocistos.
Figura 3 – Oocistos de E. maxima (a), E. brunetti (b), E. tenella (c), E. necatrix (d), E. praecox (e), E. acervulina (f) e E. mitis (g).
Fonte: Castañón et al. (2007).
localização das lesões, para que seja possível a diferenciação entre espécies. Este é um método demorado, que para ser executado necessita da manutenção de cepas puras das sete espécies de Eimeria e do uso de animais.
Embora muitos autores reconheçam que a identificação por meio das características morfo-clínicas é um método demorado e pode falhar na identificação das espécies de Eimeria, principalmente, quando algumas características são utilizadas isoladamente, estudos ainda são desenvolvidos com base nessa metodologia (AL-GAWARD et al., 2012; AWAIS et al., 2011; CARDOZO e YAMAMURA, 2006; JADHAV et al., 2012; LUCHESE et al., 2007; SANTOS et al., 2003; TERRA et al., 2001; TOLEDO et al., 2011).
Uma identificação rápida e precisa das espécies de Eimeria é requerida para várias finalidades. Em estudos epidemiológicos, é importante seguir um agente infeccioso ao longo do tempo e espaço, a fim de saber como ele pode se espalhar. Para o desenvolvimento de vacinas, é imperativo trabalhar com linhagens puras e evitar inadvertidas contaminações cruzadas. Os métodos convencionais de identificação requerem pessoal altamente treinado uma vez que as diferenças na morfologia dos oocistos são pequenas e não são facilmente visíveis. (STUCKI et al., 1993).
2.4.2 Diagnósticos bioquímicos e moleculares
2.4.2.1 Eletroforese de isoenzimas
(6-fosfogluconato dehidrogenase); e glucose-6-phosphate dehydrogenase – G6PD (glicose-6-fosfato dehidrogenase). Segundo
Kučera (1989) a LDH e a GPI são as enzimas mais adequadas para esse propósito. Entretanto, Shirley (1975) verificou que ocorreu um padrão de migração idêntico da enzima LDH entre as espécies E. acervulina e E. tenella.
Kučera (1990) utilizou a eletroforese de isoenzimas para complementar o diagnóstico pelas características morfo-clínicas em um trabalho de identificação de espécies de Eimeira na Tchecoslováquia, e concluiu que a utilização de ambos os métodos isoladamente não é conclusivo. Tebo et al. (1998) e Willians et al. (1996) também empregaram essa prova juntamente com as características morfo-clínicas para o diagnóstico das espécies de Eimeria que parasitam aves da espécie G. gallus domesticus em estudos epidemiológicos executados na Suécia e França, respectivamente.
Todavia, essa técnica demanda grande quantidade de oocistos, pois em alguns casos é incapaz de detectar espécies que estejam em um número inferior a 20%, entre às presentes na amostra. Para contornar esse problema, em alguns casos faz-se necessário à propagação dos oocistos da amostra em aves, o que torna o teste mais caro, demorado e trabalhoso (KUČERA, 1990; FERNANDEZ et al., 2003a). Tebo et al. (1998) em seus estudos de identificação das espécies de Eimeria em aves da espécie G. gallus domesticus, utilizaram uma camada fina de poliacrilamida ao invés de amido ou agarose e com isso aumentou a sensibilidade da prova, sem a necessidade de uma prévia propagação da amostra em aves.
2.4.2.2 Detecção de “Restriction Fragment Length Polymorphism” (RFLP) por hibridização Southern blot
no gel pode ocorrer uma grande quantidade de sinais de hibridização inespecífica que pode mascarar as específicas (BROWN, 2003). É uma técnica que fornece uma quantidade menor de informações, é mais trabalhosa e demorada, quando comparada com RAPD e AFLP (MUELLER; WOLFENBARGER, 1999). Shirley (1994) utilizou a transferência de Southern para RFLP com quatro sondas de DNA que repetem várias vezes no genoma de E. tenella para diferenciar oito amostras de E. tenella, três das quatro sondas hibridizaram apenas com o DNA de E. tenella enquanto uma sonda também hibridizou com o DNA de E. praecox e E. acervulina. No entanto, a detecção de RFLP por hibridização Southern Blot é trabalhosa, requer marcadores de DNA específicos e é relativamente dispendiosa (PROCUNIER, et al., 1993).
2.4.2.3 “Random Amplification of Polymorphic DNA” (RAPD)
A RAPD, ao contrário da PCR, é uma ferramenta que pode ser utilizada para a identificação das espécies sem a necessidade do conhecimento prévio da sequência da região a ser amplificada. Para essa técnica são empregados iniciadores arbitrários sob condições de baixa estringência, ou seja, pequenos oligonucleotídeos utilizados como
“primers” são colocados para hibridizar a uma baixa temperatura, isso
com gradiente de desnaturação) e Polyacrylamide gel electrophoresis – PAGE (eletroforese em gel de poliacrilamida) não só confirmaram a maior proximidade de cepas de E. tenella quando comparadas com E. acervulina como também perceberam uma melhor resolução dos fragmentos quando utilizada a DGGE. A técnica de RAPD pode ser empregada para pesquisar marcadores moleculares conhecidos como SCAR, utilizados na identificação das espécies de Eimeria de galinhas, por meio da PCR (FERNANDEZ et al., 2003b; 2004). A partir dos SCAR são desenhados “primers” específicos, mais longos que os
utilizados na RAPD, que são utilizados em condições mais rigorosas (alta temperatura de hibridação), tornando a PCR com esses “primers”
mais confiáveis que a técnica de RAPD para o diagnóstico. Fernandez et al., (2004) identificaram 84 SCAR espécie-específicos e 67 com especificidade parcial para as espécies de Eimeria de galinhas.
2.4.2.4 “Amplified Fragment Length Polymorphysm” (AFLP)
A técnica de AFLP, a exemplo da RAPD e da RFLP, também, pode ser utilizada para a identificação de marcadores moleculares. Para a elaboração dessa técnica, primeiramente são utilizadas enzimas de restrição que fazem a digestão do DNA em locais específicos, de acordo com a enzima utilizada, em seguida faz-se a ligação de adaptadores nas extremidades dos fragmentos resultantes dessa digestão enzimática, e a execução de uma AFLP-PCR com a utilização de “primers” específicos
que se ligam às sequências dos adaptadores. Dessa forma são amplificados os fragmentos resultantes da digestão com as enzimas de restrição, e finalmente o material amplificado é visualizado em um gel de eletroforese (MUELLER; WOLFENBARGER, 1999). É uma técnica que, diferentemente da RAPD, é altamente replicável, pois, “primers”
vida desse parasito no cromossomo 2 e “loci” para resistência à arprinocida no cromossomo 1. Uma limitação é que a AFLP requer DNA de alta qualidade, portanto, a dificuldade para reproduzir um grande número de parasitos recombinantes e a subsequente coleta do DNA genômico a partir de esporozoítos purificados torna-se um entrave para a execução da técnica.
2.4.2.5 “Polymerase Chain Reaction” (PCR)
A reação em cadeia da polimerase (PCR) consiste em uma amplificação seletiva de uma região da molécula de DNA que é selecionada por meio, da utilização de dois pequenos oligonucleotídeos (primers) que são desenhados para hibridizar com as extremidades de uma sequencia alvo (um para cada uma das fitas de DNA). Para isso é necessário o conhecimento das sequencias das extremidades (BROWN, 2003). Na maioria das vezes a amplificação é realizada por uma enzima termoestável, a Taq DNA-polimerase, purificada da bactéria termófila, Thermus aquaticus (Taq), que pode sobreviver à incubação prolongada a 95°C (SAIKI et al., 1988). Essa enzima promove a polimerização de novas fitas de DNA no sentido 5’-3’, durante a fase de extensão.
Prichard (1997) citou que a reação em cadeia da polimerase é uma ferramenta que possui alta sensibilidade e especificidade, torna possível que um fragmento específico de uma pequena quantidade de DNA seja multiplicado seletivamente em milhares de cópias, podendo dessa forma se determinar, por exemplo, a identidade de um parasito a partir de menos que 1 ng de DNA. Segundo Saiki (1988) o alvo específico multiplica-se em uma razão de 2n
, onde n é o número de ciclos de hibridização e extensão.
incluindo quatro espécies de aves e duas de mamíferos, apenas um produto de 560 pb que corresponde a E. tenella foi amplificado.
2.4.2.5.1 PCR utilizando o primeiro e o segundo “Internal Transcribed Spacer” (ITS) do DNA ribossômico
Schnitzler et al. (1998, 1999) sequenciaram o ITS-1 do DNA ribossômico (rDNA) e perceberam que a sua heterogeneidade no comprimento e nas sequências de bases entre as espécies poderiam
conceber marcadores para o desenho de “primers” espécie-específicos, para a utilização em uma PCR, para a identificação das sete espécies de Eimeria que parasitam aves da espécie G. gallus domesticus. Nesse estudo encontraram dois padrões de bandas para E. maxima, uma superior de 630 pb e outra inferior de 505 pb, e segundo os autores, estudos futuros poderão determinar sua aplicabilidade na identificação de cepas dessa espécie.
Lew et al. (2003) utilizaram o ITS-1 como gerador de alvos para PCR em um estudo para confirmar a presença de sete espécies de Eimeria de galinhas na Austrália e analisar as relações evolutivas de isolados australianos. Para isso, vinte e duas regiões distintas do ITS-1 de 15 isolados australianos de Eimeria de frangos foram sequenciadas e analisadas. Evidenciaram a presença de duas regiões ITS-1, uma curta e uma longa, que podem coexistir em uma cepa, como demonstrado em um clone de E. tenella. Para a PCR foram empregados marcadores ITS-1 previamente publicados para as espécies de E. acervulina, E. tenella, E. necatrix e E. brunetti, combinados com novos marcadores elaborados para esse estudo (E. mitis, E. praecox e E. maxima australiana). O conjunto de “primers” designado para amplificar uma cepa americana de E. maxima não amplificou a cepa australiana da mesma espécie. Segundo os autores isso se deve pelo fato de que os dois tipos de ITS-1 não coexistem na amostra australiana. Isso reforça a ideia de que os ensaios de PCR utilizando ITS-1 devem ser avaliados em amostras de origens geográficas diferentes, para garantir que eles possam ser usados a nível mundial (HAUG et al., 2007). Lew et al. (2003) encontraram dois clones diferentes de E. mitis provenientes do isolado “A”, portanto,
inter e intraespecífica da região ITS-1, as sete espécies de Eimeria que parasitam galinhas foram identificadas na Austrália.
Su et al. (2003) avaliaram a PCR baseada em marcadores ITS-1 para a identificação das espécies de Eimeria contidas em duas vacinas comerciais e uma cepa de E. tenella originária de Taiwan. Empregaram para a PCR um conjunto de cinco “primers” previamente desenhados (E. acervulina, E. maxima, E. tenella, E. necatrix e E. brunetti,). Todos os
conjuntos de “primers” amplificaram e não houve nenhuma amplificação inespecífica.
Estudos de prevalência e levantamentos de espécies de Eimeria têm sido executados por meio da PCR utilizando como alvo marcadores situados no ITS-1. Com o objetivo de verificar a presença de E. mitis e E. praecox, espécies de Eimeria até então pouco relatadas no Brasil, Meireles et al. (2004) submeteram à PCR (ITS-1) 156 amostras procedentes de sete estados produtores mais o Distrito Federal. E. praecox estava presente em todos os estados amostrados, enquanto a E. mitis não foi encontrada apenas nos Estados de Goiás e Minas Gerais.
Em um estudo para identificação de Eimeria spp. em instalações industriais de criação de frangos de corte, em Concórdia, Santa Catarina, foi empregado a PCR (ITS-1) para a detecção de E. acervulina, E. maxima, E. tenella e E. mitis. Sendo E. mitis a única espécie não encontrada (PRADO, 2005).
Haug et al. (2008) empregaram a análise morfométrica de oocistos e a PCR para um estudo epidemiológico das espécies de Eimeria que parasitam frangos na Noruega. Verificaram que cinco espécies de Eimeria estavam presentes nas criações de frango (E. acervulina, E. maxima, E. tenella, E. praecox e E. necatrix) e que a concordância da morfometria com a PCR na identificação das espécies foi de apenas 49%.
Aarthi et al. (2010) estudaram a prevalência molecular da coccidiose em frangos na Índia. Os marcadores utilizados foram desenhados a partir de alvos no ITS-1 e a amostragem foi feita de porções de tecidos de vários locais do intestino de aves que apresentavam sinais clínicos. Utilizaram nested PCR, com um conjunto
de “primers” para a detecção do gênero Eimeria. O produto dessa reação foi clonado e o DNA extraído do plasmídeo foi submetido a sete reações da PCR para identificação das espécies que acometem frangos. Todas as sete espécies estavam presentes, geralmente em infecções múltiplas.