Dissertação de candidatura ao grau de Doutora em Medicina Especialidade de Anatomia Patológica
FENÓTIPO ABERRANTE DE MUCINAS E MECANISMOS RELACIONADOS COM A SUA EXPRESSÃO
CONTRIBUIÇÃO PARA O CONHECIMENTO
DA CANCERIGÉNESE NA COLITE
ULCEROSA DE LONGA EVOLUÇÃO
Paula Maria Ferreira Brinca Borralho Nunes
CONTRIBUIÇÃO PARA O CONHECIMENTO
DA CANCERIGÉNESE NA COLITE ULCEROSA
DE LONGA EVOLUÇÃO
FENÓTIPO ABERRANTE DE MUCINAS E MECANISMOS
RELACIONADOS COM A SUA EXPRESSÃO
Paula Maria Ferreira Brinca Borralho Nunes
Dissertação de candidatura ao grau de Doutora em Medicina na especialidade de Anatomia Patológica
Orientada pelo Prof. Doutor Jorge Manuel de Oliveira Soares
A impressão desta dissertação foi aprovada pela Comissão Coordenadora do Conselho Científico da Faculdade de Medicina de Lisboa em reunião de 27 de Janeiro de 2009.
Ao Paulo e aos meus filhos. Aos meus Pais.
RESUMO
A colite ulcerosa (CU) é uma das poucas condições pré-neoplásicas conhecidas do intestino, pelo que a escolhemos como modelo de investigação da cancerigénese do cancro colorectal (CCR) em contexto de inflamação crónica.
Objectivos:
a) Esclarecer alguns mecanismos da sequência inflamação-displasia-carcinoma, investigando populações celulares metaplásicas reveladas pela expressão de apomucinas gástricas e estabelecendo a sua relação com a presença de displasia/neoplasia em doentes com colite ulcerosa; b) Avaliar o papel de genes homeobox envolvidos na diferenciação gástrica.
Materiais e metodologia:
Estudámos a expressão das apomucinas MUC5AC e MUC6 e dos factores de transcrição SOX2 e Pdx1 em amostras de mucosa intestinal numa série de 130 doentes com CU, subdivididos em dois grupos: grupo I, sem displasia/neoplasia (n = 105) e grupo II, com displasia/adenocarcinoma (n = 25). Avaliámos a metilação dos genes SOX2 e Pdx1 em 30 casos. Usámos métodos imunohistoquímicos e de PCR (QMSP).
Resultados:
Demonstrámos haver expressão de MUC5AC (72,1%) e MUC6 (21%), predominantemente no grupo II. MUC5AC correlacionou-se com distorção e com inflamação (actividade, intensidade) e duração da doença. MUC6 correlacionou-se com expressão de MUC5AC, extensão da doença e displasia/ neoplasia. Observou-se expressão de SOX2 (18%) e Pdx1 (73,3%). SOX2 foi detectado em neoplasias nas áreas com menor diferenciação ou padrão mucocelular e correlacionou-se com MUC6 e displasia/neoplasia. Pdx1 correlacionou-se com MUC5AC.
Identificou-se metilação do SOX2 (n = 6), correlacionando-se com a presença de displasia/neoplasia e também de Pdx1 (n = 4). Não havia diferenças significativas quando comparados os dois grupos, nem correlação com as variáveis estudadas.
Conclusões:
A expressão aberrante de mucinas sugere a existência das etapas “inflamação- metaplasia/diferenciação anómala” na cancerigénese em CU, representando marcadores precoces de evolução para neoplasia. O gene SOX2 desempenha provavelmente um papel importante, determinante no aparecimento de neoplasias com menor diferenciação ou de subtipos particulares. Constatam-se analogias com a via “Constatam-serreada” num número significativo de CCR em CU. Palavras-chave: cancerigénese colorectal, colite ulcerosa, mucinas, metaplasia gástrica.
ABSTRACT
Being one of the few pre-neoplastic conditions affecting the colon, we selected ulcerative colitis (UC) as a model within the carcinogenesis of colorectal cancer (CRC), in the setting of chronic inflammation.
Aims:
To clarify: a) Some of the mechanisms implicated in the sequence inflammation-carcinoma, investigating the role of metaplastic gastric cell lineages and their relation to dysplasia/neoplasia in patients with UC; b) The relationship between aberrant gastric mucins and homeobox genes SOX2 and
Pdx1, trying to explain some aspects responsible for cellular differentiation in
UC.
Patients and methods:
Demographic/morphological parameters of 130 patients (group I - 105 patients without dysplasia/neoplasia; group II - 25 patients with dysplasia/ invasive adenocarcinoma) were evaluated. Differentiation studies included evaluation of immunoexpression of gastric apomucins (MUC5AC e MUC6) and transcription factors SOX2 and Pdx1 in colonic mucosa samples. DNA methylation of SOX2 and Pdx1 genes was determined by PCR (QMSP) in 30 cases.
Results:
Both apomucinas were expressed. MUC5AC (72.1%) correlated with crypt distortion, inflammation and disease duration. MUC6 (21%), correlated with MUC5AC, disease extension and dysplasia/carcinoma.
SOX2 (18%) and Pdx1 (73.3%) were present in regenerative and neoplastic mucosa. SOX2 was more common in neoplasia, in areas less differentiated or with a mucocellular pattern. SOX2 correlated with MUC6 and dysplasia. Pdx1 correlated with crypt distortion and MUC5AC.
Methylation of SOX2 (n = 6) and Pdx1 (n = 4) was detected, with no significant differences amongst groups; SOX2 correlated with dysplasia/ neoplasia.
Conclusions:
In UC, the sequence “adenoma-carcinoma” should include the steps “inflammation-metaplasia/aberrant differentiation”, as suggested by expression of gastric mucins (especially MUC6), representing most likely early biomarkers in carcinogenesis. SOX2 plays probably an important role in the induction of distinct patterns or less differentiated adenocarcinomas.
Our findings substantiate some analogies with a serrated carcinogenic pathway in the context of UC that, although not the sole, is probably one of the most important.
KEY WORDS: colorectal carcinogenesis, ulcerative colitis, mucins, gastric metaplasia
A presente dissertação inclui resultados parcialmente contidos nas seguintes publicações:
Aberrant apomucin expression in ulcerative colitis and associated neoplasia
Paula Borralho, Ana Vieira, João Freitas, Paula Chaves, Jorge Soares (2007)
Journal of Crohn’s & Colitis 1 (2), 35-40.
Transcription Factors Sox2 and Pdx-1 in Ulcerative Colitis and Associated Neoplasia – Are They Related To Gastric Apomucin Expression and Involved In Carcinogenesis?
Paula Borralho, Ana Vieira, João Freitas, Ana Cóias, Cristiana Carneiro, Paula Chaves (2007) Journal of Crohn’s & Colitis 1 (1), 36 (Abstract).
Abreviaturas usadas
ADN ácido desoxirribonucleico APC adenomatosis polyposis coli CCR cancro colorectal
DALM dysplasia-associated-lesion or mass DC doença de Crohn
DIII doença inflamatória intestinal idiopática Pdx-1 Pancreatic and duodenal homeobox 1 ARN ácido ribonucleico
SOX Sry-related HMG box TLR receptores toll-like TNF-α tumor necrosis factor-α TTF1 trefoil factors 1
PREFÁCIO
Este foi sem dúvida um trabalho aliciante que não existiria não fora um convite feito pela Prof. Estela Monteiro e pelo Dr. João de Freitas, que me convidaram para integrar um grupo dedicado ao estudo da doença inflamatória intestinal (“European Colaborative Study on Inflammatory Bowel Disease” - EC-IBD), com o apoio do Dr. Luis Gonçalves. Mas foi a Prof. Paula Chaves que, durante o meu internato complementar, me ensinou a gostar da patologia do tubo digestivo e me contagiou com o seu entusiasmo. É ela, sem sombra de dúvida, a maior “culpada” pela escolha do tema desta tese. O seu persistente estímulo ajudou-me a manter a energia necessária à realização desta tarefa. Obrigada, Paula.
Ao Professor Doutor Jorge Soares, meu orientador científico nesta dissertação, agradeço o permanente incentivo, o apoio e a confiança. Foi com o Prof. Jorge Soares que compreendi, enquanto aprendia Anatomia Patológica, a importância do raciocínio e rigor científico. Sem o seu constante desafio esta tese não teria sido iniciada nem terminada.
Agradeço a todos os elementos do Serviço de Anatomia Patológica do Hospital Garcia de Orta, que directa ou indirectamente me ajudaram neste trabalho. À Dra. Maria José Brito agradeço particularmente o apoio institucional, que permitiu a realização de grande parte deste trabalho e me deu a oportunidade de realizar esta tarefa. Agradeço à Ana Cóias, à Cristiana e ao Celso a execução técnica e ao José Manuel Baptista pelo apoio fundamental a esse desempenho.
Aos Colegas e Amigos gastrenterologistas do Hospital Garcia de Orta, agradeço todo o carinho e apoio que sempre me demonstraram.
Devo, ainda, o meu reconhecimento ao Núcleo de Gastrenterologia dos Hospitais Distritais, uma vez que os trabalhos incluídos nesta tese de doutoramento foram por eles parcialmente subsidiados.
Também uma palavra especial de agradecimento a todos os que contribuíram com casos e informação clínica incluídos neste trabalho.
Na execução deste trabalho utilizaram-se anticorpos que foram gentilmente facultados pela Prof. Leonor David, a quem também devo o meu
reconhecimento.
Aos Colegas da Escola Superior da Tecnologias da Saúde, que me deram um apoio fundamental na avaliação dos resultados, um bem-haja pelo auxílio.
Ao Prof. Rui Henrique e à Prof. Carmen Jerónimo, agradeço a colaboração e apoio técnico, mas também a simpatia e disponibilidade.
À Sofia, um agradecimento especial pelo estímulo e precioso auxílio na revisão do manuscrito.
A todos os meus amigos que contribuíram para a conclusão deste trabalho com permanente incentivo e carinhoso apoio, agradeço a amizade.
Finalmente, um agradecimento muito especial à minha família, aos meus Pais, aos meus filhos e ao Paulo. Foram a razão de ser desta tese.
ÍNDICE
CAPÍTULO I INTRODUÇÃO 3
Revisão histórica 4
O conhecimento actual 11
Fundamentos científicos para a escolha do tema 19
CAPÍTULO II OBJECTIVOS 29
CAPÍTULO III MATERIAIS E METODOLOGIA 33
Caracterização clínica 34
Caracterização morfológica 34
Estudo imunohistoquímico 35
Avaliação da metilação dos genes SOX2 e Pdx1 41
Estudo estatístico 43
Questões éticas 44
CAPÍTULO IV RESULTADOS 47
Análise descritiva das características da série 47
Expressão de apomucinas MUC5AC e MUC6 56
Expressão de factores de transcrição SOX2 e Pdx1 62
Avaliação da metilação dos genes SOX2 e Pdx1 68
CAPÍTULO VI DISCUSSÃO 77
Aspectos moleculares do CCR esporádico 77
A importância dos fenómenos adaptativos 79
O significado das apomucinas MUC5AC e MUC6 84
Inflamação crónica e carcinogénese 85
O papel dos genes homeobox 88
Metilação e regulação epigenética 90
A via “serreada” e outras vias de carcinogénese na colite ulcerosa 93
CAPÍTULO VII CONCLUSÕES 97
CAPÍTULO VII SUMÁRIO 105
I
CAPÍTULO
I. INTRODUÇÃO
A colite ulcerosa é uma doença de etiologia desconhecida que, juntamente com a doença de Crohn (DC) é incluída na designação de “doença inflamatória intestinal idiopática” (DIII). Define-se como uma doença inflamatória crónica da mucosa, primitiva, com fases de remissão que se alternam com episódios agudos de recorrência, que afecta de forma contínua o recto e uma extensão variável do cólon [Satsangi J et al 2006, Stange EF et al 2008].As manifestações clínicas surgem habitualmente na segunda e terceira década de vida, sem diferenças de prevalência entre géneros, consistindo em diarreia e rectorragias que, nos casos graves, se acompanham de sinais inflamatórios. Cerca de 11% dos doentes com colite ulcerosa têm manifestações extra-intestinais (artrite, colangite esclerosante, lesões cutâneas e oculares) [Cantor M & Bernstein CN 2004]. A diarreia é causada principalmente pela inflamação da mucosa do cólon. Enquanto a DC pode envolver qualquer segmento do tracto gastrointestinal, na colite ulcerosa a doença está limitada ao cólon e recto, sendo a sua extensão variável: cerca de 40% dos doentes adultos têm proctite e 40% têm colite limitada ao cólon esquerdo; até 20% dos doentes apresentam-se com pancolite (colite que se estende para além do cólon esquerdo) [Nikolaus S 2007].
Os aspectos macroscópicos variam com o grau de actividade e duração da doença. Caracterizam-se por doença contínua com envolvimento rectal, estendendo-se ao cólon proximal. Excepcionalmente, em alguns casos em que a totalidade do cólon está envolvida, pode encontrar-se extensão das lesões ao ileon proximal (backwash-ileitis). Nas fases de actividade da colite ulcerosa a mucosa está tipicamente eritematosa, edematosa, sangrante e friável e são características as ulcerações extensas. Na doença quiescente a mucosa tem um aspecto granular com áreas de eritema. São também distintivos os pseudopolipos ou pólipos inflamatórios, que podem ser encontrados quer na colite ulcerosa activa, quer nas fases de doença quiescente. Com a evolução da doença, a mucosa do cólon perde o seu relevo habitual e o lúmen ganha uma aparência de “tubo rígido”.
processo inflamatório crónico, destrutivo e reparativo, difuso, da mucosa intestinal que variam consoante a fase clínica da doença e dependem do grau de actividade da mesma (colite activa, colite em resolução, colite quiescente). Acompanhando as fases de agudização mais graves surgem as extensas ulcerações superficiais que caracterizam esta entidade. A depleção de muco e a presença de neutrófilos em quantidade significativa com permeação de criptas e formando micro-abcessos, são também características do quadro histológico, tal como a distorção arquitectural das glândulas que traduz os processos destrutivos e reparativos típicos desta patologia. Em contraste com a DC, que se acompanha de inflamação transmural da parede intestinal, na colite ulcerosa as lesões estão caracteristicamente limitadas à mucosa e submucosa. Alguns casos de colite ulcerosa podem ter aspectos histológicos atípicos (doença descontínua, mucosa rectal poupada, fissuras, úlceras aftóides, envolvimento do ileon terminal, granulomas em relação com destruição de criptas).
A colite ulcerosa é uma das poucas condições pré-neoplásicas conhecidas na mucosa do cólon, [Ekbom et al 1992, Harpaz N et al 1996, Palli D et al 1998, Greenstein AJ 2000, Bernstein CN et al 2001] pelo que a escolhemos como modelo de investigação no processo de cancerigénese do cancro colorectal.
I.1. Revisão histórica
I.1.1. As primeiras descrições da doença
As origens históricas do conhecimento da colite ulcerosa são imprecisas e confundem-se com as da DC. Conhecem-se desde a antiguidade descrições de quadros de afecções não contagiosas que cursavam com diarreia sanguinolenta, em relatos datando de 117 A.C., atribuídos a Soranus de Ephesus [Mettler CC 1947]. O primeiro caso de DIII publicado na literatura médica ocorreu em 1761, descrito por Giovanni Battista Morgagni, que relatou um caso de “enterocolite granulomatosa” fatal, num doente do sexo masculino com 20 anos [Morgagni JB 1761]. No livro “Morbid Anatomy of Some of the Most
Important Parts of the Human Body” publicado por Matthew Baillie, em 1793,
descrevem-se casos de doença com quadros patológicos muito sugestivos de corresponder a colite ulcerosa, alguns dos quais com evolução fatal. A
designação colite ulcerosa foi usada pela primeira vez em 1859, por Samuel Wilks, anatomopatologista no Guy’s Hospital, em Londres. Wilks publicou o relatório de autópsia de uma mulher de 42 anos que morreu após vários meses de manifestações de diarreia e febre, com um quadro a que chamou
colite ulcerosa simples e que distinguiu da colite bacteriana [Wilks S 1859]. A
autópsia demonstrou o envolvimento do cólon e do recto por uma inflamação ulcerativa. Em 1870, Wilks descreveu com maior detalhe, desta vez em colaboração com Moxon, o síndrome da colite ulcerosa simples numa doente jovem com inflamação e ulceração da totalidade do cólon [Wilks S & Moxon W 1870]. A designação de colite ulcerosa foi usada novamente em 1888 por Hale-White [Hale-White W 1888]. Encontram-se posteriormente numerosas publicações relatando casos de doença inflamatória idiopática (Fenwick em 1889, Dalziel em 1913, Weiner em 1914, Moschowitz e Wilensky em 1923 e 1927 e Goldfarb e Suissman em 1931), não distinguindo os autores a colite ulcerosa da entidade mais tarde descrita por Crohn e colaboradores [Baron JH 2000].
A primeira publicação de cariz epidemiológico sobre DIII surgiu em 1909 e apresentou uma série de 317 doentes admitidos em sete hospitais de Londres, com uma doença inflamatória e ulcerativa do cólon [Cameron HC & Rippman CH 1909). Muitos destes doentes morreram por perfuração do cólon complicada de peritonite, hemorragias, sepsis e embolia pulmonar.
Crohn, Ginzburg e Oppenheimer descreveram em 1932 a ileite terminal, num artigo “histórico” que inclui uma série de 14 doentes [Crohn BB et al 1932]. Inicialmente chamada ileite terminal, a entidade foi depois redenominada ileite
regional por sugestão de Arnord Burger, que fez a revisão do artigo e considerou
que o termo terminal era inapropriado porque poderia ser confundido com
agónico. Na sua descrição original da ileite que posteriormente tomaria o
seu nome, Crohn considerou que os aspectos patológicos da doença por ele descrita seriam diferentes do que se encontrava na colite ulcerativa à direita.
Em 1951, George Lumb descreveu minuciosamente as alterações anatomopatológicas observadas na DC e na colite ulcerosa, considerando que existem grandes semelhanças entre as duas entidades [Lumb G 1951]. Lumb defendia a teoria de que a colite ulcerosa seria um processo inflamatório não
da parede do intestino, estreitamento do lúmen, mucosa irregular com aspecto em “pedra da calçada” quando o ileon está envolvido ou com pseudopolipos quando o cólon está envolvido. Segundo o autor, as alterações histológicas características da colite ulcerosa seriam o processo inflamatório constituído por elementos mononucleados e alguns eosinófilos e a distorção arquitectural da mucosa que, por vezes, se associava a necrose e ulceração.
Foi Erick Brooke quem, em 1954, no livro Ulcerative colitis [Brooke B 1954], considerou que as alterações patológicas do cólon, quando associadas à ileite que havia sido descrita por Crohn, seriam diferentes das que se observavam na colite ulcerosa, separando claramente as duas entidades. No entanto, esta opinião não era universalmente aceite e, em 1957, Erick A. Crook, num artigo de revisão sobre Condições não específicas do intestino [Crook EA 1957], defendia ainda a teoria de que a colite ulcerosa poderia ter subjacente várias doenças diferentes, interpretação sugerida pelos vários tipos de apresentação clínica. Crook descreveu três quadros: a forma comum que começaria no cólon esquerdo e se estenderia quer no sentido proximal quer no sentido distal, a forma localizada ao cólon direito, que ocorreria ocasionalmente, sendo cerca de dez vezes menos frequente do que a primeira e a forma de
proctite granular que ocorreria com menos frequência e sem tendência para
se estender ao cólon. Apesar de não reconhecer a colite ulcerosa como uma entidade individualizada, Crook teve o mérito de descrever, de forma muito detalhada, as suas características anatomopatológicas. Este autor chamou a atenção para as diferenças entre linfogranuloma venéreo, DC e colite ulcerosa, considerando que as alterações iniciais na colite ulcerosa se circunscreveriam à mucosa, que se torna edematosa, eritematosa e com tendência a sangrar, por vezes com úlceras que podiam coalescer, com extensa destruição e com formação de pseudopolipos. O autor defendeu que a ausência de fístulas e de aderências entre as ansas intestinais envolvidas eram características da colite ulcerosa, ao contrário do que acontecia na doença de Crohn. Advogou a realização de biópsias da mucosa rectal feitas sistematicamente a 11 cm do orifício anal, permitindo posteriores comparações entre diferentes doentes ou diferentes episódios num mesmo doente.
O cirurgião H. E. Lockhart-Mummery, em 1959 [Lockhart-Mummery HE, 1959], baseando-se nas observações de peças cirúrgicas de colectomia
de doentes com colite ulcerosa, chamou a atenção para os aspectos macroscópicos e histológicos da afecção. Este autor considerou ser essencial que o cirurgião conhecesse os aspectos patológicos típicos desta entidade e descreveu pormenorizadamente as alterações habituais nas várias fases da doença, incluindo o aspecto granular da mucosa intestinal, os abcessos das criptas e o denso infiltrado de células inflamatórias mononucleadas que caracteristicamente preenchia a mucosa e a submucosa superficial, sem atingir as túnicas mais exteriores da parede intestinal. Na mesma publicação, ilustrou as emblemáticas úlceras e a formação de pseudopolipos inflamatórios. Em colaboração com Morson, em 1960 e, posteriormente em 1964 [Lockhart-Mummery HE & Morson BC 1960, Lockhart-[Lockhart-Mummery HE & Morson BC 1964], compreendendo a possibilidade de envolvimento do cólon por DC, defendeu que a colite granulomatosa deveria ser claramente separada da colite ulcerosa, estabelecendo-se, assim, a distinção fenotípica entre ileite terminal/ DC e colite ulcerosa. Segundo aqueles autores estas entidades deveriam ser individualizadas de outras doenças específicas (diverticulite, disenteria bacilar, disenteria amebiana, linfogranuloma venéreo) e definiam as condições patológicas que designaram por colite ulcerosa crónica e enterite regional ou
doença de Crohn, com base no estudo macroscópico e microscópico detalhado
de peças cirúrgicas, correlacionado com os dados clínicos. Estes autores referiram ainda a possibilidade de existirem factores etiológicos comuns e enfatizaram a distinção entre as duas entidades com base nos aspectos clínicos e anatomopatológicos das mesmas. A partir dessa data as duas entidades estavam definitivamente individualizadas e assumidas como patologias distintas.
I.1.2. A evolução das teorias etiopatogénicas
No início, a comunidade científica considerou a colite ulcerosa como uma manifestação de alergia a alimentos, a pólen ou a bactérias intestinais. Esta teoria foi precocemente abandonada, uma vez que os doentes com colite ulcerosa não apresentavam outras manifestações de hipersensibilidade.
Muitos consideraram a infecção por um agente desconhecido como etiopatogenia mais provável, atendendo às semelhanças entre colite ulcerosa e colite infecciosa, pelo que as terapêuticas iniciais incluíram a utilização de permanganato de potássio, solução de Dakin, vacina anti-escherichia coli,
agentes anti-amebianos e sulfonamidas [Lockhart-Mummery JP 1907]. Em 1909, Dawson [Dawson B] implica como agente etiológico um microrganismo do conteúdo fecal e, no artigo de revisão publicado em 1949 por Warren e Sommers, volta a formular-se a mesma hipótese [Warren S & Sommers SC], que não foi confirmada em trabalhos posteriores. Com efeito, não tiveram sucesso as tentativas de identificação de um agente específico, considerando-se que os argumentos contra esta hipóteconsiderando-se eram numerosos: não tinham sido identificados casos de transmissão de colite ulcerosa entre doentes, era elevada a incidência de colite ulcerosa em países onde a colite infecciosa era pouco frequente, os baixos níveis socioeconómicos pareciam ter um papel protector e os tratamentos precoces e frequentes com agentes antibacterianos durante a infância aumentariam o risco de colite ulcerosa.
Crook considerou, em 1957 [Crook EA], a etiologia da colite ulcerosa como “um mistério”, sugerindo que poderia ser despoletada pelas lesões causadas por um episódio de “disenteria bacilar” e perpetuada posteriormente pelos microrganismos existentes na flora intestinal.
Em 1933, Buie e Bargen consideraram que fenómenos “trombóticos” vasculares seriam a causa da colite ulcerosa [Buie LA & Bargen JA, 1933] e, em 1954, Warren e Sommers voltaram a discutir esta hipótese, atribuindo à inflamação de vasos arteriais e venosos a oclusão vascular e necrose do cólon [Warren S & Sommers SC, 1954].
A hipótese de haver deficiência de algumas vitaminas como factor etiológico foi também formulada por alguns autores, concluindo-se posteriormente que esta não surgia habitualmente senão em fases avançadas da doença, pelo que a deficiência vitamínica poderia ser consequência e não a causa de colite ulcerosa. Em 1933, Florey [Florey HW] chamou a atenção para “a função do muco nas fases iniciais da invasão bacteriana da mucosa intestinal” e Prudden e colaboradores, em 1949 [Prudden JF et al 1949], descreveram a lisozima e propuseram que o seu excesso, com consequente destruição do muco protector do intestino, seria a causa de colite ulcerosa. No entanto, outros autores [Sammons KC 1951] demonstraram que a alta concentração de lisozima nas fezes destes doentes era uma consequência e não a causa da doença.
Foi também postulada uma causa psicogénica para a entidade. A labilidade emocional que muitas vezes acompanha as primeiras manifestações
da doença levou a que se sugerisse uma causa neurológica. Em 1938, Wright e colaboradores [Wright RD et al 1938] descrevem o efeito da estimulação de nervos parassimpáticos em gatos, que produziria aumento da actividade muscular do intestino e hiperprodução de muco. Nos anos sessenta, a colite ulcerosa chegou a ser considerada como uma das principais doenças psicossomáticas, tendo-se publicado casos em que se havia conseguido cura ou melhoria significativa em doentes submetidos a psicanálise [Daniels GE et
al 1962].
As descrições de casos “familiares” de DIII alertaram para a possibilidade de haver uma base genética para a afecção. Em 1936, Moltke [Moltke O 1936] descrevia cinco famílias com colite ulcerosa. Sloan e colaboradores [Sloan WP et al 1950] descrevem 26 casos familiares numa série de 2000 doentes e Schlesinger e Platt obtiveram uma história familiar positiva em 17% de uma série de 60 crianças com colite ulcerosa [Schlesinger B & Platt J 1958]. Encontram-se numerosas publicações na literatura de casos de colite ulcerosa em gémeos monozigóticos e em familiares de primeiro grau [Probert CSJ et al 1933], o que apoiaria alguma componente genética para a etiologia da doença.
Em 1971, Dombal advoga que a colite ulcerosa deve deixar de ser considerada uma doença infecciosa, apesar de as bactérias do conteúdo intestinal serem factores provavelmente importantes na modulação da resposta inflamatória do cólon [Dombal FT 1971], o que representa um conceito muito próximo das teorias etiopatogénicas actuais.
I.1.3. O reconhecimento da DIII como condição pré-neoplásica
Foi em 1907 que Lockhart-Mummery, utilizando o recente proctosigmoidoscópio iluminado [Lockhart-Mummery JP], descreveu sete casos de neoplasia do cólon que ocorreram numa série de 36 doentes com colite ulcerosa. Crohn e Rosenberg publicaram, em 1925, um caso de carcinoma rectal num doente com colite ulcerosa seguido no Hospital Mount Sinai e consideraram que a lesão deveria ser considerada como sequela tardia da doença [Crohn BB & Rosemberg H 1925]. Tornou-se evidente pouco tempo depois que os doentes com colite ulcerosa de longa duração tinham um
risco maior de desenvolver carcinomas colorectais [Bargen JA 1928]. Muitas descrições surgiram na literatura a partir dessa data, confirmando a associação entre cancro colorectal e colite ulcerosa [Shands WC et al 1952, MacDougall IP 1954]. Dawson e Pryse-Davies descreveram, em 1959, lesões polipóides pré-cancerosas, semelhantes aos adenomas solitários ou “papilomas vilosos” da mucosa colorectal e consideraram que existiriam diferenças significativas em relação às lesões esporádicas [Dawson IM & Pryse-Davies J 1959]. Nos doentes com colite ulcerosa as lesões seriam quase sempre múltiplas, sésseis e com superfície vilosa ou papilar. Em 1967, Morson e Pang [Morson BC & Pang LS 1967] recomendaram a utilização da biópsia rectal com o objectivo de identificar lesões “pré-cancerosas”, chamaram a atenção para a possibilidade de se encontrarem estas lesões em mucosa plana ou em mucosa elevada e distinguiram as lesões polipóides que ocorreriam no contexto de colite ulcerosa das que eram habitualmente encontradas, de forma esporádica, em mucosa não inflamada. Consideraram que a transformação neoplásica ocorreria com maior frequência em mucosa plana, o que limitaria a sua detecção com recurso exclusivamente ao exame macroscópico da mucosa, pelo que seria necessário realizar o exame microscópico de biópsias. Em 1971, Goligher e De Dombal defenderam que o cancro colorectal se desenvolve quase exclusivamente em doentes com colite ulcerosa muito extensa e o risco varia com a duração dos sintomas [Goligher JC & De Dombal FT]. Citam a série de Leeds [De Dombal FT et al 1966] em que se encontrou um risco cumulativo de 41,8% após 25 anos de doença. Um risco tão elevado poderia justificar, nalguns casos, o recurso a colectomia profilática, o que seria uma decisão difícil de assumir, sobretudo em doentes sem sintomatologia. Os autores advogaram a validação dos resultados de Morson e Pang [Morson BC & Pang LS 1967], com recurso a biópsia rectal para identificação de lesões pré-cancerosas, chamando a atenção para o risco de casos “falsos negativos”.
Encontram-se, posteriormente, numerosas publicações sobre as vantagens da vigilância endoscópica destes doentes e sobre o valor da identificação histológica da displasia. Foi neste contexto de colite ulcerosa que um grupo de patologistas estabeleceu a classificação estandardizada que ainda hoje é usada para a displasia no tubo digestivo, com o objectivo de uniformizar critérios de diagnóstico e incluir sugestões para a orientação dos doentes [Riddell RH et al 1983].
I.2. O conhecimento actual
I.2.1. Incidência
A incidência da colite ulcerosa varia de 0,5 a 24,5 por 100 000 habitantes [Hanauer S 2006]. Quer a incidência quer a prevalência estão associadas ao nível económico das populações, com os valores mais baixos registados nos países em vias de desenvolvimento e os valores mais altos na América do Norte e nos países da Europa do Norte e Central [Green C et al 2006]. A incidência parece estar a aumentar nos países da Europa Central e Oriental, enquanto que nos países da Europa Ocidental e Escandinávia parece ter-se mantido estável nos últimos vinte anos. Na Europa confirmou-se a existência de um gradiente Norte-Sul através de um estudo multicêntrico (Projecto EC-IBD), que decorreu entre 1991 e 1993 e comprovou existir uma incidência menor de DIII nos países mediterrânicos [Shivananda S et al 1996, Lennard-Jones JE et al 1997].
Em Portugal, os primeiros estudos epidemiológicos, incluindo o do Projecto EC-IBD, demonstraram existir uma incidência de DIII mais baixa do que nos restantes países europeus, sendo o curso clínico da doença habitualmente menos grave [Monteiro E et al 1995, Shivananda S et al 1996, Lennard-Jones JE et al 1997].
O primeiro estudo português realizado com o objectivo de avaliar a incidência de neoplasias gastrointestinais em doentes com DIII envolveu a população abrangida por sete hospitais do sul do País (Almada, Barreiro, Setúbal, Évora, Beja, Portimão e Faro), o que representou uma área de influência de 1 456 254 habitantes e abarcou um período de 10 anos [Vieira A et al 2005]. Identificaram-se 840 doentes com DIII, dos quais 541 doentes (62%) com colite ulcerosa. A prevalência estimada de DIII nesta população foi 57,6/100 000 habitantes, sendo para colite ulcerosa 37,2/100 000 habitantes, com uma relação colite ulcerosa:DC de 1,9:1. Identificaram-se 7 casos de neoplasia colorectal em colite ulcerosa (4 em doentes do sexo masculino e 3 em doentes do sexo feminino), o que representou uma incidência de 134/100 000 doentes com colite ulcerosa/ano (sendo a incidência de CCR para a população da área de influência de 54,2/100 000, para o ano de 2000, segundo o Registo Oncológico Regional Sul). A média de idades de diagnóstico foi de 57,4 anos.
Conclui-se que a incidência de CCR nos doentes com DIII no sul de Portugal foi significativa, sendo superior à da população em geral e surgindo em idades mais jovens.
O estudo epidemiológico mais recente, realizado entre Setembro de 2005 e Dezembro de 2006 pelo GEDII (Grupo de Estudos de Doença Inflamatória Intestinal), identificou em Portugal 5893 doentes com DIII, sendo 2863 casos de colite ulcerosa [Portela F et al 2008]. Incluiu a população abrangida por 33 hospitais de norte a sul do País e estimou uma prevalência de 56,62 casos de colite ulcerosa por cada 100 000 habitantes. Destes, 57% eram do sexo feminino e a média de idade na data do diagnóstico foi de 37,8 anos; 21% dos doentes foram classificados como proctite ulcerosa, 52% dos doentes como colite esquerda e 28% dos doentes como colite extensa (pancolite). O comportamento clínico da doença, classificado com base no tipo de terapêutica necessária para controlar as crises (corticoesteróides, imunosupressores, cirurgia) revelou-se como moderado numa percentagem significativa de casos, tendo, no entanto, sido identificado um subgrupo de doentes mais jovens cuja doença tinha um perfil clínico mais agressivo.
I.2.2. Etiopatogénese
A etiologia da DIII não está ainda completamente esclarecida. É provável que um número significativo de factores contribua para o desenvolvimento do processo inflamatório e para a expressão da doença como colite ulcerosa ou como DC.
A colite ulcerosa será provavelmente uma doença com componente auto-imune, iniciada por uma resposta inflamatória às bactérias do conteúdo intestinal [Collins P & Rhodes J 2006]. Estas bactérias terão um papel fundamental no desenvolvimento da resposta imunitária intestinal, estimulando a expansão clonal de linfocitos e reprimindo a sua apoptose [Marteau P et al 2004, Lukas M et al 2006]. Assim, poderá ser a resposta anormal da mucosa intestinal, com descontrolo da imunoreactividade contra as bactérias do lúmen, o principal mecanismo responsável por haver inflamação e lesão dos tecidos nestes doentes. Com efeito, o sistema imunitário próprio da mucosa intestinal parece estar permanentemente “activado” e o intestino permanece cronicamente inflamado, propondo-nos as teorias actuais três mecanismos
para o aparecimento do processo inflamatório crónico: 1) a desregulação da resposta imunitária inata à microflora entérica ou a agentes patogénicos; 2) o aumento da permeabilidade através da barreira epitelial; 3) um defeito na regulação adaptativa do sistema imunitário [Goyette P et al 2007].
O sistema imunitário inato detecta a invasão de microrganismos através dos receptores toll-like (TLR) que reconhecem os componentes microbianos e despoletam a resposta inflamatória. Uma variação genética (polimorfismo) dos TLR poderia explicar em parte a maior susceptibilidade de alguns indivíduos a DIII [Franchimont D et al 2004, De Jager et al 2007]. Com efeito, os estudos genéticos realizados nos últimos anos identificaram vários genes responsáveis pela susceptibilidade individual, particularmente para a DC. O primeiro gene a surgir como candidato foi baptizado como NOD2 (também chamado
CARD15 e IBD1) tendo-se, posteriormente, identificado outros (IBD5, IL23R, ATG16L1) [Hugot JP et al 2001, Ogura Y et al 2001, Lesage S et al
2002, Watts DA & Satsangi J 2002]. Na colite ulcerosa, o factor genético parece ter um papel ligeiramente menos importante do que na DC [Zaph C
et al 2007].
A função de barreira do epitélio é essencial para a manutenção da homeostase da mucosa. O epitélio intestinal está em constante comunicação com a flora luminal e com as células imunitárias de resposta inata e adaptativa. Para além das células colunares do epitélio intestinal, as células caliciformes parecem ter um papel importante na etiopatogenia da colite ulcerosa. Estas células são responsáveis pela produção de “trefoil peptides”, [Mashimo H et al 1996] fundamentais para a manutenção da função de barreira e para a reparação das lesões do epitélio. Estudos recentes demonstraram que a proteína RELMβ (resistin-like molecule β), específica das células caliciformes e que é induzida pela colonização bacteriana, pode ter um papel no desencadear do processo inflamatório, activando os macrófagos para produzir TNF-α [Kämäräinen M
et al 2003, McVay LD et al 2006]. Esta proteína actuaria assim como um elo
de ligação entre as células caliciformes e as bactérias comensais na patogénese da DIII.
O papel das mucinas não está completamente esclarecido, mas é seguramente importante. A mucina MUC2, o mais importante constituinte do muco produzido pelas células caliciformes, parece estar diminuída nos
doentes com colite ulcerosa, apesar de se manter qualitativamente inalterada [Tytgat KM et al 1996, Tytgat KM et al 1996]. Para avaliar a importância desta mucina na carcinogénese intestinal, Velcich e colaboradores avaliaram ratinhos deficientes em MUC2. Estes animais apresentavam distorção marcada da morfologia das criptas intestinais e desenvolveram espontaneamente colite e posteriormente adenocarcinomas, demonstrando que esta mucina é crítica para a protecção do cólon, resultados que foram igualmente observados por outros autores [Velcich A et al 2002, Van der Sluis et al 2006, An G et al 2007, Yang K et al 2008].
O aumento de casos de colite ulcerosa nos países industrializados apoia a hipótese de que os factores ambientais têm um papel fundamental na etiopatogénese da doença. A importância de factores extrínsecos, quer para o despoletar da DIII quer para as recaídas da doença, parece ser inquestionável.
Está demonstrado que quer o stress quer factores emocionais podem influenciar a gravidade de processos inflamatórios e as alterações do sistema imunitário [Mayer EA 2000]. Os doentes com DIII mostram um risco muito elevado de exacerbações da doença quando apresentam manifestações depressivas [Mittermaier C et al 2004].
A colite ulcerosa afecta predominantemente indivíduos não fumadores e ex-fumadores. Fumar parece poder melhorar a sintomatologia nestes doentes e diminuir a necessidade de recorrer a colectomia e a terapêutica médica com corticoesteróides. Uma explicação seria que o tabaco aumenta a síntese de mucinas, diminui a produção de citoquinas pró-inflamatórias, reduz o tónus muscular intestinal e modifica a permeabilidade intestinal a macromoléculas [Boyoko EJ et al 1988].
O curso da doença também parece poder ser influenciado por factores dietéticos. O consumo excessivo de produtos lácteos e a deficiência, na dieta, de alimentos ricos em fibras, agrava a doença. Os alimentos ricos em enxofre e sulfatos foram relacionados com episódios de recaída, provavelmente devido a um efeito tóxico directo sobre o epitélio intestinal. O perfil nutricional associado a uma “dieta moderna” parece ter influenciado o número de casos de DIII nas últimas décadas, aumentando a sua prevalência [Tilg H & Kaser A 2004].
uma probabilidade menor de desenvolver colite ulcerosa. Numa meta-análise publicada por Koutroubakis e colaboradores [Koutroubakis IE et al 2002] encontrou-se uma redução de quase 70% do risco, desconhecendo-se quais os eventuais factores protectores que lhe estão associados.
Uma hipótese desenvolvida recentemente, a “hipótese da higiene”, postula que crianças que crescem em meios extremamente limpos têm um desenvolvimento deficiente do seu sistema imunitário, o que as predisporá ao aparecimento de doenças alérgicas e de colite ulcerosa. Um aspecto importante parece ser o contacto com helmintas, que modulam o sistema imunitário do hospedeiro [Weinstock JV et al 2004, Moreels TG & Pelekmans PA 2006].
Em resumo, a patogénese da doença inflamatória crónica intestinal é multifactorial, com interacções da susceptibilidade individual do hospedeiro com a resposta imunitária da mucosa e as características da microflora intestinal, tendo subjacentes factores genéticos e ambientais.
I.2.3. A cancerigénese em colite ulcerosa
O CCR é considerado como a mais grave complicação da DIII de longa duração e a principal causa de mortalidade nos doentes com colite ulcerosa [Ekbom A et al 1992, Harpaz N & Tlabot IC 1996, Palli D et al 1998, Greenstein AJ 2000, Bernstein et al 2001, Cottone M et al 2008]. Apesar de contribuir com menos de 1% da totalidade dos casos de CCR, esta neoplasia é a principal causa de mortalidade em doentes com colite ulcerosa (cerca de 15% das causas de morte) [Lennard-Jones JE et al 1977, Ekbom A et al 1992] e constitui uma das poucas condições pré-neoplásicas conhecidas na mucosa do cólon. O risco relativo de CCR em colite ulcerosa de longa evolução é cerca de dez vezes superior ao da população em geral e aumenta significativamente nos doentes que têm início precoce da doença, colite extensa, lesões com maior gravidade, associação de colangite esclerosante e história familiar de carcinoma colorectal [Rubin DT & Parekh N 2000, Herszenyi L et al 2007]. Na meta-análise publicada por Eaden e colaboradores avaliou-se um risco absoluto para mais de 54 000 casos publicados em 116 estudos. Estes autores encontraram uma prevalência de CCR de 3,7% na colite ulcerosa com uma incidência de 0,3 % (uma neoplasia em cada 333 doentes). O risco cumulativo foi de 8,3%
aos 20 anos e 18,4% aos 30 anos [Eaden JA et al 2001]. Algumas publicações recentes encontraram uma tendência para a diminuição do número de casos de cancro, eventualmente relacionável com melhor vigilância e controlo da doença.
Acredita-se que a etiopatogénese do cancro colorectal associado a colite ulcerosa envolve uma progressão morfológica desde a mucosa inflamada com epitélio reactivo ao adenocarcinoma invasivo, passando por uma fase intermédia de neoplasia não invasiva (displasia) [Riddell RH et al 1983, Schlemper RJ et al 2000]. Rubio propôs, em 2007, cinco tipos de lesões precursoras para o carcinoma no contexto de colite ulcerosa: 1) áreas de displasia em mucosa plana; 2) focos de transformação vilosa displásica; 3) lesões displásicas exofíticas directamente associadas a colite ulcerosa designadas por “DALM” (“Dysplasia-associated-lesion or mass”); 4) áreas displásicas em mucosa do cólon “herniada”; 5) adenomas esporádicos não relacionados com colite ulcerosa [Rubio C 2007]. Na realidade, a heterogeneidade das lesões morfológicas encontradas na colite ulcerosa pode indiciar que há mais do que uma via de carcinogénese neste contexto [Brackmann S et al 2008].
Apesar de a displasia ser actualmente o melhor “marcador” de evolução para neoplasia invasiva, o seu diagnóstico nem sempre é fácil [Riddell RH et
al 1983], já que em áreas com inflamação activa, pode ser particularmente
difícil o diagnóstico diferencial com alterações regenerativas, podendo haver discrepâncias consideráveis, quer intra-observador quer inter-observadores. Por outro lado, num número significativo de casos, a sua identificação é coincidente com a de neoplasia invasiva. Estes aspectos apontam para a necessidade de haver uma melhor compreensão das vias de cancerigénese e de se identificarem marcadores precoces de evolução para neoplasia na mucosa intestinal dos doentes com DIII. Até hoje, a estratégia universal para diagnosticar precocemente estas neoplasias é a vigilância periódica dos doentes considerados de “alto-risco” (doença com mais de dez anos de evolução e com envolvimento extenso do intestino, doença iniciada antes dos 30 anos), com o objectivo de identificar as áreas de displasia/neoplasia não invasiva.
Tal como nos casos esporádicos, o CCR que se desenvolve no contexto de colite ulcerosa surge por uma acumulação de erros em genes supressores tumorais, oncogenes e genes de reparação de ADN, assim como da perda de
estabilidade genómica. Sabe-se actualmente que a cancerigénese no contexto de colite ulcerosa partilha alguns passos com as vias de cancerigénese em CCR esporádicos, mas parece seguir vias moleculares diferentes, com alguns passos ainda mal compreendidos. Com efeito, as mutações do gene APC parecem ser menos frequentes [Redston MS et al 1995, Tarmin L et al 1995] e as mutações do gene p53 mais precoces [Rabinovitch PS et al 1992, Harpaz N et al 1994] nos casos de colite ulcerosa. Muitos outros marcadores foram avaliados até à actualidade numa tentativa de compreender quais os passos que levam ao aparecimento de neoplasias em DIII, nomeadamente aneuploidia, mutação de
K-ras, TGFBR2, p14 (ARF) [Moriyama T et al 2007], DPC4, gene BARF [Aust
DE et al 2005], genes de reparação de ADN hMSH2 e hMLH1 [Cawkwell L et al 2000], não existindo ainda um consenso sobre os respectivos papéis na cancerigénese em colite ulcerosa. A instabilidade de microssatélites, que ocorre numa proporção de casos sobreponível nos dois contextos, parece ter um papel importante na colite ulcerosa, ocorrendo mais cedo do que nos casos de CCR esporádico [Fujiwara I et al 2008]. A instabilidade de microssatélites está presente em tecidos que são sede de processos inflamatórios crónicos, tal como ocorre na pancreatite crónica e também na mucosa intestinal dos doentes com colite ulcerosa, independentemente da presença ou ausência de displasia [Brentnall TA et al 1996], o que sugere que pode haver uma relação entre a inflamação crónica e o mecanismo de cancerigénese. Na realidade, Virchow formulou em 1863 a hipótese de que as neoplasias malignas ocorreriam em locais que são sede de processos inflamatórios crónicos [Cendan JC et al 2007]. Sabemos hoje que o desenvolvimento de neoplasias num contexto de inflamação crónica é um fenómeno biológico que pode ocorrer em múltiplos órgãos do tracto digestivo. Assim, o risco cumulativo de neoplasias em doentes portadores de colecistite crónica após 20 anos é cerca de 1%, representando um aumento de três vezes, quando o mesmo é comparado com o de uma população sem patologia vesicular. De forma semelhante, nos doentes com gastrite crónica atrófica associada a infecção por Helicobacter pylori encontra-se um aumento do risco de adenocarcinoma gástrico que é duas vezes superior ao da população sem gastrite [Schottenfeld D & Beebe-Dimmer J 2006]. No esófago, o risco de adenocarcinoma aumenta muito significativamente em situações de refluxo gastro-esofágico crónico com esofagite e metaplasia
intestinal (metaplasia de Barrett) [Shaheen N & Ransohoff DF 2002]. É também inquestionável a relação entre inflamação crónica e displasia na colite ulcerosa, sabendo-se que o risco de neoplasia aumenta com a gravidade, a extensão e a duração das lesões inflamatórias [Rutter M et al 2004, Itzkowitz S & Yio X 2004, Gupta RB et al 2007].
Em resumo, a displasia é actualmente o único “marcador” universalmente aceite de evolução potencial para neoplasia invasiva. O seu diagnóstico nem sempre é fácil e está dependente da amostragem e da experiência do observador. Muitos outros marcadores têm sido avaliados com o objectivo de melhorar a compreensão da cancerigénese na DIII e, sobretudo, para a detecção precoce dos doentes de risco, sem que se tenha atingido um consenso sobre o seu valor. Se a importância dos mecanismos inflamatórios é inquestionável na cancerigénese, ainda continuam por elucidar todos os passos da sequência de eventos moleculares que identificam, na DIII, a transição displasia -carcinoma.
I.3. Fundamentos científicos para a escolha do
tema
I.3.1. A colite ulcerosa como condição pré-neoplásica
Por ser uma das poucas condições pré-neoplásicas conhecidas na mucosa do intestino distal, a colite ulcerosa constitui um modelo promissor de investigação do processo de cancerigénese colorectal. O CCR é a neoplasia mais frequente na Europa e uma das que tem maior incidência no mundo, sendo responsável por mortalidade e morbilidade consideráveis. Estima-se que ocorrem mais de um milhão de novos casos anualmente [Bray F et al 1995, Murray CJ & Lopez AD 1997, Colliver DW et al 2006, Coleman MP et al 2008, Classen M & Lambert R 2008, Moore M 2008]. Sabe-se que nem todos os CCR seguem a mesma via de carcinogénese, sendo algumas dessas vias mal compreendidas e insuficientemente conhecidas.
As características epidemiológicas, clínicas e anatomopatológicas do CCR que surge no contexto de colite ulcerosa são significativamente diferentes das do CCR esporádico [Ekbom et al 1992, Connell WR et al 1994, Harpaz N & Talbot IC 1996, Palli D et al 1998, Greenstein AJ 2000, Bernstein et al 2001, Herszenyi L et al 2007, Cottone M et al 2008]. Com efeito, a média etária é inferior em cerca de 20 anos à dos doentes com CCR esporádico, os tumores são mais frequentemente multifocais e mais difíceis de identificar macroscopicamente. Também a sintomatologia que alerta para a existência de neoplasia, tal como a dor abdominal e as rectorragias, é muitas vezes confundida com manifestações da doença inflamatória, o que dificulta o diagnóstico e atrasa a terapêutica. Quanto aos aspectos morfológicos, está demonstrado que o CCR associado a colite ulcerosa, tal como na forma esporádica, também é precedido de displasia [Dawson IMP & Pryse-Davies J 1959, Lennard-Jones JE et al 1997, Wong NA & Harrison DJ 2001], mas as lesões precursoras são geralmente mais extensas, menos bem delimitadas e mais difíceis de identificar na observação endoscópica do que no CCR esporádico. Existem, no entanto, algumas semelhanças entre a história natural e a biologia do CCR esporádico, pelo que uma melhor compreensão das vias de cancerigénese associadas à DIII poderá também contribuir para o esclarecimento da cancerigénese do CCR esporádico. Publicações recentes sugerem que o processo inflamatório crónico
pode ser um dos elementos fundamentais para o aparecimento de neoplasias, não só no contexto de DIII mas também nos casos esporádicos, o que poderá indiciar a existência de fenómenos comuns [Rhodes JM & Campbell BJ 2002, Landi S et al 2003].
A estratégia clínica defendida para diagnosticar precocemente neoplasias nos doentes com DIII tem sido a vigilância periódica dos casos considerados de “alto risco”, com o objectivo de identificar as áreas de neoplasia em fase inicial do seu desenvolvimento. Doentes de alto risco são aqueles em que a doença tem mais de 10 anos de duração, foi iniciada antes dos 30 anos de idade, com envolvimento extenso do intestino e/ou coexiste com colangite esclerosante [Gurbuz AK et al 1995, Leidenius MH et al 1997, Florin TH et
al 2004, Rubin DT & Parekh N 2006, Herszenyi L et al 2007].
A displasia, definida como a inequívoca transformação neoplásica de um epitélio [Riddell RH et al 1983] é reconhecida como o melhor “marcador” de risco de evolução para neoplasia invasiva, mas o seu diagnóstico no contexto de colite ulcerosa é dificultado pelo processo de inflamação/reparação que caracteriza esta entidade. Todos estes factos justificam o propósito de conseguir uma melhor compreensão dos mecanismos de cancerigénese associados a colite ulcerosa, de modo a poderem identificar-se, na mucosa intestinal, outros marcadores mais precoces de evolução para neoplasia.
No CCR associado a colite ulcerosa está demonstrado haver uma relação entre a inflamação crónica e o desenvolvimento de displasia, sendo claro que o risco de transformação maligna aumenta com a gravidade, a extensão e a duração do processo inflamatório [Rutter M et al 2004, Itzkowitz S & Yio X 2004, Gupta RB et al 2007]. Nos modelos de cancerização que têm por base lesões inflamatórias de longa duração, como o adenocarcinoma do esófago associado a metaplasia de Barrett e o adenocarcinoma do estômago no contexto de gastrite atrófica, admite-se a sequência morfológica: inflamação → metaplasia → displasia → carcinoma. Nestes modelos a metaplasia constitui uma etapa intermédia através da qual populações celulares com diferenciação anómala, eventualmente com finalidade adaptativa, precedem o desenvolvimento de populações neoplásicas. As células metaplásicas surgem, assim, como precursores temporais e a displasia que nelas se desenvolve como precursor local de neoplasias. Do paralelismo com outros modelos
biopatogénicos é conceptualmente admissível nos doentes com colite ulcerosa de longa duração que a mucosa cólica contenha populações celulares com diferenciação divergente, nomeadamente gástrica, sendo elementos com evolução fenotípica aberrante que podem constituir um risco acrescido para o aparecimento de populações neoplásicas.
I.3.2. A diferenciação anómala no cólon
No cólon estão pouco investigados os processos de metaplasia. Alguns estudos relatam a existência de metaplasia gástrica ou “pseudo-pilórica” no intestino proximal de doentes com doença de Crohn [Liber AF 1951, Ahnen DJ et al 1994, Longman RJ et al 2000, Buisine MP et al 2001] mas este fenómeno, que parece ser muito invulgar encontra-se mal documentado no intestino distal. É reconhecida a existência de metaplasia de células de Paneth no cólon como um fenómeno frequente, sinónimo de cronicidade do processo inflamatório, mas não há referências claras a outras populações celulares aberrantes identificáveis por histologia convencional em patologia inflamatória ou neoplásica.
Uma forma possível de pesquisar a presença de populações celulares com características fenotípicas aberrantes poderá ser através da identificação da expressão de mucinas não nativas e, por isso, anómalas. As mucinas são glicoproteinas de elevado peso molecular, geneticamente codificadas, com “núcleos” proteicos glicosilados [Ho S B et al 1995, Buisine MP et al 1998] e estão presentes em muitos epitélios que contactam com o meio exterior “hostil”. Estes epitélios conseguem proteger-se de agressões extrínsecas através da secreção de um gel mucinoso ou muco que forma uma barreira defensiva que, adicionalmente, se destina a seleccionar as substâncias que interagem ou devem ser absorvidas pelas células. As mucinas são responsáveis pelas propriedades visco-elásticas do muco e são produzidas por numerosas estruturas: olhos, ductos pancreáticos, vesícula biliar, próstata e principalmente, tracto respiratório, tracto gastrointestinal e tracto ginecológico.
O epitélio intestinal está coberto por uma camada contínua de muco, que é segregado predominantemente pelas células caliciformes. As características estruturais desta barreira são indicadoras da sua função fisiológica e as alterações na sua composição são, há muito, conhecidas em várias patologias
do tubo digestivo.
Os genes das mucinas codificam proteínas ricamente glicosiladas que se caracterizam por um número variável de sequências de péptidos ricos em serina, treonina e prolina (apomucinas) e contêm um grande número de cadeias de oligossacáridos (Figura 1).
Figura 1 – Representação geral da estrutura de um monómero de mucina (Adaptado de R. A. Bowen, Hypertexts for Biomedical Sciences, 1998).
A expressão diferencial de mucinas é específica de um determinado tipo celular e tecido e é cuidadosamente regulada a nível genético e epigenético, estando envolvida quer na diferenciação quer na carcinogénese [Lesuffleur T
et al 1994, Kim YS et al 1999, Packer LM et al 2004, Leroy X et al 2006,
Mizoshita T et al 2007].
As técnicas histoquímicas que são utilizadas para a detecção de mucinas dependem da capacidade para reconhecer carboidratos de cadeia positiva ou negativa. O uso de técnicas de imunohistoquímica e hibridação in situ permite identificar especificamente as várias apomucinas nas células e nos tecidos. Com a utilização de novas técnicas de biologia molecular foi possível esclarecer alguns dos processos responsáveis pela regulação da sua expressão. Foram descritos até à data vinte e um genes que codificam mucinas secretoras e de membrana e foram identificados dois agrupamentos: os genes das mucinas secretoras MUC2, MUC5AC, MUC5B e MUC6, localizados no cromossoma 11p15.5 e os genes MUC-3, MUC-11 e MUC-12 localizados no cromossoma 7q22. Pelo contrário, as mucinas de membrana estão dispersas por três regiões cromossómicas (7q22, 3q, 1q21) [Pigny P et al 1996, Desseyn JL et al 1998,
Rousseau K et al 2007]. A secreção de uma determinada mucina ou a sua identificação membranar são, enquanto presença permanente e geneticamente determinada, um marcador de diferenciação ou de fenótipo tipo celular.
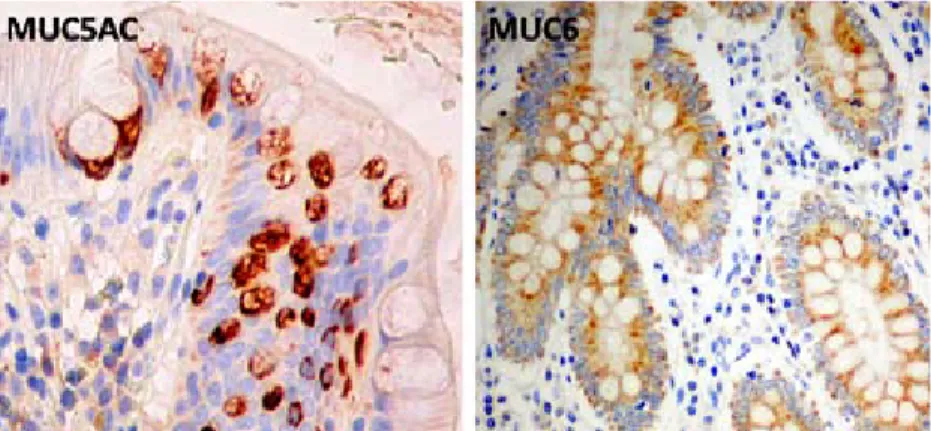
No epitélio gástrico adulto normal encontram-se predominantemente MUC1, MUC5AC e MUC6, os dois primeiros tipos expressos no epitélio de superfície (foveolar) e MUC6 expresso nas glândulas profundas (mucopépticas). Na mucosa gástrica normal não se identifica MUC2. Pelo contrário, a mucosa intestinal adulta normal expressa MUC2, que começa a ser produzida no intestino fetal por volta das dez semanas de gestação, protege o epitélio intestinal da bílis e do líquido amniótico e contribui para a formação do mecónio. O padrão de expressão de mucinas evolui ao longo da vida fetal, sendo possível identificar, por técnicas de imunohistoquímica e hibridação
in situ, a expressão de MUC5AC na mucosa do intestino até cerca das oito
semanas de gestação. No entanto, esta reduz-se significativamente com o crescimento do feto e, a partir das treze semanas, desaparece completamente. A mucina MUC6, pelo contrário, não é detectada, nem na fase embrionária nem na fase fetal do desenvolvimento intestinal [Buisine MP et al 1998, Reid CJ & Harris A 1998].
Foi descrita a presença críptica de características gástricas em mucosa intestinal evidenciada pela expressão das apomucinas MUC5AC e MUC6 em pólipos hiperplásicos, em adenomas vilosos e em CCR esporádicos [Biemer-Hutman AE et al 1999, Bartman AE et al 1999, Jass JR & Walsh MD 2001]. A presença de MUC5AC e MUC6 na composição da mucosa do cólon representará, assim, uma forma de diferenciação anormal que lhe faz atribuir características de tipo gástrico. Na colite ulcerosa, a existência deste processo e a sua relação com a inflamação crónica e com o processo de cancerigénese é ainda pouco clara. Foi descrita ocasionalmente [Jass JR et al 1988, Shaoul R
et al 2004, Forgue-Lafitte ME et al 2007], permanecendo por explicar o seu
significado e quais os mecanismos biopatogénicos que lhe estão subjacentes. O processo de diferenciação celular enquanto aquisição de capacidades funcionais pode considerar-se um somatório de sucessivas alterações qualitativas e quantitativas que surgem na sequência da síntese de diversos produtos genéticos. O controlo deste processo de síntese é multifactorial, com factores intrínsecos e extrínsecos à célula a contribuírem para o modular, daí
resultando a expressão de características fenotípicas anómalas, como é próprio da alteração denominada metaplasia. O esclarecimento dos mecanismos moleculares subjacentes à expressão de um fenótipo aberrante ou metaplásico pode contribuir para compreender os processos da cancerigénese em que a metaplasia faz parte integrante da sequência biopatogénica. Este pode ser o caso de alguns mecanismos envolvidos na expressão anómala de mucinas. Os factores responsáveis pela regulação dos genes das mucinas parecem ser muito complexos e começam a ser agora melhor conhecidos. Sabe-se que podem ser activados a nível transcricional por diversos mediadores, incluindo citocinas pró-inflamatórias, produtos bacterianos, factores de crescimento e hormonas [Van Seuningen I et al 2001, de Bolos C et al 2001]. No tracto respiratório foi descrita a activação de MUC5AC mediada por EGF-R e pelos seus ligandos EGF e TGF-alfa,[Takeyama K et al 1999]. Foi também descrita a mesma activação da transcrição mas mediada pela cascata Src/Ras/MAPk/pp90RSK [Perrais M et al 2002], envolvendo o factor nuclear de transcrição NF-kappa. Os mecanismos reguladores epigenéticos, através de alterações do padrão de metilação da respectiva região promotora, parecem também estar envolvidos na expressão aberrante de mucinas [Vincent A et al 2007].
I.3.3. A regulação epigenética e o perfil de metilação
A modificação epigenética do genoma que ocorre durante o desenvolvimento embrionário precoce e a metilação das sequências de ADN ricas em citosina (“ilhas CpG”) parecem ser os principais factores responsáveis pela diferenciação celular. Nas células somáticas adultas estáveis esta actividade é mínima ou não é detectável mas, em células estaminais, os enzimas ADN citosina metiltransferases são responsáveis pela manutenção do perfil quantitativo de metilação durante a replicação do ADN. A utilização de agentes desmetilantes, tal como o 5-AzaC (análogo da citosina que reduz a actividade das ADN metiltransferases) em células murinas, reverte células embrionárias diferenciadas em células embrionárias estaminais pluripotentes e reactiva genes silenciados, com re-expressão de factores de transcrição específicos (ex: SOX-2, Nanog, Oct-4) [Tsuji-Takayama K et al 2004]. Com efeito, a metilação da região promotora de um gene é um mecanismo que controla, por repressão, a expressão desse gene, sendo esta alteração transmitida às células filhas durante
a divisão celular [Van Seuningen I et al 2001, Imamura M et al 2006]. A natureza estável e transmissível da metilação sugere que ela é usada como um mecanismo que permite “desligar” todos os genes com excepção dos que são necessários para que a célula exerça as suas funções adultas.
Os padrões normais de metilação encontram-se frequentemente alterados em células tumorais, com hipometilação global a acompanhar a hipermetilação de algumas regiões específicas. Desta forma, a metilação da região promotora determinando o “silenciamento” dos genes responsáveis pela diferenciação e modulação do fenótipo celular pode resultar em fenómenos de metaplasia caracterizados por exibirem diferenciação anómala ou aberrante, o que se verifica em condições pré-neoplásicas tal como o esófago de Barrett e a metaplasia intestinal do estômago [Arul GS et al 2000, Mesquita P et al 2003, Perrais M et al 2001, Zou H et al 2005].
Assim, a possível expressão aberrante de mucinas de tipo gástrico na mucosa colorectal de doentes com colite ulcerosa pressupõe a existência de fenótipos metaplásicos crípticos cujo controlo poderá estar parcialmente dependente da modulação epigenética de genes reguladores da diferenciação. O esclarecimento destes mecanismos poderá contribuir para conhecer aspectos relevantes da biopatogenia de fenómenos morfológicos como a metaplasia em colite ulcerosa.
I.3.4. Genes Homeobox
Uma explicação possível para a presença de áreas de diferenciação gástrica traduzidas pela expressão anómala de mucinas em mucosa intestinal poderá ser o silenciamento ou a sobre-expressão de alguns genes homeobox. Estes genes conferem identidade individual a segmentos específicos do organismo, codificando factores de transcrição responsáveis pela manutenção do fenótipo da célula. Sabe-se que no tubo digestivo, os genes Cdx1 e Cdx2 codificam factores de transcrição essenciais para o desenvolvimento e a manutenção do fenótipo intestinal, enquanto que os genes Pdx1 e SOX2 parecem estar envolvidos na diferenciação e carcinogénese gástrica [Beck F 2002, Li X et al 2004]. Para além do seu papel no desenvolvimento celular normal, estes genes terão um papel na oncogénese do tubo digestivo, onde funcionarão como genes supressores tumorais [Mallo GV et al 1997]. Os factores de transcrição
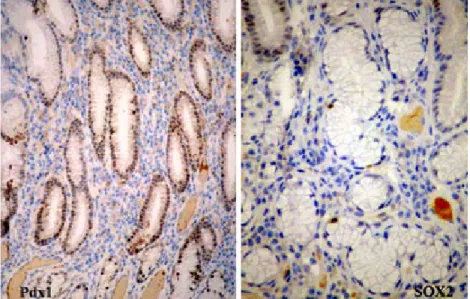
Cdx1 e Cdx2 regulam directamente a expressão de MUC2 e estão associados à expressão desta proteína na metaplasia intestinal no estômago [Tsukamoto T et al 2004]. Os factores que controlam a diferenciação gástrica são menos bem conhecidos, sabendo-se que o gene SOX2 (expresso no epitélio foveolar gástrico humano) é, provavelmente, responsável pela diferenciação gástrica, tendo-se demonstrado que há indução de mARN MUC5AC em células de cultura e existindo aparentemente uma correlação inversa entre a expressão de SOX2 e a expressão de Cdx1 e Cdx2. O gene Pdx1 (pancreatic-duodenal
homeobox 1) codifica um factor de transcrição essencial para o desenvolvimento
do pâncreas, duodeno e antro gástrico (glândulas pilóricas), estruturas onde a sua expressão parece associar-se à indução do gene MUC6 [Yamada S et al 2001, Sakai H et al 2004].
Em embriões humanos com 9 semanas de gestação foi identificada imunoexpressão intensa e difusa do factor de transcrição SOX2 no tubo neural, no epitélio brônquico e epitélio gástrico e do factor de transcrição Pdx1 no pâncreas, no duodeno e no epitélio gástrico (observações pessoais não publicadas). Em tecidos adultos normais observa-se presença muito focal de SOX2 e Pdx1 no epitélio gástrico, sendo que a sua expressão nunca foi identificada no epitélio da porção distal do intestino.
Não há estudos sobre a presença destes marcadores na mucosa colorectal de doentes com DIII e consequentemente, sobre a sua potencial relação com o cancro, bem como nas situações tipificadas pelas vias conhecidas de carcinogénese colorectal.
II
CAPÍTULO
II. OBJECTIVOS
O presente estudo tem como objectivo geral contribuir para esclarecer os mecanismos associados ao desenvolvimento de linhagens celulares metaplásicas e procurar estabelecer a sua relação com displasia e/ou neoplasia invasiva no cólon de indivíduos com colite ulcerosa de longa evolução. Pretendeu-se, especificamente, que o estudo respondesse às seguintes questões:Existirão padrões de diferenciação divergente, de tipo gástrico, na mucosa colorectal dos doentes com colite ulcerosa, que possam ser revelados in situ através da imunoexpressão de apomucinas de tipo gástrico (MUC5AC e MUC6)?
A existir diferenciação gástrica, haverá relação entre a expressão aberrante dessas apomucinas e a duração e a gravidade das lesões inflamatórias? Existirá relação entre a expressão aberrante de apomucinas de tipo gástrico e a transformação neoplásica, que confira àquelas valor como marcador de risco?
A provar-se a existência de expressão aberrante de mucinas de tipo gástrico na mucosa colorectal de doentes com colite ulcerosa, haverá relação com a expressão dos factores de transcrição SOX2 e Pdx1?
Estará mantido o estado de metilação das regiões promotoras dos genes
SOX2 e Pdx1?
A provar-se a existência de metilação das regiões promotoras dos genes
SOX2 e Pdx1, haverá relação com transformação neoplásica, com
expressão de apomucinas e com a expressão dos factores de transcrição SOX2 e Pdx1?
Este estudo pretende, assim, contribuir para a compreensão da carcinogénese colorectal quando se desenvolve num contexto de inflamação crónica. A aplicabilidade prática potencial do estudo baseia-se na hipótese de a identificação de áreas de metaplasia gástrica na mucosa colorectal nestes doentes representar um indicador de risco de evolução para displasia e/ou neoplasia invasiva, o que justificaria programas específicos de vigilância clínica e endoscópica.
1. 2. 3. 4. 5. 6.